Efikasiteti i motorit të nxehtësisë
cikle. Termike dhe makinat ftohëse. Efikasiteti i ciklit Carnot për gaz ideal
Një proces ose cikël ciklik (rrethor) është një proces në të cilin gjendja fillestare dhe përfundimtare e sistemit përkojnë. Në ciklin e treguar në Fig. 8.1, në seksionin 1-a-2, sistemi bën punë pozitive, dhe kthimi në gjendjen e tij origjinale përgjatë rrugës 2-b-1 - negativ, por më i vogël në vlerë absolute. ku punë e plotë i përfunduar për cikël është pozitiv. Është e barabartë me sipërfaqen e figurës 1-a-2-b-1 të mbuluar nga cikli në P-V grafiku.
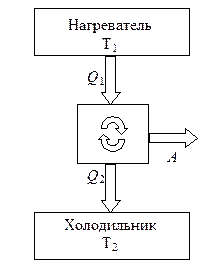 |
|
| Oriz. 8.1 | Oriz. 8.2 |
Që nga energjia e brendshme Uështë një funksion i gjendjes, ndryshimi i tij në procesin ciklik është zero (D U= 0). Pastaj nga ligji i parë i termodinamikës rrjedh se puna totale POR, e kryer nga sistemi për cikël, është e barabartë me sasinë totale të nxehtësisë P të marra nga sistemi në një cikël. Nëse cikli funksionon PORështë pozitive, themi se cikli është përshkuar brenda drejtimi përpara(në drejtim të akrepave të orës). Procese të tilla ciklike mund të përdoren për të krijuar motorët me nxehtësi - pajisje që kryejnë punë mekanike për shkak të nxehtësisë së marrë nga rezervuarët termikë.
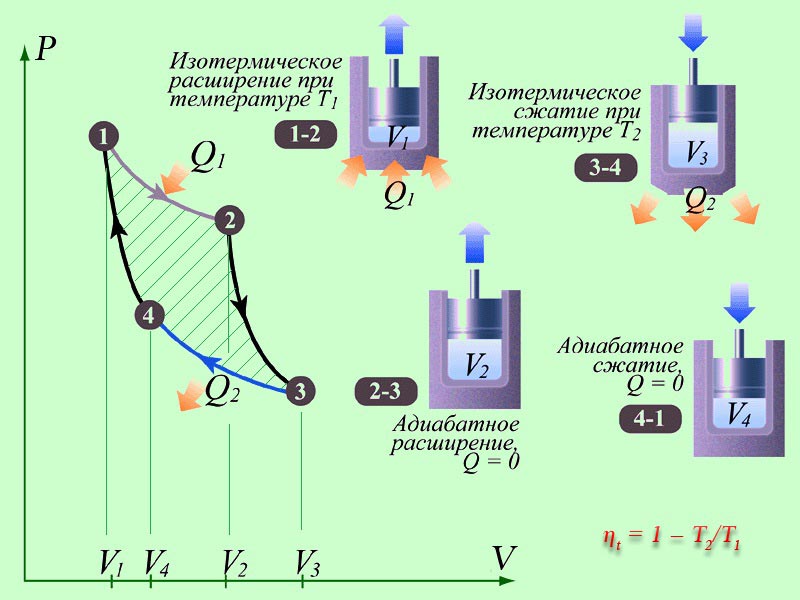
Motori termik përfshin një trup pune, d.m.th. një sistem që kryen një cikël dhe kryen punë, dhe të paktën dy rezervuarë nxehtësie me të cilët lëngu i punës shkëmben nxehtësinë.
Protozoar motor ngrohje treguar skematikisht në Fig. 8.2. Rezervuarët termikë nga të cilët lëngu i punës në një cikël të drejtpërdrejtë (në të cilin POR> 0) marrin një sasi pozitive nxehtësie quhen ngrohës. Rezervuarët nga të cilët merret një sasi negative nxehtësie quhen frigoriferë. Shuma e sasive pozitive të nxehtësisë së marrë nga sistemi nga ngrohësit në të gjitha fazat e ciklit zakonisht shënohet P + = P 1, dhe shuma e nxehtësisë negative të marrë nga frigoriferët P - = - P 2. ku P 2 quhet sasia e nxehtësisë që lëshon sistemi në frigorifer ( P 2 > 0).
Puna e ciklit është e barabartë me shumën algjebrike të sasive të nxehtësisë së marrë nga sistemi në të gjitha fazat e ciklit
A = P + + P - = P 1 – P 2 .
Koeficient veprim i dobishëm(efikasiteti) i një cikli është raporti i punës A të kryer nga sistemi gjatë kalimit të ciklit me sasinë e nxehtësisë Q 1 º Q + të marrë nga sistemi nga ngrohësi
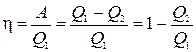 . (8.1)
. (8.1)
Efikasiteti h i llogaritur në këtë mënyrë ndonjëherë quhet termodinamik për të theksuar ndryshimin e tij nga efikasiteti teknik, i cili është gjithmonë më i ulët për shkak të humbjeve të ndryshme që shoqërojnë funksionimin e makinave reale.
Nëse drejtimi i anashkalimit të ciklit është i kundërt, atëherë puna dhe sasia e nxehtësisë në të gjitha fazat e saj do të ndryshojnë shenjë. Një cikël i tillë quhet i kundërt. Kur kaloni ciklin e kundërt, përfundoni punën POR arr, perfekt nga trupi punues, është negativ POR arr = - POR(forcat e jashtme që veprojnë në sistem bëjnë punë pozitive POR). Sistemi merr një sasi pozitive nxehtësie nga frigoriferi dhe lëshon nxehtësi në ngrohës.
Makinat ftohëse funksionojnë në ciklin e kundërt. Ata konsumojnë energji mekanike, largoni nxehtësinë nga një trup relativisht i ftohtë dhe transferoni nxehtësinë në një trup më të ngrohtë. Nëse qëllimi i makinës është të ngrohë një trup më të ngrohtë (për shembull, ngritja e temperaturës së ajrit në dhomë për shkak të nxehtësisë së marrë nga ajri i jashtëm), quhet pompë nxehtësie. Efikasiteti i tij përcaktohet nga performanca e pompës së nxehtësisë x T.N, e cila është e barabartë me raportin e sasisë së nxehtësisë së marrë nga trupi i nxehtë me punën e shpenzuar për këtë.
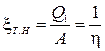 .
.
Efekti i dobishëm tejkalon punën e shpenzuar, x T..N> 1, por këtu, natyrisht, nuk ka shkelje të ligjit të ruajtjes së energjisë. Puna e forcave të jashtme nuk shndërrohet në nxehtësi, por siguron një "pompim" të nxehtësisë nga një trup më pak i nxehtë në një trup më të nxehtë.
Nëse detyra është të marrë nxehtësi nga një trup më i ftohtë, makina quhet njësi ftohëse. Efikasiteti i tij karakterizohet nga koeficienti i ftohjes x X, i barabartë me raportin e nxehtësisë së nxjerrë me punën e shpenzuar
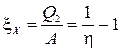 .
.
x koeficientët T.N dhe x X përdoren kryesisht në aplikimet teknike të termodinamikës.
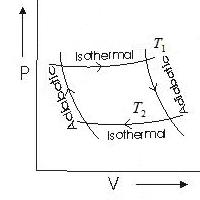
Nga proceset e ndryshme ciklike, cikli Carnot ka një rëndësi të veçantë në termodinamikë. Ai përbëhet nga dy izoterma (a-b dhe c-d) dhe dy adiabat (b-c dhe d-a) (Figura 8.3).
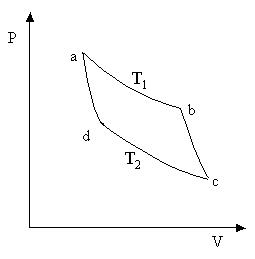 Oriz. 8.3 Oriz. 8.3 |
Le të gjejmë efikasitetin e ciklit Carnot, substanca e punës së të cilit është një mol i një gazi ideal. Në seksioni a-b lëngu i punës është në kontakt termik me një ngrohës që ka një temperaturë T një. Prodhoi zgjerim izotermik kuazi-statik të vëllimit V a në vëllim V b. Në këtë rast, gazi merr nga ngrohësi sasinë e nxehtësisë P ab. Meqenëse energjia e brendshme e një gazi ideal varet vetëm nga temperatura dhe nuk ndryshon gjatë një procesi izotermik, atëherë, sipas ligjit të parë të termodinamikës,
Në faza b-c një adiabatike ( P bc = 0) zgjerimi i gazit. Si rezultat, temperatura e saj bie. Kur të arrijë temperaturën e frigoriferit T 2 , gazi sillet në kontakt termik me frigoriferin dhe procesi i izotermik ngjeshja c-d. Gazi bën punë negative. POR cd dhe merr një sasi negative nxehtësie P cd (i jep një sasi pozitive nxehtësie frigoriferit)
Nga shqyrtimi i fazave të ciklit, mund të shihet se gazi merr një sasi pozitive nxehtësie vetëm në seksioni a-b, d.m.th. P 1 = P ab. Gazi merr një sasi negative nxehtësie në seksionin c-d, që do të thotë se nxehtësia e lëshuar në frigorifer P 2 =- P cd . Pastaj efikasiteti i ciklit
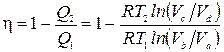 .
.
Shkruajmë ekuacionet adiabatike b-c dhe d-a, duke pasur parasysh se T a = T b= T 1 , T c= T d= T 2 ,
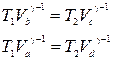 .
.
Duke pjesëtuar një ekuacion me një tjetër, marrim ![]() . Pastaj efikasiteti i ciklit Carnot për një gaz ideal
. Pastaj efikasiteti i ciklit Carnot për një gaz ideal
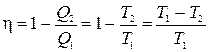 . (8.2)
. (8.2)
Vini re se nga shprehja për efikasitetin, e shkruar si , vijon
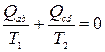 . (8.3)
. (8.3)
Lidhja (8.3) është rast i veçantë barazitë e Clausius (për detaje, shih § 13).
Ne, si njerëz të zakonshëm, rrallë mendojmë se si funksionojnë motorët e nxehtësisë, dhe aq më tepër - ne nuk përpiqemi të kuptojmë thelbin e asaj që po ndodh brenda të njëjtëve motorë nga pikëpamja e termodinamikës. Njohuritë mesatare të mekanikës dhe teknikëve janë të kufizuara në faktin se, me sa duket, diçka brenda digjet, dhe falë kësaj, pistonët fillojnë të lëvizin. (në njerëzit e thjeshtë - "piston"), duke rrotulluar pjesët e tjera dhe, siç thonë ata, "procesi ka filluar".
Por, si gjithmonë, në mesin e fisit njerëzor ka përfaqësuesit më të përpiktë që thjesht duhet të dinë se si ndodh gjithçka në të vërtetë dhe nga çfarë varet gjithçka. Ndoshta, mbi këto "të përpikta" dhe "të kudogjendura", si në degët e pemëve, rriten frutat që ushqejnë shkencën.
Pra, le të përpiqemi ta kuptojmë - si funksionon një motor ngrohjeje dhe çfarë përcakton efikasitetin e tij?
Pak teori.
Një motor ngrohje është një makinë që konverton energjinë e nxehtësisë në energji mekanike. Domethënë, brenda këtyre mekanizmave, që janë një sistem, diçka fillon të rrotullohet, të lëvizë dhe të kalojë, nëse temperatura brenda këtij sistemi ndryshon disi. (si rregull, nxehtësia furnizohet me lëngun e punës, i cili më së shpeshti është gaz për një numër arsyesh "të mira").
Epo, pak më shumë - të gjithë motorët ndahen, në përgjithësi, në motorë me djegie të brendshme dhe motorë me djegie të jashtme.
Për të parën, nxehtësia furnizohet me elementin e sistemit brenda motorit, për këtë të fundit, diku jashtë. Duke parë përpara, le të japim një shembull: motorët me djegie të jashtme përfshijnë, në veçanti, motorët me avull, në të cilët ngrohin lëngun e punës (akull, ujë ose avull ose ndonjë lëng) furnizohet jashtë motorit, duke djegur një lloj karburanti (thëngjill, naftë, dru zjarri, etj.) në një furrë të vendosur veçmas nën rezervuar (bojler) me lëngun e punës. Pastaj lëngu i ndezur i punës futet në motorin e nxehtësisë (hyn në cilindër), dhe bën punë të dobishme, duke lëshuar nxehtësi.
Motorët me djegie të brendshme (ICE) përfshijnë (për shembull) motorët me naftë dhe motorët me karburator që janë të njohur për të gjithë që nga fëmijëria, në të cilët lëngu i punës digjet dhe gjeneron nxehtësi brenda sistemit (në cilindër).
Në të dyja rastet po flasim për proceset termodinamike, d.m.th. proceset që shkaktojnë luhatje të temperaturës (ose shkaktuar nga luhatjet e temperaturës) brenda sistemit.
Në rastin e përgjithshëm, përshkruhet thelbi i asaj që po ndodh nga pikëpamja e termodinamikës moderne.
AT fillimi i XIX shekulli, inxhinieri i talentuar francez Sadi Carnot (1796-1832) studioi proceset termodinamike që ndodhin në motorët me nxehtësi duke përdorur një gaz ideal si një lëng pune. Në të njëjtën kohë, të gjitha proceset në makina u konsideruan nga ai si ekuilibër (të kthyeshëm).
Procesi i kthyeshëm- ky është një proces që ecën aq ngadalë sa mund të konsiderohet si një kalim i njëpasnjëshëm nga një gjendje ekuilibri në një tjetër, etj., dhe i gjithë procesi mund të kryhet në drejtim i kundërt pa ndryshuar punën e kryer dhe sasinë e nxehtësisë së transferuar. (Duhet theksuar se të gjitha proceset reale janë të pakthyeshme).
Qëllimi i hulumtimit të Carnot ishte të përcaktojë kushtet në të cilat është e mundur të merret puna maksimale nga nxehtësia e furnizuar në motorin e nxehtësisë, d.m.th., të shndërrohet energjia termike në energji mekanike në mënyrë më efikase.
Në fund të shekullit të 18-të - fillimi i shekullit të 19-të, i vetmi lloj i motorëve të nxehtësisë të përdorura nga njerëzimi për qëllime praktike ishin motorët me djegie të jashtme - domethënë motorët me avull. Efikasiteti i këtyre makinave ishte jashtëzakonisht i ulët - jo më shumë 2 %
, ndërkohë që nuk kishte një teori bindëse që tregonte mënyra për të përmirësuar efikasitetin e tyre.
Carnot kreu një analizë të plotë të mënyrave të ndryshme të shndërrimit të nxehtësisë në punë në shembullin e një modeli të idealizuar të një motori me avull reciprok, ndërsa rezultatet dhe përfundimet e nxjerra prej tij rezultuan të vlefshme për çdo lloj makine që përdor energji termike për të. kryejnë punë mekanike.
Si rezultat i përfundimeve teorike, Carnot arriti në përfundimin se efekti maksimal nga shndërrimi i nxehtësisë në energji mekanike mund të arrihet duke përdorur cikli rrethor, i përbërë nga katër procese të njëpasnjëshme - izotermike, adiabatike, izotermike dhe përsëri adiabatike, të cilat përfunduan ciklin, duke e kthyer sistemin në gjendjen e tij origjinale.
Kjo sekuencë proceset termodinamike në një motor ngrohjeje të quajtur cikli ideal i karnove.
Për arsye teknologjike është e pamundur të prodhohet një motor i vërtetë që konverton energjinë e nxehtësisë në energji mekanike në mënyrë rigoroze sipas ciklit të propozuar nga Carnot, prandaj cikli Carnot konsiderohet i parealizueshëm dhe ideal.
Nicolas Leonard Sadie Carnot konsiderohet si një nga themeluesit e termodinamikës. Në moshën 28 vjeç, ai shkroi veprën e vetme që ka ardhur deri te pasardhësit - "Reflektime mbi forcën lëvizëse të zjarrit dhe mbi makinat e afta për të zhvilluar këtë forcë", në të cilën ai përshkroi pikëpamje thelbësisht të reja për atë kohë mbi proceset në nxehtësi. motorët, të cilët u pasqyruan në ligjin e dytë të termodinamikës.
Sadi Carnot prezantoi konceptet bazë të termodinamikës në terminologjinë shkencore - një motor ideal i nxehtësisë, një cikël ideal, kthyeshmëri dhe pakthyeshmëri e proceseve termodinamike.
Në fillim të shekullit të 19-të, u përdorën vetëm motorë primitivë me avull, efikasiteti i të cilave nuk kalonte disa për qind, pasi nuk kishte asnjë teori që mund të shpjegonte se si të rritej efikasiteti i përdorimit të energjisë termike në motorë. Puna e Carnot shërbeu si udhëzuesi i parë për inxhinierët për të gjetur përdorimin efikas të nxehtësisë në motorë.
Carnot vdiq shumë i ri, në moshën 36 vjeçare nga kolera.
Meqenëse në ato vite kolera konsiderohej një sëmundje e tmerrshme dhe e pashërueshme, trupat dhe sendet e të vdekurve supozohej të digjeshin. Me siguri shumë vepra të vlefshme të këtij inxhinieri më të talentuar u zhdukën në zjarr. Për mrekulli, vetëm e famshmja “Reflections on forcat lëvizëse zjarri…”, për të cilin u pendua pikërisht ky zjarr, i cili shkatërroi të gjitha veprat e tjera të Carnot dhe trupin e tij të pajetë…
Sekuenca e proceseve në ciklin Carnot
Konsideroni sekuencën e proceseve termodinamike të propozuara nga Carnot, të quajtur cikli ideal i Carnot.
Siç dihet, punë mekanike mund të kryhet nga një sistem termodinamik vetëm në rastin kur ndodh një proces që shoqërohet me një ndryshim në vëllimin e lëngut punues, pra izotermik, izobarik ose adiabatik. Në të njëjtën kohë, të gjitha energji termale mund të shndërrohet në punë vetëm në një proces izotermik (me një proces izobarik dhe adiabatik, një pjesë e nxehtësisë shpenzohet për ndryshim energjia e brendshme trupi punues).
Në një proces izokorik (që ndodh në një vëllim konstant të lëngut punues), shndërrimi i nxehtësisë në punë mekanike përjashtohet.
Në gjendjen fillestare të ciklit ideal të Carnot, lëngu i punës (gazi ideal) ka disa parametra p 1 , V 1 , T 1 .
Nxehtësia furnizohet në lëngun e punës nga një burim i jashtëm i quajtur ngrohës, të cilin sistemi (motor ngrohje) fillon të përdoret me proces izotermik.
Siç u përmend më lart, në një proces izotermik, variablat janë dy parametra kryesorë të lëngut të punës - presioni dhe vëllimi, raporti midis të cilave është në përpjesëtim të zhdrejtë. (Model Boyle-Mariotte). Në këtë rast, e gjithë nxehtësia e furnizuar me lëngun e punës shpenzohet ekskluzivisht në kryerjen e punës mekanike; energjia e brendshme e lëngut të punës mbetet e pandryshuar dhe nuk kërkon nxehtësinë e marrë nga ngrohësi i jashtëm. Prandaj, zgjedhja e procesit të parë termodinamik në ciklin Carnot sipas izotermës është mjaft logjike - kjo lejon përdorimin maksimal të nxehtësisë së marrë nga ngrohësi për të kryer punë mekanike.
Në përfundim të procesit izotermik, lëngu i punës ka parametrat p 2 , V 2 , T 1 .
Ky proces i ciklit Carnot në diagramin (Fig. 1) tregohet me numra 1-2
.
Meqenëse cikli Carnot është i kthyeshëm dhe rrethor, d.m.th., të gjitha proceset termodinamike që ndodhin në të duhet ta kthejnë lëngun e punës në parametrat e tij origjinalë, bëhet e qartë se të paktën një proces tjetër izotermik duhet të jetë i pranishëm në cikël. Në të njëjtën kohë, rrjedha e tij duhet të shoqërohet me ftohjen e lëngut të punës, d.m.th., transferimin e nxehtësisë nga sistemi në mjedisi i jashtëm, përndryshe nuk mund të ktheheni në pikën me parametrat fillestarë. Nëse menjëherë pas procesit të parë, fillon procesi i dytë izotermik, atëherë puna totale e ciklit do të jetë minimale, pasi zona e grafikut që karakterizon punën mekanike të kryer nga sistemi. (e hijezuar në Fig. 1) do të jetë i vogël apo edhe zero. (nëse izotermat e përparme dhe të kundërta janë të njëjta).

Për këtë arsye, S. Carnot përdori një proces adiabatik si proces të dytë termodinamik për ciklin e tij, i cili vazhdon pa shkëmbim nxehtësie midis sistemit dhe mjedisit. Në këtë rast, puna kryhet për shkak të një ndryshimi në energjinë e brendshme të lëngut të punës, i cili vazhdon të zgjerohet dhe të ftohet në një temperaturë T 2. Në diagramin e ciklit Carnot, ky seksion është i mbyllur midis numrave 2-3
.
Përdorimi i një procesi adiabatik pas një procesi izotermik lejon që të merret një punë mekanike nga sistemi tashmë pa furnizim me nxehtësi nga ngrohësi, për shkak të përdorimit të energjisë së brendshme të lëngut të punës.
Parametrat e lëngut punues në fund të këtij procesi janë p 3 , V 3 , T 2 .
Lidhja tjetër në ciklin Carnot është procesi i dytë izotermik, i cili, siç u diskutua më lart, duhet të jetë negativ, domethënë të shoqërohet me transferimin e nxehtësisë nga lëngu i punës në mjedisin e jashtëm në një trup tjetër, i quajtur në këtë rast frigorifer. .
Në diagramin e ciklit, ky proces tregohet me numra. 3-4
.
Ecuria e procesit shoqërohet me një ulje të vëllimit dhe një rritje të presionit të lëngut punues (ngjeshje), ndërsa temperatura e tij mbetet konstante për shkak të transferimit të nxehtësisë në frigorifer.
Parametrat e lëngut të punës në fund të këtij procesi - p 4 , V 4 , T 2 .
Procesi përfundimtar i ciklit Carnot, i cili e kthen sistemin në gjendjen e tij origjinale me parametrat fillestarë p 1 , V 1 , T 1 është adiabatik.
Transferimi i nxehtësisë në frigorifer ndalet. Në të njëjtën kohë, lëngu i punës vazhdon të ulet në vëllim (kompresim), për shkak të kryerjes së disa punëve të jashtme në të, e cila është negative për procesin.
Në këtë rast, energjia e brendshme e lëngut të punës rritet, pasi një pjesë e punës së jashtme shpenzohet për ngrohjen e tij.
Ky proces tregohet me numra në diagram. 4-1
.
Një analizë e diagramit rrethor të ciklit p-V e marrë nga Carnot tregon se sistemi ka kryer punë mekanike, vlera e së cilës karakterizohet nga sipërfaqja e mbyllur midis kurbës së kufizuar me pika. 1-2-3 dhe një kurbë të kufizuar me pika 3-4-1 . Në këtë rast, e gjithë puna e kryer nga sistemi do të jetë e barabartë me shumën e punës së kryer gjatë secilit prej katër proceseve të njëpasnjëshme termodinamike të listuara më sipër.
Është e qartë se puna e kryer nga trupi punues gjatë proceseve adiabatike të drejtpërdrejta dhe të kundërta është e barabartë në madhësi, por ka një shenjë të ndryshme. (pozitiv në procesin e parë dhe negativ në të dytin), d.m.th., shuma e këtyre punimeve është e barabartë me zero. Dhe puna e bërë gjatë procesit të drejtpërdrejtë izotermik është më e madhe se puna e bërë gjatë procesit izotermik të kundërt.
Kjo është ilustruar grafikisht zonë të ndryshme diagrami i mbyllur midis abshisës dhe, përkatësisht, izotermës së parë dhe të dytë. Sa më e lartë të jetë izoterma e parë e vendosur në diagramin e izotermës së dytë relative (inverse), aq më shumë punë do të bëjë lëngu i punës.
Nëse marrim parasysh diagramin e procesit T-V, atëherë ai do të përfaqësojë një figurë të sheshtë (për shembull, një romb), në të cilën dy izoterma (i drejtpërdrejtë dhe i kundërt) paralel me një nga boshtet (temperaturën), dhe adiabatet do të jenë paralel me njëri-tjetrin.
Nga kjo rrjedh se puna e dobishme e kryer nga sistemi do të jetë sa më e madhe, aq më i madh është ndryshimi midis temperaturës së ngrohësit dhe temperaturës së frigoriferit, d.m.th., aq më i madh është ndryshimi i temperaturës midis T 1 dhe T 2 (distanca ndërmjet izotermës së sipërme dhe të poshtme në diagramin T-V).
Analiza matematikore e modelit të ciklit ideal të propozuar nga Sadi Carnot tregon se efikasiteti maksimal termik makinë termike mund të përcaktohet nga relacioni:
η t \u003d 1 - T 2 /T 1;
ku: T 1 dhe T 2 - temperatura e lëngut të punës (gazit), përkatësisht, në fillim dhe në fund të ciklit.
Kjo formulë e thjeshtë na lejon të nxjerrim dy përfundime kryesore - në lidhje me mënyrën e rritjes së efikasitetit të motorëve të nxehtësisë dhe se është e pamundur të krijohet një motor ngrohjeje, efikasiteti i të cilit do të jetë i barabartë me unitetin, pra 100%. Në të vërtetë, thyesa T 2 / T 1 mund të jetë e barabartë me zero vetëm nëse numëruesi i saj është i barabartë me zero, ose emëruesi është i barabartë me pafundësinë. Të dyja janë joreale, pasi është e pamundur të ftohet një trup material në një temperaturë zero absolute, dhe e pamundur temperatura e fillimit për ta bërë trupin punues të pafund, pasi vetë koncepti i trupit në këtë rast do të humbasë kuptimin e tij; përveç kësaj, është e pamundur të prodhohet një motor i vërtetë, pjesët dhe përbërësit e të cilit janë në gjendje të përballojnë një temperaturë të tillë.
Cikli Carnot është pikë referimi që aspirojnë inxhinierët që projektojnë motorë me nxehtësi. Në kushte të temperaturave reale, kufiri i sipërm i të cilave përcaktohet nga forca e materialeve, dhe ai i poshtëm korrespondon me temperaturën. mjedisi, efikasiteti termik i ciklit Carnot mund të arrijë 0,7…0,8.
Çdo motor real me nxehtësi do të jetë aq më i përsosur, aq më afër efikasitetit të tij është efikasiteti i llogaritur i ciklit Carnot, i cili vazhdon brenda të njëjtave kufij të temperaturës.
Realitetet moderne përfshijnë funksionimin e gjerë të motorëve të nxehtësisë. Përpjekjet e shumta për zëvendësimin e tyre me motorë elektrikë deri më tani kanë dështuar. Problemet që lidhen me akumulimin e energjisë elektrike në sistemet autonome zgjidhen me shumë vështirësi.
Ende të rëndësishme janë problemet e teknologjisë për prodhimin e baterive të energjisë elektrike, duke marrë parasysh përdorimin e tyre afatgjatë. Karakteristikat e shpejtësisë së automjeteve elektrike janë larg atyre të makinave me motorë me djegie të brendshme.
Hapat e parë drejt krijimit të motorëve hibridë mund të reduktohen ndjeshëm emetimet e dëmshme në megaqytetet, duke zgjidhur problemet mjedisore.
Pak histori
Mundësia e shndërrimit të energjisë së avullit në energji lëvizjeje ishte e njohur në antikitet. 130 pes: Filozofi Heron i Aleksandrisë i prezantoi audiencës një lodër me avull - aeolipil. Një sferë e mbushur me avull filloi të rrotullohej nën veprimin e avionëve që dilnin prej saj. Ky prototip i turbinave moderne me avull nuk gjeti aplikim në ato ditë.
Për shumë vite dhe shekuj, zhvillimi i filozofit u konsiderua vetëm një lodër argëtuese. Në vitin 1629, italiani D. Branchi krijoi një turbinë aktive. Avulli vë në lëvizje një disk të pajisur me tehe.
Që nga ai moment filloi zhvillimi i shpejtë i motorëve me avull.
motor ngrohje
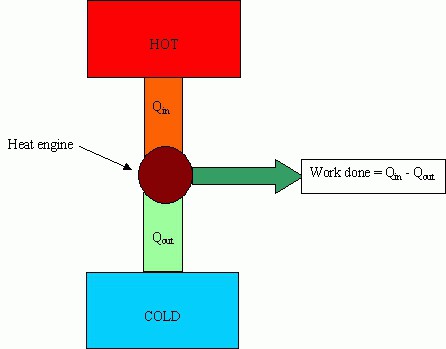
Pjesët kryesore të makinave: një ngrohës (një sistem për marrjen e energjisë nga jashtë), një lëng pune (kryen një veprim të dobishëm), një frigorifer.
Ngrohësi është projektuar për të siguruar që lëngu i punës të ketë grumbulluar një furnizim të mjaftueshëm të energjisë së brendshme për të kryer punë të dobishme. Frigoriferi largon energjinë e tepërt.
Karakteristika kryesore e efikasitetit quhet efikasiteti i motorëve me nxehtësi. Kjo vlerë tregon se cila pjesë e energjisë së shpenzuar për ngrohje shpenzohet për të kryer punë të dobishme. Sa më i lartë të jetë efikasiteti, aq më fitimprurëse është funksionimi i makinës, por kjo vlerë nuk mund të kalojë 100%.
Llogaritja e efikasitetit
Lëreni ngrohësin të marrë nga jashtë energji të barabartë me Q 1 . Lëngu i punës bënte punën A, ndërsa energjia që i jepej frigoriferit ishte Q2.
Bazuar në përkufizimin, ne llogarisim efikasitetin:
η= A / Q 1 . Ne marrim parasysh se A \u003d Q 1 - Q 2.
Nga këtu, efikasiteti i motorit të nxehtësisë, formula e të cilit ka formën η = (Q 1 - Q 2) / Q 1 = 1 - Q 2 / Q 1, na lejon të nxjerrim përfundimet e mëposhtme:
- Efikasiteti nuk mund të kalojë 1 (ose 100%);
- për të maksimizuar këtë vlerë, është e nevojshme ose një rritje e energjisë së marrë nga ngrohësi ose një ulje e energjisë së dhënë në frigorifer;
- një rritje në energjinë e ngrohësit arrihet duke ndryshuar cilësinë e karburantit;
- duke reduktuar energjinë e dhënë në frigorifer, bëjnë të mundur arritjen e tipareve të projektimit të motorëve.

Motori ideal i ngrohjes
A është e mundur të krijohet një motor i tillë, efikasiteti i të cilit do të ishte maksimal (idealisht, i barabartë me 100%)? Fizikanti teorik francez dhe inxhinieri i talentuar Sadi Carnot u përpoq të gjente përgjigjen për këtë pyetje. Në 1824, llogaritjet e tij teorike në lidhje me proceset që ndodhin në gaze u bënë publike.
Ideja kryesore e një makine ideale është të kryejë procese të kthyeshme me një gaz ideal. Fillojmë me zgjerimin e gazit në mënyrë izotermale në një temperaturë T 1 . Sasia e nxehtësisë që kërkohet për këtë është Q 1. Pasi gazi zgjerohet pa shkëmbim nxehtësie. Pasi të ketë arritur temperaturën T 2, gazi ngjeshet në mënyrë izotermale, duke transferuar energjinë Q 2 në frigorifer. Kthimi i gazit në gjendjen e tij origjinale është adiabatik.
Efikasiteti i një motori ideal të ngrohjes Carnot, kur llogaritet me saktësi, është i barabartë me raportin e ndryshimit të temperaturës midis pajisjeve të ngrohjes dhe ftohjes me temperaturën që ka ngrohësi. Duket kështu: η=(T 1 - T 2)/ T 1.
Efikasiteti i mundshëm i një motori termik, formula e të cilit është: η= 1 - T 2 / T 1 , varet vetëm nga temperatura e ngrohësit dhe ftohësit dhe nuk mund të jetë më shumë se 100%.
Për më tepër, ky raport na lejon të vërtetojmë se efikasiteti i motorëve me nxehtësi mund të jetë i barabartë me unitetin vetëm kur frigoriferi arrin temperaturat. Siç e dini, kjo vlerë është e paarritshme.
Llogaritjet teorike të Carnot bëjnë të mundur përcaktimin e efikasitetit maksimal të një motori termik të çdo dizajni.
Teorema e vërtetuar nga Carnot është si më poshtë. Një motor ngrohje arbitrare në asnjë rrethanë nuk është në gjendje të ketë një efikasitet më të madh se e njëjta vlerë e efikasitetit të një motori ideal termik.
Shembull i zgjidhjes së problemit
Shembulli 1 Sa është efikasiteti i një motori ideal me ngrohje nëse temperatura e ngrohësit është 800°C dhe temperatura e frigoriferit është 500°C më e ulët?
T 1 \u003d 800 o C \u003d 1073 K, ∆T \u003d 500 o C \u003d 500 K, η -?
Sipas përkufizimit: η=(T 1 - T 2)/ T 1.
Nuk na jepet temperatura e frigoriferit, por ∆T = (T 1 - T 2), nga këtu:
η \u003d ∆T / T 1 \u003d 500 K / 1073 K \u003d 0,46.
Përgjigje: efikasiteti = 46%.
Shembulli 2 Përcaktoni rendimentin e një motori ideal të nxehtësisë nëse kryhet 650 J punë e dobishme për shkak të një kiloxhaul të fituar të energjisë së ngrohësit Sa është temperatura e ngrohësit të motorit të nxehtësisë nëse temperatura e ftohësit është 400 K?
Q 1 \u003d 1 kJ \u003d 1000 J, A \u003d 650 J, T 2 \u003d 400 K, η -?, T 1 \u003d?
Në këtë problem, ne po flasim për një instalim termik, efikasiteti i të cilit mund të llogaritet me formulën:
Për të përcaktuar temperaturën e ngrohësit, ne përdorim formulën për efikasitetin e një motori ideal të nxehtësisë:
η \u003d (T 1 - T 2) / T 1 \u003d 1 - T 2 / T 1.
Pas kryerjes së transformimeve matematikore, marrim:
T 1 \u003d T 2 / (1- η).
T 1 \u003d T 2 / (1- A / Q 1).
Le të llogarisim:
η= 650 J / 1000 J = 0,65.
T 1 \u003d 400 K / (1- 650 J / 1000 J) \u003d 1142,8 K.
Përgjigje: η \u003d 65%, T 1 \u003d 1142,8 K.
Kushtet reale
Motori ideal i ngrohjes është projektuar me proceset ideale. Puna kryhet vetëm në proceset izotermike, vlera e tij përcaktohet si zona e kufizuar nga grafiku i ciklit Carnot.

Në fakt, është e pamundur të krijohen kushte për procesin e ndryshimit të gjendjes së një gazi pa shoqëruese të ndryshimeve të temperaturës. Nuk ka materiale që do të përjashtonin shkëmbimin e nxehtësisë me objektet përreth. procesi adiabatik bëhet e pamundur të zbatohet. Në rastin e transferimit të nxehtësisë, temperatura e gazit duhet domosdoshmërisht të ndryshojë.
Efikasiteti i motorëve me nxehtësi të krijuar në kushte reale ndryshon ndjeshëm nga efikasiteti i motorëve idealë. Vini re se proceset në motorët e vërtetë janë aq të shpejta sa që ndryshimi në energjinë e brendshme termike të substancës punuese në procesin e ndryshimit të vëllimit të saj nuk mund të kompensohet nga fluksi i nxehtësisë nga ngrohësi dhe të kthehet në ftohës.
Motorë të tjerë të nxehtësisë
Motorët e vërtetë funksionojnë në cikle të ndryshme:
- Cikli Otto: procesi në një vëllim konstant ndryshon në mënyrë adiabatike, duke krijuar një cikël të mbyllur;
- Cikli i naftës: izobar, adiabat, izohor, adiabat;
- procesi që ndodh me presion konstant zëvendësohet nga një adiabatik, duke mbyllur ciklin.
Krijoni procese ekuilibri në motorët realë (për t'i afruar me ato ideale) në kushte Teknologji moderne nuk duket e mundur. Efikasiteti i motorëve termikë është shumë më i ulët, edhe duke marrë parasysh të njëjtat regjime të temperaturës si në një instalim termik ideal.
Por nuk duhet të zvogëloni rolin e formulës së llogaritjes së efikasitetit, pasi është ajo që bëhet pika fillestare në procesin e punës për të rritur efikasitetin e motorëve realë.
Mënyrat për të ndryshuar efikasitetin
Kur krahasoni motorët idealë dhe realë të nxehtësisë, vlen të përmendet se temperatura e frigoriferit të këtij të fundit nuk mund të jetë asnjë. Zakonisht atmosfera konsiderohet të jetë një frigorifer. Temperatura e atmosferës mund të merret vetëm në llogaritje të përafërta. Përvoja tregon se temperatura e ftohësit është e barabartë me temperaturën e gazrave të shkarkimit në motorë, siç është rasti në motorët me djegie të brendshme (motorë të shkurtuar me djegie të brendshme).
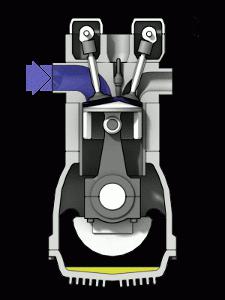
ICE është motori më i zakonshëm i nxehtësisë në botën tonë. Efikasiteti i një motori me nxehtësi në këtë rast varet nga temperatura e krijuar nga karburanti që digjet. Një ndryshim thelbësor midis një motori me djegie të brendshme dhe motorëve me avull është bashkimi i funksioneve të ngrohësit dhe lëngut të punës të pajisjes në përzierjen ajër-karburant. Me djegie, përzierja krijon presion në pjesët lëvizëse të motorit.
Një rritje në temperaturën e gazrave të punës arrihet duke ndryshuar ndjeshëm vetitë e karburantit. Fatkeqësisht, kjo nuk është e mundur të bëhet për një kohë të pacaktuar. Çdo material nga i cili është bërë dhoma e djegies së një motori ka pikën e vet të shkrirjes. Rezistenca ndaj nxehtësisë e materialeve të tilla është karakteristika kryesore e motorit, si dhe aftësia për të ndikuar ndjeshëm në efikasitetin.
Vlerat e efikasitetit të motorit
Nëse marrim parasysh temperaturën e avullit të punës në hyrjen e të cilit është 800 K, dhe gazi i shkarkimit është 300 K, atëherë efikasiteti i kësaj makine është 62%. Në realitet, kjo vlerë nuk kalon 40%. Një rënie e tillë ndodh për shkak të humbjeve të nxehtësisë gjatë ngrohjes së strehimit të turbinës.

Vlera më e lartë e efikasitetit të motorëve me djegie të brendshme nuk kalon 44%. Rritja e kësaj vlere është çështje e së ardhmes së afërt. Ndryshimi i vetive të materialeve, lëndëve djegëse është një problem mbi të cilin po punojnë mendjet më të mira të njerëzimit.
Konsideroni një të kthyeshëm ciklit Carnot kryhet nga një motor ideal i nxehtësisë.
Cikli Carnot përbëhet nga katër procese të kthyeshme: dy izoterma dhe dy adiabat. Në fig. 3.10 tregon ciklin e drejtpërdrejtë Carnot.
![]()
Oriz. 3.10
1. Komploti 1-2. Gazi ideal, i vendosur në cilindrin nën piston, në procesin e zgjerimit izotermik (T 1 = konst) vihet në kontakt termik me ngrohësin, i cili transferon nxehtësinë Q 1 në gazin ideal.
2. Komploti 2-3. Në gjendjen 2, gazi është plotësisht i izoluar termikisht nga ngrohësi. Ka një zgjerim adiabatik të tij dhe temperatura bie në T2.
3. Parcela 3-4. Në gjendjen 3, gazi ideal vihet në kontakt me ftohësin. Ndodh kompresimi izotermik (T 2 = konst), në të cilin gazi ideal transferon nxehtësinë Q 2 në frigorifer.
4. Komploti 4-1. Në gjendjen 4, gazi është i izoluar termikisht nga frigoriferi. Pastaj ka kompresim adiabatik. Temperatura e gazit rritet në T 1.
Dinamika e proceseve termodinamike mund të vërehet në modelin kompjuterik “Carnot cycle”.
Modeli kompjuterik "Cikli Carnot"
Modeli është projektuar për të studiuar një proces ciklik të kthyeshëm në një gaz ideal, i përbërë nga dy izoterma dhe dy adiabat (cikli Carnot). Kur anashkaloni ciklin Carnot, substanca e punës vihet në kontakt termik në mënyrë sekuenciale me dy rezervuarë termikë - një ngrohës dhe një frigorifer. Në model, është e mundur të ndryshohen temperaturat T 1 dhe T 2 të ngrohësit dhe frigoriferit. Paraqitet një diagram energjetik, i cili tregon sasinë e nxehtësisë Q të marrë nga gazi, punën e bërë A dhe ndryshimin ΔU në energjinë e brendshme.
Mos harroni se një motor ngrohje është duke punuar Cikli Carnot, ka një efikasitet maksimal në temperaturat e dhëna të ngrohësit dhe frigoriferit.
Puna e bërë nga trupi punues për cikël,
ku T 1 - temperatura e ngrohësit; T 2 - temperatura e frigoriferit.
Formula (3.50) shpreh të parën teorema Carnot:
Efikasiteti një motor ngrohje ideale që funksionon sipas ciklit Carnot varet vetëm nga temperaturat e ngrohësit dhe frigoriferit; nuk varet nga pajisja e makinës dhe lloji i lëngut të punës.
Për një motor të vërtetë nxehtësie (sipas teoremës së dytë Carnot):
Efikasiteti i çdo motori ngrohjeje që funksionon sipas ciklit Carnot me të njëjtat ngrohës dhe temperatura më të ftohta si një motor ideal termik nuk mund të tejkalojë efikasitetin e një motori ideal,
ato. Efikasiteti gjendet nga formula
|
. |
(3.51) |
Sipas ciklit të drejtpërdrejtë Carnot punojnë motorët me djegie të brendshme, motorët me naftë etj. Konsideroni ciklin e kundërt të Carnot. Puna me gaz për cikël A \u003d (Q 1 -P2)< 0, где Q 1 < 0 - nxehtësia e hequr nga frigoriferi; Q2 > 0 - nxehtësia e furnizuar me gazin në T 2< T 1 .
Transferimi i nxehtësisë nga një trup i ftohtë në atë të nxehtë ndodh për shkak të punës së forcave të jashtme.
Efikasiteti i një motori ideal termik që funksionon në ciklin e kundërt të Carnot është
Të gjitha makinat ftohëse funksionojnë sipas ciklit të kundërt Carnot.
Supozojmë se të gjitha molekulat, përveç asaj në shqyrtim, janë të palëvizshme. Molekulat do të konsiderohen si topa me diametër d. Përplasjet do të ndodhin sa herë që qendra e molekulës së palëvizshme është në një distancë më të vogël ose të barabartë me d nga vija e drejtë përgjatë së cilës lëviz qendra e molekulës së konsideruar. Gjatë përplasjeve, molekula ndryshon drejtimin e lëvizjes dhe më pas lëviz në vijë të drejtë deri në përplasjen tjetër. Prandaj, qendra e një molekule lëvizëse lëviz përgjatë një linje të thyer për shkak të përplasjeve (Fig. 1).
| oriz. një |
Molekula do të përplaset me të gjitha molekulat e palëvizshme, qendrat e të cilave janë brenda një cilindri të thyer me diametër 2d. Në një sekondë, një molekulë përshkon një rrugë të barabartë me . Prandaj, numri i përplasjeve që ndodhin gjatë kësaj kohe është i barabartë me numrin e molekulave, qendrat e të cilave bien brenda një cilindri të thyer me një gjatësi totale dhe rreze d. Vëllimin e tij do ta marrim të barabartë me vëllimin e cilindrit të drejtuar përkatës, d.m.th., i barabartë me Nëse ka n molekula në njësinë e vëllimit të gazit, atëherë numri i përplasjeve të molekulës në shqyrtim në një sekondë do të jetë i barabartë me
Për një gaz ideal. Kjo është arsyeja pse
| | (3.1.10) |
Kjo tregon se gjatë zgjerimit izotermik (kompresimit), rruga mesatare e lirë rritet (zvogëlohet).Siç u përmend në hyrje, diametri efektiv i molekulave zvogëlohet me rritjen e temperaturës. Prandaj, në një përqendrim të caktuar të molekulave, rruga mesatare e lirë rritet me rritjen e temperaturës. Llogaritja e rrugës mesatare të lirë për azotin (d \u003d 3 10 -10 m) në kushte normale (p \u003d 1.01 10 5 Pa, T \ u003d 273.15 K) jep: ![]() , dhe për numrin e përplasjeve në sekondë:
, dhe për numrin e përplasjeve në sekondë: ![]() . Kështu, rruga mesatare e lirë e molekulave në kushte normale është fraksione mikron, dhe numri i përplasjeve është disa miliardë në sekondë. Prandaj, proceset e barazimit të temperaturave (përçueshmëria termike), shpejtësitë e shtresave të gazit (fërkimi viskoz) dhe përqendrimet (difuzioni) janë mjaft të ngadalta, gjë që vërtetohet nga përvoja.
. Kështu, rruga mesatare e lirë e molekulave në kushte normale është fraksione mikron, dhe numri i përplasjeve është disa miliardë në sekondë. Prandaj, proceset e barazimit të temperaturave (përçueshmëria termike), shpejtësitë e shtresave të gazit (fërkimi viskoz) dhe përqendrimet (difuzioni) janë mjaft të ngadalta, gjë që vërtetohet nga përvoja.
Molekula do të thotë rrugë e lirëështë distanca mesatare (e shënuar me λ) që një grimcë përshkon gjatë rrugës së saj të lirë nga një përplasje në tjetrën.
Rruga mesatare e lirë e secilës molekulë është e ndryshme, kështu që në teoria kinetike prezantohet koncepti i rrugës mesatare të lirë (<λ>). Vlera<λ>është një karakteristikë e të gjithë grupit të molekulave të gazit në vlerat e dhëna të presionit dhe temperaturës.
Ku σ është seksioni kryq efektiv i molekulës, n është përqendrimi i molekulave.






