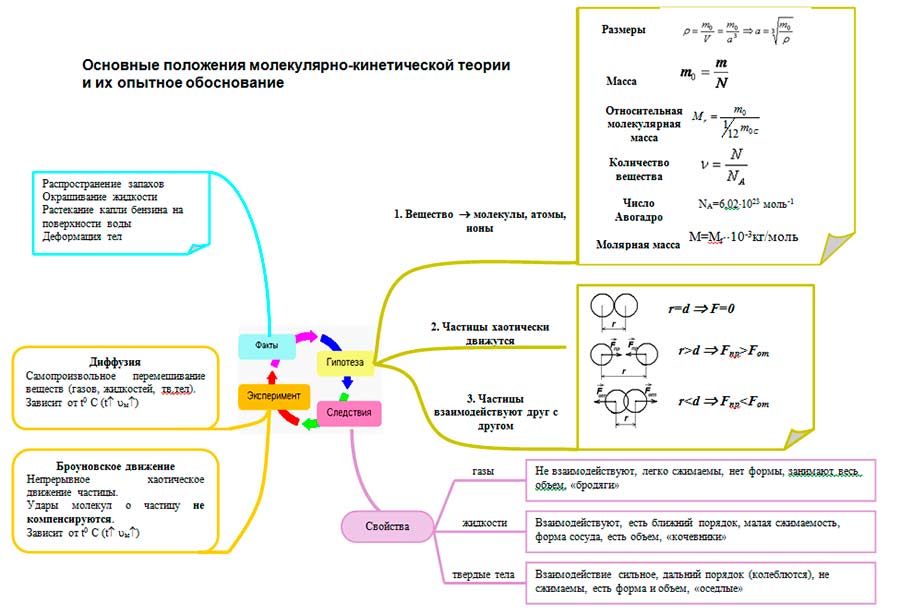
Formuloni dispozitat kryesore të kinetikës molekulare. Të gjithë trupat përbëhen nga grimca - atome, molekula, jone. Dispozitat themelore të teorisë kinetike molekulare
Dispozitat themelore të teorisë kinetike molekulare
Cila është detyra kryesore e fizikës molekulare? Çfarë është Teoria Kinetike Molekulare? Formuloni dispozitat kryesore të teorisë molekulare-kinetike. Cilat vëzhgime dhe eksperimente konfirmojnë dispozitat kryesore të teorisë kinetike molekulare? Çfarë është një molekulë? atom?
Cila është detyra kryesore e fizikës molekulare? Shpjegoni vetitë e trupave makroskopikë dhe proceset termike që ndodhin në to, bazuar në idenë se të gjithë trupat përbëhen nga grimca të veçanta, që lëvizin rastësisht.
Çfarë është Teoria Kinetike Molekulare? Teoria molekulare-kinetike (MKT) është një teori që shqyrton strukturën e një substance nga këndvështrimi i tre dispozitave kryesore afërsisht të sakta.
Formuloni dispozitat kryesore të teorisë molekulare-kinetike. të gjithë trupat përbëhen nga grimca, midis të cilave ka boshllëqe grimcat janë në lëvizje të vazhdueshme kaotike grimcat ndërveprojnë me njëra-tjetrën
Cilat vëzhgime dhe eksperimente konfirmojnë dispozitat kryesore të teorisë kinetike molekulare? Difuzioni Lëvizja Browniane Eksperimentet nga Dunoyer dhe Stern
Çfarë është një molekulë? atom? Një molekulë është një grimcë e pavarur, një përbërës i detyrueshëm i çdo substance që ka të gjitha kimikatet dhe vetitë fizike këtë substancë. Çdo molekulë përbëhet nga grimcat më të thjeshta të pavarura - atomet. Atomi - grimca më e vogël e mundshme nga ndonjë nga më të thjeshtat substancave kimike të quajtur elementë.
Dispozitat kryesore të teorisë kinetike molekulare i janë nënshtruar verifikimit eksperimental gjithëpërfshirës. Eksperimentet më të famshme që demonstrojnë strukturën molekulare të një substance dhe konfirmojnë teorinë kinetike molekulare janë eksperimenti Dunoyer dhe eksperimenti Otto Stern (1888 - 1969), të kryera përkatësisht në 1911 dhe 1920. Në këto eksperimente, trarët molekularë u krijuan nga avullimi i metaleve të ndryshme, dhe për këtë arsye molekulat e gazeve të studiuara ishin atome të këtyre metaleve. Eksperimente të tilla bënë të mundur verifikimin e parashikimeve të teorisë molekulare-kinetike, që ajo jep për rastin e gazeve, molekulat e të cilave mund të konsiderohen si pikat materiale, pra për gazet monoatomike.
Eksperimenti i Dunoyerit Skema e eksperimentit të Dunojerit me rrezet molekulare është paraqitur në fig. 1. Një enë qelqi, materiali i së cilës ishte zgjedhur në mënyrë të tillë që të siguronte një vakum të lartë, ndahej në tre ndarje 1, 2 dhe 3 nga dy ndarje me diafragma 4. Në ndarjen 1 kishte një gaz, i cili në në këtë eksperiment u përdor avulli i natriumit i marrë nga ngrohja e tij. Molekulat e këtij gazi mund të fluturonin lirshëm nëpër vrimat e diafragmave, duke ngjitur rrezen molekulare 5, domethënë, duke e lejuar atë të kalonte vetëm brenda një këndi të vogël të ngurtë. Në ndarjet 2 dhe 3, u krijua një vakum ultra i lartë, i tillë që atomet e natriumit mund të fluturonin nëpër to pa përplasje me molekulat e ajrit. Rrezja molekulare e pashpërndarë la një gjurmë 6 në murin fundor të enës. Por edhe në rastin e vakumit tepër të lartë, rrezja molekulare shpërndahej në skajet e diafragmave 4. Prandaj, në fund kishte një zonë "penumbra" 7. muri i enës, në të cilin grimcat që u shpërndanë lanë gjurmë. Ndërsa vakuumi në ndarjen 3 u përkeqësua, rajoni 7 u rrit. Nga madhësia e njollosjes së gjurmës së atomeve të natriumit të shpërndara, ishte e mundur të vlerësohej gjatësia e rrugës së tyre të lirë. Vlerësime të tilla janë bërë nga Max Born (1882 - 1970) bazuar në rezultatet e eksperimenteve të ngjashme me ato të Dunoyer.
Eksperimenti i Otto Stern Një nga eksperimentet më të famshme me rrezet molekulare ishin eksperimentet e Sternit, në të cilat për herë të parë u bë e mundur të kryheshin matje të drejtpërdrejta të shpejtësive molekulare. Skema më e famshme e eksperimentit të Stern është paraqitur në fig. 2. Fije platini 1, mbi të cilën u vendos një pikë argjendi, ishte vendosur në boshtin e dy cilindrave koaksialë 2 dhe 3, dhe në cilindrin 2 kishte një çarje paralele me boshtin e saj. Cilindrat mund të rrotullohen rreth boshtit të tyre. Në eksperimentet e Sternit, shpejtësia këndore e rrotullimit të tyre ishte 2...3 mijë rrotullime në minutë. Kur kalohet përmes një fije platini rryme elektrike ajo u ngroh temperatura maksimale rreth 1200 oС. Si rezultat, argjendi filloi të avullonte, atomet e tij fluturuan përmes çarjes 4 të cilindrit 2 dhe u vendosën në sipërfaqen e cilindrit 3, duke lënë gjurmë 5. sektori që korrespondon me shpërndarjen e tyre drejtvizore. Rrotullimi i cilindrave çoi në një lakim të trajektores së molekulave në kornizën e referencës të lidhur me cilindrat dhe, si rezultat, në një ndryshim në pozicionin e atomeve të argjendit që u vendosën në cilindrin e jashtëm. Duke analizuar densitetin e molekulave të vendosura, ishte e mundur të vlerësoheshin karakteristikat e shpërndarjes së molekulave sipas shpejtësisë, në veçanti, shpejtësitë maksimale dhe minimale që korrespondojnë me skajet e pista, dhe gjithashtu të gjendej shpejtësia më e mundshme që korrespondon me maksimumin. dendësia e molekulave të vendosura.
Oriz. 1 - Skema e eksperimentit Dunoyer 1 - ndarje e mbushur me gaz 2 dhe 3 - ndarje me vakum jashtëzakonisht të lartë 4 - ndarje me diafragma 5 - rreze molekulare 6 - gjurmë e një rrezeje të pashpërndarë 7 - gjurmë molekulash të shpërndara
Fig.2 - Skema e eksperimentit Stern 1 - burimi i molekulave 2 dhe 3 - cilindra rrotullues 4 - çarje qe kufizon rreze molekulare 5 - gjurme e rreze molekulare
Difuzioni Difuzioni është fenomeni i depërtimit të ndërsjellë të një molekule të një lënde ndërmjet molekulave të një tjetre. Difuzioni mund të ndodhë në gaze (shumë i shpejtë), në lëngje (i shpejtë), në metale (shumë i ngadalshëm).
Lëvizja Brownian Lëvizja Brownian është lëvizja termike e grimcave të pezulluara në një lëng ose gaz. Shkaqet e lëvizjes Browniane janë: 1. Lëvizja e rastësishme e molekulave 2. Devijimi nga vlera mesatare e presionit të prodhuar prej tyre. Janë vendosur: 1. Lëvizja Brown-i kryhet në çdo t dhe zgjat pafundësisht. 2. Grimcat Brownian bëjnë trajektore të rastësishme. 3. Natyra e lëvizjes së një grimce Browniane nuk varet nga natyra e saj Lëvizja Brownian është një provë e drejtpërdrejtë e lëvizjes së rastësishme të molekulave.
Jemi të rrethuar nga gjëra të ndryshme. Ne mund të shohim se ato janë ose të ngurta ose të lëngshme ose të gazta. Ka shumë pyetje për gjithçka që na rrethon. Jep përgjigje për shumë pyetje teoria kinetike molekulare.
Teoria molekulare-kinetike është një grup pikëpamjesh që përdoren për të përshkruar vetitë e vëzhguara dhe të matura të një lënde bazuar në studimin e vetive të atomeve dhe molekulave të një substance të caktuar, ndërveprimin dhe lëvizjen e tyre.
Dispozitat themelore të teorisë kinetike molekulare
Të gjithë trupat përbëhen nga grimca - atome, molekula, jone.
Të gjitha grimcat janë në lëvizje të vazhdueshme kaotike termike.
Midis grimcave të çdo trupi ekzistojnë forca të ndërveprimit - tërheqje dhe zmbrapsje.
Kështu, në teorinë molekulare-kinetike, objekti i studimit është një sistem i përbërë nga një numër i madh grimcash - makrosistem. Për të shpjeguar sjelljen e një sistemi të tillë, ligjet e mekanikës nuk janë të zbatueshme. Prandaj, metoda kryesore e hulumtimit është metodë statistikore studimi i vetive të materies.
Për të shpjeguar dhe parashikuar fenomenet, është e rëndësishme të dini Karakteristikat kryesore të molekulave:
- Dimensionet

Një vlerësim i madhësisë së një molekule mund të bëhet si madhësia e një kubi a që përmban një molekulë, bazuar në densitetin e ngurtë ose substanca të lëngshme dhe masa e një molekule:

- Masa e molekulave
Raporti i masës së një lënde m për numrin e molekulave N në këtë substancë:
- Pesha molekulare relative
Raporti i masës së një molekule (ose atomi) të një lënde të caktuar me 1/12 e masës së një atomi karboni:
- Sasia e substancës
Sasia e substancës është e barabartë me raportin e numrit të grimcave N në trup (atomet - në substancën atomike, molekulat - në molekular) në numrin e molekulave në një mol të substancës NPOR:

- Avogadro konstante
Numri i molekulave që përmbahen në 1 mol të një substance.
- Masa molare
Masa molare e një lënde është masa e një lënde të marrë në një sasi prej 1 mol.
AT sistemit ndërkombëtar njësitë e masës molare të një lënde shprehet në kg/mol.
- Ndërveprimi (sasior bazuar në përvoja)

Ndërveprimi i molekulave karakterizohet nga tërheqja dhe zmbrapsja në të njëjtën kohë: në distanca r
Teoria kinetike molekulare bën të mundur të kuptojmë pse një substancë mund të jetë në gjendje të gaztë, të lëngët dhe të ngurtë. Nga pikëpamja e MKT-së, gjendjet e grumbullimit ndryshojnë për sa i përket vlera e distancës mesatare ndërmjet molekulave dhe natyra e lëvizjes së molekulave në raport me njëra-tjetrën.
Dispozitat kryesore të teorisë kinetike molekulare janë konfirmuar në mënyrë të përsëritur nga eksperimente të ndryshme fizike. Për shembull, hulumtimi:
A) difuzion
B) Lëvizja Browniane
Përmbledhje e shkurtër
Teoria molekulare-kinetike shpjegon strukturën dhe vetitë e trupave në bazë të lëvizjes dhe bashkëveprimit të atomeve, molekulave dhe joneve. MKT bazohet në tre pozicione, të cilat janë vërtetuar plotësisht eksperimentalisht dhe teorikisht:
1) të gjithë trupat përbëhen nga grimca - molekula, atome, jone;
2) grimcat janë në lëvizje të vazhdueshme kaotike termike;
3) midis grimcave të çdo trupi ekzistojnë forca të ndërveprimit - tërheqje dhe zmbrapsje.
Struktura molekulare e një lënde konfirmohet nga vëzhgimi i drejtpërdrejtë i molekulave në mikroskopët elektronikë, si dhe shpërbërja e lëndëve të ngurta në lëngje, kompresueshmëria dhe përshkueshmëria e një lënde. Lëvizja termike - Lëvizja dhe difuzioni Brownian. Prania e forcës dhe elasticitetit të ndërveprimit ndërmolekular të ngurta, tensioni sipërfaqësor lëngjeve.
Skica e referencës për mësimin:
Pyetje për vetëkontroll në bllokun "Dispozitat bazë të teorisë kinetike molekulare dhe vërtetimi eksperimental i tyre"
- Formuloni dispozitat kryesore të teorisë molekulare-kinetike.
- Cilat vëzhgime dhe eksperimente konfirmojnë dispozitat kryesore të teorisë kinetike molekulare?
- Çfarë është një molekulë? atom?
- Çfarë quhet pesha molekulare relative? Cila formulë e shpreh këtë koncept?
- Sa është sasia e një lënde? Cila formulë e shpreh këtë koncept? Cila është njësia e sasisë së një lënde?
- Çfarë quhet konstanta Avogadro?
- Sa është masa molare e një lënde? Cila formulë shpreh kuptimin e këtij koncepti? Çfarë është njësia masë molare?
- Cila është natyra e forcave ndërmolekulare?
- Cilat janë vetitë e forcave molekulare?
- Si varen forcat e ndërveprimit nga distanca midis tyre?
- Përshkruani natyrën e lëvizjes së molekulave në gaze, lëngje dhe trupa të ngurtë.
- Cila është natyra e paketimit të grimcave në gaze, lëngje dhe lëndë të ngurta?
- Cila është distanca mesatare midis molekulave në gaz, lëngje dhe trup të ngurtë?
- Listoni vetitë kryesore të gazeve, lëngjeve, trupave të ngurtë.
- Çfarë quhet lëvizje Brownian?
- Çfarë tregon lëvizja Brownian?
- Çfarë quhet difuzion? Jepni shembuj të difuzionit në gaze, lëngje dhe trupa të ngurtë.
- 18. Si varet shpejtësia e difuzionit nga temperatura e trupave?
PËRKUFIZIM
Atomi - grimca më e vogël e një të dhënë element kimik. Të gjithë atomet që ekzistojnë në natyrë përfaqësohen në sistemin periodik të elementeve të Mendelejevit.
Atomet kombinohen në një molekulë nga lidhjet kimike bazuar në ndërveprimi elektrik. Numri i atomeve në një molekulë mund të jetë i ndryshëm. Një molekulë mund të përbëhet nga një, dy, tre ose edhe disa qindra atome.
PËRKUFIZIM
Molekula- grimca më e vogël e një lënde të caktuar që ka vetitë e saj kimike.
Teoria Kinetike Molekulare- doktrina e strukturës dhe vetive të materies bazuar në konceptin e ekzistencës së atomeve dhe molekulave.
Themeluesi i teorisë kinetike molekulare është M.V. Lomonosov (1711-1765), i cili formuloi dispozitat kryesore të tij dhe i zbatoi ato për të shpjeguar fenomene të ndryshme termike.
Dispozitat themelore të teorisë kinetike molekulare
Dispozitat kryesore të TIK:
- të gjithë trupat në natyrë përbëhen nga grimcat më të vogla (atomet dhe molekulat);
- grimcat janë në lëvizje të vazhdueshme kaotike, e cila quhet termike;
- grimcat ndërveprojnë me njëra-tjetrën: forcat e tërheqjes dhe zmbrapsjes veprojnë midis grimcave, të cilat varen nga distanca midis grimcave.
Teoria kinetike molekulare konfirmohet nga shumë dukuri.
Përzierja e lëngjeve të ndryshme, tretja e lëndëve të ngurta në lëngje, shpjegohet me përzierjen e molekulave të llojeve të ndryshme. Në këtë rast, vëllimi i përzierjes mund të ndryshojë nga vëllimi i përgjithshëm i përbërësve të tij përbërës. që tregon madhësi të ndryshme të komponimeve molekulare.
PËRKUFIZIM
Difuzioni- dukuria e depërtimit të dy ose më shumë substancave të ngjitura në njëra-tjetrën.
Difuzioni zhvillohet më intensivisht në gaze. Përhapja e aromave është për shkak të përhapjes. Difuzioni tregon se molekulat janë në lëvizje të vazhdueshme kaotike. Gjithashtu, dukuria e difuzionit tregon se ka boshllëqe midis molekulave, d.m.th. lënda është diskrete.
PËRKUFIZIM
Lëvizja Browniane- Lëvizja termike e grimcave më të vogla mikroskopike të pezulluara në një lëng ose gaz.
Ky fenomen u vëzhgua për herë të parë nga botanisti anglez R. Brown në vitin 1827. Teksa vëzhgonte polenin e luleve të pezulluar në ujë përmes një mikroskopi, ai pa se çdo grimcë poleni bën lëvizje të shpejta rastësore, duke lëvizur në një distancë të caktuar. Si rezultat i lëvizjeve individuale, çdo grimcë poleni lëvizte përgjatë një trajektoreje zigzag (Fig. 1a).
Fig.1. Lëvizja Brownian: a) trajektoret e lëvizjes së grimcave individuale të pezulluara në një lëng; b) transferimi i momentit nga molekulat e lëngëta në një grimcë pezull.
Studimet e mëtejshme të lëvizjes Brownian në lëngje të ndryshme dhe me grimca të ndryshme të ngurta treguan se kjo lëvizje bëhet më intensive, sa më e vogël të jetë madhësia e grimcave dhe aq më e lartë është temperatura e eksperimentit. Kjo lëvizje nuk ndalet kurrë dhe nuk varet nga ndonjë shkak i jashtëm.
R. Brown nuk mund të shpjegonte fenomenin e vëzhguar. Teoria e lëvizjes Browniane u ndërtua nga A. Einstein në vitin 1905 dhe mori konfirmimin eksperimental në eksperimentet e fizikanit francez J. Perrin (1900-1911).
Molekulat e lëngshme që janë në lëvizje të vazhdueshme kaotike, kur përplasen me një grimcë të pezulluar, transferojnë disa impulse në të (Fig. 1, b). Në rastin e një grimce madhësive të mëdha numri i molekulave që e sulmojnë atë nga të gjitha anët është i madh, ndikimet e tyre kompensohen në çdo moment të kohës dhe grimca mbetet praktikisht e palëvizshme. Nëse madhësia e grimcave është shumë e vogël, atëherë ndikimet e molekulave nuk kompensohen - nga njëra anë, mund të godasë më shumë molekulat sesa me tjetrin, si rezultat i të cilave grimca do të fillojë të lëvizë. Është pikërisht një lëvizje e tillë nën ndikimin e ndikimeve të rastësishme të molekulave që kryejnë grimcat Brownian. Megjithëse grimcat Brownian janë miliarda herë më të mëdha se masa e molekulave individuale dhe lëvizin me shpejtësi shumë të ulëta (krahasuar me shpejtësinë e molekulave), lëvizja e tyre ende mund të vërehet nën një mikroskop.
Shembuj të zgjidhjes së problemeve
SHEMBULL 1
SHEMBULL 2
Teoria Kinetike Molekulare quhet doktrina e strukturës dhe vetive të materies bazuar në idenë e ekzistencës së atomeve dhe molekulave si grimcat më të vogla të substancave kimike.
Teoria kinetike molekulare bazohet në tre pika kryesore:
1.
Të gjitha substancat - të lëngshme, të ngurta dhe të gazta - formohen nga grimcat më të vogla - molekulat, të cilat vetë përbëhen nga atome.
Molekulat dhe atomet janë grimca elektrike neutrale. Në kushte të caktuara, molekulat dhe atomet mund të fitojnë shtesë ngarkesë elektrike dhe kthehen në jone pozitive ose negative.
2. Atomet dhe molekulat janë në lëvizje të vazhdueshme kaotike.
3. Grimcat ndërveprojnë me njëra-tjetrën nga forcat që kanë natyrë elektrike. Ndërveprimi gravitacional ndërmjet grimcave
i papërfillshëm.
Konfirmimi eksperimental më i mrekullueshëm i ideve të teorisë kinetike molekulare për lëvizjen e rastësishme të atomeve dhe molekulave është Lëvizja Browniane.
Lëvizja Brownian - e që është lëvizja termike e grimcave më të vogla mikroskopike të pezulluara në një lëng ose gaz. Ajo u zbulua nga botanisti anglez R. Brown.
Grimcat Brownian lëvizin nën ndikimin e përplasjeve të rastësishme të molekulave. Për shkak të lëvizjes termike kaotike të molekulave, këto ndikime nuk balancojnë kurrë njëra-tjetrën. Si rezultat, shpejtësia e një grimce Brownian ndryshon rastësisht në madhësi dhe drejtim, dhe trajektorja e saj është një kurbë komplekse zigzag.
Lëvizja e vazhdueshme kaotike e molekulave të një substance manifestohet gjithashtu në një fenomen tjetër lehtësisht të vëzhguar - difuzionit.
me difuzion Dukuria e depërtimit të dy ose më shumë substancave të ngjitura në njëra-tjetrën quhet.
Procesi vazhdon më shpejt në një gaz nëse është heterogjen në përbërje. Difuzioni çon në formimin e një përzierjeje homogjene, pavarësisht nga dendësia e përbërësve. Pra, nëse në dy pjesë të enës, të ndara nga një ndarje, ka oksigjen O 2 dhe hidrogjen H 2, atëherë pas heqjes së ndarjes, fillon procesi i ndërhyrjes së gazeve në njëri-tjetrin, duke çuar në formimin e një përzierje eksplozive - gaz shpërthyes.
Difuzioni dhe lëvizja Brownian janë dukuri të lidhura. Ndërhyrja e substancave kontaktuese në njëra-tjetrën dhe lëvizja e rastësishme e grimcave më të vogla të pezulluara në një lëng ose gaz ndodh për shkak të lëvizjes kaotike termike të molekulave.
Përcaktoni termin "kapaciteti i nxehtësisë". Cilat lloje të kapaciteteve të nxehtësisë përdoren në llogaritjet e inxhinierisë termike. Shpjegoni çfarë e përcakton kapacitetin termik të gazeve? Shkruani ekuacionin Mayer.
Kapaciteti i nxehtësisë- një vlerë e barabartë me raportin e nxehtësisë së dhënë trupit ose të hequr prej tij me ndryshimin përkatës në temperaturën e tij: C= , [J/K]
ku C është kapaciteti i nxehtësisë; Q është nxehtësia e furnizuar (ose e hequr); ΔT është ndryshimi i temperaturës së trupit.
Në llogaritjet termike aplikoni lloje te ndryshme kapacitete të reduktuara të nxehtësisë (referuar një njësie të masës, sasisë dhe vëllimit)
Kapaciteti masiv (ose specifik) i nxehtësisëështë raporti i kapacitetit të nxehtësisë së trupit me masën e tij: c \u003d,
ku c është kapaciteti i nxehtësisë në masë; m - pesha e trupit.
kapaciteti molar i nxehtësisëështë raporti i kapacitetit të nxehtësisë me sasinë e substancës: μc = ,
ku μ c është kapaciteti molar i nxehtësisë; n është sasia e substancës.
Kapaciteti vëllimor i nxehtësisëështë raporti i kapacitetit të nxehtësisë me 1 m 3 gaz në kushte normale: c`=,
ku c` është kapaciteti vëllimor i nxehtësisë; v 0 është vëllimi i gazit në kushte normale.
Në SI, kapaciteti masiv i nxehtësisë c matet në J / kg * K, kapaciteti molar i nxehtësisë µ s - J / mol * K, kapaciteti vëllimor i nxehtësisë c "- J / m 3 * K.
Kapacitetet termike të gazeve dhe avujve janë të ndryshueshme; për gazet ideale ato varen nga temperatura e tyre, dhe për gazet dhe avujt realë edhe nga presioni i tyre.
Kapaciteti termik i gazrave varet në një masë të madhe nga kushtet në të cilat ato nxehen ose ftohen. Ndër këto procese në teknologji, më të rëndësishmet janë proceset që ndodhin gjatë vëllim konstant gazi (procesi izokorik) dhe në presion konstant gazi (procesi izobarik).
Në këtë drejtim, dalloni kapaciteti i nxehtësisë në vëllim konstant(me v) dhe kapaciteti i nxehtësisë në presion konstant(me p).
Marrëdhënia sasiore midis c p dhe c v vendoset duke përdorur Ekuacionet e Mayer: me p − me v = R, ku R është konstanta universale e gazit.
Kështu, ndryshimi midis kapaciteteve të nxehtësisë izobarike dhe izokorike për të gjithë gazrat është një vlerë konstante dhe është e barabartë me konstantën universale të gazit.
Përcaktoni termin " sisteme të shpërndara". Emërtoni dy tipare kryesore të sistemeve të shpërndara. Si klasifikohen sistemet e shpërndara? Duke përdorur çdo veçori, përshkruani sistemet disperse.
të shpërndara të quajtura sisteme që përbëhen nga shumë grimca të vogla të shpërndara në një mjedis të lëngët, të ngurtë ose të gaztë.
Të gjitha sistemet disperse karakterizohen nga dy karakteristika kryesore: fragmentim (dispersion) i lartë dhe heterogjenitet.
Heterogjeniteti sistemet disperse manifestohen në faktin se këto sisteme përbëhen nga dy (ose më shumë) faza. Të gjitha sistemet e shpërndara përbëhen nga një fazë e vazhdueshme - medium dispersioni dhe faza e ndërprerë (grimcat) - faza e shpërndarë.
Dispersion i lartë u jep substancave veçori të reja cilësore: rritja e reaktivitetit dhe tretshmërisë, intensiteti i ngjyrës, shpërndarja e dritës etj.
Klasifikimi i sistemeve të shpërndara kryhet në bazë të veçorive të ndryshme, përkatësisht: 1) nga madhësia e grimcave, 2) nga gjendja e grumbullimit të fazës së shpërndarë dhe mjedisit të shpërndarjes, 3) nga natyra e ndërveprimit të grimcave të fazës së shpërndarë me secilën tjera dhe me mediumin.
Në varësi të madhësisë së grimcave Sistemet disperse ndahen në grupe:
1) sisteme të trashë - sisteme në të cilat grimcat kanë një madhësi prej 1000 nm ose më shumë;
2) sistemet koloidale - grimcat kanë një madhësi nga 1 deri në 500 nm.
3) zgjidhje të vërteta - grimcat kanë një madhësi deri në 1 nm.
Sipas gjendjes së grumbullimit të fazës së shpërndarë dhe mjedisit të dispersionit sistemet klasifikohen si më poshtë:
Në lidhje me raportin e grimcave koloidale me mjedisin e dispersionit dalloni sistemet liofilike dhe liofobike ( nga greqishtja "philia" - dashuri, "fobi" - urrejtje).
Sistemet liofile- ato në të cilat grimcat koloidale janë të lidhura me molekulat e mjedisit të shpërndarjes dhe kanë një shtresë të tyre (nëse mjedisi i shpërndarjes është uji, sistemet quhen hidrofile). Për shembull, sistemet koloidale liofilike përfshijnë solucione të formuara nga shpërbërja e IUD-ve natyrale ose sintetike. Këto janë solucione proteinash, niseshteje, eteresh celuloze dhe rrëshira të ndryshme, natyrale dhe sintetike.
Sistemet liofobike(hidrofobike) - ato në të cilat grimcat koloidale janë të lidhura dobët me molekulat e mediumit të shpërndarjes ose të tretësit. Për shembull, sistemet liofobike përfshijnë kripërat e metaleve të çmuara, sollat e squfurit, hidroksidet e hekurit dhe aluminit, etj. Këto sisteme karakterizohen nga paqëndrueshmëri agregative dhe kërkojnë stabilizim.
7. Përcaktoni konceptin e "ekuilibrit kimik". Formuloni parimin e Le Chatelier. Arsyetoni si ndikojnë ndryshimet e presionit në pozicionin ekuilibër të reaksionit: N 2 +3H 2 ⇄2NH 3 . Për këtë proces, shkruani një shprehje për konstantën e ekuilibrit dhe parashikoni vlerën e saj nëse përqendrimet e ekuilibrit të reaktantëve të azotit, hidrogjenit dhe amoniakut janë përkatësisht 3 mol/l, 9 mol/l, 4 mol/l.
Ekuilibri kimik
Për një sistem në ekuilibër kimik, përqendrimet e reagentëve, temperatura dhe parametrat e tjerë të sistemit nuk ndryshojnë me kalimin e kohës.
Parimi i Le Chatelier: nëse një sistem në gjendje ekuilibri veprohet nga jashtë, duke ndryshuar ndonjë nga kushtet e ekuilibrit (temperatura, presioni, përqendrimi), atëherë proceset në sistem intensifikohen, që synojnë kompensimin (ose dobësimin) e ndikimit të jashtëm.
Reaksioni N 2 + 3H 2 ⇄ 2NH 3 vazhdon me pjesëmarrjen e substancave të gazta dhe është i kthyeshëm. Presioni ndikon ndjeshëm në pozicionin e ekuilibrit në reaksione të tilla, pasi ato shoqërohen nga një ndryshim në vëllim për shkak të një ndryshimi në sasinë e substancës në kalimin nga substancat fillestare në produktet e reaksionit: me një rritje të presionit, ekuilibri zhvendoset në drejtimin në të cilin numri i përgjithshëm i moleve zvogëlohet i gazeve dhe anasjelltas.
Sipas ekuacionit të reaksionit N 2 + 3H 2 ⇄ 2NH 3, mund të shihet se sasia e substancave fillestare të gazta është 4 mol (1 mol azot dhe 3 mol hidrogjen), dhe sasia e produkteve të gazta është 2 mol ( 2 mol amoniak). Rrjedhimisht, me një rritje të presionit, ekuilibri kimik do të zhvendoset djathtas, drejt një sasie më të vogël të substancave të gazta, dhe me një ulje të presionit, në të majtë, drejt substancave fillestare.
Konstanta e ekuilibrit- një vlerë që përcakton për një reaksion kimik të caktuar raportin ndërmjet aktiviteteve termodinamike (ose, në varësi të kushteve të reaksionit, presionet e pjesshme, përqendrimet) të substancave dhe produkteve fillestare në një gjendje ekuilibri kimik (në përputhje me ligjin e veprimit të masës). Duke ditur konstantën e ekuilibrit të reaksionit, është e mundur të llogaritet përbërja e ekuilibrit të përzierjes reaguese, rendimenti kufizues i produkteve dhe të përcaktohet drejtimi i reaksionit.
E dhënë:\u003d 3 mol / l, \u003d 9 mol / l, \u003d 4 mol / l
Gjej: K me -?
Zgjidhja: 1) Le të shkruajmë ekuacionin e reaksionit N 2 +3H 2 ⇄2NH 3
2) Konstanta e ekuilibrit për këtë reagim ka shprehjen: K c \u003d 2 / * 3; 3) llogaritni konstanten e ekuilibrit K c \u003d 4 2 / 3 * 9 3 \u003d 0,0073
Përgjigje: K c \u003d 0,0073
8. Përcaktoni termin "sistem dispers". Jepni një klasifikim të sistemeve të shpërndara sipas gjendjes së grumbullimit të fazës së shpërndarë dhe mjedisit të shpërndarë. Sistematizoni këtë njohuri dhe përcaktoni gjendjen e grumbullimit të fazës së shpërndarë dhe mjedisit të shpërndarjes për sistemet e propozuara: vaj; ajër me pluhur. Parashikoni dhe shpjegoni qëndrueshmërinë e këtyre sistemeve koloidale.
Sistemi i dispersionit- këto janë formacione të dy ose më shumë fazave (trupave) që nuk përzihen fare ose praktikisht dhe nuk reagojnë kimikisht me njëri-tjetrin.
Shumica klasifikimi i përgjithshëm i sistemeve të shpërndara bazohet në ndryshimin e gjendjes së grumbullimit të mjedisit të dispersionit dhe fazës së shpërndarë. Kombinime të tre llojeve gjendja e grumbullimit mundësojnë dallimin e nëntë llojeve të sistemeve disperse. Për shkurtësi, ato zakonisht shënohen me një fraksion, numëruesi i të cilit tregon fazën e shpërndarë, dhe emëruesi tregon mjedisin e shpërndarjes, për shembull, për sistemin "gaz në lëng", emërtimi G/L është miratuar.
| Emërtimi | Faza e shpërndarë | Medium dispersioni | Emri dhe shembulli |
| Y/Y | të gaztë | të gaztë | Sistemi i dispersionit nuk është formuar |
| F/G | E lëngshme | të gaztë | Aerosolet: mjegulla, retë |
| T/Y | të ngurta | të gaztë | Aerosolet (pluhuri, tymrat), pluhurat |
| G/F | të gaztë | E lëngshme | Emulsione dhe shkume gazi |
| F/F | E lëngshme | E lëngshme | Emulsione: vaj, krem, qumësht |
| T/F | të ngurta | E lëngshme | Pezullimet dhe sollat: tul, llum, suspension, paste |
| G/T | të gaztë | të ngurta | trupa porozë |
| F/T | E lëngshme | të ngurta | Sistemet kapilare: lëng në trupa porozë, tokë, tokë |
| T/T | të ngurta | të ngurta | Sisteme të ngurta heterogjene: lidhjet, betoni, materialet e përbëra |
Nga ana tjetër, këto sisteme klasifikohen sipas shkallës së shpërndarjes.
Sistemet me grimca të fazës së shpërndarë me të njëjtën madhësi quhen monodisperse, dhe sistemet me grimca të madhësive të ndryshme quhen polidisperse. Si rregull, sistemet reale që na rrethojnë janë polidisperse.
Stabiliteti i sistemeve të shpërndaraështë mundësia e qëndrimit të tyre në gjendjen fillestare për një kohë të pacaktuar.
Stabiliteti i sistemeve të shpërndara mund të jetë:
1. Tek reshjet
Faza e shpërndarë - karakterizon aftësinë e një sistemi të shpërndarë për të mbajtur një shpërndarje ekuilibër të fazës mbi vëllimin e mediumit të shpërndarjes ose rezistencën e tij ndaj ndarjes së fazës. Kjo pronë quhet sedimentimi (kinetik) stabiliteti .
2. Drejt grumbullimit
grimcat e saj. Stabiliteti agregativ
është aftësia e një sistemi të shpërndarë për të mbajtur të pandryshuar shkallën e dispersionit me kalimin e kohës, d.m.th. madhësitë e grimcave dhe individualiteti i tyre.
Kjo është për shkak të aftësisë së sistemeve të shpërndara për të formuar agregate (d.m.th., të rriten më shumë). Në lidhje me grumbullimin, sistemet e shpërndara mund të jenë të qëndrueshme në mënyrë kinetike
dhe termodinamikisht
. Sistemet termodinamikisht të qëndrueshme formohen si rezultat i shpërndarjes spontane të njërës prej fazave, d.m.th. formimi spontan i një sistemi heterogjen.
Sistemi i dispersionit: ajri me pluhur përbëhet nga një mjedis shpërndarës i gaztë dhe një fazë e ngurtë dispersioni. Ky sistem është i paqëndrueshëm në aspektin kinetik dhe agregativ.
Sistemi i shpërndarjes: vaji përbëhet nga një medium shpërndarjeje të lëngshme dhe një fazë dispersioni të lëngët. Dhe sistemi është i qëndrueshëm kinetikisht dhe agregativisht.
9. Përcaktoni konceptin e "zhvendosjes së ekuilibrit kimik". Komentoni cilët faktorë ndikojnë dhe cilët nuk ndikojnë në pozicionin e ekuilibrit kimik? Formuloni parimin e Le Chatelier. Parashikoni se në cilin drejtim zhvendoset ekuilibri me një rritje të presionit, temperaturës, përqendrimit të substancave fillestare për reaksionin:
+CaCO3 + O(avulli)⇄Ca(HCO 3 +Q
Ekuilibri kimik- gjendja dinamike e një sistemi kimik në të cilin një reaksion kimik vazhdon në mënyrë të kthyeshme, dhe shpejtësitë e reaksioneve të përparme dhe të kundërta janë të barabarta me njëra-tjetrën.
Pozicioni i ekuilibrit kimik varet nga parametrat e mëposhtëm të reaksionit: temperatura, presioni dhe përqendrimi. Një ndryshim në këto parametra shkakton një ndryshim në shpejtësinë e rrjedhjes reaksionet kimike dhe ndryshon ekuilibrin kimik.
Faktorët që ndikojnë në ekuilibrin kimik: temperatura, presioni, përqendrimi.
1) temperatura: kur temperatura rritet, ekuilibri kimik zhvendoset drejt një reaksioni endotermik (përthithës), dhe kur zvogëlohet, drejt një reaksioni ekzotermik (izolimi).
2) presioni: kur presioni rritet, ekuilibri kimik zhvendoset drejt një vëllimi më të vogël të substancave, dhe kur zvogëlohet, drejt një vëllimi më të madh. Ky parim vlen vetëm për gazrat, d.m.th. nëse marrin pjesë në reagim të ngurta, nuk merren parasysh.
3) përqendrimi i substancave fillestare dhe produkteve të reaksionit
Me një rritje të përqendrimit të njërës prej substancave fillestare, ekuilibri kimik zhvendoset drejt produkteve të reaksionit, dhe me një rritje të përqendrimit të produkteve të reaksionit, drejt substancave fillestare.






