Ngjeshja dhe rrallimi i gazeve
Makinat ideale në jeta reale nuk ekziston, është thjesht një konstrukt mendor. Secila prej këtyre makinave hipotetike, ndër të cilat motor carnot zë një vend të rëndësishëm, ilustron disa përfundime të rëndësishme teorike. (Edhe një kështjellë në ajër e quajtur një makinë me lëvizje të përhershme shërben, në fakt, vetëm për të treguar se nuk mund të merrni energji nga asgjëja.) Motori Carnot, i cili qëndron në themel të funksionimit të një motori ideal të nxehtësisë, u shpik nga inxhinieri francez Sadi. Carnot njëzet vjet më parë se si u formuluan themelet e termodinamikës, megjithatë, ai ilustron një pasojë të rëndësishme të ligjit të dytë të termodinamikës.
Pjesa e punës e një motori Carnot mund të konsiderohet si një pistoni në një cilindër të mbushur me gaz. Meqenëse motori Carnot është një makinë thjesht teorike, domethënë një makinë ideale, forcat e fërkimit midis pistonit dhe cilindrit dhe humbjet e nxehtësisë konsiderohen të jenë zero. Pistoni mund të lëvizë lirshëm midis dy rezervuare termike- Me temperaturë të lartë dhe me temperaturë të ulët. (Për lehtësi, imagjinoni që një rezervuar i nxehtësisë së nxehtë nxehet duke djegur një përzierje benzine me ajër dhe një i ftohtë ftohet nga uji ose ajri në temperaturën e dhomës.) Në këtë motor ngrohjeje, ndodh cikli i mëposhtëm ideal katërfazor:
1. Së pari, cilindri bie në kontakt me rezervuarin e nxehtë dhe gazi ideal zgjerohet në temperaturë konstante. Gjatë kësaj faze, gazi merr pak nxehtësi nga rezervuari i nxehtë.
2. Cilindri më pas rrethohet nga izolim termik i përsosur, ku sasia e nxehtësisë në dispozicion të gazit ruhet dhe gazi vazhdon të zgjerohet derisa temperatura e tij të bjerë në atë të rezervuarit termik të ftohtë.
3. Në fazën e tretë, hiqet termoizolimi dhe gazi në cilindër, duke qenë në kontakt me rezervuarin e ftohtë, ngjesh, duke i dhënë një pjesë të nxehtësisë rezervuarit të ftohtë.
4. Kur ngjeshja arrin një pikë të caktuar, cilindri përsëri rrethohet me izolim termik dhe gazi kompresohet duke ngritur pistonin derisa temperatura e tij të jetë e barabartë me atë të rezervuarit të nxehtë. Pas kësaj, izolimi termik hiqet dhe cikli përsëritet përsëri nga faza e parë.
Motori Carnot ka shumë të përbashkëta me motorët e vërtetë: funksionon në një lak të mbyllur (i quajtur, përkatësisht, Cikli Carnot); merr energji nga jashtë për shkak të një procesi me temperaturë të lartë (për shembull, kur digjet karburant); një pjesë e energjisë shpërndahet në mjedisi. Në këtë rast, kryhet një punë e caktuar (në rastin e një motori Carnot, për shkak të lëvizje përpara pistoni). efikasiteti, ose efikasiteti Motori Carnot përcaktohet si raporti i punës që prodhon me energjinë (në formën e nxehtësisë) të marrë nga rezervuari i nxehtë. Është e lehtë të vërtetohet se efikasiteti ( E) shprehet me formulën:
E = 1 - (T c/ T h),
ku T c dhe T h - respektivisht, temperatura e rezervuarëve të ftohtë dhe të nxehtë (në kelvin). Natyrisht, efikasiteti i motorit Carnot është më pak se 1 (ose 100%).
Kuptimi i madh i Carnot është se ai tregoi se asnjë motor ngrohje që funksionon në dy temperatura të dhëna nuk mund të jetë më efikas se një motor ideal Carnot (kjo deklaratë quhet Teorema e Carnot). Përndryshe, do të hasnim në shkelje të ligjit të dytë të termodinamikës, pasi një motor i tillë do të merrte nxehtësinë nga një rezervuar më pak i nxehtë dhe do ta transferonte atë në një më të nxehtë. (Në fakt, ligji i dytë i termodinamikës është pasojë e teoremës së Carnot.) Kështu, relacioni i marrë nga Carnot vendos kufiri i efikasitetit motorë të vërtetë që funksionojnë në botën reale. Mund të afrohet, por inxhinierët nuk do të mund ta arrijnë dhe, për më tepër, ta tejkalojnë atë. Pra, një motor thjesht hipotetik Carnot luan një rol të rëndësishëm në botën e teknologjisë reale, të zhurmshme dhe me erë të nxehtë të vajit të motorit, dhe ky është një shembull tjetër i vlerës së aplikuar të kërkimit thjesht teorik, në shikim të parë.
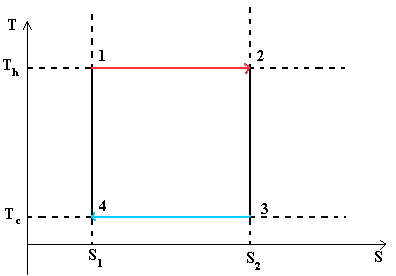
Figura 1 - Cikli Carnot është një cikël ideal termodinamik.
Ky diagram tregon një lak të mbyllur. Sistemi kalon në mënyrë sekuenciale nga pika 1 në 2, pastaj 3, 4 dhe përsëri në 1. Grafiku tregon se procesi 1® 2 është izotermik (ndodh në T 1) dhe procesi 3® 4 është gjithashtu izotermik (ndodh në T 2)
Proceset 2® 3 dhe 4® 1 janë adiabatike. Meqenëse nuk ka ndryshim të entropisë në to, atëherë dS = 0, pra dQ = 0 ose Q = konst.
Sasia e nxehtësisë së furnizuar në sistem:
Q 1 \u003d T 1 ´ (S 2 -S 1) ose zona e një drejtkëndëshi 1-2-S 2 -S 1 -1
Sasia e nxehtësisë së lëshuar nga sistemi:
Q 2 \u003d T 2 ´ (S 2 -S 1) ose zona e një drejtkëndëshi 3-S 2 -S 1 -4-3
Puna me cikël L = Q 1 - Q 2
Efikasiteti i ciklit h \u003d (Q 1 - Q 2) / Q1.
Një pasojë e rëndësishme e formulës për efikasiteti i ciklit Carnot është se për të rritur efikasitetin është e nevojshme të rritet temperatura e furnizimit me nxehtësi T 1 dhe të zvogëlohet temperatura e heqjes së nxehtësisë T 2 .
AT motor ngrohje, gazi nxehet (në mënyrë të kthyeshme) (nxehet në mënyrë të kthyeshme) dhe pastaj ftohet. Modeli i ciklit është si më poshtë: Pozicioni 1 --(zgjerimi izotermik) --> Pozicioni 2 --(zgjerimi adiabatik) --> Pozicioni 3 --(kompresimi izotermik) --> Pozicioni 4 --(ngjeshja adiabatike) -- > Pozicioni 1
Pozicioni 1 - Pozicioni 2: Zgjerimi izotermik
Zgjerimi izotermik. Në fillim të procesit, lëngu i punës ka një temperaturë T h, domethënë temperaturën e ngrohësit. Pastaj trupi vihet në kontakt me ngrohësin, i cili në mënyrë izotermale (në një temperaturë konstante) i transferon atij sasinë e nxehtësisë Q H . Në të njëjtën kohë, vëllimi i lëngut të punës rritet. Q H \u003d∫Tds \u003d T h (S 2 -S 1) \u003d T h ΔS
Pozicioni 2 - Pozicioni 3: Zgjerimi adiabatik
Zgjerimi adiabatik (isentropik). Lëngu i punës shkëputet nga ngrohësi dhe vazhdon të zgjerohet pa shkëmbim nxehtësie me mjedisin. Në të njëjtën kohë, temperatura e tij ulet në temperaturën e frigoriferit.
Pozicioni 3 - Pozicioni 4: Kompresimi izotermik
Kompresimi izotermik. Lëngu i punës, i cili në atë kohë ka një temperaturë T c , vihet në kontakt me ftohësin dhe fillon të tkurret në mënyrë izotermale, duke i dhënë ftohësit sasinë e nxehtësisë Q c . Q c \u003d T c (S 2 -S 1) \u003d T c ΔS
Pozicioni 4 - Pozicioni 1: Kompresimi adiabatik
Kompresimi adiabatik (isentropik). Lëngu i punës shkëputet nga frigoriferi dhe ngjeshet pa shkëmbim nxehtësie me mjedisin. Në të njëjtën kohë, temperatura e tij rritet në temperaturën e ngrohësit.
Në proceset izotermike, temperatura mbetet konstante, në proceset adiabatike nuk ka transferim të nxehtësisë, që do të thotë se entropia ruhet.
Prandaj, është e përshtatshme të përfaqësohet cikli Carnot në koordinatat T dhe S (temperatura dhe entropia).
3. Cikli i punës makinë ftohëse(për mësimin nr. 16)
Makinë ftohëse Kjo është një makinë me ciklin e kundërt të karnove.. Kjo do të thotë, nëse kaloni me biçikletë drejtim i kundërt, nxehtësia do të merret nga frigoriferi dhe do të transferohet në ngrohës (për shkak të punës së forcave të jashtme).
Në sistemet e ftohjes, transferimi i nxehtësisë nga një mjedis me një temperaturë më të ulët në një mjedis me një temperaturë më të lartë kryhet duke përdorur një lëng pune të quajtur ftohës.
Ftohja ndodh nga proces rrethor, ose një cikël në të cilin procesi i heqjes së nxehtësisë nga mediumi i ftohur shoqërohet nga një proces kompensues - furnizimi me energji (për shembull, kur kompresoni avujt e ftohësit në një kompresor).
Procesi i transferimit të nxehtësisë nga një trup më pak i nxehtë në një trup më të nxehtë me një kosto punë mekanike quhet cikli i kundërt i Carnot. Cikli përbëhet nga proceset e mëposhtme:
1-2 - ngjeshja adiabatike e ftohësit me avull (temperatura përfundimtare e ngjeshjes T);
2-3 - kondensimi izotermik i avullit të ftohësit në temperaturën T me kthim në mjedis (për shembull, ujë) të nxehtësisë së kondensimit Q;
3-4 - zgjerimi adiabatik i ftohësit të lëngshëm (temperatura përfundimtare e zgjerimit T o);
4-1 - avullimi izotermik i një ftohësi të lëngshëm në një temperaturë T o me heqjen e mjedisit të ftohur të nxehtësisë së avullimit Q o.
![]()
Një cikël i tillë është i realizueshëm vetëm nëse entropia e sistemit është konstante. Prandaj, nëse gjatë avullimit të ftohësit, entropia e mjedisit të ftohur zvogëlohet me Q o / T o , atëherë entropia e një mjedisi më të nxehtë (uji) duhet të rritet me të njëjtën vlerë, në të cilën transferohet nxehtësia Q o, e marrë nga mjedisi i ftohur dhe nxehtësia e barabartë me punën L k të shpenzuar për ngjeshjen e ftohësit. Si rezultat, rritja e entropisë së një mjedisi më të nxehtë është (Q o + L c) / T.
Sipas bilancit të energjisë
Q o /T o \u003d (Q o + L deri) / T
Prandaj puna që duhet shpenzuar në një njësi ftohëse që funksionon në ciklin e kundërt të Carnot
L k \u003d Q o (T - T o) / T o
Nxehtësia Q e hequr nga ftohësi i mjedisit të ftohur në temperaturën T o< Т, определяет kapaciteti ftohës cikli b, ose impiant ftohjeje.
Kështu, duke përdorur shembullin e ciklit të kundërt Carnot, bilanci i energjisë i çdo makine ftohëse:
ku L është puna e ciklit real.
Efikasiteti termodinamik i cikleve të ftohjes shprehet si raport i kapacitetit ftohës Q o ndaj punës së shpenzuar, L dhe kjo lidhje quhet koeficienti i performancës dhe shënohet me ε. Koeficienti ε shprehet me varësinë
ε \u003d Q o / L \u003d Q / (Q - Q o) \u003d T o (S 1 - S 2) / [ T (S 1 - S 2) - T o (S 1 - S 2)] \ u003d T o / T - T o
Koeficienti i performancës tregon se sa nxehtësi perceptohet nga ftohësi nga mediumi i ftohur për njësi të punës së shpenzuar.
Koeficienti i performancës që karakterizon shkallën e përdorimit të punës mekanike për të marrë të ftohtin artificial, siç shihet nga shprehja, nuk varet nga vetitë e ftohësit ose nga skema e funksionimit të njësisë ftohëse, por është vetëm një funksion i temperaturat T o dhe T. Në këtë rast, shkalla e përdorimit të punës mekanike do të jetë sa më e lartë sa më e vogël të jetë diferenca midis temperaturave të ftohësit kur lëshon T dhe merr T rreth nxehtësisë.
Procesi i zgjerimit izotermik 1 - 2 avull i mbinxehur në koordinata është paraqitur në fig. 12.8. Përkufizimi i 2 pikave fillestare/dhe përfundimtare të procesit është i qartë nga sa u tha më parë.
Një proces izotermik i zgjerimit ose tkurrjes mund të kryhet gjithashtu në mënyrë të kthyeshme në kushtet e shkëmbimit të shpejtë të nxehtësisë me mjedisi i jashtëm kërkohet për të mbajtur një temperaturë konstante.
AT procesi izotermik zgjerimi i ujit, raportohet sasia e nxehtësisë, e barabartë me nxehtësinë avullimi / h dhe në diagramin s - T zona e përcaktuar grafikisht.
Në një proces të zgjerimit izotermik n, hyrja e nxehtësisë shndërrohet plotësisht në punë dhe ndryshimi në energjinë e brendshme është zero.
Përjashtim bën procesi ideal i zgjerimit izotermik, kur e gjithë nxehtësia hyn në punë, por kapaciteti ftohës i një procesi të tillë është zero.
Pra, në procesin izotermik të zgjerimit, e gjithë nxehtësia e furnizuar shpenzohet për punë të jashtme, dhe në procesin izotermik të ngjeshjes, puna e jashtme shndërrohet plotësisht në nxehtësi.
Kështu, në procesin izotermik të zgjerimit të gazit energjia e brendshme sistemi, i shndërruar në punë kundër presionit të jashtëm, rimbushet për shkak të fluksit të nxehtësisë. Në rastin e një procesi të kthyeshëm të konsideruar këtu, puna e bërë është identike me punën maksimale të dobishme, e cila, siç tregohet më poshtë, është e barabartë me ndryshimin e funksionit të gjendjes. Kur procesi është i pakthyeshëm (humbja e fërkimit, Ap0), një pjesë e punës së dobishme humbet, duke u shndërruar në nxehtësi.
Në fig. 4 - 3 tregon një proces të zgjerimit izotermik gaz ideal në sistemin ri.
Duhet të theksohet se matja e entropisë AS Q / T e marrë për rastin e veçantë të procesit të zgjerimit izotermik është e njëjtë me atë të marrë më parë nga analiza e ciklit Carnot. Në këtë mënyrë, fizika statistikore vërteton ekzistencën e funksionit të gjendjes - entropisë, rritja e së cilës në proceset e kthyeshme është e barabartë me nxehtësinë e reduktuar dhe pozicionin që entropia e një sistemi të mbyllur priret në maksimum. Ky funksion i gjendjes bën të mundur përcaktimin e drejtimit të proceseve dhe kushteve të ekuilibrit me anë të matjeve të sasive termike. Me parimin e rritjes së entropisë në sisteme të mbyllura idetë e lidhura rreth përzierjes termike të Universit, të paraqitura nga Clausius, i cili argumentoi: Energjia e botës është konstante, entropia e botës priret në maksimum. Prandaj - përfundimi për arritjen si rezultat i proceseve të njëanshme që ndodhin në natyrë, gjendja përfundimtare e ekuilibrit, në të cilën entropia e botës është maksimale dhe Universi vdes nga vdekja nga nxehtësia.
Duke krahasuar (15.16) dhe (15.4), vërejmë se puna specifike e një motori pneumatik teorik gjatë një procesi të plotë të zgjerimit izotermik është e barabartë me të njëjtën vlerë të energjisë specifike të ajrit. Kjo është gjithashtu e vërtetë për proceset adiabatike dhe politropike.
Duke krahasuar (288) dhe (272), vërejmë se puna specifike e një motori pneumatik teorik gjatë një procesi të plotë të zgjerimit izotermik është e barabartë me të njëjtën vlerë të energjisë specifike të ajrit. Kjo është gjithashtu e vërtetë për proceset e zgjerimit adiabatik dhe politropik.
Nga fig. 23 mund të shihet se segmenti SW i barabartë me Asp - As0 paraqet njëkohësisht rritjen e entropisë në procesin izotermik të zgjerimit të SW.
Grupi i proceseve të punës në zgjerues, si dhe në kompresor, nuk është një sistem i mbyllur. cikli i procesit termodinamik. Sidoqoftë, procesi i zgjerimit izotermik është i vështirë për t'u zbatuar, dhe proceset në zgjerues janë afër adiabatikës.
Në fig. 15.7 tregon diagramet e treguesve teorikë për procese të ndryshme të zgjerimit të ajrit në motorë. Për të zbatuar një proces zgjerimi izotermik (kurba 2-3, indeksi politropik n 1), është e nevojshme të furnizohet nxehtësia në mënyrë që temperatura e ajrit të mbahet konstante, dhe për një proces adiabatik (kurba 2-3, n K), shkëmbimi i nxehtësisë. me mjedisin duhet përjashtuar. Procesi politropik do të jetë në atë rast (kurba 2 - 3, 1 p k), nëse furnizimi me nxehtësi është më i vogël se në procesin izotermik.
Një cikël i kthyeshëm mund të kryhet në kushte të tilla si më poshtë. Së pari, në procesin e zgjerimit izotermik, nxehtësia furnizohet në mënyrë të kthyeshme në lëngun e punës nga një shkëmbyes nxehtësie me një temperaturë konstante.
Energjia e brendshme (shih Tabelën 1.1) përbëhet nga energjia F Helmholtz dhe energjia e lidhur TS. Humbja e energjisë F gjatë procesit të zgjerimit izotermik (S const) është e barabartë me punën RT In (VVK2) - Thithja e nxehtësisë nga sistemi (në V konst) çon në një rritje të energjisë së lidhur me T (S2 - Sx), që nga dS 8Q / T. Nëse nuk ka ndryshim në vëllim në një temperaturë konstante, atëherë ulja e energjisë së Helmholtz-it na lejon të marrim punë të dobishme.
Cikli i drejtpërdrejtë Carnot përbëhet nga gjashtë procese (Fig. Kurba A-B përshkruan procesin izotermik të zgjerimit të gazit në një temperaturë konstante 7; kurba 3-C përshkruan procesin adiabatik të zgjerimit të gazit në mungesë të shkëmbimit të nxehtësisë me mjedisin e jashtëm - 50H; Kurba C-D përshkruan një proces izotermik të kompresimit të gazit në një temperaturë konstante Tz; Linja D-A përshkruan procesin adiabatik të kompresimit të gazit në mungesë të shkëmbimit të nxehtësisë me mjedisin. Në pro-lektorët A-B dhe B-C, gazi, duke u zgjeruar, bën punë të jashtme, 1 inç Proceset C-D dhe D-A gazi kompresohet dhe në ngjeshjen e tij aplikohet puna e jashtme. Duke zbatuar ekuacionin e ligjit të parë të termodinamikës për të gjithë ciklin, marrim Qt - Q2A (L. Prandaj, në ciklin e drejtpërdrejtë Carnot, nxehtësia e furnizuar Qi shpenzohet pjesërisht në punë të dobishme, numerikisht e barabartë me Sheshi A-B-C-D-A(Fig. Efikasiteti i dikla Carnot, në parim, nuk mund të jetë i barabartë me unitetin.
Në përgjithësi, vlera e a varet nga temperatura dhe presioni. Në të njëjtën kohë, në procesin izotermik të zgjerimit të gazit, vlera a shfaqet si produkt i ap.
Image reg - një proces i zgjerimit 4 - / - mesazh për të. Pavarësisht nga kjo veti e ciklit Carnot, cikle të tjera përdoren si bazë për funksionimin e motorëve realë, siç do të vijojë nga sa vijon. Kjo është kryesisht për shkak të pamundësisë së kryerjes së proceseve izotermike të zgjerimit dhe tkurrjes në kushte reale.
Puna e kryer nga ajri i kompresuar gjatë mbushjes dhe zgjerimit është pozitive, ndërsa puna e bërë nga ajri i kompresuar është negative. Siç shihet në fig. 93, a, puna maksimale do të jetë me një proces zgjerimi izotermik, dhe minimumi - me një adiabatik.
Faqe 2
Në pamje të parë, mund të duket se një formulim i tillë kundërshtohet, për shembull, nga procesi i zgjerimit izotermik të një gazi ideal. Në të vërtetë, e gjithë nxehtësia e marrë nga një gaz ideal nga një trup shndërrohet plotësisht në punë. Megjithatë, marrja e nxehtësisë dhe shndërrimi i saj në punë nuk është i vetmi rezultat përfundimtar i procesit; përveç kësaj, si rezultat i procesit, ndodh një ndryshim në vëllimin e gazit.
Në pamje të parë, mund të duket se formulimi i Thomson bie në kundërshtim, për shembull, me procesin e zgjerimit izotermik të një gazi ideal. Në të vërtetë, gjatë këtij procesi, e gjithë sasia e nxehtësisë e marrë nga një gaz ideal nga një trup i caktuar shndërrohet plotësisht në punë. Sidoqoftë, marrja e nxehtësisë dhe shndërrimi i saj në punë nuk është e vetmja rezultati përfundimtar procesi; përveç kësaj, ka një ndryshim në vëllimin e gazit.
Duke ditur sa izotermale dhe proceset adiabatike në një diagram Ts, mund të ndërtohet një cikël Carnot në të. Këtu 1 - 2 është procesi i zgjerimit izotermik, gjatë të cilit furnizohet sasia e nxehtësisë qv, e matur me sipërfaqen 1 - 2 - 5 - 6 - 1; 2 - 3 - zgjerim adiabatik; 3 - 4 - ngjeshja izotermike, në të cilën hiqet sasia e nxehtësisë d%, e matur me sipërfaqen 4 - 3 - 5 - 6 - 4; 4 - 1 - kompresim adiabatik. Sasia e nxehtësisë 70, e konvertuar në punë të dobishme w0, do të përfaqësohet me katror.
PRESIONI KRITIK – shih gjendja e materies është kritike. PRESIONI I ngopjes - presioni maksimal në të cilin, në procesin e zgjerimit izotermik të vajit ose ujit të formimit, fillon lëshimi i gazit të thithur prej tyre. Megjithatë, besueshmëria e kësaj metode ende nuk është vërtetuar. Vaji në prani të një kapaku gazi zakonisht është i ngopur.
Siç shihet nga ekuacioni (VI, 5), entropia rritet në procesin e zgjerimit izotermik. Ashtu si në shembullin e mëparshëm të shkrirjes së merkurit kristalor, në procesin e zgjerimit izotermik, një sasi e caktuar nxehtësie (e cila merret nga një burim nxehtësie - një termostat) në një temperaturë konstante i jepet në mënyrë të kthyeshme gazit në zgjerim.
Merrni parasysh veçoritë tranzicioni fazor nga gjendje e lëngshme në gaz - kalimi i lëngut në avull. Nëse, si rezultat i një aksidenti, ndodh depresioni, dhe temperatura ruan vlerën e saj me inerci, atëherë zhvillohet procesi i zgjerimit izotermik. Përvoja tregon se kur kaloni në izoterma me temperatura më të larta, gjatësia e seksionit ab zvogëlohet, për temperaturat më të ulëta gjatësia e seksionit ab rritet.
Cikli i kundërt Carnot përshkruhet gjithashtu në diagramin s - G - si një drejtkëndësh / - 2 - 3 - 4 (Fig. 7.6, b), por të gjitha proceset në të drejtohen në drejtim të kundërt të akrepave të orës. Cikli gjithashtu përbëhet nga dy izoterma dhe dy adiabat: / - 2 - procesi i zgjerimit adiabatik, 2 - 3 - procesi i zgjerimit izotermik, 3 - 4 - procesi i kompresimit adiabatik, 4 - / - procesi i ngjeshjes izotermale.
Meqenëse ky gaz është i izoluar nga mjedisi (Q O, A 0), energjia e tij e brendshme U, siç vijon nga ligji i parë i termodinamikës, duhet të mbetet konstante. Prandaj, si një proces i kthyeshëm që transferon gazin në të njëjtën gjendje përfundimtare si ky proces, mund të konsiderojmë procesin e zgjerimit izotermik të kthyeshëm, gjatë të cilit vëllimi i gazit dyfishohet.
Në praktikë, proceset e zgjerimit izotermik zakonisht janë mjaft të vështira për t'u zbatuar për shkak të përçueshmërisë së pamjaftueshme termike; megjithatë, është interesante të krahasohen vetitë termodinamike të një rrjedhe të tillë me rrjedhën më të zakonshme adiabatike. Në këto kushte, zgjerimi izotermik i jep një kufi të sipërm koeficientit veprim i dobishëm procesi i zgjerimit. Proceset e zgjerimit izotermik në grykat e raketës janë konsideruar teorikisht, por për shkak të kohës së shkurtër të qëndrimit të grimcave të gazit në grykë, përdorimi praktik i këtyre proceseve, me sa duket, nuk është i realizueshëm.
Nga pika / me parametrat p1; uh, 7 lëngu i punës zgjerohet në mënyrë adiabatike në gjendjen 2 (procesi / - 2) dhe lidhet me një burim me temperaturë të ulët. Zgjerimi i mëtejshëm (procesi 2 - 3) ndodh me furnizimin e nxehtësisë c / 2 në lëngun e punës. Zhvillohet procesi i zgjerimit izotermik.
Carnot mund të imagjinohet si më poshtë. Në procesin e zgjerimit izotermik 1 - Г, gazi është në kontakt termik dhe në ekuilibër me një trup që ka një televizor të temperaturës.Trup i tillë. Ky trup quhet ngrohës. Është e qartë se kapaciteti i nxehtësisë i ngrohësit duhet të jetë, në mënyrë rigoroze, pafundësisht i madh. Përndryshe, lëshimi i nxehtësisë Q4 në gaz do të shkaktonte një ulje të temperaturës së ngrohësit dhe, rrjedhimisht, një shkelje të procesit izotermik të zgjerimit të gazit. Në procesin I - - 2, gazi është plotësisht i izoluar termikisht dhe zgjerimi i tij vazhdon të ndodhë në mënyrë adiabatike.
I njëjti rezultat mund të merret lehtësisht drejtpërdrejt nga ekuacioni (3 - 177), meqenëse ne ramë dakord që burimi i punës së konsideruar në këtë shembull ka vetitë e një gazi ideal, dhe meqenëse temperatura e burimit në gjendjet 1 dhe 2 është e njëjtë dhe e barabartë me T0, atëherë energjia e brendshme e punës së burimit në gjendjet 1 dhe 2 është gjithashtu e njëjtë dhe termi i parë i ekuacionit (3 - 177) është i barabartë me zero. Termi i dytë i ekuacionit është sasia e nxehtësisë që i jepet burimit të punës në një proces izotermik në një temperaturë T0, e barabartë me punën në këtë proces (energjia e brendshme mbetet e pandryshuar. Entropia e burimit të punës në procesin e zgjerimit izotermik rritet (furnizohet nxehtësia. Slt dhe për këtë arsye termi i dytë i ekuacionit (3 - 177) do të jetë pozitiv. Termi i fundit i ekuacioni do të jetë negativ (F2 Fj), dhe vlera e tij numerike është e barabartë me zonën a-c-2 - b - a. Kështu, L ts (zona l - 2 - b - a - l) - (zona a-c-2 - b - a) (zona l - 2 - c - l ), e cila, siç pritej, përkon me rezultatin e marrë më parë.
Mënyrat kryesore të transferimit të energjisë nga një pjesë e sistemit në një tjetër janë nxehtësia dhe puna. Për shembull, zgjerimi izotermik gazet ideale nuk shoqërohet me çlirimin ose thithjen e nxehtësisë, nëse procesi vazhdon pa kryer punë nga gazi. Nëse procesi i zgjerimit izotermik të gazit shoqërohet me punë, atëherë nxehtësia thithet.
Proceset në GCM vazhdojnë në sekuencën vijuese. Nxehtësia e ngjeshjes në këtë proces largohet në mjedis. Pastaj gazi i ngjeshur, ndërsa pistonët lëvizin në të majtë, shtyhet përmes rigjeneratorit të ftohur 2 (procesi izokorik), ndërsa temperatura dhe presioni i gazit zvogëlohen. Në momentin tjetër, ndodh procesi i zgjerimit izotermik të gazit, në të cilin pistoni i djathtë është i palëvizshëm, dhe pistoni zgjerues shkon në të majtë.






