Struktura e atomit. Përvoja e Rutherford. Historia e zhvillimit të shkencave natyrore në Mesjetë
Modeli planetar i atomit u propozua nga E. Rutherford në 1910. Studimet e para të strukturës së atomit u bënë prej tij me ndihmën e grimcave alfa. Bazuar në rezultatet e marra në eksperimentet mbi shpërndarjen e tyre, Rutherford sugjeroi që të gjithë ngarkesë pozitive një atom është i përqendruar në një bërthamë të vogël në qendër të tij. Nga ana tjetër, elektronet e ngarkuara negativisht shpërndahen në të gjithë pjesën tjetër të vëllimit të saj.
Pak sfond
Supozimi i parë brilant për ekzistencën e atomeve u bë nga shkencëtari i lashtë grek Democritus. Që atëherë, ideja e ekzistencës së atomeve, kombinimet e të cilave japin të gjitha substancat rreth nesh, nuk e ka lënë imagjinatën e njerëzve të shkencës. Herë pas here iu afruan përfaqësues të ndryshëm të saj, por më parë fillimi i XIX shekujt e ndërtimit të tyre ishin vetëm hipoteza, të pambështetura nga të dhëna eksperimentale.
Më në fund, në 1804, më shumë se njëqind vjet përpara se të shfaqej modeli planetar i atomit, shkencëtari anglez John Dalton dha prova për ekzistencën e tij dhe prezantoi konceptin e peshës atomike, i cili ishte i pari i tij. karakteristikë sasiore. Ashtu si paraardhësit e tij, ai i imagjinonte atomet si pjesët më të vogla të materies, si topa të ngurtë, të cilët nuk mund të ndaheshin në grimca edhe më të vogla.
Zbulimi i elektronit dhe modeli i parë i atomit
Kaloi pothuajse një shekull kur, më në fund, në fundi i XIX shekulli, anglezi J. J. Thomson zbuloi gjithashtu grimcën e parë nënatomike, elektronin e ngarkuar negativisht. Meqenëse atomet janë elektrikisht neutrale, Thomson mendoi se ato duhet të përbëhen nga një bërthamë e ngarkuar pozitivisht me elektrone të shpërndara në të gjithë vëllimin e saj. Bazuar në rezultate të ndryshme eksperimentale, në 1898 ai propozoi modelin e tij të atomit, i quajtur ndonjëherë "kumbulla në puding", sepse atomi në të përfaqësohej si një sferë e mbushur me një lëng të ngarkuar pozitivisht, në të cilin ishin futur elektronet, si " kumbulla në puding. Rrezja e një modeli të tillë sferik ishte rreth 10 -8 cm Ngarkesa totale pozitive e lëngut balancohet në mënyrë simetrike dhe uniforme nga ngarkesat negative të elektroneve, siç tregohet në figurën më poshtë.
Ky model shpjegoi në mënyrë të kënaqshme faktin se kur një substancë nxehet, ajo fillon të lëshojë dritë. Edhe pse kjo ishte përpjekja e parë për të kuptuar se çfarë është një atom, ajo nuk arriti të kënaqë rezultatet e eksperimenteve të kryera më vonë nga Rutherford dhe të tjerët. Thomson ra dakord në 1911 se modeli i tij thjesht nuk mund të përgjigjej se si dhe pse ndodh shpërndarja e rrezeve α të vëzhguara në eksperimente. Prandaj, ai u braktis dhe u zëvendësua nga një model planetar më i përsosur i atomit.
Si është rregulluar atomi gjithsesi?
Ernest Rutherford dha një shpjegim për fenomenin e radioaktivitetit, që i solli atij Çmimi Nobël, por kontributi i tij më domethënës në shkencë erdhi më vonë, kur ai vërtetoi se atomi përbëhet nga një bërthamë e dendur e rrethuar nga orbitat e elektroneve, ashtu si Dielli është i rrethuar nga orbitat e planetëve. 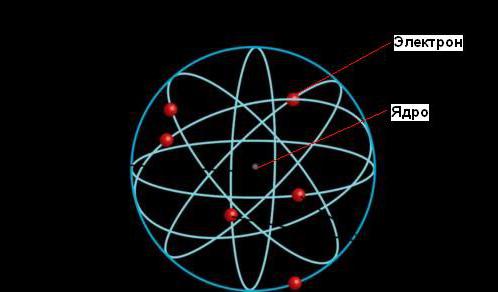
Sipas modelit planetar të një atomi, pjesa më e madhe e masës së tij është e përqendruar në një bërthamë të vogël (në krahasim me madhësinë e të gjithë atomit). Elektronet lëvizin rreth bërthamës, duke udhëtuar me shpejtësi të jashtëzakonshme, por pjesa më e madhe e vëllimit të atomeve është hapësirë boshe.
Madhësia e bërthamës është aq e vogël sa diametri i saj është 100,000 herë më i vogël se ai i një atomi. Diametri i bërthamës u vlerësua nga Rutherford si 10 -13 cm, në ndryshim nga madhësia e atomit - 10 -8 cm. Jashtë bërthamës, elektronet rrotullohen rreth tij me shpejtësi të madhe, duke rezultuar në forca centrifugale që balancojnë forcat elektrostatike. të tërheqjes ndërmjet protoneve dhe elektroneve.
Eksperimentet e Rutherford
Modeli planetar i atomit u ngrit në vitin 1911, pas eksperimentit të famshëm me fletë ari, i cili bëri të mundur marrjen e disa informacioneve themelore për strukturën e tij. Rruga e Radhërfordit drejt zbulimit të bërthamës atomike është shembull i mirë roli i krijimtarisë në shkencë. Kërkimi i tij filloi që në vitin 1899 kur zbuloi se disa elementë lëshojnë grimca të ngarkuara pozitivisht që mund të depërtojnë çdo gjë. Ai i quajti këto grimca grimca alfa (α) (tani e dimë se ishin bërthama heliumi). Si të gjithë shkencëtarët e mirë, Rutherford ishte kurioz. Ai pyeti veten nëse grimcat alfa mund të përdoren për të zbuluar strukturën e një atomi. Rutherford vendosi të drejtonte një rreze grimcash alfa në një fletë me fletë ari shumë të hollë. Ai zgjodhi arin sepse mund të prodhonte fletë të holla deri në 0.00004 cm. Pas fletës së fletës së arit, ai vendosi një ekran që shkëlqente kur grimcat alfa e goditnin atë. Përdorej për të zbuluar grimcat alfa pasi ato kishin kaluar nëpër fletë metalike. Një çarje e vogël në ekran lejoi që rrezja e grimcave alfa të arrinte në fletë metalike pas daljes nga burimi. Disa prej tyre duhet të kalojnë nëpër fletë metalike dhe të vazhdojnë të lëvizin në të njëjtin drejtim, pjesa tjetër duhet të kërcejë nga petë dhe të reflektohet nën qoshe të mprehta. Ju mund të shihni skemën e eksperimentit në figurën më poshtë. 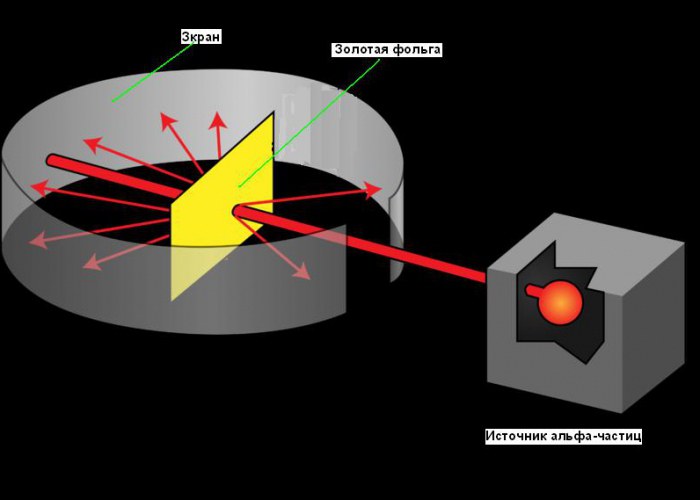
Çfarë ndodhi në eksperimentin e Radhërfordit?
Bazuar në modelin e atomit të J. J. Thomson, Rutherford supozoi se rajonet e ngurta të ngarkesës pozitive që mbushin të gjithë vëllimin e atomeve të arit do të devijonin ose përkulnin trajektoret e të gjitha grimcave alfa ndërsa ato kalonin nëpër fletë metalike.
Megjithatë, shumica dërrmuese e grimcave alfa kaluan pikërisht përmes fletës së artë sikur të mos ishte aty. Ata dukej se po kalonin nëpër hapësirë boshe. Vetëm disa prej tyre devijojnë nga rruga e drejtë, siç ishte menduar në fillim. Më poshtë është një grafik i numrit të grimcave të shpërndara në drejtimin përkatës kundrejt këndit të shpërndarjes. 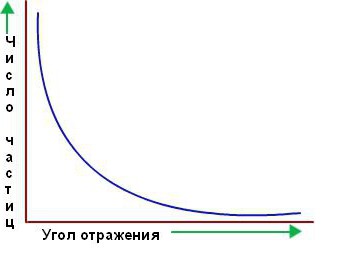
Çuditërisht, një përqindje e vogël e grimcave u kthyen nga petë, si një top basketbolli që kërcen nga një tavolinë. Rutherford kuptoi se këto devijime ishin rezultat i një përplasjeje të drejtpërdrejtë midis grimcave alfa dhe përbërësve të ngarkuar pozitivisht të atomit.
Bërthama zë në qendër të vëmendjes
Bazuar në përqindjen e papërfillshme të grimcave alfa të reflektuara nga petë, mund të konkludojmë se e gjithë ngarkesa pozitive dhe pothuajse e gjithë masa e atomit janë të përqendruara në një zonë të vogël, dhe pjesa tjetër e atomit është kryesisht hapësirë boshe. Rutherford e quajti zonën e ngarkesës pozitive të përqendruar bërthamë. Ai parashikoi dhe shpejt zbuloi se ai përmbante grimca të ngarkuara pozitivisht, të cilat i quajti protone. Rutherford parashikoi ekzistencën e neutralit grimcat atomike, i quajtur neutrone, por ai nuk mundi t'i zbulonte ato. Megjithatë, studenti i tij James Chadwick i zbuloi ato disa vjet më vonë. Figura më poshtë tregon strukturën e bërthamës së një atomi të uraniumit. 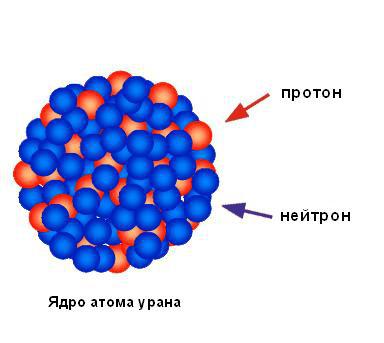
Atomet përbëhen nga bërthama të rënda të ngarkuara pozitivisht të rrethuara nga grimca jashtëzakonisht të lehta të ngarkuara negativisht - elektrone që rrotullohen rreth tyre, dhe me shpejtësi të tilla që forcat mekanike centrifugale thjesht balancojnë tërheqjen e tyre elektrostatike ndaj bërthamës, dhe në lidhje me këtë gjoja sigurohet stabiliteti i atomit.
Disavantazhet e këtij modeli
Ideja kryesore e Rutherford ishte e lidhur me idenë e një bërthame të vogël atomike. Supozimi për orbitat e elektroneve ishte hamendje e pastër. Ai nuk e dinte saktësisht se ku dhe si rrotullohen elektronet rreth bërthamës. Prandaj, modeli planetar i Radhërfordit nuk shpjegon shpërndarjen e elektroneve në orbita.
Për më tepër, stabiliteti i atomit të Rutherford ishte i mundur vetëm me lëvizjen e vazhdueshme të elektroneve në orbita pa humbje të energjisë kinetike. Por llogaritjet elektrodinamike kanë treguar se lëvizja e elektroneve përgjatë çdo trajektore lakorike, e shoqëruar nga një ndryshim në drejtimin e vektorit të shpejtësisë dhe shfaqja e një nxitimi përkatës, shoqërohet në mënyrë të pashmangshme nga emetimi i energjisë elektromagnetike. Në këtë rast, sipas ligjit të ruajtjes së energjisë, energjia kinetike e elektronit duhet të shpenzohet shumë shpejt në rrezatim dhe duhet të bjerë në bërthamë, siç tregohet skematikisht në figurën e mëposhtme. 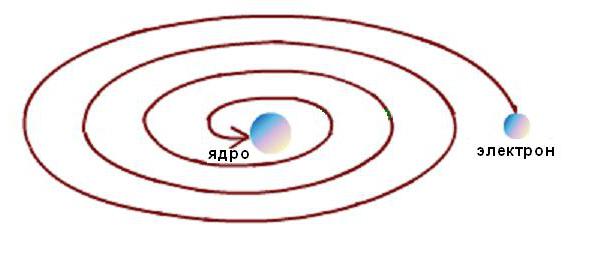 Por kjo nuk ndodh, pasi atomet janë formacione të qëndrueshme. Një kontradiktë tipike shkencore lindi midis modelit të fenomenit dhe të dhënave eksperimentale.
Por kjo nuk ndodh, pasi atomet janë formacione të qëndrueshme. Një kontradiktë tipike shkencore lindi midis modelit të fenomenit dhe të dhënave eksperimentale.
Nga Rutherford në Niels Bohr
Hapi tjetër i madh përpara në historinë atomike erdhi në vitin 1913, kur shkencëtari danez Niels Bohr publikoi një përshkrim të një modeli më të detajuar të atomit. Ajo përcaktoi më qartë vendet ku mund të ishin elektronet. Edhe pse shkencëtarët e mëvonshëm do të zhvillonin dizajne atomike më të sofistikuara, modeli planetar i atomit i Bohr ishte në thelb i saktë dhe shumë prej tij pranohet ende sot. Ai kishte shumë aplikime të dobishme, për shembull, përdoret për të shpjeguar vetitë e elementeve të ndryshëm kimikë, natyrën e spektrit të tyre të rrezatimit dhe strukturën e atomit. Modeli planetar dhe modeli Bohr ishin momentet më të rëndësishme që shënuan shfaqjen e një drejtimi të ri në fizikë - fizikën e mikrobotës. Bohr mori çmimin Nobel në Fizikë në vitin 1922 për kontributin e tij në kuptimin tonë të strukturës së atomit.
Çfarë të re solli Bohr në modelin e atomit?
Ndërsa ishte ende i ri, Bohr punoi në laboratorin e Radhërfordit në Angli. Meqenëse koncepti i elektroneve ishte zhvilluar dobët në modelin e Rutherford, Bohr u fokusua në to. Si rezultat, modeli planetar i atomit u përmirësua ndjeshëm. Postulatet e Bohr-it, të cilat ai i formuloi në artikullin e tij "Mbi Strukturën e Atomeve dhe Molekulave", botuar në 1913, lexonin:
1. Elektronet mund të lëvizin rreth bërthamës vetëm në distanca fikse prej saj, të përcaktuara nga sasia e energjisë që kanë. Ai i quajti këto nivele fikse nivele energjie ose predha elektronike. Bohr i përfytyroi ato si sfera koncentrike, me një bërthamë në qendër të secilës. Në këtë rast, elektronet me energji më të ulët do të gjenden në nivele më të ulëta, më afër bërthamës. Ata që kanë më shumë energji do të gjenden më shumë nivele të larta, larg nga thelbi.
2. Nëse një elektron thith një sasi (mjaft të sigurt për një nivel të caktuar) energjie, atëherë ai do të hidhet në nivelin tjetër, më të lartë të energjisë. Në të kundërt, nëse humbet të njëjtën sasi energjie, ai do të kthehet në nivelin e tij origjinal. Megjithatë, një elektron nuk mund të ekzistojë në dy nivele energjetike.
Kjo ide ilustrohet nga një figurë. 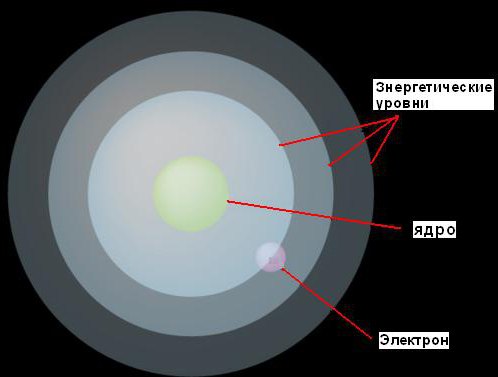
Pjesët e energjisë për elektronet
Modeli Bohr i atomit është në fakt një kombinim i dy ideve të ndryshme: modeli atomik i Rutherford-it me elektrone që rrotullohen rreth bërthamës (në thelb modeli planetar Bohr-Rutherford i atomit), dhe ideja e Max Planck-ut për kuantizimin e energjisë së materies. botuar në vitin 1901. Një kuant (shumës - kuantë) është sasia minimale e energjisë që mund të absorbohet ose të emetohet nga një substancë. Është një lloj hapi diskretizimi për sasinë e energjisë.
Nëse energjia krahasohet me ujin dhe ju dëshironi ta shtoni atë në materie në formën e një gote, nuk mund të derdhni ujë vetëm në një rrjedhë të vazhdueshme. Në vend të kësaj, mund ta shtoni në sasi të vogla, si një lugë çaji. Bohr besonte se nëse elektronet mund të thithin ose humbin vetëm sasi fikse të energjisë, atëherë ata duhet të ndryshojnë energjinë e tyre vetëm nga këto sasi fikse. Kështu, ata mund të zënë vetëm fikse nivelet e energjisë rreth bërthamës, të cilat korrespondojnë me rritjet e kuantizuara të energjisë së tyre.
Pra, nga modeli Bohr rritet një qasje kuantike për të shpjeguar se çfarë është struktura e atomit. Modeli planetar dhe modeli Bohr ishin një lloj hapash nga fizika klasike në fizikën kuantike, e cila është mjeti kryesor në fizikën e mikrobotës, duke përfshirë fizikën atomike.
Në vitin 1903, shkencëtari anglez Thomson propozoi një model të atomit, i cili me shaka u quajt "simite me rrush të thatë". Sipas tij, një atom është një sferë me një ngarkesë pozitive uniforme, në të cilën elektronet e ngarkuara negativisht janë të ndërthurura si rrushi i thatë.
Megjithatë, studimet e mëtejshme të atomit treguan se kjo teori është e paqëndrueshme. Dhe disa vjet më vonë, një fizikan tjetër anglez, Rutherford, kreu një sërë eksperimentesh. Bazuar në rezultatet, ai ndërtoi një hipotezë për strukturën e atomit, e cila ende njihet në mbarë botën.
Përvoja e Rutherford: propozimi i modelit të tij të atomit
Në eksperimentet e tij, Rutherford kaloi një rreze grimcash alfa përmes fletëve të hollë ari. Ari u zgjodh për plasticitetin e tij, i cili bëri të mundur krijimin e një petë shumë të hollë, pothuajse një shtresë molekulash të trashë. Pas fletë metalike ishte një ekran i veçantë që ndriçohej kur bombardohej nga grimcat alfa që binin mbi të. Sipas teorisë së Thomson-it, grimcat alfa duhet të kishin kaluar nëpër fletë të papenguara, duke devijuar jo pak në anët. Megjithatë, doli që disa nga grimcat u sollën në këtë mënyrë, dhe një pjesë shumë e vogël u kthye prapa, sikur të godiste diçka.
Kjo do të thotë, u zbulua se brenda atomit ka diçka të ngurtë dhe të vogël, nga e cila u hodhën grimcat alfa. Pikërisht atëherë Rutherford propozoi një model planetar të strukturës së atomit. Modeli planetar i atomit i Radhërfordit shpjegoi rezultatet e eksperimenteve të tij dhe të kolegëve të tij. Deri më sot, asnjë model më i mirë nuk është propozuar, megjithëse disa aspekte të kësaj teorie ende nuk pajtohen me praktikën në disa fusha shumë të ngushta të shkencës. Por në thelb, modeli planetar i atomit është më i dobishëm nga të gjithë. Cili është ky model?
Modeli planetar i strukturës së atomit
Siç nënkupton edhe emri, një atom krahasohet me një planet. Në këtë rast, planeti është bërthama e një atomi. Dhe elektronet rrotullohen rreth bërthamës në një distancë mjaft të madhe, ashtu si satelitët rrotullohen rreth planetit. Vetëm shpejtësia e rrotullimit të elektroneve është qindra mijëra herë më e madhe se shpejtësia e rrotullimit të satelitit më të shpejtë. Prandaj, gjatë rrotullimit të tij, elektroni krijon, si të thuash, një re mbi sipërfaqen e bërthamës. Dhe ngarkesat ekzistuese të elektroneve sprapsin të njëjtat ngarkesa të formuara nga elektronet e tjera rreth bërthamave të tjera. Prandaj, atomet nuk "ngjiten së bashku", por ndodhen në një distancë të caktuar nga njëri-tjetri.
Dhe kur flasim për përplasjen e grimcave, nënkuptojmë se ato afrohen mjaftueshëm me njëra-tjetrën distancë e madhe dhe zmbrapsen nga fushat e ngarkesave të tyre. Nuk ka asnjë kontakt të drejtpërdrejtë. Grimcat në lëndë janë përgjithësisht shumë larg njëra-tjetrës. Nëse me ndonjë mjet do të ishte e mundur të shpërthenin së bashku grimcat e ndonjë trupi, ai do të reduktohej me një miliard herë. Toka do të bëhej më e vogël se një mollë. Pra, vëllimi kryesor i çdo substance, sado e çuditshme që mund të tingëllojë, është e zënë nga një zbrazëti në të cilën ndodhen grimcat e ngarkuara, të mbajtura në një distancë nga forcat elektronike të ndërveprimit.
Keni nevojë për ndihmë me studimet tuaja?
Tema e mëparshme: Radioaktiviteti: rrezatimi alfa, beta, gamaTema tjetër: Bërthama atomike: Ngarkesa bërthamore
2.5. Eksperimentet e Rutherford. Modeli i atomit të Rutherford
Eksperimentet e A. Rutherford
Në vitin 1911, Rutherford kreu eksperimente me rëndësi të jashtëzakonshme që vërtetuan ekzistencën e bërthamës atomike. Për të studiuar atomin, Rutherford përdori sondimin (bombardimin) e tij me ndihmën e grimcave α, të cilat lindin gjatë prishjes së radiumit, poloniumit dhe disa elementëve të tjerë. Rutherford dhe bashkëpunëtorët e tij, edhe në eksperimentet e mëparshme në 1909, zbuluan se grimcat α kanë një ngarkesë pozitive të barabartë në modul me dyfishin e ngarkesës së elektronit q =+2e, dhe një masë që përkon me masën e një atomi të heliumit, d.m.th.
m a\u003d 6,62 10 -27 kg,
që është rreth 7300 herë masa e një elektroni. Më vonë u zbulua se grimcat α janë bërthamat e atomeve të heliumit. Me këto grimca, Rutherford bombardoi atomet e elementeve të rënda. Elektronet për shkak të masës së tyre të vogël nuk mund të ndryshojnë trajektoren e grimcës α. Shpërndarja e tyre (ndryshimi i drejtimit të lëvizjes) mund të shkaktohet vetëm nga pjesa e ngarkuar pozitivisht e atomit. Kështu, nga shpërndarja e grimcave α, mund të përcaktohet natyra e shpërndarjes së ngarkesës pozitive, dhe rrjedhimisht masa brenda atomit.
Dihej se grimcat α të emetuara nga polonium fluturojnë me një shpejtësi prej 1,6-107 m/s. Poloniumi u vendos brenda një kuti plumbi, përgjatë së cilës u shpua një kanal i ngushtë. Rrezja e grimcave α, duke kaluar nëpër kanal dhe hapje, u përplas në fletë metalike. Fleta e arit mund të bëhet jashtëzakonisht e hollë - 4-10 -7 m e trashë (400 atome ari; ky numër mund të vlerësohet duke ditur masën, densitetin dhe masën molare të arit). Pas fletës, grimcat α godasin një ekran gjysmë transparent të veshur me sulfur zinku. Përplasja e secilës grimcë me ekranin u shoqërua me një ndezje drite (scintilacion) për shkak të fluoreshencës, e cila u vëzhgua nën një mikroskop.
Me një vakum të mirë brenda pajisjes (në mënyrë që të mos kishte shpërndarje të grimcave nga molekulat e ajrit), në mungesë të fletë metalike, një rreth i ndritshëm u shfaq në ekran nga shkrepjet e shkaktuara nga një rreze e hollë e grimcave α. Kur një fletë metalike vendosej në shtegun e rrezes, pjesa dërrmuese e grimcave α ende nuk devijonin nga drejtimi i tyre origjinal, domethënë kaluan nëpër fletë si të ishte hapësirë boshe. Megjithatë, kishte grimca alfa që ndryshuan rrugën e tyre dhe madje u kthyen prapa.
Marsden dhe Geiger, studentët dhe bashkëpunëtorët e Rutherford-it, numëruan më shumë se një milion shkëndija dhe përcaktuan se rreth një në 2000 grimca alfa devijuan përmes këndeve më të mëdha se 90° dhe një në 8000 deri në 180°. Ishte e pamundur të shpjegohej ky rezultat në bazë të modeleve të tjera të atomit, në veçanti Thomson.
Llogaritjet tregojnë se kur shpërndahet në të gjithë atomin, një ngarkesë pozitive (edhe pa marrë parasysh elektronet) nuk mund të krijojë një fushë elektrike mjaft intensive të aftë për të hedhur prapa një grimcë α. Fuqia e fushës elektrike e një topi të ngarkuar në mënyrë uniforme është maksimale në sipërfaqen e topit dhe zvogëlohet në zero kur i afrohet qendrës. Shpërndarja e grimcave α në kënde të mëdha ndodh sikur e gjithë ngarkesa pozitive e atomit të ishte e përqendruar në bërthamën e tij - një rajon që zë një vëllim shumë të vogël në krahasim me të gjithë vëllimin e atomit.
Probabiliteti që grimcat α të godasin bërthamën dhe t'i devijojnë ato përmes këndeve të mëdha është shumë i vogël, kështu që për shumicën e grimcave α, petë nuk dukej se ekzistonte.
Rutherford konsideroi teorikisht problemin e shpërndarjes së grimcave α në fushën elektrike të Kulombit të një bërthame dhe mori një formulë që bën të mundur përcaktimin e numrit N ngarkesa elementare pozitive +e që përmbahen në bërthamën e atomeve të një fletë shpërndarjeje të caktuar. Eksperimentet kanë treguar se numri N e barabartë me numrin rendor të elementit në sistemin periodik të D. I. Mendeleev, d.m.th N=Z(për ar Z= 79).
Kështu, hipoteza e Radhërfordit për përqendrimin e një ngarkese pozitive në bërthamën e një atomi bëri të mundur përcaktimin e kuptimit fizik të numrit rendor të një elementi në sistemin periodik të elementeve. Atomi neutral duhet të përmbajë gjithashtu Z elektronet. Është thelbësore që numri i elektroneve në një atom, i përcaktuar me metoda të ndryshme, të përkojë me numrin e ngarkesave elementare pozitive në bërthamë. Kjo shërbeu si një provë e vlefshmërisë së modelit bërthamor të atomit.
B. Modeli bërthamor i atomit i Radhërfordit
Duke përmbledhur rezultatet e eksperimenteve mbi shpërndarjen e grimcave α me fletë ari, Rutherford vendosi:
♦ atomet për nga natyra e tyre janë kryesisht transparente ndaj grimcave α;
♦ Devijimet e grimcave α në kënde të mëdha janë të mundshme vetëm nëse brenda atomit ka një fushë elektrike shumë të fortë, e krijuar nga një ngarkesë pozitive e shoqëruar me një masë të madhe të përqendruar në një vëllim shumë të vogël.
Për të shpjeguar këto eksperimente, Rutherford propozoi një model bërthamor të atomit: në bërthamën atomike (rajone me dimensione lineare 10 -15 -10 -14 m) të gjithë ngarkesën e tij pozitive dhe pothuajse të gjithë masën e atomit (99,9%). janë të përqendruara. Rreth bërthamës në një rajon me dimensione lineare ~10 -10 m (përmasat e atomit vlerësohen në teorinë molekulare-kinetike), elektronet e ngarkuara negativisht lëvizin në orbita të mbyllura, masa e të cilave është vetëm 0,1% e masës. të bërthamës. Rrjedhimisht, elektronet janë të vendosura në një distancë nga bërthama nga 10,000 deri në 100,000 diametra të bërthamës, domethënë pjesa kryesore e atomit është hapësira boshe.
Modeli bërthamor i atomeve i Rutherford i ngjan sistemit diellor: në qendër të sistemit është "dielli" - bërthama, dhe rreth tij "planetet" - elektronet lëvizin në orbita, prandaj ky model quhet planetare. Elektronet nuk bien në bërthamë sepse forcat elektrike të tërheqjes midis bërthamës dhe elektroneve balancohen nga forcat centrifugale për shkak të rrotullimit të elektroneve rreth bërthamës.
Në vitin 1914, tre vjet pas krijimit të modelit planetar të atomit, Rutherford hetoi ngarkesat pozitive në bërthamë. Duke bombarduar atomet e hidrogjenit me elektrone, ai zbuloi se atomet neutrale shndërroheshin në grimca të ngarkuara pozitivisht. Meqenëse atomi i hidrogjenit ka një elektron, Rutherford vendosi që bërthama e një atomi është një grimcë që mban një ngarkesë elementare pozitive +e. Ai e quajti këtë grimcë proton.
Modeli planetar është në përputhje të mirë me eksperimentet mbi shpërndarjen e grimcave α, por nuk mund të shpjegojë qëndrueshmërinë e atomit. Konsideroni, për shembull, një model të një atomi hidrogjeni që përmban një bërthamë protoni dhe një elektron që lëviz me një shpejtësi v rreth bërthamës në një orbitë rrethore me rreze r. Elektroni duhet të rrotullohet në bërthamë dhe frekuenca e rrotullimit të tij rreth bërthamës (pra, frekuenca e valëve elektromagnetike të emetuara prej tij) duhet të ndryshojë vazhdimisht, domethënë, atomi është i paqëndrueshëm dhe rrezatimi i tij elektromagnetik duhet të ketë një vazhdimësi. spektrit.
Në fakt, rezulton se:
a) atomi është i qëndrueshëm;
b) një atom rrezaton energji vetëm në kushte të caktuara;
c) rrezatimi i një atomi ka një spektër vijash të përcaktuar nga struktura e tij.
Kështu, aplikimi i elektrodinamikës klasike në modelin planetar të atomit çoi në një kontradiktë të plotë me faktet eksperimentale. Kapërcimi i vështirësive që u shfaqën kërkonte krijimin e një të reje cilësore kuantike- teoria e atomit. Megjithatë, pavarësisht mospërputhjes së tij, modeli planetar ende pranohet si një pamje e përafërt dhe e thjeshtuar e atomit.
Modeli planetar i atomit
Modeli planetar i një atomi: bërthama (e kuqe) dhe elektronet (jeshile)
Modeli planetar i atomit, ose Modeli i Rutherford, - modeli historik i strukturës së atomit, i cili u propozua nga Ernest Rutherford si rezultat i një eksperimenti me shpërndarjen e grimcave alfa. Sipas këtij modeli, atomi përbëhet nga një bërthamë e vogël e ngarkuar pozitivisht, në të cilën është e përqendruar pothuajse e gjithë masa e atomit, rreth së cilës lëvizin elektronet, ashtu siç lëvizin planetët rreth diellit. Modeli planetar i atomit korrespondon me idetë moderne për strukturën e atomit, duke marrë parasysh faktin se lëvizja e elektroneve është e një natyre kuantike dhe nuk përshkruhet nga ligjet e mekanikës klasike. Historikisht, modeli planetar i Rutherford-it pasoi "modelin e pudingut të kumbullës" të Joseph John Thomson-it, i cili postulon se elektronet e ngarkuara negativisht vendosen brenda një atomi të ngarkuar pozitivisht.
Rutherford propozoi një model të ri për strukturën e atomit në vitin 1911 si përfundim nga një eksperiment mbi shpërndarjen e grimcave alfa në fletë ari, të kryer nën udhëheqjen e tij. Gjatë kësaj shpërndarjeje, një numër i madh i papritur i grimcave alfa u shpërndanë në kënde të mëdha, gjë që tregonte se qendra e shpërndarjes kishte dimensione të vogla dhe një sasi e konsiderueshme energjie ishte e përqendruar në të. ngarkesë elektrike. Llogaritjet e Rutherford-it treguan se një qendër shpërndarjeje, e ngarkuar pozitivisht ose negativisht, duhet të jetë të paktën 3000 herë më e vogël se madhësia e një atomi, e cila në atë kohë dihej tashmë dhe vlerësohej të ishte rreth 10 -10 m. Meqenëse elektronet njiheshin tashmë në se koha, dhe masa dhe ngarkesa e tyre janë përcaktuar, atëherë qendra e shpërndarjes, e cila më vonë u quajt bërthama, duhet të ketë pasur ngarkesë të kundërt me elektronet. Rutherford nuk e lidhi sasinë e ngarkesës me numrin atomik. Ky përfundim u bë më vonë. Dhe vetë Rutherford sugjeroi që ngarkesa është në përpjesëtim me masën atomike.
Disavantazhi i modelit planetar ishte papajtueshmëria e tij me ligjet e fizikës klasike. Nëse elektronet lëvizin rreth bërthamës si një planet rreth Diellit, atëherë lëvizja e tyre përshpejtohet, dhe, për rrjedhojë, sipas ligjeve të elektrodinamikës klasike, ata duhet të rrezatojnë valë elektromagnetike, të humbasin energjinë dhe të bien në bërthamë. Hapi tjetër në zhvillimin e modelit planetar ishte modeli Bohr, duke postuar ligje të tjera, të ndryshme nga klasike, të lëvizjes së elektroneve. Plotësisht kontradiktat e elektrodinamikës ishin në gjendje të zgjidhnin mekanikën kuantike.
Fondacioni Wikimedia. 2010 .
Shihni se çfarë është "Modeli Planetar i Atomit" në fjalorë të tjerë:
modeli planetar i atomit- planetinis atomo modelis statusas T sritis fizika atitikmenys: angl. modeli i atomit planetar vok. Planetenmodell des Atoms, n rus. model planetar i atomit, f pranc. modele planétaire de l'atome, m … Fizikos terminų žodynas
Modeli Bohr i një atomi të ngjashëm me hidrogjenin (Z është ngarkesa e bërthamës), ku elektroni i ngarkuar negativisht është i mbyllur në guaskë atomike, që rrethon një të vogël, të ngarkuar pozitivisht bërthama atomike... Wikipedia
Model (frëngjisht modèle, italisht modello, nga latinishtja modulus masë, masë, mostër, normë), 1) mostër që shërben si standard (standarde) për riprodhim serik ose masiv (M. e një makine, M. e rrobave etj. .). ), si dhe llojin, markën e çdo ... ...
I Model (Model) Walter (24 janar 1891, Gentin, Prusia Lindore, 21 Prill 1945, afër Duisburgut), Gjeneral Field Marshall nazist gjerman (1944). Në ushtri që nga viti 1909, mori pjesë në Luftën e Parë Botërore të vitit 1914 18. Nga nëntori 1940 ai komandoi tankun e 3-të ... ... Enciklopedia e Madhe Sovjetike
Një atom përbëhet nga një bërthamë e ngarkuar pozitivisht dhe grimca të ngarkuara negativisht që rrotullohen rreth tij - elektrone që përbëjnë shtresën e tij elektronike.
Shuma e ngarkesave të elektroneve është e barabartë në vlerë absolute me ngarkesën pozitive të bërthamës, kështu që atomi në tërësi është një sistem elektrikisht neutral. Madhësia e një atomi përcaktohet nga madhësia e tij shtresë elektronike dhe përbëjnë një vlerë të rendit 10-8 cm.
Elektronet në shtresën e një atomi janë të rregulluar në shtresa. Numri i shtresave elektronike është i barabartë me numrin serial element kimik në sistemin periodik të elementeve D.I. Mendelejevi.
Në shtresën e parë K, e cila është më afër bërthamës, rrotullohen jo më shumë se dy elektrone. Në shtresën tjetër L - jo më shumë se 8, në shtresën M - jo më shumë se 18, dhe në shtresën e katërt N - jo më shumë se 32 elektrone. Në këtë mënyrë, numri më i madh elektronet e këtyre shtresave është e barabartë me dyfishin e katrorit të numrit të shtresës Z = 2n2. Në shtresat pasuese, ky rregull shkelet, dhe numri i elektroneve mund të jetë: në shtresën e pestë O - nga 1 në 29, në shtresën e gjashtë P - nga 1 në 9 dhe në shtresën shtesë (të fundit) Q - jo më shumë se 2 elektrone.
Çdo atom ekziston vetëm në disa gjendje diskrete të energjisë që korrespondojnë me një vlerë të përcaktuar rreptësisht të energjisë së tij.
Kalimi i një atomi nga një gjendje energjetike në tjetrën shoqërohet me thithjen ose emetimin e energjisë. Në gjendjen e tij normale, një atom nuk rrezaton.
Nëse njëri prej elektroneve, kur përplaset me ndonjë grimcë nga jashtë, merr energji shtesë, atëherë ai do të shkojë në një orbitë më të largët të shtresës së cilës i përgjigjet energjia e re. Në këtë rast, atomi hyn në një gjendje të ngacmuar, dhe më pas një nga elektronet e shtresës së jashtme kërcen në vendin e lirë. Pas një kohe të shkurtër (të rendit 10-8 s), atomi kthehet në gjendjen e tij normale, ndërsa lëshon dritë e dukshme, rrezatimi ultravjollcë ose me rreze x.
Nëse një elektron i një atomi merr një energji të madhe, atëherë ai do të rrëzohet plotësisht (largohet) nga atomi. Ky proces quhet jonizimi.
Bërthama e një atomi përbëhet nga grimca të ngarkuara pozitivisht (protone) dhe grimca neutrale pa ngarkesë (neutrone). Të dyja këto grimca zakonisht quhen nukleone.
Një proton është një grimcë materiale që ka një masë mр = 1,6726. 10-24 vjet = 1,007275 amu Ngarkesa pozitive është e barabartë me 1e+. Meqenëse masa e neutronit (mn = 1,008665 amu) është vetëm 0,14% më e madhe se masa e protonit, ky ndryshim zakonisht nuk merret parasysh në llogaritjet dhe masa e neutronit praktikisht konsiderohet e barabartë me masën e protonit .
Dimensionet e bërthamës janë shumë të vogla: 10-12-10-13 cm (bërthama është 100.000 herë më e vogël se një atom). Pavarësisht nga madhësia e vogël e bërthamës, 99.95% e masës së atomit është e përqendruar në të. Duke pasur parasysh këtë, dendësia e lëndës bërthamore është shumë e lartë dhe arrin në rreth 1017 kg/m3.
Ngarkesa e bërthamës, e shprehur në njësi elementare, është numerikisht e barabartë me numrin rendor të elementit në sistemin periodik të D.I. Mendelejevi. Kjo bën të mundur përcaktimin e numrit të protoneve në bërthamën e një atomi të caktuar me numrin rendor të elementit Z.
Numri i përgjithshëm i nukleoneve në bërthamën e një atomi mund të përcaktohet nga i ashtuquajturi numër masiv A. Numri masiv është pesha atomike e elementit të rrumbullakosur në njësi të tëra. Meqenëse numri i protoneve në bërthamë është numerikisht i barabartë me numrin rendor të elementit Z, numri i neutroneve është i barabartë me diferencën numri masiv A dhe numri serial Z, d.m.th. N \u003d A - Z. Për shembull, heliumi ka Z \u003d 2 dhe A \u003d 4, që do të thotë se ka dy protone dhe dy neutrone në bërthamën e një atomi helium.
Kështu, vendi i elementit në sistemin periodik të elementeve të D.I. Mendelejevi dhe pesha e tij atomike zbulojnë jo vetëm strukturën e atomit, por edhe strukturën e bërthamës së tij.
Lloji i atomeve me numër të caktuar të protoneve dhe neutroneve quhet nuklid.
Vlera e peshës atomike në tabelën e elementeve shprehet pothuajse gjithmonë si një numër thyesor. Kjo ndodh sepse pothuajse çdo element në të vërtetë përbëhet nga disa lloje të këtij elementi që kanë të njëjtën ngarkesë elektrike, por masë të ndryshme, d.m.th. i njëjti numër protonesh në bërthamë, por një numër i ndryshëm neutronesh. Varietetet e një elementi kimik që kanë të njëjtin numër protonesh në bërthamën e një atomi, por një numër të ndryshëm neutronesh quhen izotopë.
Të gjithë izotopet e një elementi të caktuar vendosen në një qelizë të tabelës së elementeve të sistemit periodik. Vlera fraksionale e peshës atomike të një elementi pasqyron në këtë rast vlerën mesatare të peshës atomike të të gjithë izotopeve të këtij elementi. Aktualisht, njihen më shumë se 1500 izotope, nga të cilët jo më shumë se 300 janë të qëndrueshëm (bërthamat e të cilave nuk pësojnë ndryshime gjatë një periudhe të gjatë kohore), pjesa tjetër janë radioaktive (bërthamat e të cilave kalbet me kalimin e kohës).
Modeli planetar i strukturës së atomit u propozua për herë të parë nga J. Perrin, duke u përpjekur të shpjegonte vetitë e vëzhguara me lëvizjen orbitale të elektroneve. Por V. Vin e konsideroi të paqëndrueshme. Së pari, një elektron gjatë rrotullimit, sipas elektrodinamikës klasike, duhet të rrezatojë vazhdimisht energji dhe, në fund, të bjerë në bërthamë. Së dyti, për shkak të humbjes së vazhdueshme të energjisë, rrezatimi i një atomi duhet të ketë një spektër të vazhdueshëm dhe të vërehet një spektër i linjës.
Eksperimentet mbi kalimin e grimcave a - nëpër pllaka të holla ari dhe metale të tjera u kryen nga punonjësit e E. Rutherford E. Marsden dhe H. Geiger (1908).
Ata zbuluan se pothuajse të gjitha grimcat kalojnë nëpër pllakë lirshëm, dhe vetëm 1/10,000 prej tyre përjetojnë një devijim të fortë - deri në 150 °. Modeli i Thomson nuk mund ta shpjegonte këtë, por Rutherford, ish-asistenti i tij, bëri vlerësime të fraksionit të devijimeve dhe erdhi në modelin planetar: ngarkesa pozitive është e përqendruar në një vëllim të rendit 10 -15. me peshë të konsiderueshme.
Duke i konsideruar orbitat e elektroneve në atom për t'u fiksuar, Thomson në 1913 arriti gjithashtu në një model planetar të strukturës së atomit.
Por, duke zgjidhur problemin e stabilitetit të një atomi të tillë duke përdorur ligjin e Kulombit, ai gjeti një orbitë të qëndrueshme vetëm për një elektron. As Thomson dhe as Rutherford nuk mund të shpjegonin emetimin e grimcave a - gjatë zbërthimit radioaktiv - doli që elektronet duhet të ishin gjithashtu në qendër të atomit ?!
Për këtë foli edhe M. Sklodowska-Curie. Rutherford e pranoi këtë, por ai duhej të caktonte funksionin e ngjitjes së bërthamave së bashku me elektronet në mënyrë që zmbrapsja e Kulombit të mos e ndante bërthamën. Këto modele nuk lejuan marrjen e rezultateve sasiore në përputhje me eksperimentet. Në vitin 1913, disa të dhëna eksperimentale mbi modelin e Rutherfordit iu dhanë peshë. dukuritë radioaktive. Ndihmësi i tij G. Moseley mati frekuencën vijat spektrale një numër atomesh të sistemit periodik dhe zbuloi se "një vlerë e caktuar karakteristike është e natyrshme në atom, e cila rritet rregullisht gjatë kalimit nga atomi në atom. Kjo sasi nuk mund të jetë asgjë tjetër përveç ngarkesës së bërthamës së brendshme” [Cit. sipas: 5, f. 194].
Ndërtimi i një teorie të strukturës së atomit në bazë të modelit planetar hasi në një bollëk kontradiktash.
Fillimisht, fizikani danez N. Bohr u përpoq të zbatonte mekanikën klasike dhe elektrodinamikën për problemin e ngadalësimit të grimcave të ngarkuara kur lëviznin nëpër materie, por për një vlerë të caktuar të energjisë së elektronit, u bë e mundur të atribuoheshin parametra arbitrare të orbitës. (ose frekuencë) për të, gjë që çoi në paradokse.
Modeli planetar i Radhërfordit për strukturën e atomit doli të ishte i papajtueshëm me elektrodinamikën e Maksuellit.
Në shkurt 1913, u shfaqën artikuj mbi interpretimin e spektrave të yjeve nga J. Nicholson. Ai, duke shtrirë idenë e Planck-ut tek atomet, propozoi të kuantizonte projeksionet e momentit të elektronit. Kështu u shfaq një atom me orbita diskrete, përgjatë të cilit rrotulloheshin grupe elektronesh, duke lëshuar valë elektromagnetike me një frekuencë të barabartë me frekuencën e qarkullimit. Një model i tillë ishte i përshtatshëm për atomet shumë të ngacmuar, dhe Nicholson shpjegoi disa nga veçoritë në spektrat e yjeve dhe mjegullnajave bazuar në modelin e atomit - idenë e një unaze elektronike që rrotullohet rreth një bërthame të ngarkuar pozitivisht.
Atomi karakterizohej, para së gjithash, nga spektri i tij i emetimit. Ai lidhi me frekuencat spektrale frekuencat e dridhjeve mekanike të postuluara posaçërisht të elektroneve pingul me rrafshin e unazës.






