Bir elektronun enerjisi, enerji düzeyinde maksimumdur. Alt seviyelerde atomik orbitallerin sayısının hesaplanması
1. Periyodik yasanın bir yansıması olarak periyodik elementler sistemi . Periyodik yasanın formülasyonları. Atomik orbitallerin elektronlarla doldurulmasının ana düzenlilikleri ve periyotların oluşumu. s -, p -, d - vef - elementler ve periyodik sistemdeki yerleri. Periyodik sistemin yapısı: küçük ve büyük periyotlar, ana ve ikincil alt gruplar. Lantanitlerin ve aktinitlerin konumu. Periyodik tablonun modern formları. İnorganik kimyanın gelişiminin temeli olarak periyodik yasa. Periyodik yasanın genel bilimsel önemi.
1 İle birlikte. 41-46; 2 İle birlikte. 46-55; 4 İle birlikte. 30-40; 5 . İle birlikte. 6-8, 21-32; 8 İle birlikte. 105-106; 11 İle birlikte. 75–203.
Periyodik Kanun modern anlamda: "Kimyasal elementlerin atomlarının özellikleri ile oluşturdukları maddelerin bileşimi ve özellikleri, yüklere periyodik olarak bağımlıdır. atom çekirdeği».
Periyodik yasanın grafik ifadesi, periyodik elementler sisteminin tablosudur. Sadece bir periyodik yasa vardır ve periyodik elementler sisteminin 500'den fazla formu bilinmektedir.Bunlardan en yaygın olanı kısa süre(8 hücre) , yarı uzun dönem(18 hücre) ve uzun dönem(32 hücre).
Kimyasal elementler, atomlarının çekirdeklerinin artan yük sırasına göre periyodik tabloda düzenlenmiştir. Periyodik sistem şunlardan oluşur: dönemler ve gruplar.
Dönem- dış enerji seviyesinin elektronik konfigürasyonu arasında değişen atomlarının çekirdeğinin artan yüküne göre düzenlenmiş bir dizi element ns 1 (alkali metal) ila ns 2 np 6 (soy gaz). İlk dönem için - 1'den s 1 (hidrojen) ila 1 s 2 (helyum). Birinci, ikinci ve üçüncü periyotlara denir. küçük(veya kısa), gerisi - büyük(veya uzun). Toplamda 7 periyot vardır.
Periyot numarasının fiziksel anlamı – bu eşittir belirli bir periyotta kimyasal elementlerin atomlarındaki enerji seviyelerinin sayısı.Örneğin, uyarılmamış durumda olan 4. periyottaki elementlerin atomlarında, elektronlar 4 enerji seviyesinde (4 elektron kabuğu) dağıtılır.
Grup – dikey sıra benzer unsurlara sahip elektronik yapı atomlardır ve bu nedenle benzer özellikler sergilerler. Kural olarak, grup numarası şunları gösterir: kimyasal bağ oluşumuna katılabilen bir elementin atomundaki elektron sayısı.
2. Kimyasal elementlerin atomlarının özelliklerinin periyodikliği. Değişimin doğasını belirleyen faktörler kimyasal özellikler elementler. Atomun elektron kabuklarının "konfigürasyonu" ve "yapısı", periyot ve gruplardaki değişimleri. Atomların ve iyonların yarıçapları, değerlerinin oranı. Etkili (kovalent, iyonik, metalik) ve yörünge yarıçapları. Atomların ve iyonların yarıçaplarını periyotlara ve gruplara göre değiştirme.
İyonlaşma enerjisi (iyonlaşma potansiyeli) ve elektron ilgisi. Değerlerini belirleyen faktörler: atomun yarıçapı, dış elektron kabuğunun konfigürasyonu, atom çekirdeğinin etkin yükü. Periyotlar ve gruplar halinde iyonlaşma enerjisi ve elektron ilgisi değişim modelleri.
Elektronegatiflik kavramı. Periyotlarda ve gruplarda atomların elektronegatifliklerindeki değişim. Atomların elektronegatifliğindeki farkın, aralarındaki kimyasal bağın doğası üzerindeki etkisi. Elementlerin kimyasal özelliklerinde yapılarına bağlı olarak gruplar ve periyotlardaki değişimler elektron kabukları, atom yarıçaplarının yanı sıra.
1 İle birlikte. 46-51; 2 İle birlikte. 51-52, 94-98, 423; 99-103; 4 İle birlikte. 40-46; 5 İle birlikte. 6–9, 49–53; 7 İle birlikte. 81-90; 8 İle birlikte. 106-112; 11 İle birlikte. 63-67.
Kimyasal elementlerin atomlarının kimyasal özelliklerini belirleyen en önemli faktörler elektron kabuklarının konfigürasyonu ve yapısıdır. Atom çekirdeğinin yükündeki art arda artış, dış elektron kabuklarının elektronik konfigürasyonunda periyodik bir değişikliğe yol açar. ns 1 ila ns 2 np 6. Bunun sonucu, atomların kovalent, iyonik ve metalik yarıçap, iyonlaşma enerjisi, elektron ilgisi, oksidasyon durumu, atom hacmi vb. gibi özelliklerinde periyodik bir değişikliktir.
Kesin olarak söylemek gerekirse, herhangi bir atomun boyutu sonsuzdur, çünkü elektronlarını çekirdekten keyfi olarak büyük bir mesafede bulma olasılığı sıfır değildir. Bununla birlikte, herhangi bir yörünge için radyal elektron yoğunluk dağılımının eğrisinde bir ana maksimum vardır. Buna göre konsept yörünge yarıçapı atom. O eşittir teorik olarak hesaplanmış dış yörünge için radyal dağılım eğrisinde çekirdekten ana maksimuma olan mesafe.
Bir atomun büyüklüğünden bahsetmişken, çoğu zaman bunu kastediyorlar. etkiliyarıçap. Değerleri belirler deneysel olarak moleküllerde, iyonik ve metalik kristallerde çekirdekler arası mesafeleri bulmayı mümkün kılan elektronografi veya X-ışını kırınımı yöntemleri. Değerlerine göre, buna göre hesaplarlar kovalent, iyonik ve metalik atom yarıçapı.
Bir atomun etkin yarıçapının değeri birçok faktöre bağlıdır: maddenin yapısı, kimyasal bağın doğası, elementin oksidasyon derecesi vb. veriler ve dolayısıyla farklı yazarlar büyük ölçüde değişebilir.
Kimyasal elementlerin atom yarıçaplarının değerlerindeki değişim modeli periyodik bir karaktere sahiptir.
dönemlerde Atom çekirdeğinin yükü arttıkça (atom numarasında bir artış) atomların yarıçapı azalır. Örneğin, 3. periyodun sekiz elementi (sadece s- ve R-elementler), yarıçap 190 pm'den (sodyum için) 99 pm'ye (klor için), yani neredeyse 2 kat ve on için azalır. d- 4. periyodun elemanları, yarıçap 164 pm'den (skandiyum için) 153 pm'ye (çinko için), yani sadece% 7 oranında azalır.
Gruplarda çekirdeklerin yükü arttıkça atomların yarıçapı artar artışlar, A grubundayken ( s- ve p-elementler), böyle bir artış B gruplarına göre daha büyük ölçüde gerçekleşir ( d- ve f-elementler).
d-Aynı grupta yer alan 5. ve 6. periyotların elementleri hemen hemen aynı atom yarıçaplarına sahiptir. Örneğin, zirkonyum ve hafniyumun atom yarıçapları sırasıyla 160 pm ve 150 pm iken, molibden ve tungsteninkiler sırasıyla 139 pm ve 141 pm'dir. Yarıçapların bu kadar yakın olmasının nedeni, 6. periyotta 14 f- atomlarında üçüncü dış kısmı dolu olan elementler 4 f-dış elektronları çekirdekten güçlü bir şekilde "koruyan" enerji alt seviyesi. Sonuç olarak, atom çekirdeğinin yükündeki bir artışın atom yarıçaplarının büyüklüğü üzerinde çok az etkisi vardır. Bu etkiye denir lantanit sıkıştırma.
İyonlaşma enerjisi (E ve o. ) – izole bir atomdan 1 elektron koparmak için gereken minimum enerji ANCAK , yer enerjisi durumunda olan:
A 0 → A + + e – – E ve o.
İlkini ayırt et ( E 1 saniye ( E 2) ve birinci, ikinci ve sonraki elektronların ayrılmasına karşılık gelen sonraki iyonizasyon enerjileri. İyonlaşma enerjisinin birimi kJ/mol'dür.
iyonlaşma potansiyeli (ben ) –bir elektronun izole edilmiş bir atomdan ayrıldığı elektrik alanının en küçük voltajı (potansiyel farkı).
İlkini ayırt et ( ben 1 saniye ( ben 2) ve birinci, ikinci ve sonraki elektronların ayrılmasına karşılık gelen sonraki iyonizasyon potansiyelleri. İyonlaşma potansiyelinin birimi elektron volttur, ev. Bir eV, 96.486 kJ/mol'e karşılık gelir.
Bir atomun iyonlaşma enerjisinin değeri (ve iyonlaşma potansiyeli) birçok faktöre bağlıdır: çekirdeğin yükü, atomun yarıçapı, atomun elektron kabuğunun konfigürasyonu.
Elektron ilgisi (E bkz. ) – bir elektronun izole edilmiş nötr bir A 0 atomuna bağlanmasının bir sonucu olarak salınan veya soğurulan enerji:
0 + e – → A – ± E bkz.
Bir atoma bir elektron eklenmesi eşlik eder. enerji salınımı(+e bkz.), eğer bu sonuçlanırsa atomik parçacık kararlı bir elektron kabuğu ile. Bu, örneğin halojen atomları için tipiktir. Bir elektronun bir atoma bağlanmasının bir sonucu olarak, kararsız bir elektron kabuğuna sahip bir atomik parçacık oluşursa, böyle bir atomun elektron ilgisi negatiftir, yani. enerji emilir(– e bkz.). Bu, örneğin metal atomlarında doğaldır.
Elektronegatiflik (χ) – bir atomun yeteneğini karakterize eden koşullu değer kimyasal bileşik cezbetmek değerlik elektronları(ortak elektron çiftleri).
En basit durumda bir atomun elektronegatiflik değeri, iyonlaşma potansiyeline ve elektron ilgisine göre belirlenir.
Elementlerin χ değerlerinin biraz farklı olabileceği çeşitli ölçekler vardır (Pauling'e göre elektronegatiflik, Mulliken'e göre, Allred-Rochov'a göre, vb.). Çoğu ölçekte, flor en elektronegatif elementtir ve fransiyum en az elektronegatif elementtir.
Artan atom numarası ile Bir periyotta elektronegatiflik artarken, bir grupta kural olarak azalır.Örneğin, oksijenin elektronegatifliği karbondan daha yüksektir, çünkü aynı periyotta bulunurlar, ancak oksijen karbonun sağında bulunur. Baryumun elektronegatifliği, değerleri bir grupta yukarıdan aşağıya doğru azaldığı için magnezyumdan daha düşüktür.
İki atom aynı χ değerlerine sahipse, aralarında kovalent, polar olmayan bir kimyasal bağ oluşur. Atomların elektronegatifliği çok farklı değilse (elektronegatiflik Δχ değerlerindeki fark 1.5'i geçmiyorsa), atomlar arasında kovalent bir polar bağ ortaya çıkar. Onu oluşturan ortak elektron çiftleri her zaman daha yüksek χ olan bir atoma kayar ve bunun sonucunda kısmi bir negatif yük (δ–) kazanır. Buna göre, ikinci atom kısmi bir pozitif yük (δ+) kazanır.
Hidrojen atomu için Schrödinger denklemini çözmenin sonucu, bir atomdaki elektronun davranışını karakterize eden üç kuantum sayısıdır. Bunlar aynı Kuantum sayıları periyodik elementler sisteminin herhangi bir atomunun elektronlarının durumunu benzersiz bir şekilde karakterize eder.
Ana kuantum sayısı n elektronun enerjisini ve elektron bulutlarının boyutunu belirler. Bir elektronun enerjisi esas olarak elektronun çekirdeğe olan mesafesine bağlıdır: elektron çekirdeğe ne kadar yakınsa enerjisi o kadar düşük olur. Bu nedenle, ana kuantum sayısının elektronun şu veya bu üzerindeki konumunu belirlediğini söyleyebiliriz. enerji seviyesi(kuantum tabakası). Ana kuantum sayısı, 1'den 1'e kadar bir dizi tamsayı değerlerine sahiptir. Ana kuantum sayısının değeri bire eşit olduğunda, elektron, çekirdeğe mümkün olan minimum mesafede bulunan ilk enerji seviyesindedir. toplam enerji Böyle bir elektronun en küçüğüdür.
Çekirdekten en uzak enerji seviyesindeki elektron, maksimum enerji. Bu nedenle, bir elektronun daha uzak bir enerji seviyesinden daha yakın bir enerji seviyesine geçişi sırasında, enerji kısımları (kuanta) serbest bırakılır. Enerji seviyeleri şemaya göre büyük harflerle belirtilmiştir:
Yörünge kuantum sayısı Kuantum mekanik hesaplamalarına göre, elektron bulutları sadece boyut olarak değil, şekil olarak da farklılık gösterir. Elektron bulutunun şekli, yörünge veya azimut kuantum sayısı ile karakterize edilir. Elektron bulutlarının farklı biçimi, bir enerji seviyesindeki elektronların enerjisinde bir değişikliğe, yani enerji alt seviyelerine bölünmesine neden olur. Elektron bulutunun her biçimi, yörünge kuantum sayısı tarafından belirlenen elektronun mekanik momentumunun belirli bir değerine karşılık gelir:
![]()
Yörünge kuantum sayısı l. 0'dan tüm değerlere kadar değerler alabilir. Enerji alt seviyeleri harflerle gösterilir:
Asal kuantum sayısının değeri bire eşitken, yörünge kuantum sayısının sıfıra eşit tek bir değeri vardır. Bu değer, küresel simetriye sahip elektron bulutlarını karakterize eder (bkz. Şekil 1.3). Yörünge kuantum sayısı sıfır olan elektronlara -elektron denir.
Sadece elektronlar birinci enerji seviyesinde olabilir, koşullu gösterimi Ana kuantum sayısının değeri ikiye eşit olduğunda, yörünge kuantum sayısının iki anlamı vardır: Yörünge sayısı,
bire eşit, bir elektron bulutunun dambıl şeklindeki formuna (sekiz hacmin şekli) karşılık gelir (Şekil 1.4. Yörünge kuantum sayısı bire eşit olan elektronlara - elektronlar denir.
İkinci enerji seviyesi, iki alt seviye oluşturan S- ve - elektronları içerebilir: Ana kuantum sayısının değeri üç olduğunda, yörünge kuantum sayısının üç değeri vardır: İkiye eşit bir yörünge kuantum sayısı, daha fazlasına karşılık gelir. karmaşık şekil elektron bulutları (Şekil 1.5). Yörünge kuantum sayısı iki olan elektronlara d-elektron denir.
Üçüncü enerji seviyesi, üç alt seviye oluşturan elektronlar içerebilir: Ana kuantum sayısının değeri dört olduğunda, yörünge kuantum sayısının dört değeri vardır: Üçe eşit bir yörünge sayısı, daha da karmaşık bir bulut şekline karşılık gelir. elektronlar,
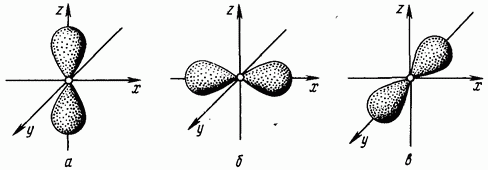
Pirinç. 1.4. Elektronik -bulutlar -yörünge; -orbital; - -yörüngede

Pirinç. 1.5. Elektron d-bulutları - yörünge; -orbital; c - yörünge; - -yörünge; - -yörünge
yörünge kuantum sayısı üç olan elektronlara -elektron denir.
Dördüncü enerji seviyesi, dört alt seviye oluşturan elektronları içerebilir;
Manyetik kuantum sayısı Schrödinger denkleminin çözümünden, elektron bulutlarının uzayda yönlendirildiği sonucu çıkar. Elektron bulutlarının uzaysal yönelimi, bir manyetik kuantum sayısı ile karakterize edilir.
Harici bir manyetik veya elektrik alanı, elektron bulutlarının uzaysal yönünü değiştirir, bu nedenle bir manyetik veya elektrik alanına maruz kaldığında, elektronların enerji alt seviyeleri bölünür. manyetik ve elektrik alanları atomik spektral çizgilerin ayrılması gözlenir.
Manyetik kuantum sayısı, 0 dahil olmak üzere herhangi bir tamsayı sayısal değeri alır. Böylece, manyetik kuantum sayısının olası değerlerinin sayısı, yörünge kuantum sayısının değeri sıfır ise, manyetik kuantum sayısının yalnızca bir tane vardır. sıfıra eşit değer (bkz. Şekil 1.3). Bire eşit bir yörünge kuantum sayısı ile, manyetik kuantum sayısı üç değere sahiptir: Manyetik sayının üç değeri, -elektronların üç durumunu karakterize eder; bu, koordinat boyunca karşılıklı olarak üç dik düzlemde uzaydaki bulutların oryantasyonuna karşılık gelir. eksenler (bkz. Şekil 1.4).
İkiye eşit bir yörünge kuantum sayısıyla, manyetik kuantum sayısının beş değeri vardır: . Manyetik kuantum sayısının beş değeri, d-elektron bulutlarının beş uzamsal konumuna karşılık gelir (Şekil 1.5). Üçe eşit yörünge kuantum sayısı, manyetik sayının yedi değerine ve bulutların yedi uzamsal konumuna karşılık gelir.
Atomik orbitaller (AO). Kuantum sayıları kavramlarına dayanarak, bir atomdaki elektron yörüngesinin tanımını iyileştirmek mümkündür. Bir atomdaki bir elektronun belirli kuantum sayıları değerleriyle karakterize edilen konumları kümesine atomik orbital denir.
2. ATOMLARIN ELEKTRONİK YAPISI. KİMYASAL BAĞ
Bir atomdaki bir elektronun herhangi bir kararlı durumu, sırasıyla n, l, ml, ms olarak adlandırılan belirli kuantum sayıları değerleri ile karakterize edilir: ana, yörünge, manyetik ve dönüş.
Bir atomdaki elektronun, n, ℓ, ml kuantum sayılarının belirli değerlerine karşılık gelen durumuna atomik orbital (a.o.) denir. Aksi takdirde, atom yörüngesi elektronun kalma olasılığının en yüksek olduğu alandır.
Yörünge kuantum sayısının değerine bağlı olarak, aşağıdaki enerji alt seviyelerinin tanımı kabul edilir:
– s alt düzeyi (n/a) |
||
ℓ= 2 – d -*- ℓ= 3 – f -*-
Her tür atomik yörüngenin kendi elektron bulutu şekli vardır. S küresel bir yörüngedir, p dambıl şeklinde bir yörüngedir, d rozet şeklinde bir yörüngedir ve f daha da karmaşık bir şekle sahip bir yörüngedir.
Her türün yörünge sayısı, onları uzayda yönlendirmenin yollarının sayısıyla belirlenir, yani. manyetik kuantum sayısının değer sayısı - ml. Manyetik kuantum sayısı (2ℓ + 1) değerlerine sahiptir
(Tablo 2.1).
Alt seviyelerde atomik orbitallerin sayısının hesaplanması | Tablo 2.1 |
||||
atama | Değer sayısı | ||||
alt düzey | |||||
2;-1;0; + 1; + 2 | |||||
3;-2;-1;0; + 1;+2;+3 | |||||
Grafiksel olarak, bir atomik yörünge gösterilir veya -. Bir enerji seviyesindeki atomik orbitallerin sayısı (z) za.o ile verilir. = n2 , burada n ana kuantum sayısıdır.
Pauli ilkesine göre, bir atom aynı kuantum sayılarıyla karakterize edilen iki elektrona sahip olamaz. Bundan, her bir atomik orbitalin ikiden fazla elektron tarafından işgal edilemeyeceği ve spin kuantum sayılarının farklı olması gerektiği ve bu da ↓ ile gösterildiği sonucu çıkar.
Böylece enerji seviyesindeki toplam elektron sayısı ze = 2n2 formülü ile belirlenir. Bir alt seviyedeki elektron sayısı 2(2ℓ + 1) formülü ile belirlenir. Elektron sayısının hesaplanması ve seviye yapısı Tablo şeklinde sunulabilir. 2.2.
Her alt seviyenin ve seviyenin yapısını bilerek, elektronik element formülleri oluşturmak mümkündür.
Çok elektronlu bir atomun kararlı (uyarılmamış) durumu, atom enerjisinin minimum olduğu atomik orbitaller üzerinde böyle bir elektron dağılımına karşılık gelir. Bu nedenle, atomik orbitaller, enerjilerindeki art arda artış sırasına göre doldurulur. Atomik orbitallerin elektronlarla doldurulma sırası, bir orbitalin enerjisinin hem ana (n) hem de orbital (ℓ) kuantum sayılarının değerlerine bağımlılığını hesaba katan Klechkovsky kuralları ile belirlenir. Bu kurallara göre, atomik orbitaller, toplamdaki (n + 1) (Klechkovsky'nin ilk kuralı) ardışık artış sırasına göre ve bu toplamın aynı değerleri için, sırasına göre elektronlarla doldurulur. ana sayı n'de art arda artış (Klechkovsky'nin ikinci kuralı).
Elektronların bir enerji alt seviyesindeki atomik orbitallere yerleştirilmesi, bir atomun minimum enerjisinin, toplam dönüşün mutlak değerinin belirli bir alt seviyenin atomik orbitallerindeki böyle bir elektron dağılımına karşılık geldiğine göre Hund kuralı ile belirlenir. atomun maksimumu; başka herhangi bir elektron düzenlemesi ile, atom uyarılmış bir durumda olacaktır, yani. daha yüksek enerjiye sahip olacaktır.
Görevler ve alıştırmalar
2.1. Bir elektronun durumu nasıl belirlenir: a) n=4, ℓ=2 ile; b) n=5, ℓ=3 ile.
Çözüm: Enerji durumunu kaydederken, sayı alt düzeyin (n) numarasını, harf ise alt düzeyin (s, p, d, f) niteliğini belirtir. n=4 ve ℓ=2 için 4d yazarız; n=5 ve ℓ=3 için 5f yazarız.
Tablo 2.2
Elektron sayısının hesaplanması
atama | Ze = 2(2ℓ + 1) | Z = 2n2 | Yapı |
|||||
alt düzey | ||||||||
2 12 | ||||||||
2 22 | s2 p6 |
|||||||
Masanın sonu. 2.2
atama | Ze = 2(2ℓ + 1) | Z = 2n2 | Yapı |
|||||||||
alt düzey | ||||||||||||
2(2 2 + 1) = 10 | ||||||||||||
2 42 = 32 | 2p 6d 10f 14 |
|||||||||||
2.2. Üçüncü enerji seviyesine kaç orbital karşılık gelir? Bu seviyede kaç elektron var? Bu seviye kaç alt seviyeye ayrılır?
Çözüm: Üçüncü enerji düzeyi n = 3 için atomik orbitallerin sayısı 9'dur (32); bu yörünge sayısı 1(s) + 3(p) + 5(d) = 9'un toplamıdır. Pauli ilkesine göre, bu seviyedeki elektron sayısı 18'dir. Üçüncü enerji seviyesi üç alt seviyeye bölünmüştür. : s, p, d (alt seviyelerin sayısı, ana kuantum sayısının değer sayısı ile aynıdır).
Herşey kimyasal elementler 4 tipte doldurulacak alt seviyelerin doğasına bağlı olarak sınıflandırılabilir:
s-elemanları - elektronlarla doldurun ns - alt seviye; p-elemanları - elektronlarla doldurun np - alt seviye; d- elementler - elektronlarla doldurun (n-1) d - alt seviye; f-elemanları - elektronlarla doldurun (n-2) f - alt seviye.
Bir elementin elektronik formülünü yazmak için şunları yapmalısınız: enerji seviyesinin numarasını Arap rakamıyla belirtin, alt seviyenin gerçek değerini yazın, elektron sayısını üs olarak yazın.
Örneğin: 26 FeIV 1s2 2s2 2p6 3s2 3p6 4s2 3d6 .
Elektronik formül, alt seviyelerin rekabeti dikkate alınarak derlenir, yani. minimum enerji kuralları Son elektronik hariç
formül yazılacak: 26 Fe1V 1s2 2s2 2p6 3s2 3p6 3d6 4s2 . Bir elementin maksimum değerliliği, değerlik orbitallerinin sayısı ile belirlenir ve elementin elektronik tipine ve periyot numarasına bağlıdır.
Elementlerin periyotlara göre elektronik yapısı ve maksimum değerlilikleri Tablo'da sunulmuştur. 2.3.
Tablo 2.3 Elemanların elektronik yapısı ve maksimum değerliği
değerlik | ||||||||||||||||
Yapı | ||||||||||||||||
yörüngeler | ||||||||||||||||
1s 1-2 | ||||||||||||||||
1s 22s 1-22p 1-6 | ||||||||||||||||
1s2 2s2 2p6 3s1-2 | 3 boyutlu) | |||||||||||||||
3p 1-6 | ||||||||||||||||
4d) | ||||||||||||||||
1s2 2s2 2p6 3s2 3p6 | ||||||||||||||||
4s 1-23d 1-104p 1-6 | ||||||||||||||||
5d) | ||||||||||||||||
1s2 2s2 2p6 3s2 3p6 | ||||||||||||||||
4s2 3d10 4p6 5s1-2 | ||||||||||||||||
4d 1-105p 1-6 | ||||||||||||||||
6f) | ||||||||||||||||
1s2 2s2 2p6 3s2 3p6 | 6d) | |||||||||||||||
4s2 3d10 4p6 5s2 | ||||||||||||||||
4d 105p 66s 1-10 | ||||||||||||||||
5d 14f 1-145d 2-10 | ||||||||||||||||
6p 1-6 | ||||||||||||||||
2.3. Alt seviyeyi doldurduktan sonra atomda hangi alt seviye elektronlarla doldurulur: a) 4p; b) 4s?
R Çözüm: a) Alt düzey 4p, 4+1 = 5'e eşit (n + l) toplamına karşılık gelir. Aynı toplam n+l, 3d alt düzeylerini (3+2 = 5) karakterize eder.
ve 5s (5+0 = 5). Bununla birlikte, 3d durumu, 4p durumundan daha küçük bir n (n = 3) değerine karşılık gelir, bu nedenle 3d alt seviyesi, 4p alt seviyesinden daha erken dolar. Bu nedenle, 4p alt düzeyi doldurulduktan sonra, n'nin (n=5) bir büyük değerine karşılık gelen alt düzey 5s doldurulacaktır.
b) 4s alt düzeyi n+l = 4+0 = 4 toplamına karşılık gelir ikincisi, ana kuantum sayısının daha büyük bir değerine karşılık gelir. Bu nedenle, alt düzey 4s'den sonra, toplam (n+l) = 5 olan alt düzey, ayrıca bu toplama karşılık gelen tüm olası n+ℓ kombinasyonlarından (n=3, ℓ=2; n=4, ℓ) doldurulacaktır. =1; n= 5, ℓ=0), ilk önce ana kuantum sayısının en düşük değerine sahip kombinasyon uygulanacaktır, yani. 4s alt seviyesini 3d alt seviyesi takip edecektir.
Sonuç: Böylece, alt seviye d'nin doldurulması birer birer geride kalıyor kuantum seviyesi, alt seviye f'nin doldurulması iki kuantum seviyesi ile geride kalıyor.
2.4. Bir atomun elektronik yapısı formül 1s ile tanımlanır. 2 2s2 2p6 3s2 3d7 4s2 . Bu element nedir?
R Çözüm: Bu eleman elektronik tipe aittir.
d-elemanları 1U dönemi, çünkü 3 boyutlu alt seviye elektronlar tarafından oluşturulur; elektron sayısı 3d7, bunun yedinci element olduğunu gösterir. Toplam elektron sayısı 27'dir, yani seri numarası 27'dir. Bu element kobalttır.
2.5. Fosfor ve vanadyum neden periyodik tabloda aynı grupta yer alır? Neden farklı alt gruplara yerleştirildiler?
R Çözüm: P 1s atomlarının elektronik konfigürasyonları 2 2s2 2p3 3s 2 3p 3 ; V 1s2 2s2 2p6 3s2 3p6 4s 2 3d 3 . Değerlik elektronlarının altı çizilir.
Bu elementler aynı sayıda değerlik elektronuna sahiptir - 5. Bu nedenle, P ve V aynı 5. grupta bulunur. Aynı zamanda, bu elemanlar elektronik muadilleri değildir, çünkü. farklı alt düzeyler oluşturun, bu nedenle aynı alt gruba yerleştirilmemeleri gerekir.
Kimyasal bağ elektronların kuantum mekaniksel etkileşiminin sonucudur.
Elektron yoğunluğunun atomlar arasındaki dağılımının doğasına göre, kimyasal bağlar kovalent polar olmayan, polar ve iyonik olanlara ayrılır (burada metallerde gerçekleşen metalik bağ dikkate alınmaz). Bir çift elektronun yer değiştirmesi yoksa, bağ kovalent bir polar olmayan bağa yaklaşır. Bir kovalent polar bağ, ortak atomlardan birinin çekirdeğine yer değiştiren (polarize) ortak bir elektron çifti tarafından gerçekleştirilir. İyonik bağ aşırı polarize olarak kabul edilir. kovalent bağ. Belirli bir elementin atomunun ortak bir elektron çiftini kendine çekme yeteneğini değerlendirmek için bağıl elektronegatiflik (χ) değeri kullanılır (Tablo 5). Elektronegatiflikteki (Δχ) fark ne kadar büyük olursa, bağın polarizasyonu o kadar büyük olur (bağın iyonikliği o kadar yüksek olur). Δχ > 1.9 ise bağın iyonik olduğuna inanılır.
2.6. E(OH)2 bileşiklerinde H-O ve E-O bağları için atomların bağıl elektronegatifliklerindeki farkı hesaplayın, burada E, Ca, Sr, Ba elementleridir ve şunları belirleyin:
a) ne N-O bağı veya E-O, her molekülde daha yüksek bir iyoniklik derecesi ile karakterize edilir; b) Sulu bir çözeltide bu moleküllerin iyonlaşmasının doğası nedir?
Karar: a) E-O ve H-O arasındaki ilişki için Δχ'yi hesaplayın:
Δχ Ca-O = 3.5 - 1.04 = 2.46 ΔχSr-O = 3.5 - 0.99 = 2.51 Δχ Ba-O = 3.5 - 0.90 = 2.60 Δχ H-O = 3.5 - 2.1 = 1.4
Δχ karşılaştırmasından görüyoruz ki E-O iletişim iyonik olarak kabul edilebilir, H-O bağı polardır.
b) sulu çözeltilerde iyonizasyon, en iyonik bağ, yani. şemaya göre: E (OH) 2 ↔ E2 + + 2OH- (tipe göre
gerekçesiyle).
Kimyasal bir bağın gücü, enerji (kJ/mol) ve
bağın uzunluğu (nm veya A). Bağ enerjisi ne kadar yüksek ve uzunluğu ne kadar kısaysa, bağ o kadar güçlüdür.
Kimyasal bağ, yani ortak bir elektron çifti iki şekilde oluşturulabilir: değişim ve verici-alıcı mekanizma ile. Bir kimyasal bağ, üç ana özellik ile karakterize edilir:
1) uzayda belirli bir yönü vardır. Bu açıdan, σ veπ bağları. İki σ-bağının yönlerinin oluşturduğu açıya değerlik açısı denir. Bir π bağı birkaç atomu birleştirirse, buna lokalize olmayan denir;
2) parçacıkların belirli bir bileşime ve yapıya sahip olmasının bir sonucu olarak doygunluk eğilimindedir. mümkün: koordinasyon

atomların doymamış, koordineli olarak doymuş, değerlik-doygun ve değerlik-doymamış halleri;
3) çeşitli faktörlerin etkisi altında polarize edilebilir (atomların elektronegatifliğine bağlı olarak ve ayrıca diğer polar moleküllerin etkisi altında harici bir elektrik veya manyetik alanın etkisi altında).
Moleküllerin geometrik yapısını açıklamak için merkezi atomun atomik orbitallerinin hibridizasyonu kavramı kullanılır. Bu kavrama göre, σ-bağlarının oluşumu, atomik orbitallerin şekil ve enerjisindeki bir değişiklikten önce gelir. Daha derin örtüşme ve dolayısıyla daha güçlü bağlar yapabilen hibrit orbitaller oluşur. s ve p elektronik tipindeki elemanlar için, paylaşılmamış elektron çiftleri dahil orbitaller hibridizasyonda yer alabilir.
2.7. Bir BF3 molekülünde ve bir BF4 - iyonunda bağ oluşumunu gösterin. Bu parçacıkların yapısını açıklayınız.
Çözüm: 1. Atomların elektronik formüllerini oluşturun ve io-
yeni: B 1s2 2s2 2p1 ; F 1s2 2s2 2p5 ; F- 1s2 2s2 2p6 .
2. Değerlik orbitallerine göre elektron dağılımını gösterelim. Bu durumda, bileşikteki bor atomunun oksidasyon derecesini hesaba katarız (atomdaki eşleşmemiş elektronların sayısının oksidasyon derecesine karşılık geldiğini koşullu olarak varsayabiliriz).
3. Tüm olası bağların oluşumunu göstereceğiz, oluşum mekanizmalarını göstereceğiz:
3 σ-bağları, atomun değerlik olasılıklarına dayalı olarak değiş tokuş mekanizmasıyla oluşturulmuştur.
bor ve doyma eğilimi, verici-alıcı mekanizma ile bir π-bağının oluşumunu göstereceğiz. Ama çünkü bu bağ ikiden fazla atomu birleştirir
mov, yerelleştirilmeyecek.
BF4 - iyonunda, üçü değişim ve biri verici-alıcı mekanizma ile olmak üzere 4 σ-bağ oluşur.

4. Bağlantının çokluğunu oran olarak hesaplayın toplam sayısı bağlantılarıσ-bağları. BF3 molekülünde bağ çokluğu 1⅓'dir; BF4 iyonunda bağ çokluğu 1'dir.
5. Merkez atomun durumunu doygunluk cinsinden tanımlayalım.
köprüler. BF3 molekülünde, σ ve π bağları nedeniyle maksimum değerlik kendini gösterir, bu nedenle bor atomunun durumu değerlik doymuştur.
BF 4 - iyonunda, σ-bağları nedeniyle maksimum değerlik kendini gösterir, bu nedenle bor atomunun durumu koordineli olarak doymuştur.
6. Bağlantının doğasını tanımlayalım Polarite açısından B-F. Çünkü elektronegatiflik değerindeki fark (Δχ) 4.0-2.0 = 2.0, yani. 1.9'dan fazla ise bağ iyonik olarak kabul edilebilir.
7. Merkez atomun atomik orbitallerinin hibridizasyon türünü ve parçacıkların geometrik şeklini belirleyelim.
BF 3 molekülünde, s ve 2p orbitalleri, σ-bağlarının oluşumunda rol oynar, dolayısıyla sp2 hibridizasyonunun tipidir. Molekül üçgendir
yapı. BF4 - iyonunda, bir s ve üç p orbitali, σ-bağlarının oluşumunda yer alır, dolayısıyla sp3 hibridizasyon tipi. İyon tetrahedral bir şekle sahiptir.
8. Parçacıkların yapısını grafiksel olarak gösterelim
2.8. SO3 molekülünde bağ oluşumunu gösterir, molekülün yapısını açıklar.
Çözüm: Elemanların Elektronik Formülleri
S 1s2 2s2 2p6 3s2 3p4 O 1s2 2s2 2p4 .
Çünkü kükürt atomunun oksidasyon durumu +6 ise, uyarılmış kükürt atomunun değerlik orbitalleri üzerindeki elektron dağılımını göstereceğiz.
Kükürt atomu, değişim mekanizmasıyla 3 σ-bağ (bir s ve iki p-atomik orbitalden dolayı) ve 3 π-bağ (bir p- ve iki d-atomik orbitalden dolayı) oluşturur.
Sonuç olarak, atom değerlik bakımından doymuş, koordineli olarak doymamış; bağ çokluğu 6/3 = 2. S-O bağlantısı polar, ortak elektron çiftleri oksijene kaydırılır (Δχ = 0,5). Sp2 hibridizasyon tipi. Molekül bir üçgen yapısına sahiptir.

3. KOMPLEKS BİLEŞİKLER
Kompleks bileşikler, canlı organizmaların yaşamında önemli bir rol oynar. Vücutta önemli fizyolojik işlevleri yerine getiren Na, K, Ca, Mg iyonları kan, lenf ve doku sıvılarında kompleks bileşikler halinde bulunur. Fe, Zn, Mn, Cu iyonları proteinlerle kompleks bileşikler oluşturur ve enzimlerin ve vitaminlerin bir parçasıdır. Demir, hemoglobinin bir parçasıdır. Hemoglobin, globin proteini ile hem kompleksi arasındaki bağlantıdır. Hem'de merkezi iyon Fe2+'dır.
Kompleks bileşiklere, bileşenlerin kombinasyonu hem kristalde hem de çözeltide serbest var olabilen kompleks iyonların oluşumuna yol açan moleküler bileşikler denir. Karmaşık bileşiklerin moleküllerinde iç ve dış küreler ayırt edilir. İç küre köşeli parantez içine alınır ve kompleks yapıcı olarak adlandırılan bir merkezi atom veya iyondan ve onun etrafında koordine edilen ve ligand adı verilen atomlar, iyonlar veya moleküllerden oluşur.
Kompleks oluşturucu ajan etrafında koordine edilen ligandların sayısı, koordinasyon sayısını (c.h.) belirler. İkincisi, f.p. arasında ortaya çıkan σ-bağlarının sayısını gösterir. ve ligandlar.
k.ch arasındaki bağlantı | k.o. ve oksidasyon durumu |
||
Paslanma durumu | |||
Molekül c.s. elektriksel olarak nötr. İç küre yükü yüke eşit zıt işaretli harici. Bir kompleks iyonun yükü, k.o yüklerinin cebirsel toplamına eşittir. ve ligandlar.
Karmaşık bileşiklerin sınıflandırılması
1. Karmaşık iyonun yükünün doğası gereği
- katyonik: pozitif yüklü bir c.o. etrafındaki koordinasyon nedeniyle oluşur. nötr ligand molekülleri
Cl2; Cl3;
- anyonik: kompleks yapıcı ajan - pozitif iyonlar, ikisinden biri-
çeteler K2 anyonlarıdır; Na2;
- tarafsız: nötr bir f.r. etrafında koordinasyon üzerine oluşturulur. nötr ligandlar o veya pozitif yüklü bir c.o etrafında eş zamanlı koordinasyon ile.
negatif yüklü ve nötr ligandlar
2. Ligandların doğası gereği
Hidratlar veya su kompleksleri Cl3 ;
Amonyak S04 ;
- asit kompleksleri K 2 ;
- Na hidroksokompleksleri.
3. k.o sayısına göre
Mononükleer Cl2 ;
Polinükleer [(NH 3 )4 Co\ / OH OH / \ Co(NH3 )4 ]Cl4 .
Karmaşık bileşikleri adlandırma kuralları
1) c.s.'nin adı bir katyon ile başlayın;
2) bir kompleks iyon adına, önce ligandlar, sonra merkezi atom belirtilir. Anyonik ligandların adlarına "o" sonu eklenir, moleküler ligandlar olarak adlandırılır.
karşılık gelen serbest moleküller. İstisna: NH3 - amin; H2O - su; CO - karbonil;
3) katyonik ve nötr c.s.'de kompleks yapıcı ajan elementin Rusça adını anyonik olarak adlandırdı - "at" bitişinin eklenmesiyle Latince adı;
4) oksidasyon durumu k.o. Arap rakamı ile gösterilir ve yazılır
adından sonra parantez. K3 – potasyum heksanitritokobaltat (+3); Cl3 - heksaaquakrom (+3) klorür; o demir pentakarbonildir (0).
Çözeltideki karmaşık bileşiklerin davranışı
c.s. çözümlerinde güçlü bir elektrolit gibi davranır ve tamamen karmaşık bir iyon ve dış küre iyonlarına ayrışır:
Cl → + + Cl-
Kompleks iyonlar tersinir ve kademeli olarak iyonlaşır: + ↔ + + NH3
+ ↔ Ag+ + NH3 veya toplam: + ↔ Ag+ + 2NH3
Bir kompleks iyonun iyonlaşma denge sabitine kararsızlık sabiti denir.
Yuva yapmak = | |
Sadece bileşiğin doğasına ve sıcaklığa bağlıdır; referans kitaplarında verilmiştir (bkz. Tablo 6).
4. KİMYASAL DENGE
Kimyasal denge, ileri ve geri reaksiyon hızlarının eşitliğine karşılık gelen bir durumdur:
Bu durumda Gibbs enerjisindeki değişim sıfırdır.
git=O; ΔΗο = T Yani
Kimyasal denge durumu sabit bir değerde değişmeden kalır. dış koşullar. Bu koşullar (sıcaklık, basınç, konsantrasyonlar) değiştiğinde, yeni koşullar altında, yeniden eski haline dönebilmek için denge bozulur.
Denge kayması, Le Chatelier ilkesine uyar: Bir denge sisteminde denge konumunu belirleyen koşullardan biri değiştirilirse, denge, etkinin etkisini zayıflatan süreç yönünde kayar. Böylece, reaktiflerin konsantrasyonundaki bir artışla denge, bu reaktiflerin tüketimine neden olacak sürece doğru kayar. Denge sisteminin bu davranışının nedeni, belirtilen reaktiflerin parçacıklarının çarpışma sayısındaki artıştır, bu da ileri veya geri reaksiyonun hızlanmasına neden olur.
Gaz sistemlerinde, basınçta bir artış veya sistemin hacminde bir azalma ile reaktif konsantrasyonlarında bir artış meydana gelir. Bu nedenle, sistemdeki toplam basınçtaki bir artışla, daha fazla sayıda mol gazın katılımıyla meydana gelen iki tersinir reaksiyondan biri, yani. denge, daha az sayıda mol oluşumuna doğru kayar.
Sıcaklıktaki bir artışla, hem ileri hem de geri reaksiyonların hızı artar, ancak endotermik hız daha büyük ölçüde artar.
tepkiler, çünkü daha yüksek bir sıcaklık katsayısına sahiptir.
Görevler ve alıştırmalar
4.1. Denge sisteminde azalan H2 konsantrasyonu ile denge kaymasının yönünü gösterin:
CO + H2 O↔ CO2 + H2 Çözümü: CH 2'de bir azalma ile, Le- ilkesine göre
Chatelier, doğrudan tepki geçerli olmalı, çünkü bu durumda H2 miktarı artacak ve denge yeniden sağlanacaktır.
4.2. PC15 ↔ PC13 + C12 - 31 kJ mol-1 dengesi artan sıcaklık ve basınçla hangi yöne kayar?
Çözüm: Sıcaklık arttıkça denge sağa kayar çünkü doğrudan reaksiyon, ısının emilmesiyle devam eder, yani. dır-dir
endotermik. Basınç arttıkça, PC13 ve C12 moleküllerinin çarpışma sayısı PC15'ten daha büyük olacak ve bu nedenle denge sola kayacaktır.
4.3. Bir denge sisteminde hangi koşullar altında
N2 g + 3H2 g ↔ 2NH3 g + 22 kJ mol-1 NH3 verimini maksimize etmek mümkün müdür?
Çözüm: NH3 çıkışını artırmak için, ör. dengeyi sağa kaydırmak için gereklidir:
1) gaz karışımının basıncını arttırın, çünkü bu durumda, doğrudan reaksiyonun hızı artar, çünkü daha fazla benler;
2) N konsantrasyonunu artırmak 2 ve H2 ve NH3 konsantrasyonunu azaltarak reaksiyon küresinden çıkarın;
3) reaksiyon karışımının sıcaklığını düşürün, çünkü hakkında tepki-
NH3 oluşumu ekzotermiktir.
Kimyasal denge durumunun nicel özelliği, kütle hareket yasasını yansıtan denge sabitidir.
Denge sabiti, RTlnK bağıntısıyla Gibbs enerjisiyle ilişkilidir.
= -∆G hakkında . Proses için aA + bB ↔ cC + dD konsantrasyon sabiti
denge şu şekildedir: Кс = [C] c [D] d , burada [A], [B], [C], [D] – denge [A]a [B]b
mol/l cinsinden nye konsantrasyonları; a, b, c, d stokiyometrik katsayılar.
Gaz sistemleri için K sabitini yazın | |||||||
gazların ve karışımların kısmi basınçları.
Kc ve Kp sabitleri, elektrolitlerin ve elektrolit olmayanların seyreltik çözeltilerinde ve 101,3 kPa'ya (ideal gazlar) yakın basınçlarda gaz sistemlerinde denge süreçlerini karakterize eder.
Konsantre çözeltiler ve ideal olmayan gazlar için aktivite değerleri kullanılmalıdır:
Ka = a C ca D da A a bir B b
Denge sabiti, reaktiflerin doğasına ve sıcaklığa bağlıdır, ancak denge sisteminin bileşenlerinin konsantrasyonlarına bağlı değildir.
Heterojen sistemlerde, katı fazın konsantrasyonu denge sabitinin değerine dahil edilir, çünkü sabit bir değerdir.
Reaksiyonlar, suyun katılımıyla sulu çözeltilerde devam ederse, su konsantrasyonu büyük ve sabittir ve pratik olarak denge durumunu etkilemeyecektir.
İşlemlerin denge sabitlerini yazıyoruz: 4HC1g + O2 g ↔ 2H2 Og + 2C12 g
PH 2 | P С2 1 |
||||||||||||||
4 2 2 | |||||||||||||||
CuSO4 p-p + Fekp ↔ Cukp + FeSO4 p-p |
|||||||||||||||
Problemleri çözerken, açıkça tanımlamak gerekir. toplama durumu reaksiyona giren maddeler ve ayrıca maddelerin ilk konsantrasyonlarını dengeden ayırt etmek.
C dengesi \u003d C ilk - C harcandı
4.4. 1 mol H2 ve 1 mol I2, 410°C'de 1 l kapasiteli bir kapta karıştırıldı. Denge sabiti 48 ise, kimyasal dengenin hangi konsantrasyonlarda kurulduğunu hesaplayın?
Çözüm: H 2 + I 2 ↔ 2HI
Reaksiyonda X mol H2 ve I2 tüketildiğini varsayalım. Daha sonra 2X mol HI oluştu, yani. HI = 2 mol/l. Bu durumda ==
1 - X. Yazalım: Кс = | (2x)2 | ||||
(1−x)2 |
|||||
Denklemi elde ederiz: 44X2 - 96X + 48 = 0 Bunu çözerek X = 0.776 elde ederiz. Denge konsantrasyonlarını hesaplayın: HI = 2X = 2 0.776 = 1.552 mol/l
1 - X \u003d 0.222 mol / l.
4.5. CO + C12 ↔ COC12 tersinir reaksiyonda, aşağıdaki denge konsantrasyonları (mol/l) oluşturulmuştur: = 0.1; = 0.4; = 4. Crav'i hesaplayın. ve C12 ve CO'nun başlangıç konsantrasyonları.
Çözüm: K = | |||||

İlk konsantrasyonları buluyoruz: Cish. = Komp. + Sizexp. . 4 mol COC12 oluşumu için reaksiyon denklemine göre 4
mol CO ve C12. Dolayısıyla başlangıç konsantrasyonları: CCO = 0.1 + 4 = = 4.1 mol/l; CC1 2 \u003d 0,4 + 4 \u003d 4,4 mol / l.
4.6. 1300 ° C'de ise Cgrafit + O2 g ↔ CO2 g reaksiyonu için denge anında karışımın hacimsel bileşimini belirleyin. = 0.289.
Çözüm: K p \u003d P R CO 2
X, hacim fraksiyonları (yüzde) cinsinden CO2 içeriğini göstersin. O zaman O2 içeriği (100-X) olacaktır. Denklemde yerine koyun:
K \u003d 0.289 \u003d (100 X - X); X = %22.42 hacim. O2 içeriği
5. KİMYASAL KİNETİK
Kimyasal kinetik, kimyasal reaksiyonların hızını ve mekanizmasını ve ayrıca çeşitli faktörlerin hız üzerindeki etkisini inceler. ortalama sürat Kimyasal reaksiyon birim zaman başına reaktan konsantrasyonundaki değişiklikle ölçülür:
V = ±C 2 − C 1 ,
τ2−τ1
burada C2 ve C1, τ2 ve τ1 (s veya dak olarak) zamanına karşılık gelen madde konsantrasyonlarıdır (mol/l). Heterojen sistemler için hız ölçülür
katı fazın birim yüzeyi başına konsantrasyon değişikliği (1 cm2 veya 1 m2).
Bir kimyasal reaksiyonun hızı aşağıdaki ana faktörlere bağlıdır:
- reaksiyona giren maddelerin doğası ve durumu;
- reaksiyonun gerçekleştiği ortamın doğası;
katalizör;
- reaksiyona giren maddelerin konsantrasyonu ve gazlar ve basınç için;
Sıcaklıklar.
Maddelerin kimyasal aktivitesi, atomların veya moleküllerin yapısına, molekül içi ve moleküller arası bağların doğasına bağlıdır. Radikaller en yüksek aktiviteye sahiptir, iyonlar ve moleküller için biraz daha düşüktür. Reaktiflerin kümelenme durumu ve dağılma derecesi de küçük bir öneme sahip değildir.
Hemen hemen her zaman, maddeler ortam (çözücü) ile reaksiyona girerek solvatlar (hidratlar) oluşturur. Ek olarak, çözücünün katalitik bir etkisi olabilir.
Katalizörler genellikle yollarını değiştirerek kimyasal reaksiyonları hızlandırır. Bu durumda, yeni bir reaksiyon yolu, daha düşük bir aktivasyon enerjisine karşılık gelir. Aktivasyon enerjisi (Ea), etkileşimi gerçekleştirmek için reaksiyona giren maddelerin parçacıklarının sahip olması gereken minimum enerjidir. Ea'nın değeri, maddelerin kimyasal doğasına göre belirlenir.
Konsantrasyon, basınç ve sıcaklığın kimyasal reaksiyon hızı üzerindeki etkisi ölçülebilir.
Hareket eden kütleler yasası kimyasal reaksiyon hızının reaktanların konsantrasyonuna bağımlılığını ifade eder: reaksiyon hızı, stokiyometrik katsayılarının gücüne yükseltilmiş reaktanların konsantrasyonları ile doğru orantılıdır. Reaksiyon için
аА + вВ → С V = KCA a CB b ,

burada CA ve CB, reaktif A ve B'nin molar konsantrasyonlarıdır;
a ve b, A ve B için stokiyometrik katsayılardır;
İle - maddelerin doğasının etkisini yansıtan bu reaksiyonun hız sabiti. Sıcaklığa bağlıdır, ancak maddelerin konsantrasyonuna bağlı değildir.
Gaz sistemleri için konsantrasyonlar yerine değeri kullanabilirsiniz.
biz kısmi basınçlar: V = KPA a PB b .
Heterojen sistemlerde kristalli maddelerin konsantrasyonları sabit değerlerdir ve hız sabitine dahil edilir. Artan reaktan konsantrasyonları ile reaksiyon hızındaki artışın nedeni, toplam partikül çarpışma sayısındaki artış ve dolayısıyla aktif çarpışma sayısındaki artış ile açıklanabilir. Aşağıdaki reaksiyonların hızları için ifadeler yazalım:
a) 2H2 g + O2 g \u003d 2H2 Og
V=KC | V=KP | |||||
b) CaOcr + CO2 g \u003d CaCO3 cr | ||||||
V=KCCO2 | V = KPCO 2 | |||||
c) FeCl3 çözeltisi + 3KSCN p-p = Fe(SCN)3 p-p | V = KC FeCl3C3KSCN |
|||||
d) 2AgCO3 cr | V=K |
|||||
→ 2Agcr + 2CO2 g + O2 g |
||||||
Kitlesel eylem yasası sadece şunlar için geçerlidir: basit reaksiyonlar az düzen ve molekülerlik ile.
Tepkime sırası, kütle etkisi yasasının ifadesindeki konsantrasyonlardaki üslerin toplamı olarak anlaşılır. reaksiyon molekülerliği etkileşim eyleminde yer alan minimum molekül sayısı tarafından belirlenir. Molekülerlik temelinde, reaksiyonlar tek moleküler (monomoleküler), iki moleküler (bimoleküler) ve üç moleküler (trimoleküler) olarak ayrılır. Daha yüksek moleküler reaksiyonlar nadirdir, çünkü bu tür reaksiyonlar birkaç aşamada ilerler.
Tek moleküler reaksiyonlar, bozunma reaksiyonlarını ve molekül içi yeniden düzenlemeleri içerir, onlar için V = K·C. İki moleküler reaksiyonlar, iki molekül çarpıştığında etkileşimin meydana geldiği reaksiyonları içerir, onlar için V \u003d K C1 C2; üç moleküler reaksiyonlar için V = K·C1 ·C2 ·C3 . Reaksiyonun sırasına göre birinci, ikinci ve üçüncü mertebeler ile sıfır ve kesirli mertebeler vardır.
üçüncü derece V = K·C3 , V = K·C1 2 ·C2 , V = K·C1 ·C2 2 .
Tüm süreç boyunca maddenin konsantrasyonu değişmezse ve hız sabit bir değerdeyse, reaksiyonlar sıfırdır. Bu, heterojen sistemlerde mümkündür. kristal madde yüzey ile etkileşime girer ve konsantrasyon kalır sabit değer. Sıfır dereceli bir reaksiyon için, V = K·Co . İşlem, her biri ihmal edilebilir bir hıza sahip olan birkaç aşamada gerçekleşirse, reaksiyon kesirli bir sıraya sahiptir.
Görevler ve alıştırmalar
5.1. Reaksiyonun molekülerliğini ve sırasını belirleyin:
С12 g + 2NOg = 2NOClg
Çözüm: 1 mol C12 ve 2 mol NO reaksiyona girer, bu nedenle belirtilen reaksiyon trimolekülerdir. belirleme prosedürü
denklemi kullanırız: V = KCCl 2 C2 NO . Cevap üçüncü derecedendir.
5.2. K = 40'ta demir (II) hidroksitin 0.02 M H2SO4 içinde çözünme hızını hesaplayın. Reaksiyonun molekülerliğini ve sırasını belirleyin.
Çözüm: Reaksiyon şu denkleme göre ilerleyecektir:
Fe(OH)2 cr + H2SO4 p-p = FeSO4 p-p + 2H2 Ozh
V \u003d KCH 2 SO 4, çünkü Fe(OH)2 kristal fazdadır. Reaksiyonun molekülerliği 2'dir, sıra 1'dir. Reaksiyon hızını hesaplayın:
V \u003d 40 0.02 \u003d 0.8 mol / dak l.
5.3. 1 mol SnCl içeren bir çözeltide 2 ve 2 mol FeCl3, reaksiyon denkleme göre ilerler:
SnCl2p + 2FeCl3p ↔ SnCl4p + 2FeCl2p
Reaksiyondan sonra reaksiyon hızı kaç kat azalır?
ruet 0.65 mol SnCl2?
Çözüm: Başlangıçtaki reaksiyon hızını hesaplayın
0.65 mol SnCl2 reaksiyona girdikten sonra, konsantrasyonlar
aşağıdaki değerlere sahiptir: СSnCl2 = 1 - 0.65 = 0.35 mol/l; СFeCl3 = = 2 - 1.3 = 0.7 mol/l. Bu durumda, reaksiyon hızı şuna eşit olacaktır:
V1 = K 0.35 0.72 = 0.17 K.
hız oranı | |||||
5.4. Gaz karışımının hacmi yarıya indirilirse reaksiyon hızı CO2 + C12 g = COC12 g nasıl değişir?
Çözüm: İlk reaksiyon hızı şöyle olacaktır:
Vo = K CCO CC1 2 . Hacmin yarıya bölünmesiyle, tüm konsantrasyonlar
bileşenler ikiye katlanır ve hız aşağıdaki gibi hesaplanabilir: V 1= K 2C CO2C Cl2 = 4KC COC Cl2
Hacimde 2 kat azalma ile reaksiyon hızının 4 kat arttığı oldukça açıktır.
Sıcaklığın kimyasal reaksiyon hızı üzerindeki etkisi de ölçülür. Artan sıcaklıkla, enerjisi aktivasyon enerjisine Ea ulaşan veya onu aşan aktif parçacıkların sayısındaki bir artışla açıklanan herhangi bir reaksiyonun hızı artar. Reaksiyon hızı sabitinin sıcaklığa bağımlılığı şu şekilde ifade edilir:
Arrhenius denklemi: 2.303 lg | |||||||||
Burada K1 ve K2 | mutlak için bu reaksiyonun hız sabitleri |
||||||||
sıcaklıklar T1 ve T2; | |||||||||
adet | aktivasyon enerjisidir; | ||||||||
gaz sabitidir. | |||||||||
Uygulamada, hesaplamalar için van't Hoff kuralı kullanılır; buna göre, sıcaklıkta 10 ° artışla, reaksiyonun hız veya hız sabiti 2-4 kat artar.
Vt 2 | Kt 2 | t2 - t1 | ||||||
= γ10 , |
||||||||
nerede Vt1 ve Vt2 | t1 ve t2 sıcaklıklarındaki reaksiyon hızlarıdır; |
|||||||
Kt1, Kt2 | oran sabitleri; | |||||||
γ sıcaklık katsayısıdır.
Van't Hoff kuralı, Arrhenius denkleminden daha az doğru sonuçlar verir, çünkü γ sadece küçük bir sıcaklık aralığında sabit olarak kabul edilebilir. İnorganik reaksiyonlar için γ = 2-4, enzimatik reaksiyonlar için γ = 7-8.
5.5. 356-376o C sıcaklık aralığında HI'nın bozunma hızının sıcaklık katsayısı 2'dir.
Çözüm: | kuralın matematiksel ifadesini yazalım |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Van't Hoff: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
376 | K376 | 376− 356 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
= y 10 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
5.7. Pestisit 10 gün boyunca 25°C'de suda ayrışır. Kimyasal bozunma reaksiyonunun sıcaklık katsayısı 3 ise, zehirli suyun 1 saat sonra zararsız hale gelmesi için hangi sıcaklıkta tutulması gerekir?
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Aynı değere sahip bir atomdaki bir elektronun durumları kümesi n aranan enerji seviyesi. Elektronların atomun temel durumunda olduğu seviyelerin sayısı, elementin bulunduğu periyodun sayısı ile örtüşür. Bu seviyelerin sayıları sayılarla gösterilir: 1, 2, 3, ... (daha az sıklıkla - harflerle K, L, M, ...).
Enerji alt seviyesi- bir atomdaki bir elektronun, aynı kuantum sayıları değerleriyle karakterize edilen bir dizi enerji durumu n ve ben. Alt düzeyler harflerle gösterilir: s, p, d, f... Birinci enerji seviyesinin bir alt seviyesi, ikinci - iki alt seviyesi, üçüncü - üç alt seviyesi vb.
Yörüngeler diyagramda hücreler (kare çerçeveler) ve elektronlar oklar (veya ↓) olarak belirtilirse, ana kuantum sayısının, ana ve yörünge kuantumunun birleşimi olan enerji seviyesini (EU) karakterize ettiğini görebilirsiniz. sayılar - enerji alt düzeyi (EPL ), bir dizi temel, yörünge ve manyetik kuantum sayısı - atomik yörünge ve dört kuantum sayısının tümü bir elektrondur.
Her yörünge belirli bir enerjiye karşılık gelir. Yörüngenin tanımı, enerji seviyesinin numarasını ve ilgili alt seviyeye karşılık gelen harfi içerir: 1 s, 3p, 4d vb. Her enerji seviyesi için, ikinciden başlayarak, enerjide üç eşit varlığın varlığı p birbirine dik üç yönde bulunan yörüngeler. Üçüncü enerji seviyesinden başlayarak her enerji seviyesinde beş d-daha karmaşık dört yapraklı şekle sahip yörüngeler. Dördüncü enerji seviyesinden başlayarak, daha da karmaşık şekiller ortaya çıkar. f-orbitaller; Her seviyede yedi tane var. Üzerine dağıtılmış bir elektron yüküne sahip bir atomik yörüngeye genellikle elektron bulutu denir.
Soru 12.
yatay periyodiklik
Çok fiziksel özellikler, iyonlaşma enerjisi ve elektron ilgisi olarak, son enerji alt seviyelerindeki elektron sayısındaki periyodik bir değişiklikle ilişkili olarak yatay bir periyodiklik de kendini gösterir:
Soru 13.
Soru 14.
Bir atomun manyetik özellikleri
Elektronun, uygulanan manyetik alana paralel veya zıt yönde nicelenen kendi manyetik momenti vardır. Aynı yörüngeyi işgal eden iki elektron zıt yönlü spinlere sahipse (Pauli ilkesine göre), bu durumda birbirlerini yok ederler. Bu durumda elektronların eşlendiği söylenir. Sadece çift elektronlu atomlar manyetik alanın dışına itilir. Bu tür atomlara diyamanyetik denir. Bir veya daha fazla eşleşmemiş elektrona sahip atomlar manyetik alana çekilir. Bunlara diamanyetik denir.
Bir atomun etkileşiminin yoğunluğunu karakterize eden bir atomun manyetik momenti manyetik alan, pratik olarak eşleşmemiş elektronların sayısıyla orantılıdır.
özellikler elektronik yapı atomlar çeşitli unsurlar iyonlaşma enerjisi ve elektron ilgisi gibi enerji özelliklerine yansır.
İyonlaşma enerjisi
Bir atomun iyonlaşma enerjisi (potansiyeli) ben denkleme göre bir atomdan bir elektronu sonsuza kadar uzaklaştırmak için gereken minimum enerjidir.
X = X + + e- . Değerleri, Periyodik sistemin tüm elementlerinin atomları için bilinir. Örneğin, bir hidrojen atomunun iyonlaşma enerjisi, bir elektronun 1'den geçişine karşılık gelir. s- enerji alt seviyesi (−1312.1 kJ/mol) sıfır enerjili alt seviyeye ve +1312.1 kJ/mol'e eşittir.
Atomların bir elektronunun çıkarılmasına karşılık gelen ilk iyonlaşma potansiyellerinin değişiminde, periyodiklik atomun sıra sayısında bir artışla açıkça ifade edilir:
Periyot boyunca soldan sağa hareket edildiğinde iyonlaşma enerjisi, genel olarak, kademeli olarak artar, grup içinde seri numarası arttıkça azalır. Minimum ilk iyonlaşma potansiyelleri alkali metaller, maksimum - soy gazlar.
Aynı atom için, elektronun pozitif yüklü bir iyondan ayrılması gerektiğinden, ikinci, üçüncü ve sonraki iyonlaşma enerjileri her zaman artar. Örneğin, bir lityum atomu için birinci, ikinci ve üçüncü iyonlaşma enerjileri sırasıyla 520.3, 7299.1 ve 11814.9 kJ/mol'dür.
Elektronların ayrılma sırası, genellikle, minimum enerji ilkesine göre elektronlar tarafından yörünge popülasyonu dizisinin tersidir. Ancak, doldurulan unsurlar d-orbitaller istisnadır - her şeyden önce kaybetmezler d-, a s-elektronlar.
Elektron ilgisi
Bir atomun bir elektrona ilgisi A e - atomların ek bir elektron bağlama ve negatif iyona dönüşme yeteneği. Elektron ilgisinin ölçüsü, süreçte salınan veya emilen enerjidir. Elektron ilgisi, negatif iyonun iyonlaşma enerjisine eşittir X − : X − = X + e −
Halojen atomları en yüksek elektron ilgisine sahiptir. Örneğin, bir flor atomu için, bir elektron eklenmesine 327.9 kJ/mol enerjinin serbest bırakılması eşlik eder. Bir dizi element için elektron ilgisi sıfıra yakındır veya negatiftir, bu da bu element için kararlı bir anyon olmadığı anlamına gelir.
Genellikle, çeşitli elementlerin atomlarına olan elektron ilgisi, iyonlaşma enerjilerindeki artışa paralel olarak azalır. Ancak, bazı eleman çiftleri için istisnalar vardır:
Bunun için bir açıklama, ilk atomların daha küçük boyutlarına ve içlerindeki daha büyük elektron-elektron itmesine dayanarak verilebilir.
Soru 15.
Soru 16.
yatay periyodiklik
Yatay periyodiklik, özelliklerin maksimum ve minimum değerlerinin ortaya çıkmasından oluşur. basit maddeler ve her dönem içindeki bağlantılar. Özellikle VIIIB grubu elementleri ve lantanitler için fark edilir (örneğin, seri numaraları çift olan lantanitler, tek olanlardan daha yaygındır).
İyonlaşma enerjisi ve elektron ilgisi gibi fiziksel özelliklerde, son enerji alt seviyelerindeki elektron sayısındaki periyodik bir değişiklikle ilişkili olarak yatay periyodiklik de kendini gösterir.






