Grup, dikey bir öğe sırasıdır
Mendeleev, lityumdan neona veya sodyumdan argona sekiz elementten oluşan bir dizi gibi özelliklerin sırayla değiştiği elementler dizisine periyot adını verdi. Bu iki periyodu, sodyum lityum altında ve argon neon altında olacak şekilde alt alta yazarsak, aşağıdaki element dizilişini elde ederiz:
Bu düzenleme ile, özelliklerinde benzer ve aynı değere sahip elementler, örneğin lityum ve sodyum, berilyum ve magnezyum vb. dikey sütunlara düşer.
Mendeleyev, tüm elementleri periyotlara bölerek ve bir periyodu diğerinin altında, özellik ve tür bakımından benzer elementleri oluşturan bileşiklerin birbirinin altına düşecek şekilde düzenleyerek, elementlerin gruplara ve serilere göre periyodik sistemi adını verdiği bir tablo hazırladı. Bu tablo içinde modern biçim Mendeleev'den sonra keşfedilen unsurlarla desteklenen , kitabın başında verilmiştir.
On yatay sıra ve sekiz dikey sütun veya birbirine benzer öğelerin alt alta yerleştirildiği gruplardan oluşur.
İlk önce elemanların yatay sıralardaki düzenine dikkat edelim. İlk sırada sadece iki element var - hidrojen ve helyum. Bu iki unsur ilk periyodu oluşturur. İkinci ve üçüncü sıralar, daha önce ele aldığımız öğelerden oluşur ve her biri sekiz öğeden oluşan iki periyot oluşturur. Her iki periyot da bir alkali metalle başlar ve bir soy gazla biter. Her üç döneme de küçük dönemler denir.
Dördüncü sıra ayrıca bir alkali metal - potasyum ile başlar. Önceki iki satırda özelliklerin nasıl değiştiğine bakılırsa, burada aynı sırayla değişmeleri beklenir ve dizideki yedinci element yine halojen ve sekizinci - soy gaz olur. Ancak bu gözlenmez. Halojen yerine, yedinci sırada hem bazik hem de asidik oksitleri oluşturan bir metal olan manganez bulunur ve bunların yalnızca en yükseği karşılık gelen klor okside benzer. Manganezden sonra aynı sırada üç metal daha vardır - birbirine çok benzeyen demir, kobalt ve nikel. Ve sadece bakır ile başlayan bir sonraki beşinci sıra, soy gaz kriptonu ile biter. Altıncı sıra yine alkali metal rubidyum ile başlar ve böylece, argondan sonraki elementlerde, özelliklerin aşağı yukarı tam bir tekrarı, ikincisinde olduğu gibi sekizden sonra değil, sadece on sekiz elementten sonra gözlenir. ve üçüncü sıralar. Bu on sekiz element, iki sıradan oluşan sözde büyük dönem olan dördüncüyü oluşturur.
Beşinci ana periyot, altıncı ve yedinci olmak üzere sonraki iki sıradan oluşur. Bu dönem başlar alkali metal rubidyum ve asil gaz ksenon ile biter.
Sekizinci sırada, lantandan sonra, lantana ve birbirine son derece benzeyen lantanitler (veya lantanitler) adı verilen on dört element vardır. Bu benzerlik göz önüne alındığında, atomlarının yapısının özelliğinden dolayı (bkz. § 32), lantanitler genellikle genel tablonun dışına yerleştirilir, yalnızca sistemdeki konumlarını lantan kutusuna not eder.
Ksenonu takip eden soy gaz radonu yalnızca dokuzuncu sıranın sonunda olduğundan, sekizinci ve dokuzuncu sıralar da büyük bir periyot oluşturur - altıncı, otuz iki element içerir.
Büyük periyotlarda, elementlerin tüm özellikleri ikinci ve üçüncü periyotlarda olduğu kadar tutarlı bir şekilde değişmez. Burada, dönemlerin kendi içindeki özelliklerin değişiminde hala bir miktar dönemsellik vardır.
Böylece, en yüksek oksijen değerliliği, bir elementten diğerine geçerken başlangıçta düzgün bir şekilde artar, ancak daha sonra, periyodun ortasında maksimuma ulaşarak ikiye düşer, ardından periyodun sonunda tekrar yediye çıkar. Bu bağlamda, büyük periyotların her biri iki kısma (iki sıra) ayrılmıştır.
Yedinci -henüz tamamlanmamış- dönemi oluşturan onuncu dizi, ilk ve son on üçü ancak nispeten yakın zamanda yapay yollarla elde edilen on dokuz öğe içerir. Aktinyumu takip eden on dört element, atomlarının yapısında aktinyuma benzer; bu nedenle, aktinitler (veya aktinitler) adı altında, lantanitler gibi genel tablonun dışına yerleştirilirler.
Tablonun dikey sütunlarında veya gruplar halinde benzer özelliklere sahip öğeler vardır. Bu nedenle, her dikey grup, olduğu gibi, doğal bir element ailesidir. Tabloda bu tür sekiz grup var. Grup numaraları üstte Romen rakamı ile işaretlenmiştir.
Birinci gruptaki elementler ile oksitler oluştururlar. Genel formül, ikinci - RO, üçüncü - vb. Böylece, her grubun elementlerinin oksijen açısından en yüksek değeri, birkaç istisna dışında grup numarasına karşılık gelir.
Aynı gruba ait elemanlar karşılaştırıldığında, beşinci sıradan (dördüncü periyot) başlayarak, her elemanın en büyük benzerliği, doğrudan altında veya üstünde bulunan elemanla değil, ondan ayrılan elemanlarla gösterdiği kolayca görülür. bir hücre. Örneğin, yedinci grupta brom, doğrudan klor ve iyodine bağlanmaz, ancak klordan manganez ile ve iyottan teknetyum ile ayrılır; altıncı gruptaki benzer elementler - selenyum ve tellür, onlardan çok farklı olan molibden ile ayrılır; Birinci grupta yer alan rubidyum, sekizinci sırada yer alan sezyuma büyük benzerlik gösterirken, hemen altında yer alan gümüşe çok az benzerlik gösterir.
Bu, dördüncü sıradan itibaren, her biri üst üste yerleştirilmiş iki sıradan oluşan büyük dönemlerin başlamasıyla açıklanır. Periyot içerisinde metalik özellikler soldan sağa doğru zayıfladığı için, her büyük periyotta üst (çift) sıradaki elementlerin onları alttaki (tek) elementlerden daha belirgin olduğu açıktır. Satırlar arasındaki farkı belirtmek için büyük periyotların ilk sıralarının elemanları tabloda sola, ikinci sıraların elemanları ise sağa kaydırılır.
Böylece, dördüncü periyottan başlayarak, periyodik sistemin her grubu iki alt gruba ayrılabilir: üst sıraların elemanlarından oluşan "çift" ve alt sıraların elemanlarından oluşan "tek". Mendeleev'in tipik olarak adlandırdığı küçük periyotların elemanlarına gelince, birinci ve ikinci gruplarda, özelliklerinde çift sıraların elemanlarına daha yakındırlar ve sola, diğerlerinde - tek sıraların elemanlarına kaydırılır ve kaydırılır. Sağa.
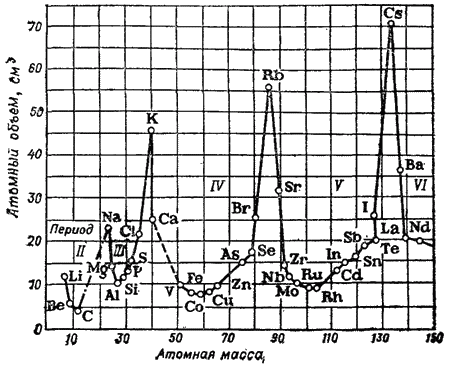
Pirinç. 1. Bir elementin atom hacminin atom kütlesine bağımlılığı.
Bu nedenle, tipik öğeler genellikle çift veya tek sıraların benzer öğeleriyle bir ana alt grupta birleştirilir ve diğer alt gruba ikincil denir.
Periyodik sistemi kurarken, Mendeleev, elementleri artan atom kütlelerine göre düzenleme ilkesiyle yönlendirildi. Ancak, tablodan da anlaşılacağı gibi, üç durumda bu ilke ihlal edilmiştir. evet, argon atom kütlesi 39.948) potasyumdan (39.098), kobalttan (58.9332) nikelden (58.70) ve tellürden (127.60) iyottan (126.9045) öncedir. Burada Mendeleev, düzenlemelerinin böyle bir sırasını gerektiren bu öğelerin özelliklerinden yola çıkarak benimsediği düzenden saptı. Böylece, atom kütlesine istisnai bir önem vermedi ve bir elementin tablodaki yerini belirleyerek, özelliklerinin toplamı tarafından yönlendirildi. Daha sonraki çalışmalar, Mendeleev tarafından yapılan periyodik sistemdeki elementlerin düzeninin kesinlikle doğru olduğunu ve atomların yapısına tekabül ettiğini gösterdi (daha fazla ayrıntı için bkz. Bölüm III).
Böylece, periyodik sistemde elementlerin özellikleri, atom kütleleri, değerlikleri ve kimyasal karakterleri bilinen bir sırayla hem yatay hem de dikey yönde değişir. Bir öğenin tablodaki yeri, bu nedenle, özellikleriyle belirlenir ve bunun tersine, her yer, belirli bir dizi özelliğe sahip bir öğeye karşılık gelir.
Bu nedenle, bir öğenin tablodaki konumunu bilerek, özelliklerini oldukça doğru bir şekilde belirleyebilirsiniz.
Elementlerin sadece kimyasal özellikleri değil, aynı zamanda birçok fiziksel özelliği de vardır. basit maddeler atom kütlesinin fonksiyonları olarak düşünürsek, periyodik olarak değişirler.
Değişimde periyodiklik fiziksel özellikler basit maddeler, örneğin atom hacimlerini karşılaştırırken açıkça ortaya çıkar.
Şek. 1 eğrisi, artan atom kütlesi ile elementlerin atom hacminin nasıl değiştiğini gösterir: alkali metaller en büyük atom hacmine sahiptir.
Basit maddelerin diğer birçok fiziksel sabiti de periyodik olarak değişir.
Dmitry Ivanovich Mendeleev, 27 Ocak (8 Şubat), 1834'te Tobolsk şehrinde yerel spor salonu müdürünün ailesinde doğdu. Tobolsk spor salonundan mezun olduktan sonra, 1855'te altın madalya ile mezun olduğu St. Petersburg Pedagoji Enstitüsü'ne girdi. 1859'da, "On" konulu yüksek lisans tezini savundu. belirli hacimler”, Mendeleev iki yıllık bir bilimsel gezi için yurtdışına gitti. Rusya'ya döndükten sonra, önce St. Petersburg Teknoloji Enstitüsü'nde ve iki yıl sonra - 33 yıl boyunca bilimsel ve pedagojik çalışmalar yürüttüğü St. Petersburg Üniversitesi'nde profesör seçildi. 1892'de Mendeleev, inisiyatifiyle 1893'te Ağırlıklar ve Ölçüler Ana Odasına (şimdi D. I. Mendeleev'in adını taşıyan All-Union Bilimsel Metroloji Araştırma Enstitüsü) dönüştürülen Örnek Ağırlıklar ve Ölçüler Deposu'nun bilimsel sorumlusu olarak atandı.
Mendeleev'in yaratıcı etkinliğinin en büyük sonucu, 1869'da, yani 35 yaşında, periyodik yasanın keşfi ve periyodik elementler sisteminin yaratılmasıydı. Mendeleev'in diğer çalışmalarından en önemlisi "Sulu çözeltilerin incelenmesi" dir. spesifik yer çekimi”, doktora tezi “Alkolün su ile kombinasyonu üzerine” ve “Dernekler olarak çözümleri anlama”. Mendeleev tarafından geliştirilen kimyasal veya hidrat çözelti teorisinin temel kavramları, modern çözelti teorisinin önemli bir bölümünü oluşturur.
Mendeleev'in olağanüstü eseri, ilk kez hepsinin ilk kez yer aldığı "Kimyanın Temelleri" adlı kitabıdır. inorganik kimya Periyodik yasa açısından sunulmuştur.
Teoriyi pratikle organik olarak birleştiren Mendeleev, hayatı boyunca yerli sanayinin gelişimine çok dikkat etti.
1984 yılında bilim topluluğu Sovyetler Birliği ve dünyanın birçok ülkesi, periyodik yasayı keşfeden ve periyodik elementler sistemini yaratan seçkin bir bilim adamı olan D. I. Mendeleev'in doğumunun yüz ellinci yıldönümünü ciddiyetle kutladı.
Periyodik sistem kimyasal elementler
Şu anda 109 kimyasal element bilinmektedir. Son elementler sadece birkaç atom miktarında elde edildi ve pratik bir önemi yoktu. Ancak, periyodik sistem daha da genişletilebilir.
Formlar grafik görüntü periyodik sistem (periyodik tablo) farklı olabilir; bunlardan başlıca ikisi: uzun ve kısa.
Tablonun uzun formunda her bir nokta tek satırda yazılmıştır. Eğitim amaçlı olarak, genellikle uzun periyotların iki satırda yazıldığı tablonun kısa formu kullanılır.
Periyodik sistem oluşur yedi dönemden, Tabloda yatay olarak düzenlenmiş, ve dikey olarak düzenlenmiş sekiz grup.
Bir periyot, bir alkali metal ile başlayan ve bir inert (asil) gaz ile biten (1. periyot hariç) yatay bir element sırasıdır.
1. periyot 2 element içerir, 2. ve 3. periyotlar - her biri 8 element. Birinci, ikinci ve üçüncü periyotlara denir. küçük (kısa) dönemler. 4. ve 5. periyotların her biri 18 element içerir, 6. periyot - 32 element, 7. periyot 87. ve daha ileri, şu anda bilinen elementlerin sonuncusuna kadar - 109. elementleri içerir. Dördüncü, beşinci, altıncı ve yedinci periyotlara denir. büyük (uzun) dönemler.
Her biri Grup Periyodik sistem iki alt gruptan oluşur: ana alt grup (A) ve ikincil alt grup (B). Ana alt grup küçük ve büyük periyotların elementlerini içerir (metaller ve metal olmayanlar). yan alt grup sadece büyük periyotların elementlerini içerir (sadece metaller).
Örneğin, grup I'in ana alt grubu lityum, sodyum, potasyum, rubidyum, sezyum ve fransiyum elementlerinden, grup I'in ikincil alt grubu ise bakır, gümüş ve altın elementlerinden oluşur. VIII grubunun ana alt grubu inert gazlardan oluşur ve ikincil alt grup, demir, kobalt, nikel, rutenyum, rodyum, paladyum, osmiyum, iridyum, platin, hassium ve meitneryum metalleridir. .
Basit maddelerin ve elementlerin bileşiklerinin özellikleri değişir monoton bir şekilde her dönemde ve spazmodik olarak dönemlerin sınırlarında. Özelliklerdeki değişimin bu doğası, periyodik bağımlılığın anlamıdır.
AT dönemler soldan sağa doğru elementlerin metalik olmayan özellikleri monoton olarak artarken metalik özellikleri zayıflar.Örneğin, ikinci dönemde, lityum çok aktif bir metaldir, berilyum bir amfoterik oksit oluşturan bir metaldir ve buna göre bir amfoterik hidroksit, B, C, N, O tipik metal olmayanlardır, flor en aktif olanıdır. metal olmayan neon, inert bir gazdır. Böylece, periyodun sınırlarında özellikler aniden değişir: periyot bir alkali metal ile başlar ve bir soy gazla biter.
AT dönemler soldan sağa doğru element oksitlerinin ve hidratlarının asidik özellikleri artarken temel özellikleri zayıflar.Örneğin, üçüncü periyotta sodyum oksit bazik oksittir, magnezyum oksit baziktir, alüminyum oksit amfoteriktir ve silikon, fosfor, kükürt ve klor oksitleri asidik oksitlerdir. Sodyum hidroksit güçlü bir bazdır (alkali), magnezyum hidroksit çözünmeyen zayıf bir bazdır, A1 (OH) 3 çözünmeyen bir amfoterik hidroksittir, silisik asit çok zayıf bir asittir, H3P04 orta kuvvette bir asittir, sülfürik ise kuvvetli asit, HClO 4 ( perklorik) bu serinin en kuvvetli asididir.
AT ana alt gruplar yukarıdan aşağıya doğru elementlerin metalik özellikleri artarken metalik olmayan özellikleri zayıflar.Örneğin, 4A alt grubunda: karbon ve silikon metal değildir, germanyum, kalay, kurşun metaldir ve kalay, kurşun germanyumdan daha tipik metallerdir. 1A alt grubunda tüm elementler metaldir, ancak kimyasal özellikler ayrıca lityumdan sezyum ve fransiyuma kadar metalik özelliklerin güçlendirilmesinin izini sürebilir.
Sonuç olarak, metalik özellikler çoğu sezyum ve fransiyumda ve metalik olmayan - florda ifade edilir.
AT ana alt gruplar yukarıdan aşağıya doğru oksitlerin ve hidratların temel özellikleri artarken asit özellikleri zayıflar.Örneğin, 3A alt grubunda: B 2 O 3 - asit oksit, ve T1 2 O 3 - temel. Hidratları: H3BO3 bir asittir ve T1(OH)3 bir bazdır.
1. D.I. tarafından periyodik yasanın keşfi. Mendeleyev.
2.
D.I. tarafından periyodik yasanın keşfi. Mendeleyev
D.I. tarafından periyodik yasanın keşfedildiği gün. Mendeleev, 1 Mart 1869 olarak kabul edilir, ancak bu keşfe giden yol yıllar sonra yatmaktadır. Şimdi Mendeleev'in adı sonsuza dek dünyanın en büyük bilim adamlarının isimleri listesine girdi ve keşfi modern kimyanın temeli haline geldi.
Kimyasal elementlerin sınıflandırılmasının temeli D.I. Mendeleyev o dönemde bilinen iki temel özelliği ortaya koydu: 1) atom kütlesi; 2) kimyasal özellikler. Bilinen elementlerin sistematiği üzerine yapılan çalışma (o zamanlar 63 tanesi biliniyordu), D.I. Mendeleyev, elementleri temel özelliklerini dikkate alarak atom kütlelerindeki artışa göre düzenlemiştir. Kimyasal olarak benzer elementlerin düzenli aralıklarla meydana geldiğini ve bu nedenle özelliklerinin birçoğunun bir dizi elementte periyodik olarak tekrarlandığını keşfetti. Elementlerin özelliklerinin atomik kütlelere bağımlılığı kuruldu.
Bu model periyodik yasada ifade edildi: basit cisimlerin özellikleri ve ayrıca elementlerin bileşiklerinin formları ve özellikleri, elementlerin atom ağırlıklarının (kütlelerinin) büyüklüğüne periyodik olarak bağlıdır.
Hukuk, elementlerin incelenmesinde güçlü ve yeni bir araçtır. Henüz keşfedilmemiş elementlerin özelliklerini önceden tanımlamayı mümkün kıldı. Bu yüzden o sırada bilinmeyen elementlerin özelliklerini No. 21, 31, 32 altında tanımladı (boş hücreler bıraktı). D.I.'nin hayatı boyunca Mendeleev'e göre, bu üç element keşfedildi: 1875'te. 31 Ga (Lecoq de Boisbaudran), 1879 - 21 Sc (Nilson ve Cleve), 1886 - 32 Ge (Winkler) keşfetti ve periyodik sisteme yerleştirildi. D.I.'nin bu üç unsuru Mendeleev, periyodik yasanın "güçlendiricileri" olarak adlandırdı. Şöyle yazdı: "Gelecek, periyodik yasayı yıkımla tehdit etmiyor, sadece daha fazla üstyapı ve gelişme vaat ediliyor." Elementlerin atom kütlesini artırarak düzenlenmesi, D.I. Mendeleyev bu ilkeyi üç kez terk etti. Yani 18 Ar(A=39.948), 19 K(A=39.098)'e kadar maliyet; 27 Co(A=58.933), 28 Ni(A=58.70'e kadar); 52 Te(127.60) ila 53 I(A=126.904). Böylece, atom kütlesine istisnai bir önem vermedi, ancak elementlerin özelliklerinin toplamını dikkate alarak elementin tablodaki yerini belirledi. Atomun yapısı teorisinin gelişimi, elementlerin D.I. Periyodik sistemdeki Mendeleev kesinlikle doğrudur ve atomların yapısına tekabül eder.
Şu anda açık olan 114 ürün var. Periyodik sistemin sınırları var mı? Bilim cevap verir: Kesin olarak belirlenmiş sınırlar olamaz - periyodik sistemin ne başı ne de sonu. Böylece, 1953'te kütlesi hidrojen atomundan neredeyse 1000 kat daha az olan pozitronyum (Ps) keşfedildi. Mendeleev element sistemini keşfeder.
Pozitronyum bir elektron ve bir pozitron olarak temsil edilebilir. Pozitron, kütle olarak elektrona benzeyen ancak pozitif yüke sahip bir parçacıktır. Pozitronyum (Ps), ortak bir ağırlık merkezi etrafında hareket eden bir elektron ve bir pozitrondur. Pozitronyum bir elektron-pozitron kabuğundan oluşur ve çekirdeğe sahip değildir, ancak kısa bir ömre sahiptir: yaklaşık 10 -7 - 10 -10 sn. ve fotonların emisyonu ile kaybolur. Pozitronyum elementlerin periyodik tablosunu açar, güçlü bir indirgeyici ajandır ve bir indirgeyici ajan olarak kimyasal reaksiyonlara katılabilir. Örneğin, iyonları geri yükler: Fe 3+ ila Fe 2+
Pozitronyumun keşfi, anti-atomlardan yapılmış tamamen farklı bir maddi dünyanın varlığı sorusunu gündeme getirdi. Aslında, pozitronyum, pozitif yüklü bir çekirdek ve negatif yüklü elektronlardan oluşan atomlar arasındaki sınırda bulunur ve anti-atomlar – negatif yüklü çekirdek ve pozitif yüklü pozitron sistemleri:
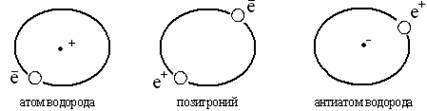
Antiatomlar mevcuttur, bazıları (hidrojen, helyum antiatomları) deneysel olarak incelenmiştir. Bu nedenle, periyodik sistemin başlangıcından söz edilemez, çünkü pozitronyum ile ilgili tablo, anti-atomlar dünyasında D.I.'nin periyodik tablosunun yapısını tekrarlayabilir. Mendeleyev.
Ağır elementler alanında kimyasal elementler sisteminde bir gelişme var: element 114 zaten keşfedildi. D.I. yasasını tamamlayan (ancak ihlal etmeyen) yeni kalıpların ortaya çıkması mümkündür. Mendeleyev.
Periyodik sistemin doğal sonu, ortalama ömrü olan elementin atom numarası ile belirlenir. atom çekirdeği 1 * 10 -15 saniyeden az olur. 108-114 seri numaralı elemanlar için bu süre yaklaşık 1*10 -12 saniyedir. Atom çekirdeği teorisinin gelişimi, büyük seri sayılarında "kararlılık adaları" olarak adlandırılanların var olabileceğini, yani. uzun ömürlü bireysel atomlar.
başlangıca
Periyodik sistemin oluşturulması (periyot, grup, alt grup).
Periyodik yasanın ifadesi, kimyasal elementlerin periyodik sistemidir. Periyodik sistem, periyodik yasanın grafik bir temsilidir. 1869'da Mendeleev tablonun bir taslağını verdi - uzun bir form ve 1870'de kısa bir form önerdi. Kısa formun modern versiyonunda bazı önemli değişiklikler yapıldı (soy gazlar sıfır grubundan sekizinci gruba taşındı). Şu anda, periyodik eleman sisteminin (400'den fazla) birkaç yüz çeşidi bilinmektedir ve hepsi temel olarak Mendeleev tarafından önerilen inşaat ilkesini içermektedir.
Periyodik sistem 7 periyot ve 8 gruptan oluşur.
Dönem - tipik bir metal (alkali) ile başlayan, amfoterik bir elementten geçen ve metal olmayan (soy gazlar) ile biten atomların artan nükleer yükünün sırasına göre düzenlenmiş yatay bir element sırası. Periyot numarası, enerji seviyelerinin sayısını gösterir. Dönemler küçük ve büyüktür.
Malyugin 3. Periyodik sistemin yapısı. Dönemler.
Periyodik tablonun kısa periyot versiyonu aşağıdakilerden oluşur: periyotlar, seriler, gruplar ve alt gruplar.
Uzun vadeli versiyonda seri belirtilmemiştir.
Periyot - bir alkali metal ile başlayan atom çekirdeğinin yükünün artan sırasına göre düzenlenmiş periyodik kimyasal elementler sisteminin yatay bir sırası ( Li, Na, K.Rb, C'ler, Fr) ve inert bir gazla (O, Ne, Ar, kr, Xe, Rn).
İstisnalar: hidrojen (metal olmayan) ile başlayan ilk dönem.
Periyodik sistemin sahip olduğu yedi dönem ve 10 seri.
Dönemler küçük ve büyük olarak ayrılır.
İlk periyod, 2 eleman içeren ve ayrıca ikinci ve üçüncü, her biri 8 elemanlı, küçük denir. Bir yatay sıradan oluşurlar.
Kalan periyotlar, her birinde iki yatay sıra bulunan, büyük denir.
Dördüncü ve beşinci periyotların her biri 18 kimyasal element içerir. Beşinci ve altıncı periyotlar - her biri 32 kimyasal element. Yedinci periyot, en son verilere göre, çoğu bir nükleer füzyon reaksiyonu gerçekleştirilerek yapay olarak elde edilen 32 element içerir.
Her büyük dönemin sahip olduğu iki sıra.
Büyük dönemlerin üst sıralarına denir Bile, alt sıralar garip. Büyük periyotların sıralarında bile sadece metaller vardır.
Lantan La'dan sonraki altıncı periyotta (seri numarası Z=57) 14 element vardır (seri numaraları Z=5, özellikleri lantana benzer ve denir. lantanitler, periyodik tablonun en altında bulunurlar.
Aktinyum Ac'dan sonraki tamamlanmamış yedinci periyotta (seri numarası Z = 89) 14 element vardır (seri numaraları Z =, özellikleri aktinyuma benzer ve denir. aktinitler. Lantanitler gibi periyodik tablonun en altında yer alırlar (Şek. 1)
Şekil 1. Periyotların ve serilerin düzenlenmesi
periyodik sistemde
Tablo 1. Periyotlardaki element sayısı:
Adet numarası | Satır sayısı | Dönem adı | Eleman sayısı | Alt gruplara göre eleman sayısı |
||
yan | Lantanitler/ aktinitler |
|||||
2 sıra + lantanitler | ||||||
2 sıra + aktinitler |
Dönemlerde gözlenen desenler.
Her periyot (birincisi hariç) tipik bir metalle (Li, Na, K, Rb, Cs, Fr) başlar ve bir asal gazla (He, Ne, Ar, Kr, Xe, Rn) biter. -metal (F, Cl, Br, I, At).
Her periyotta soldan sağa doğru atom çekirdeğinin yükü artar, atomun yarıçapı azalır, metalik özelliklerde zayıflama ve metalik olmayan özelliklerde güçlenme, oksitleyici özelliklerde azalma ve güçlenme vardır. elementler ve oluşturdukları basit ve karmaşık maddelerdir.
Kendi kendine muayene için sorular
1. Kimyasal elementlerin periyodik tablosu hangi yapısal elementlerden oluşur?
2. Dönem nedir?
3. Periyodik sistemde kaç tane periyot ve satır vardır?
4. Her periyotta kaç element vardır?
5. Hangi dönemlere küçük denir ve neden?
6. Küçük periyotları olan kaç seri vardır?
7. Hangi dönemlere büyük denir? Kaç satırda uzun periyotlar vardır?
8. VI, VII dönemlerinin yapısında ne gibi özellikler vardır?
9. Her periyotta hangi elementler başlar?
10. Hangi elementler her periyodu bitirir?
11. Asil (inert) gazlardan önce hangi elementler gelir?
12. Soldan sağa doğru periyotlarda elementlerin özellikleri nasıl değişir?
Cevabı görüntüle
1. Dönemlerden, serilerden, gruplardan ve alt gruplardan.
2. Periyot - bir alkali metal (Li, Na, K. Rb, Cs, Fr) ile başlayan ve atom çekirdeğinin yükünün artan sırasına göre düzenlenmiş, periyodik kimyasal elementler sisteminin yatay bir sırası soy gaz (He, Ne, Ar, Kr, Xe , Rn).
3. 7 periyot ve 10 satır.
4. Tablo 1'e bakın.
5. I, II ve III dönemlerine küçük denir, sırasıyla 2, 8, 8 kimyasal element içerirler.
6. Küçük periyotların her birinde bir satır bulunur. Şekil 1'e bakın.
7. IV, V, VI, VII dönemlerine büyük denir. Her büyük periyodun 2 satırı vardır. Şekil 1'e bakın.
8. VI 14 element içerir - lantanitler, VII periyodu 14 aktinit elementi içerir. Kolaylık sağlamak için masanın altında bulunurlar.
13. Her periyot (birincisi hariç) tipik bir alkali metal (Li, Na, K, Rb, Cs, Fr) ile başlar.
14. Her periyot bir soy gazla biter (He, Ne, Ar, Kr, Xe, Rn).
15. Onlardan önce tipik metal olmayan halojenler (F, Cl, Br, I, At) gelir.
16. Her periyotta soldan sağa doğru metalikte zayıflama ve metalik olmayan özelliklerde güçlenme, elementlerin ve oluşturdukları basit ve karmaşık maddelerin oksitleyici özelliklerinde azalma ve güçlenme vardır.
Bağımsız çözüm için görevler
1. Seri numarası 14, 48, 52, 56, 78 olan elementler hangi periyot ve serilerdedir? Sembollerini, Rusça adını, bağıl atom kütlesini belirtin.
2. IV. periyodun tek serisi elementlerinin sembollerini, isimlerini ve bağıl atom kütlelerini yazınız.
3. Hangi elementin daha belirgin metalik özellikleri vardır - kalsiyum veya potasyum? Neden? Niye?
4. Hangi elementin metalik olmayan özellikleri daha belirgindir: fosfor veya klor? Neden? Niye?
5. Dördüncü periyodun hangi elementi en aktif ametaldir? Neden? Niye?
6. Beşinci periyodun hangi elementi en aktif metaldir? Neden? Niye?
Cevabı görüntüle:
Seri numarası | ||||||
Öğe sembolü | ||||||
Göreceli atomik kütle |
tek, PSHE'nin 5. satırıdır, öğeleri içerir |
|||||||||
Öğe sembolü | |||||||||
Seri numarası | |||||||||
Rus adı | germanyum | ||||||||
Göreceli atomik kütle |
3. Potasyum. PSCE'deki öğelerin konumuna bakmanız gerekir. Potasyum (K) ve kalsiyum (Ca) aynı (dördüncü) dönemdedir. Bir periyotta soldan sağa doğru metalik özellikler zayıflar.
4. Klor. PSCE'deki öğelerin konumuna bakmanız gerekir. Fosfor (P) ve klor (Cl) aynı (üçüncü) periyottadır. Bir periyotta soldan sağa doğru metalik olmayan özellikler artar.
5. Bu dönemin en aktif ametali bromdur. Bir periyotta soldan sağa doğru metalik olmayan özellikler artar. İnert element kripton kimyasal aktivite göstermez, en aktif metal olmayandan önce gelir.
6. Bu dönemin en aktif metali rubidyumdur. Periyot aktif bir alkali metal ile başlar (Li, Na, K. Rb, Cs, Fr), periyotta soldan sağa hareket edildiğinde metalik özellikler zayıflar. .






