Basit maddelerin Gibbs enerjisi. gibbs enerjisi
Hollandalı fiziksel kimyager van't Hoff, kimyasal afinitenin doğasını açıklamadan, ölçüm yöntemini belirtmekle sınırlı olan yeni bir kimyasal afinite teorisi önerdi. niceleme kimyasal afinite.
van't Hoff, kimyasal afinitenin bir ölçüsü olarak Ayax'ın maksimum çalışmasını veya sırasıyla veya sırasında meydana gelen reaksiyonlar için kullanır.
Maksimum iş, reaksiyonu durdurmak, yani kimyasal afinite kuvvetlerinin üstesinden gelmek için sisteme uygulanması gereken enerjiye eşittir. Reaksiyon, pozitif maksimum iş yönünde ilerlediğinden, kimyasal etkileşimin kendiliğinden akışının işareti veya yönünü belirler.
Maksimum çalışma sabit hacim eşittir
Aradaki fark, sistemin Helmholtz enerjisi olarak adlandırılır ve harfle gösterilir. Böylece,
Maksimum çalışma sabit basınç eşittir
Aradaki fark sistemin Gibbs enerjisi olarak adlandırılır ve harf ile gösterilir. Böylece,
![]()
Bir kimyasal reaksiyonun Gibbs enerjisi.
Sistem durumunun Gibbs enerjisi termodinamik fonksiyonu Akış sırasında sistemdeki Gibbs enerjisindeki değişim Kimyasal reaksiyon kimyasal tepkimenin Gibbs enerjisi olarak adlandırılır. (IV.20) ve (IV.21) denklemlerine göre,
![]()
(IV.21)'e dayanarak, bir kimyasal reaksiyonun Gibbs enerjisi, sabit sıcaklık ve basınç koşulları altında reaksiyonun kendiliğinden akışının yönünü ve sınırını karakterize eder.
Bir kimyasal reaksiyonun Helmholtz enerjisi.
Helmholtz enerjisi aynı zamanda sistemin durumunun termodinamik bir fonksiyonudur.Bir reaksiyon sırasında bir sistemdeki Helmholtz enerjisindeki değişime kimyasal reaksiyonun Helmholtz enerjisi denir. (IV.18) ve (IV.19)'a göre,
T sıcaklığında ve T sıcaklığında devam eden reaksiyon sırasında ilgili termodinamik fonksiyonlardaki değişim nerede ve nedir?
Değer [bkz. denklem (IV. 19)], izokorik-izotermal koşullar altında kendiliğinden reaksiyon akışının yönünü ve sınırını karakterize eder.
Şek. IV.3, sistemin durumunun ana termodinamik fonksiyonları arasındaki ilişkiyi gösterir.
Gibbs kimyasal bileşiklerin oluşum enerjisi.
Sistemin durumunun termodinamik fonksiyonundaki bir değişiklik olan bir kimyasal reaksiyonun Gibbs enerjisi, farktan hesaplanabilir.
![]()
("2" ve "1" endeksleri, sırasıyla sistemin son ve ilk durumlarını ifade eder). (IV.24) denklemine göre bir kimyasal reaksiyonun Gibbs enerjisini hesaplarken, - tüm reaksiyon ürünlerinin oluşum Gibbs enerjilerinin toplamı, - oluşumun Gibbs enerjilerinin toplamı akılda tutulmalıdır. tüm başlangıç maddelerinin Bir kimyasal reaksiyonun standart Gibbs enerjisi, reaksiyon ürünlerinin ve başlangıç malzemelerinin standart Gibbs oluşum enerjilerinin toplamları arasındaki farktan hesaplanır.
Standart Gibbs Enerji Eğitimi kimyasal bileşik Standart durumda olan bu bileşiğin bir molünün oluşum reaksiyonunun Gibbs enerjisini karşılık gelen değerden adlandırın.
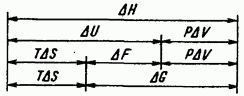
Pirinç. IV.3. En önemli termodinamik fonksiyonların oranı
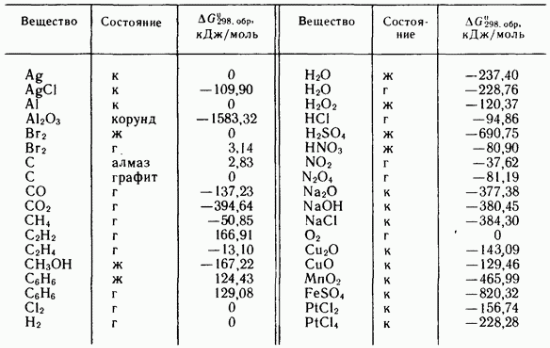
basit maddeler de bulunur standart durumlar ve belirli bir sıcaklıkta termodinamik olarak kararlı olan fazlar ve modifikasyonlar (Tablo IV.3).
Basit maddelerin oluşumunun standart Gibbs enerjileri, eğer varsa, sıfıra eşit alınır. toplu durumlar ve modifikasyonlar standart koşullar ve 298.16 K altında kararlıdır.
Kimyasal reaksiyonların kendiliğinden akışının yönü ve sınırları.
(IV. 19) ve (IV.21) uyarınca, pozitif maksimum çalışma A veya Helmholtz enerjisinin negatif değerlerine ve kimyasal reaksiyonların Gibbs enerjisine karşılık gelir. Başka bir deyişle, ne zaman Sabit sıcaklık ve basınç, reaksiyon, sistemin Gibbs enerjisindeki azalmaya karşılık gelen yönde kendiliğinden ilerler.Bu nedenle, verilen bir kimyasal reaksiyonun kendiliğinden akışının koşulu ve T eşitsizliğidir.
Reaksiyonun kendiliğinden akışının sınırı, yani denge koşulu, veri için minimum değerin ve fonksiyonun T'sinin elde edilmesidir.
Sabit sıcaklık ve hacimde reaksiyon, sistemin Helmholtz enerjisindeki azalmaya karşılık gelen yönde kendiliğinden ilerler.
Tablo IV.3, 298.16 K'da bazı basit madde ve bileşiklerin standart Gibbs oluşum enerjileri
verilen V ve T için kimyasal reaksiyonun keyfi seyri eşitsizliktir
Reaksiyonun kendiliğinden akışının sınırı, yani denge koşulu, fonksiyonun verilen V ve T değerleri için minimum değerin elde edilmesidir.
eğer değiştirirken kimyasal bileşim Sistem, Gibbs enerjisindeki bir artışa karşılık gelir, bu da kendiliğinden bir reaksiyon meydana gelmediği anlamına gelir. eşitsizlik
reaksiyonun sadece kendiliğinden ilerleyebileceği anlamına gelir. ters yön, sistemin Gibbs enerjisindeki azalmaya karşılık gelir. 298.16 K'da bir kimyasal reaksiyonun standart Gibbs enerjisini hesaplamak ve böylece fonksiyondaki değişimin işaretini bulmak zor değildir.
Örneğin, Tabloda verilen verileri kullanarak. IV.3'te, 298.16 K'da (1 mol için) reaksiyonun standart Gibbs enerjisi hesaplanabilir.
Tepkimenin Gibbs enerjisinin ortaya çıkan değeri eşitsizliği sağlar (IV.25). Bu, 101 kPa ve 298 K'da sodyum oksidin su ile etkileşim sürecinin kendiliğinden üretim (k) yönünde ilerleyebileceği anlamına gelir.
Yine de standart enerji Bir kimyasal reaksiyonun Gibbs'i, standart dışındaki koşullar altında bir kimyasal etkileşimin kendiliğinden meydana gelmesinin yönü veya sınırı için bir kriter olamaz. Miktarı nicelikle değiştirmek de imkansızdır.Bütün bunlar, gerçek koşullarda meydana gelen süreçleri değerlendirmek için Gibbs enerjisinin kullanımını biraz karmaşıklaştırır.
(IV.22) denkleminden, bir kimyasal reaksiyonun Gibbs enerjisi ne kadar küçükse, o kadar küçük ve o kadar büyük olur. sistemin entropisinde bir artışla birlikte Denklem (IV.22)'den, bu durumda değer her zaman pozitif olduğu için, entropide bir azalma ile meydana gelen endotermik süreçlerin kendiliğinden meydana gelemeyeceği de takip edilir. Endotermik etkileşimler, ancak bu tür etkileşimler sıcaklıktaki bir artışla kolaylaştırılırsa kendiliğinden ilerleyebilir, çünkü bu işlemin entropi faktörünün değerini arttırır.
Burada entalpi, entropi gibi termodinamik parametreleri hesaplamak için görev örnekleri bulacaksınız. Sürecin kendiliğinden akış olasılığının belirlenmesi ve ayrıca termokimyasal denklemlerin derlenmesi.
Çözümlerle termodinamiğin temelleri bölümü için görevler
Görev 1. Bir kimyasal reaksiyonun standart entalpisini ve standart entropisini hesaplayın. 298 °K'de (ileri veya geri) reaksiyonun hangi yönde ilerleyeceğini belirleyin. Tepkimenin her iki yönünün de eşit derecede olası olduğu sıcaklığı hesaplayın.
Fe 2 O 3 (c) + 3H 2 \u003d 2Fe (c) + 3H 2 O (g)
Δ Hsemt = ΣH 0 con– ΣH 0 referans kJ/mol
Referans verilerini kullanma standart entalpiler maddeler buluruz:
Δ Hsemt= 2 Δ H 0 Fe +3 Δ H 0 H2 O - Δ H 0 Fe2 O3 - 3 Δ H 0 H2 \u003d 2 0 + 3 (- 241.82) - (-822.16) - 3 0 \u003d 96.7 kJ / mol
Δ Ssemt=Σ S 0 con– Σ S 0 referans J/(mol K)
Referans verilerini kullanma standart entropiler maddeler buluruz:
Δ Ssemt= 2 Δ S 0 Fe + 3 Δ S 0 H2 O - Δ S 0 Fe2 O3 - 3 Δ S 0 H2 = 2 27,15 + 3 188,7 – 89,96 – 3 131 = 137,44 J/(mol K)
ΔG = Δ H – TΔS\u003d 96.7 - 298 137.44 / 1000 \u003d 55.75 kJ / mol
T=298°K'de, ΔG> 0 - reaksiyon kendiliğinden ilerlemez, yani. reaksiyon ters yönde ilerleyecektir.
ΔG = Δ H – TΔS= 0, sonra
T= — (ΔG – Δ H) / ∆S= — (0-96.7)/0.137 = 705.83K
T = 705.83 K'da reaksiyon hem ileri hem de geri yönde eşit olasılıkla devam edecektir.
Görev 2. Gibbs enerjisini hesaplayın ve reaksiyonun 1000 ve 3000 K sıcaklıklarda meydana gelme olasılığını belirleyin.
Sıvı karbon disülfidin yanması için reaksiyon denklemi aşağıdaki gibidir:
CS 2 (l) + 3O 2 \u003d CO 2 + 2SO 2
Standart madde entalpilerinin referans verilerini aşağıdaki ifadeye koyarak reaksiyonun ısı etkisini hesaplıyoruz:
Δ Hsemt = ΣH 0 con– ΣH 0 referans kJ/mol
Δ Hsemt= 2 Δ H 0 SO2+ Δ H 0 CO2- Δ H 0 CS2 - 3 Δ H 0 O2 \u003d 2 (-296.9) + 3 (- 393.5) - 87 - 3 0 \u003d -1075.1 kJ / mol
Şunlar. yanma sırasında 1 mol karbon disülfid açığa çıkar 1075.1 kJ sıcaklık
ve yanarken x benler karbon disülfid açığa çıkar 700 kJ sıcaklık
Bulalım X:
x\u003d 700 1 / 1075.1 \u003d 0.65 mol
Yani reaksiyon sonucunda 700 kJ ısı açığa çıkarsa, 0,65 mol CS2 reaksiyona girecektir.
Görev 4. Aşağıdaki termokimyasal denklemlere dayanarak, demir oksidin (II) hidrojen ile indirgeme reaksiyonunun termal etkisini hesaplayın:
1. FeO (c) + CO (g) \u003d Fe (c) + CO2 (g); AH1 = -18.20 kJ;
2. CO (g) + 1/2O2 (g) \u003d CO2 (g) ΔH2 \u003d -283.0 kJ;
3. H 2 (g) + ½ O 2 (g) \u003d H 2 O (g) ΔH3 \u003d -241,83 kJ.
Demir oksidin (II) hidrojen ile indirgeme reaksiyonu aşağıdaki forma sahiptir:
4. FeO (c) + H2 (g) = Fe (c) + H2O (g)
Reaksiyonun termal etkisini hesaplamak için uygulamak gerekir, yani. reaksiyon 4, reaksiyon 1 ve 2 eklenerek ve reaksiyon 1 çıkarılarak elde edilebilir:
Δ Hsemt= Δ H 1 + Δ H 3 – Δ H 2 \u003d -18.2 - 241.3 + 283 \u003d 23 kJ
Böylece, reaksiyonun termal etkisi demir oksidin (II) hidrojen ile indirgenmesi eşittir
Δ Hsemt= 23 kJ
Görev 5. Benzenin yanma reaksiyonu termokimyasal denklemle ifade edilir:
C 6H6 (g) + 7½ O2 (g) \u003d 6C02 (g) + 3H20 (g) - 3135,6 kJ.
Sıvı benzenin oluşum ısısını hesaplayın. Standart koşulların normal ile aynı olması şartıyla sıvı benzenin kalorifik değerini belirleyin.
Reaksiyonun termal etkisi:
Δ Hsemt = ΣH 0 con– ΣH 0 referans kJ/mol
bizim durumumuzda Δ Hsemt= - 3135.6 kJ, sıvı benzenin oluşum ısısını buluruz:
Δ Hsemt= 6 Δ H 0 O2 + 3 ile Δ H 0 H2 O - Δ H 0 C6 H6 - 7.5 Δ H 0 O2
-Δ H 0 C6 H6= Δ Hsemt- 3 (-241.84) + 6 (- 393.51) - 7.5 0 \u003d - 3135,6 - 3 (-241.84) + 6 (- 393.51) - 7, 5 0 \u003d - 49.02 kJ / mol
Δ H 0 C6 H6 = 49.02 kJ/mol
Kalorifik değer sıvı benzen aşağıdaki formülle hesaplanır:
QT= Δ Hsemt 1000 / M
M(benzen) = 78 g/mol
QT= - 3135.6 1000 / 78 = - 4.02 10 4 kJ / kg
Kalorifik değer sıvı benzen Q T = - 4.02 10 4 kJ / kg
Görev 6. Etil alkolün oksidasyon reaksiyonu denklemle ifade edilir:
C2H5OH (g) + 3.0 O2 (g) \u003d 2C02 (g) + 3H20 (g).
ΔH x.r'yi bilerek, C 2 H 5 OH (l) oluşum ısısını belirleyin. = - 1366,87 kJ. Bir termokimyasal denklem yazın. C 2 H 5OH (g) oluşum ısısı biliniyorsa, -235.31 kJ mol -1'e eşit olan buharlaşma ısısını C 2 H 5 OH (g) → C 2 H 5 OH (g) belirleyin.
Verilen verilere göre yazıyoruz. termokimyasal denklem:
C2H5OH (g) + 3O2 (g) \u003d 2C02 (g) + 3H20 (g) + 1366.87 kJ
termal etki reaksiyonlar eşittir:
Δ Hsemt = ΣH 0 con– ΣH 0 referans kJ/mol
bizim durumumuzda Δ Hsemt= - 1366,87 kJ.
Referans verilerini kullanma maddelerin oluşum ısıları, C 2 H 5 OH (l) oluşum ısısını buluyoruz:
Δ Hsemt= 2 Δ H 0 O2 + 3 ile Δ H 0 H2 O - Δ H 0 C2H5OH(l) – 3 Δ H 0 O2
- 1366.87 \u003d 2 (-393.51) + 3 (-285.84)— Δ H 0 C2H5OH - 3 0
Δ H 0 C2H5OH(w)\u003d -277,36 kJ / mol
Δ H 0 C2H5OH(g) = Δ H 0 C2H5OH(l) + Δ H 0 buharlaşma
Δ H 0 buharlaşma = Δ H 0 C2H5OH(g) — Δ H 0 C2H5OH(l)
Δ H 0 buharlaşma\u003d - 235.31 + 277.36 \u003d 42.36 kJ / mol
C 2 H 5 OH (l) oluşum ısısının şuna eşit olduğunu belirledik.
Δ H 0 C2H5OH(w)\u003d -277,36 kJ / mol
ve molar buharlaşma ısısı C 2 H 5 OH (l) → C 2 H 5 OH (g)
Δ H 0 buharlaşma= 42.36 kJ/mol
Görev 7. Standart koşullar altında ekzotermik bir reaksiyonun imkansız olduğu nasıl açıklanabilir:
CO 2 (g) + H 2 (g) ↔ CO (g) + H 2 O (g)?
Bu reaksiyonun ΔG'sini hesaplayın. hangi sıcaklıklarda bu tepki kendiliğinden olur mu?
Hesaplamak ΔG bu reaksiyon:
ΔG = Δ H – TΔS
Bunu yapmak için önce tanımlıyoruz Δ Hve ∆S reaksiyonlar:
Δ Hsemt = ΣH 0 con– ΣH 0 referans kJ/mol
Referans verilerini kullanma standart entalpiler maddeler buluruz:
Δ Hsemt= Δ H 0 H2O(l) + Δ H 0 CO- Δ H 0 CO2 - Δ H 0 H2 \u003d -110.5 + (-285.8) - (393.5) - 0 \u003d -2.8 kJ / mol
Δ Ssemt=Σ S 0 con– Σ S 0 referans J/(mol K)
Benzer şekilde, referans verileri kullanılarak standart entropiler maddeler buluruz:
Δ Ssemt= Δ S 0 H2O(l) + Δ S 0 CO- Δ S 0 CO2 - Δ S 0 H2 \u003d 197,5 + 70.1 - 213.7 - 130.52 \u003d -76.6 J / (mol K)
Bulalım Gibbs enerjisi standart koşullar altında
ΔGsemt= Δ H – TΔS\u003d -2.8 + 298 76.6 / 1000 \u003d 20 kJ / mol> 0,
yani reaksiyon kendiliğinden gitmez.
Bu reaksiyonun hangi sıcaklıklarda olduğunu bulun doğal.
Denge durumunda ΔGsemt = 0 , sonra
T = Δ H/ ∆S = -2.8 / (-76.6 1000) \u003d 36,6 K
Görev 8. ΔG ve ΔS tablo verileri temelinde hesaplama, reaksiyonun termal etkisini belirleyin:
2 NO (g) + Cl2 (g) ↔ 2 NOCl (g).
Sabit sıcaklık ve basınçta, değişim Gibbs enerjisi
ΔG = Δ H – TΔS
Tablo verilerine dayanarak, hesaplıyoruz ∆G ve ∆S
ΔG 0 semt= Σ ΔG 0 eşya — Σ ΔG 0 referans
ΔGsemt= 2 ΔG 0 NOCI(G) — 2 ΔG 0 NUMARA(G) — ΔG 0 Cl2(d)
ΔGsemt= 2 66,37 — 2 89,69 – 0 = — 40,64 kJ/mol
ΔGsemt < 0 , yani reaksiyon kendiliğindendir.
Δ Ssemt=Σ S 0 con– Σ S 0 referans J/(mol K)
Δ Ssemt = 2 ∆S 0 NOCI(G) — 2 ∆S 0 NUMARA(G) — ∆S 0 Cl2(d)
Δ Ssemt = 2 261,6 — 2 210,62 – 223,0 = -121,04 J/(mol K)
Bulalım Δ H :
Δ H = ΔG + TΔS
Δ H = - 40.64 + 298 (-121.04 / 1000) \u003d - 76,7 kJ / mol
Reaksiyonun termal etkisi Δ H = - 76,7 kJ / mol
Görev 9. Gaz halindeki hidrojen klorür neyle daha yoğun etkileşir (1 mol başına): alüminyum ile mi kalay ile mi? Cevabınızı her iki tepkime için de ΔG 0 hesaplayarak veriniz. Reaksiyon ürünleri katı tuz ve gaz halinde hidrojendir.
Hesaplamak ∆G0 gaz halindeki hidrojen klorürün (1 mol başına) alüminyum ile etkileşiminin reaksiyonu için
2Al (t) + 6HCl (g) \u003d 2AlCl 3 (t) + 3H 2
ΔG 0 semt= Σ ΔG 0 eşya — Σ ΔG 0 referans kJ/mol
ΔG 0 ilçeler1= 2 ΔG 0 AlCl3 (t) + 3 ΔG 0 H2 — 2 ΔG 0 Al(t) - 6ΔG 0 HCl(G)
ΔG 0 ilçeler1= 2 (-636.8) + 3 0 — yirmi - 6(-95.27) = -701.98 kJ/mol
2 mol Al(t) reaksiyonda yer alır, daha sonra ΔGilçeler1 1 mol Al(t) eşittir
ΔG 0 1. bölge \u003d -701.98 / 2 \u003d -350.99 kJ / mol
Hesaplamak ∆G0 gaz halindeki hidrojen klorürün (1 mol başına) kalay ile etkileşiminin reaksiyonu için:
Sn (t) + 2HCl (g) \u003d SnCl2 (t) + H2
ΔG 0 ilçeler2 =ΔG 0 SnCl2(t) + ΔG 0 H2 — ΔG 0 Sn(t) - 2ΔG 0 HCl(G)
ΔG 0 2. bölge \u003d -288.4 + 0- 0- 2 (-95.27) \u003d -97.86 kJ / mol
Her iki reaksiyon da ΔG 0 <0 , bu nedenle, kendiliğinden ileri yönde akarlar, ancak gaz halindeki hidrojen klorür, alüminyum ile daha yoğun bir şekilde etkileşime girecektir, çünkü
ΔG 0 1. bölge˂ ΔG 0 2. bölge
Problem 10. Hesaplamalara başvurmadan hangi işaretlerin (>0,<0, ≅0) имеют ΔG, ΔH и ΔS для протекающей в прямом направлении реакции:
4 HBr (g) + O 2 (g) ↔ 2 H 2 O (g) + 2 Br 2 (g)
Sıcaklıktaki bir artış kimyasal reaksiyonun yönünü nasıl etkiler?
Sabit sıcaklık ve basınçta Gibbs enerji değişimi ifade ile entalpi ve entropi ile ilgili:
ΔG = Δ H – TΔS
sistemin düzensizliğinin bir ölçüsüdür. Entropinin değeri ne kadar büyükse, sistemdeki düzensizlik o kadar büyük olur (daha fazla gaz halinde madde). Bu tepkimede gazların sağındaki mol sayısı 5, solundaki gaz sayısı 4'tür, yani sistemin entropisi azalır. ∆S˂0.
Problemin durumuna göre reaksiyon ileri yönde ilerler, dolayısıyla ΔG˂0.
Normal koşullar altında TΔS ˂˂ ΔH, yani bu durumda ∆H˂0 ekzotermik bir reaksiyondur.
Sıcaklık yükseldiğinde değerlerin bir zaman gelebilir TΔS ve Δ H aynı olursa sistem dengeye gelir ΔG=0. Sıcaklık önemli ölçüde artarsa, entropi faktörü geçerli olacaktır. TΔS, o zaman reaksiyon artık kendiliğinden ilerlemeyecek ΔG>0.
Kimyasal termodinamiğin temel problemlerinden birini çözmek için - kendiliğinden süreçlerin temel olasılığını belirlemek için - nesnel bir nicel kritere sahip olmak gerekir. Yukarıda, çeşitli süreçlerde (kimyasal olanlar dahil) etki eden kuvvetlerin birbiriyle rekabet eden iki eğilim veya iki zıt faktör olduğu gösterilmiştir:
1. Sistemin en düşük enerjiye sahip duruma gitme arzusundan kaynaklanan enerji veya entalpi, örneğin p = const'ta entalpiyi düşürür (𝛥H< 0);
2. Sistemin maksimum düzensizlik derecesine sahip bir duruma geçme arzusundan kaynaklanan yapısal veya entropi, yani. entropiyi arttırır (𝛥S>0).
Tepkime sırasında düzensizlik derecesi değişmiyorsa (𝛥S=0), sürecin yönü entalpi değişimi ile belirlenir ve süreç azalan entalpi (𝛥H) yönünde kendiliğinden ilerler.< 0).
İşlem entalpi değişmeden gerçekleşirse (𝛥H=0), entropi reaksiyonun yönünü belirleyen faktördür ve işlem artış yönünde kendiliğinden artacaktır (𝛥S > 0).
Hem entalpi hem de entropi aynı anda değişirse, sürecin kendiliğinden akışının yönü toplam tarafından belirlenir. itici güç reaksiyonlar. Kendiliğinden bir reaksiyon, toplamın olduğu yönde ilerler. itici güç sistemler azalacak.
Bu iki zıt faktörün eşzamanlı etkisi göz önüne alındığında, sabit sıcaklık ve basınçta meydana gelen reaksiyonlar için böyle bir itici güç (durum fonksiyonu), izobarik-izotermal potansiyel veya serbest enerji olarak da adlandırılan Gibbs enerjisidir (G).
Kimyasal süreçlerin kendiliğinden akışının yönünü belirlemek için bir kriter olarak (p=sabit olduğunda, Gibbs enerjisindeki değişim 𝛥G veya
𝛥G=G 2 - G 1 (1.27)
Değişikliğinin işaretine bağlı olarak, üç durum mümkündür.
1. 𝛥G< 0, реакция термодинамически возможна.
Sabit sıcaklık ve basınçta, kimyasal reaksiyonlar sadece sistemdeki Gibbs enerjisinin azalması yönünde kendiliğinden ilerler (𝛥G< 0).
Bu hüküm, formülasyonlarından biri şu şekilde olan termodinamiğin ikinci yasasının temelini oluşturan minimum enerji ilkesiyle bağlantılıdır:
"Isı, daha az ısıtılmış bir gövdeden daha ısıtılmış bir gövdeye bağımsız olarak geçemez, yalnızca ters işlem kendiliğinden mümkündür."
2. 𝛥G > 0, reaksiyon termodinamik olarak imkansızdır;
3. 𝛥G = 0, hem doğrudan hem de ters reaksiyonlar termodinamik olarak mümkündür.
Gibbs enerjisinde bir değişikliğin olmaması, reaksiyon sisteminde kimyasal dengenin kurulması için termodinamik bir koşuldur.
Gibbs enerjisi entalpi, entropi ve sıcaklıkla aşağıdaki gibi ilişkilidir:
Gibbs enerjisindeki (𝛥G) değişim şu şekilde yazılır:
𝛥G = 𝛥Н – Т𝛥S (1.28)
1.28 denkleminden, kendiliğinden kimyasal reaksiyon olasılığının, 𝛥Н ve Т𝛥S değerlerinin oranına bağlı olduğunu takip eder. Bu durumda, dört ana durum mümkündür:
1. Eğer 𝛥Н< 0, а 𝛥S >0, o zaman Gibbs enerjisi her zaman negatif olacaktır (𝛥G< 0). Такие реакции термодинамически возможны при любой температуре.
2. 𝛥Н > 0 ve 𝛥S ise< 0, то всегда 𝛥G >0. Bu tür reaksiyonlar, herhangi bir sıcaklıkta termodinamik olarak imkansızdır.
3. Eğer 𝛥Н > 0 ve 𝛥S > 0 ise, reaksiyon sadece yüksek sıcaklıklarda, | 𝛥Н |< | Т𝛥S |.
4. Eğer 𝛥Н<0 и 𝛥S <0, то реакция возможна при низких температурах, когда | 𝛥Н | >| TÖS |.
Diğer termodinamik fonksiyonlarda olduğu gibi, çeşitli termodinamik hesaplamaları gerçekleştirmek için özel bir konsept sunulmuştur: bir maddenin oluşumunun standart Gibbs enerjisi (𝛥G° numunesi 298). Bu, katılan tüm maddeler standart durumdayken ve reaksiyon standart koşullar altında (genellikle kJ cinsinden ölçülür) gerçekleştiğinde, karşılık gelen basit maddelerden bir mol bileşik oluşumunun reaksiyonunda Gibbs enerjisindeki değişikliktir. / mol). Burada:
Basit maddelerin oluşum standart Gibbs enerjisi koşullu olarak sıfıra eşit alınır.
Referans kitapları genellikle 298 K'da bir maddenin standart Gibbs oluşum enerjilerinin değerlerini verir. 𝛥H ve 𝛥S değerlerini bilerek, 𝛥G değerini diğer sıcaklıklarda hesaplayabilir ve buna göre olasılık veya kendiliğinden bir reaksiyonun imkansızlığı.
Gibbs enerjisi, sistemin durumunun bir fonksiyonudur. Bu nedenle, belirli bir kimyasal reaksiyonun seyrindeki değişimi, yalnızca ilk maddelerin ve reaksiyon ürünlerinin doğasına, fiziksel veya toplu durumuna, miktarlarına bağlıdır ve reaksiyonun ara aşamalarına veya verilen reaksiyon sisteminin nasıl olduğuna bağlı değildir. son duruma ulaştı, yani.
Toplarken, katılan tüm maddelerin mol sayısı (v) mutlaka dikkate alınır.
örnek 1. Hesaplamak  standart oluşum ısılarına dayanan reaksiyon.
standart oluşum ısılarına dayanan reaksiyon.






