H kimyasal bağ. Kimyasal bir bağın özellikleri
Her atomun belirli sayıda elektronu vardır.
Girmek kimyasal reaksiyonlar atomlar en kararlı elektronik konfigürasyona ulaşarak elektronları bağışlar, alır veya sosyalleştirir. En düşük enerjili konfigürasyon en kararlı olanıdır (soy gaz atomlarında olduğu gibi). Bu modele "sekizli kural" denir (Şekil 1).
Pirinç. bir.
Bu kural herkes için geçerlidir bağlantı türleri. elektronik iletişim atomlar arasında, en basit kristallerden nihai olarak canlı sistemler oluşturan karmaşık biyomoleküllere kadar kararlı yapılar oluşturmalarına izin verir. Sürekli metabolizmalarında kristallerden farklıdırlar. Bununla birlikte, birçok kimyasal reaksiyon mekanizmalara göre ilerler. elektronik aktarım vücuttaki enerji süreçlerinde önemli bir rol oynayan .
Kimyasal bağ, iki veya daha fazla atomu, iyonu, molekülü veya bunların herhangi bir kombinasyonunu bir arada tutan bir kuvvettir..
Doğa Kimyasal bağ evrensel: atomların dış kabuğundaki elektronların konfigürasyonu tarafından belirlenen, negatif yüklü elektronlar ile pozitif yüklü çekirdekler arasındaki elektrostatik çekim kuvvetidir. Bir atomun kimyasal bağ oluşturma yeteneğine denir. değerlik, veya paslanma durumu. kavramı değerlik elektronları - kimyasal bağlar oluşturan elektronlar, yani en yüksek enerjili orbitallerde bulunanlar. Buna göre, bu orbitalleri içeren bir atomun dış kabuğuna denir. değerlik kabuğu. Şu anda, kimyasal bir bağın varlığını belirtmek yeterli değildir, ancak türünü netleştirmek gerekir: iyonik, kovalent, dipol-dipol, metalik.
İlk bağlantı türü,iyonik bağ
Lewis ve Kossel'in elektronik değerlik teorisine göre, atomlar iki şekilde kararlı bir elektronik konfigürasyon elde edebilirler: Birincisi, elektronları kaybederek, katyonlar ikincisi, onları elde etmek, dönüştürmek anyonlar. Elektron transferinin bir sonucu olarak, zıt işaretli iyonlar arasındaki elektrostatik çekim kuvveti nedeniyle, Kossel adı verilen kimyasal bir bağ oluşur " elektrovalent(Şimdi çağırdı iyonik).
Bu durumda, anyonlar ve katyonlar, doldurulmuş bir dış elektron kabuğu ile kararlı bir elektronik konfigürasyon oluşturur. Tipik iyonik bağlar, periyodik sistemin T ve II gruplarının katyonlarından ve VI ve VII gruplarının metalik olmayan elementlerinin anyonlarından (sırasıyla 16 ve 17 alt grup -, kalkojenler ve halojenler). İyonik bileşiklerdeki bağlar doymamış ve yönsüzdür, bu nedenle diğer iyonlarla elektrostatik etkileşim olasılığını korurlar. Şek. 2 ve 3, Kossel elektron taşıma modeline karşılık gelen iyonik bağ örneklerini göstermektedir.
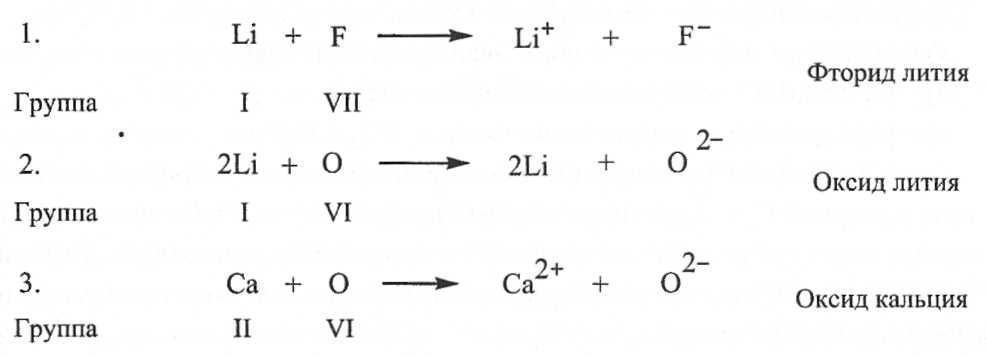
Pirinç. 2.
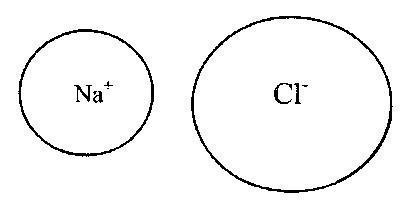
Pirinç. 3. Sodyum klorür (NaCl) molekülündeki iyonik bağ
Burada maddelerin doğadaki davranışlarını açıklayan bazı özellikleri hatırlamak, özellikle de madde kavramını dikkate almak uygun olacaktır. asitler ve zemin.
Tüm bu maddelerin sulu çözeltileri elektrolitlerdir. Farklı şekillerde renk değiştirirler. göstergeler. Göstergelerin etki mekanizması F.V. Ostwald. Göstergelerin, rengi ayrışmamış ve ayrışmış durumlarda farklı olan zayıf asitler veya bazlar olduğunu gösterdi.
Bazlar asitleri nötralize edebilir. Tüm bazlar suda çözünür değildir (örneğin, -OH grupları içermeyen bazı organik bileşikler çözünmezdir, özellikle, trietilamin N (C2H 5) 3); çözünür bazlar denir alkaliler.
Asitlerin sulu çözeltileri karakteristik reaksiyonlara girer:
a) metal oksitlerle - tuz ve su oluşumu ile;
b) metallerle - tuz ve hidrojen oluşumuyla;
c) karbonatlarla - tuz oluşumuyla, CO 2 ve H 2 Ö.
Asitlerin ve bazların özellikleri çeşitli teorilerle açıklanmıştır. S.A.'nın teorisine göre. Arrhenius, bir asit iyonları oluşturmak üzere ayrışan bir maddedir H+ , baz iyon oluştururken O- . Bu teori, hidroksil grupları olmayan organik bazların varlığını hesaba katmaz.
Doğrultusunda proton Bronsted ve Lowry'nin teorisine göre asit, proton veren moleküller veya iyonlar içeren bir maddedir. bağışçılar protonlar) ve baz, protonları kabul eden moleküller veya iyonlardan oluşan bir maddedir ( alıcılar protonlar). Sulu çözeltilerde, hidrojen iyonlarının hidratlı bir formda, yani hidronyum iyonları formunda bulunduğunu unutmayın. H3O+ . Bu teori, sadece su ve hidroksit iyonları ile değil, aynı zamanda bir çözücünün yokluğunda veya susuz bir çözücü ile gerçekleştirilen reaksiyonları da açıklar.
Örneğin, amonyak arasındaki reaksiyonda NH Gaz fazında 3 (zayıf baz) ve hidrojen klorür, katı amonyum klorür oluşur ve iki maddenin denge karışımında her zaman ikisi asit ve diğer ikisi baz olan 4 parçacık vardır:
Bu denge karışımı, iki konjuge asit ve baz çiftinden oluşur:
1)NH 4+ ve NH 3
2) HCl ve Cl ‑
Burada, her bir konjuge çiftte asit ve baz bir proton kadar farklıdır. Her asidin bir eşlenik bazı vardır. Güçlü bir asit, zayıf bir eşlenik bazına sahiptir ve zayıf bir asit, güçlü bir eşlenik bazına sahiptir.
Bronsted-Lowry teorisi, biyosferin yaşamı için suyun benzersiz rolünü açıklamayı mümkün kılar. Su, kendisiyle etkileşime giren maddeye bağlı olarak, bir asit veya bir bazın özelliklerini gösterebilir. Örneğin, sulu asetik asit çözeltileri ile reaksiyonlarda su bir bazdır ve sulu amonyak çözeltileri ile bir asittir.
1) CH3 COOH + H2O ↔ H3O + + CH 3 SOO- . Burada, bir asetik asit molekülü, bir su molekülüne bir proton bağışlar;
2) NH3 + H2O ↔ NH4 + + O- . Burada amonyak molekülü, su molekülünden bir proton alır.
Böylece su iki konjuge çift oluşturabilir:
1) H2O(asit) ve O- (eşlenik taban)
2) H3O+ (asit) ve H2O(eşlenik taban).
İlk durumda, su bir proton bağışlar ve ikincisinde onu kabul eder.
Böyle bir özellik denir amfiprotonite. Hem asit hem de baz olarak tepkimeye girebilen maddelere denir amfoterik. Bu tür maddeler genellikle doğada bulunur. Örneğin, amino asitler hem asitler hem de bazlarla tuzlar oluşturabilir. Bu nedenle peptitler, mevcut metal iyonları ile kolayca koordinasyon bileşikleri oluşturur.
Bu nedenle, bir iyonik bağın karakteristik özelliği, bir grup bağlayıcı elektronun çekirdeklerden birine tamamen yer değiştirmesidir. Bu, iyonlar arasında elektron yoğunluğunun neredeyse sıfır olduğu bir bölge olduğu anlamına gelir.
İkinci bağlantı türü isekovalent bağ
Atomlar kararlı hale gelebilir elektronik konfigürasyonlar elektronları paylaşarak.
Böyle bir bağ, bir çift elektron birer birer paylaşıldığında oluşur. herbirinden atom. Bu durumda, sosyalleşmiş bağ elektronları atomlar arasında eşit olarak dağıtılır. Kovalent bağa bir örnek homonükleer iki atomlu H molekülleri 2 , N 2 , F 2. Allotroplar aynı tip bağa sahiptir. Ö 2 ve ozon Ö 3 ve çok atomlu bir molekül için S 8 ve ayrıca heteronükleer moleküller hidrojen klorür HCl, karbon dioksit CO 2, metan CH 4, etanol İTİBAREN 2 H 5 O, sülfür hekzaflorid bilimkurgu 6, asetilen İTİBAREN 2 H 2. Bütün bu moleküller aynı ortak elektronlara sahiptir ve bağları aynı şekilde doyurulur ve yönlendirilir (Şekil 4).
Biyologlar için, ikili ve üçlü bağlardaki atomların kovalent yarıçaplarının tek bir bağa kıyasla azaltılması önemlidir.
![]()
Pirinç. dört. Cl 2 molekülünde kovalent bağ.
İyonik ve kovalent bağ türleri, kümenin iki sınırlayıcı durumudur. mevcut tipler kimyasal bağlardır ve pratikte bağların çoğu orta düzeydedir.
Mendeleev sisteminin aynı veya farklı periyotlarının karşıt uçlarında bulunan iki elementin bileşikleri ağırlıklı olarak iyonik bağlar oluşturur. Elementler bir periyotta birbirine yaklaştıkça bileşiklerinin iyonik yapısı azalırken kovalent karakter artar. Örneğin, periyodik tablonun sol tarafındaki elementlerin halojenürleri ve oksitleri, ağırlıklı olarak iyonik bağlar oluşturur ( NaCl, AgBr, BaSO 4 , CaCO 3 , KNO 3 , CaO, NaOH) ve tablonun sağ tarafındaki elementlerin aynı bileşikleri kovalenttir ( H 2 O, CO 2, NH 3, NO 2, CH 4, fenol C6H5OH, glikoz C6H12O6, etanol C2H5OH).
Kovalent bağ, sırayla, başka bir modifikasyona sahiptir.
Çok atomlu iyonlarda ve karmaşık biyolojik moleküllerde, her iki elektron da yalnızca bir atom. denir bağışçı elektron çifti. Bu elektron çiftini bir verici ile sosyalleştiren atoma denir. akseptör elektron çifti. Bu tür kovalent bağ denir koordinasyon (bağışçı-kabul eden, veyatarih) iletişim(Şek. 5). Metabolizma için en önemli d-elementlerinin kimyası büyük ölçüde koordinasyon bağları ile tanımlandığından, bu tür bir bağ biyoloji ve tıp için çok önemlidir.
![]()
resim 5.
Kural olarak, karmaşık bir bileşikte, bir metal atomu bir elektron çifti alıcısı olarak hareket eder; aksine iyonik ve kovalent bağlarda metal atomu elektron vericidir.
Kovalent bağın özü ve çeşitliliği - koordinasyon bağı - GN tarafından önerilen başka bir asit ve baz teorisi yardımıyla açıklığa kavuşturulabilir. Lewis. Bronsted-Lowry teorisine göre "asit" ve "baz" terimlerinin anlamsal kavramını biraz genişletti. Lewis teorisi, kompleks iyonların oluşumunun doğasını ve maddelerin nükleofilik ikame reaksiyonlarına, yani CS oluşumuna katılımını açıklar.
Lewis'e göre asit, bir bazdan bir elektron çifti alarak kovalent bağ oluşturabilen bir maddedir. Bir Lewis bazı, elektron vererek Lewis asidi ile kovalent bir bağ oluşturan yalnız bir çift elektrona sahip bir maddedir.
Yani, Lewis teorisi, asit-baz reaksiyonlarının aralığını, protonların hiç katılmadığı reaksiyonlara da genişletir. Ayrıca, bu teoriye göre protonun kendisi de bir asittir, çünkü bir elektron çiftini kabul edebilir.
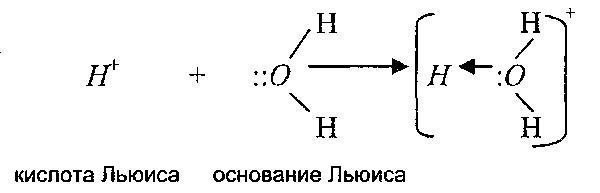
Dolayısıyla bu teoriye göre katyonlar Lewis asitleri ve anyonlar Lewis bazlarıdır. Aşağıdaki reaksiyonlar örnektir:
Yukarıda, kovalent moleküllerde metal atomlarından alıcı atomlara bir elektronun tam aktarımı olmadığından, maddelerin iyonik ve kovalent olanlara bölünmesinin göreceli olduğu belirtilmişti. İyonik bağa sahip bileşiklerde, her iyon zıt işaretli iyonların elektrik alanındadır, bu nedenle karşılıklı olarak polarize olurlar ve kabukları deforme olur.
Polarize edilebilirlik belirlenen elektronik yapı, iyonun yükü ve boyutu; anyonlar için katyonlardan daha yüksektir. Katyonlar arasında en yüksek polarize edilebilirlik, daha büyük yüke ve daha küçük boyuta sahip katyonlar içindir, örneğin, Hg 2+ , Cd 2+ , Pb 2+ , Al 3+ , Tl 3+. Güçlü bir polarize edici etkiye sahiptir H+ . İyon polarizasyonunun etkisi iki yönlü olduğu için oluşturdukları bileşiklerin özelliklerini önemli ölçüde değiştirir.
Üçüncü bağlantı türü,dipol-dipol bağ
Listelenen iletişim türlerine ek olarak, dipol-dipol de vardır. moleküller arası etkileşimler olarak da bilinir van der Waals .
Bu etkileşimlerin gücü, moleküllerin doğasına bağlıdır.
Üç tür etkileşim vardır: kalıcı dipol - kalıcı dipol ( dipol-dipol cazibe); kalıcı dipol - indüklenmiş dipol ( indüksiyon cazibe); anlık dipol - indüklenmiş dipol ( dağılım cazibe veya Londra kuvvetleri; pilav. 6).

Pirinç. 6.
Sadece polar kovalent bağlara sahip moleküller bir dipol-dipol momentine sahiptir ( HCl, NH3, SO2, H20, C6H5Cl) ve bağ gücü 1-2 hoşçakal(1D \u003d 3.338 × 10 -30 coulomb metre - C × m).
Biyokimyada başka bir bağ türü ayırt edilir - hidrojen sınırlayıcı bir durum olan bağlantı dipol-dipol cazibe. Bu bağ, bir hidrojen atomu ile küçük bir elektronegatif atom, çoğunlukla oksijen, flor ve nitrojen arasındaki çekim ile oluşur. Benzer elektronegatifliğe sahip büyük atomlarda (örneğin, klor ve kükürt ile), hidrojen bağı çok daha zayıftır. Hidrojen atomu bir temel özellik ile ayırt edilir: bağlayıcı elektronlar çekildiğinde, çekirdeği - proton - açığa çıkar ve elektronlar tarafından taranmayı bırakır.
Bu nedenle atom büyük bir dipole dönüşür.
Van der Waals bağından farklı olarak bir hidrojen bağı, yalnızca moleküller arası etkileşimler sırasında değil, aynı zamanda bir molekül içinde de oluşur - moleküliçi hidrojen bağı. Hidrojen bağları biyokimyada önemli bir rol oynar, örneğin proteinlerin yapısını bir a-sarmal formunda stabilize etmek veya bir DNA çift sarmalının oluşumu için (Şekil 7).
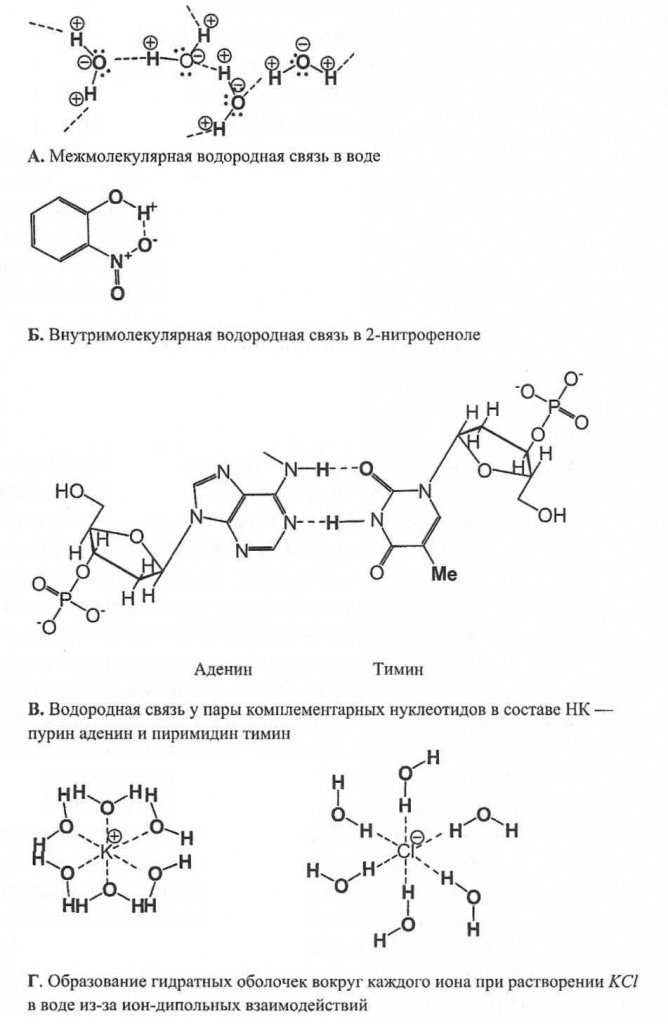
Şekil 7.
Hidrojen ve van der Waals bağları iyonik, kovalent ve koordinasyon bağlarından çok daha zayıftır. Moleküller arası bağların enerjisi Tabloda belirtilmiştir. bir.
Tablo 1. Moleküller arası kuvvetlerin enerjisi
Not: Moleküller arası etkileşimlerin derecesi, erime ve buharlaşma (kaynama) entalpisini yansıtır. İyonik bileşikler, iyonları ayırmak için molekülleri ayırmaktan çok daha fazla enerji gerektirir. İyonik bileşiklerin erime entalpileri moleküler bileşiklerden çok daha yüksektir.
Dördüncü bağlantı türü -metalik bağ
Son olarak, moleküller arası bağların başka bir türü daha vardır - metal: bağ pozitif iyonlar serbest elektronlu metal kafesler. Bu tür bir bağlantı biyolojik nesnelerde oluşmaz.
İtibaren genel bakış bağ türleri, bir ayrıntı açıklığa kavuşturulmuştur: bir metal atomunun veya iyonunun önemli bir parametresi - bir elektron donörü ve bir atom - bir elektron alıcısı onun boyut.
Ayrıntılara girmeden, periyodik sistem gruplarında atom numaraları arttıkça atomların kovalent yarıçaplarının, metallerin iyonik yarıçaplarının ve etkileşen moleküllerin van der Waals yarıçaplarının arttığını not ediyoruz. Bu durumda iyon yarıçaplarının değerleri en küçüktür ve van der Waals yarıçapları en büyüktür. Kural olarak, grupta aşağı doğru hareket ederken, hem kovalent hem de van der Waals olmak üzere tüm öğelerin yarıçapları artar.
Biyologlar ve doktorlar için en önemli Koordinasyon(donör-kabul eden) koordinasyon kimyası tarafından dikkate alınan bağlar.
Tıbbi biyoinorganikler. G.K. Baraşkov
İki veya daha fazla atomdan oluşan kimyasal parçacıklara denir. moleküller(gerçek veya koşullu formül birimleri çok atomlu maddeler). Moleküllerdeki atomlar kimyasal olarak bağlanmıştır.
Kimyasal bağ ile kastedilen elektrik kuvvetleri parçacıkları bir arada tutan çekim. Her bir kimyasal bağ yapısal formüller görünür değerlik çizgisi,örneğin:
H - H (iki hidrojen atomu arasındaki bağ);
H3N - H+ (amonyak molekülünün nitrojen atomu ile hidrojen katyonu arasındaki bağ);
(K +) - (I -) (potasyum katyonu ve iyodür iyonu arasındaki bağ).
Kimyasal bir bağ, karmaşık parçacıkların (moleküller, kompleks iyonlar) elektronik formüllerinde genellikle kendi paylaşılmamış elektron atom çiftlerinin aksine bir değerlik çizgisi ile değiştirilen bir çift elektron ( ) tarafından oluşturulur, örneğin:
Kimyasal bağ denir kovalent eğer her iki atom tarafından bir çift elektronun sosyalleşmesiyle oluşuyorsa.
F 2 molekülünde, her iki flor atomu da aynı elektronegatifliğe sahiptir, bu nedenle bir elektron çiftine sahip olmak onlar için aynıdır. Böyle bir kimyasal bağa polar olmayan denir, çünkü her bir flor atomunun elektron yoğunluğu içinde aynı elektronik formül moleküller şartlı olarak aralarında eşit olarak bölünebilir:
HCl molekülünde kimyasal bağ zaten kutup, klor atomundaki elektron yoğunluğu (daha yüksek elektronegatifliğe sahip bir element) hidrojen atomundan çok daha yüksek olduğundan:
Bir kovalent bağ, örneğin H - H, iki nötr atomun elektronlarını paylaşarak oluşturulabilir:
H + H > H - H
Bu bağlanma mekanizmasına denir değiş tokuş veya eşdeğer.
Başka bir mekanizmaya göre, aynı H - H kovalent bağı, H hidrit iyonunun elektron çifti H + hidrojen katyonu ile sosyalleştiğinde ortaya çıkar:
H + + (:H) - > H - H
Bu durumda H + katyonu denir akseptör ve anyon H - bağışçı elektron çifti. Bu durumda bir kovalent bağ oluşum mekanizması olacaktır. donör-kabul eden, veya koordine etmek.
Tekli bağlar (H - H, F - F, H - CI, H - N) denir a-bağlantılar, moleküllerin geometrik şeklini belirlerler.
Çift ve üçlü bağlar () bir a-bileşeni ve bir veya iki a-bileşeni içerir; Ana ve koşullu olarak ilk oluşturulan ?-bileşeni, her zaman ?-bileşenlerinden daha güçlüdür.
Kimyasal bir bağın fiziksel (aslında ölçülebilir) özellikleri, enerjisi, uzunluğu ve polaritesidir.
kimyasal bağ enerjisi (E cv) bu bağın oluşumu sırasında açığa çıkan ve onu kırmak için harcanan ısıdır. Aynı atomlar için tek bir bağ her zaman daha zayıf birden fazla (çift, üçlü).
Kimyasal bağ uzunluğu (ben s) - nükleer mesafe. Aynı atomlar için tek bir bağ her zaman uzun birden fazla.
Polarite iletişim ölçülür elektrik dipol momenti p- gerçek bir elektrik yükünün (belirli bir bağın atomları üzerinde) dipol uzunluğu (yani bağın uzunluğu) ile çarpımı. Dipol momenti ne kadar büyük olursa, bağın polaritesi o kadar yüksek olur. Gerçek elektrik ücretleri bir kovalent bağdaki atomlar üzerinde her zaman elementlerin oksidasyon durumlarından daha az değerdedir, ancak işaret olarak çakışır; örneğin, H + I -Cl -I bağı için gerçek yükler H +0 "17 -Cl -0" 17'dir (bipolar parçacık veya dipol).
Moleküllerin polaritesi kompozisyonları ve geometrik şekilleri ile belirlenir.
Polar olmayan (p = O) olacak:
a) moleküller basit sadece polar olmayan kovalent bağlar içerdiklerinden maddeler;
b) çok atomlu moleküller zor maddeler, eğer geometrik şekilleri simetrik.
Örneğin, CO2, BF3 ve CH4 molekülleri, aşağıdaki eşit (uzunluk boyunca) bağ vektörlerine sahiptir:
Bağ vektörleri eklendiğinde, bunların toplamı her zaman yok olur ve moleküller bir bütün olarak polar bağlar içermelerine rağmen polar değildir.
Kutupsal (p> O) olacaktır:
a) iki atomlu moleküller zor maddeler, sadece polar bağlar içerdiklerinden;
b) çok atomlu moleküller zor maddeler, eğer yapıları asimetrik olarak yani, geometrik şekilleri eksik veya bozuktur, bu da örneğin NH3, H20, HNO3 ve HCN moleküllerinde toplam bir elektrik dipolün ortaya çıkmasına neden olur.
NH 4 + , SO 4 2- ve NO 3 - gibi kompleks iyonlar prensipte dipol olamazlar, sadece bir (pozitif veya negatif) yük taşırlar.
İyonik bağ katyonların ve anyonların elektrostatik çekimi sırasında, örneğin K + ve I - arasında bir çift elektronun neredeyse hiç sosyalleşmesi olmadan ortaya çıkar. Potasyum atomunun elektron yoğunluğu eksikliği vardır, iyot atomunun fazlalığı vardır. Bu bağlantı kabul edilir sınırlayıcı bir kovalent bağ durumunda, çünkü bir çift elektron pratikte anyonun mülkiyetindedir. Böyle bir bağlantı, tipik metallerin ve metal olmayanların (CsF, NaBr, CaO, K 2 S, Li 3 N) bileşikleri ve tuz sınıfındaki maddeler (NaNO 3, K 2 SO 4, CaCO 3) için en tipik olanıdır. Tüm bu bileşikler oda koşullarında kristalli maddeler bu birleştirmek yaygın isimiyonik kristaller(katyon ve anyonlardan oluşan kristaller).
denilen başka bir bağlantı türü var. metalik bağ, değerlik elektronlarının metal atomları tarafından o kadar gevşek bir şekilde tutulduğu ki, aslında belirli atomlara ait değiller.
Açıkça kendilerine ait olan dış elektronlar olmadan bırakılan metal atomları, olduğu gibi pozitif iyonlar haline gelir. oluştururlar metal kristal kafes. Sosyalleştirilmiş değerlik elektronları seti ( elektron gazı) pozitif metal iyonlarını bir arada ve belirli kafes bölgelerinde tutar.
İyonik ve metalik kristallere ek olarak, ayrıca nükleer ve moleküler sırasıyla atomların veya moleküllerin bulunduğu kafes bölgelerinde kristalli maddeler. Örnekler: elmas ve grafit - atomik kafesli kristaller, iyot I 2 ve karbondioksit CO2 (kuru buz) - moleküler kafesli kristaller.
Kimyasal bağlar yalnızca maddelerin moleküllerinin içinde değil, aynı zamanda örneğin sıvı HF, su H2O ve bir H2O + NH3 karışımı için moleküller arasında da oluşabilir:
hidrojen bağı en elektronegatif elementlerin atomlarını içeren polar moleküllerin elektrostatik çekim kuvvetleri nedeniyle oluşur - F, O, N. Örneğin, hidrojen bağları HF, H20 ve NH3'te bulunur, ancak HCl, H'de değildirler. 2 S ve PH 3.
Hidrojen bağları kararsızdır ve örneğin buz eridiğinde ve su kaynadığında oldukça kolay kırılır. Ancak, bu bağları kırmak için bir miktar ek enerji harcanır ve dolayısıyla hidrojen bağı olan maddelerin erime noktaları (Tablo 5) ve kaynama noktaları

(örneğin, HF ve H20), benzer maddelerden önemli ölçüde daha yüksektir, ancak hidrojen bağları yoktur (örneğin, sırasıyla HCl ve H2S).
Birçok organik bileşik ayrıca hidrojen bağları oluşturur; Hidrojen bağı biyolojik süreçlerde önemli bir rol oynar.
Kısım A atamalarına örnekler1. Sadece kovalent bağ içeren maddeler
1) SiH 4, Cl 2 O, CaBr 2
2) NF 3, NH4Cl, P2O 5
3) CH 4 , HNO3 , Na(CH30)
4) CCl 2 O, I 2, N 2 O
2–4. kovalent bağ
2. tek
3. çift
4. üçlü
maddede mevcut
5. Moleküllerde çoklu bağlar bulunur
6. Radikal denilen parçacıklar
7. Bağlardan biri, iyon setindeki donör-alıcı mekanizma tarafından oluşturulur.
1) SO4 2-, NH4 +
2) H3O+, NH4+
3) PO 4 3-, NO 3 -
4) PH 4 + , SO 3 2-
8. en dayanıklı ve kısa bağ - bir molekülde
9. Sadece iyonik bağları olan maddeler - sette
2) NH4Cl, SiCl4
10–13. Maddenin kristal örgüsü
13. Ba(OH)2
1) metal
3) nükleer
Bir bağın en önemli özellikleri şunları içerir: uzunluk, polarite, dipol momenti, doygunluk, yönlülük, kuvvet ve bağların çokluğu.
iletişim uzunluğu bir moleküldeki atomların çekirdekleri arasındaki mesafedir. Bağ uzunluğu, çekirdeklerin boyutuna ve elektron bulutlarının üst üste gelme derecesine göre belirlenir.
HF'de bağ uzunluğu 0.92∙10 -10, HCl'de - 1.28∙10 -10 m'dir.Kimyasal bağ ne kadar güçlü olursa, uzunluğu o kadar kısa olur.
Bağ açısı (Değer açısı) kimyasal olarak bağlı atomların çekirdeklerinden geçen hayali çizgiler arasındaki açıya denir. ∟HOH=104 0,5; ∟H2S \u003d 92.2 0; ∟H 2 S e \u003d 91 0.0.
Kimyasal bir bağın en önemli özelliği, enerji, onu tanımlayan kuvvet.
Nicel olarak, bir bağın gücü, onu kırmak için harcanan enerji ile karakterize edilir ve 1 mol madde başına kJ olarak ölçülür.
Bu nedenle, bağ kuvveti, süblimasyon enerjisini E subl nicel olarak karakterize eder. maddeler ve bir molekülün atomlarına ayrışma enerjisi E diss. . Süblimleşme enerjisi, bir maddenin başka bir maddeden geçişi için harcanan enerji olarak anlaşılır. katı hal gaz halinde. İki atomlu moleküller için bağlanma enerjisi, molekülün iki atoma ayrılma enerjisine eşittir.
Örneğin, E diss. (ve dolayısıyla E St.) H2 molekülündeki 435 kJ/mol'dür. F 2 \u003d 159 kJ / mol molekülünde, N 2 \u003d 940 kJ / mol molekülünde.
AB tipi iki atomlu değil, çok atomlu moleküller için n, ortalama bağlanma enerjisidir.
AB n \u003d A + nB nedeniyle.
Örneğin, süreçte emilen enerji
924 kJ/mol'e eşittir.
bağ enerjisi
EOH = = = = 462 kJ/mol.
Moleküllerin yapısı ve bir maddenin yapısı hakkında farklı yöntemlerle elde edilen sonuçlara göre çıkarım yapılır. Bu durumda, elde edilen bilgiler yalnızca bağların uzunlukları ve enerjileri, bağ açıları hakkında değil, aynı zamanda örneğin manyetik, optik, elektrik, termal ve diğerleri gibi maddenin diğer özellikleri hakkında da kullanılır.
Bir maddenin yapısı hakkında deneysel olarak elde edilen verilerin toplamı, kuantum-mekanik kimyasal bağ teorisi kavramını kullanan kuantum-kimyasal hesaplama yöntemlerinin sonuçlarını tamamlar ve genelleştirir. Kimyasal bağın esas olarak değerlik elektronları tarafından gerçekleştirildiğine inanılmaktadır. s ve p elementleri için değerlik elektronları dış katmanın yörüngeleridir ve d elementleri için dış katmanın s-orbitalinin elektronları ve ön dış katmanın d-orbitalidir.
Kimyasal bağın doğası.
Kimyasal bir bağ ancak atomlar birbirine yaklaştığında oluşur. toplam enerji sistem (E kin. + E pot.) azalır.
Moleküler hidrojen iyonu H2+ örneğini kullanarak kimyasal bağın doğasını düşünün. (H2 hidrojen moleküllerinin elektronlarla ışınlanmasıyla elde edilir; bir gaz deşarjında). Böyle basit bir moleküler sistem için Schrödinger denklemi en doğru şekilde çözülür.
Hidrojen iyonunda H 2 + bir elektron iki çekirdek - proton alanında hareket eder. Çekirdekler arasındaki mesafe 0.106 nm, bağlanma enerjisi (H atomlarına ve H + iyonlarına ayrışma) 255,7 kJ/mol'dür. Yani parçacık güçlüdür.
AT moleküler iyon H 2 + iki tip elektrostatik kuvvet etki eder - elektronun her iki çekirdeğe olan çekim kuvvetleri ve çekirdekler arasındaki itme kuvvetleri. İtme kuvveti, aşağıdaki şekilde temsil edilebilecek pozitif yüklü çekirdekler H A + ve H A + arasında kendini gösterir. 3. İtme kuvveti, çekirdekleri birbirinden ayırma eğilimindedir.

Pirinç. 3. İki çekirdek arasındaki, atomların büyüklük sırasına göre mesafelerde yaklaştıklarında ortaya çıkan itme (a) ve çekim (b) kuvveti.
Çekici kuvvetler, negatif yüklü elektron e - ile pozitif yüklü çekirdekler H + ve H + arasında hareket eder. Çekim ve itme kuvvetlerinin bileşkesi sıfır ise bir molekül oluşur, yani çekirdeklerin karşılıklı itmesi elektronun çekirdeğe olan çekimi ile telafi edilmelidir. Bu tür bir telafi, elektronun e - çekirdeğe göre konumuna bağlıdır (Şekil 3 b ve c). Burada (belirlenemeyen) bir elektronun uzaydaki konumunu değil, uzayda bir elektron bulma olasılığını kastediyoruz. Elektron yoğunluğunun uzaydaki konumu, Şekil 1'e karşılık gelir. 3.b) çekirdeklerin yakınsamasına ve karşılık gelen şek. 3.c) - çekirdeklerin itilmesi, çünkü bu durumda çekim kuvvetleri bir yöne yönlendirilir ve çekirdeğin itmesi telafi edilmez. Böylece, elektron yoğunluğu çekirdekler arasında dağıtıldığında bir bağlanma bölgesi ve elektron yoğunluğu çekirdeklerin arkasına dağıtıldığında bir gevşeme veya anti-bağ bölgesi vardır.
Bir elektron bağ bölgesine girerse, kimyasal bir bağ oluşur. Elektron gevşeme bölgesine girerse kimyasal bağ oluşmaz.
Bağlanma bölgesindeki elektron yoğunluğu dağılımının doğasına bağlı olarak, üç ana kimyasal bağ türü vardır: kovalent, iyonik ve metalik. Bu bağlar saf formlarında oluşmazlar ve genellikle bileşiklerde bu tip bağların bir kombinasyonu bulunur.
Bağlantı türleri.
Kimyada, aşağıdaki bağ türleri ayırt edilir: kovalent, iyonik, metalik, hidrojen bağları, van der Waals bağları, donör-alıcı bağları ve datif bağlar.
kovalent bağ
Bir kovalent bağ oluştuğunda, atomlar elektronları birbirleriyle paylaşır. Kovalent bağın bir örneği, bir Cl 2 molekülündeki kimyasal bağdır. Lewis (1916) ilk önce böyle bir bağda iki klor atomunun her birinin dış elektronlarından birini diğer klor atomuyla paylaştığını öne sürdü. Üst üste binmek için atomik yörüngeler iki atom mümkün olduğunca birbirine yaklaşmalıdır. Ortak bir elektron çifti kovalent bir bağ oluşturur. Bu elektronlar aynı yörüngeyi işgal eder ve spinleri zıt yönlere yönlendirilir.
Böylece, elektronların zıt spinlerle eşleşmesi sonucunda farklı atomlardan elektronların sosyalleşmesiyle kovalent bir bağ gerçekleştirilir.
Kovalent bağ, yaygın olarak kullanılan bir bağ türüdür. Kovalent bir bağ sadece moleküllerde değil, kristallerde de oluşabilir. Aynı atomlar arasında (H 2, Cl 2, elmas moleküllerinde) ve farklı atomlar arasında (H 2 O, NH 3 ...'de) oluşur.
Kovalent bir bağın oluşum mekanizması
H 2 molekülünün oluşum örneğini kullanarak mekanizmayı ele alalım.
H + H \u003d H 2, ∆H \u003d -436 kJ / mol
Serbest bir hidrojen atomunun çekirdeği, 1s elektronundan oluşan küresel simetrik bir elektron bulutu ile çevrilidir. Atomlar belirli bir mesafeye kadar birbirlerine yaklaştıklarında elektron bulutları (orbitalleri) kısmen örtüşür (Şekil 4).
Pirinç. 4. Hidrojen molekülünde bağ oluşum mekanizması.
Dokunmadan önce yaklaşan hidrojen atomlarının çekirdekleri arasındaki mesafe 0.106 nm ise, elektron bulutlarının çakışmasından sonra bu mesafe 0.074 nm'dir.
Sonuç olarak, çekirdekler arasındaki boşlukta maksimum elektron yoğunluğuna sahip olan çekirdek merkezleri arasında moleküler iki elektronlu bir bulut belirir. yoğunluk artışı negatif yükçekirdekler arasındaki çekim kuvvetlerinde güçlü bir artışı destekler, bu da enerjinin serbest kalmasına yol açar. Kimyasal bağ ne kadar güçlü olursa, elektron orbitallerinin örtüşmesi o kadar büyük olur. İki hidrojen atomu arasında kimyasal bir bağın oluşmasının bir sonucu olarak, her biri bir soy gaz atomunun - helyumun elektronik konfigürasyonuna ulaşır.
Sırasıyla elektron bulutlarının örtüşen bir bölgesinin oluşumunu ve bir kovalent bağ oluşumunu kuantum-mekanik bakış açısından açıklayan iki yöntem vardır. Bunlardan biri BC (değerlik bağları) yöntemi, diğeri ise MO (moleküler orbitaller) yöntemidir.
Değerlik bağları yönteminde, seçilen bir atom çiftinin atomik orbitallerinin örtüşmesi dikkate alınır. MO yönteminde molekül bir bütün olarak ele alınır ve elektron yoğunluğunun dağılımı (bir elektrondan) tüm moleküle yayılır. MO 2H'nin H2'deki konumundan, çekirdeklerin bu çekirdekler arasında bulunan elektron bulutuna çekiciliği nedeniyle bağlanır.
Bir kovalent bağın tasviri
Bağlantılar farklı şekillerde gösterilir:
bir). Elektronları nokta olarak kullanma
Bu durumda, bir hidrojen molekülünün oluşumu şema ile gösterilmiştir.
H∙ + H∙ → H: H
2). Kare hücreleri (yörüngeler) kullanmak, bir moleküler hücreye zıt dönüşlere sahip iki elektron yerleştirmek gibi kuantum hücresi

Bu diyagram, moleküler enerji seviyesinin başlangıçtaki atomik seviyelerden daha düşük olduğunu gösterir; bu, bir maddenin moleküler halinin atomik halinden daha kararlı olduğu anlamına gelir.
3). Bir kovalent bağ, bir çubuk ile temsil edilir.
Örneğin, N - N. bu özellik bir çift elektronu sembolize eder.
Atomlar arasında bir kovalent bağ oluşmuşsa (bir ortak elektron çifti), buna denir. bekar, eğer daha fazlaysa, o zaman bir çoklu çift(iki ortak elektron çifti), üçlü(üç ortak elektron çifti). Tek bir bağ bir çizgi, bir çift bağ iki ve üçlü bir bağ üç ile temsil edilir.
Atomlar arasındaki çizgi, genelleştirilmiş bir elektron çiftine sahip olduklarını gösterir.
Kovalent bağların sınıflandırılması
Üst üste binen elektron bulutlarının yönüne bağlı olarak, σ-, π-, δ-bağları ayırt edilir. σ-bağı, elektron bulutları, etkileşen atomların çekirdeklerini birbirine bağlayan eksen boyunca üst üste bindiğinde ortaya çıkar.
σ-bağ örnekleri:

Pirinç. 5. s-, p-, d- elektronları arasında bir σ-bağ oluşumu.
Bir hidrojen molekülünde s-s bulutları üst üste geldiğinde bir σ-bağı oluşumuna bir örnek.
π-bağ, eksenin her iki tarafında üst üste binen elektron bulutları ile atom çekirdeklerini birbirine bağlayarak gerçekleştirilir.

Pirinç. 6. p-, d- elektronları arasında bir π-bağının oluşumu.
δ-bağı, paralel düzlemlerde bulunan iki d-elektron bulutunun üst üste gelmesiyle oluşur. δ bağı π bağından daha az güçlüdür ve π bağı σ bağından daha az güçlüdür.
Bir kovalent bağın özellikleri
a). Polarite.
İki tür kovalent bağ vardır: polar olmayan ve polar.
Polar olmayan bir kovalent bağ durumunda, ortak bir elektron çiftinin oluşturduğu elektron bulutu, atom çekirdeğine göre uzayda simetrik olarak dağıtılır. Bir örnek, bir elementin atomlarından oluşan iki atomlu moleküllerdir: H 2 , Cl 2 , O 2 , N 2 , F 2 . Elektron çiftleri eşit olarak her iki atoma da aittir.
Bir polar bağ durumunda, bağı oluşturan elektron bulutu, göreceli elektronegatifliği daha yüksek olan atoma doğru yer değiştirir.
Örnekler moleküllerdir: HCl, H2O, H2S, N2S, NH3, vb. Aşağıdaki şema ile temsil edilebilen HCl molekülünün oluşumunu düşünün.
![]()
Elektron çifti klor atomuna kaydırılır, çünkü klor atomunun (2.83) bağıl elektronegatifliği hidrojen atomununkinden (2.1) daha büyüktür.
b). doygunluk
Atomların sınırlı sayıda kovalent bağ oluşumuna katılma yeteneğine kovalent bağın doygunluğu denir. Kovalent bağların doygunluğu, kimyasal etkileşim sadece dış elektronlar dahil enerji seviyeleri yani sınırlı sayıda elektron.
içinde) . Oryantasyon ve kovalent bağın hibridizasyonu.
Bir kovalent bağ, uzayda yönelim ile karakterize edilir. Bu, elektron bulutlarının belirli bir şekle sahip olması ve belirli bir uzaysal yönelim ile maksimum örtüşmelerinin mümkün olması ile açıklanmaktadır.
Kovalent bağın yönü moleküllerin geometrik yapısını belirler.
Örneğin, su için üçgen bir şekle sahiptir.
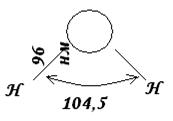
Pirinç. 7. Su molekülünün uzaysal yapısı.
H 2 O su molekülünde hidrojen ve oksijen çekirdekleri arasındaki mesafenin 0.096 nm (96 pm) olduğu deneysel olarak tespit edilmiştir. Çekirdeklerden geçen doğrular arasındaki açı 104,5 0'dır. Böylece su molekülü açısal bir şekle sahiptir ve yapısı sunulan şekil şeklinde ifade edilebilir.
hibridizasyon
Deneysel olarak ve teorik çalışmalar(Slater, Pauling) BeCl 2 , BeF 2 , BeBr 2 gibi bazı bileşiklerin oluşumu sırasında bir moleküldeki atomun değerlik elektronlarının durumu saf s-, p-, d-dalga fonksiyonları ile açıklanmaz. , ancak doğrusal kombinasyonları ile. Bu tür karışık yapılara hibrit orbitaller ve karıştırma işlemine hibridizasyon denir.
Kuantum-kimyasal hesaplamaların gösterdiği gibi, bir atomun s- ve p-orbitallerinin karıştırılması, bir molekülün oluşumu için uygun bir süreçtir. Bu durumda, saf s- ve p-orbitalleri içeren bağların oluşumundan daha fazla enerji açığa çıkar. Bu nedenle, bir atomun elektronik orbitallerinin hibridizasyonu, sistemin enerjisinde büyük bir azalmaya ve buna bağlı olarak molekülün stabilitesinde bir artışa yol açar. Hibritleştirilmiş bir yörünge, çekirdeğin bir tarafında diğerine göre daha uzundur. Bu nedenle, hibrit bulutun örtüşen bölgesindeki elektron yoğunluğu, ayrı ayrı s- ve p-orbitallerinin örtüşen bölgesindeki elektron yoğunluğundan daha büyük olacaktır, bunun sonucunda hibrit orbitalin elektronları tarafından oluşturulan bağ, daha fazla güç ile karakterizedir.
Birkaç tür hibrit durum vardır. S- ve p-orbitalleri hibritleştiğinde (sp hibridizasyonu olarak adlandırılır), birbirine göre 180 0'lık bir açıda bulunan iki hibrit yörünge ortaya çıkar. Bu durumda doğrusal bir yapı oluşur. Bu konfigürasyon (yapı), alkali toprak metal halojenürlerin çoğu için bilinir (örneğin, X=Cl, F, Br olan BeX2), yani. bağlantı açısı 180 0 С'dir.

Pirinç. 8. sp hibridizasyonu
Sp 2 hibridizasyonu (bir s ve iki p orbitalinden oluşan) adı verilen başka bir hibridizasyon türü, birbirine 120 0'lık bir açıyla yerleştirilmiş üç hibrit yörüngenin oluşumuna yol açar. Bu durumda, uzayda bir molekülün (veya normal bir üçgenin) üçgen yapısı oluşur. Bu tür yapılar, BX3 (X=Cl, F, Br) bileşikleri için bilinmektedir.



Pirinç. 9. sp 2 hibridizasyonu.
Bir s ve üç p orbitalinden oluşan sp 3 hibridizasyonu daha az yaygın değildir. Bu durumda, uzayda simetrik olarak tetrahedronun dört köşesine yönlendirilmiş dört hibrit yörünge oluşur, yani bunlar 109 0 28 "açıda bulunurlar. Bu uzamsal pozisyona tetrahedral denir. Böyle bir yapı için bilinir. NH 3, H 2 O molekülleri ve genel olarak II. periyodun elemanları için. Şematik olarak uzaydaki görünümü aşağıdaki şekilde gösterilebilir

Pirinç. 10. Amonyak molekülündeki bağların uzaysal düzenlenmesi,
bir uçağa yansıtılır.
sp 3 hibridizasyonu nedeniyle tetrahedral bağların oluşumu aşağıdaki gibi gösterilebilir (Şekil 11):
Pirinç. 11. sp3 hibridizasyonu sırasında tetrahedral bağların oluşumu.
Sp3 hibridizasyonu sırasında tetrahedral bağların oluşumu, Şek. 12.

Şekil 12. sp3 - CCl 4 moleküllerine hibridizasyon sırasında tetrahedral bağların oluşumu
Hibridizasyon sadece s- ve p-orbitalleri ile ilgili değildir. III'ün stereokimyasal elementlerini ve sonraki periyotları açıklamak için, s-, p-, d-orbitalleri de dahil olmak üzere aynı anda hibrit orbitaller oluşturmak gerekli hale gelir.
Kovalent bağ içeren maddeler şunları içerir:
1. organik bileşikler;
2. katı ve sıvı maddeler halojen atomu çiftleri arasında ve ayrıca hidrojen, azot ve oksijen atomu çiftleri arasında bağların oluşturulduğu, örneğin H2;
3. grup VI'nın elemanları (örneğin, tellür sarmal zincirleri), grup V'nin elemanları (örneğin, arsenik), grup IV'ün elemanları (elmas, silikon, germanyum);
4. Mendeleev'in periyodik tablosunda II-VI, III-V gruplarında kendilerini oluşturan elementler bulunduğunda 8-N kuralına uyan bileşikler (InSb, CdS, GaAs, CdTe gibi).
AT katılar kovalent bağ ile aynı madde için farklı olabilir kristal yapılar bağlanma enerjisi hemen hemen aynıdır. Örneğin ZnS yapısı kübik (çinko blend) veya altıgen (wurtzite) olabilir. Çinko blende ve wurtzite içindeki en yakın komşuların dizilimi aynıdır ve bu iki yapının enerjilerindeki tek ve küçük fark, en yakın atomları takip eden atomların dizilimi ile belirlenir. Bazı maddelerin bu yeteneğine allotropi veya polimorfizm denir. Allotropinin başka bir örneği, tamamen kübikten altıgene kadar çeşitli yapılarda çok sayıda politit içeren silisyum karbürdür. ZnS, SiC'nin bu sayısız kristal modifikasyonu oda sıcaklığında mevcuttur.
İyonik bağ
İyonik bağ, zıt yüklü iyonlar (yani + ve -) arasındaki elektrostatik bir çekim kuvvetidir.
İyonik bağ fikri, V. Kossel'in fikirleri temelinde oluşturulmuştur. (1916), iki atom etkileşime girdiğinde, birinin vazgeçtiğini ve diğerinin elektronları kabul ettiğini öne sürdü. Böylece, bir veya daha fazla elektronun bir atomdan diğerine aktarılması sonucu bir iyonik bağ oluşur. Örneğin, sodyum klorürde, bir elektronun bir sodyum atomundan bir klor atomuna aktarılmasının bir sonucu olarak bir iyonik bağ oluşur. Bu aktarım sonucunda +1 yüklü bir sodyum iyonu ve -1 yüklü bir klor iyonu oluşur. Elektrostatik kuvvetler tarafından birbirlerine çekilirler ve kararlı bir molekül oluştururlar. Kossel tarafından önerilen elektron transfer modeli, lityum florür, kalsiyum oksit ve lityum oksit gibi bileşiklerin oluşumunu açıklamayı mümkün kılmaktadır.
En tipik iyonik bileşikler, periyodik sistemin I ve II gruplarına ait metal katyonlarından ve VI ve VII gruplarına ait metalik olmayan elementlerin anyonlarından oluşur.
İyonik bir bileşiğin oluşum kolaylığı, onu oluşturan katyon ve anyonların oluşum kolaylığına bağlıdır. Elektron veren (elektron verici) atomun iyonlaşma enerjisi ne kadar düşükse, oluşum kolaylığı ne kadar yüksekse, elektron alan (elektron alıcı) atomun elektrona karşı ilgisi o kadar fazladır. Elektron ilgisi bir atomun bir elektronu kabul etme yeteneğinin bir ölçüsüdür. Kantitatif olarak, bir mol atomdan bir mol tek yüklü anyon oluştuğunda meydana gelen enerji değişikliği olarak tanımlanır. Bu, sözde "birinci elektron ilgisi" kavramıdır. İkinci elektron ilgisi, bir mol tek yüklü anyondan bir mol çift yüklü anyon oluştuğunda meydana gelen enerji değişimidir. Bu kavramlar, yani iyonlaşma enerjisi ve elektron ilgisi, gaz halindeki maddelere atıfta bulunur ve atom ve iyonların özellikleridir. gaz hali. Ancak çoğu iyonik bileşiğin katı halde en kararlı olduğu akılda tutulmalıdır. Bu durum, katı hallerinde bir kristal kafesin varlığı ile açıklanmaktadır. Bir soru ortaya çıktı. Sonuçta, iyonik bileşikler neden gaz halinde değil de kristal kafesler şeklinde daha kararlıdır? Bu sorunun cevabı, elektrostatik modele dayalı olarak kristal kafesin enerjisinin hesaplanmasıdır. Buna ek olarak, bu hesaplama aynı zamanda iyonik bağ teorisinin bir testidir.
Kristal kafesin enerjisini hesaplamak için, kristal kafesin gaz halindeki iyonların oluşumu ile yok edilmesi için harcanması gereken işi belirlemek gerekir. Hesaplama için çekim ve itme kuvvetleri kavramı kullanılır. Tek yüklü iyonların potansiyel etkileşim enerjisi ifadesi, çekim enerjisi ile itme enerjisinin toplanmasıyla elde edilir.
E \u003d E inc + E çıkışı (1).
E prit olarak, zıt işaretli iyonların Coulomb çekiminin enerjisi alınır, örneğin NaCl bileşiği için Na + ve Cl -
E int \u003d -e 2 / 4πε 0 r (2),
çünkü doldurulmuş elektron kabuğundaki elektronik yükün dağılımı küresel olarak simetriktir. Anyon ve katyonun dolu kabukları üst üste geldiğinde Pauli ilkesine bağlı olarak meydana gelen itme nedeniyle, iyonların yaklaşabileceği mesafe sınırlıdır. İtici enerji, çekirdekler arası mesafe ile hızla değişir ve aşağıdaki iki yaklaşık ifade olarak yazılabilir:
E otm \u003d A / r n (n≈12) (3)
E otm \u003d B ∙ exp (-r / ρ) (4),
A ve B sabit olduğunda, r iyonlar arasındaki mesafedir, ρ bir parametredir (karakteristik uzunluk).
Bu ifadelerin hiçbirinin itmeye yol açan karmaşık bir kuantum mekaniksel sürece karşılık gelmediğine dikkat edilmelidir.
Bu formüllerin yaklaşıklığına rağmen, NaCl, KCl, CaO gibi iyonik bileşiklerin moleküllerindeki kimyasal bağın doğru bir şekilde hesaplanmasına ve buna göre tanımlanmasına izin verirler.
İyonun elektrik alanı küresel simetriye sahip olduğundan (Şekil 13), kovalent bağın aksine iyonik bağın yönlülüğü yoktur. Zıt yüklü iki iyonun etkileşimi, yalnızca iyon çekirdeklerinin merkezlerini birleştiren yönde itici kuvvetler tarafından telafi edilir; diğer yönlerde, iyonların elektrik alanları telafi edilmez. Bu nedenle, diğer iyonlarla etkileşime girebilirler. Bu nedenle, iyonik bir bağın doygunluğu yoktur.
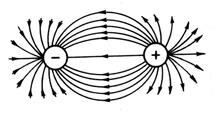
Pirinç. 13. Küresel simetri elektrostatik alan
zıt yüklü ücretler.
İyonik bağın yönsüzlüğü ve doymamışlığı nedeniyle, her bir iyon tarafından çevrelendiğinde enerjik olarak en uygunudur. azami sayı zıt işaretli iyonlar. Bundan dolayı, bir iyonik bileşiğin en çok tercih edilen varoluş biçimi bir kristaldir. Örneğin, bir NaCl kristalinde, her katyonun en yakın komşuları olarak altı anyonu vardır.
Yalnızca yüksek sıcaklıklar gaz halinde, iyonik bileşikler, ilişkisiz moleküller şeklinde bulunur.
İyonik bileşiklerde koordinasyon sayısı, kovalent bileşiklerde olduğu gibi atomların elektronik yapısının özelliklerine bağlı değildir, ancak iyonların boyutlarının oranı ile belirlenir. 0,41 - 0,73 aralığında bir iyonik yarıçap oranı ile, 0,73-1,37 - kübik koordinasyon, vb. oranında iyonların oktahedral koordinasyonu gözlenir.
Bu nedenle, normal koşullar altında iyonik bileşikler kristalli maddelerdir. İki iyonlu molekül kavramı, örneğin NaCL, CsCl, onlar için geçerli değildir. Her kristal çok sayıda iyondan oluşur.
İyonik bir bağ, bir atomun etkin yükünün birliğe yakın olduğu sınırlayıcı bir polar bağ olarak temsil edilebilir. Tamamen kovalent polar olmayan bir bağ için atomların etkin yükü sıfırdır. Gerçek maddelerde tamamen iyonik ve tamamen kovalent bağlar nadirdir. Çoğu bileşik, polar olmayan kovalent ve polar iyonik arasındaki bağın bir ara yapısına sahiptir. Yani bu bileşiklerde kovalent bağ kısmen iyonik karaktere sahiptir. Gerçek maddelerdeki iyonik ve kovalent bağların doğası Şekil 14'te gösterilmiştir.

Pirinç. 14. Bağın iyonik ve kovalent doğası.
Bağın iyonik doğasının oranına iyoniklik derecesi denir. Moleküldeki atomların etkin yükleri ile karakterize edilir. İyoniklik derecesi, kurucu atomlarının elektronegatifliğindeki farkın artmasıyla artar.
metal bağlantı
Metal atomlarında, dış değerlik elektronları metal olmayan atomlardan çok daha zayıf tutulur. Bu, elektronların yeterince uzun bir süre boyunca bireysel atomlarla bağlantısının kaybolmasına ve sosyalleşmelerine neden olur. Sosyalleşmiş bir dış elektron topluluğu oluşur. Böyle bir elektronik sistemin varlığı, pozitif metal iyonlarını benzer yüklerine rağmen yakın durumda tutan kuvvetlerin ortaya çıkmasına neden olur. Böyle bir bağa metalik bağ denir. Böyle bir bağ sadece bir metalin karakteristiğidir ve katı halde bulunur. sıvı hal maddeler. Metalik bağ, bir tür kimyasal bağdır. Atomla bağlantılarını kaybeden ve bu nedenle serbest elektronlar olarak adlandırılan dış elektronların sosyalleşmesine dayanır (Şekil 15).
Pirinç. 15. Metal bağlantı.
Aşağıdaki gerçekler metalik bir bağın varlığını doğrulamaktadır. Tüm metaller, serbest elektronların varlığıyla sağlanan yüksek termal iletkenliğe ve yüksek elektrik iletkenliğine sahiptir. Ek olarak, aynı durum, metallerin ışık ışımasına karşı iyi yansıtıcılığını, parlaklıklarını ve opaklıklarını, yüksek plastisitelerini ve pozitif sıcaklık elektrik direnci katsayısını belirler.
Metallerin kristal kafesinin kararlılığı, iyonik ve kovalent gibi bağlarla açıklanamaz. Kristal kafesin düğümlerinde bulunan metal atomları arasında aynı yüke sahip oldukları için iyonik bağ imkansızdır. Metal atomları arasında bir kovalent bağ da olası değildir, çünkü her atomun en yakın 8 ila 12 komşusu vardır ve bu kadar çok ortak elektron çifti ile kovalent bağların oluşumu bilinmemektedir.
Metal yapılar, oldukça nadir bir atom düzenine sahip olmaları (nükleer mesafeler büyüktür) ve Büyük sayı kristal kafesteki her atomun en yakın komşuları. Tablo 1, üç tipik metal yapıyı listeler.
tablo 1
En yaygın üç metalin yapılarının özellikleri
Her atomun çok sayıda bağ oluşumuna katıldığını görüyoruz (örneğin 8 atomla). Bu kadar çok sayıda bağ (8 veya 12 atomlu) aynı anda uzayda lokalize edilemez. Rezonans nedeniyle iletişim yapılmalıdır salınım hareketi her atomun dış elektronları, kristalin tüm dış elektronlarının bir elektron gazı oluşumu ile birlikte toplanmasıyla sonuçlanır. Birçok metalde metalik bağ oluşturmak için her atomdan bir elektron almak yeterlidir. Dış kabuğunda sadece bir elektronu olan lityum için gözlemlenen tam olarak budur. Bir lityum kristali, bir elektron gazı ile çevrili Li + iyonlarından (0.068 nm yarıçaplı toplar) oluşan bir kafestir.

Pirinç. 16. Çeşitli kristalli paketleme türleri: a-altıgen yakın paketleme; b - yüz merkezli kübik ambalaj; B-kübik ambalaj.
Metalik ve kovalent bağlar arasında benzerlikler vardır. Her iki bağ türünün de değerlik elektronlarının sosyalleşmesine dayandığı gerçeğinde yatmaktadır. Bununla birlikte, bir kovalent bağ sadece iki komşu atomu birbirine bağlar ve paylaşılan elektronlar bağlı atomlara çok yakındır. Metalik bir bağda, değerlik elektronlarının sosyalleşmesine birkaç atom katılır.
Bu nedenle, metalik bağ kavramı, elektron gazı ile doldurulmuş iyonlar arasında büyük boşluklara sahip bir dizi pozitif yüklü iyonik çekirdek olarak metaller fikriyle ayrılmaz bir şekilde bağlantılıyken, makroskopik düzeyde sistem elektriksel olarak nötr kalır.
Yukarıda tartışılan kimyasal bağ türlerine ek olarak, moleküller arası olan başka bağ türleri de vardır: hidrojen bağı, van der Waals etkileşimi, donör-alıcı etkileşimi.
Moleküllerin donör-alıcı etkileşimi
Bir atomun iki elektronlu bulutu ve diğerinin serbest yörüngesi nedeniyle kovalent bir bağ oluşum mekanizmasına donör-alıcı denir. İletişim için iki elektronlu bir bulut sağlayan atom veya parçacığa donör denir. Bu elektron çiftini kabul eden serbest yörüngeli bir atom veya parçacığa alıcı denir.
Moleküller arası etkileşimin ana türleri. hidrojen bağı
Değerlik doygun moleküller arasında, partikül boyutunu aşan mesafelerde, moleküller arası çekimin elektrostatik kuvvetleri ortaya çıkabilir. Bunlara van der Waals kuvvetleri denir. Van der Waals etkileşimi her zaman yakın aralıklı atomlar arasında mevcuttur, ancak yalnızca daha güçlü bağlanma mekanizmalarının yokluğunda önemli bir rol oynar. 0,2 eV/atom'luk karakteristik bir enerjiye sahip bu zayıf etkileşim, nötr atomlar ve moleküller arasında gerçekleşir. Etkileşimin adı van der Waals adıyla ilişkilidir, çünkü gaz molekülleri arasındaki zayıf etkileşimi dikkate alan durum denkleminin gerçek gazların özelliklerini denklemden çok daha iyi tanımladığını ilk öneren oydu. durum Ideal gaz. Ancak bu çekici gücün doğası ancak 1930'da Londra tarafından açıklanmıştır. Şu anda, Van der Waals cazibesi aşağıdaki üç etkileşim türünü içerir: oryantasyon, indüksiyon, dağılım (Londra etkisi). Van der Waals çekim enerjisi, oryantasyon, indüksiyon ve dağılım etkileşimlerinin toplamı ile belirlenir.
E int = E op + E ind + E görüntü (5).
Yön etkileşimi (veya dipol-dipol etkileşimi), yaklaşıldığında zıt kutuplarla birbirlerine doğru dönen (yönlendirilen) polar moleküller arasında kendini gösterir. potansiyel enerji molekül sistemi minimal hale geldi. Yönelme etkileşiminin enerjisi, moleküllerin μ dipol momenti ne kadar büyükse ve aralarındaki l mesafesi ne kadar küçükse, o kadar önemlidir:
E op \u003d - (μ 1 μ 2) 2 / (8π 2 ∙ε 0 ∙l 6) (6),
burada ε 0 bir elektrik sabitidir.
Endüktif etkileşim, çevreleyen dipoller tarafından moleküllerin polarizasyon süreçleri ile ilişkilidir. Polar olmayan molekülün polarize edilebilirliği α ne kadar yüksekse ve polar molekülün dipol momenti μ ne kadar büyükse, o kadar önemlidir.
E ind \u003d - (αμ 2) / (8π 2 ∙ε 0 ∙l 6) (7).
Polar olmayan bir molekülün polarize edilebilirliği α, parçacığın deformasyonu ile ilişkili olduğu için deformasyon polarize edilebilirliği olarak adlandırılırken, μ elektron bulutunun ve çekirdeklerin önceki konumlarına göre yer değiştirmesini karakterize eder.
Dağılım etkileşimi (Londra etkisi), yapılarına ve polaritelerine bakılmaksızın herhangi bir molekülde meydana gelir. Elektron bulutu ve çekirdek yüklerinin ağırlık merkezlerinin anlık uyumsuzluğu nedeniyle, diğer parçacıklarda anlık dipolleri indükleyen anlık bir dipol oluşur. Anlık dipollerin hareketi koordineli hale gelir. Sonuç olarak, komşu parçacıklar karşılıklı çekim yaşarlar. Dağılım etkileşim enerjisi iyonlaşma enerjisine E I ve moleküllerin α polarize edilebilirliğine bağlıdır.
E disp \u003d - (E I 1 ∙ E I 2) ∙ α 1 α 2 / (E I 1 + E I 2) l 6 (8).
Hidrojen bağı, değerlik ve moleküller arası etkileşimler arasında bir ara karaktere sahiptir. Hidrojen bağ enerjisi düşük, 8-80 kJ/mol'dür, ancak van der Waals etkileşim enerjisinden daha yüksektir. Hidrojen bağı, su, alkoller, asitler gibi sıvıların karakteristiğidir ve pozitif polarize hidrojen atomundan kaynaklanır. Küçük boyut ve iç elektronların yokluğu, herhangi bir bileşikteki bir sıvıda bulunan hidrojen atomunun, kendisine kovalent olarak bağlı olmayan başka bir veya aynı molekülün negatif polarize bir atomu ile ek etkileşime girmesine izin verir.
A δ- - H δ+ .... A δ- - H δ+ .
Yani, bir molekül birliği vardır. Moleküllerin birleşimi, uçuculukta bir azalmaya, kaynama noktasında ve buharlaşma ısısında bir artışa, viskozitede bir artışa ve geçirgenlik sıvılar.
Su molekülü iki hidrojen atomuna ve oksijen atomunda iki yalnız çifte sahip olduğundan, hidrojen bağı oluşumu için özellikle uygun bir maddedir. Bu, molekülün yüksek bir dipol momentine (μ D = 1.86 D) ve dört hidrojen bağı oluşturma yeteneğine neden olur: ikisi proton verici olarak ve ikisi proton alıcı olarak
(H 2 O .... N - O ... H 2 O) 2 kez.
Serideki moleküler ağırlıktaki bir değişiklikle deneylerden bilinmektedir. hidrojen bileşikleriüçüncü ve sonraki periyotların elemanları, kaynama noktası yükselir. Bu model suya uygulanırsa, kaynama noktası 100 0 C değil, 280 0 C olmalıdır. Bu çelişki suda bir hidrojen bağının varlığını doğrular.
Deneyler, moleküler bağların sıvıda ve özellikle katı suda oluştuğunu göstermiştir. Buzun bir tetrahedral kristal kafesi vardır. Tetrahedronun merkezinde bir su molekülünün oksijen atomu vardır, dört köşede en yakın komşularıyla hidrojen bağları ile bağlanan komşu moleküllerin oksijen atomları vardır. Sıvı suda, hidrojen bağları kısmen kırılır, yapısında moleküllerin ortakları ile serbest moleküller arasında dinamik bir denge gözlenir.
değerlik bağ yöntemi
Değerlik bağları veya lokalize elektron çiftleri teorisi, bir moleküldeki her bir atom çiftinin bir veya daha fazla ortak elektron çifti tarafından bir arada tutulduğunu varsayar. Değerlik bağları teorisinin temsilinde, iki atom arasında bir kimyasal bağ lokalizedir, yani iki merkezli ve iki elektronludur.
Değerlik tahvillerinin yöntemi aşağıdaki ana hükümlere dayanmaktadır:
Bir moleküldeki her bir atom çifti, bir veya daha fazla ortak elektron çifti tarafından bir arada tutulur;
Tek bir kovalent bağ, bağlanan atomların değerlik orbitallerinde yer alan antiparalel spinlere sahip iki elektron tarafından oluşturulur;
Bir bağ oluştuğunda, elektronların dalga fonksiyonları örtüşür, bu da atomlar arasındaki elektron yoğunluğunun artmasına ve elektron yoğunluğunun azalmasına neden olur. toplam enerji sistemler;
Her atomun belirli sayıda elektronu vardır.
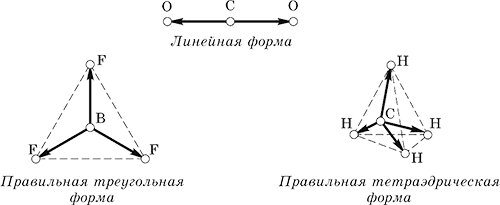
Kimyasal reaksiyonlara giren atomlar, en kararlı elektronik konfigürasyona ulaşarak elektronları bağışlar, alır veya sosyalleştirir. En düşük enerjili konfigürasyon en kararlı olanıdır (soy gaz atomlarında olduğu gibi). Bu modele "sekizli kural" denir (Şekil 1).
Pirinç. bir.
Bu kural herkes için geçerlidir bağlantı türleri. Atomlar arasındaki elektronik bağlar, en basit kristallerden, sonunda canlı sistemler oluşturan karmaşık biyomoleküllere kadar kararlı yapılar oluşturmalarına izin verir. Sürekli metabolizmalarında kristallerden farklıdırlar. Bununla birlikte, birçok kimyasal reaksiyon mekanizmalara göre ilerler. elektronik aktarım vücuttaki enerji süreçlerinde önemli bir rol oynayan .
Kimyasal bağ, iki veya daha fazla atomu, iyonu, molekülü veya bunların herhangi bir kombinasyonunu bir arada tutan bir kuvvettir..
Kimyasal bağın doğası evrenseldir: negatif yüklü elektronlar ile pozitif yüklü çekirdekler arasındaki, atomların dış kabuğundaki elektronların konfigürasyonu tarafından belirlenen elektrostatik bir çekim kuvvetidir. Bir atomun kimyasal bağ oluşturma yeteneğine denir. değerlik, veya paslanma durumu. kavramı değerlik elektronları- kimyasal bağlar oluşturan elektronlar, yani en yüksek enerjili orbitallerde bulunanlar. Buna göre, bu orbitalleri içeren bir atomun dış kabuğuna denir. değerlik kabuğu. Şu anda, kimyasal bir bağın varlığını belirtmek yeterli değildir, ancak türünü netleştirmek gerekir: iyonik, kovalent, dipol-dipol, metalik.
İlk bağlantı türü,iyonik bağ
Lewis ve Kossel'in elektronik değerlik teorisine göre, atomlar iki şekilde kararlı bir elektronik konfigürasyon elde edebilirler: Birincisi, elektronları kaybederek, katyonlar ikincisi, onları elde etmek, dönüştürmek anyonlar. Elektron transferinin bir sonucu olarak, zıt işaretli iyonlar arasındaki elektrostatik çekim kuvveti nedeniyle, Kossel adı verilen kimyasal bir bağ oluşur " elektrovalent(Şimdi çağırdı iyonik).
Bu durumda, anyonlar ve katyonlar, doldurulmuş bir dış elektron kabuğu ile kararlı bir elektronik konfigürasyon oluşturur. Tipik iyonik bağlar, periyodik sistemin T ve II gruplarının katyonlarından ve VI ve VII gruplarının metalik olmayan elementlerinin anyonlarından (sırasıyla 16 ve 17 alt grup -, kalkojenler ve halojenler). İyonik bileşiklerdeki bağlar doymamış ve yönsüzdür, bu nedenle diğer iyonlarla elektrostatik etkileşim olasılığını korurlar. Şek. 2 ve 3, Kossel elektron taşıma modeline karşılık gelen iyonik bağ örneklerini göstermektedir.

Pirinç. 2.

Pirinç. 3. Sodyum klorür (NaCl) molekülündeki iyonik bağ
Burada maddelerin doğadaki davranışlarını açıklayan bazı özellikleri hatırlamak, özellikle de madde kavramını dikkate almak uygun olacaktır. asitler ve zemin.
Tüm bu maddelerin sulu çözeltileri elektrolitlerdir. Farklı şekillerde renk değiştirirler. göstergeler. Göstergelerin etki mekanizması F.V. Ostwald. Göstergelerin, rengi ayrışmamış ve ayrışmış durumlarda farklı olan zayıf asitler veya bazlar olduğunu gösterdi.
Bazlar asitleri nötralize edebilir. Tüm bazlar suda çözünür değildir (örneğin, -OH grupları içermeyen bazı organik bileşikler çözünmezdir, özellikle, trietilamin N (C2H 5) 3); çözünür bazlar denir alkaliler.
Asitlerin sulu çözeltileri karakteristik reaksiyonlara girer:
a) metal oksitlerle - tuz ve su oluşumu ile;
b) metallerle - tuz ve hidrojen oluşumuyla;
c) karbonatlarla - tuz oluşumuyla, CO 2 ve H 2 Ö.
Asitlerin ve bazların özellikleri çeşitli teorilerle açıklanmıştır. S.A.'nın teorisine göre. Arrhenius, bir asit iyonları oluşturmak üzere ayrışan bir maddedir H+ , baz iyon oluştururken O- . Bu teori, hidroksil grupları olmayan organik bazların varlığını hesaba katmaz.
Doğrultusunda proton Bronsted ve Lowry'nin teorisine göre asit, proton veren moleküller veya iyonlar içeren bir maddedir. bağışçılar protonlar) ve baz, protonları kabul eden moleküller veya iyonlardan oluşan bir maddedir ( alıcılar protonlar). Sulu çözeltilerde, hidrojen iyonlarının hidratlı bir formda, yani hidronyum iyonları formunda bulunduğunu unutmayın. H3O+ . Bu teori, sadece su ve hidroksit iyonları ile değil, aynı zamanda bir çözücünün yokluğunda veya susuz bir çözücü ile gerçekleştirilen reaksiyonları da açıklar.
Örneğin, amonyak arasındaki reaksiyonda NH Gaz fazında 3 (zayıf baz) ve hidrojen klorür, katı amonyum klorür oluşur ve iki maddenin denge karışımında her zaman ikisi asit ve diğer ikisi baz olan 4 parçacık vardır:
Bu denge karışımı, iki konjuge asit ve baz çiftinden oluşur:
1)NH 4+ ve NH 3
2) HCl ve Cl ‑
Burada, her bir konjuge çiftte asit ve baz bir proton kadar farklıdır. Her asidin bir eşlenik bazı vardır. Güçlü bir asit, zayıf bir eşlenik bazına sahiptir ve zayıf bir asit, güçlü bir eşlenik bazına sahiptir.
Bronsted-Lowry teorisi, biyosferin yaşamı için suyun benzersiz rolünü açıklamayı mümkün kılar. Su, kendisiyle etkileşime giren maddeye bağlı olarak, bir asit veya bir bazın özelliklerini gösterebilir. Örneğin, sulu asetik asit çözeltileri ile reaksiyonlarda su bir bazdır ve sulu amonyak çözeltileri ile bir asittir.
1) CH3 COOH + H2O ↔ H3O + + CH 3 SOO- . Burada, bir asetik asit molekülü, bir su molekülüne bir proton bağışlar;
2) NH3 + H2O ↔ NH4 + + O- . Burada amonyak molekülü, su molekülünden bir proton alır.
Böylece su iki konjuge çift oluşturabilir:
1) H2O(asit) ve O- (eşlenik taban)
2) H3O+ (asit) ve H2O(eşlenik taban).
İlk durumda, su bir proton bağışlar ve ikincisinde onu kabul eder.
Böyle bir özellik denir amfiprotonite. Hem asit hem de baz olarak tepkimeye girebilen maddelere denir amfoterik. Bu tür maddeler genellikle doğada bulunur. Örneğin, amino asitler hem asitler hem de bazlarla tuzlar oluşturabilir. Bu nedenle peptitler, mevcut metal iyonları ile kolayca koordinasyon bileşikleri oluşturur.
Bu nedenle, bir iyonik bağın karakteristik özelliği, bir grup bağlayıcı elektronun çekirdeklerden birine tamamen yer değiştirmesidir. Bu, iyonlar arasında elektron yoğunluğunun neredeyse sıfır olduğu bir bölge olduğu anlamına gelir.
İkinci bağlantı türü isekovalent bağ
Atomlar, elektronları paylaşarak kararlı elektronik konfigürasyonlar oluşturabilir.
Böyle bir bağ, bir çift elektron birer birer paylaşıldığında oluşur. herbirinden atom. Bu durumda, sosyalleşmiş bağ elektronları atomlar arasında eşit olarak dağıtılır. Kovalent bağa bir örnek homonükleer iki atomlu H molekülleri 2 , N 2 , F 2. Allotroplar aynı tip bağa sahiptir. Ö 2 ve ozon Ö 3 ve çok atomlu bir molekül için S 8 ve ayrıca heteronükleer moleküller hidrojen klorür HCl, karbon dioksit CO 2, metan CH 4, etanol İTİBAREN 2 H 5 O, sülfür hekzaflorid bilimkurgu 6, asetilen İTİBAREN 2 H 2. Bütün bu moleküller aynı ortak elektronlara sahiptir ve bağları aynı şekilde doyurulur ve yönlendirilir (Şekil 4).
Biyologlar için, ikili ve üçlü bağlardaki atomların kovalent yarıçaplarının tek bir bağa kıyasla azaltılması önemlidir.
![]()
Pirinç. dört. Cl 2 molekülünde kovalent bağ.
İyonik ve kovalent bağ türleri, mevcut birçok kimyasal bağ türünün iki sınırlayıcı durumudur ve pratikte bağların çoğu ara bağdır.
Mendeleev sisteminin aynı veya farklı periyotlarının karşıt uçlarında bulunan iki elementin bileşikleri ağırlıklı olarak iyonik bağlar oluşturur. Elementler bir periyotta birbirine yaklaştıkça bileşiklerinin iyonik yapısı azalırken kovalent karakter artar. Örneğin, periyodik tablonun sol tarafındaki elementlerin halojenürleri ve oksitleri, ağırlıklı olarak iyonik bağlar oluşturur ( NaCl, AgBr, BaSO 4 , CaCO 3 , KNO 3 , CaO, NaOH) ve tablonun sağ tarafındaki elementlerin aynı bileşikleri kovalenttir ( H 2 O, CO 2, NH 3, NO 2, CH 4, fenol C6H5OH, glikoz C6H12O6, etanol C2H5OH).
Kovalent bağ, sırayla, başka bir modifikasyona sahiptir.
Çok atomlu iyonlarda ve karmaşık biyolojik moleküllerde, her iki elektron da yalnızca bir atom. denir bağışçı elektron çifti. Bu elektron çiftini bir verici ile sosyalleştiren atoma denir. akseptör elektron çifti. Bu tür kovalent bağ denir koordinasyon (bağışçı-kabul eden, veyatarih) iletişim(Şek. 5). Metabolizma için en önemli d-elementlerinin kimyası büyük ölçüde koordinasyon bağları ile tanımlandığından, bu tür bir bağ biyoloji ve tıp için çok önemlidir.
![]()
resim 5.
Kural olarak, karmaşık bir bileşikte, bir metal atomu bir elektron çifti alıcısı olarak hareket eder; aksine iyonik ve kovalent bağlarda metal atomu elektron vericidir.
Kovalent bağın özü ve çeşitliliği - koordinasyon bağı - GN tarafından önerilen başka bir asit ve baz teorisi yardımıyla açıklığa kavuşturulabilir. Lewis. Bronsted-Lowry teorisine göre "asit" ve "baz" terimlerinin anlamsal kavramını biraz genişletti. Lewis teorisi, kompleks iyonların oluşumunun doğasını ve maddelerin nükleofilik ikame reaksiyonlarına, yani CS oluşumuna katılımını açıklar.
Lewis'e göre asit, bir bazdan bir elektron çifti alarak kovalent bağ oluşturabilen bir maddedir. Bir Lewis bazı, elektron vererek Lewis asidi ile kovalent bir bağ oluşturan yalnız bir çift elektrona sahip bir maddedir.
Yani, Lewis teorisi, asit-baz reaksiyonlarının aralığını, protonların hiç katılmadığı reaksiyonlara da genişletir. Ayrıca, bu teoriye göre protonun kendisi de bir asittir, çünkü bir elektron çiftini kabul edebilir.

Dolayısıyla bu teoriye göre katyonlar Lewis asitleri ve anyonlar Lewis bazlarıdır. Aşağıdaki reaksiyonlar örnektir:
Yukarıda, kovalent moleküllerde metal atomlarından alıcı atomlara bir elektronun tam aktarımı olmadığından, maddelerin iyonik ve kovalent olanlara bölünmesinin göreceli olduğu belirtilmişti. İyonik bağa sahip bileşiklerde, her iyon zıt işaretli iyonların elektrik alanındadır, bu nedenle karşılıklı olarak polarize olurlar ve kabukları deforme olur.
Polarize edilebilirlik iyonun elektronik yapısı, yükü ve boyutu ile belirlenir; anyonlar için katyonlardan daha yüksektir. Katyonlar arasında en yüksek polarize edilebilirlik, daha büyük yüke ve daha küçük boyuta sahip katyonlar içindir, örneğin, Hg 2+ , Cd 2+ , Pb 2+ , Al 3+ , Tl 3+. Güçlü bir polarize edici etkiye sahiptir H+ . İyon polarizasyonunun etkisi iki yönlü olduğu için oluşturdukları bileşiklerin özelliklerini önemli ölçüde değiştirir.
Üçüncü bağlantı türü,dipol-dipol bağ
Listelenen iletişim türlerine ek olarak, dipol-dipol de vardır. moleküller arası etkileşimler olarak da bilinir van der Waals .
Bu etkileşimlerin gücü, moleküllerin doğasına bağlıdır.
Üç tür etkileşim vardır: kalıcı dipol - kalıcı dipol ( dipol-dipol cazibe); kalıcı dipol - indüklenmiş dipol ( indüksiyon cazibe); anlık dipol - indüklenmiş dipol ( dağılım cazibe veya Londra kuvvetleri; pilav. 6).

Pirinç. 6.
Sadece polar kovalent bağlara sahip moleküller bir dipol-dipol momentine sahiptir ( HCl, NH3, SO2, H20, C6H5Cl) ve bağ gücü 1-2 hoşçakal(1D \u003d 3.338 × 10 -30 coulomb metre - C × m).
Biyokimyada başka bir bağ türü ayırt edilir - hidrojen sınırlayıcı bir durum olan bağlantı dipol-dipol cazibe. Bu bağ, bir hidrojen atomu ile küçük bir elektronegatif atom, çoğunlukla oksijen, flor ve nitrojen arasındaki çekim ile oluşur. Benzer elektronegatifliğe sahip büyük atomlarda (örneğin, klor ve kükürt ile), hidrojen bağı çok daha zayıftır. Hidrojen atomu bir temel özellik ile ayırt edilir: bağlayıcı elektronlar çekildiğinde, çekirdeği - proton - açığa çıkar ve elektronlar tarafından taranmayı bırakır.
Bu nedenle atom büyük bir dipole dönüşür.
Van der Waals bağından farklı olarak bir hidrojen bağı, yalnızca moleküller arası etkileşimler sırasında değil, aynı zamanda bir molekül içinde de oluşur - moleküliçi hidrojen bağı. Hidrojen bağları biyokimyada önemli bir rol oynar, örneğin proteinlerin yapısını bir a-sarmal formunda stabilize etmek veya bir DNA çift sarmalının oluşumu için (Şekil 7).

Şekil 7.
Hidrojen ve van der Waals bağları iyonik, kovalent ve koordinasyon bağlarından çok daha zayıftır. Moleküller arası bağların enerjisi Tabloda belirtilmiştir. bir.
Tablo 1. Moleküller arası kuvvetlerin enerjisi
Not: Moleküller arası etkileşimlerin derecesi, erime ve buharlaşma (kaynama) entalpisini yansıtır. İyonik bileşikler, iyonları ayırmak için molekülleri ayırmaktan çok daha fazla enerji gerektirir. İyonik bileşiklerin erime entalpileri moleküler bileşiklerden çok daha yüksektir.
Dördüncü bağlantı türü -metalik bağ
Son olarak, moleküller arası bağların başka bir türü daha vardır - metal: metal kafesinin pozitif iyonlarının serbest elektronlarla bağlantısı. Bu tür bir bağlantı biyolojik nesnelerde oluşmaz.
Bağ türlerinin kısa bir incelemesinden, bir ayrıntı ortaya çıkıyor: bir metal atomunun veya iyonunun önemli bir parametresi - bir elektron vericisinin yanı sıra bir atom - bir elektron alıcısı onun boyut.
Ayrıntılara girmeden, periyodik sistem gruplarında atom numaraları arttıkça atomların kovalent yarıçaplarının, metallerin iyonik yarıçaplarının ve etkileşen moleküllerin van der Waals yarıçaplarının arttığını not ediyoruz. Bu durumda iyon yarıçaplarının değerleri en küçüktür ve van der Waals yarıçapları en büyüktür. Kural olarak, grupta aşağı doğru hareket ederken, hem kovalent hem de van der Waals olmak üzere tüm öğelerin yarıçapları artar.
Biyologlar ve doktorlar için en önemli Koordinasyon(donör-kabul eden) koordinasyon kimyası tarafından dikkate alınan bağlar.
Tıbbi biyoinorganikler. G.K. Baraşkov






