Elektronların enerji seviyelerine göre düzenlenmesi bir tablodur. Enerji seviyelerinde elektronların düzenlenmesi
|
ben= 0, 1, ... ila n-1 |
m = - ben; 0;+ ben | |||
|
ben= 0(lar) | ||||
|
ben= 0(lar), ben= 1(p) |
m = -1, 0, +1 |
| ||
|
ben= 0(lar), ben= 1(p) ben= 1(d) |
m = -1, 0, +1 m = -2, -1, 0, +1,+2 |
|
Not: Tablo, enerji seviyesindeki mümkün olan maksimum elektron sayısını göstermektedir.
elektronik formül
Elektronlar, artan enerji sırasına göre bir atomun yörüngelerini doldurur. Yörünge çekirdeğe ne kadar yakınsa (daha düşük bir sayı ile enerji seviyesi), elektron çekirdeğe ne kadar güçlü çekilirse, böyle bir düzenleme onun için o kadar uygun olur.
Örneğin, bir karbon atomunun atom numarası altıdır, yani nükleer yük +6, elektron sayısı da altıdır. Bu elektronlar iki enerji seviyesinde (periyot numarası) bulunur. Karbon atomunun birinci enerji seviyesi tamamen doludur: tek bir yörüngede zıt spinli (1s 2) iki elektron vardır (bkz. Tablo 7). Kalan dört elektron, ikisi tercih edilen s orbitallerinde ve ikisi p orbitallerinde (2s 2 2p 2) olmak üzere ikinci enerji seviyesini işgal eder.
Elektronların dağılımı enerji seviyeleri ve alt düzeyler aşağıdakilere uyar:
1. Pauli ilkesi
2. Klechkovsky'nin kuralı
3. Hund kuralı.
Pauli prensibi. 1925'te P. Pauli, bir atomun tamamen aynı kümeye sahip iki elektrona sahip olamayacağı ilkesini öne sürdü. Kuantum sayıları: n ben, Hanım. Her yörüngenin ikiden fazla elektronu olamaz ve zıt dönüşlere sahip olmaları gerekir, yani. dolgusuna izin verilir ve ve dolgusuna izin verilmez.
V. Klechkovsky'nin kuralı. Enerjideki artış ve buna bağlı olarak yörüngenin doldurulması, kuantum sayılarının toplamını artırma sırasına göre gerçekleşir n + ben, ve ne zaman toplamına eşit n+ ben artan sırada
Örneğin, Ca +20)))) 1s 2s 2p 3s 3p 3d 4s 4p 4d
enerji alt seviyeleri dizisi
s = 0, p = 1, d = 2 ise
Sonuç olarak, seviyelerin ve alt seviyelerin elektronlarla doldurulması, artan toplam n ve ben: 1s 2 2s 2 2p 6 3s 2 3p 6 3 d 0 4s2
İstisna, dip olarak adlandırılan bazı d ve f elementleridir (bir elektronun s alt seviyesinden dış d veya f'ye olan düşüşü). Örneğin, Cu, Ag, Cr, Pd, Pt.
Hund kuralı.Atomun normal durumundaki p,d,f alt seviyelerindeki orbitallerin doldurulması aynı spinlere sahip tek elektronlarla başlar. Tek elektronlar tüm alt düzey orbitalleri işgal ettikten sonra, orbitaller zıt spinli ikinci elektronlarla doldurulur. Örneğin, elektronik yapı azot atomu aşağıdaki yapıya sahiptir 1s2s2p
Elementlerin özellikleri, değerlik elektronlarının elektronik konfigürasyonuna bağlıdır. Değerlik elektronları, kural olarak, dış enerji seviyesindedir (periyot numarası), değerlik elektronlarının sayısı grup numarası ile belirlenebilir (grup VIII'in d elemanları hariç). Örneğin, bir nitrojen atomunun ikinci enerji seviyesinde bulunan beş değerlik elektronu (V grubu) vardır (element ikinci periyottadır).
Değerlik elektronlarının yapısına göre PSE'nin tüm elemanları s-, p-, d-, f- elemanlarına bölünebilir, aksi takdirde aile olarak adlandırılırlar:
s- elementler grup I, II'dedir (ana alt gruplar)
p- elementler III-VIII gruplarındadır (ana alt gruplar)
d- elementler I-VIII gruplarındadır (yan alt gruplar)
f-elementler lantanitler ve aktinitler olarak sınıflandırılır.
Ailenin tüm unsurları benzer bir yapıya sahiptir:
uyarılmamış durumdaki s-elemanları, yalnızca s-alt düzeyinde değerlik elektronlarına sahiptir.
uyarılmamış durumdaki p-elemanları, dış s ve p-alt düzeylerinde değerlik elektronlarına sahiptir.
Uyarılmamış durumdaki d-elemanları, dış s ve ön-dış d-alt düzeylerinde değerlik elektronlarına sahiptir.
Ailenin elementlerinin benzer elektronik konfigürasyonu, bu ailenin elementlerinin kimyasal özelliklerinin benzerliğini sağlar.
TANIM
skandiyum Periyodik Tablonun ikincil (B) alt grubunun III. grubunun dördüncü periyodunda yer alır.
d-ailesinin öğelerini ifade eder. Metal. Tanım - Sc. Sıra numarası - 21. Göreceli atom kütlesi- 44.956 amu
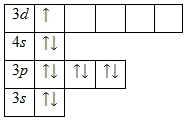
Skandiyum atomunun elektronik yapısı
Skandiyum atomu, içinde 21 proton ve 24 nötron bulunan ve 21 elektronun dört yörüngede hareket ettiği pozitif yüklü bir çekirdekten (+21) oluşur.
Şekil 1. Skandiyum atomunun şematik yapısı.
Elektronların yörüngelerdeki dağılımı aşağıdaki gibidir:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 1 4s 2 .
Skandiyum atomunun dış enerji seviyesi, değerlik olan 3 elektron içerir. Skandiyumun oksidasyon durumu +3'tür. Temel durumun enerji diyagramı aşağıdaki formu alır:
Problem çözme örnekleri
ÖRNEK 1
ÖRNEK 2
| Egzersiz yapmak | Galyum elementinin iki doğal izotopu 69 Ga ve 71 Ga'dır. Elementin nispi atom kütlesi 69.72 ise, bu izotopların doğal galyumdaki kütle fraksiyonlarını hesaplayın. |
| Çözüm | İzotoplar, aynı kimyasal elementin farklı özelliklere sahip atomlarıdır. kütle numaraları(aynı sayıda proton, ancak farklı - nötronlar). Her yüz doğal klor atomunda galyum izotopu 69 Ga'nın atom sayısını x olarak alalım, o zaman 71 Ga izotopunun atom sayısı (100-x) eşit olacaktır. 69 Ga izotopunun atom kütlesi 69x'e ve 71 Ga - 71 × (100-x)'e eşit olacaktır. Bir denklem yapalım: 69x + 74x(100x) = %69,72x100. x'i bulalım: 69x + 7400 - 74x = 6972; |
| Cevap | Doğal klordaki 69 Ga izotopunun içeriği %85,6 ve 71 Ga izotopunun içeriği %14.4'tür. |
ben. Atomların elektronik formülleri kimyasal elementler aşağıdaki sırayla yapılır:
· İlk olarak, D. I. Mendeleev tablosundaki element sayısı ile atomdaki toplam elektron sayısı belirlenir;
· Daha sonra elementin bulunduğu periyot sayısına göre enerji seviyesi sayısı belirlenir;
· Seviyeler alt seviyelere ve orbitallere ayrılır ve buna göre elektronlarla doldurulur. En az enerji ilkesi
· Kolaylık sağlamak için, elektronlar aşağıdaki formül kullanılarak enerji seviyelerine ayrılabilir: N=2n2 ve bunu göz önünde bulundurarak:
1. elementlerde ana alt gruplar ( s-; p -elementler), dış seviyedeki elektron sayısı grup numarasına eşittir.
2. elementlerde yan alt gruplar genellikle dışarıda iki elektron (atomlar hariç)Cu, Ag, Au, cr, not, ay, Ru, Rh, kimin dış seviyesi bir elektron, enPDdış seviyede sıfır elektronlar);
3. sondan bir önceki seviyedeki elektron sayısı toplam sayısı bir atomdaki elektronlar eksi diğer tüm seviyelerdeki elektron sayısı.
II. Elektron doldurma sırası atomik yörüngeler belirlenen :
1.En az enerji ilkesi
enerji ölçeği:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s…
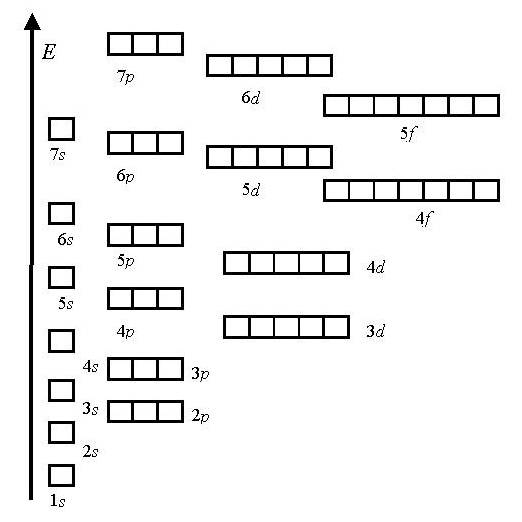
2. Tamamen veya yarı dolu bir alt seviyeye sahip bir atomun durumu (yani, her orbitalde eşleşmemiş bir elektron bulunduğunda) daha kararlıdır.
Bu, elektronun "başarısızlığını" açıklar. Böylece, aşağıdaki elektron dağılımı, krom atomunun kararlı durumuna karşılık gelir:
Cr: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5 , Ama değil 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 4 ,
yani 4'ten elektronda bir "arıza" var s-alt düzeyinden 3 d-alt düzeyine.
KENDİNİZİ KONTROL EDİN: Elemanların elektronik formülleri.
Modülü indirin: eğitim aparatı“Element atomlarının elektron kabuklarını doldurmak” kimyasal elementlerin periyodik bir tablosunu ve bir atomdaki elektronların dağılımını gösteren bir diyagramı içerir.
Atomun elektronik yapısı ile kimyasal elementi belirlemeye davetlisiniz.
1. Periyodik sistemin hangi gruplarının ana alt gruplarında, elektronik atom şemaları tablonun ilk sütununda gösterilen kimyasal elementlerin bulunduğunu belirleyin.
Elektronik devreler Gruplar 1 2 3 4 5 6 7 2. 4. SCH VE E X ANCAK B saat 2. 8. 2. AT Ve İle M H Ö P 2. 1. M İTİBAREN S F YU ANCAK ben 2. 8. 5. R B T AT Ve E G 2. 8. 1. H D VE Ve İle W M 2. 8. 7. L Ö AT H saat P E 2. 8. 3. R T İTİBAREN X C H F 2. 3. SCH S İle E M H İle 2. 8. 6. Ö ben ANCAK AT İTİBAREN Ve Ö 2. 5. YU P R M Y AT X 2. Periyodik sistemin hangi gruplarının ana alt gruplarında, tablonun ilk sütununda proton ve nötron sayıları verilen kimyasal elementlerin bulunduğunu belirleyin.
Proton ve nötron sayısı Gruplar 1 2 3 4 5 6 7 13r 14n ANCAK G E G Ö İTİBAREN B 12p 12n AT L SCH İle Ve P H 15r 16n B Ö P E E İle saat 19 kuruş 20n M C saat ANCAK D S E 17p18n Y W F L W L E 6p 6n İle M ben H YU YU ben 8p 8n P İTİBAREN T D H T AT
Modülü indirin ve çalıştırın"Periyodik yasa ve kimyasal elementlerin periyodik sistemi" konusunda yiyor
D. I. Mendeleev ve atomun yapısı"
Modülü indirin ve çalıştırın "Atomların yapısı hakkında temel bilgiler" konusunda yiyor. Modül, konuyla ilgili 10 test sorusu içerir. Özellikle kükürt atomunun elektronik formülünü sayısal ve alfabetik gösterimleri uygun bölgeye aktararak oluşturmaya davetlisiniz.
Sabitleme görevleri
3. Bir atomun çekirdeğinin bileşimi nedir?
5. İzotopları karşılaştırın.
6. Na +1 iyonunun oluşum şemasını yazın.
1. D.I.'nin kimyasal elementinin periyodik sistemindeki elementin konumunu yazın Mendeleev.
2. Çekirdeğin yükünü, toplam elektron sayısını belirleyin.
3. Bir atomun çekirdeğinin bileşimi nedir?
4. Elektronların katmanlardaki (seviyelerdeki) dağılımının bir diyagramını çizin.
5. İzotopları karşılaştırın ![]() .
.
6. O-2 iyonunun oluşum şemasını yazın.
7. Bir iyondaki katmanlar (seviyeler) üzerindeki elektron dağılımının bir diyagramını çizin.
1. D.I.'nin kimyasal elementinin periyodik sistemindeki elementin konumunu yazın Mendeleev.
2. Çekirdeğin yükünü, toplam elektron sayısını belirleyin.
3. Bir atomun çekirdeğinin bileşimi nedir?
4. Elektronların katmanlardaki (seviyelerdeki) dağılımının bir diyagramını çizin.
5. İzotopları karşılaştırın.
6. S-2 iyonunun oluşum şemasını yazın
7. Bir iyondaki katmanlar (seviyeler) üzerindeki elektron dağılımının bir diyagramını çizin.
1. D.I.'nin kimyasal elementinin periyodik sistemindeki elementin konumunu yazın Mendeleev.
2. Çekirdeğin yükünü, toplam elektron sayısını belirleyin.
3. Bir atomun çekirdeğinin bileşimi nedir?
4. Elektronların katmanlardaki (seviyelerdeki) dağılımının bir diyagramını çizin.
5. İzotopları karşılaştırın ![]() .
.
6. Mg +2 iyonunun oluşum şemasını yazın.
7. Bir iyondaki katmanlar (seviyeler) üzerindeki elektron dağılımının bir diyagramını çizin.
1. D.I.'nin kimyasal elementinin periyodik sistemindeki elementin konumunu yazın Mendeleev.
2. Çekirdeğin yükünü, toplam elektron sayısını belirleyin.
3. Bir atomun çekirdeğinin bileşimi nedir?
4. Elektronların katmanlardaki (seviyelerdeki) dağılımının bir diyagramını çizin.
5. İzotopları karşılaştırın ![]() .
.
6. Si +4 iyonunun oluşum şemasını yazınız.
7. Bir iyondaki katmanlar (seviyeler) üzerindeki elektron dağılımının bir diyagramını çizin.
1. D.I.'nin kimyasal elementinin periyodik sistemindeki elementin konumunu yazın Mendeleev.
2. Çekirdeğin yükünü, toplam elektron sayısını belirleyin.
3. Bir atomun çekirdeğinin bileşimi nedir?
4. Elektronların katmanlardaki (seviyelerdeki) dağılımının bir diyagramını çizin.
5. İzotopları karşılaştırın ![]() .
.
6. Al +3 iyonunun oluşum şemasını yazın.
7. Bir iyondaki katmanlar (seviyeler) üzerindeki elektron dağılımının bir diyagramını çizin.
1. D.I.'nin kimyasal elementinin periyodik sistemindeki elementin konumunu yazın Mendeleev.
2. Çekirdeğin yükünü, toplam elektron sayısını belirleyin.
3. Bir atomun çekirdeğinin bileşimi nedir?
4. Elektronların katmanlardaki (seviyelerdeki) dağılımının bir diyagramını çizin.
5. İzotopları karşılaştırın ![]() .
.
6. Cl -1 iyonunun oluşum şemasını yazın.
7. Bir iyondaki katmanlar (seviyeler) üzerindeki elektron dağılımının bir diyagramını çizin.
1. D.I.'nin kimyasal elementinin periyodik sistemindeki elementin konumunu yazın Mendeleev.
2. Çekirdeğin yükünü, toplam elektron sayısını belirleyin.
3. Bir atomun çekirdeğinin bileşimi nedir?
4. Elektronların katmanlardaki (seviyelerdeki) dağılımının bir diyagramını çizin.
5. İzotopları karşılaştırın ![]() .
.
6. K +1 iyonunun oluşum şemasını yazın.
7. Bir iyondaki katmanlar (seviyeler) üzerindeki elektron dağılımının bir diyagramını çizin.
Periyodik kimyasal elementler sistemi, kesinlikle düzenli bir kimyasal elementler kümesidir, bunların doğal sınıflandırması, periyodik yasanın tablo veya başka bir grafik ifadesidir.
Periyodik sistem tablolarının çok sayıda farklı versiyonu bilinmektedir. Ancak, yalnızca D.I. tarafından derlenen tabloya yakın olduğu ortaya çıkanlar. Mendeleyev. Şu anda, periyodik sistemin başlıca iki biçimi kullanılmaktadır: uzun dönem ve kısa dönem.
Periyodik sistemin dikey grafiklerine denir. gruplar, ve yatay olanlar dönemler. Kısa dönem formu sekiz grup ve yedi dönemden oluşmaktadır. Lantanitler ve aktinitlerin aileleri tablonun altında yer almaktadır.
Dönem - atomlarında aynı sayıda enerji seviyesi elektronlarla dolu olan ardışık bir dizi element (seviye sayısı periyot sayısına eşittir). Dönemler şunları içerir: 2, 8, 8, 18, 32 ve 32 elementler. Son dönem tamamlanmadı. Periyotlardaki farklı sayıda element, enerji alt seviyelerini doldurmanın farklı dizisi ile açıklanmaktadır. Elektronlarla dolu elementler s- alt seviye denir s- doldurulduğu elemanlar R- alt düzey - R- doldurulduğu elemanlar d- ve f- alt düzeyler - sırasıyla d- ve f- elementler. Dönemler, atomlarında yeni bir elektronik düzeyde, alkali metallerle başlar. s- elektron. Periyotlar atomları tamamen dolu olan elementlerle biter. p- seviyenin 2 ile oluşturulduğu helyum ile biten ilk dönem hariç, altı elektronlu (atıl gazlar) dış seviyenin alt seviyesi s- elektronlar. 4. ve 5. periyotlarda s- ve p- yerleştirilen elemanlar 10 d- elementler ve 6. ve 7. dönemlerde - 10 d- elementler ve 14 f- elementler.
Periyodik sistem 8 gruptan (veya sistemin uzun periyot versiyonunda 32 gruptan) oluşur. Gruplar Romen rakamlarıyla belirtilir I - VIII ve iki alt gruptan oluşur: ANCAK ve B.
Her grup, atomları benzer bir elektron kabuğu yapısına sahip elementlerden oluşur. Örneğin, potasyum 4 s 1 (IA), ve bakır - 3 boyutlu 10 4 s 1 (Ben B). Bu elemanlar dış 4 s- Her alt seviyenin bir elektronu vardır. Aynı gruba ait olan elementlere denir elektronik analoglar.
Bir alt grubun parçası olan öğeler, tam elektronik muadilleri, aynı elektronik seviye yapısına sahip oldukları için. Örneğin, elemanlar ben bir grupların genel formülü vardır ns 1 , ve elementler ben -(n-1)d 10 ns 1 .
Periyodik Element Tablosunun yayınlanmasından bu yana, içinde 40'tan fazla yeni element ortaya çıktı. Periyodik yasaya dayanarak, atom numarası 93 ila 105 (toplamda 15) olan transuranyum elementler yapay olarak elde edildi. Üretimleri, çekirdekleri nötronlarla bombardıman edilerek “üzerine inşa edilen” Dünya'daki en ağır element olan uranyum-238'in kullanımına dayanmaktadır. Fermiyuma kadar olan elementler bu şekilde elde edilir. 100 Fm 257 nükleer reaktörlerde. Transuranidler ayrıca termonükleer patlamalarda oluşur.
Atom numarası 100'ün üzerinde olan tüm elementler hızlandırıcılarda üretilir. Ağır atom çekirdekleri (hedefler) ağır iyonlarla bombardımana tutulur. Nötronların emisyonundan sonra, her ikisi de birleşerek bileşenlerin atom numaralarının toplamı ile yeni elementler oluşturur. Periyodik sistem gelişir, yeni elementler keşfedilir. Modern bilgisayar teknolojisi kullanılarak hesaplanan olasılık teorisine göre, 8. periyodun, şimdiye kadar oktadekanoidler olarak adlandırılan 18 elementten oluşan yeni bir kimyasal olarak benzer elementler grubunun olacağı 50 element içermesi gerektiği tahmin edilmektedir. (Z=121-138). Olası kararlılığın üst sınırı, mevcut bilgi düzeyiyle belirlenebileceği gibi, atom numarası 174'e yakındır. Ancak, bu sınır değildir, çünkü örneğin, kimyasal elementlerin Seaborg kararlılık diyagramından, varlığın varlığı Atom numarası 500'e kadar olan elementler mümkündür.







