Molekül yapısı Molekül yapısı
MOLEKÜL YAPISI
MOLEKÜL YAPISI- (moleküler yapı), moleküllerdeki atomların karşılıklı düzenlenmesi. Sırasında kimyasal reaksiyonlar reaktiflerin moleküllerinde atomların yeniden düzenlenmesi vardır ve yeni bileşikler oluşur. Bu nedenle, temel kimyasal problemlerden biri, ilk bileşiklerdeki atomların düzenini ve bunlardan diğer bileşiklerin oluşumundaki değişikliklerin doğasını aydınlatmaktır. Moleküllerin yapısı hakkındaki ilk fikirler, maddenin kimyasal davranışının analizine dayanıyordu. Bu fikirler, biriken maddelerin kimyasal özellikleri hakkında bilgi olarak daha karmaşık hale geldi. Kimyanın temel yasalarının uygulanması, belirli bir bileşiğin molekülünü oluşturan atomların sayısını ve türünü belirlemeyi mümkün kıldı; bu bilgi kimyasal formülde yer almaktadır. Zamanla kimyagerler, aynı kimyasal formüllere sahip ancak farklı özelliklere sahip izomer molekülleri olduğundan, bir molekülü doğru bir şekilde karakterize etmek için tek bir kimyasal formülün yeterli olmadığını fark ettiler. Bu gerçek, bilim adamlarını, bir moleküldeki atomların, aralarındaki bağlarla stabilize edilmiş belirli bir topolojiye sahip olması gerektiği fikrine götürdü. Bu fikir ilk olarak 1858 yılında Alman kimyager F. Kekule tarafından ifade edilmiştir. Fikirlerine göre, bir molekül, yalnızca atomların kendilerini değil, aynı zamanda aralarındaki bağları da gösteren yapısal bir formül kullanılarak gösterilebilir. Atomlar arası bağlar da atomların uzaysal düzenine karşılık gelmelidir. Metan molekülünün yapısıyla ilgili fikirlerin gelişme aşamaları, Şek. 1. Yapı r modern verilere karşılık gelir: molekül, merkezinde bir karbon atomu bulunan ve köşelerde - hidrojen atomları bulunan düzenli bir tetrahedron şeklindedir.
Pirinç. 1. BİR METAN MOLEKÜLÜ GÖRÜNTÜLEMEK İÇİN DÖRT YÖNTEM. a - kimyasal formül. Yalnızca atomların sayısı ve türü belirtilir; b - yapısal formül; c - molekülün gerçek şeması; d - bir moleküldeki atomların uzaysal düzenlemesi.
Ancak bu tür çalışmalar, moleküllerin boyutu hakkında hiçbir şey söylemedi. Bu bilgi ancak uygun fiziksel yöntemlerin geliştirilmesiyle elde edilebilir hale geldi. Bunlardan en önemlisi X-ışını kırınımıydı. Saçılan resimlerden röntgen kristaller üzerinde, bir kristaldeki atomların tam konumunu belirlemek mümkün oldu ve moleküler kristaller için atomları tek bir molekülde lokalize etmek mümkün oldu. Diğer yöntemler, gazlardan veya buharlardan geçerken elektronların kırınımını ve moleküllerin dönme spektrumlarının analizini içerir. Tüm bu bilgiler sadece Genel fikir Molekülün yapısı hakkında. doğa Kimyasal bağlar moderni keşfetmenizi sağlar kuantum teorisi. Moleküler yapı henüz yeterince yüksek bir doğrulukla hesaplanamasa da, kimyasal bağlarla ilgili bilinen tüm veriler açıklanabilir. Yeni kimyasal bağ türlerinin varlığı bile tahmin edildi.
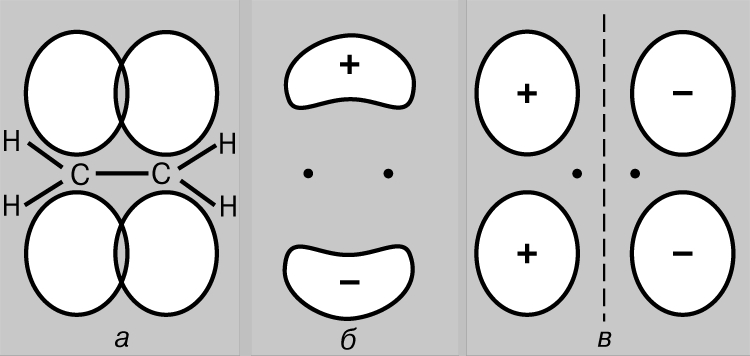
Basit kovalent bağ. Hidrojen molekülü H2 iki özdeş atomdan oluşur. Göre fiziksel ölçümler bağ uzunluğu - hidrojen atomlarının (protonlar) çekirdekleri arasındaki mesafe - 0.70'dir (1 = 10-8 cm), bu da temel durumda hidrojen atomunun yarıçapına karşılık gelir, yani. en düşük enerji durumunda. Atomlar arasındaki bağ, ancak elektronlarının esas olarak çekirdekler arasında lokalize olduğu, negatif yüklü bağlayıcı parçacıklardan oluşan bir bulut oluşturduğu ve pozitif yüklü protonları bir arada tuttuğu varsayılarak açıklanabilir. Temel durumdaki iki hidrojen atomunu düşünün, yani. elektronlarının 1s orbitalinde olduğu durum. Bu elektronların her biri bir dalga, yörünge ise duran bir dalga olarak düşünülebilir. Atomlar birbirine yaklaştığında, yörüngeler üst üste binmeye başlar (Şekil 2) ve sıradan dalgalarda olduğu gibi girişim meydana gelir - örtüşme bölgesinde dalgaların üst üste binmesi (dalga fonksiyonları). Dalga fonksiyonlarının işaretleri zıt ise girişim sırasında dalgalar birbirini yok eder (yıkıcı girişim), aynıysa eklenir (yapıcı girişim). Hidrojen atomları birbirine yaklaştığında, dalga fonksiyonlarının fazda (Şekil 2a) veya antifazda (Şekil 2b) olmasına bağlı olarak iki sonuç mümkündür. İlk durumda, yapıcı girişim meydana gelecek, ikincisinde - yıkıcı ve iki moleküler orbital görünecektir; bunlardan biri, çekirdekler arasındaki bölgede yüksek bir yoğunluk (Şekil 2c) ile karakterize edilirken, diğeri düşük yoğunluk (Şekil 2d) ile karakterize edilir - aslında, çekirdekleri ayıran sıfır genliğe sahip bir düğüm.
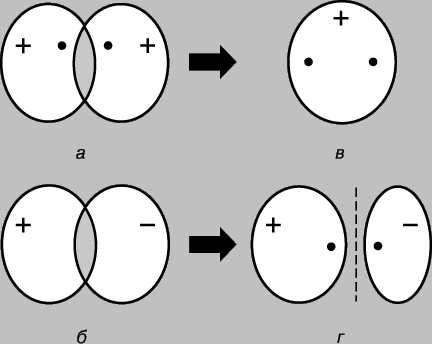
Pirinç. 2. HİDROJEN ATOMLARININ 1S Yörüngelerinin Örtüşmesinin Sonuçları. a - dalga fonksiyonlarının aşamaları çakışır; yapıcı girişim gözlemlenir ve bunun sonucunda çekirdekler (c) arasındaki bölgede yüksek yoğunluklu bir moleküler orbital oluşur; b - dalga fonksiyonlarının evreleri çakışmaz; atomlar (r) arasında düşük yoğunluklu bir moleküler orbital oluşumuyla sonuçlanan yıkıcı girişim meydana gelir.
Böylece hidrojen atomları yaklaştığında ve etkileşime girdiğinde, 1s orbitalleri iki moleküler orbital oluşturur ve iki elektron bunlardan birini doldurmalıdır. Atomlardaki elektronlar her zaman en kararlı konumu - enerjilerinin minimum olduğu konumu - işgal etmeye çalışırlar. Şekilde gösterilen yörünge için. Şekil 2c'de, çekirdekler arasındaki bölgede yüksek bir yoğunluk karakteristiktir ve bu yörüngeyi işgal eden her elektron çoğu zaman pozitif yüklü çekirdeklere yakın olacaktır, yani. onun potansiyel enerji küçük olacak. Aksine, Şekil 2'de gösterilen yörünge. 2d'de maksimum yoğunluk, çekirdeğin solunda ve sağında bulunan bölgelerde meydana gelir ve bu yörüngedeki elektronların enerjisi yüksek olacaktır. Dolayısıyla elektronlar, yörüngeyi işgal ettiklerinde daha az enerjiye sahiptir ve bu enerji, atomlar birbirinden sonsuz ayrı olsaydı sahip olacağından bile daha azdır. Bu durumda sadece iki elektron olduğu için, spinleri antiparalel ise her ikisi de enerji açısından daha avantajlı bir yörüngeyi işgal edebilir (Pauli ilkesi). Bu nedenle, iki hidrojen atomundan oluşan bir sistemin enerjisi, atomlar birbirine yaklaştıkça azalır ve daha sonra atomları birbirinden uzaklaştırmak için enerji gerekir, enerjiye eşit kararlı bir hidrojen molekülü H2 oluşumu. Bir hidrojen molekülünün varlığı için gerekli bir koşulun, yukarıda daha önce söylediklerimize uygun olarak, çekirdekler arasında elektronların tercihli lokalizasyonu olduğuna dikkat edin. Moleküler orbital c, bağlayıcı orbital, r orbitali ise gevşeyen orbital olarak adlandırılır. Şimdi iki helyum atomunun (atom numarası 2) yaklaşımını düşünün. Burada da 1s orbitallerinin örtüşmesi, biri daha düşük, diğeri daha yüksek enerjiye karşılık gelen iki moleküler orbitalin oluşumuyla sonuçlanır. Ancak bu sefer, her helyum atomundan 2 elektron olmak üzere 4 elektronun orbitallere yerleştirilmesi gerekiyor. Sadece ikisi düşük enerjili bağ orbitalini doldurabilir, diğer ikisi yüksek enerjili r orbitalini işgal etmelidir. İlk çiftin uygun lokalizasyonu nedeniyle enerjideki azalma, olumsuz nedeniyle enerjideki artışa yaklaşık olarak eşittir. ikinci çiftin konumu. Şimdi atomların yaklaşımı enerjide bir kazanç sağlamaz ve moleküler helyum He2 oluşmaz. Bu uygun bir şekilde bir diyagramla gösterilebilir (Şekil 3); üzerinde farklı yörüngeler şeklinde temsil edilir enerji seviyeleri elektronlar nerede bulunur. İkincisi, dönüşlerin yönlerini ayırt etmek için yukarı ve aşağı oklarla gösterilir. İki elektron, ancak spinleri antiparalel ise aynı yörüngeyi işgal edebilir.
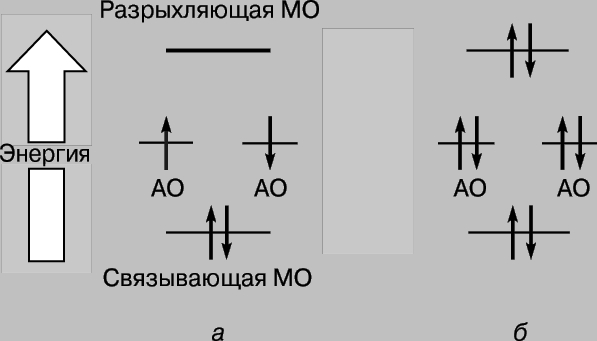
Pirinç. 3. (a) hidrojen ve (b) helyum moleküllerinin oluşumu sırasında ELEKTRON ENERJİSİNDEKİ DEĞİŞİMLER. Elektronlar, spinlerini ayırt etmek için yukarı ve aşağıyı gösteren oklarla gösterilmiştir. Düşük enerjili moleküler orbitaller bağ oluştururken, yüksek enerjili moleküler orbitaller anti-bağdır.
Bu genel ilkeler, atomlardan moleküllerin oluşumunda yerine getirilir. İki atom, atomik orbitalleri (AO) üst üste gelecek kadar yakınlaşır yaklaşmaz, iki moleküler orbital (MO) ortaya çıkar: biri bağlanma, diğeri gevşeme. AO'ların her birinin yalnızca bir elektronu varsa, her ikisi de AO'nunkinden daha düşük enerjili bir MO bağını işgal edebilir ve kimyasal bir bağ oluşturabilir. Şimdi kovalent olarak adlandırılan bu tür bağlar uzun zamandır kimyagerler tarafından bilinmektedir (kovalent bir bağ fikri, 1916'da Amerikalı fiziksel kimyager G. Lewis tarafından formüle edilen sekizli bağ teorisinin temelini oluşturdu). Oluşumları, bir çift elektronun etkileşime giren atomlarla sosyalleşmesiyle açıklandı. Modern kavramlara göre, bağ gücü, karşılık gelen orbitallerin örtüşme derecesine bağlıdır. Yukarıdakilerin tümü, atomlar arasındaki bağların sadece iki değil, aynı zamanda bir veya üç elektronun sosyalleşmesi sırasında da oluşabileceğini göstermektedir. Ancak, normalden daha zayıf olacaklar. değerlik bağları aşağıdaki nedenler. Tek elektronlu bir bağ oluştuğunda sadece bir elektronun enerjisi azalır ve üç elektronun sosyalleşmesi sonucu bağ oluşumu durumunda ikisinin enerjisi azalır, üçüncüsü ise tam tersine, artar, ilk iki elektrondan birinin enerjisindeki azalmayı telafi eder. Sonuç olarak, ortaya çıkan üç elektronlu bağ, normal kovalent bağdan iki kat daha zayıftır. Oluşum sırasında bir ve üç elektronun sosyalleşmesi gerçekleşir. moleküler iyon sırasıyla hidrojen H2+ ve HHe molekülleri. Genel olarak, bu tip bağlar nadirdir ve karşılık gelen moleküller oldukça reaktiftir.
değerlik. Verici-alıcı bağları. Yukarıdakilerin tümü, atomların, bir elektron tarafından işgal edilen orbitaller kadar çok sayıda kovalent bağ oluşturabileceğini varsayar, ancak bu her zaman böyle değildir. (Kabul edilen AO doldurma şemasında, önce kabuk numarasını, ardından yörünge tipini ve daha sonra yörüngede birden fazla elektron varsa, sayılarını (üst simge) belirtin. Yani, (2s) 2 gösterimi ikinci kabuğun s-orbitalinin iki elektron içerdiği anlamına gelir.) Temel durumdaki (3P) karbon atomu elektronik konfigürasyona (1s) 2 (2s) 2 (2px)(2py) sahiptir, iki orbital ise doldurulmamıştır. , yani bir elektron içerir. Bununla birlikte, iki değerlikli karbon bileşikleri çok nadirdir ve yüksek kimyasal aktiviteye sahiptir. Genellikle, karbon dört değerlidir ve bunun nedeni, dört boş yörünge ile uyarılmış 5S durumuna (1s) 2 (2s) (2px)(2py)(2pz) gitmenin çok az enerji gerektirmesidir. 2s elektronunun serbest 2p orbitaline geçişiyle ilişkili enerji maliyetleri, iki ek bağın oluşumu sırasında açığa çıkan enerji ile dengelenmekten daha fazladır. Doldurulmamış AO'nun oluşumu için bu sürecin enerjik olarak uygun olması gerekir. (1s) 2 (2s)2(2px)(2py)(2pz) elektronik konfigürasyonlu nitrojen atomu beş değerlikli bileşikler oluşturmaz, çünkü 2s elektronunu beş değerlikli konfigürasyonu (1s) oluşturmak için 3d orbitaline aktarmak için gereken enerji ) 2 (2s )(2px)(2py)(2pz)(3d) çok büyük. Benzer şekilde, (1s) 2 (2s)2(2p) olağan konfigürasyonuna sahip bor atomları, 2s elektronu 2p'ye geçtiğinde meydana gelen (1s) 2 (2s)(2px)(2py) uyarılmış durumda üç değerlikli bileşikler oluşturabilir. -AO, ancak beş değerlikli bileşikler oluşturmaz, çünkü uyarılmış duruma (1s)(2s)(2px)(2py)(2pz) geçiş, 1s-elektronlarından birinin daha fazlasına aktarılması nedeniyle yüksek seviye, çok fazla enerji gerektirir. Atomların aralarında bir bağ oluşumu ile etkileşimi, yalnızca yakın enerjili orbitallerin varlığında meydana gelir, yani. Aynı temel kuantum sayısına sahip yörüngeler. Periyodik tablonun ilk 10 elementi için ilgili veriler aşağıda özetlenmiştir. Bir atomun değerlik durumu, dört değerlikli karbon için 5S durumu gibi kimyasal bağlar oluşturduğu durumdur.
Bu modeller aşağıdaki örneklerde gösterilmiştir:
Yukarıdakilerin tümü yalnızca nötr atomlar için geçerlidir. İyonlar ve karşılık gelen atomlar farklı sayıda elektrona sahiptir; iyonlar, aynı sayıda elektrona sahip diğer atomlarla aynı değerliliğe sahip olabilir. Dolayısıyla, N+ ve B iyonları, nötr karbon atomuyla aynı sayıda elektrona (altı) sahiptir ve buna göre dört değerlidirler. Amonyum iyonları NH 4 + ve bor hidrit BH 4 - kompleks tuzlar oluşturur ve elektronik konfigürasyon metan CH4'e benzer. Şimdi amonyak NH3 ve bor triflorür BF3 moleküllerinin birbirine yaklaştığını varsayalım. Bir elektron bir nitrojen atomundan bir bor atomuna geçtiğinde, her biri boş bir yörüngeye sahip iki iyon, NH3+ ve BF3 - elde ederiz, bu da bir kovalent bağ oluşumuna yol açabilir. H3N-BF3 molekülü, 1,1,1-trifloroetan H3C-CF3'ün elektronik bir analogudur. Atomlar arası elektron transferi ve ardından kovalent bağ oluşumu sonucunda oluşan bağlara donör-alıcı bağları denir.
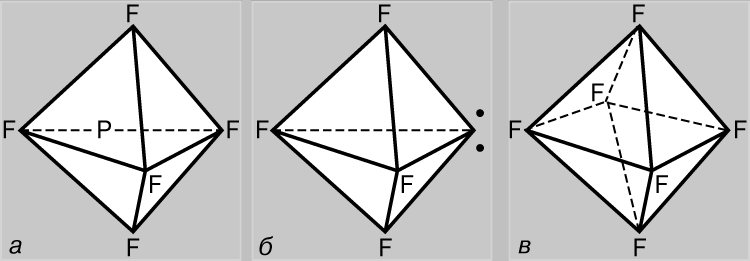
Moleküllerin geometrisi. Hibridizasyon. s hariç tüm atomik orbitaller küresel olarak asimetriktir ve diğer atomların AO ile örtüşme derecesi, orbitallerin karşılıklı yönelimine bağlıdır. Böylece, p-AO, başka bir atomun AO'su ile örtüşecektir. çoğu, ikincisi ekseni boyunca bulunuyorsa (Şekil 4a). Bu, AO örtüşmesinin bir sonucu olarak oluşan bağların belirli bir geometriye sahip olması gerektiği anlamına gelir. 5S durumundaki bir karbon atomunu düşünün. Üç p-orbitalinde ve dördüncü, küresel simetrik s-orbitalinde bir elektrona sahiptir. Oluşturduğu üç bağın dördüncüden farklı olacağı, p-bağlarının ise p-AO eksenleri boyunca karşılıklı olarak dik yönlerde yer alacağı görülüyor. Aslında, tamamen simetrik başka bir resim daha var. Bunu açıklamanın en kolay yolu aşağıdaki gibidir. Yörüngeler (2s)+(2px)+(2py)+(2pz) kümesi, dört çift elektron tutabilen belirli bir miktarda "yörünge alanı"dır. Tüm orbitalleri karıştırarak ve toplamlarını dört eşit parçaya bölerek bu durumun eşdeğer bir tanımını elde edebiliriz, böylece elde edilen karışık veya hibrit orbitallerin her biri bir çift elektrona sahip olur. Bu nedenle, karbonun 5S durumu (1s)2(t 1)(t 2)(t 3)(t 4) olarak temsil edilebilir, burada ti, simetrik dört değerlikli bir karbon molekülünün oluşumunu başarıyla açıklayan hibrit orbitallerdir. Şimdi p-AO ile s-AO karıştırıldığında ne olduğunu düşünelim. Girişim sırasında p-dambılın bir yarısının güçlendirilmesine, her zaman diğer yarısının zayıflaması eşlik edecektir (Şekil 4b), bu da asimetrik bir hibrit yörüngenin oluşmasına neden olacaktır (Şekil 4c). Yeterince güçlü bağların oluşumu ile aynı yönde yönlendirilmiş diğer yörüngeler tarafından etkin bir şekilde örtüşecektir. Bu, karbon atomunun AO hibridizasyonu yoluyla bağ oluşturmayı tercih etmesinin nedenlerinden biridir. Ama başka bir sebep daha var. Metan CH4 gibi tipik bir dört değerlikli karbon bileşiğini düşünün. İçinde, her hidrojen atomu, bir çift ortak elektron tarafından karbon atomuna yakın tutulur. Bu çiftler birbirini iter ve molekülün optimal konfigürasyonu, birbirlerinden mümkün olan maksimum uzaklıkta olacak şekildedir. Bu durumda, hidrojen atomları düzenli bir tetrahedronun köşelerinde yer alacak ve karbon atomu merkezinde olacaktır. Böyle bir geometri sözde kullanılarak gerçekleştirilebilir. sp3 hibrit yörüngeler, her biri 2s-AO'nun 1/4'ü ve 2p-AO'nun biri tarafından oluşturulur. Tüm bu orbitaller şekil olarak aynıdır, kolayca bağ oluşturur ve düzenli bir tetrahedronun merkezindeki karbon atomundan dört köşesine yönlendirilir (Şekil 1d).
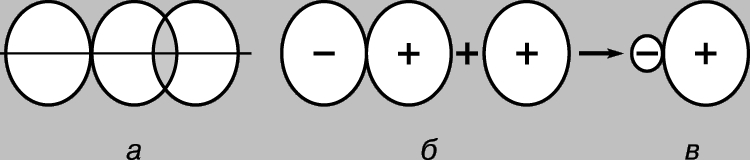
Pirinç. 4. p Yörüngesinin BAŞKA BİR ATOM Yörüngesiyle Örtüşmesi, ikincisi aynı eksen (a) boyunca yönlendirildiği zaman en verimlidir. Atomik p-orbitalinin s-orbital (b) ile örtüşmesi, asimetrik bir "dambıl" (c) oluşumuna yol açar.
Azot atomu sadece 2p-AO'nun yardımıyla, aralarındaki açılar 90° olan bağlar oluşturabilir, ancak "tetrahedral" ise 2. kabuğun bağ elektron çiftleri ile bağ yapmayan elektron çiftlerinin karşılıklı itmesi en aza indirilir. sp3 orbitalleri bağ oluşumuna katılır. Ancak burada başka bir özellik ortaya çıkıyor. N+ iyonu için, (1s)2(2s)(2p)3 ve (1s)2(t) 4 konfigürasyonları, burada t sp3 hibrit AO'lar aslında eşdeğerdir. Başka bir şey, 7. elektronu 2s-AO'yu işgal edebilen nötr nitrojen atomudur ve daha sonra (1s)2(2s)(2p) 4 konfigürasyonu veya konfigürasyondaki t-AO (1s) elde edilecektir. )2(t) 5 . 2s-AO, 2p-AO'nun altında ve dolayısıyla herhangi bir sp-hibritlenmiş yörüngenin altında bulunduğundan, ilk konfigürasyon enerjisel olarak daha uygundur ve diğer şeylerin eşit olması durumunda, üç değerlikli nitrojenin "hibritlenmemiş" konfigürasyonu tercih etmesi beklenir. Bununla birlikte, elektron çiftlerinin karşılıklı itilmesi, amonyak NH3 gibi bir nitrojen bileşiğindeki bağ açılarının düzenli bir tetrahedrondaki karşılık gelen açılara yakın olduğu hibridizasyonun meydana gelmesi için görünüşte yeterlidir, yani. 109°'ye kadar. Aynısı, su molekülü H 2 O'nun bileşimindeki iki değerlikli oksijen için de geçerlidir. Tüm bu durumlarda, bağlı atomlar tetrahedronun üç (veya iki) köşesini işgal eder ve 2. kabuğun yalnız elektron çiftleri kalan köşeleri işgal eder. . Benzer akıl yürütme, periyodik tablonun IV, V ve VI gruplarının diğer tipik elemanları için de geçerlidir. IV. grubun dört değerlikli elementleri (Si, Ge, Sn ve Pb) her zaman tetrahedral yapılar oluşturur, ancak V ve VI gruplarının diğer elementleri (P, S, As, Se, Sb, Te) nitrojen ve oksijenden farklıdır ve bileşikler oluşturur. 90°'ye yakın bağ açıları ile. Görünüşe göre daha büyük boy bu karşılıklı itme atomları değerlik elektronları N ve O için gözlemlenen hibridizasyonu mümkün kılmak için yeterli değildir.
d-orbitalleri içeren bağlar. Azotun aksine, fosfor atomu beş kovalent bağ oluşturabilir. Temel durumda, fosfor (1s) 2 (2s) 2 (2p) 6 (3s) 2 (3p x)(3p y)(3p z) konfigürasyonuna sahiptir ve nitrojen gibi PF'nin bileşiklerini oluşturan üç değerlidir. 3 tip. Ancak bu durumda, d-AO (3d) aynı prensibe sahip olduğundan, 3s elektronlarının bağ oluşumuna katılımı mümkündür. kuantum sayısı. Aslında, fosforun +5 değerlik durumunda olduğu, elektronik konfigürasyon (1s) 2 (2s) 2 (2p) 6 (3s)(3p x)( 3p y)(3p z )(3d); bu durumda bağlar, sp 3 d-hibridizasyonunun bir sonucu olarak oluşur (yani, bir s-, üç p- ve bir d-AO'nun karıştırılmasının bir sonucu olarak). Üçgen bipiramit, değerlik elektron çiftlerinin karşılıklı itmesini azaltma açısından en uygun yapıdır (Şekil 5a). Kükürt sadece iki değerli değil, aynı zamanda (1s) 2 (2s) 2 (2p) 6 (3s) 2 (3p x)(3p y) ( Sırasıyla 3p z)(3d) ve (1s) 2 (2s) 2 (2p) 6 (3s)(3p x)(3p y)(3p z)(3d 1)(3d 2). Dört değerlikli kükürt bileşiklerinde, 3. kabuğun elektronlarının karşılıklı itilmesi, tüm elektronlarının yörüngelerinin hibridizasyonu ile optimize edilir. Bu tip bileşiklerin yapısı PF5'inkine benzerdir, ancak üçgen çift piramidin köşelerinden biri 3. kabuğun bir çift yalnız elektronu tarafından işgal edilmiştir (Şekil 5b). Hekzavalent kükürt bileşiklerinde, sp 3 d 2 hibridizasyonu sırasında, tüm orbitaller eşdeğer olduğunda ve normal bir oktahedronun köşelerine doğru yönlendirildiğinde, elektronların karşılıklı itmesi en aza indirilir (Şekil 5c).
Pirinç. 5. FOSFOR PENTAFLUORÜR (a) 3s elektronunun katılımıyla oluşur. Kükürt tetraflorür molekülü (b) benzer bir şekle sahiptir, ancak üçgen bipiramidin köşelerinden biri 3. kabuğun (noktaların) bir çift paylaşılmamış elektronu tarafından işgal edilmiştir. Kükürt heksaflorürde (c), tüm yörüngeler eşdeğerdir ve normal bir oktahedronun köşelerine yönlendirilir.
Şimdiye kadar, sadece d-yörüngeli kabukların ya tamamen dolu ya da tamamen serbest olduğu periyodik tablonun elemanlarını ele aldık. Şimdi bu kabukların tam olarak doldurulmadığı geçiş elemanları üzerinde duralım. 3. kabuğun farklı yörüngelerindeki elektronların enerjisi aşağıdaki sırayla artar: 3s
Çoklu bağlantı. Bilinen karbon bileşiklerinden biri, her bir karbon atomunun sadece diğer üç atoma bağlı olduğu etilen C2H4'tür. Bora benzeterek, sp 2 hibrit orbitallerinin aynı düzlemde yer aldığı böyle bir geometrinin optimal olacağı varsayılabilir. Bu durumda, her karbon atomu, dört değerlik elektronundan birini içeren bir kullanılmamış (sp 2 hibridizasyonunda) p-orbitaline sahip olacaktır. Altı etilen atomunun tümü aynı düzlemde bulunuyorsa, kullanılmayan iki p-AO, Şekil 2'de gösterildiği gibi birbiriyle örtüşür. 6, bir. Bu örtüşme, bir çift MO oluşumuna yol açar: bir bağlanma (Şekil 6b) ve bir gevşeme MO (Şekil 6c). Her biri yalnızca bir elektron içerdiğinden, düşük enerjili bir MO oluşturabilirler. Böylece, karbon atomları arasında ek bir bağ ortaya çıkar ve etilenin yapısal formülü şu şekildedir:
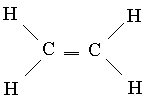
Bu yeni bağ türü, atomların bağlantı hattı boyunca orbitallerin üst üste gelmesiyle oluşanlardan iki açıdan farklıdır. Son türden bağlantılar, tek C-C bağlantıları, eksenel simetriktir ve bu nedenle bağlandıkları grupların dönüşünden etkilenmezler. Tersine, p- orbitallerinin örtüşmesi, etilen molekülündeki altı atomun hepsinin aynı düzlemde olup olmamasına bağlıdır, çünkü p-AO'ların optimal örtüşme için paralel olması gerekir. Bu nedenle, eğer tek bir C-C bağı etrafında dönme nispeten serbestçe gerçekleşebiliyorsa, o zaman bir C=C çift bağı etrafında bu çok zordur. Aslında, etilen molekülü katı bir düz yapıdır. İkinci fark, yörünge örtüşme derecesi ile ilgilidir. p-AO'nun çapraz örtüşmesi nispeten verimsizdir ve bu nedenle bu tip bağlanma zayıftır. Bu nedenle etilen, yalnızca tekli bağları olan doymuş bileşiklerden daha reaktiftir.
Pirinç. 6. EĞER ALTI ETİLEN ATOMUNUN TAMAMI aynı düzlemdeyse, kullanılmayan iki atomik p-orbital enine örtüşmeye katılır (a). Bu, bir çift moleküler orbitalin oluşumuna yol açar - bağlanma (b) ve gevşeme (c).
Atomların bağlantı çizgisi boyunca orbitaller üst üste geldiğinde (uzunlamasına üst üste binme) oluşan bağlara s-bağları ve enine üst üste bindiğinde - p-bağları denir. C2H2 asetilen gibi bazı bileşiklerin molekülleri üçlü bağ içerir. Onlarda, her karbon atomu, sp-hibrit orbitallerinin oluşturduğu s-bağları ile komşusuna bağlanır. Doğrusaldırlar, bu nedenle bir asetilen molekülündeki dört atom aynı düz çizgi üzerinde bulunur. Karbon atomlarının kalan p-AO'ları üst üste bindiklerinde iki p-bağı oluşturur.
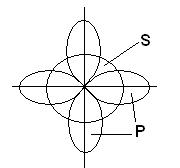
aromatik bileşikler. C6H6 benzen molekülü, her biri aynı zamanda bir hidrojen atomu bağlı olan altı üyeli bir karbon atomu halkası olarak temsil edilir (Şekil 7a). Her karbon atomunun üç komşusu olduğundan, karşılık gelen bağların sp 2 hibridizasyonu sonucu oluştuğu ve aynı düzlemde birbirine 120°'lik bir açıyla uzandığı varsayılabilir. Gerçekten de benzen molekülü düz bir yapıdır. Karbon atomlarının kullanılmayan p-AO'ları p-bağları oluşturabilir (Şekil 7b), ancak benzen için durum, AO çiftlerinin örtüşmesinin bir sonucu olarak bağların oluştuğu yukarıda belirtilen durumlardan daha karmaşıktır. Benzende, her bir karbon atomunun 2p-AO'su, tüm komşu atomların 2p-AO'su ile eşit derecede örtüşmelidir. (Burada, bir benzen molekülündeki orbitallerin örtüşmesini, iki yarıkta veya bir kırınım ızgarasında kırınan dalgaların örtüşmesini karşılaştırarak, çoklu dalga girişimi ile bir analoji çizebiliriz.) Sonuç olarak, benzen için bir dizi halka moleküler elde ederiz. altı karbon atomunun tamamını kapsayan orbitaller (Şekil 7, in). Böyle bir elektronik konfigürasyona sahip sistemin toplam enerjisi, p-AO'ların çiftler halinde sıradan p-bağları oluşturmasından daha azdır. Aslında benzen, "klasik" yapısına dayanarak beklendiğinden daha kararlı ve daha az aktiftir (Şekil 7d). Molekülündeki tüm bağlar simetriktir ve uzunlukları aynıdır ve mukavemet açısından tek ve çift bağlar arasında bir ara pozisyonda yer alırlar. P-elektronlarının "çok merkezli" MO'ların oluşumuna katıldığı ve bunun için başka bileşikler de bilinmektedir. benzer özellikler bağ uzunlukları ve kimyasal aktivite.
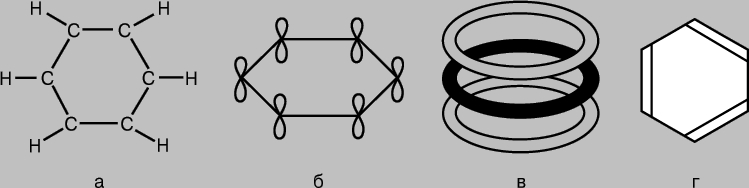
Pirinç. 7. BENZEN MOLEKÜLÜ C6H6, her biri aynı zamanda bir hidrojen atomuna (a) bağlı olan altı üyeli bir karbon atomu halkasıdır. Karbon atomlarının "ekstra" p-orbitalleri, p-bağlarının (b) oluşumu ile örtüşür ve bu, altı atomun tümünü (c) kapsayan bir dizi halka moleküler orbital ile sonuçlanır. Sonuç olarak benzen, "klasik" yapısından (d) beklenenden daha kararlı ve daha az aktif bir bileşiktir.
Çok merkezli bağlar içeren bileşikler. CH4 gibi basit moleküllerde bile, bireysel moleküler orbitaller zorunlu olarak birbirleriyle etkileşime girer. Bu nedenle, yerelleştirilmiş iki merkezli kovalent bağlar fikri sadece bir yaklaşım olarak kabul edilebilir. Bununla birlikte, bir kural olarak, yörünge örtüşme derecesi küçük olduğundan (aromatik ve ilgili bileşiklerde p-MO hariç) bu etkileşimler zayıftır. Bununla birlikte, elektronların üç veya daha fazla atom tarafından paylaşılması yoluyla bağların oluşumundan sorumlu, çoklu örtüşen AO'lara sahip moleküllerin varlığı göz ardı edilemez. Bir örnek, altı çift değerlik elektronuna sahip olan diboran B2H6'dır; bu, klasik H3B-BH3 yapısını oluşturmak için gereken yedi bağı oluşturmak için yeterli değildir. H. Longe-Higgins, Şekil 2'de gösterilen diboran yapısını önerdi. 8, bir. Bu yapıda, merkezi hidrojen atomları, iki bor atomunun sp3 hibrit orbitallerinin hidrojen atomunun 1s-AO'su ile örtüşmesi sonucu oluşan üç merkezli bağlarla bağlanır (Şekil 8b). Altı çift değerlik elektronundan dördü, "terminal" hidrojen atomlu sıradan s-bağlarının ve iki çift - üç merkezli bağların oluşumunda rol oynar. Çok merkezli bir bağın daha karmaşık bir örneği, dibenzenkrom molekülü tarafından sağlanır (Şekil 8c). Bu moleküldeki benzen halkaları, benzenin p-MO'sunun merkezi atomun 3d-, 4s- ve 4p-AO ile örtüşmesinin bir sonucu olarak oluşan karmaşık çok merkezli orbitallerle metal atomuna bağlanır. Bir sandviç yapıya sahip olan diğer benzer bileşikler de bilinmektedir.
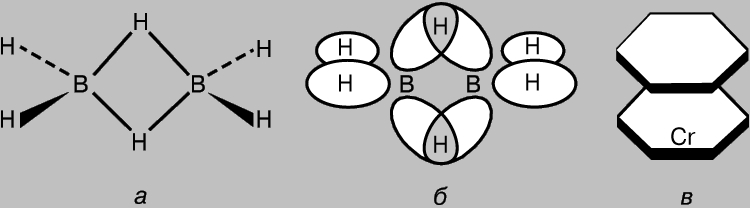
Pirinç. 8. DİBORAN (a)'da hidrojen atomları, iki bor atomunun sp3 hibrit orbitallerinin hidrojenin (b) 1s atomik orbitaliyle örtüşmesi sonucu oluşan üç merkezli bağlarla bağlanır. Bu tip bağların oluşumunun daha karmaşık bir örneği, dibenzenkrom molekülüdür (c).
umutlar. Bugüne kadar, moleküllerin yapısının genel ilkelerinin kurulmuş olduğu kabul edilebilir. Biyolojik olanlar da dahil olmak üzere karmaşık moleküllerin yapısını belirlemek için fizikokimyasal yöntemler geliştirilmiştir. Yakın gelecekte, birbiriyle ilişkili iki yönde ilerleme mümkündür. Birincisi, kuantum mekaniksel hesaplamaların doğruluğunda bir artış ve ikinci olarak bir gelişme beklenmelidir. deneysel yöntemler karşılık gelen moleküler parametrelerin ölçümleri.
EDEBİYAT
Kondratiev V.N. Atomların ve moleküllerin yapısı. M., 1959 Coulson C. Valence. M., 1965 Slater J. elektronik yapı moleküller. M., 1965 Cartmell E., Fauls G. Moleküllerin değeri ve yapısı. M., 1979
Karbon monoksit olarak da bilinen karbon monoksit, çok güçlü bir moleküler bileşime sahiptir, içeriğinde inerttir. kimyasal özellikler ve suda az çözünür. Bu bileşik aynı zamanda inanılmaz derecede zehirlidir; solunum sistemine girdiğinde kan hemoglobini ile birleşir ve dokulara ve organlara oksijen taşımayı durdurur.
Kimyasal isimler ve formül
Karbon monoksit, karbon monoksit II de dahil olmak üzere başka isimlerle de bilinir. Günlük yaşamda genellikle karbon monoksit olarak adlandırılır. Bu karbon monoksit zehirli, renksiz, tatsız ve kokusuz bir gazdır. Kimyasal formülü CO'dur ve bir molekülün kütlesi 28.01 g/mol'dür.

Vücut üzerindeki etkisi
Karbon monoksit hemoglobin ile birleşerek oksijen taşıma kapasitesi olmayan karboksihemoglobini oluşturur. Buharlarının solunması merkezi sinir sistemine (merkezi gergin sistem) ve boğulma. Ortaya çıkan oksijen eksikliği, baş ağrısına, baş dönmesine, kalp hızının ve solunum hızının azalmasına neden olarak bayılmaya ve ardından vücudun ölümüne neden olur.

Toksik gaz
Karbon monoksit, örneğin motorlarda, karbon içeren maddelerin kısmi yanması ile üretilir. içten yanma. Bileşik, 1 oksijen atomuna kovalent olarak bağlı 1 karbon atomu içerir. Karbon monoksit oldukça zehirlidir ve dünya çapında ölümcül zehirlenmelerin en yaygın nedenlerinden biridir. Maruz kalma, kalbe ve diğer organlara zarar verebilir.
Karbon monoksitin faydaları nelerdir?
Ciddi toksisitesine rağmen, karbon monoksit son derece faydalıdır - modern teknolojiler sayesinde ondan bir dizi hayati ürün yaratılmıştır. Karbon monoksit, bugün bir kirletici olarak kabul edilmesine rağmen, doğada her zaman mevcut olmuştur, ancak örneğin karbondioksit gibi miktarlarda değil.
Bileşik karbon monoksitin doğada bulunmadığına inananlar yanılıyorlar. CO, dünyanın mantosunda yüksek basınçlarda erimiş volkanik kayalarda çözünür. Volkanik gazlardaki karbon oksit içeriği, yanardağa bağlı olarak %0.01'den %2'ye kadar değişir. Bu bileşiğin doğal değeri sabit bir değer olmadığı için doğal gaz emisyonlarını doğru bir şekilde ölçmek mümkün değildir.

Kimyasal özellikler
Karbon monoksit (formül CO), tuz oluşturmayan veya kayıtsız oksitleri ifade eder. Ancak +200 o sıcaklıkta sodyum hidroksit ile reaksiyona girer. Bu sırada sodyum format oluşumu meydana gelir:
NaOH + CO = HCOONa (formik asit tuzu).
Karbon monoksitin özellikleri, indirgeme kabiliyetine dayanmaktadır. Karbonmonoksit:
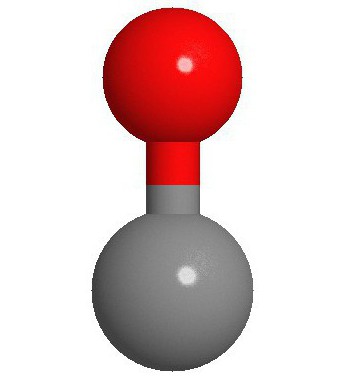
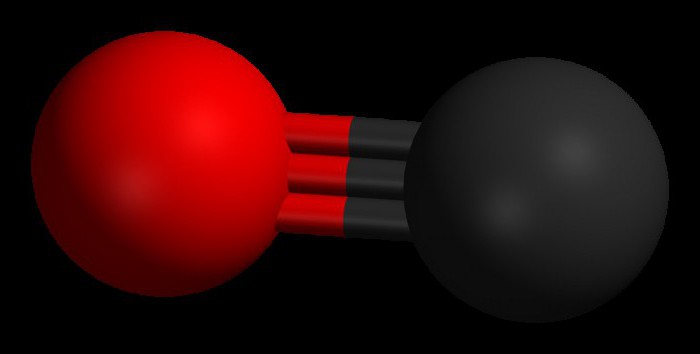
molekül yapısı
Karbon monoksit (CO) molekülünü oluşturan iki atom, üçlü bir bağla bağlanır. Bunlardan ikisi, karbon atomlarının p-elektronlarının oksijen ile füzyonu ile oluşur ve üçüncüsü, serbest 2p karbon yörüngesi ve 2p elektron oksijen çifti nedeniyle özel bir mekanizmadan kaynaklanır. Bu yapı moleküle yüksek mukavemet sağlar.
biraz tarih
Daha fazla Aristoteles Antik Yunan yanan kömürlerden çıkan zehirli dumanları anlattı. Ölüm mekanizmasının kendisi bilinmiyordu. Ancak, eski infaz yöntemlerinden biri, suçluyu için için yanan kömürlerin olduğu bir buhar odasına kilitlemekti. Yunan doktor Galen, havanın bileşiminde solunduğunda zarar veren bazı değişikliklerin meydana geldiğini öne sürdü.
İkinci Dünya Savaşı sırasında, dünyanın benzin ve dizelin kıt olduğu bölgelerinde motorlu taşıtlar için yakıt olarak karbon monoksit katkılı gaz kullanıldı. Harici (birkaç istisna dışında) odun kömürü veya odun gazı jeneratörleri kuruldu ve atmosferik nitrojen, karbon monoksit ve az miktarda diğer gazların bir karışımı bir gaz karıştırıcısına beslendi. Sözde odun gazıydı.
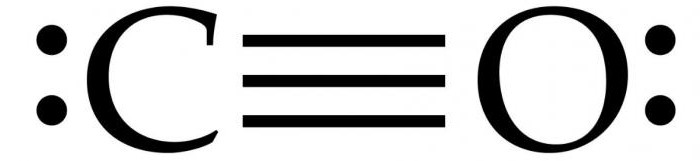
Karbon monoksitin oksidasyonu
Karbon monoksit, karbon içeren bileşiklerin kısmi oksidasyonu sırasında oluşur. CO, bir fırın veya içten yanmalı bir motorun kapalı bir alanda çalıştırılması gibi, karbondioksit (CO2) üretmek için yeterli oksijen olmadığında oluşur. Oksijenin yanı sıra belirli diğer atmosferik konsantrasyonlar mevcutsa, karbon monoksit yanar, mavi ışık yayar ve karbondioksit olarak bilinen karbon dioksit üretir.
1960'lara kadar iç mekan aydınlatması, pişirme ve ısıtma için yaygın olarak kullanılan kömür gazı, baskın yakıt bileşeni olarak CO2'ye sahipti. Bazı süreçlerde modern teknolojiler demir eritme gibi, hala yan ürün olarak karbon monoksit üretir. CO bileşiğinin kendisi oda sıcaklığında CO2'ye oksitlenir.
CO doğada var mı?
Doğada karbon monoksit var mı? Doğal olarak oluşan kaynaklarından biri, fotokimyasal reaksiyonlar troposferde meydana gelir. Bu proseslerin yılda yaklaşık 5×10 12 kg e maddesi üretebilmesi beklenmektedir. Diğer kaynaklar arasında, yukarıda belirtildiği gibi, yanardağlar, orman yangınları ve diğer yanma türleri bulunmaktadır.
moleküler özellikler
Karbon monoksit vardır molar kütle 28.0, havadan biraz daha az yoğun hale getirir. İki atom arasındaki bağ uzunluğu 112,8 mikrometredir. Bu, en güçlü kimyasal bağlardan birini sağlayacak kadar yakındır. Bir CO bileşiğindeki her iki element birlikte bir değerlik kabuğunda yaklaşık 10 elektrona sahiptir.
Kural olarak, organik karbonil bileşiklerinde bir çift bağ oluşur. Karakteristik özellik CO molekülü, 3 bağlı moleküler orbitalde 6 ortak elektronlu atomlar arasında güçlü bir üçlü bağın ortaya çıkmasıdır. Paylaşılan elektronların 4'ü oksijen atomundan ve sadece 2'si karbondan geldiğinden, bir bağlı orbital, O2'den iki elektron tarafından işgal edilir ve bir datif veya dipol bağı oluşturur. Bu, karbon üzerinde küçük bir "-" yük ve oksijen üzerinde küçük bir "+" yük ile molekülün bir C ← O polarizasyonuna neden olur.
Kalan iki bağlı orbital, karbondan ve oksijenden yüklü bir parçacık işgal eder. Molekül asimetriktir: oksijen, karbondan daha yüksek bir elektron yoğunluğuna sahiptir ve ayrıca negatif karbona kıyasla biraz pozitif yüklüdür.
Fiş
Endüstride karbon monoksit CO, havaya erişimi olmayan karbon dioksit veya su buharının kömürle ısıtılmasıyla elde edilir:
CO2 + C \u003d 2CO;
H 2 O + C \u003d CO + H 2.
Son elde edilen karışıma su veya sentez gazı da denir. Laboratuvar koşullarında, karbon monoksit II, organik asitleri dehidrasyon maddesi olarak işlev gören konsantre sülfürik aside maruz bırakarak:
HCOOH \u003d CO + H20;
H 2 C 2 O 4 \u003d CO 2 + H 2 O.
CO zehirlenmesi için ana semptomlar ve yardım
Karbon monoksit zehirlenmeye neden olur mu? Evet ve çok güçlü. Karbon monoksit zehirlenmesi dünya çapında en yaygın olaydır. En yaygın semptomlar:
- zayıflık hissi;
- mide bulantısı;
- baş dönmesi;
- tükenmişlik;
- sinirlilik;
- iştahsızlık;
- baş ağrısı;
- oryantasyon bozukluğu;
- görme bozukluğu;
- kusmak;
- bayılma;
- konvülsiyonlar.
Bu zehirli gaza maruz kalmak, genellikle uzun süreli kronik rahatsızlıklara yol açabilen önemli hasarlara neden olabilir. Karbon monoksit hamile bir kadının fetüsüne ciddi zarar verebilir. Mağdurlara, örneğin bir yangından sonra acil yardım sağlanmalıdır. ambulans çağırmak, temiz havaya erişim sağlamak, nefes almayı kısıtlayan, sakin, sıcak giysiler çıkarmak acildir. Şiddetli zehirlenme, kural olarak, bir hastanede sadece doktorların gözetiminde tedavi edilir.
Başvuru
Karbon monoksit, daha önce de belirtildiği gibi, zehirli ve tehlikelidir, ancak modern endüstride organik sentez için kullanılan temel bileşiklerden biridir. CO saf metaller, karboniller, fosgen, karbon sülfür üretmek için kullanılır, metil alkol, formamid, aromatik asitler. Bu madde aynı zamanda yakıt olarak da kullanılır. Toksisitesine ve zehirli olmasına rağmen, genellikle üretim için bir hammadde olarak kullanılır. çeşitli maddeler kimya endüstrisinde.
Karbon Monoksit vs Karbon Dioksit: Fark Nedir?
Karbon monoksit ve karbon dioksit (CO ve CO2) sıklıkla birbiriyle karıştırılır. Her iki gaz da kokusuz ve renksizdir ve her ikisi de kardiyovasküler sistemi olumsuz etkiler. Her iki gaz da vücuda soluma, deri ve göz yoluyla girebilir. Bu bileşikler, canlı bir organizmaya maruz kaldıklarında bir takım ortak semptomlara sahiptir - baş ağrıları, baş dönmesi, kasılmalar ve halüsinasyonlar. Çoğu insan aradaki farkı söylemekte zorlanır ve araba egzozunun hem CO hem de CO 2 yaydığının farkında değildir. İç mekanlarda, bu gazların konsantrasyonundaki bir artış, bunlara maruz kalan kişinin sağlığı ve güvenliği için tehlikeli olabilir. Fark ne?
Yüksek konsantrasyonlarda her ikisi de ölümcül olabilir. Fark, CO 2'nin tüm bitki ve hayvan yaşamı için gerekli olan yaygın bir doğal gaz olmasıdır. CO yaygın değildir. Oksijensiz yakıt yanmasının bir yan ürünüdür. Kritik kimyasal fark, CO2'nin bir karbon atomu ve iki oksijen atomu içerirken CO'nun yalnızca bir tane içermesidir. Karbondioksit yanıcı değildir, monoksitin tutuşma olasılığı daha yüksektir.
Karbondioksit atmosferde doğal olarak oluşur: insanlar ve hayvanlar oksijenle nefes alır ve karbondioksiti dışarı verir, bu da canlıların küçük miktarlarına dayanabileceği anlamına gelir. Bu gaz, bitkiler tarafından fotosentezin gerçekleştirilmesi için de gereklidir. Ancak karbon monoksit atmosferde doğal olarak oluşmaz ve düşük konsantrasyonlarda bile sağlık sorunlarına neden olabilir. Her iki gazın yoğunluğu da farklıdır. Karbon dioksit havadan daha ağır ve yoğunken, karbon monoksit biraz daha hafiftir. Evlere uygun sensörler kurulurken bunların bu özelliği dikkate alınmalıdır.
Kimyasal bağ ile kastedilen Farklı çeşit iki ve çok atomlu bileşiklerin kararlı varlığına neden olan etkileşimler: moleküller, iyonlar, kristalli maddeler. Doğası gereği, kimyasal bir bağ, pozitif yüklü çekirdekler ile negatif yüklü elektronların yanı sıra elektronların birbirleriyle etkileşimidir. Ana kimyasal bağ türleri: kovalent, iyonik, metalik. Bir kovalent bağı tanımlamak için iki yöntem kullanılır - değerlik bağ yöntemi (MVS) ve moleküler yörünge yöntemi (MMO).
VS yöntemi aşağıdaki hükümlere dayanmaktadır:
1. Yalnızca zıt yönlere sahip iki atomun eşleşmemiş elektronları, bir kovalent bağın (bağ oluşumu için bir değişim mekanizması) veya bir atomun elektron çiftinin oluşumuna katılır.
Başka bir atomun verici ve serbest yörüngesi - alıcı (verici-alıcı mekanizması).
2. Örtüşmenin bir sonucu olarak iki atom arasında bir kovalent kimyasal bağ oluşur. atomik yörüngeler elektron çiftlerinin oluşumu ile (iki elektronun sosyalleşmesi).
Değerlik bağları teorisine göre, bir kovalent bağ, etkileşen atomların atomik orbitallerinin maksimum örtüşmesine yöneliktir.
İkiden fazla atomdan oluşan bir molekülün geometrik (uzaysal) yapısı, karşılıklı düzenleme kimyasal bağların oluşumunda rol oynayan atomik orbitaller. AB 2 molekülü doğrusal olabilir ![]() , veya açısal bir yapı (a). AB 3 molekülü, düzenli bir üçgen (b), bir üçgen piramit (c) şeklinde olabilir. AB 4 molekülü bir tetrahedron (d) şeklindedir.
, veya açısal bir yapı (a). AB 3 molekülü, düzenli bir üçgen (b), bir üçgen piramit (c) şeklinde olabilir. AB 4 molekülü bir tetrahedron (d) şeklindedir.
a) 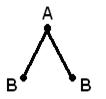 b)
b) 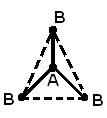 içinde)
içinde) 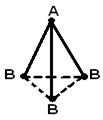 G)
G) 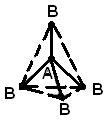
Bir molekülün uzaysal yapısı, merkezi atomun değerlik orbitallerinin hibridizasyon tipi ve değerlik elektron katmanında bulunan paylaşılmamış elektron çiftlerinin sayısı ile belirlenir.
örnek 1 Değerlik bağları yöntemi açısından moleküllerin yapısını tanımlayın: a) РН 3 , b) BBr 3 . Kimyasal bağların oluşumunda hangi atomik orbitaller yer alır? Hibridizasyon tipini belirtin (hibridizasyon meydana gelirse). Bu moleküllerin uzaysal yapısı nedir?
Çözüm. a) PH 3 molekülünün oluşumu.
PH 3 molekülünü zemin (normal) halde oluşturan atomların elektronik formüllerini yazalım: 15 Р 1s 2 2s 2 2p 6 3s 2 3p 3 ; 1 H 1s 1
Bu atomların dış seviyesinin elektron grafik formülleri:
Bu molekülde, merkezi atom, aynı alt seviyede bulunan ve aynı şekle ve aynı enerjiye sahip olan üç kimyasal bağın oluşumuna sadece p orbitallerinin katıldığı bir fosfor atomudur. Sonuç olarak, PH 3 molekülünde hibridizasyon yoktur.
Değerlik şemalarının görsel bir temsili için aşağıdaki yöntem kullanılabilir. Dış elektron tabakasında bulunan elektronlar, atomun kimyasal sembolü etrafında bulunan noktalarla gösterilir. İki atom için ortak olan elektronlar, kimyasal sembolleri arasına yerleştirilmiş noktalarla gösterilir; bir ikili veya üçlü bağ, sırasıyla iki veya üç çift ortak nokta ile gösterilir. Bu gösterimler kullanılarak PH 3 molekülünün oluşumu aşağıdaki gibi gösterilebilir:
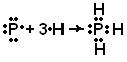 H
H
ê
Bu şema farklı şekilde yazılabilir: H - P - H, burada iki atomu bağlayan her elektron çifti, yapısal formüllerde bir kovalent bağı gösteren bir çizgiye karşılık gelir.
p - fosfor atomunun elektron bulutları karşılıklı olarak dik yönlerde (koordinat eksenleri boyunca) yönlendirilir -p x, p y, p z ve dambıl şeklindedir. Bir kimyasalın oluşumunda hidrojen atomunda R-N iletişimi küresel bir bulut şekline sahip bir s-elektronu söz konusudur. Bir PH 3 molekülü oluştuğunda, fosfor atomunun p-elektron bulutları, üç hidrojen atomunun s-elektron bulutları ile örtüşür:
Değerlik bağları yönteminin gereklerine uygun olarak, üç bağ
P - H, 90 ° C'ye yakın açılarda yerleştirilmelidir. Bu nedenle, tekli bağların uzaysal düzeni, molekülün geometrik yapısını belirler. PH 3 molekülü, üçgen bir piramit şeklinde olmalıdır:
Piramidin tepesinde bir fosfor atomu, tabanın tepesinde ise hidrojen atomları bulunur.
b) BBr 3 molekülünün oluşumu. Вr 3 molekülünde, merkezi atom bir bor atomudur.
Atomların elektronik formülleri:
5 V 1s 2 2s 2 2p 1 35 Br 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 5
Dış seviyenin elektronik grafik formülleri şu şekildedir:
Bileşikteki bor üç değerli olduğundan, uyarılmış halde bor atomunun elektron grafik formülünü yazıyoruz:
BBr 3 molekülünde üç kimyasal bağın oluşumunda, farklı alt seviyelerde yer alan ve farklı şekil ve farklı enerji
Bu durumda, uyarılmış bor atomunun orijinal bir s- ve iki p-orbitali yerine, üç eşdeğer hibrit orbital oluşur (sp 2 - hibridizasyon). sp 2 hibridizasyonu ile hibrit elektron bulutları, aynı düzlemde yer alan ve birbirine 120 ° açıyla yönlendirilmiş yönlerde düzenlenir:
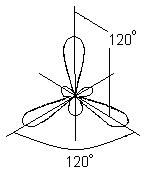
Bu tür hibridizasyon, düz üçgen bir molekülün oluşumuna karşılık gelir. BBr 3 molekülü oluşturulduğunda, bor atomunun üç hibrit orbitali, üç brom atomunun p-elektronik orbitalleri ile örtüşür:
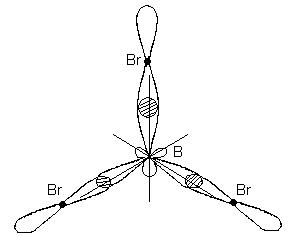
BBr 3 molekülü, merkezde bir bor atomu ve köşelerde brom atomları ile düz bir düzenli üçgen şeklindedir. BBr 3 molekülündeki üç B-Br bağının tümü eşdeğerdir.
Örnek 2 Moleküler orbital yöntemini kullanarak F 2 molekülü ve F 2 + moleküler iyon oluşumu için enerji şemalarını çizin. Bağ ve karşı bağ orbitallerinde kaç elektron vardır? Bu parçacıklardaki bağ sırası nedir? Manyetik özelliklerini (paramanyetizma veya diamanyetizma) belirtin.
Çözüm. Moleküler orbitaller (MMO) teorisine göre, bir molekül, her elektronun diğer elektronlar ve tüm çekirdekler alanında hareket ettiği, pozitif yüklü çekirdekler ve negatif yüklü elektronlar topluluğu olarak kabul edilir.
MMO teorisine göre bir molekülü tanımlamak, orbitallerinin tipini, enerjilerini belirlemek ve elektronların orbitaller üzerindeki dağılımının doğasını belirlemek anlamına gelir.
Bir molekül oluştuğunda, iki tür moleküler orbital ortaya çıkar - bağlanma ve gevşeme. Atomlardan bir molekülün oluşumu sırasında, bir elektronun moleküler bir yörüngeye geçişine enerjide bir azalma eşlik ediyorsa, böyle bir moleküler yörünge bağlama. Bir elektronun moleküler orbitale geçişine enerjide bir artış eşlik ederse, böyle bir moleküler orbital olacaktır. gevşeme.
Moleküllerdeki elektronlar s ve p moleküler orbitallerinde bulunur. s-orbitalleri, örtüşen s - atomik orbitaller ve örtüşen 2p x - atomik orbitaller tarafından oluşturulabilir. Bu durumda moleküler orbitaller oluşur: s-bağ (s st) ve s-gevşeme (s raz). 2p y ve 2p z atomik orbitalleri çakıştığında, moleküler orbitaller oluşur: p sv2Py, p sv2P z ve p kez2Py, p kez2P z. Elektronların moleküler orbitallerdeki yerleşim sırası atomik orbitallerdekiyle aynıdır, yani en az enerji ilkesine, Pauli'nin ilkesine, Hund'un kuralına karşılık gelir.








