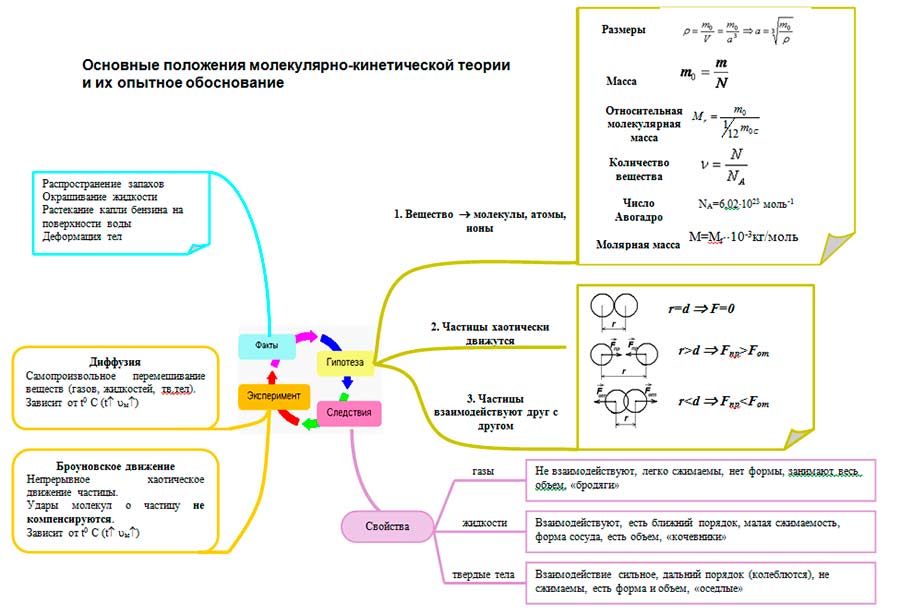
Moleküler kinetiğin ana hükümlerini formüle edin. Tüm bedenler parçacıklardan oluşur - atomlar, moleküller, iyonlar. Moleküler Kinetik Teorinin Temel Hükümleri
Moleküler Kinetik Teorinin Temel Hükümleri
Moleküler fiziğin temel görevi nedir? Moleküler Kinetik Teori Nedir? Moleküler-kinetik teorinin ana hükümlerini formüle edin. Hangi gözlemler ve deneyler moleküler kinetik teorinin ana hükümlerini doğrular? Molekül nedir? atom?
Moleküler fiziğin temel görevi nedir? Tüm cisimlerin ayrı, rastgele hareket eden parçacıklardan oluştuğu fikrine dayanarak, makroskopik cisimlerin özelliklerini ve bunlarda meydana gelen termal süreçleri açıklayın.
Moleküler Kinetik Teori Nedir? Moleküler-kinetik teori (MKT), bir maddenin yapısını üç ana yaklaşık olarak doğru hüküm açısından ele alan bir teoridir.
Moleküler-kinetik teorinin ana hükümlerini formüle edin. tüm cisimler parçacıklardan oluşur, aralarında boşluklar vardır parçacıklar sürekli kaotik hareket halindedir parçacıklar birbirleriyle etkileşime girer
Hangi gözlemler ve deneyler moleküler kinetik teorinin ana hükümlerini doğrular? difüzyon Brown hareketi Dunoyer ve Stern'in Deneyleri
Molekül nedir? atom? Molekül, bağımsız bir parçacıktır, tüm kimyasal ve fiziksel özellikler bu madde. Herhangi bir molekül, en basit bağımsız parçacıklardan oluşur - atomlar. Atom - en basitlerinden herhangi birinin mümkün olan en küçük parçacığı kimyasal maddeler elemanlar denir.
Moleküler kinetik teorinin ana hükümleri kapsamlı deneysel doğrulamaya tabi tutulmuştur. Bir maddenin moleküler yapısını gösteren ve moleküler kinetik teoriyi doğrulayan en ünlü deneyler, sırasıyla 1911 ve 1920'de gerçekleştirilen Dunoyer deneyi ve Otto Stern deneyidir (1888 - 1969). Bu deneylerde, çeşitli metallerin buharlaştırılmasıyla moleküler ışınlar oluşturuldu ve bu nedenle incelenen gazların molekülleri bu metallerin atomlarıydı. Bu tür deneyler, molekülleri olarak kabul edilebilecek gazlar için verdiği moleküler-kinetik teorinin tahminlerini doğrulamayı mümkün kıldı. maddi noktalar yani tek atomlu gazlar için.
Dunoyer'in deneyi Dunoyer'in moleküler ışınlarla deneyinin şeması, Şek. 1. Malzemesi yüksek vakum sağlayacak şekilde seçilmiş bir cam kap, diyaframlı iki bölme ile üç bölmeye 1, 2 ve 3'e ayrılmıştır. 4. Bölme 1'de gaz vardı. bu deneyde ısıtılarak elde edilen sodyum buharı kullanıldı. Bu gazın molekülleri, diyaframlardaki deliklerden serbestçe uçabilir, moleküler demeti (5) hizalayarak, yani yalnızca küçük bir katı açı içinde geçmesine izin verebilir. 2. ve 3. bölmelerde, sodyum atomlarının hava molekülleri ile çarpışmadan içinden geçebilmesi için ultra yüksek bir vakum yaratıldı. Dağılmayan moleküler ışın, kabın uç duvarında bir iz 6 bıraktı, ancak ultra yüksek vakum durumunda bile, moleküler ışın diyaframların 4 kenarlarında dağıldı. Bu nedenle, uçta bir “penumbra” bölgesi 7 vardı. saçılma geçiren parçacıkların iz bıraktığı kabın duvarı. Bölme 3'teki vakum kötüleştikçe bölge 7 arttı. Saçılan sodyum atomlarının izinin bulaşmasının büyüklüğünden, serbest yollarının uzunluğunu tahmin etmek mümkün oldu. Bu tür tahminler, Dunoyer'inkine benzer deneylerin sonuçlarına dayanarak Max Born (1882 - 1970) tarafından yapılmıştır.
Otto Stern Deneyi Moleküler ışınlarla ilgili en ünlü deneylerden biri, ilk kez moleküler hızların doğrudan ölçümlerinin yapılmasının mümkün olduğu Stern deneyleriydi. Stern'in deneyinin en ünlü şeması, Şek. 2. Üzerine bir damla gümüş uygulanan platin iplik 1, iki koaksiyel silindir 2 ve 3'ün eksenine yerleştirildi ve silindir 2'de eksenine paralel bir yarık vardı. Silindirler kendi ekseni etrafında dönebilir. Stern'in deneylerinde, dönüşlerinin açısal hızı dakikada 2...3 bin devirdi. Platin iplikten geçirildiğinde elektrik akımı o ısındı Maksimum sıcaklık yaklaşık 1200 oС. Sonuç olarak, gümüş buharlaşmaya başladı, atomları 2. silindirin 4. yuvasından uçtu ve 3. silindirin yüzeyine yerleşti ve üzerinde çizgisel dağılımlarına karşılık gelen 5. iz bıraktı. Silindirlerin dönüşü, silindirlerle ilişkili referans çerçevesindeki moleküllerin yörüngesinde bir eğriliğe ve sonuç olarak, dış silindire yerleşen gümüş atomlarının konumunda bir değişikliğe yol açtı. Yerleşmiş moleküllerin yoğunluğunu analiz ederek, hıza göre moleküllerin dağılımının özelliklerini, özellikle yolun kenarlarına karşılık gelen maksimum ve minimum hızları tahmin etmek ve ayrıca maksimuma karşılık gelen en olası hızı bulmak mümkün oldu. Yerleşik moleküllerin yoğunluğu.
Pirinç. 1 - Dunoyer deneyinin şeması 1 - gazla dolu bölme 2 ve 3 - ultra yüksek vakumlu bölmeler 4 - diyaframlı bölmeler 5 - moleküler ışın 6 - saçılmamış bir ışın izi 7 - saçılan moleküllerin izi
Şekil 2 - Stern deneyinin şeması 1 - moleküllerin kaynağı 2 ve 3 - dönen silindirler 4 - moleküler ışını sınırlayan yarık 5 - moleküler ışının izi
Difüzyon Difüzyon, bir maddenin molekülünün diğerinin molekülleri arasına karşılıklı olarak nüfuz etmesi olgusudur. Difüzyon gazlarda (çok hızlı), sıvılarda (hızlı), metallerde (çok yavaş) meydana gelebilir.
Brown hareketi Brown hareketi, bir sıvı veya gaz içinde asılı duran parçacıkların termal hareketidir. Brown hareketinin nedenleri şunlardır: 1. Moleküllerin rastgele hareketi 2. Ürettikleri basıncın ortalama değerinden sapma. Aşağıdakiler belirlenmiştir: 1. Brown hareketi herhangi bir t'de gerçekleştirilir ve süresiz olarak sürer. 2. Brown parçacıkları rastgele yörüngeler yapar. 3. Bir Brown parçacığının hareketinin doğası onun doğasına bağlı değildir Brown hareketi, moleküllerin rastgele hareketinin doğrudan bir kanıtıdır.
Çeşitli şeylerle çevriliyiz. Katı veya sıvı veya gaz olduklarını görebiliriz. Bizi çevreleyen her şey hakkında birçok soru var. Birçok soruya cevap verir moleküler kinetik teori.
Moleküler-kinetik teori, belirli bir maddenin atomlarının ve moleküllerinin özelliklerinin, etkileşimlerinin ve hareketlerinin incelenmesine dayalı olarak bir maddenin gözlemlenen ve ölçülen özelliklerini tanımlamak için kullanılan bir görüşler dizisidir.
Moleküler Kinetik Teorinin Temel Hükümleri
Tüm bedenler parçacıklardan oluşur - atomlar, moleküller, iyonlar.
Tüm parçacıklar sürekli kaotik termal hareket halindedir.
Herhangi bir cismin parçacıkları arasında etkileşim kuvvetleri vardır - çekim ve itme.
Bu nedenle, moleküler-kinetik teoride, çalışmanın amacı çok sayıda parçacıktan oluşan bir sistemdir - makrosistem. Böyle bir sistemin davranışını açıklamak için mekanik yasaları geçerli değildir. Bu nedenle, ana araştırma yöntemi, istatistiksel yöntem maddenin özelliklerini incelemek.
Fenomenleri açıklamak ve tahmin etmek için bilmek önemlidir. moleküllerin temel özellikleri:
- Boyutlar

Bir molekülün boyutuna ilişkin bir tahmin, katı veya katı maddenin yoğunluğuna dayalı olarak bir molekül içeren bir küpün boyutu olarak yapılabilir. sıvı maddeler ve bir molekülün kütlesi:

- Molekül kütlesi
Bir maddenin kütle oranı m molekül sayısına N bu maddede:
- bağıl moleküler ağırlık
Belirli bir maddenin bir molekülünün (veya atomunun) kütlesinin, bir karbon atomunun kütlesinin 1/12'sine oranı:
- Madde miktarı
Madde miktarı tanecik sayısının oranına eşittir N vücutta (atomlar - atomik maddede, moleküllerde - molekülerde) maddenin bir molündeki molekül sayısına NANCAK:

- Avogadro sabiti
1 mol maddede bulunan molekül sayısı.
- Molar kütle
Bir maddenin molar kütlesi, 1 mol miktarında alınan bir maddenin kütlesidir.
AT uluslararası sistem Bir maddenin molar kütlesi birim olarak ifade edilir kg/mol.
- Etkileşim (deneyimlere dayalı nicel)

Moleküllerin etkileşimi, aynı anda hem çekme hem de itme ile karakterize edilir: mesafelerde r
Moleküler kinetik teori, bir maddenin neden gaz, sıvı ve katı halde olabileceğini anlamayı mümkün kılar. MKT'nin bakış açısından, kümelenme durumları şu şekilde farklılık gösterir: moleküller arasındaki ortalama mesafenin değeri ve moleküllerin birbirine göre hareketinin doğası.
Moleküler kinetik teorinin ana hükümleri, çeşitli fiziksel deneylerle defalarca doğrulanmıştır. Örneğin, araştırma:
A) difüzyon
B) Brown hareketi
Kısa özet
Moleküler-kinetik teori, cisimlerin yapısını ve özelliklerini atomların, moleküllerin ve iyonların hareketi ve etkileşimi temelinde açıklar. MKT'ye dayanmaktadır üç pozisyon, deneysel ve teorik olarak tamamen doğrulanan:
1) tüm cisimler parçacıklardan oluşur - moleküller, atomlar, iyonlar;
2) parçacıklar sürekli kaotik termal hareket halindedir;
3) herhangi bir cismin parçacıkları arasında etkileşim kuvvetleri vardır - çekim ve itme.
Bir maddenin moleküler yapısı, elektron mikroskoplarında moleküllerin doğrudan gözlemlenmesi ve ayrıca katıların sıvılarda çözünmesi, bir maddenin sıkıştırılabilirliği ve geçirgenliği ile doğrulanır. Termal hareket - Brown hareketi ve difüzyon. Moleküller arası etkileşim gücü ve esnekliğinin varlığı katılar, yüzey gerilimi sıvılar.
Ders için referans taslağı:
"Moleküler kinetik teorinin temel hükümleri ve deneysel doğrulamaları" bloğunda kendi kendini kontrol etme soruları
- Moleküler-kinetik teorinin ana hükümlerini formüle edin.
- Hangi gözlemler ve deneyler moleküler kinetik teorinin ana hükümlerini doğrular?
- Molekül nedir? atom?
- Bağıl moleküler ağırlık ne denir? Bu kavramı hangi formül ifade eder?
- Bir maddenin miktarı nedir? Bu kavramı hangi formül ifade eder? Bir maddenin miktar birimi nedir?
- Avogadro sabiti ne denir?
- Bir maddenin molar kütlesi nedir? Bu kavramın anlamını hangi formül ifade eder? birim nedir molar kütle?
- Moleküller arası kuvvetlerin doğası nedir?
- Moleküler kuvvetlerin özellikleri nelerdir?
- Etkileşim güçleri, aralarındaki mesafeye nasıl bağlıdır?
- Gazlarda, sıvılarda ve katılarda moleküllerin hareketinin doğasını tanımlar.
- Gazlarda, sıvılarda ve katılarda partikül paketlemenin doğası nedir?
- Gazlarda, sıvılarda ve katılarda moleküller arasındaki ortalama mesafe nedir?
- Gazların, sıvıların ve katıların temel özelliklerini listeler.
- Brownian hareketi ne denir?
- Brownian hareketi neyi gösterir?
- Difüzyon neye denir? Gazlarda, sıvılarda ve katılarda difüzyon örnekleri verin.
- 18. Difüzyon hızı cisimlerin sıcaklığına nasıl bağlıdır?
TANIM
atom - verilen en küçük parçacık kimyasal element. Doğada bulunan tüm atomlar, Mendeleev'in periyodik element sisteminde temsil edilir.
Atomlar bir molekülde birleştirilir Kimyasal bağlar dayalı elektriksel etkileşim. Bir moleküldeki atom sayısı farklı olabilir. Bir molekül bir, iki, üç ve hatta birkaç yüz atomdan oluşabilir.
TANIM
molekül- belirli bir maddenin kimyasal özelliklerine sahip en küçük parçacığı.
Moleküler Kinetik Teori- atomların ve moleküllerin varlığı kavramına dayanan maddenin yapısı ve özellikleri doktrini.
Moleküler kinetik teorinin kurucusu M.V. Ana hükümlerini formüle eden ve bunları çeşitli termal olayları açıklamak için uygulayan Lomonosov (1711-1765).
Moleküler Kinetik Teorinin Temel Hükümleri
BİT'in ana hükümleri:
- doğadaki tüm cisimler en küçük parçacıklardan (atomlar ve moleküller) oluşur;
- parçacıklar termal olarak adlandırılan sürekli kaotik hareket halindedir;
- parçacıklar birbirleriyle etkileşime girer: parçacıklar arasındaki mesafeye bağlı olarak parçacıklar arasında çekim ve itme kuvvetleri hareket eder.
Moleküler kinetik teori birçok fenomen tarafından doğrulanır.
Çeşitli sıvıların karıştırılması, katıların sıvılarda çözünmesi, çeşitli türdeki moleküllerin karışmasıyla açıklanır. Bu durumda, karışımın hacmi, onu oluşturan bileşenlerin toplam hacminden farklı olabilir. bu, farklı boyutlarda moleküler bileşikleri gösterir.
TANIM
difüzyon- iki veya daha fazla bitişik maddenin birbirine nüfuz etme olgusu.
Difüzyon en yoğun gazlarda gerçekleşir. Kokuların yayılması difüzyondan kaynaklanır. Difüzyon, moleküllerin sürekli kaotik hareket halinde olduğunu gösterir. Ayrıca difüzyon fenomeni, moleküller arasında boşluklar olduğunu gösterir, yani. madde ayrıktır.
TANIM
Brown hareketi- bir sıvı veya gaz içinde asılı duran en küçük mikroskobik parçacıkların termal hareketi.
Bu fenomen ilk olarak 1827 yılında İngiliz botanikçi R. Brown tarafından gözlemlenmiştir. Suda asılı duran çiçek polenlerini mikroskopla incelerken, her bir polen parçacığının belirli bir mesafe boyunca hızla rastgele hareketler yaptığını görmüştür. Bireysel hareketlerin bir sonucu olarak, her polen parçacığı zikzak bir yörünge boyunca hareket etti (Şekil 1a).
Şekil 1. Brown hareketi: a) bir sıvı içinde asılı duran bireysel parçacıkların hareket yörüngeleri; b) sıvı moleküller tarafından süspansiyon halindeki bir parçacığa momentum transferi.
Çeşitli sıvılarda ve çeşitli katı parçacıklarla Brownian hareketinin daha sonraki çalışmaları, bu hareketin daha yoğun hale geldiğini, parçacık boyutunun küçüldüğünü ve deneyin sıcaklığının arttığını gösterdi. Bu hareket asla durmaz ve herhangi bir dış nedene bağlı değildir.
R. Brown, gözlemlenen fenomeni açıklayamadı. Brownian hareket teorisi, 1905'te A. Einstein tarafından inşa edildi ve Fransız fizikçi J. Perrin'in (1900-1911) deneylerinde deneysel onay aldı.
Sabit kaotik hareket halinde olan sıvı moleküller, asılı bir parçacıkla çarpışırken, ona bir miktar dürtü aktarır (Şekil 1, b). Bir parçacık durumunda büyük boy ona her taraftan saldıran moleküllerin sayısı fazladır, etkileri her an dengelenir ve parçacık pratik olarak hareketsiz kalır. Parçacık boyutu çok küçükse, o zaman moleküllerin etkileri telafi edilmez - bir yandan çarpabilir daha fazla moleküller diğerinden daha fazladır, bunun sonucunda parçacık hareket etmeye başlar. Brown parçacıklarının gerçekleştirdiği, moleküllerin rastgele etkilerinin etkisi altındaki tam da böyle bir harekettir. Brown parçacıkları tek tek moleküllerin kütlesinden milyarlarca kat daha büyük olmasına ve çok düşük hızlarda (moleküllerin hızlarına kıyasla) hareket etmesine rağmen, hareketleri hala bir mikroskop altında gözlemlenebilir.
Problem çözme örnekleri
ÖRNEK 1
ÖRNEK 2
Moleküler Kinetik Teori kimyasal maddelerin en küçük parçacıkları olarak atomların ve moleküllerin varlığı fikrine dayanan maddenin yapısı ve özellikleri doktrini olarak adlandırılır.
Moleküler kinetik teori, üç ana nokta:
1.
Tüm maddeler - sıvı, katı ve gaz halinde - en küçük parçacıklardan - kendileri atomlardan oluşan moleküllerden oluşur.
Moleküller ve atomlar elektriksel olarak nötr parçacıklardır. Belirli koşullar altında, moleküller ve atomlar ek kazanabilir. elektrik şarjı ve pozitif veya negatif iyonlara dönüşür.
2. Atomlar ve moleküller sürekli kaotik hareket halindedir.
3. Parçacıklar, doğaları gereği elektriksel olan kuvvetlerle birbirleriyle etkileşirler. Parçacıklar arasındaki yerçekimi etkileşimi
ihmal edilebilir.
Moleküler kinetik teorinin atomların ve moleküllerin rastgele hareketi hakkındaki fikirlerinin en çarpıcı deneysel doğrulaması, Brown hareketi.
Brown hareketi - e bu, bir sıvı veya gaz içinde asılı duran en küçük mikroskobik parçacıkların termal hareketidir. İngiliz botanikçi R. Brown tarafından keşfedilmiştir.
Brown parçacıkları, moleküllerin rastgele çarpışmalarının etkisi altında hareket eder. Moleküllerin kaotik termal hareketi nedeniyle bu etkiler asla birbirini dengelemez. Sonuç olarak, bir Brown parçacığının hızı, büyüklük ve yönde rastgele değişir ve yörüngesi karmaşık bir zikzak eğrisidir.
Bir maddenin moleküllerinin sürekli kaotik hareketi, kolayca gözlemlenen başka bir fenomende de kendini gösterir - difüzyon.
difüzyonla Birbirine bitişik iki veya daha fazla maddenin birbirine nüfuz etmesi olgusuna denir.
İşlem, bileşimde heterojen ise bir gazda en hızlı şekilde ilerler. Difüzyon, bileşenlerin yoğunluğundan bağımsız olarak homojen bir karışımın oluşmasına yol açar. Bu nedenle, bir bölme ile ayrılmış geminin iki parçasında oksijen O2 ve hidrojen H2 varsa, bölmenin çıkarılmasından sonra, gazların birbirine nüfuz etme süreci başlar ve bir oluşumuna yol açar. patlayıcı karışım - patlayıcı gaz.
Difüzyon ve Brown hareketi ilgili fenomenlerdir. Moleküllerin kaotik termal hareketi nedeniyle, temas halindeki maddelerin iç içe geçmesi ve bir sıvı veya gaz içinde asılı duran en küçük parçacıkların rastgele hareketi meydana gelir.
"Isı kapasitesi" terimini tanımlayın. Termal mühendislik hesaplamalarında ne tür ısı kapasiteleri kullanılır? Gazların ısı kapasitesini neyin belirlediğini açıklayın? Mayer denklemini yazın.
Isı kapasitesi- vücuda verilen veya ondan alınan ısının, sıcaklığındaki karşılık gelen değişime oranına eşit bir değer: C= , [J/K]
burada C ısı kapasitesidir; Q, sağlanan (veya çıkarılan) ısıdır; ∆T vücut sıcaklığındaki değişimdir.
Termal hesaplamalarda uygulamak Farklı çeşit azaltılmış ısı kapasiteleri (kütle, miktar ve hacim birimine atıfta bulunulur)
Kütle (veya özgül) ısı kapasitesi vücudun ısı kapasitesinin kütlesine oranıdır: c \u003d,
burada c kütle ısı kapasitesidir; m - vücut ağırlığı.
molar ısı kapasitesiısı kapasitesinin madde miktarına oranıdır: µ c = ,
burada μ c molar ısı kapasitesidir; n madde miktarıdır.
Hacimsel ısı kapasitesi normal koşullar altında ısı kapasitesinin 1 m3 gaza oranıdır: c`=,
burada c' hacimsel ısı kapasitesidir; v 0, normal koşullar altında gazın hacmidir.
SI'de kütle ısı kapasitesi c, J / kg * K, molar ısı kapasitesi µ s - J / mol * K, hacimsel ısı kapasitesi c "- J / m 3 * K olarak ölçülür.
Gazların ve buharların ısı kapasiteleri değişkendir; için ideal gazlar sıcaklıklarına ve gerçek gazlar ve buharlar için de basınçlarına bağlıdırlar.
Gazların ısı kapasitesi büyük ölçüde ısıtıldıkları veya soğutuldukları koşullara bağlıdır. Teknolojideki bu süreçler arasında en önemlileri üretim sırasında meydana gelen süreçlerdir. sabit hacim gaz (izokorik süreç) ve sabit basınç gaz (izobarik süreç).
Bu bağlamda, ayırt sabit hacimde ısı kapasitesi(v ile) ve sabit basınçta ısı kapasitesi(p ile).
c p ve c v arasındaki nicel ilişki kullanılarak ayarlanır Mayer denklemleri: p ile - v = R ile, burada R evrensel gaz sabitidir.
Böylece, tüm gazlar için izobarik ve izokorik ısı kapasiteleri arasındaki fark sabit bir değerdir ve evrensel gaz sabitine eşittir.
" terimini tanımlayın dağınık sistemler". Dağınık sistemlerin iki ana özelliğini adlandırın. Dağınık sistemler nasıl sınıflandırılır? Her bir özelliği kullanarak, dağılım sistemlerini tanımlayın.
dağınık, dağılmış sıvı, katı veya gazlı bir ortamda dağılmış birçok küçük parçacıktan oluşan sistemler olarak adlandırılır.
Tüm dispers sistemler ile karakterize edilir iki ana özellik: yüksek parçalanma (dağılma) ve heterojenlik.
heterojenlik dağınık sistemler, bu sistemlerin iki (veya daha fazla) fazdan oluşmasıyla kendini gösterir. Tüm dağınık sistemler sürekli bir fazdan oluşur - dağılım ortamı ve süreksiz faz (parçacıklar) - dağınık faz.
Yüksek dağılım maddelere yeni niteliksel özellikler kazandırır: artan reaktivite ve çözünürlük, renk yoğunluğu, ışık saçılması vb.
Dağınık sistemlerin sınıflandırılmasıçeşitli özellikler temelinde gerçekleştirilir, yani: 1) parçacık boyutuna göre, 2) dağılmış fazın ve dispersiyon ortamının kümelenme durumuna göre, 3) dağılmış fazın parçacıklarının her biri ile etkileşiminin doğasına göre. diğer ve ortam ile.
Parçacık boyutuna bağlı olarak dağınık sistemler gruplara ayrılır:
1) kaba sistemler - partiküllerin 1000 nm veya daha fazla boyuta sahip olduğu sistemler;
2) kolloidal sistemler - partiküllerin boyutu 1 ila 500 nm arasındadır.
3) gerçek çözümler - partiküllerin boyutu 1 nm'ye kadardır.
Dağınık fazın toplanma durumuna ve dağılım ortamına göre sistemler şu şekilde sınıflandırılır:
Kolloidal partiküllerin dispersiyon ortamına oranı ile ilgili olarak liyofilik ve liyofobik sistemleri ayırt eder ( Yunancadan "philia" - aşk, "fobi" - nefret).
liyofilik sistemler- kolloidal parçacıkların dağılım ortamının molekülleri ile ilişkili olduğu ve bunların bir kabuğuna sahip oldukları (dağılım ortamı su ise, sistemlere hidrofilik denir). Örneğin, liyofilik kolloidal sistemler, doğal veya sentetik RİA'ların çözülmesiyle oluşturulan çözeltileri içerir. Bunlar hem doğal hem de sentetik proteinlerin, nişastanın, selüloz eterlerin ve çeşitli reçinelerin çözeltileridir.
liyofobik sistemler(hidrofobik) - kolloidal parçacıkların dispersiyon ortamının veya çözücünün moleküllerine zayıf bir şekilde bağlandığı olanlar. Örneğin, liyofobik sistemler arasında değerli metal solları, kükürt solları, demir solları ve alüminyum hidroksitler vb. bulunur. Bu sistemler, toplu kararsızlık ile karakterize edilir ve stabilizasyon gerektirir.
7. "Kimyasal denge" kavramını tanımlar. Le Chatelier ilkesini formüle edin. Basınçtaki değişikliklerin reaksiyonun denge konumunu nasıl etkilediğini açıklayın: N 2 +3H 2 ⇄2NH 3 . Bu işlem için, denge sabiti için bir ifade yazın ve reaktantların nitrojen, hidrojen ve amonyak denge konsantrasyonları sırasıyla 3 mol/l, 9 mol/l, 4 mol/l ise değerini tahmin edin.
Kimyasal Denge
Kimyasal dengedeki bir sistem için reaktiflerin konsantrasyonları, sıcaklık ve sistemin diğer parametreleri zamanla değişmez.
Le Chatelier ilkesi: denge durumundaki bir sisteme dışarıdan etki edilirse, denge koşullarından herhangi biri (sıcaklık, basınç, konsantrasyon) değiştirilirse, sistemdeki süreçler yoğunlaşır, dış etkiyi telafi etmeyi (veya zayıflatmayı) amaçlar.
Reaksiyon N 2 + 3H 2 ⇄ 2NH 3 gaz halindeki maddelerin katılımıyla ilerler ve geri dönüşümlüdür. Basınç, bu tür reaksiyonlarda denge konumunu önemli ölçüde etkiler, çünkü bunlara başlangıç maddelerinden reaksiyon ürünlerine geçişte madde miktarındaki bir değişiklik nedeniyle hacimde bir değişiklik eşlik eder: basınçta bir artışla denge, toplam mol sayısının olduğu yöne kayar. gazlar azalır ve bunun tersi de geçerlidir.
N2 + 3H2 ⇄2NH3 reaksiyon denklemine göre, başlangıçtaki gaz halindeki maddelerin miktarının 4 mol (1 mol azot ve 3 mol hidrojen) ve gaz halindeki ürünlerin miktarının 2 mol olduğu görülebilir ( 2 mol amonyak). Sonuç olarak, basınçtaki bir artışla kimyasal denge, daha az miktarda gaz halindeki maddelere doğru sağa ve basınçta bir azalma ile sola, başlangıç maddelerine doğru kayar.
Denge sabiti- belirli bir kimyasal reaksiyon için termodinamik aktiviteler arasındaki oranı belirleyen bir değer (veya reaksiyonun koşullarına bağlı olarak, kısmi basınçlar, konsantrasyonları) kimyasal bir denge durumunda (kütle etkisi yasasına göre) başlangıç maddelerinin ve ürünlerin. Reaksiyonun denge sabitini bilerek, reaksiyona giren karışımın denge bileşimini, ürünlerin sınırlayıcı verimini hesaplamak ve reaksiyonun yönünü belirlemek mümkündür.
Verilen:\u003d 3 mol / l, \u003d 9 mol / l, \u003d 4 mol / l
Bulmak: K ile -?
Çözüm: 1) N 2 +3H 2 ⇄2NH 3 reaksiyon denklemini yazalım
2) Bu reaksiyon için denge sabiti şu ifadeye sahiptir: K c \u003d 2 / * 3; 3) denge sabitini hesaplayın K c \u003d 4 2 / 3 * 9 3 \u003d 0.0073
Cevap: Kc \u003d 0.0073
8. "Yaygın sistem" terimini tanımlayın. Dağınık fazın ve dağınık ortamın agregasyon durumuna göre dağınık sistemlerin bir sınıflandırmasını verin. Bu bilgiyi sistematize edin ve önerilen sistemler için dağılmış faz ve dağılım ortamının kümelenme durumunu belirleyin: petrol; tozlu hava. Bu kolloidal sistemlerin kararlılığını tahmin edin ve açıklayın.
Dispersiyon sistemi- bunlar, birbiriyle kimyasal olarak reaksiyona girmeyen veya hiç karışmayan veya pratik olarak iki veya daha fazla fazın (cismin) oluşumlarıdır.
Çoğu dağınık sistemlerin genel sınıflandırması dağılma ortamı ve dağılmış fazın kümelenme durumundaki farka dayanır. Üç türün kombinasyonları toplama durumu Dokuz tip dağılma sistemini ayırt etmeye izin verir. Kısalık için, genellikle payı dağılmış fazı gösteren bir kesir ile gösterilir ve payda, örneğin "sıvıdaki gaz" sistemi için dağılım ortamını gösterir, G/L tanımı kabul edilir.
| atama | dağınık faz | dispersiyon ortamı | İsim ve örnek |
| E/Y | gazlı | gazlı | Dispersiyon sistemi oluşturulmadı |
| F/G | Sıvı | gazlı | Aerosoller: sisler, bulutlar |
| T/Y | sağlam | gazlı | Aerosoller (toz, duman), tozlar |
| G/F | gazlı | Sıvı | Gaz emülsiyonları ve köpükler |
| F/F | Sıvı | Sıvı | Emülsiyonlar: yağ, krema, süt |
| T/F | sağlam | Sıvı | Süspansiyonlar ve sollar: hamur, silt, süspansiyon, macun |
| G/T | gazlı | sağlam | gözenekli cisimler |
| F/T | Sıvı | sağlam | Kılcal sistemler: gözenekli cisimlerde sıvı, toprak, toprak |
| T/T | sağlam | sağlam | Katı heterojen sistemler: alaşımlar, beton, kompozit malzemeler |
Sırayla, bu sistemler dağılma derecesine göre sınıflandırılır.
Dağınık fazda aynı boyutta partikül içeren sistemlere monodispers, farklı boyutlarda partikül içeren sistemlere polidispers denir. Kural olarak, bizi çevreleyen gerçek sistemler çoklu dağılır.
Dağınık sistemlerin kararlılığı süresiz olarak başlangıç durumunda bulunma olasılığıdır.
Dağınık sistemlerin kararlılığı şunlar olabilir:
1. yağışa
dağılmış faz - dağılmış bir sistemin, dağılma ortamının hacmi üzerinde fazın bir denge dağılımını veya faz ayrımına karşı direncini koruma yeteneğini karakterize eder. Bu özellik denir sedimantasyon (kinetik) istikrar .
2. Toplamaya doğru
onun parçacıkları. Toplam kararlılık
bir dağılma sisteminin zaman içinde dağılma derecesini değişmeden tutma yeteneğidir, yani. parçacık boyutları ve bireysellikleri.
Dağınık sistemlerin agrega oluşturma (yani daha büyük büyüme) yeteneğinden kaynaklanmaktadır. Toplama ile ilgili olarak, dağınık sistemler kararlı olabilir kinetik olarak
ve termodinamik olarak
. Termodinamik olarak kararlı sistemler, fazlardan birinin kendiliğinden dağılmasının bir sonucu olarak oluşur, yani. heterojen bir sistemin kendiliğinden oluşumu.
Dispersiyon sistemi: Tozlu hava, gazlı bir dispersiyon ortamından ve bir katı dispersiyon fazından oluşur. Bu sistem kinetik ve toplu olarak kararsızdır.
Dispersiyon sistemi: yağ, bir sıvı dispersiyon ortamından ve bir sıvı dispersiyon fazından oluşur. Ve sistem kinetik ve toplu olarak kararlıdır.
9. "Kimyasal denge değişimi" kavramını tanımlayın. Hangi faktörlerin kimyasal dengenin konumunu etkilediğini ve hangilerinin etkilemediğini yorumlayın? Le Chatelier ilkesini formüle edin. Reaksiyon için başlangıç maddelerinin basınç, sıcaklık ve konsantrasyonundaki bir artışla dengenin hangi yöne kaydığını tahmin edin:
+CaCO3 + O(buhar)⇄Ca(HCO 3 +Q
Kimyasal Denge- bir kimyasal reaksiyonun tersinir olarak ilerlediği ve ileri ve geri reaksiyonların hızlarının birbirine eşit olduğu bir kimyasal sistemin dinamik durumu.
Kimyasal dengenin konumu şu reaksiyon parametrelerine bağlıdır: sıcaklık, basınç ve konsantrasyon. Bu parametrelerdeki bir değişiklik, akış hızında bir değişikliğe neden olur. kimyasal reaksiyonlar ve kimyasal dengeyi değiştirir.
Kimyasal Dengeyi Etkileyen Faktörler: sıcaklık, basınç, konsantrasyon.
1) sıcaklık: sıcaklık arttığında, kimyasal denge endotermik (absorpsiyon) reaksiyona, düştüğünde ise ekzotermik (izolasyon) reaksiyona kayar.
2) basınç: basınç arttığında, kimyasal denge daha küçük bir madde hacmine ve azaldığında daha büyük bir hacme doğru kayar. Bu ilke yalnızca gazlar için geçerlidir, yani. reaksiyona katılırlarsa katılar, dikkate alınmazlar.
3) başlangıç maddelerinin ve reaksiyon ürünlerinin konsantrasyonu
Başlangıç maddelerinden birinin konsantrasyonundaki artışla, kimyasal denge reaksiyon ürünlerine ve reaksiyon ürünlerinin konsantrasyonundaki artışla başlangıç maddelerine doğru kayar.






