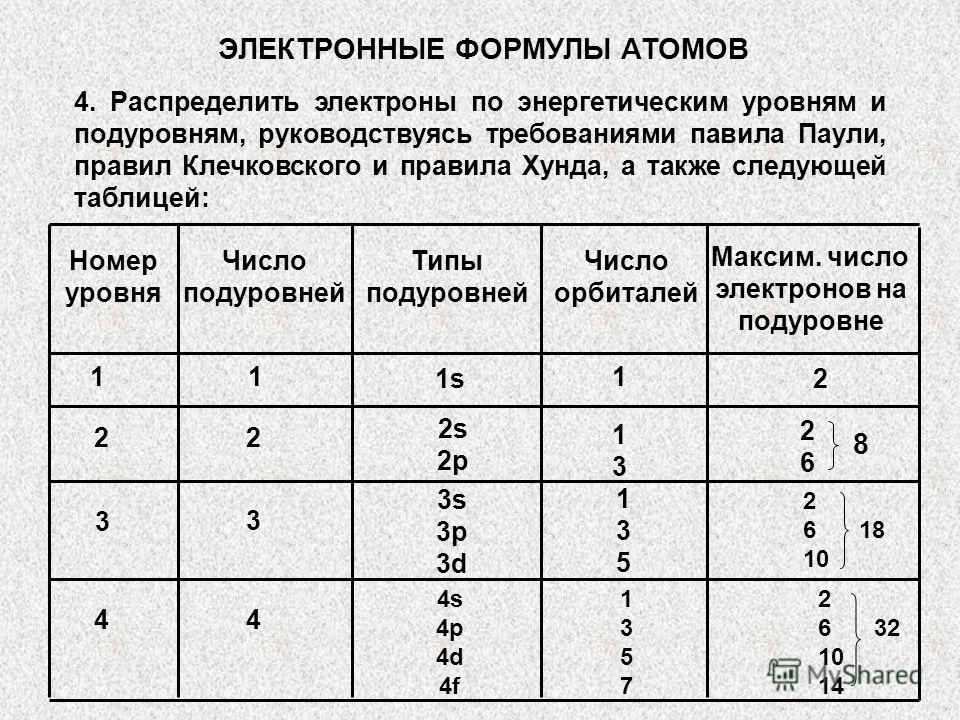
Kuantum hücreleri arasında silikon elektronları dağıtın. Vanadyum elektronlarının kuantum hücreleri üzerindeki dağılımı
1. bölüm için görevler
Örnek yürütme ev ödevi
atomun yapısı
Görev 1. a) Bu alt seviyelerin ana ve yörünge kuantum sayılarının sayısal değerlerini belirtin, doldurma sırasını hesaplayın: 5 p, 7p, 7s.
Çözüm. 5p 7p 7s
Anlam n 5 7 7
Anlam ben 1 1 0
toplam ( n +ben ) 6 8 7
Doldurma sırası (Klechkovsky'nin kurallarına göre):
1 – 5p; 2 – 7s; 3 – 7p.
b) Kuantum hücreleri üzerinde dağıtın değerlik elektronları 2s 2 2p 4, kimyasal elementi ve D.I.'deki konumunu belirleyin. Mendeleev (dönem numarası, grup, alt grup).
Çözüm. Kuantum hücrelerindeki değerlik elektronları aşağıdaki gibi dağıtılır: 2 s 2 2p 4
Önerilen oksijen elementi, D.I.'nin Periyodik Tablosunun ana alt grubu olan ikinci periyotta, altıncı grupta yer almaktadır. Mendeleyev.
içinde) Atomların ve iyonların elektronik formüllerini yazın, D.I.'deki konumlarını belirtin. Mendeleev (dönem numarası, grup, alt grup): K, Zn 2+ .
Çözüm. Potasyum kimyasal elementinin elektronik formülü aşağıdaki gibidir: 1 s 2 2s 2 2p 6 3s 2 3p 6 4s bir . Dördüncü periyotta, birinci grup, D.I.'nin Periyodik Tablosunun ana alt grubunda yer alır. Mendeleyev. Zn 2+ katyonunun elektronik formülü: 1 s 2 2s 2 2p 6 3s 2 3p 6 3d 10 . Kimyasal element dördüncü periyotta çinko yer alır, ikinci grup, bir yan alt gruptur.
Tüm görevler için aynı şeyi yapın.
ATOM YAPISI
D. I. Mendeleev'in Periyodik sisteminde (Tablo S.4) hepsi bilinen elementler. Yedi dönemden (1-3 - küçük, 4-7 - büyük), 8 gruptan oluşur. Her grup ana ve ikincil alt gruplara ayrılır. Ana alt grup, küçük ve büyük periyotların unsurlarını içerir ve yan grup sadece büyük olanları içerir.
örnek 1 Periyodik sistemde belirtin D.I. 85 nükleer yüke sahip bir elementin atomunun Mendeleev konumu (periyot numarası, grup numarası, ana veya ikincil alt grup).
Çözüm. Element (85 At) 6. periyot, 7. grup, ana alt gruptadır.
Elementlerin atomları, pozitif yüklü bir çekirdek (protonlar ve nötronlar) ve elektronlardan oluşur. Elektron sayısı elementin atom numarasına eşittir. Bir atomdaki elektronun durumu kuantum sayıları ile karakterize edilir. n,l, m l ve m s sırasıyla adları verilen en önemlisi, yörünge, manyetik ve spin.
Yörüngeleri elektronlarla doldurma sırası, aşağıdaki V. Klechkovsky kurallarına göre belirlenir:
doldurma, miktarın artan sırasına göre gerçekleşir ( n + ben);
Bu toplamın aynı değerlerinde, önce ana değerin daha düşük değerine sahip alt seviye doldurulur. kuantum sayısı n.
Elektron doldurma sırası enerji seviyeleri ve çok elektronlu atomlardaki alt düzeyler şu şekildedir:
1s<2s<2p<3s<3p<4s<3d <4p<5s<4d <5p<6s<5d 4f<6p <7s<6d 5f<7p.
Örnek 2. Klechkovsky kurallarını kullanarak, önce hangi alt seviyenin elektronlarla dolu olduğunu hesaplayın 4 R veya 5 s.
Çözüm. 4 için R-alt seviye sn + ben= 4 + 1 = 5; 5 için s-alt seviye Sn+l= 5 + 0 = 5. Toplamı aynı olduğu için önce alt değere sahip alt seviye doldurulur. n, yani 4 R.
Örnek 3 Değerlik elektronlarının dağılımına göre - 3d 5 4s 2 Hangi element olduğunu belirleyin, sembolünü belirtin ve tam elektronik formülü yazın.
Çözüm. Son enerji seviyesinin temel kuantum sayısının değeri, oda periyot, yani eleman 4. dönem. Değerlik elektronlarının toplamı şunu gösterir: oda elemanın bulunduğu grup, bu durumda sayı gruplar 7. Değerlik elektronları açık olduğundan d-sublevel, o zaman bu bir elementtir yan alt grup: 25 Dakika 1 s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2 .
Örnek 4. 22 nükleer yüke sahip bir elementin atomunun tam elektronik formülünü yazın.
Çözüm. 22 Ti 1 s 2 2s 2 2p 6 3s 2 3p 6 3d 2 4s 2 .
Örnek 5. Fq, Sn 2+ iyonlarının tam elektronik formüllerini yazın.
Çözüm. Negatif yüklü bir iyon oluştuğunda, elementin nötr atomu elektronları kabul eder: F 0 + 1 ē = Fq; iyon 9 Fq1'in elektronik formülü s 2 2s 2 2p 6. Bir elementin nötr atomu elektron verdiğinde pozitif yüklü bir iyon elde edilir: Sn 0 - 2 ē = Sn 2+ ; 50 Sn 2+1 iyonunun elektronik formülü s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 0 .
1. bölüm için görevler
Her görev şunları içerir: üç soru(bir B C).
| İş numarası | a) Bu alt seviyelerin ana ve yörünge kuantum sayılarının sayısal değerlerini belirtin, doldurma sırasını hesaplayın | b) Değerlik elektronlarını kuantum hücreleri arasında dağıtın, kimyasal elementi ve D.I. Mendeleev sistemindeki konumunu belirleyin (periyot numarası, grup, alt grup) | c) Önerilen atomların ve iyonların elektronik formüllerini yazın, D.I. Mendeleev sistemindeki konumlarını belirtin (periyot numarası, grup, alt grup) |
| 3p; 4s; 2p | 3d 1 4s 2 | Fe, Na+ | |
| 3d; 4p; 3p | 3d 2 4s 2 | Co, Cl- | |
| 5d; 4p; 4d | 3d 3 4s 2 | Ni, Ba2+ | |
| 3d; 4f; 5s | 3d 5 4s 1 | Zn, Ca2+ | |
| 4d; 4s; 5s | 4d 5 5s 2 | Sn, S 2- | |
| 6s; 4p; 4f | 3d 6 4s 2 | K, 3+ yılında | |
| 3d; 5s; 7p | 3d 7 4s 2 | S, La 3+ | |
| 4d; 6s; 5d | 3d 8 4s 2 | F, TL 3+ | |
| 4p; 5p; 4f | 3d 10 4s 1 | Br, Zr 4+ | |
| 3d; 3p; 2s | 3d 10 4s 2 | Al, Hg2+ | |
| 5d; 3s; 6s | 4s 2 4p 1 | Pb, Au 3+ | |
| 6d; 4f; 5p | 4s 2 4p 2 | Ge, Ag+ | |
| 5d; 3p; 4d | 4 s 2 4p 3 | Ga, Sb 3+ | |
| 7s; 6p; 4d | 4s 2 4p 4 | N, Bi 3+ | |
| 5d; 4p; 3d | 4s 2 4p 5 | Cl, Pb 2+ | |
| 5s; 6s; 4p | 4s 2 4p 6 | Y, Hf 4+ | |
| 6p; 5f; 6d | 5d 7 6 s 2 | Zr, At- | |
| 5d; 5s; 4f | 5d 10 6 s 2 | Ta, Ga 3+ | |
| 3s; 4d; 3p | 5d 3 6 s 2 | Cr, Se 2- | |
| 5f; 4d; 4s | 5d 5 6 s 2 | Mo, Cu 2+ |
Anlatım 5. ANA KUANTUM SAYISI (n) (n) sayısı, bir atomdaki elektronun toplam enerjisini karakterize eder. Tam sayıların değerlerini alabilir: 1, 2, 3 ... n Kuantum sayısı n'nin her bir değeri kendi enerji seviyesine sahiptir. Elektronlar tarafından doldurulan bir atomdaki enerji seviyelerinin sayısı, elementin periyodik tabloda bulunduğu periyot sayısına eşittir.

ANA KUANTUM NUMARASI (n) Örneğin, herhangi bir elementin üçüncü periyoduna ait bir atomundaki elektronlar, üç enerji seviyesinde bulunur. (n=1) dizisine en yakın enerji düzeyinde bulunan elektronlar en düşük enerjiye sahiptir. Kuantum enerjisini (E=hν) emerken, elektron daha yüksek bir enerji seviyesine gider. Daha düşük bir seviyeye hareket ederken, bir elektron bir kuantum enerji yayar. (devam)

Yörüngesel Kuantum Sayısı (ɭ) ɭ sayısı yörüngenin şeklini ve dolayısıyla elektron bulutunu belirler. Sıfırdan n-1'e kadar bir değer alabilir: ɭ = 0, 1, 2, 3 … n-1 Örneğin ana kuantum sayısı dört (n=4) ise ɭ 0 değerini alır. 1, 2, 3.

N sayısının aynı değerlerine sahip, ancak farklı (ɭ) elektronlar, enerjide biraz farklılık gösterir. Bu nedenle, belirli bir enerji seviyesindeki elektronların, enerji alt seviyelerinde gruplandığı söylenir. Yörüngesel Kuantum Sayısı (ɭ) Bu alt düzeylere aşağıdaki harf adları atanmıştır: Yörünge kuantum sayısı (l) Enerji alt düzey tanımı s p d f (devamı)

Her enerji seviyesindeki alt seviyelerin sayısı, kuantum sayısına eşittir, yani. Bu seviyenin sayısı. Birinci enerji seviyesi (n=1) bir s - alt seviyesinden oluşur; ikinci (n=2) - iki (s;p) alt düzeyden; üçüncü (n=3) - üç (s; p; d) alt düzeyden; dördüncü (n=4) – dört (s; p; d; f) alt düzeyden: Temel kuantum sayısı (n) (seviye numarası) Alt düzey türleri s s, ps, p, d s, p, d, f ORBITAL KUANTUM NUMARASI ( ɭ ) (devam)

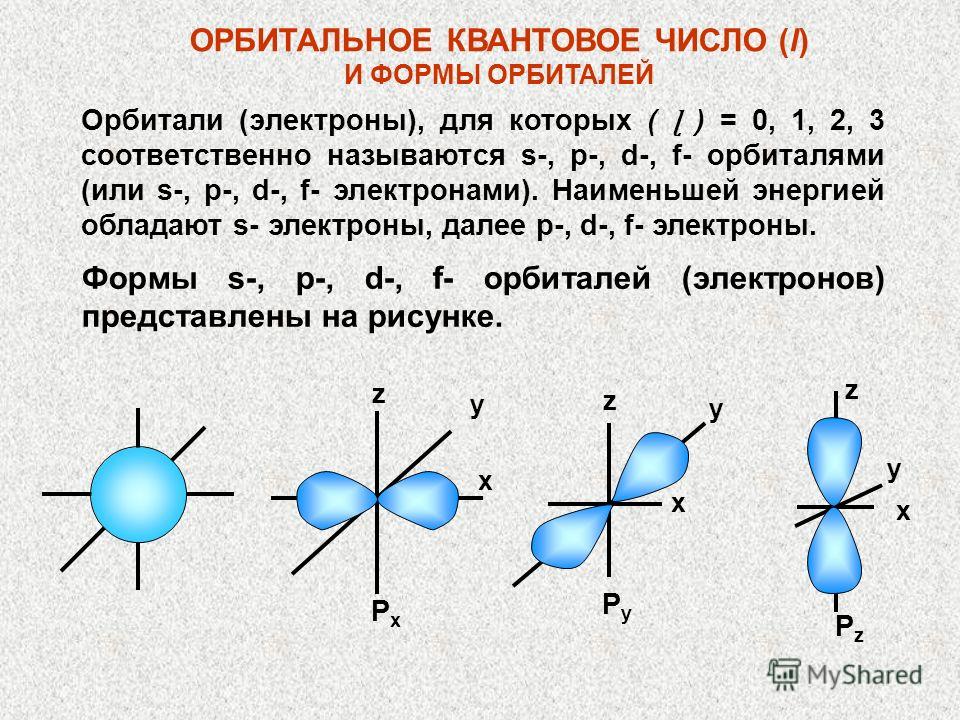
Yörüngesel Kuantum Sayısı (l) VE Yörünge Şekilleri Sırasıyla (ɭ) = 0, 1, 2, 3 olan yörüngeler (elektronlar) s-, p-, d-, f-orbitalleri (veya -, f- elektronları) olarak adlandırılır. S-elektronları en düşük enerjiye, ardından p-, d-, f-elektronlarına sahiptir. s-, p-, d-, f-orbitallerinin (elektronlar) şekilleri şekilde gösterilmiştir. x x x z PyPy PzPz y y y z z PxPx
M sayısı, yörüngelerin (bulutların) uzaysal düzenini karakterize eder. Sıfır dahil olmak üzere – ɭ ile + ɭ arasındaki tüm tamsayı değerlerini alabilir: m = – l … 0 … + l Örneğin: ɭ = 2 ile m = – 2, – 1, 0, + 1, + 2 m, yörünge kuantum sayısına bağlıdır ve belirli bir alt seviyedeki bir elektronun (verilen bir ɭ değeri ile) içinde olabileceği enerji durumlarının (yörüngelerin) sayısını gösterir. Belirli bir değere (ɭ) sahip orbital sayısı 2 ɭ + 1 MANYETİK KUANTUM SAYISI (m)

MANYETİK VE Yörüngesel KUANTUM SAYILARININ İLİŞKİSİ Yörünge kuantum sayısı (ɭ) Manyetik kuantum sayısı (m) Yörünge sayısı (bulutlar) – 1, 0, + 1 – 2, – 1, 0, + 1, + 2 –3, – 2 , – 1, 0, +1, +2,

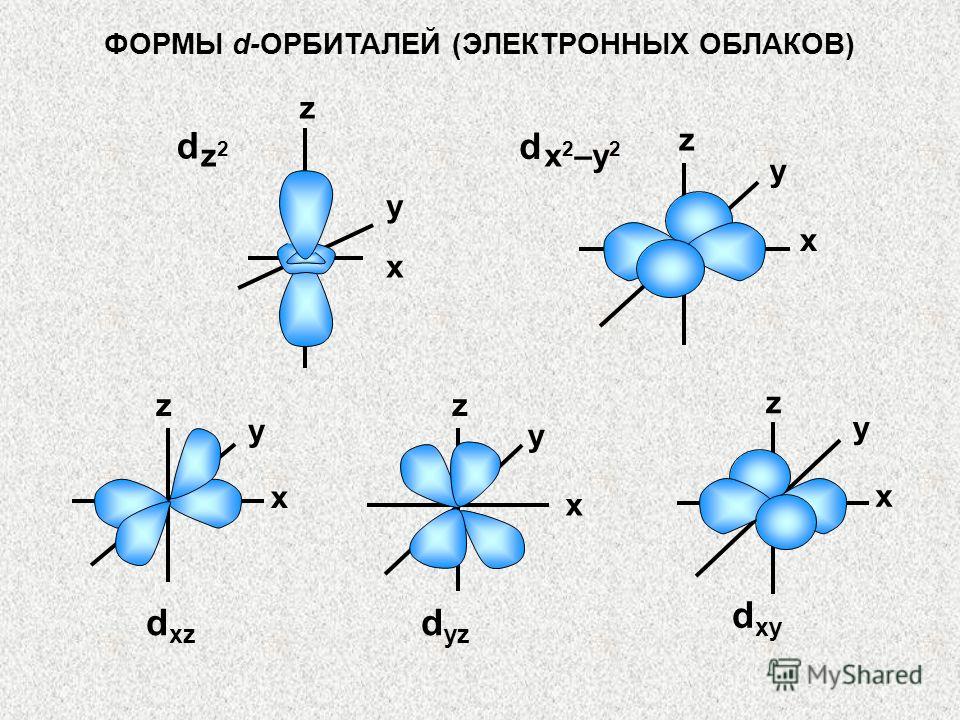
KUANTUM HÜCRELERİ (ORBİTALLER) Her orbital genellikle kuantum hücresi olarak da adlandırılan bir dikdörtgen ile temsil edilir s - alt seviye 1 hücreden oluşur p - alt seviye 3 hücreden oluşur d - alt seviye 5 hücreden oluşur f - alt seviye 7 hücreden oluşur s p d f

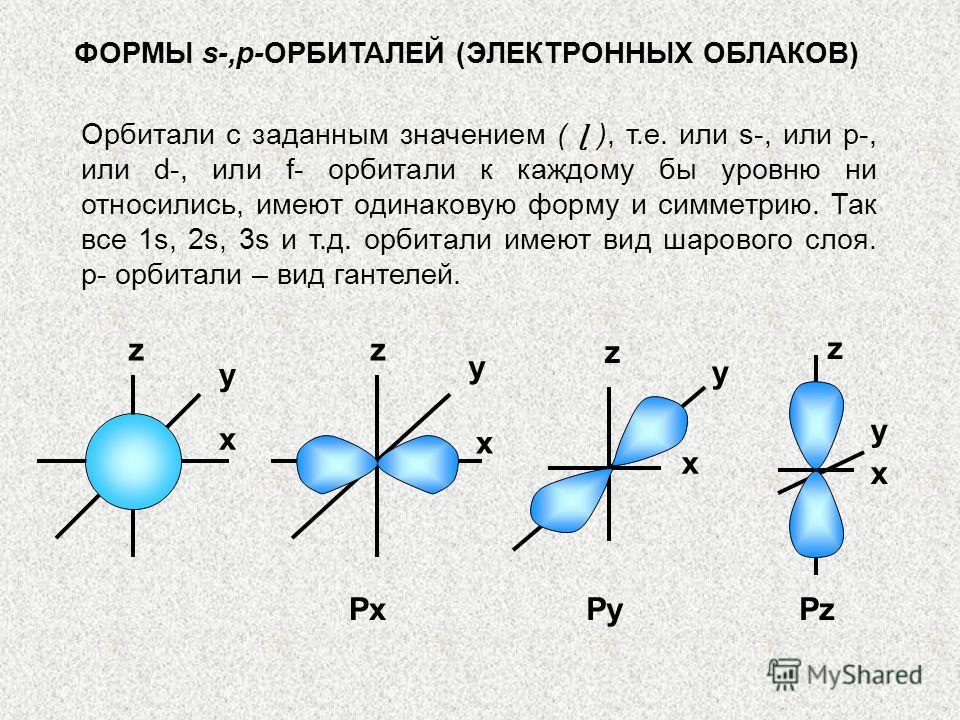
s-,p-ORBİTALLERİN ŞEKİLLERİ (ELEKTRON BULUTLARI) Belirli bir değere (ɭ) sahip orbitaller, yani. veya s- veya p- veya d- veya her seviyeye f-orbitalleri, aynı şekle ve simetriye sahiptirler. Yani her şey 1s, 2s, 3s vb. yörüngeler küreseldir. p-orbitalleri bir tür dambıldır. x x x x y z PxPyPz y y y z z z
DÖNÜŞ KUANTUM SAYISI (S) Belirli bir m değeri için, s sayısının yalnızca iki anlamı olabilir: Bir elektronun sözde bir dönüşü olduğu hipotezi 1925'te ortaya atıldı (ilk önce - netlik için - bunun böyle olduğuna inanılıyordu. Bu fenomen, Güneş'in etrafında yörüngede hareket ederken dünyanın kendi ekseni etrafında dönmesine benzer). + ½ ve – ½ Aslında spin, klasik analogları olmayan bir elektronun salt kuantum özelliğidir. Kesin konuşmak gerekirse, spin, uzaydaki hareketle ilgili olmayan, bir elektronun uygun açısal momentumudur. Tüm elektronlar için spinin mutlak değeri her zaman s = 1/2'dir. Dönüşün Z eksenine yansıması (manyetik dönüş sayısı) yalnızca iki değere sahip olabilir: m S = +1/2 veya m S = -1/2.

"Bir atomda dört kuantum sayısının hepsinin aynı değerlerine sahip iki elektron olamaz." AO üç kuantum sayısı n, l, m ile karakterize edildiğinden, zıt spinli ikiden fazla elektron içeremez: PAULI İLKESİ X e = 2 (2l + 1); s-2; p–6; d-10; f – 14 Maksimum elektron sayısı: Alt seviyede: Seviyede: N = 2n2

“Seviyeleri ve alt seviyeleri elektronlarla doldururken, bir atomdaki elektronların yerleşim sırası, çekirdekle olan en büyük bağlantılarına karşılık gelmelidir, yani. elektron en düşük enerjiye sahip olmalıdır." AZ ENERJİ İLKESİ Bu ilke, sistemlerin kararlılığı için genel termodinamik gereksinimleri ifade eder: maksimum kararlılık, minimum enerjiye karşılık gelir. Pratikte, "en az enerji ilkesi" Klechkovsky'nin kuralları biçiminde uygulanır:

Enerji rezervini alt seviyelerde karşılaştıralım: 4s 
3d, 4p ve 5s alt düzeylerinde toplam (n+l) 5'e eşittir: ALT SEVİYE (n + l) 3+2=5 4+1=5 5+0=5 3d 4p 5s 1s2s2p3s4s3d4p5s4d5p6s4f5d Klechkovsky'nin kuralları. Örnek 2: Bu durumda, önce ana kuantum sayısı n'nin daha düşük değerine sahip alt seviye doldurulur, yani. aşağıdaki sırayla: 3d 3p 5s Genel olarak, seviyelerin ve alt seviyelerin doldurulması şu sırayla yapılır: 6p7s5f6d6p7s5f6d


Elektronik formüllerde s, p, d, f harfleri enerji elektronlarını ifade eder. Harflerin önündeki sayılar, verilen elektronun bulunduğu enerji seviyesini gösterir ve sağ üstteki indeks bu alt seviyedeki elektronların sayısıdır. 5p 3 kaydı, p-alt seviyesinde üç elektron olduğu anlamına gelir. beşinci enerji seviyesi. ATOMLARIN ELEKTRONİK FORMÜLÜ

Herhangi bir elementin atomunun elektronik formülünü derlerken, aşağıdaki sıra izlenmelidir: 1. Elementin sıra numarasını (ve dolayısıyla atomdaki elektron sayısını) belirleyin; 2. Elektronların yerleştirileceği enerji seviyelerinin sayısını /periyot numarasına göre/ belirleyin; 3. Elektronları ana hükümlerin gerekliliklerine göre alt seviyelere ve seviyelere dağıtın. ATOMLARIN ELEKTRONİK FORMÜLÜ

4. Elektronları, Pauli kuralının, Klechkovsky'nin kurallarının ve Hund'un kurallarının gerekliliklerinin yanı sıra aşağıdaki tablonun rehberliğinde enerji seviyeleri ve alt seviyeleri üzerinde dağıtın: ATOMLARIN ELEKTRONİK FORMÜLÜ Seviye numarası Alt seviyelerin sayısı Alt seviyelerin türleri Yörünge sayısı Maks. alt düzey başına elektron sayısı 11 1s s 2p s 3p 3d s 4p 4d 4f
1. Kükürt atomunun elektronik formülünü oluşturun: 1. Kükürtün seri numarası 16: atomda sadece 16 elektron var 2. Kükürt üçüncü periyotta: 16 elektron üç enerji seviyesinde yer alıyor: 1s 2s2p 3s3p3d 3. En az enerji ilkesine ve Pauli ilkesine uygun olarak 16 elektronu enerji alt düzeylerine dağıtalım: 16 S - 1s 2 2s 2 2p 6 3s 2 3p 4 - kükürt atomunun formülü. ATOMLARIN ELEKTRONİK FORMÜLÜNÜN DERLENMESİ

2. Kalsiyum atomunun (Ca) formülünü oluşturun: 1. Seri numarası Ca \u003d 20: atomda 20 elektron var 2. Ca dördüncü periyotta: 20 elektron dört seviyede bulunur: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 3. 20 elektron dağıtın: 20 Ca - 1s 2 2s 2 2p 6 3s 2 3p 6 3d 0 4s 2 veya 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2

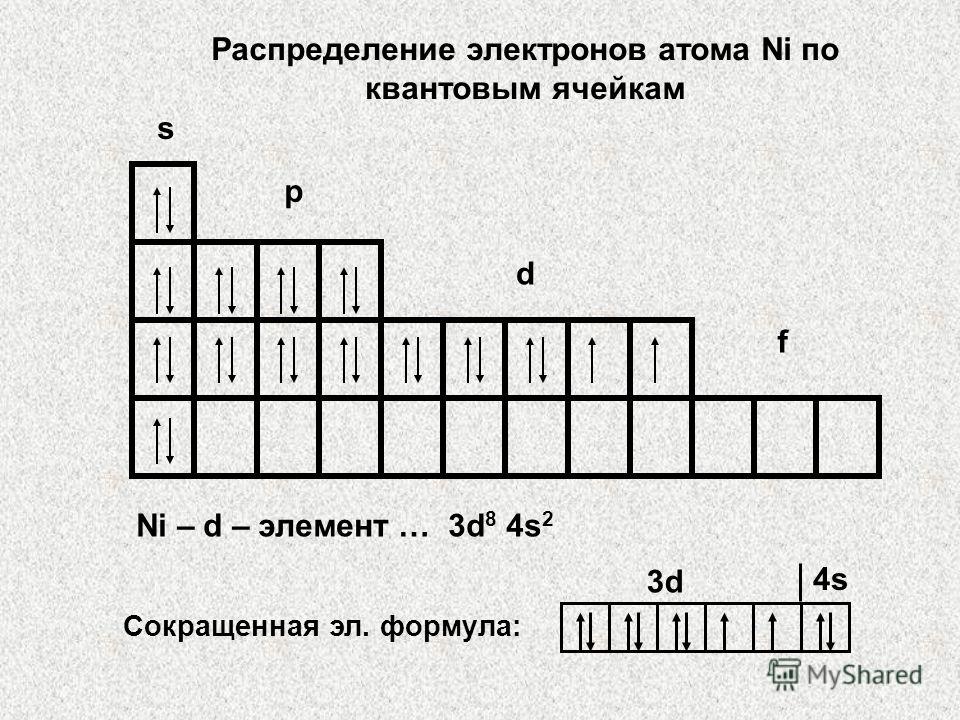
3. Titanyum atomu / Ti / formülünü oluşturun: 1. Seri numarası Ti = 22: atomda 22 elektron var 2. Ti 4. periyotta: elektronlar 4 seviyede yer alıyor: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 3. 22 elektronu, Pauli ilkesinin ve en az enerji ilkesinin gerekliliklerini yerine getirerek alt düzeylere dağıtın: 22 Ti - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 veya 22 Ti - 1s 2 2s 2 2p 6 3s 2 3p 6 3d 2 4s 2 ATOMLARIN ELEKTRONİK FORMÜLÜNÜN DERLENMESİ

4. Seryum atomunun formülünü oluşturun (Ce): 1. Seri numarası Ce \u003d 58: atomda 58 elektron var 2. Ce altıncı periyotta: 58 elektron altı seviyede bulunur: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p … 3. Alt düzeyler arasında 58 elektron dağıtın 58 Ce – 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 6 6s 2 4f 2 4f (n + l = = 7) 5p (n + l == 6) 5s (n + l == 5) 6s (n + l == 6) 5s 5p 6s 4f

Hangi alt seviyenin elektronlarla doldurulduğuna bağlı olarak, tüm elementler dört tipe (aileler) ayrılır: 1) S - elementler: dış seviyenin S-alt seviyesi doldurulur. Genel formülleri şöyledir: … nS 2 n – periyot numarası s-elemanları her periyodun ilk iki elemanını içerir. 2) P-elemanları: harici seviyenin P-alt seviyesi doldurulur. Genel formülleri şöyledir: … nS 2 n P 1–6 p-elemanları her periyodun son altı elemanını içerir /1. ve 7. hariç/. DÖRT TİP ELEMAN

3) d - elemanlar: ikinci seviyenin d-alt seviyesini dışarıdan doldururlar. Genel formülleri şöyledir: ... (n-1) d 1-10 nS 2 Dış seviyede 2 bazen 1 elektronları vardır (s 1-2). d-elemanları, s- ve p-elemanları arasında yer alan büyük periyotların 10 elemanını içerir. DÖRT ELEMAN TÜRÜ veya (n-2) f 1-14 (n-1) d 1 nS 2 4) f - elemanlar: ikinci seviyenin d-alt seviyesini dışarıdan doldururlar. Genel formülleri şöyledir: ... (n-2) f 1-14 nS 2 f-elementleri lantanitleri ve aktinitleri içerir

Periyodik tablonun yardımı olmadan atomların elektronik konfigürasyonlarını hazırlamak Bunu yapmak için bilmeniz gerekenler: 1. Bir periyotta kaç element bulunur: periyot Bir periyottaki element sayısı = 18 3 = 36 4 = 54 5 = 86 6 bitmedi

2. Bir periyottaki ilk iki elementin S-elemanları olduğu. 3. Her periyodun son altı elementi (1. ve 7. hariç) büyük periyotların elementlerinin (3.den başlayarak) p elementleridir - bunlar d elementleridir. 5. Lantanı (57 La) 4f elementleri takip eder. 6. Aktinyumdan (89 Ac) sonra, 5f elementleri, periyodik tablonun yardımı olmadan atomların elektronik konfigürasyonlarının derlenmesini takip eder.

3. Çözüm 4. Her AO, üç kuantum sayısı değeri ile karakterize edilir: n, l, m l. L Düzeyinin (n = 2) iki alt düzeyi vardır: l = 0 ve l = 1. l = 0 için yalnızca bir tane vardır" title="(!LANG: Çözüm 3. Hayır, çünkü d-alt düzey için l = 2 , sadece n > 3 değerleri için mümkündür Çözüm 4. Her AO, üç kuantum sayısı değeri ile karakterize edilir: n, l, m l L seviyesinin (n = 2) iki alt seviyesi vardır: l = 0 ve l = 1. l = O için sadece bir tane var" class="link_thumb"> 34 !}Çözüm 3. Hayır, çünkü d-alt seviye l = 2 için, bu sadece n > 3 değerleri için mümkündür. Çözüm 4. Her AO, üç kuantum sayısı değeri ile karakterize edilir: n, l, m l. Seviye L (n = 2) iki alt seviyeye sahiptir: l = 0 ve l = 1. l = 0'da tek bir değer vardır m l = 0 (bir AO) ve l = 1'de üç değer vardır m l = 1 , 0, + 1 (toplamda üç AO), bu nedenle, L düzeyindeki toplam AO sayısı dörttür. ÖRNEKLER ve ZORLUKLAR 3. Çözüm 4. Her AO, üç kuantum sayısı değeri ile karakterize edilir: n, l, m l. Seviye L (n = 2) iki alt seviyeye sahiptir: l = 0 ve l = 1. l = 0 için sadece bir "> 3. Çözüm vardır 4. Her AO, üç kuantum sayısı değeri ile karakterize edilir: n, l , m l. Seviye L ( n = 2) iki alt seviyeye sahiptir: l = 0 ve l = 1. l = 0'da tek bir değer vardır m l = 0 (bir AO) ve l = 1'de üç değer vardır m l = 1, 0, + 1 (toplam üç AO), bu nedenle, L düzeyindeki toplam AO sayısı dörttür. ÖRNEKLER ve SORUNLAR "> 3. Çözüm 4. Her AO, üç değeri ile karakterize edilir: kuantum sayıları: n, l, m l. L Düzeyinin (n = 2) iki alt düzeyi vardır: l = 0 ve l = 1. l = 0 için yalnızca bir tane vardır" title="(!LANG: Çözüm 3. Hayır, çünkü d-alt düzey için l = 2 , sadece n > 3 değerleri için mümkündür Çözüm 4. Her AO, üç kuantum sayısı değeri ile karakterize edilir: n, l, m l L seviyesinin (n = 2) iki alt seviyesi vardır: l = 0 ve l = 1. l = O için sadece bir tane var"> title="Çözüm 3. Hayır, çünkü d-alt seviye l = 2 için, bu sadece n > 3 değerleri için mümkündür. Çözüm 4. Her AO, üç kuantum sayısı değeri ile karakterize edilir: n, l, m l. Seviye L (n = 2) iki alt seviyeye sahiptir: l = 0 ve l = 1. l = 0 için sadece bir tane vardır."> !}
Bir atomun ele alınan elektron kabuğu, üç ilkeye göre elektronlarla doldurulur: en az enerji ilkesi, Pauli ilkesi / kuralı / Hund.
En az ilkesi, bir atomdaki bir elektronun minimum enerji değerine sahip olacağı serbest alt seviyeyi işgal ettiğini belirtir. Başka bir şekilde elektron, çekirdekle en güçlü bağın sağlandığı alt seviyede kalır.
Alt seviyeleri doldurma sırası, atomun elektron kabuğunun yapısındaki yukarıdaki gerçek alt seviyelerin düzenlenmesine karşılık gelir:
1sà2sà2pà3sà3pà4sà3d –… vb. /santimetre. üstünde/.
Pauli ilkesi /Pauli yasağı/ bir atomun dört kuantum sayısının aynı değerlerine sahip iki elektronu bile olamaz.
Sonuçlar. Bir yörünge, farklı spinlere sahip iki elektron içerebilir (yani, spin kuantum sayısının farklı değerlerine sahip: ms = +1/2 ve ms = –1/2).
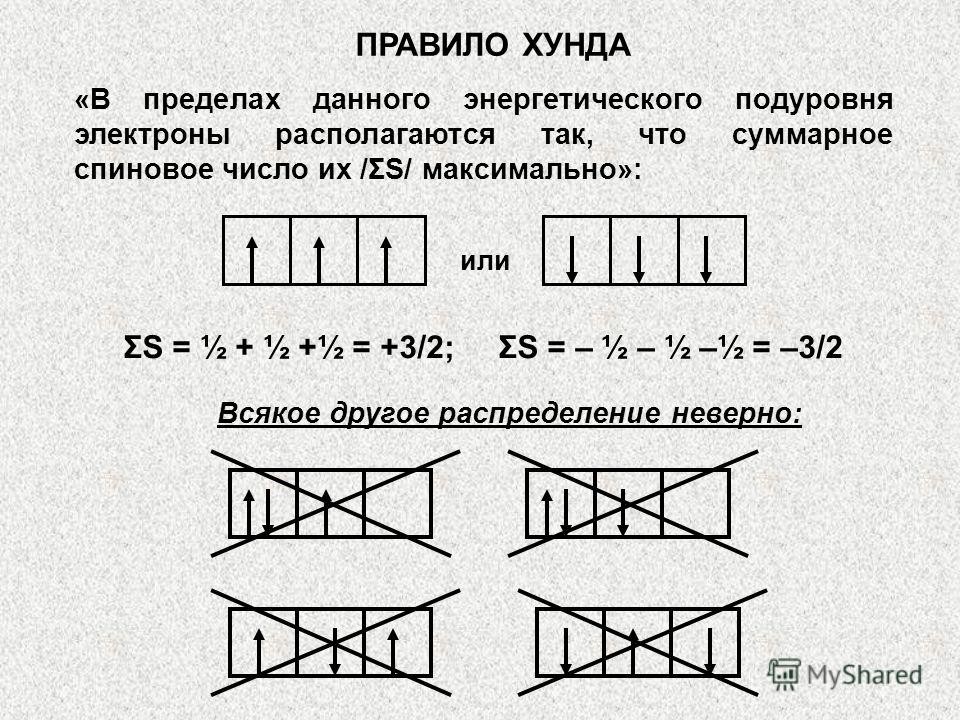
Üçüncü ilke, Gunda /Hunda/ ilkesi veya kuralıdır. Elektronların kuantum alt seviyesini doldurma sırasını açıklar. Alt düzey içinde, elektronlar, toplam kuantum sayıları maksimum değere sahip olacak şekilde dağıtılır /ilk orbital başına bir elektron ve ardından eşleşme/. Doğru dağılım, örneğin şu şekilde üç p-elektron olacaktır:
Hangi alt seviyenin son elektronlarla doldurulduğuna bağlı olarak, s-, p-, d-, f-elementleri ayırt edilir.
s-elemanları, atomlarında son elektronların dış kuantum seviyesinin s-alt seviyesini işgal ettiği elementlerdir. /Örneğin, sodyum, magnezyum, potasyum, kalsiyum vb./.
p-elementleri, atomlarındaki son elektronların dış kuantum seviyesinin p-alt seviyesini işgal ettiği elementlerdir. /Örneğin, karbon, oksijen, klor vb./.
Son elektronlarla dolu d-alt seviyesi, elementleri d-elemanları olarak sınıflandırır. /Örneğin, d-elementleri titanyum, krom, demir, bakırdır, çünkü bu elementlerde, son elektronlar sondan bir önceki seviyenin d-alt seviyesini işgal eder/.
f-elementleri, atomlarındaki son elektronların kuantum seviyesinin dışından ikincinin f-alt seviyesini işgal ettiği elementlerdir. /Örneğin, praseodimyum, öropyum, erbiyum, vb./.
2.1.7. Elektronik formüller ve kuantum hücreleri kullanan atomların elektronik yapısının görüntüsü.
Herhangi bir atomun elektronik yapısı, elektronik formüllerle temsil edilir. Elektronik formüllerde, kuantum elektronik seviyesi, ana kuantum sayısının n sayısal değeri ile gösterilir, alt seviye, ilgili alt seviyenin harf ataması ile yazılır ve alt seviyedeki elektron sayısı, alt seviyenin derecesi ile gösterilir. atama. Örneğin, 3d5, 3. kuantum seviyesinin d-alt seviyesinde beş elektron olduğu anlamına gelir. Herhangi bir elemanın elektronik formülü, örnekte belirtildiği gibi, bu tür parçaların eksiksiz bir setinden oluşur. Böylece titanyum atomunun elektronik formülü /№22/ şöyledir: 1s22s22p63s23p64s23d2. Tüm güçlerin toplamı 22'dir, bu, +22 nükleer yüke sahip titanyum atomunun elektron kabuğunda 22 elektron içerdiği ve toplam negatif yükleriyle (–22) pozitif yükünü telafi ettiği anlamına gelir. atom çekirdeği, atomu karmaşık elektriksel olarak nötr bir sistem haline getirir.
D.I.'nin periyodik element sisteminin yapısını düşündükten sonra elektronik formüller oluşturmak daha uygundur. İleriye baktığımızda ve lisede edinilen bilgilere dayanarak, periyodik elementler sistemini elektronik formüller şeklinde sunacağız. (Şekil 2.10.) Periyodik sistemdeki belirli bir elementin elektronik formüllerini yazmaya daha sonra döneceğiz ve herhangi bir elementin elektronik formülünün nasıl yazılacağını öğrenmenin kolay olduğu bir algoritma ele alacağız. İkinci olarak, bir atomun elektron kabuğunun yapısı kuantum hücreleri kullanılarak tasvir edilmiştir.

 ben 1s2
ben 1s2
II 2s2 2p6
VI 6s2 5d1 4f14 5d9 6p6
VII 7s2 6d1 5f14 6d9 7p6
“Kuantum hücresi” kavramını tanıtmamamıza rağmen, kuantum hücrelerini zaten kullandık. Kuantum hücresi, bir yörüngenin grafik temsilinden başka bir şey değildir. Bir hücre tarafından gösterilir ve yörüngedeki elektronlar, bir hücrede duran bir okla gösterilir. S-alt düzeyi yalnızca bir yörüngeye sahip olduğundan, s-alt düzeyi için bir hücre atanır. p-alt düzeyi üç p-orbital içerdiğinden, p-alt düzeyi için üç hücre ayrılmıştır. d-alt düzeyi beş hücreyle ve f-alt düzeyi yedi hücreyle temsil edilir.
Kuantum hücreleri kullanılarak tasvir edilen elektronik formülü zaten yazdığımız titanyum atomunun elektronik yapısı şöyle görünür:
Rusya Federasyonu Tarım Bakanlığı
FGOU VPO "Ulyanovsk Devlet Tarım Akademisi"
Disiplin içindeki testler ve sınav soruları için görevler
Ulyanovsk - 2010
A.L. Ignatov. "Kimya" disiplinindeki testler ve sınav soruları için görevler / Ed. Prof. VE. Kostina. - Ulyanovsk Devlet Tarım Akademisi, 2009, 58'ler.
Hakem: Kafiyatullina A.G., Kimya Adayı, Ulyanovsk Devlet Pedagoji Üniversitesi Kimya Bölümü Kıdemli Öğretim Üyesi. I.N. Ulyanova»
Bu kılavuz kimya dersinin ana bölümleri için kontrol görevleri, tipik problem çözme örnekleri ve sınav sorularının bir listesini içerir.
Mühendislik Fakültesi öğrencileri için uzmanlık alanında yazışma dersleri: 110301 "Tarımın mekanizasyonu", 110304 "Tarımsal sanayi kompleksindeki makinelerin bakım ve onarım teknolojisi", 190601 "Otomobil ve otomotiv endüstrisi".
© A.L. Ignatov, 2010.
© FGOU VPO "Ulyanovsk Devlet Tarım Akademisi", 2010.
KONTROL GÖREVLERİ
MADDENİN YAPISI
Tipik problem çözme örnekleri
Görev 1. Bir atomun hangi enerji alt düzeyi daha önce elektronlarla doldurulur: a) 4s veya 3d; b) 5p veya
4d; c) 6p veya 4f?
Çözüm. Enerji alt seviyelerini elektronlarla doldurma sırası, alt seviyelerin ana ve yörünge kuantum sayılarının (n + l) toplamındaki ardışık artış sırasına göre elektronlarla doldurulduğu Klechkovsky kuralı ile belirlenir. bu toplamın aynı değerleri, ana kuantum sayısı n'nin artan sırasına göre. Problem durumunda listelenen enerji alt düzeylerinin toplamını (n+l) bulalım.
Toplam n+l 4+0=4 |
Sonuç olarak, (a) durumunda 4s alt seviyesi önce elektronlarla, ardından 3d alt seviyesiyle doldurulur; (b) durumunda, önce 4d, sonra 5p; (c) durumunda, önce 4f, sonra 6p.
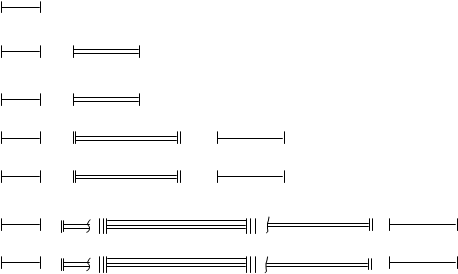
Görev 2. Elektronları seviyelerine göre dağıtın, Fe atomunun temel ve uyarılmış durumdaki elektronik formülünü yazın, değerlik elektronlarının kuantum durumlarını belirtin ve bunları kuantum hücreleri arasında dağıtın.
Çözüm. Bu problemin çözümü, uyarılmamış bir demir atomundaki elektronların işgal edeceği seviyelerin sayısını belirlemekle başlamalıdır. Sayıları, elemanın bulunduğu dönemin sayısına göre belirlenir. Demir için 4'e eşittir. İlk iki seviyede, maksimum elektron sayısı sırasıyla 2 ve 8'dir (ana kuantum sayısı 2n2'nin ikiye katlanmış karesi ile belirlenir). Maksimum değerlik elektron sayısı, elementin (VIII) bulunduğu grubun sayısı ile belirlenir. Demir bir yan alt grupta yer aldığından, değerlik elektronları s - dış enerji seviyesinin bir alt seviyesi ve d - dış enerji seviyesinin bir alt seviyesi arasında dağıtılır. Yani 4s durumunda 2 elektron ve 3d durumunda 6 elektron vardır (grup numarası eksi 2). Bir demir atomunun sondan bir önceki enerji seviyesindeki toplam elektron sayısı 14'tür.
Böylece, uyarılmamış bir demir atomundaki elektronlar, seviyeler arasında aşağıdaki gibi dağıtılır:
Her n. düzey, n alt düzeye bölünür. Bir atomun elektronik formülünü yazarken, alt düzeyler, asal ve yörünge kuantum sayılarının toplamına göre artan sırada düzenlenir:
Değerlik elektronları - 3d 6 4s2.
Alt seviyenin kuantum hücrelerinin elektronlarla doldurulma sırası, toplam dönüşün en büyük mutlak değeri ilkesine göre Hund kuralı ile belirlenir:
Uyarılmış bir demir atomunda bir s - elektron 4p - alt seviyesine gider. Uyarılmış durumda elektronlar kuantum hücreleri üzerinde şu şekilde dağılır:
Görev 3. Mn2+, S2-, Brions'ın elektronik formüllerini yazın.
Çözüm. Mn atomunda (d-elementi) elektronlar dağıtılır
enerji seviyeleri aşağıdaki gibidir: 1s2 2s2 2p6 3s2 3p6 3d 5 4s 2
d - elementlerinde pozitif iyonlar oluştuğunda, her zaman önce dış tabakanın s-elektronları çıkarılır, yani Mn + 2 için elektronik formül geçerlidir:
1s2 2s2 2p6 3s2 3p6 3d 5 4s 0
daha sonra S2– iyonu için 3p alt seviyesinin “tamamlanması” gerçekleşecektir.
S2– :1s2 2s2 2p6 3s 2 3p 6
Alt seviyenin benzer bir “tamamlanması”, Brion'un oluşumu sırasında meydana gelir:
Br:1s2 2s2 2p6 3s2 3p6 3d10 4s 2 4p 5
Br– :1s2 2s2 2p6 3s2 3p6 3d10 4s 2 4p 6 |
|||||||
Görev 4. Atomundaki son elektron duruma düşerse, elementin periyodik sistemdeki (periyot, grup, alt grup) konumunu belirtin: a) 3d6; b) 4p2 .
Cevabı gerekçelendirin.
Çözüm. a) Son elektron d-durumunda atoma çarparsa, bu yan alt grubun bir elementidir. İkincil alt grupların elementlerinin atomlarında, son değerlik elektronu, sondan bir önceki enerji seviyesinin alt seviyesi olan d'ye düşer. Bundan n-1=3 ve n=4 çıkar. Ana kuantum sayısının değeri - 4 - periyodun sayısını belirler - 4. 4s durumu 3d'den önceki elektronlarla dolu olduğundan, değerlik olabilecek toplam elektron sayısı 4:3d2 4s2'dir. Bu, bunun yan alt grubun IV grubunun 4. periyodunun bir elementi olduğu anlamına gelir - titanyum (Ti).
b) Son elektron atoma p durumunda girmişse, bu ana alt grubun bir elementidir.
Ana alt grupların elementlerinin atomlarında, değerlik elektronları dış enerji seviyesinde bulunur. Bu nedenle, ana kuantum sayısının değeri - 4 - periyodun sayısını belirler. Dış seviyenin p-durumu, s-durumundan sonra elektronlarla dolduğundan, 4'e eşit olan toplam değerlik elektronlarının sayısı grup numarasını belirler. Bu nedenle, bu IV grubunun 4. periyodu ve ana alt grup - germanyumun bir unsurudur.
Görev 5. BCl3 molekülünde hangi elektron bulutlarının üst üste geldiğini, molekülün hangi bağ açısına sahip olduğunu, BCl3 molekülünün polar olup olmadığını belirleyin. Cevabınızı gerekçelendirin, BCl3 molekülünün yapısını VS yöntemi (değerlik bağları) açısından düşünün.
Çözüm. Elementin periyodik sistemdeki konumuna göre, bağ oluşturan atomlardaki değerlik elektronlarının kuantum durumlarını belirtiniz ve bunları aşağıdaki gibi dağıtınız.
kuantum hücreleri: B…2s 2 2p1 , ancak bor atomu üç kimyasal bağ oluşturduğu için uyarılmış durumdadır ve sp2 elektronik orbitallerinin hibridizasyonu meydana gelir; üç hibrit elektron bulutu oluşur.
22p1 | ||||||||
B* ….2s1 2p2 | ||||||||
23p5 | ||||||||
P-elektron, klorda bir bağ oluşumunda rol oynar.
B–Cl bağları, В atomunun hibrit elektron bulutları ile Cl atomunun p-elektron bulutunun örtüşmesiyle oluşur.
Üç değerlikli B atomunun hibrit elektron bulutlarının yönü, bağların yönünü ve BCl3 molekülünün şeklini belirler. B–Cl bağları 1200°'lik bir açıyla yönlendirilir ve BCl3 molekülü düz bir üçgen şeklindedir. Bir molekülde bağ oluşum şeması Şekil 1'de gösterilmiştir.
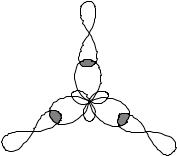
Bağ dipol moment vektörleri µb >0 elektronegatifliği daha yüksek olan atoma yöneliktir. PM molekülünün toplam dipol momenti 0'dır, yani. molekül polar değildir, ancak tüm B-Cl bağları polardır.
Görev 6. Aşağıdaki maddelerin kristallerindeki partiküller arasındaki ilişki nedir: CH4, Ne, Rb, RbF, Si, ZnSe? Parçacıkların doğasına ve aralarındaki bağ türlerine göre bu maddelerin yapısında ne tür kristal kafes vardır?
yoğunlaştırılmış hali?
Çözüm. Metan ve neon kristalleri moleküler bir kafes ile karakterize edilir. Birinci kristal kafesin bölgeleri, aralarında van der Waals kuvvetlerinin dağılım bileşeninin etki ettiği polar olmayan CH4 molekülleri içerir. Dispersiyon etkileşimi, monoatomik neon molekülleri arasındaki kristallerde de kendini gösterir.
Rubidyum bir metaldir; kristalli rubidyum, metalik bir kafes ile karakterize edilir; kafes bölgelerinde bulunan rubidyum katyonları arasındaki bağ metaliktir.
RbF bileşiğinde, atomların elektronegatifliğindeki farktan dolayı tipik bir iyonik bağ çalışır.
ikiden fazla ünite: ΔX RbF \u003d XF - XRb \u003d 4.0 - 0.8 \u003d 3.2 (Ek I), RbF kristalleri, düğümlerinde pozitif ve negatif Rb + ve F iyonlarının bulunduğu iyonik bir kafes ile karakterize edilir - arasında iyonik bağ vardır.
Kristal silisyum (silikon bir metal değildir), her bir silikon atomunun polar olmayan bir kovalent bağ ile dört komşu atoma bağlandığı elmas benzeri bir kovalent kristal kafese sahiptir. Çinko selenit kristalleri kovalent bir kafese sahiptir.
∆XZnSe = 2.4 - 1.6 = 0.8 olduğundan, kristal kafesin düğümlerinde bulunan çinko ve selenyum atomları arasında bir polar kovalent bağ etki eder.
1. Egzersiz
Görevler tablo 1'de verilmiştir. Varyant numarası satıra, görev numarası sütuna karşılık gelir.
1. Elektronları enerji seviyelerine dağıtın, görevde önerilen atomun elektronik formülünü yazın, değerlik elektronlarının kuantum durumlarını belirtin, bunları uyarılmamış ve uyarılmış durumlarda kuantum hücreleri arasında dağıtın, bu elementin hangi elektronik aileye ait olduğunu belirtin?
2. Önerilen iyonların elektronik formüllerini yazın, değerlik elektronlarının kuantum durumlarını belirtin ve bunları kuantum hücreleri arasında dağıtın.
3. Görevde önerilen alt seviyeler hangi sırayla elektronlarla doldurulacak? Bir açıklama yapın.
4. Son elektronun kuantum durumuna göre, elementin periyodik sistemdeki konumunu (periyot, grup, alt grup) belirtin.
5. Değerlik bağları yöntemi açısından görevde önerilen moleküllerin yapısını düşünün, belirtin






