Care substanțe au un punct de topire constant. Topire
ESEU
„Corpi care se topesc”
Efectuat:
Prisyazhnyuk Olga 9-A
Verificat:
Nevzorova Tatyana Igorevna
Introducere
1) Calculul cantității de căldură
2) Topire
3) Căldura specifică de fuziune
4) Topirea metalelor
5) Punctul de topire și punctul de fierbere al apei
6) Se topește
7) Interesant despre topire
Utilizarea cunoștințelor în alte contexte, condiții conexe
Proprietățile materiei și în special ale apei joacă un rol în multe fenomene. Aici, de exemplu, trebuie menționat ciclul meteorologic al apei și evapotranspirația organismelor vii. Aisbergurile sunt formate din apă pură, motiv pentru care sunt considerate surse de apă potabilă. Dar și producție apa dulce din apa sărată din mări nu este, teoretic și tehnic, o dificultate și este o procedură frecvent aplicată în țările cu apă potabilă mică, dar surse bogate de energie. Singura problemă este viabilitatea economică.
Concluzie (concluzii)
Introducere
Stare agregată - o stare a materiei caracterizată prin anumite proprietăți calitative: capacitatea sau incapacitatea de a menține volumul și forma, prezența sau absența ordinii pe distanță lungă și scurtă și altele. O schimbare a stării de agregare poate fi însoțită de o schimbare bruscă energie gratis, entropia, densitatea și alte proprietăți fizice de bază.
Pe Internet veți găsi multe pagini care spun topire și evaporare. Desigur, sunt multe altele. Dar unele întrebări rămân la fel de bune ca niciodată fără răspuns. De ce unele substanțe au un punct de topire foarte scăzut, în timp ce altele au un punct de topire ridicat?
- Ce procese au loc în timpul topirii și evaporării?
- Deci de ce țesăturile au așa ceva puncte diferite fierbere?
Ce procese au loc în timpul topirii?
De ce unele substanțe nu se topesc sau nu fierb, ci se descompun mai devreme? . Termenii fierbere și evaporare sunt folosiți în același mod pe această pagină. Mai multe informații pot fi găsite pe această pagină.
Primul pas: cum este creat solidul
Fiecare solid este format din particule minuscule. Există forțe între particule care le țin împreună. Sunt întotdeauna electrostatice. Natura particulelor și puterea forțelor sunt foarte numeroase. Puteți găsi colecția exactă pe pagina mea de Legături. Iată un scurt rezumat.Există trei stări principale de agregare: solid, lichid și gazos. Uneori nu este chiar corect să clasificăm plasma ca stare de agregare. Există și alte stări de agregare, de exemplu, cristalele lichide sau condensatul Bose-Einstein.
Schimbările în starea de agregare sunt procese termodinamice numite tranziții de fază. Se disting următoarele soiuri: de la solid la lichid - topire; de la lichid la gazos - evaporare și fierbere; de la solid la gazos - sublimare; de la gazos la lichid sau solid - condensare. O caracteristică distinctivă este absența unei granițe clare a tranziției la starea de plasmă.
Al doilea pas: ce se întâmplă când un solid este încălzit sub punctul său de topire?
Dacă o substanță este încălzită prin încălzire, cele mai mici particule absorb această energie. Ei spun că energia lor internă crește. Energia internă poate fi de trei tipuri: energie vibrațională, energie de rotație și energie electronică. Energia electronilor este irelevantă pentru topire și fierbere. Electroni care ajung peste nivel inalt energie, rămâneți acolo doar pentru un timp, apoi reveniți la nivelul inițial. Energia este eliberată și părăsește solidul. Aici apar fenomene precum fosforescența și fluorescența.
Pentru a descrie diferite stări din fizică, se folosește un concept mai larg de fază termodinamică. Fenomenele care descriu tranzițiile de la o fază la alta sunt numite fenomene critice.
Solid: O stare caracterizată prin capacitatea de a menține volumul și forma. Atomii unui corp solid produc doar mici vibrații în jurul stării de echilibru. Există atât ordine pe rază lungă, cât și pe rază scurtă.
Să ne uităm la vibrație, nu? iar forța de rotație este puțin mai apropiată. Particulele mici se mișcă într-un anumit fel. Unele dintre posibilitățile pentru aceste mișcări sunt acum enumerate. Întinderea. Cei 2 atomi legați printr-o legătură vibrează de-a lungul axei de legătură, astfel încât legătura devine periodic mai scurtă și mai lungă. Numai moleculele pot efectua vibrații de întindere, deoarece au doar o legătură în interiorul particulei. Vibrații de încovoiere. 3 atomi legați vibrează astfel încât unghiul dintre cele două legături este periodic mai mic și mai mare. Moleculele cu cel puțin 3 atomi pot provoca vibrații de încovoiere. Moleculele mai mari și mai complexe pot efectua vibrații complexe complexe. Un exemplu simplu este inversarea moleculei de amoniac. Întreaga particulă se poate roti în jurul centrului său de greutate. O parte din moleculă se poate roti în jurul unei legături.
- Vibrațiile unei particule în jurul poziției sale centrale.
- Adică, un ion sau o moleculă oscilează înainte și înapoi ca un pendul.
- Fiecare dintre cele mai mici particule din primul pas poate efectua astfel de vibrații.
Lichid: starea unei substanțe în care are compresibilitate scăzută, adică își păstrează bine volumul, dar nu își poate păstra forma. Lichidul ia cu ușurință forma vasului în care este plasat. Atomii sau moleculele unui lichid vibrează în apropierea stării de echilibru, blocate de alți atomi și sar adesea în alte locuri libere. Există doar o comandă pe distanță scurtă.
La temperaturi scăzute, particulele poartă doar oscilații lente, de amplitudine redusă și se rotesc încet. Dacă solidul este încălzit, vibrațiile și rotațiile devin mai rapide, iar vibrațiile cresc în amplitudine. Prin urmare, cele mai mici particule absorb căldura căldurii și o transformă în energie de mișcare.
Al treilea pas: Ce procese au loc în timpul topirii?
Pot cele mai mici particule să absoarbă o cantitate nelimitată de căldură? În cele două paragrafe anterioare, am văzut două proprietăți ale celor mai mici particule dintr-un solid. Atractorii electrostatici lucrează între ei. Ele conduc la o anumită energie de legare. Nu depinde de temperatura. Pe de altă parte, energie kinetică conținute în particule. Aceasta este cu atât cu cât temperatura este mai mare.
Gaz: O stare caracterizată printr-o compresibilitate bună, lipsită de capacitatea de a păstra atât volumul, cât și forma. Gazul tinde să ocupe întregul volum furnizat acestuia. Atomii sau moleculele unui gaz se comportă relativ liber, distanțele dintre ei sunt mult mai mari decât dimensiunea lor.
Alte stări: La răcirea profundă, unele substanțe (de departe nu toate) trec într-o stare supraconductoare sau superfluid. Aceste stări, desigur, sunt faze termodinamice separate, dar cu greu merită să fie numite noi stări agregate ale materiei din cauza neuniversalității lor. Substanțele neomogene, cum ar fi pastele, gelurile, suspensiile, aerosolii etc., care în anumite condiții prezintă proprietăți atât solide, cât și lichide și chiar gaze, sunt de obicei clasificate ca materiale dispersate, și nu la orice anume state agregate substante.
Dacă un corp solid este încălzit, energia cinetică a particulelor sale cele mai mici crește. La un moment dat, este mai mare decât energia de legătură. Se poate imagina că forțele de atracție dintre particule nu mai sunt suficient de puternice pentru a rezista forțelor cauzate de fluctuațiile termice. Particulele se mișcă acum independent unele de altele, iar aceasta este tocmai caracteristica lichidului. Solidul se topește.
De ce sunt lichidele lichide?
Într-un lichid, particulele nu mai sunt astfel ținute împreună de forțele de atracție electrostatică. Săgeata roșie arată ce se întâmplă când tu. solidul este încălzit la presiune scăzută. Acest proces se numește sublimare. Acest lucru este ușor de înțeles deoarece argumentul este simplu. Energia de legare este prea mică, forțele atractive sunt prea slabe pentru a ține particulele împreună, astfel încât acestea se depărtează. Totuși, dacă nu cunoști doar informațiile despre cărțile școlare, vei găsi aici o contradicție și îți vei pune o întrebare.
Topire
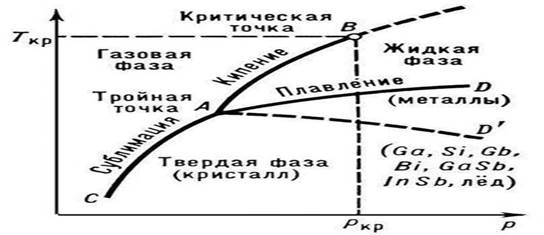
Orez. 1. Starea materiei pure (diagrama)
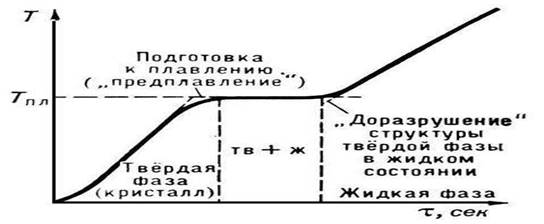
Orez. 2. Temperatura de topire a unui corp cristalin
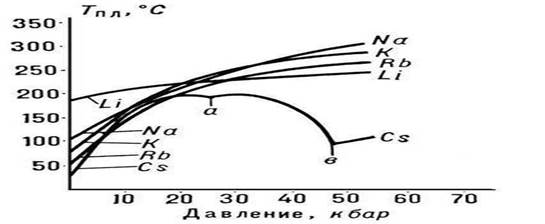
Orez. 3. Punct de topire Metale alcaline
Topirea - trecerea unei substanțe de la o stare cristalină (solidă) la o stare lichidă; are loc cu absorbția căldurii (tranziție de fază de ordinul întâi). Principalele caracteristici ale P. substanțelor pure sunt punctul de topire (Tmelt) și căldura care este necesară implementării procesului P. (căldura de topire Qmelt).
Într-un lichid, particulele nu sunt aproape întotdeauna separate unele de altele, ele sunt încă aproape la fel de aproape ca într-un solid. De ce nu se filmează ca și cum ar fi în gaz? Cu alte cuvinte, de ce solidul nu intră imediat în stare gazoasă în timpul topirii?
Presiunea joacă un rol cheie
O fac la presiune scăzută. Numai la presiune mare devin lichide. Este presiunea care împiedică particulele solide să intre direct în stare gazoasă? Este presiunea motivul pentru care există lichide?
Temperatura lui P. depinde de presiunea exterioară p; pe diagrama de stare a unei substanțe pure, această dependență este reprezentată de curba de topire (curba coexistenței fazelor solide și lichide, AD sau AD „în Fig. 1). Topirea aliajelor și a soluțiilor solide are loc, ca un regulă, în domeniul de temperatură (cu excepția eutecticilor cu o Ttopire constantă) Dependența temperaturii începutului și sfârșitului P. a unui aliaj de compoziția sa la o presiune dată este reprezentată pe diagramele de stare prin linii speciale ( curbele liquidus și solidus, vezi Sisteme binare). de la o stare solidă cristalină la un lichid izotrop are loc în etape (într-un anumit interval de temperatură), fiecare etapă caracterizează o anumită etapă de distrugere structură cristalină.
Să aruncăm o privire mai atentă asupra rolului presiunii. Particulele din interior sunt înconjurate de vecini. înconjurat şi atras de ei. Particulele de la suprafață au mai mulți vecini. Uită-te la poza din dreapta. Arată o parte din lichid, dar rapoartele în solide sunt practic aceleași.
Particulele din imagine sunt sferice, dar rapoartele sunt aceleași pentru molecule sau ioni de forme diferite. În primul rând, uită-te la particulele din interior. Este înconjurat de alte particule în toate direcțiile. Există atractori între particulă și toți vecinii ei. Acestea sunt forțele Coulomb, care au fost descrise în detaliu în primul pas. Desigur, sunt prezente atât în lichid, cât și în solid și sunt încă la fel de puternice ca înainte de topire. Ele sunt reprezentate prin linii negre în figură. O particulă este evidențiată, are 7 vecini, care sunt afectați de forțele Coulomb.
Prezenţa unei anumite temperaturi P. este un semn important al corectului structură cristalină corpuri solide. Pe această bază, ele sunt ușor de distins de solidele amorfe, care nu au un Tm fix. Solidele amorfe trec treptat în stare lichidă, înmuiindu-se odată cu creșterea temperaturii (vezi Starea amorfa). Tungstenul are cea mai ridicată temperatură dintre metalele pure (3410°C), iar mercurul are cea mai scăzută temperatură (-38,9°C). Compușii refractari în special includ: TiN (3200 °C), HfN (3580 °C), ZrC (3805 °C), TaC (4070 °C), HfC (4160 °C), etc. De regulă, pentru substanțe cu nivel ridicat Tm se caracterizează prin valori mai mari ale Qm. Impuritățile prezente în substanțe cristaline ah, coboară Tm-ul lor. Acest lucru este folosit în practică pentru a obține aliaje cu Tmelt scăzut (vezi, de exemplu, aliajul de lemn cu Tmelt = 68 °C) și amestecuri de răcire.
Unul dintre ei se îndepărtase deja de el. Dacă se mișcă mai departe, va părăsi complet mediul primei particule. Dar se află încă în lichid, deoarece se va apropia de o altă particulă și se va forma o legătură între ele pentru o perioadă scurtă de timp. Particulele din interiorul lichidului nu le pot părăsi, deoarece abia se mișcă de la o particulă vecină, sunt atrase de alta.
În cazul particulelor de pe suprafața lichidului, situația este diferită. Imaginea arată două astfel de particule. Au vecini doar în interiorul lichidului și doar pentru ei forțele Coulomb. În exterior, aproape că nu există vecini. Există aer sau alt gaz. Are o densitate foarte scăzută în comparație cu un lichid, deci conține mult mai puține particule pe unitate de volum. Veți descoperi că trebuie să aruncați o privire mai atentă asupra particulelor de pe suprafață. Există o cheie pentru răspuns.
P. începe când substanţa cristalină ajunge la Tpl. De la începutul lui P. până la finalizarea lui, temperatura substanței rămâne constantă și egală cu Tmelt, în ciuda transferului de căldură către substanță (fig. 2). În condiții normale, nu este posibil să se încălzească un cristal la T > Ttopire (vezi Supraîncălzire), în timp ce în timpul cristalizării o suprarăcire semnificativă a topiturii se realizează relativ ușor.
Particule cu mai multă sau mai puțină energie
Distribuția energiei particulelor într-un lichid. Am spus întotdeauna că particulele au o anumită energie din cauza fluctuațiilor termice și s-ar putea crede că toate particulele dintr-o picătură de lichid au aceeași energie. Unii dintre ei au o energie mai mare, alții o au una mai scăzută. Acest lucru este ușor de înțeles, având în vedere că particulele se ciocnesc. În funcție de viteza și direcția în care se ciocnesc, energia este transferată de la o particulă la alta. Deoarece întâlnirile sunt destul de aleatorii, există câștigători a căror energie crește de la pumn la pumn, precum și învinși.
Natura dependenței lui Tm de presiunea p este determinată de direcția modificărilor volumetrice (DVm) la P. (vezi ecuația Clapeyron-Clausius). În cele mai multe cazuri, P. unei substanțe este însoțită de o creștere a volumului acestora (de obicei cu câteva procente). Dacă acesta este cazul, atunci o creștere a presiunii duce la o creștere a Tm (Fig. 3). Totuşi, în unele substanţe (apă, un număr de metale şi metalide, vezi fig. 1), în timpul P. se produce o scădere a volumului. Temperatura lui P. a acestor substanţe scade odată cu creşterea presiunii.
Distribuția energiei particulelor într-o singură. Ambele distribuții diferă ușor. Particulele se evaporă. Zona din dreapta liniei roșii din partea de jos. Prin urmare, la 20°C, mai puține particule au energia necesară pentru a se evapora. poate fi atât la 50 ° C, iar la această temperatură, evaporarea este mai stabilă. Ce se întâmplă cu câștigătorii? Energia lor este atât de mare încât pot depăși forțele Coulomb ale vecinilor lor. Doar pentru că sunt atât de puțini vecini, au șansa de a depăși atractivitatea tuturor vecinilor.
Și doar pentru că energia lor este atât de mare, ei nu numai că pot depăși aceste priveliști pentru o perioadă scurtă de timp, ci și le pot prinde din nou, ci pentru totdeauna. Aceste câteva particule de înaltă energie lasă picături de lichid. Se mișcă pe cât posibil și nu se întorc niciodată la picăturile lor. Toată lumea cunoaște fenomenul descris mai sus.
P. este însoțită de o modificare a proprietăților fizice ale substanței: o creștere a entropiei, care reflectă dezordinea structurii cristaline a substanței; o creștere a capacității termice rezistență electrică[excepția sunt unele semimetale (Bi, Sb) și semiconductori (Ge), în stare lichida cu conductivitate electrică mai mare. În timpul P., rezistența la forfecare scade până la aproape zero (undele elastice transversale nu se pot propaga în topitură, vezi Lichid), viteza de propagare a sunetului (unde longitudinale), etc.
Tocmai ai învățat de ce cade o picătură de apă. Energie termală unele particule de pe suprafață sunt suficient de mari pentru a lăsa picături. Deoarece vorbim doar de evaporare, puteți și curăța rapid, deoarece depinde de temperatură. Deja chiar deasupra punctului de topire vor exista mai multe particule care au suficientă energie pentru a lăsa o picătură. Cu cât temperatura este mai mare, cu atât energia medie a particulelor este mai mare și tot mai multe particule vor avea energia necesară pentru a ieși de pe suprafață.
Sistemele închise aduc mai multă claritate
Ca urmare, picătura se evaporă mai repede. Ilustrația de mai jos ilustrează acest lucru. Încă o dată, am putut să explicăm experiențele de zi cu zi. Un sistem deschis este un sistem cu care se face schimb de materie și energie mediu inconjurator. De exemplu, o picătură de apă este sistem deschis. Împotriva, sisteme închiseși sisteme închise. Sticla de apă minerală cu model este bun exemplu sistem închis. Este aproximativ o treime umplut cu lichid. Pentru a evita un argument complicat inutil, ar trebui să fie umplut cu un lichid curat precum apa, nu cu un amestec precum apa minerală sau benzina.
Conform reprezentărilor moleculare și cinetice, P. se realizează astfel. Când căldura este aplicată unui corp cristalin, energia vibrațiilor (amplitudinea oscilației) a atomilor săi crește, ceea ce duce la creșterea temperaturii corpului și contribuie la formarea diferitelor tipuri de defecte în cristal (noduri neumplute ale rețelei cristaline). - locuri libere; încălcări ale periodicității rețelei de către atomii încorporați între nodurile sale etc., vezi Defecte în cristale). În cristalele moleculare, poate apărea dezordonarea parțială a orientării reciproce a axelor moleculelor dacă moleculele nu au formă sferică. O creștere treptată a numărului de defecte și asocierea lor caracterizează etapa de pretopire. Când se atinge Ttopirea, se creează o concentrație critică de defecte în cristal și începe cristalizarea; rețeaua cristalină se rupe în regiuni submicroscopice ușor mobile. Căldura furnizată în timpul P. este folosită nu pentru a încălzi corpul, ci pentru a rupe legăturile interatomice și a distruge ordinea pe distanță lungă în cristale (vezi Ordinea pe distanță lungă și ordinea pe rază scurtă). Pe de altă parte, în regiunile submicroscopice înseși, ordinea pe distanță scurtă în aranjarea atomilor nu se modifică semnificativ la punctul de topire (numărul de coordonare al topiturii la Tmelt în cele mai multe cazuri rămâne același cu cel al cristalului). Aceasta explică valorile mai mici ale căldurilor de fuziune Qm în comparație cu căldurile de vaporizare și modificarea relativ mică a unui număr de proprietăți fizice ale substanțelor în timpul P lor.
Procesul de piroliză joacă un rol important în natură (piroliza zăpezii și a gheții de pe suprafața pământului, mineralizarea mineralelor în adâncimea ei și așa mai departe) și în tehnologie (producția de metale și aliaje, turnarea mucegaiului etc.) .
Căldura specifică de fuziune
Căldura specifică de fuziune (de asemenea: entalpia de fuziune; există și un concept echivalent de căldură specifică de cristalizare) - cantitatea de căldură care trebuie transmisă unei unități de masă a unei substanțe cristaline într-un proces izobaric-izotermic de echilibru pentru pentru a-l transfera dintr-o stare solidă (cristalină) într-un lichid (aceeași cantitate de căldură eliberată în timpul cristalizării unei substanțe). Căldura de topire - caz special căldură faza de tranzitie sunt amabil. Distingeți căldura specifică de fuziune (J/kg) și molară (J/mol).
Căldura specifică de fuziune este indicată prin literă
(litera greacă lambda) Formula de calcul a căldurii specifice de fuziune: , - căldură specifică de fuziune, - cantitatea de căldură primită de substanță în timpul topirii (sau eliberată în timpul cristalizării), - masa substanței care se topește (cristaliza) .
Topirea metalelor
La topirea metalelor, trebuie respectate anumite reguli. Să presupunem că vor topi plumbul și zincul. Plumbul se va topi rapid, având un punct de topire de 327°; zincul, pe de altă parte, va rămâne solid pentru o lungă perioadă de timp, deoarece punctul său de topire este peste 419 °. Ce se va întâmpla cu o astfel de supraîncălzire? Va începe să fie acoperit cu o peliculă de culoare irizată, iar apoi suprafața sa va fi ascunsă sub un strat de pulbere care nu se topește. Plumbul ars din supraîncălzire, oxidat prin combinarea cu oxigenul din aer. După cum știți, acest proces are loc la temperatura obișnuită, dar atunci când este încălzit, merge mult mai repede. Astfel, în momentul în care zincul începe să se topească, va rămâne foarte puțin plumb metalic. Aliajul se va dovedi a avea o compoziție complet diferită, așa cum era de așteptat, și o cantitate mare de plumb se va pierde sub formă de deșeuri. Este clar că trebuie mai întâi să topim zincul mai refractar și apoi să punem plumb în el. Același lucru se va întâmpla dacă zincul este aliat cu cupru sau alamă, mai întâi încălzind zincul. Zincul va arde în momentul în care cuprul se topește. Aceasta înseamnă că trebuie întotdeauna să topești mai întâi metalul cu un punct de topire mai mare.
Dar acesta nu poate evita frenezia. Dacă un aliaj încălzit corespunzător este ținut pe foc pentru o lungă perioadă de timp, se formează din nou o peliculă pe suprafața metalului lichid ca urmare a fumului. Este clar că metalul mai fuzibil se va transforma din nou în oxid și compoziția dopului se va schimba; Aceasta înseamnă că metalul nu poate fi supraîncălzit mult timp în mod inutil. Prin urmare, ei încearcă în toate modurile posibile să reducă deșeurile de metal, așezându-l într-o masă compactă; bucăți mici, rumeguș, așchii sunt mai întâi „ambalate”, bucăți mai mult sau mai puțin de aceeași dimensiune sunt topite, sunt încălzite la o temperatură suficientă, iar suprafața metalică este protejată de contactul cu aerul. În acest scop, maestrul poate lua un borax sau poate acoperi pur și simplu suprafața metalului cu un strat de cenușă, care va pluti întotdeauna deasupra (datorită gravitație specifică) și nu va răni la turnarea metalului. Când metalul se solidifică, are loc un alt fenomen, probabil familiar și tinerilor meșteri. Metalul, solidificându-se, scade în volum, iar această scădere se produce datorită particulelor de metal interne, încă nesolidificate. Pe suprafața turnării sau în interiorul acesteia se formează o depresiune mai mult sau mai puțin semnificativă în formă de pâlnie, așa-numita cavitate de contracție. De obicei, matrița este realizată în așa fel încât în acele locuri ale turnării să se formeze găuri de contracție, care sunt ulterior îndepărtate, încercând să protejeze produsul în sine cât mai mult posibil. Este clar că găurile de contracție strică turnarea și uneori o pot face inutilizabilă. După topire, metalul este ușor supraîncălzit, astfel încât să fie mai subțire și mai fierbinte și, prin urmare, umple mai bine detaliile matriței și nu îngheață prematur din contactul cu o matriță mai rece.
Deoarece punctul de topire al aliajelor este de obicei mai mic decât punctul de topire al celor mai refractare dintre metalele care alcătuiesc aliajul, uneori este benefic să faceți opusul: mai întâi topiți metalul mai fuzibil și apoi pe cel mai refractar. Cu toate acestea, acest lucru este permis numai pentru metalele care nu sunt puternic oxidate sau cu condiția ca aceste metale să fie protejate de oxidarea excesivă. Este necesar să se ia mai mult metal decât este necesar pentru lucrul în sine, astfel încât să umple nu numai matrița, ci și canalul de colectare. Este clar că mai întâi trebuie să calculați cantitatea necesară de metal.
Punctul de topire și de fierbere al apei
Cea mai surprinzătoare și mai fericită proprietate a apei pentru natura vie este capacitatea sa de a fi lichid în condiții „normale”. Moleculele de compuși foarte asemănătoare cu apa (de exemplu, moleculele H2S sau H2Se) sunt mult mai grele, dar formează un gaz în aceleași condiții. Astfel, apa pare să contrazică legile tabelului periodic, care, după cum știți, prezice când, unde și ce proprietăți ale substanțelor vor fi apropiate. În cazul nostru, din tabel rezultă că proprietățile compuși cu hidrogen elementele (numite hidruri) situate în aceleași coloane verticale ar trebui să se modifice monoton odată cu creșterea masei atomilor. Oxigenul este un element din grupa a șasea din acest tabel. În aceeași grupă se află sulful S (cu o greutate atomică de 32), seleniul Se (cu o greutate atomică de 79), telurul Te (cu o greutate atomică de 128) și poloniu Po (cu o greutate atomică de 209). În consecință, proprietățile hidrurilor acestor elemente ar trebui să se schimbe monoton la trecerea de la elemente grele la elemente mai ușoare, adică. în secvența H2Po → H2Te → H2Se → H2S → H2O. Ceea ce se întâmplă, dar numai cu primele patru hidruri. De exemplu, punctele de fierbere și de topire cresc pe măsură ce greutatea atomică a elementelor crește. În figură, crucile marchează punctele de fierbere ale acestor hidruri, iar cercurile marchează punctele de topire.

După cum se poate observa, pe măsură ce greutatea atomică scade, temperaturile scad destul de liniar. Zona de existență a fazei lichide a hidrurilor devine din ce în ce mai „rece”, iar dacă hidrura de oxigen H2O ar fi un compus normal, similar cu vecinii săi din al șaselea grup, atunci apa lichidă ar exista în intervalul de la - 80 ° C până la -95 ° C. La mai mult La temperaturi ridicate, H2O ar fi întotdeauna un gaz. Din fericire pentru noi și pentru toată viața de pe Pământ, apa este anormală, nu recunoaște un model periodic, ci își urmează propriile legi.
Acest lucru se explică destul de simplu - majoritatea moleculelor de apă sunt conectate prin legături de hidrogen. Aceste legături sunt cele care disting apa de hidrurile lichide H2S, H2Se și H2Te. Dacă nu ar fi, atunci apa ar fierbe deja la minus 95 ° C. Energia legăturilor de hidrogen este destul de mare și pot fi rupte doar la mult mai mare temperatura ridicata. Chiar și în stare gazoasă număr mare Moleculele de H2O își păstrează legăturile de hidrogen, unindu-se în dimeri (H2O)2. Legăturile de hidrogen complet dispar numai la o temperatură a vaporilor de apă de 600 °C.
Amintiți-vă că fierberea constă în faptul că în interiorul unui lichid care fierbe se formează bule de vapori. La presiune normală, apa pură fierbe la 100 "C. Dacă căldura este furnizată prin suprafața liberă, procesul de evaporare a suprafeței va fi accelerat, dar evaporarea volumetrică caracteristică fierberii nu are loc. Fierberea poate fi efectuată și prin scăderea nivelului extern. presiune, deoarece în acest caz presiunea vaporilor egală cu presiunea exterioară se realizează la o temperatură mai scăzută. În partea de sus este foarte munte înalt presiunea și, în consecință, punctul de fierbere sunt atât de scăzute încât apa devine nepotrivită pentru gătirea alimentelor - temperatura necesară a apei nu este atinsă. Cu o presiune suficient de mare, apa poate fi încălzită suficient pentru a topi plumbul (327°C) și încă să nu fiarbă.
Pe lângă punctele de fierbere super-mari de topire (și ultimul proces necesită prea multă căldură de fuziune pentru un lichid atât de simplu), chiar domeniul de existență a apei este anormal - o sută de grade prin care aceste temperaturi diferă - un interval destul de mare pentru un lichid cu greutate moleculară atât de mică precum apa. Limitele valorilor admisibile ale hipotermiei și supraîncălzirii apei sunt neobișnuit de mari - cu încălzire sau răcire atentă, apa rămâne lichidă de la -40 ° C la +200 ° C. Aceasta extinde intervalul de temperatură în care apa poate rămâne lichidă la 240 °C.
Când gheața este încălzită, temperatura acesteia crește mai întâi, dar din momentul în care se formează amestecul de apă și gheață, temperatura va rămâne neschimbată până când toată gheața se va topi. Acest lucru se explică prin faptul că căldura furnizată gheții care se topește este cheltuită în primul rând numai pentru distrugerea cristalelor. Temperatura gheții de topire rămâne neschimbată până când toate cristalele sunt distruse (vezi căldura latentă de fuziune).
se topește
Topiturile sunt o stare lichidă topită a substanțelor la temperaturi cuprinse în anumite limite îndepărtate punct critic punctul de topire și situat mai aproape de punctul de topire. Natura topiturii este determinată în mod inerent de tip legături chimice elementele din substanța topită.
Topiturile sunt utilizate pe scară largă în metalurgie, fabricarea sticlei și în alte domenii ale tehnologiei. Topiturile au de obicei o compoziție complexă și conțin diferite componente care interacționează (vezi diagrama de fază).
Topiturile sunt
1. Metalic (Metale (numele provine din latinescul metallum - mine, mine) - un grup de elemente cu proprietăți metalice caracteristice, precum conductivitate termică și electrică ridicată, coeficient de rezistență pozitiv la temperatură, ductilitate ridicată și luciu metalic);
2. Ionic (Ion (greaca veche ἰόν - merge) - o particulă monoatomică sau poliatomică încărcată electric formată ca urmare a pierderii sau adăugării unuia sau mai multor electroni la un atom sau moleculă. Ionizarea (procesul de formare a ionilor) poate apar la temperaturi ridicate, sub impact câmp electric);
3.Semiconductor cu legaturi covalenteîntre atomi (Semiconductorii sunt materiale care, în ceea ce privește conductivitatea lor specifică, ocupă o poziție intermediară între conductori și dielectrici și diferă de conductori printr-o dependență puternică a conductivității specifice de concentrația de impurități, temperatură și diferite feluri radiatii. Principala proprietate a acestor materiale este o creștere a conductibilității electrice odată cu creșterea temperaturii);
4. Topituri organice cu legături van der Waals;
5. Polimer înalt (Polimeri (greacă πολύ- - mulți; μέρος - parte) - substanțe anorganice și organice, amorfe și cristaline obținute prin repetarea repetată a diferitelor grupe de atomi, numite „unități monomerice”, conectate în macromolecule lungi prin chimie sau coordonare obligațiuni)
Se topește după tip compuși chimici Sunt:
1. Sare;
2.Oxid;
3. Oxid-silicat (zgură), etc.
Se topește cu proprietăți speciale:
1.Eutectic
Interesant despre topire
Boabele de gheață și stele.
Introduceți o bucată gheață purăîntr-o cameră caldă și priviți cum se topește. Va deveni rapid clar că gheața, care părea monolitică și omogenă, se desface în multe boabe mici - cristale individuale. În volumul de gheață, acestea sunt situate aleatoriu. Nu mai puțin decât poza interesanta poate fi văzut când gheața se topește de la suprafață.
Aduceți o bucată netedă de gheață la lampă și așteptați până când începe să se topească. Când topirea atinge boabele interioare, acolo vor începe să apară modele foarte fine. Cu o lupa puternica se poate observa ca au forma de fulgi de zapada hexagonali. De fapt, acestea sunt depresiuni topite pline cu apă. Forma și direcția razelor lor corespund orientării monocristalelor de gheață. Aceste modele sunt numite „stele Tyndall” după fizicianul englez care le-a descoperit și descris în 1855. „Stelele Tyndall”, asemănătoare fulgilor de zăpadă, sunt de fapt depresiuni de pe suprafața gheții topite, de aproximativ 1,5 mm, umplute cu apă. În centrul lor sunt vizibile bule de aer, care au apărut din cauza diferenței dintre volumele de gheață topită și apa topită.
ȘTIAȚI?
Există un metal, așa-numitul aliaj de lemn, care se poate topi ușor chiar și în apă caldă (+68 grade Celsius). Deci, atunci când amestecați zahărul într-un pahar, o lingură de metal din acest aliaj se va topi mai repede decât zahărul!
Cea mai refractară substanță, carbura de tantal TaCO-88, se topește la o temperatură de 3990°C.
În 1987, cercetătorii germani au reușit să suprarăciască apa la -700C în timp ce o păstrau în stare lichidă.
Uneori, ca să se topească mai repede zăpada de pe trotuare, acestea sunt stropite cu sare. Topirea gheții are loc deoarece se formează o soluție de sare în apă, al cărei punct de îngheț este mai mic decât temperatura aerului. Soluția curge de pe trotuar.
Interesant este că picioarele se răcesc mai mult pe pavajul umed, deoarece temperatura soluției de apă sărată este mai mică decât cea a zăpezii pure.
Dacă turnați ceaiul dintr-un ceainic în două căni: cu zahăr și fără zahăr, atunci ceaiul într-o cană cu zahăr va fi mai rece, pentru că. dizolvarea zahărului (distrugerea rețelei sale cristaline) consumă și energie.
În înghețuri severe, pentru a reda netezimea gheții, patinoarul este udat apa fierbinte.. Apa fierbinte topește un strat subțire de gheață superior, nu îngheață atât de repede, are timp să se răspândească, iar suprafața gheții este foarte netedă.
Concluzie (concluzii)
Topirea este trecerea unei substanțe din stare solidăîn lichid.
Când este încălzită, temperatura substanței crește, iar viteza de mișcare termică a particulelor crește, în timp ce energia internă a corpului crește.
Când temperatura unui solid atinge punctul de topire, rețeaua cristalină solidîncepe să se destrame. Astfel, cea mai mare parte a energiei încălzitorului, condusă către corpul solid, este cheltuită pentru reducerea legăturilor dintre particulele substanței, adică pentru distrugerea rețelei cristaline. În acest caz, energia de interacțiune între particule crește.
Substanța topită are o cantitate mare energie interna decât în stare solidă. Partea rămasă din căldura de fuziune este cheltuită pentru a face lucru pentru a schimba volumul corpului în timpul topirii acestuia.
Când este topit, volumul majorității corpuri cristaline crește (cu 3-6%) și scade în timpul întăririi. Dar, există substanțe în care, la topire, volumul scade, iar când se solidifică, crește. Acestea includ, de exemplu, apa și fonta, siliciul și altele. . De aceea gheața plutește pe suprafața apei, iar fonta solidă - în propria topitură.
Solidele numite amorfe (chihlimbar, rășină, sticlă) nu au un punct de topire specific.
Cantitatea de căldură necesară pentru a topi o substanță este egală cu produsul căldurii specifice de fuziune înmulțit cu masa substanței.
Căldura specifică de fuziune arată câtă căldură este necesară pentru a transforma complet 1 kg dintr-o substanță dintr-o stare solidă în stare lichidă, luată la viteza de topire.
Unitatea de măsură a căldurii specifice de fuziune în SI este 1J/kg.
În timpul procesului de topire, temperatura cristalului rămâne constantă. Această temperatură se numește punct de topire. Fiecare substanță are propriul punct de topire.
Punctul de topire pentru o anumită substanță depinde de presiunea atmosferică.
Lista literaturii folosite
1) Date din enciclopedia electronică gratuită „Wikipedia”
http://ru.wikipedia.org/wiki/Main_page
2) Site-ul "Clasă! Fizica pentru curioși" http://class-fizika.narod.ru/8_11.htm
3) Site " Proprietăți fizice apă"
http://all-about-water.ru/boiling-temperature.php
4) Site-ul web „Metale și structuri”
http://metaloconstruction.ru/osnovy-plavleniya-metallov/
Nu exista asa ceva corp solid, care ar rezista la cresterea temperaturii atat cat este necesar. Mai devreme sau mai târziu o bucată solidă se transformă într-un lichid; corect, în unele cazuri nu vom putea ajunge la punctul de topire – poate apărea descompunerea chimică.
Pe măsură ce temperatura crește, moleculele se mișcă din ce în ce mai repede. În cele din urmă, vine un moment în care menținerea ordinii „între moleculele puternic” oscilante „devine imposibilă. Solidul se topește. Tungstenul are cel mai înalt punct de topire: 3380 ° C. Aurul se topește la 1063 ° C, fierul la 1539 ° C. Cu toate acestea, există sunt metale cu punct de topire scăzut.Mercurul, așa cum este bine cunoscut, se topește deja la o temperatură de -39 ° C. Substanțele organice nu au puncte de topire ridicate. Naftalina se topește la 80 ° C, toluenul - la -94,5 ° C.
Nu este deloc dificil de măsurat punctul de topire al unui corp, mai ales dacă acesta se topește în intervalul de temperatură care se măsoară cu un termometru obișnuit. Nu este deloc necesar să urmăriți corpul care se topește cu ochii. Este suficient să te uiți la coloana de mercur a termometrului. Până la începutul topirii, temperatura corpului crește (Fig. 4.5). De îndată ce începe topirea, creșterea temperaturii se oprește și temperatura va rămâne neschimbată până la finalizarea procesului de topire.
La fel ca transformarea unui lichid în vapori, transformarea unui solid într-un lichid necesită căldură. Căldura necesară pentru aceasta se numește căldură latentă topire. De exemplu, topirea unui kilogram de gheață necesită 80 kcal.
Gheața este unul dintre corpurile cu o căldură mare de fuziune. Topirea gheții necesită, de exemplu, de 10 ori mai multă energie decât topirea aceleiași mase de plumb. Desigur vorbim despre topirea în sine, nu spunem aici că înainte de a începe topirea plumbului, acesta trebuie încălzit la + 327 ° C. Din cauza căldurii mari a gheții care se topește, topirea zăpezii încetinește. Imaginați-vă că căldura de topire ar fi de 10 ori mai mică. Apoi, inundațiile de primăvară ar aduce dezastre de neimaginat în fiecare an.
Deci, căldura de fuziune a gheții este mare, dar este și mică în comparație cu căldura specifică vaporizare la 540 kcal/kg (de șapte ori mai puțin). Cu toate acestea, această diferență este destul de naturală. La transformarea unui lichid în vapori, trebuie să rupem moleculele una de alta, iar la topire, nu trebuie decât să distrugem ordinea în aranjarea moleculelor, lăsându-le la aproape aceleași distanțe. Este clar că este nevoie de mai puțină muncă în al doilea caz.
Prezența unui anumit punct de topire este o caracteristică importantă a substanțelor cristaline. Pe această bază sunt ușor de distins de alte solide, numite amorfe sau sticle. Ochelarii se găsesc atât printre substanțele anorganice, cât și printre substanțele organice. Geamurile ferestrelor sunt de obicei fabricate din silicați de sodiu și calciu; de multe ori pe birou se pune sticla organica (se mai numeste si plexiglas).
Substanțele amorfe, spre deosebire de cristale, nu au un punct de topire definit. Sticla nu se topește, ci se înmoaie. Când este încălzită, o bucată de sticlă devine mai întâi moale din tare, poate fi ușor îndoită sau întinsă; la o temperatură mai mare, piesa începe să-și schimbe forma sub influența propriei gravitații. Pe măsură ce se încălzește, masa vâscoasă groasă de sticlă ia forma vasului în care se află. Această masă este la început groasă, ca mierea, apoi ca smântâna și, în cele din urmă, devine aproape la fel de lichid cu vâscozitate scăzută ca apa. Cu toată dorința noastră, nu putem indica aici o temperatură specifică pentru trecerea unui solid la un lichid. Motivele pentru aceasta constă în diferența fundamentală dintre structura sticlei și structura corpurilor cristaline. După cum am menționat mai sus, atomii din corpuri amorfe aranjate aleatoriu. Paharele în structură seamănă cu lichidele. Chiar și în sticlă solidă, moleculele sunt aranjate aleatoriu. Aceasta înseamnă că o creștere a temperaturii sticlei nu face decât să mărească gama de vibrații ale moleculelor sale, oferindu-le treptat din ce în ce mai multă libertate de mișcare. Prin urmare, sticla se înmoaie treptat și nu prezintă o tranziție ascuțită „solid” - „lichid”, care este caracteristică trecerii de la aranjarea moleculelor într-o ordine strictă la un aranjament aleatoriu.
Când a venit vorba de curba de fierbere, am spus că lichidul și vaporii pot, deși într-o stare instabilă, să trăiască în regiuni străine - vaporii pot fi suprarăciți și transferați la stânga curbei de fierbere, lichidul poate fi supraîncălzit și tras la dreapta. a acestei curbe.
Sunt posibile fenomene similare în cazul unui cristal cu un lichid? Se pare că aici analogia este incompletă.
Dacă încălziți cristalul, acesta va începe să se topească la punctul său de topire. Cristalul nu poate fi supraîncălzit. Dimpotrivă, prin răcirea lichidului, este posibil, dacă se iau anumite măsuri, să „trece prin” punctul de topire relativ ușor. În unele lichide, pot fi realizate subrăciri mari. Există chiar și lichide care sunt ușor de suprarăcit, dar greu de făcut să se cristalizeze. Pe măsură ce un astfel de lichid se răcește, devine din ce în ce mai vâscos și în cele din urmă se solidifică fără a cristaliza. Așa este sticla.
De asemenea, puteți răci apa. Picăturile de ceață nu pot îngheța chiar și în înghețuri severe. Dacă un cristal al unei substanțe, o sămânță, este aruncat într-un lichid suprarăcit, atunci cristalizarea va începe imediat.
În cele din urmă, în multe cazuri, cristalizarea întârziată poate fi inițiată prin agitare sau altfel evenimente aleatorii. Se știe, de exemplu, că glicerolul cristalin a fost obținut mai întâi în timpul transportului calea ferata. Ochelarii după o perioadă lungă de timp pot începe să se cristalizeze (devitrificarea sau „prăbușirea”, așa cum se spune în tehnologie).






