Ce înseamnă „punct critic”?
Care sunt punctele critice ale oțelului
Punctele critice ale oțelului sau punctele Chernoff sunt temperaturi critice la care are loc o schimbare a stării fazei și a structurii oțelului atunci când este încălzit sau răcit în formă solidă. Înființată de Dmitri Konstantinovici Chernov în 1868.
Punctele critice sunt notate cu litera A. Punctul critic inferior corespunde liniei PSK a diagramei stării fier-carbon. Acest punct se numește A1 și corespunde transformării austenitei în perlită la răcire sau a perlitei în austenită la încălzire. Punctul critic superior se numește A3. Punctul critic A3 pentru oțelurile hipoeutectoide se află pe linia GS a diagramei fier-carbon și corespunde începutului precipitării feritei la răcire sau sfârșitului dizolvării acesteia la încălzire. Punctul critic A3 pentru oțelurile hipereutectoide se află pe linia SE și corespunde începutului precipitării secundare a cementitei la răcire sau sfârșitului dizolvării acesteia la încălzire.
În funcție de faptul că punctul critic este determinat în timpul încălzirii sau răcirii, indicele „c” se adaugă la litera A în timpul încălzirii (din cuvântul francez chauffage - încălzire) și indicele „r” (din cuvântul francez refroidissement - răcire) în timpul răcirii, lăsând numărul care caracterizează această transformare.
Astfel, de exemplu, încălzirea oțelului hipoeutectoid deasupra punctului corespunzător de pe linia GS este notată ca încălzire deasupra punctului Ac3. Când acest oțel este răcit, prima transformare ar trebui să fie desemnată ca Ar3, al doilea (pe linia PSK) - ca Ar1. Punctul A3 pentru oțelurile hipereutectoide este de obicei notat Acm.
Punct Mnîn tabel denotă temperatura de început a transformării martensitice.
În tratamentul termic al oțelurilor, valorile punctului critic sunt cel mai adesea utilizate pentru a determina temperatura de încălzire pentru întărire.
Cum să alegeți temperatura de încălzire pentru întărire
Pentru oțelurile hipoeutectoide (conținutul de carbon din oțel este mai mic de 0,8%), temperatura de călire este de obicei aleasă conform formulei Ac3+30...50°C. În practică, există cazuri când oțelurile hipoeutectoide sunt întărite din intervalul de temperatură între Ac1 și Ac3. În acest caz, structura de oțel va consta din martensită și ferită nedizolvată. Un astfel de proces se numește întărire incompletă și este teoretic o căsătorie. În practică, o astfel de schemă este utilizată pentru a reduce deformarea pieselor sau pentru a elimina fisurarea oțelurilor înalt aliate.
Oțelurile hipereutectoide sunt de obicei încălzite pentru întărire la temperaturi Ac1+30...50°C. După întărire, structura oțelului va fi compusă din martensită și cementită secundară nedizolvată, ceea ce crește duritatea și rezistența la uzură a produselor.
punct critic
descrie starea critică a materiei pe diagrame de stare. Punctul critic se termină, de exemplu, curba de echilibru fază lichid-vapori în sistemul de coordonate: temperatura T, presiunea p.
Punct critic
punct de pe diagrama de stare corespunzatoare condiție critică. K. t. lichid de echilibru bifazic ≈ vapori este punctul final al curbei de echilibru și se caracterizează prin valori critice ale temperaturii Tk, presiunii pk și volumului Vk (tabel). K. t. este caz special puncte faza de tranzitieși se caracterizează printr-o pierdere a stabilității termodinamice în ceea ce privește densitatea sau compoziția substanței. Pe o parte a C. t., substanța este omogenă (de obicei la T > Tk), iar pe de altă parte, se separă în faze. Pentru amestecuri sau soluții, ar trebui să se facă distincția între temperatura de echilibru a lichidului ≈ vapori și temperatura de echilibru a fazelor compoziție diferită situat într-una starea de agregare(lichid ≈ lichid, gaz ≈ gaz). În acest sens, amestecurile (soluțiile) K. t. se caracterizează suplimentar printr-o concentrație critică de cc. Ca urmare a creșterii numărului de parametri care determină starea sistemului, amestecurile nu au o temperatură critică, ci o curbă critică, ale cărei puncte diferă în valorile Tk, pk, Vk și xk. În vecinătatea lui K, m se observă fenomene critice. Parametrii punctului critic lichid ≈ vapori ai unor substanțe
Substanţă
Oxigen
dioxid de carbon
etanol)
* 1 amm = 1,01×105 n/m2.
Wikipedia
Punct critic
Punct critic- termen ambiguu:
- Un punct critic este un punct în care derivata este fie zero, fie nedefinită.
- Punctul critic este temperatura la care cele două faze sunt în echilibru.
- „Punctul critic” - Program de jurnalism de investigație pe postul TV Ucraina
Punct critic (termodinamică)
Temperatura de tranziție a fazei critice este valoarea temperaturii în punctul critic. Peste temperatura critică, gazul nu poate fi condensat la nicio presiune.
Punct critic (matematică)
punct critic funcția diferențiabilă $f:D\to\R$, unde D- aria în $\R^n$, este punctul în care toate derivatele sale parțiale dispar. Această condiție este echivalentă cu dispariția diferențială a funcției într-un punct dat și este, de asemenea, echivalentă cu orizontalitatea hiperplanului tangentei la graficul funcției. Această condiție este necesară pentru ca un punct interior al regiunii să fie un punct de minim sau maxim local al unei funcții diferențiabile.
Se numește valoarea funcției în punctul critic critic. Conform lemei lui Sard, setul de valori critice ale oricărei funcții C-netede $f: \to\R$ are măsura Lebesgue zero (deși pot exista tot atâtea puncte critice în acest caz, de exemplu, pentru funcția f = const orice punct este critic).
Noțiunea de punct critic poate fi generalizată în cazul mapărilor diferențiabile $f:\R^n\to\R^m$ și în cazul mapărilor diferențiabile ale varietăților arbitrare f : N → M. În acest caz, definiția unui punct critic este că rangul matricei jacobiene a mapării fîn ea este mai mică decât maximul (egal cu numărul min( n, m}).
Punctele critice ale funcțiilor și mapărilor joacă un rol important în domenii ale matematicii, cum ar fi ecuațiile diferențiale, calculul variațiilor, teoria stabilității, precum și în mecanică și fizică. Studiul punctelor critice ale mapărilor netede este una dintre principalele întrebări ale teoriei catastrofelor.
Noțiunea de punct critic este generalizată și în cazul funcționalelor definite pe spații funcționale infinit-dimensionale. Căutarea punctelor critice ale unor astfel de funcționale este o parte importantă a calculului variațiilor. Punctele critice ale funcționalelor sunt numite extremale.
Curba de echilibru de fază (în planul P, T) se poate termina la un moment dat (Fig. 16); un astfel de punct se numește critic, iar temperatura și presiunea corespunzătoare acestuia se numesc temperatură critică și presiune critică. La temperaturi mai mari și presiuni mai mari, nu există faze diferite, iar corpul este întotdeauna omogen.
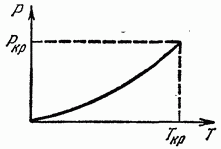
Se poate spune că în punctul critic diferența dintre cele două faze dispare. Conceptul de punct critic a fost introdus pentru prima dată de D. I. Mendeleev (1860).
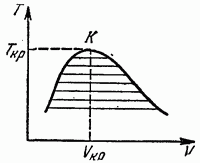
În coordonatele T, V, diagrama de echilibru în prezența unui punct critic arată așa cum este prezentată în Fig. 17. Pe măsură ce temperatura se apropie de valoarea sa critică, volumele specifice ale fazelor care sunt în echilibru între ele se apropie și în punctul critic (K în Fig. 17) coincid. O diagramă în coordonatele Р, V are o formă similară.
În prezența unui punct critic între oricare două stări ale materiei, se poate face o tranziție continuă, în care în niciun moment nu are loc separarea în două faze - pentru aceasta, starea trebuie să se schimbe de-a lungul unei curbe care învăluie punctul critic și nu nu intersectează curba de echilibru nicăieri. În acest sens, în prezența unui punct critic, însuși conceptul de diferite faze devine condiționat și este imposibil în toate cazurile de a indica care stări sunt o fază și care sunt alta. Strict vorbind, se poate vorbi de două faze numai atunci când ambele există simultan, atingându-se, adică în puncte situate pe curba de echilibru.
Este clar că un punct critic poate exista doar pentru astfel de faze, diferența dintre care are doar un caracter pur cantitativ. Acestea sunt lichidul și gazul, care diferă unul de celălalt doar într-un rol mai mare sau mai mic de interacțiune între molecule.
Aceleași faze ca lichid și solid(cristalul) sau diferitele modificări cristaline ale unei substanțe sunt diferite calitativ unele de altele, deoarece diferă prin simetria lor internă. Este clar că orice proprietate (element) de simetrie se poate spune doar fie că există, fie că nu există; poate apărea sau dispărea doar odată, brusc, și nu treptat. În fiecare stare, corpul va avea fie una, fie cealaltă simetrie și, prin urmare, este întotdeauna posibil să se indice căreia dintre cele două faze îi aparține. Un punct critic, prin urmare, nu poate exista pentru astfel de faze, iar curba de echilibru trebuie fie să meargă la infinit, fie să se termine, intersectându-se cu curbele de echilibru ale altor faze.
Punctul obișnuit de tranziție de fază nu reprezintă matematic o singularitate pentru mărimile termodinamice ale unei substanțe. Într-adevăr, fiecare dintre faze poate exista (cel puțin ca una metastabilă) de cealaltă parte a punctului de tranziție; inegalitățile termodinamice nu sunt încălcate în acest moment. În punctul de tranziție potenţiale chimice ambele faze sunt egale între ele: ; pentru fiecare dintre funcții, acest punct nu este remarcabil.
Să descriem în planul P, V orice izotermă de lichid și gaz, adică curba dependenței lui P de V în timpul expansiunii izoterme a unui corp omogen din fig. optsprezece). Conform inegalității termodinamice, există o funcție descrescătoare V. O astfel de pantă a izotermelor trebuie să persistă și pe o anumită distanță dincolo de punctele de intersecție a acestora cu curba de echilibru a lichidului și gazului (punctele b și secțiunile izotermelor corespund metastabilei). lichid supraîncălzitși aburul suprarăcit, în care se observă încă inegalitățile termodinamice (schimbarea de stare izotermă complet echilibrată între punctele b nu corespunde, desigur, unui segment orizontal pe care are loc separarea în două faze).
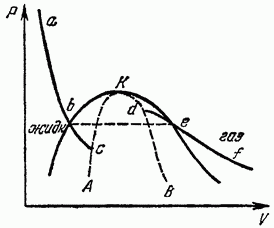
Dacă luăm în considerare că punctele au aceeași ordonată P, atunci este clar că ambele părți ale izotermei nu pot intra una în alta într-un mod continuu și trebuie să existe un decalaj între ele. Izotermele se termină în punctele (c și d) la care inegalitatea termodinamică este încălcată, i.e.
După ce am construit locusul punctelor finale ale izotermelor lichid și gaz, obținem curba AKB, pe care sunt încălcate inegalitățile termodinamice (pentru un corp omogen); limitează regiunea în care corpul sub nicio formă nu poate exista la fel de omogen. Regiunile dintre această curbă și curba de echilibru de fază corespund lichidului supraîncălzit și vaporilor suprarăciți. Evident, în punctul critic, ambele curbe trebuie să se atingă. Dintre punctele aflate pe curba AKB însăși, doar punctul critic K corespunde stărilor efectiv existente ale unui corp omogen - singurul la care această curbă intră în contact cu regiunea stărilor omogene stabile.
Spre deosebire de punctele obișnuite de echilibru de fază, punctul critic este matematic un punct singular pentru funcțiile termodinamice ale materiei (același lucru este valabil și pentru întreaga curbă AQW, care limitează regiunea de existență a stărilor omogene ale corpului). Natura acestei singularități și comportamentul materiei în apropierea punctului critic vor fi luate în considerare în § 153.






