Punctele de topire și, respectiv, de fierbere ale apei sunt egale. Căldura specifică latentă de fuziune a unui solid
1. PROPRIETĂȚI ȘI STRUCTURA APEI
1.1. Anomalie a proprietăților apei
Abia la sfârșitul secolului al XVIII-lea și începutul secolului al XIX-lea. a devenit conștient de ceea ce constituie o substanță numită apă. Experimentele lui G. Cavendish, A. Lavoisier, A. Humboldt, J.L. Gay-Lussac a demonstrat că apa se formează din două volume de hidrogen și un volum de oxigen, adică. are o formulă chimică H 2 Oși greutatea moleculară 18. Treptat, însă, a devenit clar că în aproape toți parametrii fizico-chimici această substanță este unică, foarte diferită de alți compuși naturali.
Punctele de topire și de fierbere ale apei
Acestea se bazează pe sistemele de referință de temperatură acceptate.
Selectarea apei pentru a crea scale de temperatură.
Celsius(1701-44). Scara Celsius -1741 Punctele de fierbere și de topire ale apei la presiune atmosferică egal cu 100 o C și respectiv 0 o C,
Réaumur(1683-1757). Scara Réaumur din 1730. Punctul de fierbere al apei este luat ca 80 o (1 o C \u003d 5/4 o R).
Fahrenheit(1686-1736). Punctul de topire al gheții este de 32 o F, punctul de fierbere al apei este de 180 o F (t o C \u003d 5/9 t o F - 32).
Descoperirea legii periodiceD.I. Mendeleev (1869). Discrepanța dintre parametrii fizici ai apei și legea periodică.
Discrepanța cu legea periodică poate fi observată dintr-o comparație a punctelor de fierbere și de topire ale compușilor cu hidrogen ai elementelor grupului de oxigen. Datele pentru H 2 Se sunt preluate din grafic. Pentru apă, se poate observa că în conformitate cu legea periodică, punctul de topire al apei ar fi de aproximativ minus 90 o, iar punctul de fierbere ar fi de aproximativ -70 o. Apa în condiții „normale” ar fi un gaz toxic, urât mirositor. Viața pe Pământ ar fi imposibilă.
Datorită acestor proprietăți „anomale”, apa protejează viața și reglează regimul termic și gazos al planetei noastre.
Capacitatea termică a apei
Capacitatea termică specifică a apei este cea mai mare dintre toate lichidele. Și aici apa este luată ca standard: pentru a încălzi 1 g de apă cu 1 o C pentru a cheltui 1 calorie de energie termică (calor - căldură, lat.). Pentru comparație: gips - 0,27, argilă uscată 0,22 cal. (1 cal = 4,187 J.). Capacitatea termică specifică a gheții și aburului este la jumătate - 0,5 cal/g. deg. Căldura latentă de topire și vaporizare a apei sunt, de asemenea, neobișnuit de mari - 79 și 539 cal. Astfel, pentru a transforma 1 g de gheață cu o temperatură de 0 ° C în abur, trebuie să cheltuiți 79 + 100 + 539 = 718 calorii de căldură. Datorită unei capacități termice atât de ridicate, apa este principalul regulator al regimului termic de pe planeta noastră. Influența Oceanului Mondial afectează aproape toate punctele Pământului, chiar și cele mai îndepărtate de coasta mării, caracterizate prin așa-numita climă continentală. Corpurile mari de apă și, mai ales, Oceanul Mondial, sunt regulatorii regimului termic al Pământului. Pentru stratul de sol, randamentul anual de căldură este de 1,5-3 kcal / cm 2, pentru, de exemplu, Marea Baltică și Marea Neagră 48-52. În absența rezervoarelor, temperatura ar crește vara, iar iarna ar scădea cu câteva sute de grade și viața pe pământ ar fiimposibil; dimpotrivă, dacă Pământul ar fi acoperit complet de ocean, amplitudinea anuală a aerului s-ar schimba de la 0 la ecuator la 5-6 o C la poli. Influența oceanului se extinde la întreaga planetă, inclusiv la polii reci din Antarctica.
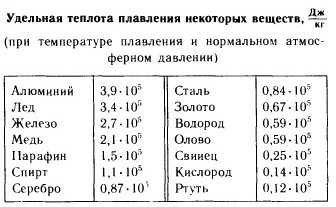
Capacitatea ridicată de căldură a apei este asociată cu indicatori precum căldură latentă de fuziune, componenta 333,7 10 3 J/kg, și căldura latentă de vaporizare, componenta 2258,10 3 J/kg, i.e. Este nevoie de o cantitate imensă de energie pentru a transforma 1 kg de gheață în lichid și 1 kg de apă lichidă în abur. Aceasta mărturisește intensitatea energetică ridicată a apei, care predetermina rolul său exclusiv de acumulator de energie în cursul proceselor naturale.
Constantă dielectrică apă ( )
Valoare constantă dielectrică căci apa este cea mai mare dintre toate lichidele și este egală cu 80,1 la o temperatură de 20 o C. la o temperatură de aproximativ 0 o C este de aproximativ 82. Aceasta înseamnă că atunci când sărurile sunt dizolvate în apă, puterea interacțiunii electrice dintre particulele încărcate opus scade de 80 de ori, determinând disocierea sărurilor în ioni. Majoritatea solvenților nu au mai mult de 50, lichidele nepolare (benzină, kerosen) nu mai mult de 3. Această proprietate a apei predetermină fenomenul disociere electrolitică, adică capacitatea sărurilor, acizilor, alcalinelor de a se descompune în soluții apoase în ioni încărcați opus. Apa este inertă ca solvent. Aduce nutrienți organismelor vii și elimină toxinele și nu există nimic care să-l înlocuiască. Acea. și fără această proprietate a apei viața pe pământ ar fiimposibil.
Apa dizolvă mineralele, dar ele renasc dacă apa este evaporată. Această trăsătură are o semnificație geologică și biologică colosală, predeterminand ciclurile apei de diferite ordine, care au loc în câteva ore (la organismele vii) și durează multe milioane de ani în intestinele Pământului (geologice). Aparent, apariția vieții pe Pământ se datorează în mare măsură acestei proprietăți uimitoare a apei.
Densitatea apei .
Toate substanțele au o densitate maximă la punctul lor de topire, cu excepția apei. Densitatea maximă a apei(1,0 g/cm3) corespunde t-re 3,98 o; densitatea gheții 0,918 g/cm3; numai apa nu se scufundă în propria topitură; Thales din Milet a atras atenția asupra acestui lucru. Când apa îngheață, se formează o crustă de gheață protectoare subțire, care asigură conservarea corpurilor de apă, în primul rând Oceanul Mondial, principalul regulator al regimului aerian al planetei. Și fără această proprietate a apei viața ar lua o cu totul altă formă.
1.2. Idei despre structura ascunsă a apei
Structura apei. Anii treizeci ai secolului XX au adus o nouă descoperire majoră legată de studiul apei: fizicienii englezi J. Bernal și R. Fowler, pe baza studiilor cu raze X și spectroscopice, au stabilit că moleculele de apă sunt ordonate într-un anumit fel , fiecare moleculă de apă este înconjurată de alte patru într-un tetraedru. Astfel, afirmația făcută la sfârșitul secolului al XVIII-lea a fost confirmată. V. Roentgen s-a gândit la structura complexă a apei lichide și la existența unor legături suplimentare între moleculele individuale. Oamenii de știință numesc acest fenomen structura apei, deși este clar că este imposibil să-l identificăm complet cu rețeaua cristalină a solidelor, deoarece apa lichidă este un amestec de molecule monomerice și polimerice, legăturile dintre monomerii individuali sunt dinamice: apar în mod constant, se descompun, se întăresc, se slăbesc.
Principalul motiv pentru existența structurii apei este un tip special de legătură între atomi individuali - hidrogen. Această legătură este de natură electrostatică, dar este mai slabă decât în mod normal. legătura de valențăîntre atomii de hidrogen și oxigen formând monomeri individuali. În fiecare monomer H2O, distanța dintre atomii de hidrogen și oxigen este de 0,1 nm, iar unghiul format între legăturile de valență este de aproximativ 105º. Într-o legătură de hidrogen, distanța dintre atomi crește la 0,176 nm și nu este strict constantă.
Există mai multe modele ale structurii apei bazate pe ideea de a conecta monomeri individuali prin legături de hidrogen. J. Bernal și R. Fowler au sugerat existența a trei tipuri de aranjament molecular: a) structuri care se apropie de rețeaua cristalină a gheții există la temperaturi de la 0 la 4ºС; b) structuri precum cuarțul, predomină la o temperatură de 4-200ºС; c) structuri compacte tipice lichidelor normale (aproape lipsite de legături de hidrogen) apar la temperaturi peste 200 ºС [Blokh A.M. Structura apei și proceselor geologice.L., 1969, p.216].
O abordare interesantă a interpretării caracteristicilor structurale ale apei a fost propusă de fizicianul italian M. Angeno (1967). Conform ideilor sale, fiecare moleculă de apă poate participa la cel mult două, dar așa-numitele legături colective de hidrogen, în urma cărora combinația de valență și legături de hidrogen formează legături. tipuri diferite(Fig. 1).
Orez. 1. Agregate moleculare în apă lichidă (după M. Ajendo).
Aceste legături pot forma lanțuri, inele și sisteme mai complexe care se formează continuu, sunt distruse și schimbă molecule. în care numărul total punțile de hidrogen din sistem rămân constante și posibilele tipuri de agregate sunt prezente în apă în proporții diferite într-un echilibru static determinat de temperatură. Inele de șase molecule par să se apropie de structura gheții.
Din punct de vedere al structurii structurale a apei lichide, toate acestea proprietăți anormale. Necesitatea distrugerii legăturilor de hidrogen predetermină intensitatea energetică mare a apei, în urma căreia punctele de topire și de fierbere, capacitatea de căldură și căldura latentă de topire și vaporizare devin anormal de ridicate. Când apa este răcită în intervalul de temperatură de la 4 la 0ºС, structura este restructurată de la un strat de gheață mai dens tetragonal la hexagonal. Legătura puternică dintre moleculele de apă o face inertă față de substanțe dizolvate. Întrucât structura apei este formată din legături electrostatice, aceasta este afectată de diverse câmpuri (temperatură, geodinamică, magnetică, electrică).
Pe măsură ce temperatura crește, structura apei începe să se destrame. Estimările diferiților autori, care calculează procentul de molecule cu legături de hidrogen păstrate, sunt apropiate: aproximativ jumătate din molecule sunt structurate în apă rece, la atingerea temperaturii de 100ºС, legăturile structurale sunt reținute în aproximativ 30% din molecule, iar când se apropie temperatura critică (374 ºС), moleculele structurate dispar.
Când se aplică presiune, moleculele de lichide se apropie unele de altele și vâscozitatea lor crește. Apa se comportă destul de diferit. Primele etape de încărcare duc la o restructurare a structurii apei, umplerea golurilor intermoleculare, însoțită de o scădere a vâscozității acesteia și abia pornind de la presiuni de aproximativ 100 MPa (suficient de mare pentru condițiile naturale) începe o creștere treptată a vâscozității.
1.3. Soiuri de apă
Proprietățile structurale ale apei și existența mai multor izotopi ai oxigenului și hidrogenului sunt motivul pentru care apa poate forma multe specii fizico-chimice. Iată câteva dintre ele.
Idei despre apa activata
Experimentele oamenilor de știință de la Novosibirsk (F.A. Letnikov și alții) privind tratarea apei în autoclave la temperaturi de 300-400 ºС și presiuni de până la 100 MPa au arătat că acest lucru crește puterea de dizolvare a apei pentru multe minerale (la sulfuri, gips, cuarț), pH-ul scade, conductivitatea electrică crește. Influența temperaturii și presiunii asupra modificării structurilor apei a condus experții la ideea posibilității de a simula proprietățile apei situate la adâncimi mari (adică la temperaturi și presiuni ridicate) și a condus la descoperirea numit apă activată . După tratarea apei în autoclave Detectarea unei stări activate în apa izvoarelor minerale termale sugerează că proprietățile curative ale unor tipuri de ape minerale pot fi asociate nu numai cu compoziția lor chimică, ci și cu o creștere a activității biologice a apei. în timpul activării acestuia. Descoperirea fenomenului de activare nu numai că face posibilă explicarea unor proprietăți ale soluțiilor hidrotermale, dar deschide și perspective pentru prepararea artificială a apelor minerale.
Influența câmpului electric
Când se pune apă câmp electric pot apărea anumite modificări în structura sa. Deci, curentul electric slăbește legăturile structurale, iar după tratarea apei cu curent electric alternativ, viteza de evaporare crește, conform puținelor date disponibile, cu 11-18%. S-a remarcat influența câmpurilor electrice asupra intensității absorbției razelor de lumină de către apă.
Influența câmpului magnetic
Impactul pozitiv asupra corpului de apă uman care a fost în camp magnetic, a fost observată în Evul Mediu. În 1945, inginerul belgian T. Vermayern a brevetat o modalitate simplă de reducere a intensității formării depunerilor în cazanele cu abur folosind tratarea preliminară a apei magnetice. În prezent, această metodă de a trata scara este foarte utilizată. Este suficient să ne referim la experiența multor centrale termice (Rostovskaya, Astrakhanskaya etc.), a centralelor electrice districtuale de stat (Simferopolskaya, Saratovskaya), a fabricilor, minelor și a altor întreprinderi.
Când se înmoaie semințele multor culturi agricole, flori și fructe cu apă magnetizată, germinarea lor crește dramatic. În prezent, industria autohtonă produce chiar și dispozitive speciale pentru magnetizarea apei, recomandate întreprinderilor agricole și grădinarilor.
Apă- II . La începutul anilor 60 ai secolului XX. N.N. Fedyakin a descoperit un fenomen extrem de interesant: atunci când vaporii de apă se condensează în capilare subțiri de cuarț (5-20 microni în diametru), se formează un lichid, care diferă semnificativ de apa obișnuită în proprietăți. Mai târziu, acest lichid, numit apă-II, a fost studiat de mari cercetători ruși și străini, în special de o echipă mare de oameni de știință condusă de B.V. Deryagin. Sa constatat că apa-II este un lichid vâscos cu o densitate de aproximativ 1 g/cm3 și un indice de refracție de 1,49 (față de 1,33 pentru apa obișnuită). Acest lichid trece în stare solidă la răcire la minus 35÷40 ºС fără salt de volum. Punctul de fierbere al apei-II la presiunea atmosferică este de aproximativ 250 ºС. Water-II are un spectru unic de absorbție în infraroșu care nu corespunde cu niciunul dintre substanțe cunoscute. Starea modificată a substanței obținute este stabilă și se păstrează în timpul distilării (această procedură a fost folosită pentru a îngroșa porțiuni de apă-II). S-a dovedit că substanţa nou obţinută corespunde strict cu formula H2O; cuarțul, aparent, joacă rolul unui catalizator în sinteza apei-II.
Studiul apei-II a condus B.V. Deryagin și colaboratorii săi au concluzionat că ar putea exista un tip special de legătură moleculară puternică între hidrogen și oxigen, formând polimeri constând din 6–10 molecule monomerice de H2O. Este încă dificil de determinat rolul apei-II în sistemele naturale, dar este clar că studiul său promite anumite perspective în studiul proceselor geologice profunde.
Apa grea. În prezent, sunt cunoscuți trei izotopi de hidrogen (1 H-protiu, 2 H-deuteriu D, 3 H-tritiu T) și trei izotopi de oxigen (16 O, 17 O, 18 O). Aceasta înseamnă că poate exista un număr semnificativ de soiuri de apă cu diferite combinații de izotopi. Cea mai stabilă dintre ele este așa-numita apă grea D 2 O, conținută ca impuritate în apa obișnuită în sutimi de procent. După proprietățile sale, apa grea diferă semnificativ de apa obișnuită: densitatea maximă se observă la t=11,2 ºС și este de 1,056 g/cm 3 ; vâscozitatea este cu 20% mai mare; constanta dielectrică este cu 0,3-0,5% mai mică. Punctul de topire al apei grele este de 3,8 ºС; punctul de fierbere 101,4 ºС. Judecând după datele date și după o serie de alte date, legătura de deuteriu este chiar mai puternică decât legătura de hidrogen.Apa grea este folosită ca moderator de neutroni în reactoarele nucleare. Apa grea este toxică, ființele vii și plantele mor în ea. Unii oameni de știință asociază evoluția vieții pe planeta noastră cu modificări ale concentrației de deuteriu în apă: în special, concentrația mai mică de deuteriu în apă în comparație cu concentrația modernă de deuteriu în apă explică existența ierbivorelor gigantice în Mezozoic. Cu toate acestea, aceste prevederi sunt controversate.
Exemplele date aici ale varietăților de apă, predeterminate de structura sa complexă și izotopia, arată cât de inepuizabile sunt perspectivele apariției unor noi descoperiri în studiul unei substanțe atât de uimitoare precum apa.
ESEU
„Corpi care se topesc”
Efectuat:
Prisyazhnyuk Olga 9-A
Verificat:
Nevzorova Tatyana Igorevna
Introducere
Calculul cantității de căldură
Topire
Căldura specifică de fuziune
Topirea metalelor
Punctul de topire și de fierbere al apei
se topește
Interesant despre topire
Concluzie (concluzii)
Lista literaturii folosite
Introducere
Stare agregată - o stare a materiei caracterizată prin anumite proprietăți calitative: capacitatea sau incapacitatea de a menține volumul și forma, prezența sau absența ordinii pe distanță lungă și scurtă și altele. O schimbare a stării de agregare poate fi însoțită de o schimbare asemănătoare unui salt în energia liberă, entropia, densitatea și alte proprietăți fizice de bază.
Există trei stări principale de agregare: solid, lichid și gazos. Uneori nu este chiar corect să clasificăm plasma ca stare de agregare. Există și alte stări de agregare, de exemplu, cristalele lichide sau condensatul Bose-Einstein.
Modificările stării de agregare sunt procese termodinamice numite tranziții de fază. Se disting următoarele soiuri: de la solid la lichid - topire; de la lichid la gazos - evaporare și fierbere; de la solid la gazos - sublimare; de la gazos la lichid sau solid - condensare. O caracteristică distinctivă este absența unei granițe clare a tranziției la starea de plasmă.
Pentru a descrie diferite stări din fizică, se folosește un concept mai larg de fază termodinamică. Fenomenele care descriu tranzițiile de la o fază la alta sunt numite fenomene critice.
Solid: O stare caracterizată prin capacitatea de a menține volumul și forma. Atomii unui corp solid produc doar mici vibrații în jurul stării de echilibru. Există atât ordine pe rază lungă, cât și pe rază scurtă.
Lichid: starea unei substanțe în care are compresibilitate scăzută, adică își păstrează bine volumul, dar nu își poate păstra forma. Lichidul ia cu ușurință forma vasului în care este plasat. Atomii sau moleculele unui lichid vibrează în apropierea stării de echilibru, blocate de alți atomi și sar adesea în alte locuri libere. Există doar o comandă pe distanță scurtă.
Gaz: O stare caracterizată printr-o compresibilitate bună, lipsită de capacitatea de a păstra atât volumul, cât și forma. Gazul tinde să ocupe întregul volum furnizat acestuia. Atomii sau moleculele unui gaz se comportă relativ liber, distanțele dintre ei sunt mult mai mari decât dimensiunea lor.
Alte stări: La răcirea profundă, unele substanțe (de departe nu toate) trec într-o stare supraconductoare sau superfluid. Aceste stări, desigur, sunt faze termodinamice separate, dar cu greu merită să fie numite noi stări agregate ale materiei din cauza neuniversalității lor. Substanțele neomogene, cum ar fi pastele, gelurile, suspensiile, aerosolii etc., care în anumite condiții demonstrează proprietățile atât ale solidelor, cât și ale lichidelor și chiar ale gazelor, sunt de obicei clasificate ca materiale dispersate și nu în anumite stări agregate specifice ale materiei.
Topire
Orez. 1. Starea materiei pure (diagrama)

Orez. 2. Temperatura de topire a unui corp cristalin

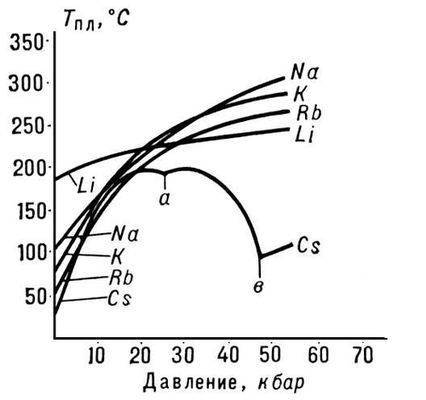
Orez. 3. Punctul de topire al metalelor alcaline
Topirea - trecerea unei substanțe de la o stare cristalină (solidă) la o stare lichidă; are loc cu absorbția căldurii (tranziție de fază de ordinul întâi). Principalele caracteristici ale P. substanțelor pure sunt punctul de topire (Tmelt) și căldura care este necesară implementării procesului P. (căldura de topire Qmelt).
Temperatura lui P. depinde de presiunea exterioară p; pe diagrama de stare a unei substanțe pure, această dependență este reprezentată de curba de topire (curba de coexistență a fazelor solide și lichide, AD sau AD „în Fig. 1). Topirea aliajelor și a soluțiilor solide are loc, de regulă , în domeniul de temperatură (cu excepția eutecticilor cu Ttopire constantă) Dependența temperaturii începutului și sfârșitului P. a unui aliaj de compoziția sa la o presiune dată este reprezentată pe diagramele de stare prin linii speciale (liquidus). iar curbele solidus, vezi Sisteme binare).de la o stare solidă cristalină la un lichid izotrop are loc în etape (într-un anumit interval de temperatură), fiecare etapă caracterizează o anumită etapă în distrugerea structurii cristaline.
Prezenţa unei anumite temperaturi P. este un semn important al structurii cristaline corecte a solidelor. Pe această bază, ele sunt ușor de distins de solidele amorfe, care nu au un Tm fix. Solidele amorfe trec treptat în stare lichidă, înmuiindu-se odată cu creșterea temperaturii (vezi Starea amorfa). Tungstenul are cea mai ridicată temperatură dintre metalele pure (3410°C), iar mercurul are cea mai scăzută temperatură (-38,9°C). Compușii refractari în special includ: TiN (3200 °C), HfN (3580 °C), ZrC (3805 °C), TaC (4070 °C), HfC (4160 °C), etc. De regulă, pentru substanțe cu nivel ridicat Tm se caracterizează prin valori mai mari ale Qm. Impuritățile prezente în substanțele cristaline le reduc Tm. Acest lucru este folosit în practică pentru a obține aliaje cu Tmelt scăzut (vezi, de exemplu, aliajul de lemn cu Tmelt = 68 °C) și amestecuri de răcire.
P. începe când substanţa cristalină ajunge la Tpl. De la începutul lui P. până la finalizarea lui, temperatura substanței rămâne constantă și egală cu Tmelt, în ciuda transferului de căldură către substanță (fig. 2). În condiții normale, nu este posibilă încălzirea unui cristal la T > Ttopit (vezi Supraîncălzire), în timp ce în timpul cristalizării este relativ ușor să se obțină o suprarăcire semnificativă a topiturii.
Natura dependenței lui Tm de presiunea p este determinată de direcția modificărilor volumetrice (DVm) la P. (vezi ecuația Clapeyron-Clausius). În cele mai multe cazuri, P. unei substanțe este însoțită de o creștere a volumului acestora (de obicei cu câteva procente). Dacă acesta este cazul, atunci o creștere a presiunii duce la o creștere a Tm (Fig. 3). Totuşi, în unele substanţe (apă, un număr de metale şi metalide, vezi fig. 1), în timpul P. se produce o scădere a volumului. Temperatura lui P. a acestor substanţe scade odată cu creşterea presiunii.
P. este însoțită de o modificare a proprietăților fizice ale substanței: o creștere a entropiei, care reflectă dezordinea structurii cristaline a substanței; o creștere a capacității termice, a rezistenței electrice [cu excepția unor semimetale (Bi, Sb) și semiconductori (Ge), care au o conductivitate electrică mai mare în stare lichidă]. În timpul P., rezistența la forfecare scade la aproape zero (undele elastice transversale nu se pot propaga în topitură, vezi Lichid), viteza de propagare a sunetului (unde longitudinale), etc., scade.
Conform reprezentărilor moleculare și cinetice, P. se realizează astfel. Când căldura este aplicată unui corp cristalin, energia vibrațiilor (amplitudinea oscilației) atomilor săi crește, ceea ce duce la creșterea temperaturii corpului și contribuie la formarea diferitelor tipuri de defecte în cristal (nodurile neumplute ale rețelei cristaline). - locuri libere; încălcări ale periodicității rețelei de către atomii încorporați între nodurile sale etc., vezi Defecte în cristale). În cristalele moleculare, poate apărea dezordonarea parțială a orientării reciproce a axelor moleculelor dacă moleculele nu au formă sferică. O creștere treptată a numărului de defecte și asocierea lor caracterizează etapa de pretopire. Când se atinge Ttopirea, se creează o concentrație critică de defecte în cristal și începe cristalizarea; rețeaua cristalină se rupe în regiuni submicroscopice ușor mobile. Căldura furnizată în timpul P. este folosită nu pentru a încălzi corpul, ci pentru a rupe legăturile interatomice și a distruge ordinea pe distanță lungă în cristale (vezi Ordinea pe distanță lungă și ordinea pe rază scurtă). Pe de altă parte, în regiunile submicroscopice înseși, ordinea pe distanță scurtă în aranjarea atomilor nu se modifică semnificativ în timpul cristalizării (numărul de coordonare al unei topituri la Tm în cele mai multe cazuri rămâne același cu cel al unui cristal). Aceasta explică valorile mai mici ale căldurilor de fuziune Qm în comparație cu căldurile de vaporizare și modificarea relativ mică a unui număr de proprietăți fizice ale substanțelor în timpul P lor.
Procesul de piroliză joacă un rol important în natură (piroliza zăpezii și gheții de pe suprafața pământului, mineralizarea mineralelor în adâncimea ei și așa mai departe) și în tehnologie (producția de metale și aliaje, turnarea matriței etc.) .
Căldura specifică de fuziune
Căldura specifică de fuziune (de asemenea: entalpia de fuziune; există și un concept echivalent de căldură specifică de cristalizare) - cantitatea de căldură care trebuie transmisă unei unități de masă a unei substanțe cristaline într-un proces izobar-izotermic de echilibru pentru pentru a-l transfera dintr-o stare solidă (cristalină) într-un lichid (aceeași cantitate de căldură eliberată în timpul cristalizării unei substanțe). Căldura de fuziune este un caz special al căldurii unei tranziții de fază de ordinul întâi. Distingeți căldura specifică de fuziune (J/kg) și molară (J/mol).
Căldura specifică de fuziune este indicată de litera (litera greacă lambda) Formula de calcul căldura specifică punct de topire:
unde este căldura specifică de fuziune, este cantitatea de căldură primită de substanță în timpul topirii (sau eliberată în timpul cristalizării), este masa substanței care se topește (cristalizează).
Topirea metalelor
La topirea metalelor, trebuie respectate anumite reguli. Să presupunem că vor topi plumbul și zincul. Plumbul se va topi rapid, având un punct de topire de 327°; zincul, pe de altă parte, va rămâne solid pentru o lungă perioadă de timp, deoarece punctul său de topire este peste 419 °. Ce se va întâmpla cu o astfel de supraîncălzire? Va începe să fie acoperit cu o peliculă de culoare irizată, iar apoi suprafața sa va fi ascunsă sub un strat de pulbere care nu se topește. Plumbul ars din supraîncălzire, oxidat prin combinarea cu oxigenul din aer. După cum știți, acest proces are loc la temperatura obișnuită, dar atunci când este încălzit, merge mult mai repede. Astfel, în momentul în care zincul începe să se topească, va rămâne foarte puțin plumb metalic. Aliajul se va dovedi a avea o compoziție complet diferită, așa cum era de așteptat, și o cantitate mare de plumb se va pierde sub formă de deșeuri. Este clar că trebuie mai întâi să topim zincul mai refractar și apoi să punem plumb în el. Același lucru se va întâmpla dacă zincul este aliat cu cupru sau alamă, mai întâi încălzind zincul. Zincul va arde în momentul în care cuprul se topește. Aceasta înseamnă că trebuie întotdeauna să topești mai întâi metalul cu un punct de topire mai mare.
Dar acesta nu poate evita frenezia. Dacă un aliaj încălzit corespunzător este ținut pe foc pentru o lungă perioadă de timp, se formează din nou o peliculă pe suprafața metalului lichid ca urmare a fumului. Este clar că metalul mai fuzibil se va transforma din nou în oxid și compoziția dopului se va schimba; Aceasta înseamnă că metalul nu poate fi supraîncălzit mult timp în mod inutil. Prin urmare, ei încearcă în toate modurile posibile să reducă deșeurile de metal, așezându-l într-o masă compactă; bucăți mici, rumeguș, așchii sunt mai întâi „ambalate”, bucăți mai mult sau mai puțin de aceeași dimensiune sunt topite, sunt încălzite la o temperatură suficientă, iar suprafața metalică este protejată de contactul cu aerul. În acest scop, maestrul poate lua un borax sau poate acoperi pur și simplu suprafața metalului cu un strat de cenușă, care va pluti întotdeauna deasupra (datorită greutății sale specifice mai mici) și nu va interfera la turnarea metalului. Când metalul se solidifică, are loc un alt fenomen, probabil familiar și tinerilor meșteri. Metalul, solidificându-se, scade în volum, iar această scădere se produce datorită particulelor de metal interne, încă nesolidificate. Pe suprafața turnării sau în interiorul acesteia se formează o depresiune mai mult sau mai puțin semnificativă în formă de pâlnie, așa-numita cavitate de contracție. De obicei, matrița este realizată în așa fel încât să se formeze găuri de contracție în acele locuri ale turnării, care sunt ulterior îndepărtate, încercând să protejeze produsul în sine cât mai mult posibil. Este clar că găurile de contracție strică turnarea și uneori o pot face inutilizabilă. După topire, metalul este ușor supraîncălzit, astfel încât să fie mai subțire și mai fierbinte și, prin urmare, umple mai bine detaliile matriței și nu îngheață prematur din contactul cu o matriță mai rece.
Deoarece punctul de topire al aliajelor este de obicei mai mic decât punctul de topire al celor mai refractare dintre metalele constitutive ale aliajului, uneori este benefic să faceți opusul: mai întâi topiți metalul mai fuzibil și apoi cel mai refractar. Cu toate acestea, acest lucru este permis numai pentru metalele care nu sunt puternic oxidate sau cu condiția ca aceste metale să fie protejate de oxidarea excesivă. Este necesar să se ia mai mult metal decât este necesar pentru lucrul în sine, astfel încât să umple nu numai matrița, ci și canalul de colectare. Este clar că mai întâi trebuie să calculați cantitatea necesară de metal.
Punctul de topire și de fierbere al apei
Cea mai surprinzătoare și mai fericită proprietate a apei pentru natura vie este capacitatea sa de a fi lichid în condiții „normale”. Moleculele de compuși foarte asemănătoare cu apa (de exemplu, moleculele H2S sau H2Se) sunt mult mai grele, dar formează un gaz în aceleași condiții. Astfel, apa pare să contrazică regularitățile tabelului periodic, care, după cum știți, prezice când, unde și ce proprietăți ale substanțelor vor fi apropiate. În cazul nostru, din tabel rezultă că proprietățile compușilor cu hidrogen ai elementelor (numiți hidruri) localizați în aceleași coloane verticale ar trebui să se modifice monoton odată cu creșterea masei atomilor. Oxigenul este un element din grupa a șasea din acest tabel. În aceeași grupă se află sulful S (cu o greutate atomică de 32), seleniul Se (cu o greutate atomică de 79), telurul Te (cu o greutate atomică de 128) și poloniu Po (cu o greutate atomică de 209). În consecință, proprietățile hidrurilor acestor elemente ar trebui să se schimbe monoton la trecerea de la elemente grele la elemente mai ușoare, adică. în secvența H2Po → H2Te → H2Se → H2S → H2O. Ceea ce se întâmplă, dar numai cu primele patru hidruri. De exemplu, punctele de fierbere și de topire cresc pe măsură ce greutatea atomică a elementelor crește. În figură, crucile marchează punctele de fierbere ale acestor hidruri, iar cercurile marchează punctele de topire.

După cum se poate observa, pe măsură ce greutatea atomică scade, temperaturile scad destul de liniar. Zona de existență a fazei lichide a hidrurilor devine din ce în ce mai „rece”, iar dacă hidrura de oxigen H2O ar fi un compus normal, similar cu vecinii săi din al șaselea grup, atunci apa lichidă ar exista în intervalul de la - 80 ° C până la -95 ° C. La mai mult La temperaturi ridicate, H2O ar fi întotdeauna un gaz. Din fericire pentru noi și pentru toată viața de pe Pământ, apa este anormală, nu recunoaște un model periodic, ci își urmează propriile legi.
Acest lucru se explică destul de simplu - majoritatea moleculelor de apă sunt conectate prin legături de hidrogen. Aceste legături sunt cele care disting apa de hidrurile lichide H2S, H2Se și H2Te. Dacă nu ar fi, atunci apa ar fierbe deja la minus 95 ° C. Energia legăturilor de hidrogen este destul de mare și pot fi rupte doar la o temperatură mult mai mare. Chiar și în stare gazoasă, un număr mare de molecule de H2O își păstrează legăturile de hidrogen, combinându-se pentru a forma dimeri (H2O)2. Legăturile de hidrogen complet dispar numai la o temperatură a vaporilor de apă de 600 °C.
Amintiți-vă că fierberea constă în faptul că în interiorul unui lichid care fierbe se formează bule de vapori. La presiune normală, apa pură fierbe la 100 "C. Dacă căldura este furnizată prin suprafața liberă, procesul de evaporare a suprafeței va fi accelerat, dar evaporarea volumetrică caracteristică fierberii nu are loc. Fierberea poate fi efectuată și prin scăderea nivelului extern. presiune, deoarece în acest caz presiunea vaporilor egală cu presiunea exterioară se realizează la o temperatură mai scăzută. În vârful unui munte foarte înalt, presiunea și, în consecință, punctul de fierbere sunt atât de scăzute încât apa devine nepotrivită pentru gătit - nu se atinge temperatura ceruta a apei.Cu o presiune suficient de mare apa poate fi incalzita atat de mult incat in ea poate topi plumbul (327°C) si totusi nu va fierbe.
Pe lângă punctele de fierbere super-mari de topire (și ultimul proces necesită prea multă căldură de fuziune pentru un lichid atât de simplu), chiar domeniul de existență a apei este anormal - o sută de grade prin care aceste temperaturi diferă - un interval destul de mare pentru un lichid cu greutate moleculară atât de mică precum apa. Limitele valorilor admisibile ale hipotermiei și supraîncălzirii apei sunt neobișnuit de mari - cu încălzire sau răcire atentă, apa rămâne lichidă de la -40 ° C la +200 ° C. Aceasta extinde intervalul de temperatură în care apa poate rămâne lichidă la 240 °C.
Când gheața este încălzită, temperatura acesteia crește mai întâi, dar din momentul în care se formează amestecul de apă și gheață, temperatura va rămâne neschimbată până când toată gheața se va topi. Acest lucru se explică prin faptul că căldura furnizată gheții care se topește este cheltuită în primul rând doar pentru distrugerea cristalelor. Temperatura gheții de topire rămâne neschimbată până când toate cristalele sunt distruse (vezi căldura latentă de fuziune).
se topește
Topiturile sunt o stare lichidă topită a substanțelor la temperaturi cuprinse în anumite limite îndepărtate de punctul critic de topire și situate mai aproape de punctul de topire. Natura topiturii este determinată în mod inerent de tipul de legături chimice ale elementelor din substanța topită.
Topiturile sunt utilizate pe scară largă în metalurgie, fabricarea sticlei și în alte domenii ale tehnologiei. Topiturile au de obicei o compoziție complexă și conțin diverse componente care interacționează (vezi diagrama de fază).
Topiturile sunt
1. Metalice (Metale (numele provine din latinescul metallum - mine, mine) - un grup de elemente cu proprietăți metalice caracteristice, precum conductivitate termică și electrică ridicată, coeficient de rezistență pozitiv la temperatură, ductilitate ridicată și luciu metalic);
2. Ionic (Ion (greaca veche ἰόν - rulare) - o particulă monoatomică sau poliatomică încărcată electric formată ca urmare a pierderii sau adăugării unuia sau mai multor electroni la un atom sau moleculă. Ionizarea (procesul de formare a ionilor) poate apar la temperaturi ridicate, sub influența unui câmp electric);
3. Semiconductor cu legături covalente între atomi (Semiconductori - materiale care, din punct de vedere al conductivității lor, ocupă un loc intermediar între conductori și dielectrici și se deosebesc de conductori într-o puternică dependență a conductivității de concentrația de impurități, temperatură și diferite tipuri de radiații. principala proprietate a acestor materiale este o creștere a conductibilității electrice odată cu creșterea temperaturii);
4. Topituri organice cu legături van der Waals;
5. Foarte polimeric (Polimeri (greacă πολύ- - mulți; μέρος - parte) - substanțe anorganice și organice, amorfe și cristaline obținute prin repetarea repetată a diferitelor grupe de atomi, numite „unități monomerice”, conectate în macromolecule lungi prin chimie sau coordonare obligațiuni)
Topiturile în funcție de tipul de compuși chimici sunt:
1. Sare;
2.Oxid;
3. Oxid-silicat (zgură), etc.
Se topește cu proprietăți speciale:
1.Eutectic
Interesant despre topire
Boabele de gheață și stele.
Luați o bucată de gheață pură într-o cameră caldă și urmăriți cum se topește. Va deveni rapid clar că gheața, care părea monolitică și omogenă, se desface în multe boabe mici - cristale individuale. În volumul de gheață, acestea sunt situate aleatoriu. O imagine la fel de interesantă poate fi văzută când gheața se topește de la suprafață.
Aduceți o bucată netedă de gheață la lampă și așteptați până când începe să se topească. Când topirea atinge boabele interioare, acolo vor începe să apară modele foarte fine. Cu o lupa puternica se poate observa ca au forma de fulgi de zapada hexagonali. De fapt, acestea sunt depresiuni topite pline cu apă. Forma și direcția razelor lor corespund orientării monocristalelor de gheață. Aceste modele sunt numite „stele Tyndall” după fizicianul englez care le-a descoperit și descris în 1855. „Stelele Tyndall”, asemănătoare fulgilor de zăpadă, sunt de fapt depresiuni de pe suprafața gheții topite, de aproximativ 1,5 mm, umplute cu apă. În centrul lor sunt vizibile bule de aer, care au apărut din cauza diferenței dintre volumele de gheață topită și apa topită.
ȘTIAȚI?
Există un metal, așa-numitul aliaj de lemn, care se poate topi ușor chiar și în apă caldă (+68 grade Celsius). Deci, atunci când amestecați zahărul într-un pahar, o lingură de metal din acest aliaj se va topi mai repede decât zahărul!
Cea mai refractară substanță, carbura de tantal TaCO-88, se topește la o temperatură de 3990°C.
În 1987, cercetătorii germani au reușit să suprarăciască apa la -700C în timp ce o păstrau în stare lichidă.
Uneori, ca să se topească mai repede zăpada de pe trotuare, acestea sunt stropite cu sare. Topirea gheții are loc deoarece se formează o soluție de sare în apă, al cărei punct de îngheț este mai mic decât temperatura aerului. Soluția curge de pe trotuar.
Interesant este că picioarele se răcesc mai mult pe pavajul umed, deoarece temperatura soluției de apă sărată este mai mică decât cea a zăpezii pure.
Dacă turnați ceaiul dintr-un ceainic în două căni: cu zahăr și fără zahăr, atunci ceaiul într-o cană cu zahăr va fi mai rece, pentru că. dizolvarea zahărului (distrugerea rețelei sale cristaline) consumă și energie.
În înghețuri severe, pentru a restabili netezimea gheții, patinoarul este udat cu apă fierbinte.Apa fierbinte topește un strat subțire de gheață, nu îngheață atât de repede, are timp să se răspândească, iar suprafața gheții este foarte netedă.
Concluzie (concluzii)
Topirea este trecerea unei substanțe de la starea solidă la starea lichidă.
Când este încălzită, temperatura substanței crește, iar viteza de mișcare termică a particulelor crește, în timp ce energia internă a corpului crește.
Când temperatura unui solid atinge punctul de topire, rețeaua cristalină a solidului începe să se descompună. Astfel, cea mai mare parte a energiei încălzitorului, condusă către corpul solid, este cheltuită pentru reducerea legăturilor dintre particulele substanței, adică pentru distrugerea rețelei cristaline. În acest caz, energia de interacțiune între particule crește.
Substanța topită are un depozit de energie internă mai mare decât în stare solidă. Partea rămasă din căldura de fuziune este cheltuită pentru a face lucru pentru a schimba volumul corpului în timpul topirii acestuia.
În timpul topirii, volumul majorității corpurilor cristaline crește (cu 3-6%) și scade în timpul solidificării. Dar, există substanțe în care, la topire, volumul scade, iar când se solidifică, crește. Acestea includ, de exemplu, apa și fonta, siliciul și altele. . De aceea gheața plutește pe suprafața apei, iar fonta solidă - în propria topitură.
Solidele numite amorfe (chihlimbar, rășină, sticlă) nu au un punct de topire specific.
Cantitatea de căldură necesară pentru a topi o substanță este egală cu produsul căldurii specifice de fuziune înmulțit cu masa substanței.
Căldura specifică de fuziune arată câtă căldură este necesară pentru a transforma complet 1 kg dintr-o substanță dintr-o stare solidă în stare lichidă, luată la viteza de topire.
Unitatea de măsură a căldurii specifice de fuziune în SI este 1J/kg.
În timpul procesului de topire, temperatura cristalului rămâne constantă. Această temperatură se numește punct de topire. Fiecare substanță are propriul punct de topire.
Punctul de topire pentru o anumită substanță depinde de presiunea atmosferică.
Lista literaturii folosite
Date din enciclopedia electronică gratuită „Wikipedia”
en./wiki/Main_page
Site „Clasă! Fizica pentru curioși” class-fizika.narod/8_11.htm
Site-ul web „Proprietățile fizice ale apei”
totul-despre-apă/temperatura-de-fierbere.php
Site „Metale și structuri”
metaloconstrucție/osnovy-plavleniya-metallov/
Rezumate similare:
Proprietatea principală a unui lichid este schimbarea formei sub influența acțiunii mecanice. Lichide ideale și adevărate. Conceptul de fluide newtoniene. Metodă de determinare a proprietăților unui lichid. Formarea liberă a suprafeței și tensiunea superficială.
Kamchatka Academia de Stat flota de pescuit REZUMAT Pe tema: „Echilibrul de fază și transformări de fază„Scris de: Primit de: student IEF Isakov A.Ya.
Aceasta se numește uneori căldură latentă (căldura latentă se numește deoarece procesul de topire (și solidificare) are loc la temperatura constanta, încălzirea (răcirea) pare să fie absentă, deși absorbția (eliberarea) de căldură continuă). Căldura specifică latentă de fuziune —este cantitatea de căldură necesară pentru a transforma o unitate de masă solidîntr-un lichid fără schimbare de temperatură. Este, de asemenea, cantitatea de energie termică emisă atunci când o unitate de masă a unui lichid se transformă într-un solid fără modificarea temperaturii.
Studiu. Determinați căldura latentă specifică de topire a gheții
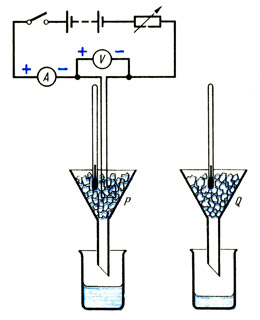 Pune sume egale gheață spartăîn două pâlnii identice P și Q (vezi Fig.). Dacă gheața a fost luată din congelator, atunci ar trebui să așteptați până când ajunge la o temperatură de 0 o C și începe să se topească. Puneți încălzitorul cu imersie conectat la ampermetru, voltmetru și reostat în pâlnia P, astfel încât să fie complet acoperit cu gheață.
Pune sume egale gheață spartăîn două pâlnii identice P și Q (vezi Fig.). Dacă gheața a fost luată din congelator, atunci ar trebui să așteptați până când ajunge la o temperatură de 0 o C și începe să se topească. Puneți încălzitorul cu imersie conectat la ampermetru, voltmetru și reostat în pâlnia P, astfel încât să fie complet acoperit cu gheață.
Imediat după pornirea încălzitorului, puneți pahare uscate de greutate cunoscută sub pâlniile P și Q. Înregistrați citirile ampermetrului și voltmetrului și, dacă este necesar, utilizați un reostat pentru a le menține constante în timpul experimentului. După câteva minute, când s-a adunat puțină apă în paharul de sub pâlnia P, marcați timpul, scoateți paharele și opriți încălzitorul. Determinați masele paharelor cu conținutul lor.
În căldura latentă specifică l are unitatea J x kg -1. Dacă o substanţă de masă m trece din stare solidăîn lichid, atunci dobândirea cantității de căldură ΔQ este determinată de formula ΔQ = mƖ.
Să presupunem că obținem următoarele rezultate:
masa sticlei sub P înainte de experiment = m 1 kg
masa sticlei sub P după experiment = m 2 kg
masa de gheață topită în P în timpul experimentului = (m 2 -m 1) kg
masa sticlei sub Q înainte de experiment = m 3 kg
masa sticlei sub Q după experiment = m 4 kg
masa de gheață topită în Q în timpul experimentului = (m 4 - m 3) kg
citirea ampermetrului = I, A
citirea voltmetrului = V, V
Timp în care încălzitorul a fost pornit = t min = 60t s
Controlul pâlniei Q. Vă permite să determinați masa de gheață care s-a topit la temperatura camerei în timpul experimentului. Ar fi logic să presupunem că gheața de aceeași masă se va topi în P. Astfel, masa suplimentară de gheață topită de încălzitor este:
(m 2 - m 1) - (m 4 - m 3) \u003d m.
Dacă Ɩ — căldură latentă specifică de fuziune gheata, atunci energie termală, necesar pentru ca gheața să se topească, va fi ml J. Ar trebui să fie egal cu energie electrica transmisă de încălzitor, care este VI x 60t. Prin urmare, ml = VI x 60t Ɩ = Vl x 60t / m J x kg -1
Valoarea căldurii specifice de topire a gheții este de 336.000 J x kg -1 sau 336.000 J de energie termică necesară pentru a topi 1 kg de gheață la 0 °C. Aceeași cantitate de căldură este eliberată atunci când 1 kg de apă îngheață la 0°C.
În cazul în care un gheață inițială sub 0°C, va fi nevoie de căldură suplimentară pentru a ridica temperatura la 0°C înainte ca gheața să înceapă să se topească.
Multe case au pivnițe, iar legumele sunt adesea depozitate acolo pentru iarnă. Datorită proprietății izolante a pământului, pivnița rămâne relativ rece vara și relativ caldă iarna. Când se așteaptă o iarnă aspră, în pivniță se pune un butoi cu apă. Când îngheață, energia termică latentă eliberată ajută la menținerea temperaturii din pivniță aproape de 0 ° C, ceea ce protejează legumele de îngheț.






