Cum și când se schimbă energia internă a corpului. Modalități de a schimba energia internă
Aflați cum puteți calcula modificarea energie internaîn timpul transferului de căldură. Pentru a face acest lucru cât mai precis posibil, este necesar să se minimizeze pierderile de căldură nesocotite în timpul schimbului de căldură. Prin urmare, când cercetare științifică transferul de căldură se realizează într-un calorimetru (Fig. 6.1), a cărui utilizare vă permite să determinați cu exactitate căldura dată sau primită de organism în procesul de transfer de căldură.
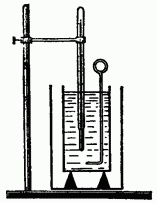
Calorimetrul este format din două vase: extern și intern. Vasul interior este realizat dintr-un bun conductor de căldură (alama, cupru), deoarece temperatura acestuia trebuie să fie aceeași cu cea a lichidului turnat în el.
Vasul exterior protejează vasul interior de pierderile de căldură prin convecție și radiații. Prin urmare, este de obicei vopsit cu vopsea albă sau din tablă lucioasă.
Pentru a proteja vasul interior de pierderile de căldură prin conducție, acesta este așezat pe suporturi din lemn (lemnul are o conductivitate termică slabă). Puneți un agitator (din același material ca și vasul) și un termometru în vasul interior.
Schimbul de căldură se efectuează după cum urmează. Cu ajutorul balanțelor se determină masa vasului interior al calorimetrului și al agitatorului, apoi masa lichidului turnat în el, de exemplu apă. După aceea, masa corpului este măsurată, încălzită la o temperatură cunoscută și, observând temperatura de pornire lichid, coborâți corpul încălzit în calorimetru. Măsurând temperatura finală a lichidului, este posibil să se calculeze câtă căldură a emis corpul în procesul de transfer de căldură.
Cu ajutorul unor astfel de experimente, este ușor de stabilit că modificarea energiei interne a unui corp este direct proporțională cu masa acestuia și cu modificarea temperaturii corpului.
![]()
aici c este coeficientul de proporționalitate. Deoarece modificarea energiei interne în timpul transferului de căldură este estimată prin cantitatea de căldură, avem
Temperatura inițială a corpului este de obicei desemnată ca temperatură finală, apoi, în cazul încălzirii corpului, și în cazul răcirii.
Experimentele arată că depinde de tipul de substanță, de conditii externe, din starea agregată a materiei. Aceste dependențe sunt exprimate prin coeficientul c în formulele (6.1) și (6.2).
Valoarea c care caracterizează dependența modificării energiei interne a corpului în timpul încălzirii sau răcirii de tipul de substanță și de condițiile externe se numește căldura specifică substante. Capacitatea termică specifică a unei substanțe se măsoară prin cantitatea de căldură necesară pentru a încălzi o unitate de masă a unei substanțe per unitate de temperatură:
![]()
Deducem unitatea căldura specificăîn SI:
În SI, unitatea de capacitate termică specifică este capacitatea termică specifică a unei astfel de substanțe pentru care se cheltuiește 1 J de energie pentru încălzirea unei mase de 1 kg la 1 K. Pentru mici schimbări de temperatură, capacitatea termică specifică poate fi considerată constantă. Pentru a rezolva probleme, se ia din tabele.
Trebuie avut în vedere că atunci când se determină cantitatea de căldură necesară pentru încălzire sau eliberată în timpul răcirii unui corp, uneori se folosește capacitatea termică a corpului C - o valoare măsurată prin cantitatea de căldură necesară pentru încălzirea corpului pe unitate. temperatura. Prin urmare,
Este deosebit de convenabil să folosiți capacitatea de căldură a întregului corp în calcule atunci când părțile individuale ale corpului sunt făcute din diferite substanțe. În SI, este luată unitatea de măsură a capacității termice a unui corp (Arătați acest lucru folosind formula (6.3).)
De asemenea, observăm că capacitatea termică specifică a unui gaz depinde de natura procesului în care este încălzit. De exemplu, capacitatea termică specifică a unui gaz la presiune constantă mai mare decât capacitatea sa termică specifică la volum constantîntrucât în primul caz este necesar nu numai creșterea energiei interne a gazului, ci și cheltuirea energiei pentru a efectua munca efectuată de gaz asupra corpurilor externe în procesul de expansiune a acestuia (§ 5.10). În al doilea caz, căldura furnizată gazului merge doar pentru a-i crește energia internă.
energie interna este suma energiilor cinetice ale tuturor particulelor care alcătuiesc corpul și energii potentiale interacțiunile dintre aceste particule. Aceasta include energia de interacțiune a electronilor cu nucleele și energia de interacțiune părțile constitutive miezuri.
Energia internă depinde de temperatura sa. Temperatura caracterizează energia cinetică medie a particulelor unei substanțe. Când temperatura se schimbă, distanța dintre particule se modifică, prin urmare, se modifică și energia de interacțiune dintre ele.
Energia internă se modifică și atunci când o substanță trece de la o stare de agregare la alta. Procesele asociate cu o modificare a temperaturii sau a stării de agregare a unei substanțe se numesc termic. Procesele termice sunt însoțite de o modificare a energiei interne a corpului.
reacții chimice, reactii nucleare sunt, de asemenea, însoțite de o modificare a energiei interne a corpului, tk. energia de interacțiune a particulelor implicate în reacții se modifică. Energia internă se schimbă atunci când atomii emit sau absorb energie în timpul tranziției electronilor de la o înveliș la alta.
Unul dintre modalități de a schimba energia internă este Muncă. Deci, în timpul frecării a două corpuri, temperatura acestora crește, adică. energia lor internă crește. De exemplu, în prelucrarea metalelor - găurire, strunjire, frezare.
Când două corpuri cu temperaturi diferite intră în contact, energia este transferată din corp cu temperatura ridicata la un corp cu o temperatură scăzută. Procesul de transfer de energie de la un corp la altul la o temperatură mai scăzută se numește transfer de căldură.
Astfel, în natură există două procese în care energia internă a corpului se modifică:
a) transformare energie mecanică la interior și invers; în timp ce se lucrează;
b) transfer de căldură; în timp ce nu se lucrează.
Dacă amestecați apă caldă și rece, atunci prin experiență puteți vedea că cantitatea de căldură degajată apa fierbinte, iar cantitatea de căldură primită de apa rece sunt egale între ele. Experiența arată că, dacă are loc schimbul de căldură între corpuri, atunci energia internă a tuturor corpurilor de încălzire crește cu atât cât scade energia internă a corpurilor de răcire. Astfel, energia trece de la un corp la altul, dar energia totală a tuturor corpurilor rămâne neschimbată. aceasta legea conservării și transformării energiei.
În toate fenomenele care apar în natură, energia nu apare și nu dispare. Se schimbă doar de la o specie la alta, în timp ce valoarea sa este păstrată.
De exemplu, un glonț de plumb care zboară cu o anumită viteză lovește un obstacol și se încălzește.
Sau, un slip de gheață, care cade dintr-un nor de zăpadă, se topește lângă pământ.
Sau, un ibric cu apă se încălzește pe o sobă cu gaz, o parte din apă se evaporă.
Legea conservării energiei este baza științifică pentru calcule în toate domeniile științei și tehnologiei. Trebuie avut în vedere că energia complet internă nu poate fi transformată în energie mecanică.
Energia internă poate fi modificată în două moduri.
Dacă se lucrează asupra unui corp, energia internă a acestuia crește.
Energia internă a corpului(notat E sau U) este suma energiilor interacțiunilor moleculare și mișcărilor termice ale unei molecule. Energia internă este o funcție cu o singură valoare a stării sistemului. Aceasta înseamnă că ori de câte ori un sistem se găsește într-o stare dată, energia sa internă își asumă valoarea inerentă acestei stări, indiferent de istoria sistemului. În consecință, modificarea energiei interne în timpul tranziției de la o stare la alta va fi întotdeauna egală cu diferența dintre valorile sale în starea finală și inițială, indiferent de calea pe care a fost făcută tranziția.
Energia internă a unui corp nu poate fi măsurată direct. Numai modificarea energiei interne poate fi determinată:
Această formulă este o expresie matematică a primei legi a termodinamicii
Pentru procesele cvasi-statice, este valabilă următoarea relație:
Temperatura măsurată în Kelvin
Entropia, măsurată în jouli/kelvin
Presiunea măsurată în pascali
Numărul de particule din sisteme
Căldura de ardere a combustibilului. combustibil condiționat. Cantitatea de aer necesară arderii combustibilului.
Calitatea unui combustibil se apreciază după puterea calorică. Indicele este utilizat pentru a caracteriza combustibilii solizi și lichizi. căldura specifică arderea, care este cantitatea de căldură eliberată în timpul arderii complete a unei unități de masă (kJ/kg). Pentru specii gazoase combustibil, se utilizează un indicator al căldurii volumetrice de ardere, care este cantitatea de căldură eliberată în timpul arderii unei unități de volum (kJ / m3). În plus, combustibilul gazos în unele cazuri este estimat prin cantitatea de căldură eliberată în timpul arderii complete a unui mol de gaz (kJ/mol).
Căldura de ardere este determinată nu doar teoretic, ci și empiric, prin arderea unei anumite cantități de combustibil în aparate speciale numite calorimetre. Căldura de ardere este estimată prin creșterea temperaturii apei în colorimetru. Rezultatele obținute prin această metodă sunt apropiate de valorile calculate din compoziția elementară a combustibilului.
Întrebarea 14Modificarea energiei interne în timpul încălzirii și răcirii. Lucrul gazului cu modificarea volumului.
Energia internă a corpului depinde de energia cinetică medie a moleculelor sale, iar această energie, la rândul ei, depinde de temperatură. Prin urmare, prin modificarea temperaturii corpului, îi schimbăm și energia internă.Când un corp este încălzit, energia lui internă crește, iar când se răcește, scade.
Energia internă a corpului poate fi schimbată fără a lucra. Deci, de exemplu, poate fi mărită prin încălzirea unui ibric cu apă pe aragaz sau prin coborârea unei linguri într-un pahar de ceai fierbinte. Se încălzește șemineul în care se aprinde focul, acoperișul casei iluminat de soare etc.. O creștere a temperaturii corpurilor în toate aceste cazuri înseamnă o creștere a energiei interne a acestora, dar această creștere se produce fără a lucra. .
Schimbarea energiei interne organismul fără a lucra se numește transfer de căldură. Transferul de căldură are loc între corpuri (sau părți ale aceluiași corp) care au temperaturi diferite.
Cum, de exemplu, are loc transferul de căldură atunci când o lingură rece intră în contact cu apa fierbinte? În primul rând, viteza medie și energie kinetică moleculele de apă fierbinte depășesc viteza medie și energia cinetică a particulelor de metal din care este făcută lingura. Dar în acele locuri în care lingura intră în contact cu apa, moleculele de apă fierbinte încep să transfere o parte din energia lor cinetică către particulele lingurii și încep să se miște mai repede. În acest caz, energia cinetică a moleculelor de apă scade, iar energia cinetică a particulelor lingurii crește. Odată cu energia se schimbă și temperatura: apa se răcește treptat, iar lingura se încălzește. Schimbarea temperaturii lor are loc până când devine aceeași atât pentru apă, cât și pentru lingură.
O parte din energia internă transferată de la un corp la altul în timpul schimbului de căldură este notă cu o literă și se numește cantitatea de căldură.
Q este cantitatea de căldură.
Cantitatea de căldură nu trebuie confundată cu temperatura. Temperatura este măsurată în grade, iar cantitatea de căldură (ca orice altă energie) este măsurată în jouli.
La contactul corpurilor cu temperaturi diferite un corp mai fierbinte degajă ceva căldură, iar un corp mai rece o primește.
Lucrați la expansiune gazoasă izobară. Unul din principalele procese termodinamice, care are loc în majoritatea motoarelor termice, este procesul de expansiune a gazului cu efectuarea muncii. Este ușor de determinat munca efectuată în timpul expansiunii izobare a unui gaz.
Dacă în timpul expansiunii izobare a gazului de la volumul V1 la volumul V2, pistonul se deplasează în cilindru la o distanță l (Fig. 106), atunci lucrul A „efectuat de gaz este egal cu
Unde p este presiunea gazului, este modificarea volumului acestuia.
Lucrați cu un proces arbitrar de expansiune a gazului. Un proces arbitrar de expansiune a gazului de la volumul V1 la volumul V2 poate fi reprezentat ca un set de procese izobare și izocorice alternative.
Lucrați cu expansiune gazoasă izotermă. Comparând zonele figurilor sub secțiunile izotermei și izobarei, putem concluziona că dilatarea gazului de la volumul V1 la volumul V2 la aceeași valoare inițială a presiunii gazului este însoțită în cazul expansiunii izobare de mai multă muncă.
Lucrați cu compresie de gaz. Când gazul se dilată, direcția vectorului forță de presiune a gazului coincide cu direcția vectorului deplasare, prin urmare munca A „efectuată de gaz este pozitivă (A” > 0), iar munca A forțelor externe este negativă: A \u003d -A "< 0.
La comprimarea gazului direcția vectorului forțelor exterioare coincide cu direcția de mișcare, deci lucrul A al forțelor externe este pozitiv (A > 0), iar lucrul A „efectuat de gaz este negativ (A”< 0).
proces adiabatic. Pe lângă izobar, izocoric și procese izoterme, procesele adiabatice sunt adesea considerate în termodinamică.
proces adiabatic este un proces care are loc într-un sistem termodinamic în absența schimbului de căldură cu corpurile înconjurătoare, adică în condiția Q = 0.
Întrebarea 15 Condiții pentru echilibrul corpului. Moment de putere. Tipuri de echilibru.
Echilibrul sau echilibrul unui număr de fenomene înrudite din științele naturale și umane.
Un sistem este considerat a fi într-o stare de echilibru dacă toate influențele asupra acestui sistem sunt compensate de alții sau sunt absente cu totul. Un concept similar este sustenabilitatea. Echilibrul poate fi stabil, instabil sau indiferent.
Exemple tipice de echilibru:
1. Balanța mecanică, cunoscută și ca echilibru static, - starea unui corp în repaus, sau în mișcare uniformă, în care suma forțelor și momentelor care acționează asupra acestuia este egală cu zero.
2. Echilibrul chimic – poziţia în care reactie chimica se desfășoară în aceeași măsură ca reacția inversă și, ca urmare, nu există nicio modificare a cantității fiecărei componente.
3. Echilibrul fizic al oamenilor și animalelor, care se menține prin înțelegerea necesității acestuia și, în unele cazuri, prin menținerea artificială a acestui echilibru [sursa nespecificată 948 de zile].
4. Echilibru termodinamic - starea sistemului în care procesele sale interne nu duc la modificări ale parametrilor macroscopici (cum ar fi temperatura și presiunea).
R egalitatea cu zero a sumei algebrice momente de forţe de asemenea, nu înseamnă că organismul este neapărat în repaus. Timp de câteva miliarde de ani, rotația Pământului în jurul axei sale continuă cu o perioadă constantă tocmai pentru că suma algebrică a momentelor forțelor care acționează asupra Pământului de la alte corpuri este foarte mică. Din același motiv, roata bicicletei care se învârte continuă să se rotească la o frecvență constantă și numai forțe externe opriți această rotație.
Tipuri de echilibru. În practică, un rol important îl joacă nu numai îndeplinirea condiției de echilibru pentru corpuri, ci și caracteristica calitativă a echilibrului, numită stabilitate. Există trei tipuri de echilibru al corpurilor: stabil, instabil și indiferent. Echilibrul se numește stabil dacă, după mici influențe externe, corpul revine la starea inițială de echilibru. Aceasta se întâmplă dacă, cu o deplasare ușoară a corpului în orice direcție față de poziția inițială, rezultanta forțelor care acționează asupra corpului devine nenulă și este îndreptată spre poziția de echilibru. În echilibru stabil este, de exemplu, o minge în partea de jos a adânciturii.
Condiția generală pentru echilibrul unui corp. Combinând cele două concluzii, putem formula o condiție generală de echilibru pentru un corp: un corp este în echilibru dacă suma geometrică a vectorilor tuturor forțelor aplicate lui și suma algebrică a momentelor acestor forțe în jurul axei de rotație sunt egal cu zero.
Întrebarea 16Vaporizare și condensare. Evaporare. Lichid care fierbe. Dependența fierberii lichidului de presiune.
vaporizare - proprietatea de a scăpa lichide de a le schimba starea de agregareși se transformă în abur. Vaporizarea care are loc numai pe suprafața unui lichid care picura se numește evaporare. Vaporizarea pe întreg volumul unui lichid se numește fierbere; apare la o anumită temperatură, în funcție de presiune. Presiunea la care fierbe un lichid la o anumită temperatură se numește presiune. vapori saturati pnp, valoarea sa depinde de tipul de lichid și de temperatura acestuia.
Evaporare este procesul prin care o substanță se mișcă din stare lichidaîn gaz (abur). Procesul de evaporare este inversul procesului de condensare (trecerea de la o stare de vapori la una lichidă. Evaporarea (vaporizarea), trecerea unei substanțe dintr-o fază condensată (solidă sau lichidă) la una gazoasă (abur); faza de tranzitie primul fel.
Condens - este procesul invers de evaporare. În timpul condensării, moleculele de vapori revin în lichid. Într-un vas închis, un lichid și vaporii săi pot fi într-o stare de echilibru dinamic atunci când numărul de molecule care părăsesc lichidul este egal cu numărul de molecule care se întorc în lichid din vapori, adică atunci când ratele de evaporare și condensarea sunt aceleasi. Un astfel de sistem se numește sistem în două faze. Un vapor care este în echilibru cu lichidul său se numește saturat. Numărul de molecule emise dintr-o unitate de suprafață a unui lichid într-o secundă depinde de temperatura lichidului. Numărul de molecule care se întorc din vapori în lichid depinde de concentrația moleculelor de vapori și de viteza medie mișcarea lor termică, care este determinată de temperatura aburului.
Fierbere- procesul de vaporizare într-un lichid (trecerea unei substanțe de la lichid la stare gazoasă), cu apariția limitelor de separare a fazelor. Punctul de fierbere la presiune atmosferică este de obicei dată ca una dintre principalele caracteristici fizico-chimice ale unei substanțe pure din punct de vedere chimic.
Fierberea se distinge după tip:
1. fierbere cu convecție liberă în volum mare;
2. fierbere sub convecție forțată;
3. cât şi în relaţie temperatura medie lichid până la temperatura de saturație:
4. fierberea unui lichid subrăcit la temperatura de saturație (fierberea la suprafață);
5. fierberea unui lichid încălzit la temperatura de saturaţie
Bubble
Fierbere , în care se formează aburul sub formă de bule care apar și cresc periodic, se numește fierbere nucleată. Cu fierbere nucleată lentă într-un lichid (mai precis, de regulă, pe pereți sau pe fundul vasului), apar bule pline cu vapori. Datorită evaporării intense a lichidului din interiorul bulelor, acestea cresc, plutesc, iar vaporii sunt eliberați în faza de vapori deasupra lichidului. În acest caz, în stratul din apropierea peretelui, lichidul este ușor stare supraîncălzită, adică temperatura sa depășește punctul nominal de fierbere. În condiții normale, această diferență este mică (de ordinul unui grad).
Film
Când fluxul de căldură crește până la o anumită valoare critică, bulele individuale se îmbină, formând un strat continuu de vapori lângă peretele vasului, care se sparge periodic în volumul lichidului. Acest mod se numește modul film.
©2015-2017 site
Toate drepturile aparțin autorilor lor. Acest site nu pretinde autor, dar oferă o utilizare gratuită.






