Cum se schimbă entropia? Entropia termodinamică. proces circular. Ciclul Carnot
În majoritatea proceselor chimice, două fenomene apar simultan: transferul de energie și o schimbare a aranjamentului ordonat al particulelor unul față de celălalt. Toate particulele (molecule, atomi, ioni) tind să se miște aleatoriu, astfel încât sistemul tinde să treacă de la o stare mai ordonată la una mai puțin ordonată. O măsură cantitativă a dezordinei (haoticitatea, dezordinea) unui sistem este entropia S . De exemplu, dacă o butelie de gaz este conectată la un vas gol, atunci gazul din butelie va fi distribuit pe întregul volum al vasului. Sistemul se va muta de la o stare mai ordonată la una mai puțin ordonată, ceea ce înseamnă că entropia va crește (ΔS > 0).
Este puțin probabil ca conceptul de fizică să fie folosit atât de des în afara fizicii - și, prin urmare, adesea se abate de la sensul său real - ca entropie. Conceptul are un sens foarte restrâns. Definiția specifică a acestui cantitate fizica a fost realizată de fizicianul austriac Ludwig Boltzmann în a doua jumătate a anului. S-a concentrat asupra comportamentului microscopic al unui fluid, adică a unui gaz sau lichid. Mișcarea dezordonată a atomilor sau moleculelor a fost înțeleasă ca căldură, ceea ce a fost decisiv pentru definirea ei.
LA sistem închis cu un volum fix și un număr fix de particule, a subliniat Boltzmann, entropia este proporțională cu logaritmul numărului de microstadii din sistem. În microstări, el a înțeles toate posibilitățile de a stivui molecule sau atomi ai unui lichid închis într-un lichid. Formula sa definește entropia ca o măsură a „libertății de aranjare” a moleculelor și atomilor: dacă numărul de microstări acceptabile crește, entropia crește. Există mai puține posibilități pentru modul în care se pot forma particulele fluide, mai puțină entropie.
Entropia crește întotdeauna (ΔS > 0) în timpul tranziției sistemului de la o stare mai ordonată la una mai puțin ordonată: în timpul tranziției unei substanțe de la o stare cristalină la o stare lichidă și de la o stare lichidă la o stare gazoasă, cu o creștere. în temperatură, cu dizolvare și disociere substanță cristalină etc.
În timpul tranziției sistemului de la o stare mai puțin ordonată la o stare mai ordonată, entropia sistemului scade (ΔS< 0), например при конденсации, кристаллизации, понижении температуры и т.д.
Formula lui Boltzmann este adesea interpretată ca și cum entropia ar fi echivalentă cu „dezordine”. Cu toate acestea, această imagine simplificată este ușor înșelătoare. Spuma de baie este un exemplu în acest sens: atunci când bulele izbucnesc și suprafața apei devine netedă, supărarea pare să scadă. Dar entropia nu! De fapt, chiar crește pentru că după spargerea spumei, spațiul posibil pentru moleculele lichide nu mai este limitat de membranele exterioare ale veziculelor, astfel încât numărul de microstări ingerate a crescut.
Ce este entropia
Definiția lui Boltzmann ne permite să înțelegem o latură a termenului, dar entropia are și un alt aspect macroscopic, pe care fizicianul german Rudolf Clausius l-a descoperit deja în urmă cu câțiva ani. S-a inventat motorul cu abur, clasicul motor termic. Motoarele termice transformă diferența de temperatură în munca mecanica. Fizicienii au încercat apoi să înțeleagă principiile care guvernează aceste mașini. Cercetătorii au descoperit că doar câteva procente din energia termică poate fi transformată în energie mecanică.
În termodinamică, modificarea entropiei este legată de căldură prin expresia:
dS = δQ/T sau ΔS=ΔH/T
Entropiile substanțelor, precum și entalpiile lor de formare, sunt denumite condiții standard. entropia standard Se notează 1 mol S 0 298 , aceasta este o valoare de referință, măsurată în J / (K mol) (Anexa 2).
De exemplu, entropia standard
Restul s-a pierdut cumva - fără a înțelege motivul. Teoria termodinamicii, aparent, nu avea un concept fizic care să țină cont de diferitele valențe ale energiei și să limiteze posibilitatea transformării energiei termice în energie mecanică. Soluția a luat forma entropiei. Clausius a introdus termenul ca o variabilă termodinamică și l-a definit ca o măsură macroscopică a unei proprietăți care limitează capacitatea de utilizare a energiei.
Potrivit lui Clausius, modificarea entropiei unui sistem depinde de căldura furnizată și de temperatură. Odată cu căldura, entropia este întotdeauna transferată, deci derivarea acesteia. În plus, Clausius a ajuns la concluzia că entropia în sistemele închise, spre deosebire de energie, nu este un factor de conservare. Acesta a fost al doilea moment major al termodinamicii în fizică.
gheaţă……………..S 0 298 = 39,7 J/(K mol);
apă…………….S 0 298 = 70,08 J/(K mol);
vapori de apă ... ..S 0 298 \u003d 188,72 J / (K mol),
acestea. entropia crește - gradul de dezordine a unei substanțe în stare gazoasă Mai Mult.
Pentru grafit S 0 298 = 5,74 J / (K mol), pentru diamant S 0 298 = 2,36 J / (K mol), deoarece substanțele cu structură amorfă au mai multă entropie decât cu una cristalină.
„Într-un sistem închis, entropia nu scade niciodată”. Prin urmare, entropia crește întotdeauna sau rămâne constantă. Acest lucru introduce o linie temporală în fizica în buclă închisă, deoarece procese termodinamiceîn sistemele închise sunt ireversibile cu creșterea entropiei.
Teoria muncii de laborator
Procesul ar fi reversibil dacă entropia ar rămâne constantă. Dar acest lucru este posibil doar teoretic. Toate procesele reale sunt ireversibile. Potrivit lui Boltzmann, se mai poate spune că numărul de microstări posibile crește în orice moment. Această interpretare microscopică extinde interpretarea termodinamică-macroscopică a lui Clausius. Entropia a rezolvat în cele din urmă misterul energiei care dispare în motoarele termice. O parte din energia termică este în cele din urmă eliminată din capacitatea de utilizare mecanică și eliberată din nou, deoarece entropia în sistemele închise nu ar trebui să scadă.
Entropia S 0 298, J / (K mol) crește odată cu complicarea moleculelor, de exemplu:
În cursul reacțiilor chimice, se modifică și entropia, astfel încât, odată cu creșterea numărului de molecule de substanțe gazoase, entropia sistemului crește, iar cu o scădere, scade.
Modificarea entropiei sistemului ca rezultat al proceselor este determinată de ecuația:
Informații generale despre termodinamică
De la rezultatele lui Clausius și Boltzmann, entropia s-a mutat și în alte domenii ale fizicii. Chiar și în afara fizicii, ele au fost atacate, cel puțin ca concept matematic. Cu această dimensiune, el a caracterizat pierderea de informații în transmisiile telefonice.
Ciclul ideal al unui motor termic Carnot
Entropia joacă, de asemenea, un rol în chimie și biologie: în unele sisteme deschise se pot forma noi structuri atâta timp cât entropia este eliberată. Acestea ar trebui să fie așa-numitele sisteme disipative în care energia este convertită în energie termică. Această teorie a formării structurale vine de la fizicianul-chimistul belgian Ilya Prigogine. Până în prezent, a fost publicată o lucrare în care aspecte noi se adaugă sferei fizice a conceptului.
∆S 0 = ∑ ∆S 0 cont. - ∑ ΔS 0 ref.
De exemplu: în reacție
C (grafit) + CO 2 (g) \u003d 2CO (g); AS0298 = 87,8 J/K
În partea stângă a ecuației, există 1 mol de substanță gazoasă CO 2 (g), iar în dreapta - 2 moli de substanță gazoasă 2CO (g), ceea ce înseamnă că volumul sistemului crește și entropia crește ( ΔS > 0).
Cu o creștere a entropiei (ΔS > 0), apar și reacții:
![]()
De ce este limitată eficiența motoarelor termice? Rudolf Clausius a rezolvat această ghicitoare introducând conceptul de entropie. Fizicianul a considerat procesul circular al unui motor termic idealizat în care dilatarea și contracția alternează în condiții izoterme și izoentropice. Corelând conservarea energiei în al doilea set de bază de termodinamică, următoarea inegalitate pentru eficiență duce la acest așa-numit proces Carnot.
Astfel, randamentul maxim realizabil al unui motor termic este limitat de legile termodinamice. De exemplu, dacă mașina funcționează între 100 și 200 de grade Celsius, eficiența maximă realizabilă este de aproximativ 21%. Două informații utile suplimentare pot fi derivate matematic din conservarea energiei și din cel de-al doilea set de bază de termodinamică: atunci când se lucrează, căldura poate călători doar de la un corp rece la unul cald - frigiderele și pompele de căldură au nevoie de o sursă de energie.
2 H 2 O (g) \u003d 2 H 2 (g) + O 2 (g)
2 H 2 O 2 (g) \u003d 2 H 2 O (g) + O 2 (g)
CaCO 3 (c) \u003d CaO (c) + CO 2 (g), ΔS 0 298 \u003d 160,48 J / K
În reacția de formare a amoniacului
N2 (g) + 3H2 (g) \u003d 2NH3 (g); ΔS 0 298 \u003d - 103,1 J / K
Volumul sistemului scade și, prin urmare, scade și entropia (ΔS< 0).
Cu scăderea entropiei (ΔS< 0) протекают реакции:
3 H 2 (g) + N 2 (g) \u003d 2 NH 3 (g)
2 H 2 (g) + O 2 (g) \u003d 2 H 2 O (g)
În al doilea rând, nu se poate lucra cu rezervorul încălzit temperatura constanta. În acest scop, este întotdeauna necesar un flux de căldură între rezervoare. temperaturi diferite. Termenul de entropie este o nouă formare a lui Rudolf Clausius din cuvinte grecești și se traduce aproximativ prin „conținut de conversie”.
Formula spune că entropia este întotdeauna transferată împreună cu căldura. Definiția entropiei lui Boltzmann se bazează pe înțelegerea căldurii ca mișcare dezordonată a atomilor sau moleculelor. Microstările sunt posibilitățile în care pot fi aranjate moleculele sau atomii unui fluid blocat. Entropia este una vastă. Orice stare de echilibru a unui sistem termodinamic i se poate atribui în mod unic o valoare de entropie. LA fizica statistica Entropia este o măsură a cantității de spațiu de fază pe care o poate atinge un sistem.
În reacţiile dintre solide iar în procesele în care cantitatea de substanțe gazoase nu se modifică, entropia practic nu se modifică și modificarea acesteia este determinată de structura moleculelor sau de structura rețelei cristaline, de exemplu:
C (grafit) + O 2 (g) \u003d CO 2 (g), ΔS 0 298 \u003d 2,9 J / K
Al (c) + Sb (c) \u003d AlSb (c), ΔS 0 298 \u003d - 5,01 J / K
Exemplul #1. Calculați și explicați modificarea entropiei pentru un proces
În cadrul termodinamicii clasice, entropia este o măsură pentru. Această modificare a entropiei este pozitivă când este introdusă căldură, negativă când căldura este îndepărtată. Clausius a descris, de asemenea, multiplicarea entropiei fără transfer de căldură prin procese ireversibile într-un caz izolat cu inegalitate.
Istoria termenului "entropie"
![]()
Ecuația este o formă a celui de-al doilea set principal de termodinamică. Cu procesul prezentat în figură într-un sistem adiabatic, unde pot fi specificate doar starea inițială și starea finală, nu este cazul. Cu toate acestea, pentru un gaz ideal, diferența de entropie poate fi calculată într-un mod simplu printr-un proces de deplasare izotermă reversibilă, așa cum este descris în secțiunea Exemple. Pe lângă energie, entropia este cel mai important concept și este util să mergem la punctul de plecare al acestei științe pentru o mai bună înțelegere și repetare a dezvoltării.
2SO 2 (g) + O 2 (g) \u003d 2SO 2 (g)
Soluţie.
ΔS 0 \u003d 2 S 0 SO 3 (g) - (2 S 0 SO2 (g) + S 0 O 2 (g)) \u003d 2 256,23 - (2 248,1 + 205,04) \u003d - 188 ,78 J/K .
Deoarece ΔS< 0, энтропия уменьшается вследствии уменьшения объема системы, т.е. уменьшения числа молей газообразных веществ (в левой части 3 моль газообразных веществ, в правой – 2 моль).
Exemplul #2. Calculați și explicați modificarea entropiei pentru un proces:
Mașina și-a putut îndeplini sarcina, dar a luat mult combustibil. În acest moment, legătura dintre energie și căldură era complet obscură, iar Julius Mayer încă mai trebuia să o publice peste 130 de ani mai târziu. Inspirat de munca tatălui său la mori, Carnot a descris un motor cu abur într-un proces ciclic în care căldura curge de la o sursă fierbinte la o ieșire rece, lucrând astfel.
În lucrarea sa inițială, Carnot și-a exprimat părerea că căldura este un fel de substanță imponderabilă care curge întotdeauna dintr-un corp mai fierbinte într-un corp mai rece, deoarece apa se mișcă întotdeauna în jos. Și la fel ca apa care cade, căldura poate funcționa în continuare, cu cât gradientul este mai mare, în special, mașina nu poate face mai multă muncă decât a fost furnizată căldura. Carnot s-a corectat mai târziu și a recunoscut deja echivalența căldurii și energiei cu zece ani înainte de Mayer, Joule și Thomson. Între timp era înaintea timpului său, dar, din păcate, a murit tânăr, iar munca lui a trecut neobservată la prima vedere.
Soluţie. Să scriem din aplicație. 2 valori entropii standard substante
Conform corolarului legii lui Hess,
ΔS 0 \u003d (2 S 0 CuO (c) + S 0 SO 2 (g)) - (S 0 Cu2S (c) + 2 S 0 O 2 (g)) \u003d (2 42,64 + 248,1) – (119,24 + 205,04) = 9,1 J/K.
Entropia crește ușor, aceasta se datorează complicației structurii moleculei de SO 2 (g) în comparație cu molecula de O 2 (g).
Exemplul #3. Determinați modificarea entropiei pentru proces:
Doar Clausius a formulat legătura dintre diferența de temperatură - sursa și chiuveta - cu randamentul schimbătorului de căldură și că această eficiență nu poate fi depășită de un alt motor termic, deoarece altfel căldura ar curge spontan de la un corp rece la unul fierbinte. Imposibilitatea unui astfel de proces în natură se numește acum Clausius, formulată de ea printr-un proces circular.
Nu există nicio mașină de ciclism al cărui singur efect este să transfere căldura de la răcitor într-un rezervor mai cald. Mai simplu spus, afirmația principală afirmă că diferențele de temperatură nu pot crește spontan în natură. Clausius ar putea cere o ofertă cu asta.
C (grafit) + O 2 (g) \u003d CO 2 (g)
Soluţie: Să scriem din aplicație. 2 valori standard de entropie
ΔS 0 \u003d S 0 CO2 (g) - (S 0 C (g) + S 0 O2 (g)) \u003d 213,68 - (5,74 + 205,04) \u003d 2,9 J / K.
Deoarece ΔS > 0, entropia crește ușor în timpul reacției. Volumul sistemului nu se modifică, dar entropia crește datorită complexității structurii moleculei de CO 2 în comparație cu molecula de O 2.
Termodinamica în funcție de stare
Pentru orice proces circular. Semnul de echivalență se aplică numai proceselor reversibile. Cu această teoremă Clausius dimensiunea este evidentă. Clausius a numit această cantitate entropie și, de-a lungul timpului, a devenit obișnuită formularea propoziției principale direct cu entropia, ceea ce nu duce în niciun caz la o înțelegere mai profundă. Abia decenii mai târziu, cu mecanica sa statistică, a putut fi găsită o explicație a entropiei ca măsură a microstărilor realizabile ale unui sistem. Căldura este distribuită aleatoriu în atomi și molecule, distribuind energia și trecând de la cald la rece, deoarece drumul înapoi este pur și simplu prea puțin probabil.
Energia Gibbs
În mod spontan, adică fără cheltuirea energiei din exterior, sistemul poate trece doar de la o stare mai puțin stabilă la una mai stabilă.
LA procese chimice doi factori in acelasi timp:
Tendința sistemului de a trece la starea cu cea mai scăzută energie internă, ceea ce reduce entalpia sistemului ( ∆H → min);
Tendința unui sistem de a trece la o stare mai dezordonată, ceea ce crește entropia ( ∆S → max).
Se numește schimbarea energiei sistemului factor de entalpie , se exprimă cantitativ în termeni de efect termic al reacției ΔH. Reflectă tendința de a forma legături și de a mări particulele.
Creșterea entropiei într-un sistem se numește factor de entropie , se exprimă cantitativ în unități de energie (J) și se calculează ca T ΔS. Ea reflectă o tendință spre o aranjare mai aleatorie a particulelor, spre dezintegrarea substanțelor în particule mai simple.
Efectul total al acestor două tendințe opuse în procesele care au loc la constante T și P , se reflectă printr-o modificare a potenţialului izobaric-izoterm sau energie gratis Gibbs ΔG și se exprimă prin ecuația:
∆G = ∆H – T ∆S
La presiune și temperatură constante (proces izobar-izotermic), reacțiile se desfășoară spontan în direcția scăderii energiei Gibbs.
După natura schimbării energiei Gibbs, se poate judeca posibilitatea fundamentală sau imposibilitatea implementării procesului.
În cazul în care un ΔG< 0 , reacția poate decurge spontan în directie înainte. Cu cât este mai mare scăderea factorului de entalpie și creșterea factorului de entropie, cu atât tendința sistemului de a continua reacția este mai puternică. Energia Gibbs în starea inițială a sistemului este mai mare decât în starea finală.
Dacă energia Gibbs ∆G > 0, reacția nu poate decurge spontan în direcția înainte.
În cazul în care un ∆G=0, sistemul este într-o stare de echilibru chimic, factorii de entalpie și entropie sunt egali (ΔH=T ΔS). Temperatura la care ∆G = 0, se numește temperatura de pornire a reacției : T = ∆H/∆S. La această temperatură, atât reacțiile directe, cât și cele inverse sunt la fel de probabile. Posibilitatea (sau imposibilitatea) unei reacții spontane la diverse rapoarte valorile ΔH și ΔS sunt prezentate în tabel.
Exemplul #1.
Cu 2 S (c) + 2 O 2 (g) \u003d 2 CuO (c) + SO 2 (g)
Precizați posibilitatea apariției sale în conditii standardîn sistem închis.
Soluţie: Gibbs schimbă energia liberă în reactie chimicaîn condiții standard (T \u003d 298 K, P \u003d 101325 Pa) se calculează prin ecuația ΔG 0 \u003d ΔH 0 - T ΔS 0.
Efectul termic al unei reacții chimice ΔH 0 = - 545,5 kJ (vezi calculul de mai sus). Modificarea entropiei într-o reacție chimică ΔS 0 = -9,1 J/K (vezi calculul de mai sus).
La calcularea ΔG 0, trebuie luat în considerare faptul că ΔH 0 este exprimat în kJ, iar ΔS 0 în J / K, pentru aceasta, ΔS 0 trebuie înmulțit cu 10 -3.
Modificarea energiei libere Gibbs într-o reacție chimică
ΔG 0 \u003d ΔH 0 - T ΔS 0 \u003d - 545,5 - \u003d -548,21 kJ.
Deoarece ΔG 0< 0, следовательно, в стандартных условиях самопроизвольное протекание данной химической реакции в прямом направлении возможно.
Exemplul #2. Pe baza valorilor ∆H 0 și ∆S 0, se calculează ∆G 0 al reacției
MgCO 3 (c) \u003d MgO (c) + CO 2 (g)
Indicați posibilitatea curgerii acestuia în condiții standard într-un sistem închis. La ce temperatură va începe să se descompună carbonatul de calciu?
Soluţie: Scriem din Anexele 1 și 2 valorile etalpiilor standard ∆H0f, kJ/mol și entropia S 0 , J/(K mol):
Calculați variația de entalpie și entropie
∆H0= (∆H0f, MgО(c) + ∆H0f, CO 2 (g)) - ∆H0f, MgСО 3 (k) \u003d [-601,24 + (-393,5)] - (-1096,21) \u003d 101,46 kJ;
ΔS 0 \u003d - S 0 MgSO 3 (k) \u003d - 112,13 \u003d 128,41 J / K.
ΔG 0 \u003d ΔH 0 - T ΔS 0 \u003d 101,46 - 298 128,41 10 -3 \u003d 63,19 kJ.
Deoarece ΔG 0 > 0, prin urmare, cursul acestei reacții în condiții standard este imposibil. Deoarece ΔH > 0 și ΔS > 0, se poate concluziona că reacția se poate desfășura spontan la o temperatură suficient de ridicată.
Calculați temperatura la care începe descompunerea carbonatului de magneziu:
T \u003d ΔH 0 / ΔS 0 \u003d 101,46 / (128,41 10 -3) \u003d 790,12 K (517,12 0 C).
La o temperatură de 790,12 K, atât reacțiile directe, cât și cele inverse sunt la fel de probabile. La temperaturi peste 790,12 K, va avea loc o reacție directă, adică va avea loc descompunerea carbonatului de magneziu.
§6 Entropie
De obicei, orice proces în care un sistem trece de la o stare la alta se desfășoară în așa fel încât este imposibil să se efectueze acest proces în direcția opusă, astfel încât sistemul să treacă prin aceleași stări intermediare fără modificări în corpurile înconjurătoare. Acest lucru se datorează faptului că o parte din energie este disipată în proces, de exemplu, datorită frecării, radiațiilor și așa mai departe. Aproape toate procesele din natură sunt ireversibile. În orice proces, ceva energie se pierde. Pentru a caracteriza disiparea energiei se introduce conceptul de entropie. ( Valoarea entropiei caracterizează starea termică a sistemului și determină probabilitatea implementării acestei stări a corpului. Cu cât starea dată este mai probabilă, cu atât entropia este mai mare.) Toate procesele naturale sunt însoțite de o creștere a entropiei. Entropia rămâne constantă doar în cazul unui proces reversibil idealizat care are loc într-un sistem închis, adică într-un sistem în care nu există schimb de energie cu corpurile exterioare acestui sistem.
Entropia și semnificația ei termodinamică:
Entropie- aceasta este o astfel de funcție a stării sistemului, a cărei modificare infinitezimală într-un proces reversibil este egală cu raportul dintre cantitatea infinit de căldură introdusă în acest proces și temperatura la care a fost introdusă.
Într-un proces final reversibil, modificarea entropiei poate fi calculată folosind formula:
![]()
unde integrala este luată de la starea inițială 1 a sistemului până la starea finală 2.
Deoarece entropia este o funcție de stare, atunci proprietatea integraleieste independența sa față de forma conturului (calea) de-a lungul căruia este calculată, prin urmare, integrala este determinată numai de stările inițiale și finale ale sistemului.
- În orice proces reversibil de modificare a entropiei este 0
(1)
- Termodinamica demonstrează căSsistemul care face un ciclu ireversibil crește
Δ S> 0 (2)
Expresiile (1) și (2) se aplică numai sistemelor închise, dacă sistemul schimbă căldură cu Mediul extern, apoi eSse poate comporta în orice fel.
Relațiile (1) și (2) pot fi reprezentate ca inegalitatea Clausius
∆S ≥ 0
acestea. entropia unui sistem închis poate fie să crească (în cazul proceselor ireversibile) fie să rămână constantă (în cazul proceselor reversibile).
Dacă sistemul face o tranziție de echilibru de la starea 1 la starea 2, atunci entropia se modifică
![]()
Unde dUși δAscris pentru un anumit proces. Conform acestei formule, ΔSse determină până la o constantă aditivă. sens fizic nu are entropia în sine, ci diferența de entropii. Să aflăm modificarea entropiei în procesele unui gaz ideal.
![]()
acestea. modificări de entropieS Δ S 1→2 a unui gaz ideal în timpul trecerii lui de la starea 1 la starea 2 nu depinde de tipul procesului.
pentru că pentru un proces adiabatic δQ = 0, atunci ∆ S= 0 => S= const , adică un proces adiabatic reversibil are loc la entropie constantă. Prin urmare, se numește izoentropic.
La proces izotermic (T= const ; T 1 = T 2 : )
![]()
Într-un proces izocor (V= const ; V 1 = V 2 ; )
![]()
Entropia are proprietatea aditivității: entropia sistemului este egală cu suma entropiilor corpurilor incluse în sistem.S = S 1 + S 2 + S 3 + ... Diferența calitativă dintre mișcarea termică a moleculelor și alte forme de mișcare este aleatorietatea, dezordinea acesteia. Prin urmare, pentru a caracteriza mișcarea termică, este necesar să se introducă o măsură cantitativă a gradului de tulburare moleculară. Dacă luăm în considerare orice stare macroscopică dată a unui corp cu anumite valori medii ale parametrilor, atunci este altceva decât o schimbare continuă a microstărilor apropiate care diferă unele de altele în distribuția moleculelor în diferite părți ale volumului și în energia distribuită între molecule. Numărul acestor microstări în continuă schimbare caracterizează gradul de tulburare a stării macroscopice a întregului sistem,wse numește probabilitatea termodinamică a unei microstări date. Probabilitatea termodinamicăwstările sistemului este numărul de moduri în care poate fi realizată o anumită stare a unui sistem macroscopic sau numărul de microstări care implementează o anumită microstare (w≥ 1 și probabilitate matematică ≤ 1 ).
Am convenit să luăm logaritmul probabilității sale, luat cu semnul minus, ca măsură a neașteptății unui eveniment: neașteptarea stării este egală cu =-
După Boltzmann, entropiaSsistemele și probabilitatea termodinamică sunt legate după cum urmează:
S=
Unde - constanta Boltzmann (![]() ). Astfel, entropia este determinată de logaritmul numărului de stări cu care poate fi realizată o anumită microstare. Entropia poate fi considerată ca o măsură a probabilității stării sistemului t/d. Formula Boltzmann ne permite să dăm entropiei următoarea interpretare statistică. Entropia este o măsură a dezordinei unui sistem. Într-adevăr, decât mai mult număr microstări realizând microstarea dată, cu atât mai multă entropie. În starea de echilibru a sistemului - cea mai probabilă stare a sistemului - numărul de microstări este maxim, în timp ce entropia este de asemenea maximă.
). Astfel, entropia este determinată de logaritmul numărului de stări cu care poate fi realizată o anumită microstare. Entropia poate fi considerată ca o măsură a probabilității stării sistemului t/d. Formula Boltzmann ne permite să dăm entropiei următoarea interpretare statistică. Entropia este o măsură a dezordinei unui sistem. Într-adevăr, decât mai mult număr microstări realizând microstarea dată, cu atât mai multă entropie. În starea de echilibru a sistemului - cea mai probabilă stare a sistemului - numărul de microstări este maxim, în timp ce entropia este de asemenea maximă.
pentru că procesele reale sunt ireversibile, atunci se poate argumenta că toate procesele dintr-un sistem închis duc la o creștere a entropiei sale - principiul creșterii entropiei. În interpretarea statistică a entropiei, aceasta înseamnă că procesele dintr-un sistem închis merg în direcția creșterii numărului de microstări, cu alte cuvinte, de la stări mai puțin probabile la cele mai probabile, până când probabilitatea stării devine maximă.
§7 A doua lege a termodinamicii
Prima lege a termodinamicii, care exprimă legea conservării energiei și transformării energiei, nu permite stabilirea direcției fluxului proceselor t/d. În plus, este posibil să ne imaginăm un set de procese care nu se contraziceuînceputul m/d, în care este stocată energia, dar în natură nu sunt realizate. Formulări posibile ale celui de-al doilea început t/d:
1) legea creșterii entropiei unui sistem închis în timpul proceselor ireversibile: orice proces ireversibil într-un sistem închis are loc în așa fel încât entropia sistemului crește ΔS≥ 0 (proces ireversibil) 2) ΔS≥ 0 (S= 0 pentru reversibil și ΔS≥ 0 pentru proces ireversibil)
În procesele care au loc într-un sistem închis, entropia nu scade.
2) Din formula Boltzmann S = , prin urmare, o creștere a entropiei înseamnă o tranziție a sistemului de la o stare mai puțin probabilă la una mai probabilă.
3) Potrivit lui Kelvin: un proces circular nu este posibil, al cărui singur rezultat este conversia căldurii primite de la încălzitor în lucru echivalent cu acesta.
4) Potrivit lui Clausius: un proces circular nu este posibil, al cărui singur rezultat este transferul de căldură de la un corp mai puțin încălzit la unul mai încălzit.
Pentru a descrie sistemele t/d la 0 K, se folosește teorema Nernst-Planck (a treia lege a lui t/d): entropia tuturor corpurilor aflate în echilibru tinde spre zero pe măsură ce temperatura se apropie de 0 K
Din teoremă Nernst-Planck urmează căC p= C v = 0 la 0 La
§8 Maşini termice şi frigorifice.
Ciclul Carnot și eficiența acestuia
Din formularea celei de-a doua legi a lui t / d în conformitate cu Kelvin, rezultă că o mașină de mișcare perpetuă de al doilea fel este imposibilă. (O mașină cu mișcare perpetuă este un motor care funcționează periodic care funcționează prin răcirea unei surse de căldură.)
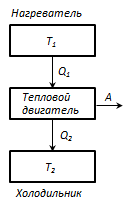 Termostat- acesta este un sistem t/d care poate face schimb de căldură cu corpurile fără a modifica temperatura.
Termostat- acesta este un sistem t/d care poate face schimb de căldură cu corpurile fără a modifica temperatura.
Principiul de funcționare al unui motor termic: de la un termostat cu o temperatură T 1 - încălzitor, cantitatea de căldură este luată pe cicluQ 1 , si termostat cu temperatura T 2 (T 2 < T 1) - frigider, cantitatea de căldură transferată pe cicluQ 2 , în timp ce lucrați DAR = Q 1 - Q 2
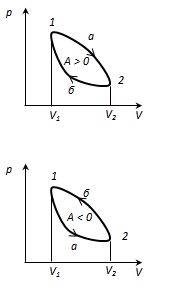 Proces sau ciclu circular este procesul prin care sistemul, după ce trece printr-o serie de stări, revine la starea inițială. Pe diagrama de stare, ciclul este reprezentat printr-o curbă închisă. Ciclul care gaz ideal, poate fi împărțit în procese de expansiune (1-2) și compresie (2-1), munca de expansiune este pozitivă DAR 1-2 > 0, deoareceV 2
>
V 1
, lucrul de compresie este negativ DAR 1-2 < 0, т.к.
V 2
<
V 1
. Prin urmare, munca efectuată de gaz pe ciclu este determinată de aria acoperită de curba închisă 1-2-1. Dacă munca pozitivă este efectuată într-un ciclu (ciclul este în sensul acelor de ceasornic), atunci ciclul se numește direct, dacă este un ciclu invers (ciclul are loc în sens invers acelor de ceasornic).
Proces sau ciclu circular este procesul prin care sistemul, după ce trece printr-o serie de stări, revine la starea inițială. Pe diagrama de stare, ciclul este reprezentat printr-o curbă închisă. Ciclul care gaz ideal, poate fi împărțit în procese de expansiune (1-2) și compresie (2-1), munca de expansiune este pozitivă DAR 1-2 > 0, deoareceV 2
>
V 1
, lucrul de compresie este negativ DAR 1-2 < 0, т.к.
V 2
<
V 1
. Prin urmare, munca efectuată de gaz pe ciclu este determinată de aria acoperită de curba închisă 1-2-1. Dacă munca pozitivă este efectuată într-un ciclu (ciclul este în sensul acelor de ceasornic), atunci ciclul se numește direct, dacă este un ciclu invers (ciclul are loc în sens invers acelor de ceasornic).
ciclu direct utilizat la motoarele termice – motoare care funcționează periodic care efectuează lucrări datorită căldurii primite din exterior. Ciclul invers este utilizat în mașini frigorifice- instalatii de functionare periodica, in care datorita lucrarii forțe externe căldura este transferată unui corp cu o temperatură mai ridicată.
Ca urmare a unui proces circular, sistemul revine la starea inițială și, în consecință, o schimbare completă energie interna este egal cu zero. ApoiІ începe t/d pentru proces circular
Q= Δ U+ A= A,
Adică munca efectuată pe ciclu este egală cu cantitatea de căldură primită din exterior, dar
Q= Q 1 - Q 2
Q 1 - cantitate căldură primită de sistem,
Q 2 - cantitate căldură degajată de sistem.
Eficiență termică pentru un proces circular este egal cu raportul dintre munca efectuată de sistem și cantitatea de căldură furnizată sistemului:
![]()
Pentru η = 1, condițiaQ 2 = 0, adică motorul termic trebuie să aibă o singură sursă de căldurăQ 1 , dar aceasta contrazice a doua lege a lui t/d.
Procesul invers față de ceea ce se întâmplă într-un motor termic este utilizat într-o mașină de refrigerare.
 De la termostat cu temperatura T 2 se ia cantitatea de căldurăQ 2
si transmis la termostat cu temperaturaT 1
, cantitatea de căldurăQ 1
.
De la termostat cu temperatura T 2 se ia cantitatea de căldurăQ 2
si transmis la termostat cu temperaturaT 1
, cantitatea de căldurăQ 1
.
Q= Q 2 - Q 1 < 0, следовательно A< 0.
Fără a lucra, este imposibil să iei căldură de la un corp mai puțin încălzit și să o dai unuia mai fierbinte.
Pe baza celei de-a doua legi a lui t/d, Carnot a dedus o teoremă.
Teorema lui Carnot: a tuturor motoarelor termice care funcționează periodic cu aceleași temperaturi ale încălzitorului ( T 1) și frigidere ( T 2), cea mai mare eficiență. au mașini reversibile. K.P.D. masini reversibile pentru egal T 1 și T 2 sunt egale și nu depind de natura fluidului de lucru.
Un corp de lucru este un corp care efectuează un proces circular și schimbă energie cu alte corpuri.
Ciclul Carnot este cel mai economic ciclu reversibil, format din 2 izoterme și 2 adiabați.
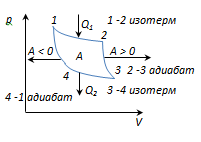 1-2-expansiune izotermă la T 1 încălzitor; căldura este furnizată gazuluiQ 1
si munca este facuta
1-2-expansiune izotermă la T 1 încălzitor; căldura este furnizată gazuluiQ 1
si munca este facuta![]()
2-3 - adiabat. expansiune, gazul funcționeazăA 2-3 >0 peste corpurile externe.
3-4 compresie izotermă la T 2 frigidere; se ia calduraQ 2
si munca este facuta![]() ;
;
Compresie 4-1-adiabatică, se lucrează pe gaz A 4-1 <0 внешними телами.
Într-un proces izotermU= const , deci Q 1 = A 12
![]() 1
1
Cu expansiune adiabaticăQ 2-3 = 0, iar gazul funcționează A 23 realizat cu energie internă A 23 = - U
![]()
Cantitatea de căldurăQ 2 , dat de gaz la frigider în timpul compresiei izoterme este egal cu munca de compresie DAR 3-4
![]() 2
2
Lucrări de compresie adiabatică
![]()
Lucrare realizată într-un proces circular
A = A 12 + A 23 + A 34 + A 41 = Q 1 + A 23 - Q 2 - A 23 = Q 1 - Q 2
și este egală cu aria curbei 1-2-3-4-1.
Eficiență termică Ciclul Carnot
![]()
Din ecuația adiabatică pentru procesele 2-3 și 3-4 obținem
Apoi ![]()
![]()
acestea. eficienţă Ciclul Carnot este determinat doar de temperaturile încălzitorului și răcitorului. Pentru a crește eficiența trebuie să măresc diferența T 1 - T 2 .
******************************************************* ******************************************************






