Distanța dintre moleculele din starea solidă. Stări agregate ale materiei. stare de agregare la alta
Căutare text integral:
Fizică->Lucrări de laborator
Dacă ați făcut vreodată prăjituri și ați lăsat ușa bucătăriei deschisă, probabil știți că parfumul se răspândește în toată casa. Este cel mai puternic în bucătărie, unde se coace prăjiturile, puțin mai puțin în sufragerie sau sufragerie și mai puțin în dormitorul de la etaj. Iar dacă ușa este închisă în dormitorul din colț, mirosul de prăjituri este și mai slab.
Ce cauzează mișcarea moleculară aleatorie?
Când moleculele se deplasează dintr-o zonă de concentrație mare într-o zonă de concentrație scăzută. afectează viteza de difuzie. Cristale de sare solidă dizolvată în apă în conducte și răspândite spre rezervor. Debitul de apă dulce a înlocuit apa sărată din rezervor. Sarea a fost depozitată în acest curent de apă.
Studiul proceselor în circuit electric Cu conexiune paralelă receptoare ce contin elemente inductive si capacitive, cu alt raport...full>>
Fizică->Lucrări de laborator
Investigarea influenței inductanței bobinei asupra parametrilor electrici ai unui circuit de tensiune sinusoidal monofazat care conține în serie ... complet>>
În natură, substanțele se găsesc în
Când este dizolvat în apă, heliul are o difuzie mai mare decât aerul. 
Lichidele se formează atunci când energia sistemului crește și structura rigidă a stării solide este distrusă. În lichide, moleculele se pot mișca una după alta și se pot ciocni cu alte molecule; cu toate acestea, ele rămân relativ apropiate una de cealaltă, ca solidele. Adesea, în lichide, forțele intermoleculare țin moleculele împreună și se descompun rapid. Pe măsură ce temperatura lichidului crește, crește numărul de mișcări ale moleculelor individuale.
Acasă > Rezumat >Fizică
1 Menținerea…………………………………………………………..2
2 Corpul principal
2.1 Structura lichidului. Mișcarea moleculelor lichide………3
2.2 Presiunea în lichid……………………………………….4
2.3 Legea lui Arhimede …………………………………………….5
2.4 Evaporarea…………………………………………………………………6
Ca urmare, lichidele pot „curge” pentru a lua forma recipientului lor, dar nu pot fi comprimate cu ușurință deoarece moleculele sunt deja apropiate. Astfel, lichidele au o formă nedefinită, dar un volum determinat. În exemplul de animație de mai jos, vedem că apa lichidă este alcătuită din molecule care se pot deplasa liber unele pe lângă altele, dar rămân relativ apropiate la o distanță una de cealaltă.

Gazele se formează atunci când energia dintr-un sistem depășește toate forțele atractive dintre molecule. Astfel, moleculele de gaz interacționează puțin unele cu altele, cu excepția faptului că se ciocnesc ocazional una de alta. În stare gazoasă, moleculele se mișcă rapid și se mișcă liber în orice direcție, răspândindu-se pe distanțe mari. Pe măsură ce temperatura gazului crește, crește numărul de mișcări ale moleculelor individuale. Gazele se extind pentru a-și umple recipientele și au o densitate scăzută.
2.5 Fierberea……………………………………………………….7
2.6 Tensiunea superficială a lichidului…………….8
2.7 Pelicule lichide……………………………………………………9
2.8 Udare și neumezire…………………………….….10
2.9 Fenomene capilare………………………………………..12
2.10 Electricitateîn lichide……………………………..13
3 Concluzie…………………………………………………………………..14
Coeficientul de proporționalitate k se numește echivalentul electrochimic al unei substanțe. Este numeric egal cu masa substanței eliberată în timpul trecerii unei singure sarcini electrice prin electrolit și depinde de natura chimică a substanței.
Deoarece moleculele individuale sunt larg separate și se pot deplasa cu ușurință în stare gazoasă, gazele sunt ușor comprimate și au o formă nedefinită. Solidele, lichidele și gazele sunt cele mai comune stări ale materiei care există pe planeta noastră. Observați diferențele în mișcarea moleculară a moleculelor de apă în aceste trei stări.
Referințe……………………………………………………16
1. Introducere
LA Viata de zi cu zi de obicei întâlnim stări de trei faze ale materiei - solidă, lichidă și gazoasă. Avem o idee destul de clară despre structura gazelor și a corpurilor cristaline solide. Un gaz este o colecție de molecule care se mișcă aleatoriu în toate direcțiile, independent unele de altele. Într-un corp solid, toate moleculele își păstrează aranjamentul reciproc pentru o lungă perioadă de timp, făcând doar mici oscilații în jurul anumitor poziții de echilibru.

Plasma este gaz fierbinte, ionizate. Plasma se formează în condiții de energie extrem de mare, atât de mare încât moleculele se despart și există doar atomi liberi. Mai surprinzător, plasmele au atât de multă energie încât electronii exteriori sunt de fapt îndepărtați din atomii individuali, formând astfel un gaz de ioni încărcați cu energie înaltă. Deoarece atomii din plasmă există ca ioni încărcați, plasmele se comportă diferit față de gaze, care este a patra stare a materiei.
În acest eseu, mă voi concentra pe o analiză mai detaliată a stării lichide a materiei. Caracteristica principală Această stare de agregare este aceea că starea lichidă, ocupând o poziție intermediară între gaze și cristale, combină unele dintre proprietățile ambelor stări. În special, pentru lichide, precum și pentru corpurile cristaline, prezența unui anumit volum este caracteristică și, în același timp, un lichid, ca un gaz, ia forma vasului în care se află. Majoritatea oamenilor tind să creadă că lichidele nu au formă proprie. Dar acest lucru nu este adevărat. Forma naturală a oricărui lichid este o sferă. De obicei, gravitația împiedică lichidul să ia această formă, lichidul fie se răspândește într-un strat subțire pe suprafață, fie ia forma unui vas dacă este turnat în el.
Plasma poate fi vizualizată pur și simplu privind în sus; condițiile de înaltă energie care există în stele, cum ar fi Soarele nostru, forțează atomii individuali într-o stare de plasmă. Au o formă nedefinită și se extind pentru a-și umple recipientul.
După cum am văzut, o creștere a energiei are ca rezultat mai multă mișcare moleculară. În schimb, o scădere a energiei are ca rezultat o mișcare moleculară mai mică. Ca rezultat, o predicție a cineticii teoria moleculară este că dacă vom continua să scădem energia materiei, vom ajunge la un punct în care toată mișcarea moleculară încetează. Temperatura la care se oprește mișcarea moleculară se numește zero absolut și se calculează ca -15 grade Celsius. În timp ce oamenii de știință răcesc substanțele la temperaturi apropiate zero absolut, nu au ajuns niciodată la zero absolut.
Poziția intermediară a lichidelor se datorează faptului că starea lichidă este deosebit de complexă în proprietățile sale. Deși lichidele au făcut obiectul studiilor științifice cel puțin încă de pe vremea lui Arhimede, adică acum 2200 de ani, analiza comportamentului lichidelor este încă unul dintre cele mai dificile domenii ale științei aplicate. Până acum, nu există o teorie completă și general acceptată a lichidelor.
Dificultatea de a observa materia la zero absolut este că este nevoie de lumină pentru a „vedea” materia, iar lumina însăși transferă energie materiei, ridicând astfel temperatura. În ciuda acestor provocări, oamenii de știință au observat recent o a cincea stare a materiei care există doar la temperaturi foarte apropiate de zero absolut.
Condensații Bose-Einstein reprezintă a cincea stare a materiei, observată pentru prima dată în condensurile B-E, sunt lichide superfluide gazoase răcite la temperaturi foarte apropiate de zero absolut. În această stare ciudată, toți atomii condensatului ajung în aceeași stare mecanică cuantică și pot curge unul împotriva celuilalt fără frecare.
2 .Parte principală.
Pentru a înțelege proprietățile și regularitățile de bază ale stării lichide a unei substanțe, este necesar să se ia în considerare următoarele aspecte:
2.1.Structura lichidului. Mișcarea moleculelor lichide.
Un fluid este ceva care poate curge.
Așa-numita ordin de rază scurtă este observată în aranjamentul particulelor lichide. Aceasta înseamnă că, în ceea ce privește orice particulă, locația celor mai apropiați vecini este ordonată. Cu toate acestea, pe măsură ce se îndepărtează de o anumită particulă, aranjarea altor particule în raport cu aceasta devine din ce în ce mai puțin ordonată și destul de repede ordinea în aranjamentul particulelor dispare complet. Moleculele lichide se mișcă mult mai liber decât moleculele solide, deși nu la fel de liber ca moleculele de gaz. Fiecare moleculă de lichid de ceva timp se mișcă ici și colo, fără a se îndepărta, totuși, de vecinii săi. Dar, din când în când, o moleculă lichidă iese din mediul său și merge în alt loc, intrând într-un mediu nou, unde din nou de ceva timp face mișcări similare cu oscilațiile. Un merit semnificativ în dezvoltarea unui număr de probleme în teoria stării lichide aparține omului de știință sovietic Ya. I. Frenkel. Potrivit lui Frenkel, mișcarea termică în lichide are următorul caracter. Fiecare moleculă oscilează în jurul unei anumite poziții de echilibru pentru un timp. Din când în când, molecula își schimbă locul de echilibru, sărind într-o nouă poziție, separată de cea anterioară printr-o distanță de ordinul mărimii moleculelor înseși. Adică, moleculele se mișcă lent în interiorul lichidului, rămânând o parte din timp în apropierea unor locuri.Astfel, mișcarea moleculelor lichide este ceva ca un amestec de mișcări într-un solid și într-un gaz: mișcarea oscilativă într-un loc este înlocuită. printr-o trecere liberă dintr-un loc în altul.
Câteva alte stări mai puțin obișnuite ale materiei au fost, de asemenea, descrise sau observate efectiv. Unele dintre aceste stări includ cristale lichide, condensate fermionice, superfluide, supersolide și substanța ciudată bine numită. Citiți mai multe despre aceste etape în secțiunea Faze a resurselor noastre pentru acest modul.
Se numește transformarea unei stări a materiei într-o altă stare faza de tranzitie. Apa se comportă diferit decât majoritatea celorlalți compuși chimici. În aproape toate substanțele, atomii și moleculele se apropie pe măsură ce se răcesc. Apa, însă, atinge cea mai mare densitate la patru grade Celsius, deoarece moleculele de apă se împachetează cel mai aproape la această temperatură. Multe lacuri cu apă dulce sunt patru grade Celsius în punctul cel mai adânc, deoarece apa grea se scufundă în fund.
2.2 Presiunea într-un lichid
Experiența de zi cu zi ne învață că lichidele acționează cu forțe cunoscute pe o suprafață. solideîn contact cu ei. Aceste forțe se numesc forțe de presiune a fluidului.
Acoperind cu un deget deschiderea unui robinet de apă deschis, simțim forța presiunii lichidului asupra degetului. Durerea de urechi resimțită de un înotător care se scufundă la adâncimi mari este cauzată de forțele presiunii apei asupra timpanului. Termometrele de adâncime trebuie să fie foarte puternice, astfel încât presiunea apei să nu le zdrobească.
Ia forma unui vas și se umple complet
Dar, în mod surprinzător, pentru a ajunge la faza solidă a gheții, moleculele de apă se deplasează din nou mai departe. Acest fenomen este denumit anomalia apei. Gheața este mai ușoară și plutește la suprafață. Acest lucru poate fi văzut în mari zone oceanice la latitudini polare, parțial acoperite cu gheață. Motivul acestei anomalii constă în proprietățile neobișnuite ale moleculei de apă. Atomul său de oxigen și doi atomi de hidrogen sunt aranjați asimetric. Aceasta creează un dipol, o moleculă cu un capăt negativ și unul pozitiv. În funcție de temperatură, acești dipoli se aliniază în agregate în conformitate cu sarcina lor, de exemplu, în timpul formării unui cristal de gheață.
Presiunea dintr-un lichid se datorează unei modificări a volumului său - compresie. În raport cu o modificare a volumului, lichidele au elasticitate. Forțele elastice dintr-un fluid sunt forțe de presiune. Astfel, dacă un fluid acționează cu forțe de presiune asupra corpurilor în contact cu el, aceasta înseamnă că este comprimat. Deoarece densitatea unei substanțe crește în timpul compresiei, se poate spune că lichidele au elasticitate în raport cu o modificare a densității.
Natura dipol a apei este un factor critic pentru climă. Deoarece dipolii de apă tind să se lipească împreună ca niște mici magneți, apa reacționează încet la încălzire sau răcire. De fapt, apa are cea mai mare capacitate termică dintre toate lichidele și solide cu excepția amoniacului. Aceasta înseamnă că apa poate absorbi multă căldură înainte de a fierbe. Atât punctele de îngheț, cât și cele de fierbere ale apei, o parte atât de mare din viața noastră de zi cu zi, sunt într-adevăr destul de neobișnuite.
Dacă molecula de apă era simetrică, atunci apa se topește la minus 110 grade Celsius și fierbe la minus 80 de grade. Inerția climatică este rezultatul capacității mari de căldură a apei, în primul rând. Apa afectează clima nu numai în stare lichidă și solidă. În plus, sporește impactul altor substanțe asupra climei. De exemplu, dacă temperatura crește ca urmare a mai multor niveluri înalte dioxid de carbon, conținutul de vapori de apă crește, de asemenea, deoarece o atmosferă mai caldă poate reține în mod durabil mai mulți vapori de apă.
Presiunea dintr-un lichid este perpendiculară pe orice suprafață plasată în lichid. Presiunea din lichid la adâncimea h este egală cu suma presiunii de la suprafață și o valoare proporțională cu adâncimea:
Datorita faptului ca lichidele pot transmite presiune statica, practic nu mai mica decat densitatea lor, ele pot fi folosite in aparate care dau un castig de rezistenta: presa hidraulica.
Datorită moleculei sale dipol, apa absoarbe radiația infraroșie foarte eficient. Ca rezultat, aceasta dublează aproximativ scurgerea cauzată inițial de dioxid de carbon. O altă proprietate importantă a apei este capacitatea sa de a dizolva sărurile, ceea ce îi modifică semnificativ densitatea. Salinitatea medie a oceanului este de 7 părți la mie. Cu aceasta mineralizare apa are cea mai mare densitate minus 8 grade Celsius, care este sub punctul de îngheț al apei de mare cu salinitate medie. Acesta este, de fapt, minus 9 grade Celsius.
Prin urmare, răcirea suprafeței poate determina formarea de gheață prin convecție. Această caracteristică de densitate este motorul convecției, unul dintre cele mai importante elemente ale sistemului climatic; apa rece, sărată este grea și se scufundă la adâncimi mari.
2.3.Legea lui Arhimede
Forțele de presiune acționează pe suprafața unui corp solid scufundat într-un lichid. Deoarece presiunea crește odată cu adâncimea, forțele de presiune în sus de pe fundul fluidului sunt mai mari decât forțele de jos de pe partea superioară și ne putem aștepta ca rezultanta forțelor de presiune să fie în sus. Forța rezultantă de presiune asupra unui corp scufundat într-un lichid se numește forța de susținere a lichidului.
Este înlocuit de apa care curge la suprafața mării. 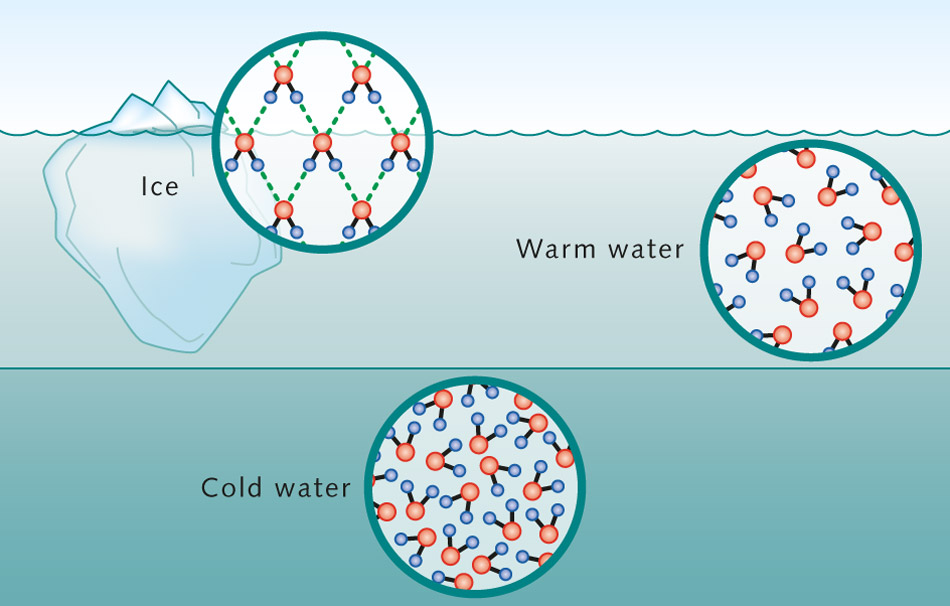
Astfel, se comportă diferit față de alte substanțe. Gheața este mai puțin densă și plutește la suprafață. Apa dulce are cea mai mare densitate de patru grade și se scufundă în fund. Apoi se acoperă cu apă caldă. Apa sărată are caracteristici diferite.
Starea agregată la alta
Vitraliile vechi sunt mai groase decât mai sus. De secole, sticla curge încet, turiștii au fost învățați de turiști din întreaga lume. La urma urmei, paharele sunt practic lichide, deși foarte vâscoase. De la publicarea sa în numărul din mai al Jurnalului American de Fizică, această afirmație a fost acum respinsă. Deși sticla a fost produsă de multe secole, încă nu există teorie completă, care explică în final dezvoltarea sticlei. Mai presus de toate, fabricile de sticlă folosesc experiență și metode care au fost perfecționate prin încercare și eroare.
Dacă un corp scufundat într-un lichid este lăsat singur, atunci se va scufunda, rămâne în echilibru sau plutește la suprafața lichidului, în funcție de faptul dacă forța de susținere este mai mică decât forța gravitațională care acționează asupra corpului, egală cu ea sau mai mare decât ea.
Principiul lui Arhimede afirmă că un corp dintr-un fluid este supus unei forțe de plutire în sus egală cu greutatea fluidului deplasat. Un corp scufundat într-un lichid este supus unei forțe de plutire (numită forță Arhimede)
Oamenii de știință au fost interesați de proprietățile ochelarilor doar de câteva decenii. Fără deformare De verificat istorie complexă coborând ferestrele bisericii, fizicianul brazilian Edgar Dutra Zanotto a studiat comportamentul ochelarilor vechi și noi atunci când temperaturi diferite. Rezultatul său: Spectacolele medievale ar fi putut scăpa în ultimii 800 de ani, sugerând că în acest timp bisericile au fost încălzite continuu la 400 de grade Celsius. La temperatura camerei, paharele au rezistat milioane de ani. Prin urmare, chiar și cele mai vechi vaze din muzee nu prezintă nicio deformare.
Sticla, acest material abia explorat, diferă de majoritatea celorlalte materiale solide în starea sa „amorfă”. Atomii nu sunt aranjați într-o rețea obișnuită ca un cristal. Mai degrabă, ele formează o rețea tridimensională haotică. Această așa-numită stare sticloasă apare atunci când un lichid, un amestec fierbinte fierbinte de nisip de cuarț și săruri Metale alcaline se răcește rapid cu mult sub punctul său de topire. Spre deosebire de sticlă, moleculele majorității lichidelor se aranjează spontan la punctul de topire într-o rețea cristalină.
unde ρ este densitatea lichidului (gazului), este accelerația cădere liberă, A V- volumul corpului scufundat (sau partea din volum a corpului sub suprafață).
Dacă un corp scufundat într-un lichid este suspendat de o cântar, atunci cântarul arată diferența dintre greutatea corpului în aer și greutatea lichidului deplasat. Prin urmare, legii lui Arhimede i se dă uneori următoarea formulare: un corp scufundat într-un lichid pierde în greutate atât de mult cât cântărește lichidul deplasat de acesta.
Este interesant de observat un astfel de fapt experimental că, aflându-se în interiorul unui alt lichid de un mai mare gravitație specifică, lichidul conform legii lui Arhimede „își pierde” din greutate și își ia forma naturală, sferică.
2.4 Evaporare
In stratul superficial si in apropierea suprafetei lichidului actioneaza forte care asigura existenta suprafetei si nu permit ca moleculele sa paraseasca din volumul lichidului. Datorită mișcării termice, unele dintre molecule au viteze suficient de mari pentru a depăși forțele care țin moleculele în lichid și a părăsi lichidul. Acest fenomen se numește evaporare. Se observă la orice temperatură, dar intensitatea sa crește odată cu creșterea temperaturii.
Dacă moleculele care au părăsit lichidul sunt îndepărtate din spațiul de lângă suprafața lichidului, atunci, în final, tot lichidul se va evapora. Dacă moleculele care au părăsit lichidul nu sunt îndepărtate, ele formează vapori. Moleculele de vapori care au căzut în regiunea din apropierea suprafeței lichidului sunt atrase în lichid de forțele de atracție. Acest proces se numește condensare.
Astfel, dacă moleculele nu sunt îndepărtate, viteza de evaporare scade cu timpul. Odată cu o creștere suplimentară a densității vaporilor, se ajunge la o situație în care numărul de molecule care părăsesc lichidul într-un anumit timp va fi egal cu numărul de molecule care se întorc în lichid în același timp. Apare o stare de echilibru dinamic. Vaporii aflati in stare de echilibru dinamic cu un lichid se numesc saturati.
Odată cu creșterea temperaturii, densității și presiunii abur saturat crește. Cu cât temperatura este mai mare, cu atât numărul de molecule lichide are suficientă energie pentru a se evapora și densitatea vaporilor trebuie să fie mai mare pentru ca condensarea să egaleze evaporarea.
2.5 Fierberea
Când un lichid este încălzit la o temperatură la care presiunea vapori saturati egală cu presiunea exterioară se stabilește un echilibru între lichid și acesta abur saturat. Când o cantitate suplimentară de căldură este comunicată lichidului, masa corespunzătoare de lichid este imediat convertită în abur. Acest proces se numește fierbere.
Fierberea este evaporarea intensă a unui lichid, care are loc nu numai de la suprafață, ci în întregul său volum, în interiorul bulelor de vapori rezultate. Pentru a trece de la lichid la vapori, moleculele trebuie să dobândească energia necesară pentru a depăși forțele atractive care le țin în lichid. De exemplu, pentru a evapora 1 g de apă la o temperatură de 100 ° C și o presiune corespunzătoare presiunii atmosferice la nivelul mării, este necesar să cheltuiți 2258 J, dintre care 1880 merg pentru a separa moleculele de lichid, iar restul merg să lucreze la creșterea volumului ocupat de sistem, împotriva forțelor presiunii atmosferice (1 g de vapori de apă la 100 ° C și presiune normală ocupă un volum de 1,673 cm3, în timp ce 1 g de apă în aceleași condiții este de doar 1,04 cm3 ).
Punctul de fierbere este temperatura la care presiunea vaporilor devine egală cu presiunea exterioară. Pe măsură ce presiunea crește, punctul de fierbere crește, iar pe măsură ce presiunea scade, aceasta scade.
Datorită modificării presiunii într-un lichid cu înălțimea coloanei sale, fierberea la diferite niveluri în lichid are loc, strict vorbind, la diferite temperaturi. Doar aburul saturat deasupra suprafeței unui lichid care fierbe are o anumită temperatură. Temperatura sa este determinată numai de presiunea externă. La această temperatură se înțelege atunci când vorbim despre punctul de fierbere.
Punctele de fierbere ale diferitelor lichide sunt foarte diferite unele de altele, iar acest lucru este utilizat pe scară largă în tehnologie, de exemplu, în distilarea produselor petroliere.
Cantitatea de căldură care trebuie furnizată pentru a transforma izoterm o anumită cantitate de lichid în vapori, la o presiune externă egală cu presiunea vaporilor săi saturați, se numește căldură latentă de vaporizare. De obicei, această valoare este legată de un gram sau o molă. Cantitatea de căldură necesară pentru evaporarea izotermă a unui mol de lichid se numește molară căldură latentă vaporizare. Dacă această valoare este împărțită la greutatea moleculară, atunci se va obține căldura latentă specifică de vaporizare.
2.6 Tensiunea superficială a lichidului
Proprietatea unui lichid de a-și reduce suprafața la minimum se numește tensiune superficială. Tensiunea superficială este un fenomen de presiune moleculară asupra unui lichid, cauzat de atracția moleculelor din stratul de suprafață către moleculele din interiorul lichidului. La suprafața unui lichid, moleculele experimentează forțe care nu sunt simetrice. Pe molecula din interiorul lichidului, în medie, forța de atracție, de coeziune, acționează în medie uniform din toate părțile. Dacă suprafața lichidului crește, atunci moleculele se vor mișca împotriva acțiunii forțelor de reținere. Astfel, forța care tinde să scurteze suprafața lichidului acționează în direcția opusă forței exterioare de tracțiune de pe suprafață. Această forță se numește forță de tensiune superficială și se calculează prin formula:
 - coeficientul de tensiune superficială
- coeficientul de tensiune superficială
 (
( )
)
 - lungimea limitei suprafeţei lichidului
- lungimea limitei suprafeţei lichidului
Rețineți că lichidele care se evaporă ușor (eter, alcool) au o tensiune superficială mai mică decât lichidele nevolatile (mercur). Tensiunea superficială a hidrogenului lichid și, în special, a heliului lichid este foarte scăzută. Pentru metale lichide tensiune de suprafata dimpotrivă, este foarte mare. Diferența de tensiune superficială a lichidelor se explică prin diferența dintre forțele de coeziune ale diferitelor molecule.
Măsurătorile tensiunii superficiale a unui lichid arată că tensiunea superficială depinde nu numai de natura lichidului, ci și de temperatura acestuia: odată cu creșterea temperaturii, diferența de densitate a lichidului scade și, prin urmare, coeficientul de tensiunea superficială – scade.
Datorită tensiunii superficiale, orice volum de lichid tinde să reducă suprafața, reducând astfel energia potențială. Tensiunea superficială este una dintre forțele elastice responsabile de mișcarea ondulațiilor pe apă. În umflături, gravitația de suprafață și tensiunea superficială trage particulele de apă în jos, având tendința de a face suprafața netedă din nou.
2.7 Filme lichide
Toată lumea știe cât de ușor este să scoți spuma din apa cu săpun. Spuma este un set de bule de aer delimitate de cea mai subțire peliculă de lichid. O peliculă separată poate fi obținută cu ușurință din lichidul care formează spumă.
Aceste filme sunt foarte interesante. Ele pot fi extrem de subțiri: în părțile cele mai subțiri, grosimea lor nu depășește o sută de miimi de milimetru. În ciuda subțirii lor, sunt uneori foarte stabili. Filmul de săpun poate fi întins și deformat, iar un curent de apă poate curge prin pelicula de săpun fără a o distruge.
Cum se poate explica stabilitatea filmelor? O condiție indispensabilă pentru formarea unui film este adăugarea de substanțe solubile în acesta la un lichid pur, în plus, cele care reduc foarte mult tensiunea superficială.
În natură și tehnologie, de obicei ne întâlnim nu cu filme individuale, ci cu o colecție de filme - spumă. Puteți vedea adesea în pâraie, unde mici pâraie cad în apă calmă, o formare abundentă de spumă. În acest caz, capacitatea apei de a spuma este asociată cu prezența în apă a unei substanțe organice speciale eliberate din rădăcinile plantelor. În echipamentele de construcții se folosesc materiale care au o structură celulară, cum ar fi spuma. Astfel de materiale sunt ieftine, ușoare, nu conduc căldura și sunetul bine și sunt suficient de puternice. Pentru fabricarea lor, la soluțiile din care se formează materialele de construcție se adaugă substanțe care favorizează spumarea.
2.8 Udare
Picăturile mici de mercur plasate pe o placă de sticlă capătă o formă sferică. Acesta este rezultatul forțelor moleculare care tind să reducă suprafața lichidului. Mercurul plasat pe suprafața unui solid nu formează întotdeauna picături rotunde. Se întinde pe placa de zinc, iar suprafața totală a picăturii va crește fără îndoială.
O picătură de anilină este, de asemenea, sferică numai atunci când nu atinge peretele vasului de sticlă. De îndată ce atinge peretele, se lipește imediat de sticlă, întinzându-se de-a lungul acestuia și dobândind o suprafață comună mare.
Acest lucru se explică prin faptul că, în cazul contactului cu un corp solid, forțele de aderență ale moleculelor lichide cu moleculele corpului solid încep să joace un rol semnificativ. Comportamentul unui lichid va depinde de care este mai mare: aderența dintre moleculele lichide sau aderența unei molecule lichide la o moleculă solidă. În cazul mercurului și sticlei, forțele de coeziune dintre mercur și moleculele de sticlă sunt mici în comparație cu forțele de coeziune dintre moleculele de mercur, iar mercurul se adună într-o picătură. Un astfel de lichid se numește neumedare solid. În cazul mercurului și zincului, forțele de coeziune dintre moleculele lichidului și solidului depășesc forțele de coeziune care acționează între moleculele lichidului, iar lichidul se răspândește peste solid. În acest caz, lichidul se numește umezire solid.
De aici rezultă că, vorbind despre suprafața unui lichid, trebuie să avem în vedere nu numai suprafața în care lichidul se învecinează cu aerul, ci și suprafața care se învecinează cu alte lichide sau cu un corp solid.
În funcție de faptul că lichidul udă sau nu pereții vasului, forma suprafeței lichidului în punctul de contact cu peretele solid și gazul are o formă sau alta. În cazul neumezirii, forma suprafeței lichidului de la margine este rotundă, convexă. In cazul umezirii, lichidul de la margine ia forma concava.
2.9.Fenomene capilare.
În viață, avem de-a face adesea cu corpuri străpunse de multe canale mici (hârtie, fire, piele, diverse materiale de construcție, pământ, lemn). Intrând în contact cu apa sau cu alte lichide, astfel de corpuri le absorb adesea. Aceasta este baza pentru acțiunea unui prosop la uscarea mâinilor, acțiunea unui fitil într-o lampă cu kerosen etc. Fenomene similare pot fi observate și în tuburile înguste de sticlă. Tuburile înguste se numesc capilare sau păr.
Când un astfel de tub este scufundat cu un capăt într-un vas larg într-un vas larg, se întâmplă următoarele: dacă lichidul udă pereții tubului, atunci se va ridica peste nivelul lichidului din vas și, în plus, mai înalt, cu atât tubul este mai îngust; dacă lichidul nu udă pereții, atunci, dimpotrivă, nivelul lichidului din tub este setat mai jos decât într-un vas larg. Se numește modificarea înălțimii nivelului lichidului în tuburi înguste sau goluri capilaritate.În sens larg, fenomenele capilare sunt înțelese ca toate fenomenele datorate existenței tensiunii superficiale.
Înălțimea creșterii lichidului în tuburile capilare depinde de raza canalului din tub, de tensiunea superficială și de densitatea lichidului. Între lichidul din capilar și din vasul larg se stabilește o astfel de diferență de nivel h astfel încât presiunea hidrostatică gh echilibrează presiunea capilară:
unde este tensiunea superficială a lichidului
R este raza capilară.
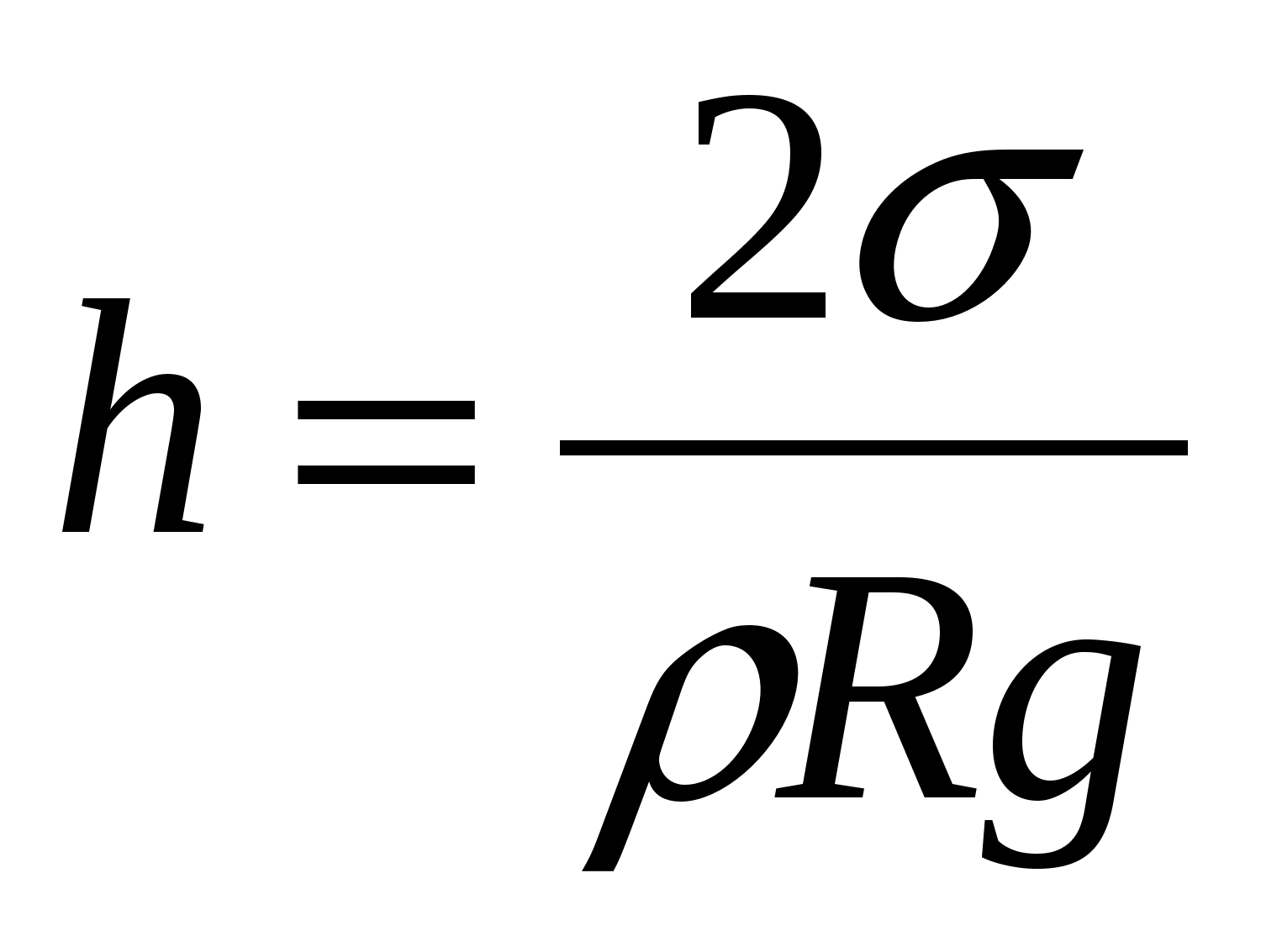
Înălțimea creșterii unui lichid într-un capilar este proporțională cu tensiunea superficială a acestuia și invers proporțională cu raza canalului capilar și cu densitatea lichidului (legea lui Jurin)
2.10.Curentul electric în lichide.
Lichidele pure nu conduc curentul electric, adică sunt dielectrice, deoarece fiecare dintre moleculele de lichid este neutră și nu se mișcă într-un câmp electric.
Fluidele care conduc electricitatea se numesc electroliți. Curentul electric din lichide se formează ca urmare a mișcării direcționate a ionilor de sare. Fenomenul de eliberare a unei substanțe pe electrozi atunci când un curent trece prin electrolit se numește electroliză. Pe un electrod încărcat negativ catod există o reducere electrochimică a particulelor (atomi, molecule, cationi), iar pe un electrod încărcat pozitiv - anod are loc o oxidare electrochimică a particulelor (atomi, molecule, anioni). În 1832, Faraday a descoperit că masa M a substanței eliberate pe electrod este direct proporțională cu sarcina electrică Q care a trecut prin electrolit:
dacă se trece prin electrolit un timp t DC. cu curentul I.
Coeficientul de proporționalitate k se numește echivalentul electrochimic al unei substanțe. Este numeric egal cu masa substanței eliberată în timpul trecerii unei singure sarcini electrice prin electrolit și depinde de natura chimică a substanței.
A doua lege a lui Faraday spune: Echivalenții electrochimici ai diferitelor substanțe sunt tratați ca echivalenți chimici ai acestora. Echivalentul chimic al unui ion este raportul dintre masa molară A a ionului și valența sa z. Prin urmare, echivalentul electrochimic este:
![]() ,
,
unde F este constanta lui Faraday
Fenomenul electrolizei este utilizat pe scară largă în industria modernă. În special, electroliza este una dintre metodele de producție industrială a hidrogenului, precum și hidroxid de sodiu, clor, compuși organoclorați, dioxid de mangan și peroxid de hidrogen. Un număr mare de metale sunt extrase din minereuri și prelucrate prin electroliză (electroextracție, electrorafinare). Electroliza este utilizată pentru tratarea apelor uzate (procese de electrocoagulare, electroextracție, electroflotație).
3.Concluzie
Astfel, un lichid este o stare intermediară a materiei între starea solidă și starea gazoasă. Acest lucru face ca lichidele să aibă proprietăți caracteristice atât pentru starea solidă, cât și pentru cea gazoasă. Un exemplu izbitor al stării materiei, combinând proprietățile lichidului și stări solide, sunt cristale lichide utilizate pe scară largă în industrie și tehnologie (afișaje cu cristale lichide). În acest sens, descrierea stării unui lichid necesită sinteza metodelor matematice utilizate pentru descrierea stărilor solide și gazoase, ceea ce complică și îngreunează descrierea minuțioasă a multor fenomene fizice și chimice.
În prezent, multe proprietăți ale lichidelor sunt utilizate pe scară largă în industrie și tehnologie. De exemplu, proprietatea unui lichid de a crește presiunea în întregul său volum este utilizată în mașinile de ridicare acționate hidraulic. Dar este, de asemenea, necesar un studiu profund al teoriei stării lichide a materiei. Astfel, relevanța studierii debitului unui lichid în fierbere este asociată cu cerințele energiei nucleare, cu problema securității centralelor electrice.
Interes deosebit pentru studiul proceselor fizico-chimice în stare lichida datorită faptului că noi înșine suntem 90% apă, cel mai comun lichid de pe Pământ. Și toate procesele vitale la animal și floră apar într-un lichid, și anume apă. Prin urmare, studiul acestei stări a materiei este important și relevant pentru toți oamenii.
Bibliografie:
I.V. Savelyev „Curs de fizică generală”
Cl.E. Swartz „Fizica extraordinară a fenomenelor obișnuite”
Manual elementar de fizică, editat de academicianul G.S. Landsberg
T.I. Trofimov „Cursul de fizică”
EU SI. Perelman „Fizica distractivă”
Aranjarea moleculelor în solide. La solide, distanțele dintre molecule sunt egale cu dimensiunea moleculelor, astfel încât solidele își păstrează forma. Moleculele sunt dispuse într-o anumită ordine, numită rețea cristalină, astfel încât în condiții normale, solidele își păstrează volumul.
Poza 5 din prezentarea „3 stări ale materiei” la lecții de fizică pe tema " fenomene termice»Dimensiuni: 960 x 720 pixeli, format: jpg. Pentru a descărca o imagine gratuit lectie de fizica, faceți clic dreapta pe imagine și faceți clic pe „Salvare imagine ca...”. Pentru a afișa imagini în lecție, puteți descărca gratuit și prezentarea „3 stări ale materiei.ppt” cu toate imaginile într-o arhivă zip. Dimensiunea arhivei este de 2714 KB.
Descărcați prezentareafenomene termice
„Difuzie în natură” – Folosit pe scară largă în industria alimentară la conservarea legumelor și fructelor. La topirea oțelului. Un exemplu de difuzie este amestecul de gaze sau lichide. Ce este difuzia? Difuzie în respirație. Fenomenul de difuzie are manifestări importante în natură, este folosit în știință și în industrie.
„Schimbarea stărilor agregate ale materiei” - Transformări agregate ale materiei. Căldura specifică vaporizare. Temperatura de fierbere. Fierbere. Graficul temperaturii modificărilor stărilor agregate ale apei. Temperatura de topire si cristalizare. conditii de vaporizare. transformări agregate. Vaporizare. Calculul cantității de căldură. procesul de topire si solidificare.
„3 State of Matter” - Rezolvați cuvintele încrucișate. Cristalizare. Aranjarea moleculelor în solide. Exemple de proces. state. Substanţă. Proprietățile gazelor. Vaporizare. Întrebări pentru cuvinte încrucișate. Proprietățile lichidelor. Aranjarea moleculelor în lichide. Gheaţă. Proprietățile corpurilor solide. Condensare. Caracterul mișcării și interacțiunii particulelor.
„Difuzia de substanțe” - Frunze parfumate. Culoare inchisa. Proverbe. Thales din Milet. Heraclit. Rezolvăm probleme. Oamenii de știință Grecia antică. Difuzie în tehnologie și natură. Sarcini pentru iubitorii de biologie. Difuzie. Fenomenul difuziei. Democrit. Observatii. Difuzia în gaze.
„Fenomene termice în timpul dizolvării” - D.I. Mendeleev. Briefing. Dizolvarea permanganatului de potasiu în apă. proces exotermic. Verifică-ți colegul de cameră. Vă dorim succes în cunoașterea ulterioară a legilor fizicii și chimiei. viteza de difuzie. Ceea ce se numește mișcare termică. Pătrunderea reciprocă a moleculelor. Valoarea solutiilor. Sarcini practice.
„Interacțiunea moleculelor” - Este posibil să conectați două bucăți dintr-un cui de fier? Atracția ține particulele împreună. Varianta I Amestecuri naturale nu includ: a) argila; b) ciment; c) sol. substante gazoase. Varianta II Un amestec artificial este: a) argila; b) ciment; c) sol. Distanța dintre moleculele de gaz mai multe dimensiuni moleculele în sine.
Total la subiect 23 prezentari






