Spesifik buhar entalpisi. Petrol ve gazın büyük ansiklopedisi
Sayfa 1
Yoğunluk doymuş buharlar aynı sıcaklıkta farklı maddeler için keskin bir şekilde farklıdır. Oda sıcaklığında, suyun doymuş buhar yoğunluğu 13 mm'dir ve doymuş cıva buharının yoğunluğu sadece 0,005 mm'dir.
ile dengede doymuş buharın yoğunluğu sağlam, artan sıcaklıkla artar.
Sıcaklığa bağlı olarak ürünün doymuş buharlarının yoğunluğu tablolardan belirlenir.
Doymuş buharın yoğunluğunun değeri yalnızca sıcaklığa (tablo) bağlıdır ve işgal edilen hacme bağlı değildir.
Ayırıcıda aşırı basınçta doymuş buhar yoğunluğunun değeri 0 7 kgf / szh2 tablolardan alınmıştır, ayırıcının buhar boşluğunun izin verilen stresi önerilen değerler dahilinde ortalamadır. 0 7 m3 hacimli bir ayırıcı, 600 mm çapında Biysk kazan fabrikası kabul edildi - 1 adet.
Sıvının yüzeyine x ekseni yönünde doymuş buharın basıncı ve yoğunluğu değişmezken, sıvıya doğrudan bitişik sonsuz ince bir buhar hecesinde, yoğuşma nedeniyle molekül sayısı her zaman azalır. . Bu kaybı telafi etmek için, buhar parçacıklarının sıvıya molar veya moleküler bir hareketi olmalıdır, ancak her ikisi de ancak x ekseni yönünde yoğunluk veya basınçta bir fark varsa mümkündür, ancak bunların hiçbiri mümkün değildir. mümkün.
Doymuş buharın yoğunluğu sıcaklığa bağlı mıdır?
Sıvı veya katı bir fazdan buhar oluşturma işlemine buharlaşma denir. Buhar ters yönde oluşursa bu işleme yoğuşma denir.
Çift olarak görülebilir Ideal gaz eğer şartlar içindeyse alçak basınç ve Yüksek sıcaklık. 100 vakanın neredeyse 99'unda, "buhar" kelimesini kullanırken su buharını anlıyorlar veya kastediyorlar, diğer tüm durumlarda genellikle bir açıklama var.
İki tür buhar durumu vardır kimyasal bileşikler, safsızlık bileşenleri içermeyen:
- doymamış buhar, yani. henüz sıvı ile dinamik dengede olmayan buhar. Sıvının yüzeyi ise doymamış buhar, daha sonra buharlaştırma işlemi yoğuşma işlemine üstün gelir. Bu nedenle, bu durumda kaptaki sıvı hacmi yavaş yavaş azalacaktır.
- doymuş buhar, yani. bir sıvı ile dinamik dengede olan buhar, bu basitçe şu anlama gelir: süreçlerin hiçbiri - buharlaşma veya yoğunlaşma - biri diğerine üstün gelmez. Hacim sabitse ve sıcaklık iki durumda da aynıysa, verilen kapta hacim olmayacaktır. daha fazla buhar orijinalinden daha. Sıvının üzerindeki buhar bir piston yardımıyla sıkıştırılırsa bu denge bozulabilir: buharlaşma üzerinde yoğunlaşma hakim olacaktır. Bu sürecin geçici bir olgu olduğunu ve dinamik denge yeniden kurulana kadar devam edeceğini hatırlamakta fayda var.
Buhar ve sıvı arasındaki dinamik dengenin kurulması için gereken süre, moleküller arası etkileşim kuvvetlerindeki farkla ilişkili olan buharın yoğunluğuna önemli ölçüde bağlıdır.
Yoğunluktaki değişimin yanı sıra su buharının (doymuş) diğer fiziksel özelliklerinin sıcaklığa bağımlılığı tabloda verilmiştir:
Problem çözme örnekleri
ÖRNEK 1
| Egzersiz yapmak | Oksijen için a) yoğunluğunu hesaplayın; b) nitrojen; c) aşağıdaki gazların hava yoluyla: bor florür BF 3 ve nitrojen oksit (V). |
| Çözüm |
M r (BF 3) = A r (B) + 3 × A r (F) = 11 + 3 × 19 = 11 + 57 = 68. D hava (BF 3) = M r (BF 3) / M r (hava) = 68/29 = 2.345; D O2 (BF 3) \u003d M r (BF 3) / M r (O 2) \u003d 68 / 32 \u003d 0.875; D N2 (BF 3) = M r (BF 3) / M r (N 2) = 68 / 28 = 1. M r (N 2 O 5) = 2 × A r (N) + 5 × A r (O) = 2 × 14 + 5 × 16 = 28 + 80 = 108. D hava (N 2 O 5) \u003d M r (N 2 O 5) / M r (hava) \u003d 108/29 \u003d 3.724; D O2 (N 2 O 5) \u003d M r (N 2 O 5) / M r (O 2) \u003d 108 / 32 \u003d 3.375; D N2 (N 2 O 5) \u003d M r (N 2 O 5) / M r (N 2) \u003d 108 / 28 \u003d 3.857. |
| Cevap | Bor florürün hava, oksijen ve nitrojen içindeki yoğunlukları sırasıyla 2.345, 0.875 ve 1'dir; hava, oksijen ve nitrojen içindeki nitrik oksidin (V) yoğunlukları sırasıyla 3.724, 3.375 ve 3.857'dir. |
ÖRNEK 2
| Egzersiz yapmak | Oksijen için a) yoğunluğunu hesaplayın; b) nitrojen; c) hava yoluyla şu gazlar: karbon monoksit (IV) ve hidrojen bromür HBr. |
| Çözüm | Bir gazın diğerinden göreli yoğunluğunu hesaplamak için, birinci gazın göreli molekül ağırlığını ikinci gazın göreli molekül ağırlığına bölmek gerekir. Havanın bağıl moleküler ağırlığı 29'a eşittir (havadaki azot, oksijen ve diğer gazların içeriği dikkate alınarak). Havanın bir gaz karışımı olması nedeniyle "nispi hava moleküler ağırlığı" kavramının şartlı olarak kullanıldığına dikkat edilmelidir. M r (HBr) = Ar (H) + A r (Br) = 1 + 80 = 81. D hava (HBr) \u003d M r (HBr) / M r (hava) \u003d 81 / 29 \u003d 2.7931; D O2 (HBr) \u003d M r (HBr) / M r (O 2) \u003d 81 / 32 \u003d 2.5313; D N2 (HBr) \u003d M r (HBr) / M r (N 2) \u003d 81 / 28 \u003d 2.8929. M r (O 2) = 2 × A r (O) = 2 × 16 = 32. M r (N 2) = 2 × A r (N) = 2 × 14 = 28. M r (CO 2) \u003d A r (C) + 2 × A r (O) \u003d 12 + 2 × 16 \u003d 12 + 32 \u003d 44. D hava (CO 2) \u003d M r (CO 2) / M r (hava) \u003d 44 / 29 \u003d 1.5172; D O2 (CO 2) \u003d M r (CO 2) / M r (O 2) \u003d 44 / 32 \u003d 1.375; D H2 (CO 2) \u003d M r (CO 2) / M r (N 2) \u003d 44 / 28 \u003d 1.5714. |
| Cevap | Hidrojen bromürün hava, oksijen ve nitrojen içindeki yoğunlukları sırasıyla 2.7931, 2.5313 ve 2.8929'dur; karbon monoksitin (IV) hava, oksijen ve nitrojen içindeki yoğunlukları sırasıyla 1.5172, 1.375 ve 1.5714'tür. |
Sıcaklık arttıkça doymuş buhar yoğunluğunun arttığını daha önce belirtmiştik (bkz. §6.3). Buharıyla dengede olan bir sıvının yoğunluğu, aksine, ısıtıldığında genleşmesi nedeniyle azalır.
Tablo 2, farklı sıcaklıklar için suyun ve doymuş buharın yoğunluk değerlerini göstermektedir.
Tablo 2
Bir şekilde bir sıvının yoğunluğunun ve doymuş buharının sıcaklığa bağımlılığı için eğriler çizersek, sıvı için eğri aşağı inecek ve buhar için yukarı çıkacaktır (Şekil 6.6). Kritik sıcaklıkta her iki eğri birleşir, yani sıvı yoğunluğu buhar yoğunluğuna eşit olur. Sıvı ve buhar arasındaki ayrım ortadan kalkar.
Gaz ve buhar
"Gaz" ve "buhar" kelimelerini birçok kez kullandık. Bu terimler, buharın bir sıvıya dönüştürülebileceğine inanılan, ancak bir gazın olamayacağı bir zamanda ortaya çıktı. Tüm gazlar yoğuşturulduktan sonra (bkz. § 6.7), bu tür ikili terminolojinin temeli yoktur. Buhar ve gaz bir ve aynıdır, aralarında temel bir fark yoktur. İnsanlar bir sıvının buharından bahsettiğinde, genellikle sıcaklığının kritik olandan daha düşük olduğu ve sıkıştırılarak sıvıya dönüştürülebileceği anlamına gelir. Su gazından değil su buharından, doymuş gazdan değil doymuş buhardan vb. söz etmemiz yalnızca alışkanlıktandır.
Kritik durumun deneysel çalışması
Kritik durum çalışması üzerine deneyler, 1863'te Rus bilim adamı MP Avenarius tarafından gerçekleştirildi. Kritik durumu gözlemleyebileceğiniz cihaz (Avenarius cihazı) bir hava banyosundan (Şekil 6.7) ve banyonun içinde sıvı eter bulunan sızdırmaz bir cam tüpten (ampul) oluşur. Ampulün hacmi (kapasitesi), tüpe dökülen kritik eter hacmine eşittir. Ampuldeki eterin üzerindeki boşluk, doymuş eter buharı ile doldurulur.
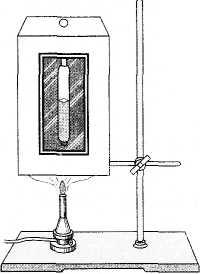
Bir gaz brülörü veya başka bir ısıtıcı kullanarak hava banyosu ısıtılır. Eterin durumu, cihazdaki bir cam pencereden gözlemlenir.
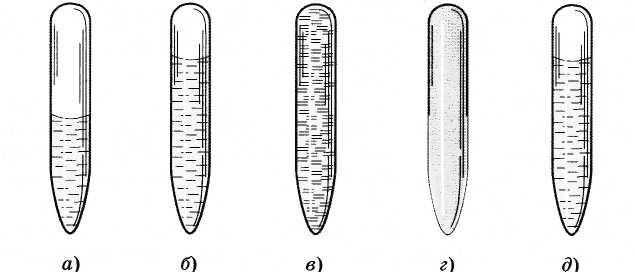
Oda sıcaklığında sıvı ve buhar arasındaki sınırı açıkça görebilirsiniz (Şekil 6.8, a). Kritik sıcaklığa yaklaşıldığında, sıvı eterin hacmi artar ve sıvı-buhar arayüzü zayıf bir şekilde ifade edilir, kararsız hale gelir (Şekil 6.8, b).
yaklaşırken kritik durum aralarındaki sınır tamamen kaybolur (Şekil 6.8, içinde).
Soğuduğunda, tüm tüpü dolduran yoğun bir sis belirir (Şekil 6.8, G). Bunlar sıvı damlacıklardır. Sonra birleşirler ve yine sıvı ile buhar arasında bir arayüz oluşur (Şekil 6.8, e).
Nispeten düşük bir kritik basınca (yaklaşık 36 atm) sahip olduğundan deney için eter seçilmiştir. Kritik sıcaklığı da düşüktür: 194 °C.
Gazı sıkıştırırsanız, sıcaklığını kritik olanın üzerinde tutarak (bkz. Şekil 6.4, izoterm) T3), ve daha önce olduğu gibi, çok büyük hacimlerle başlayın, daha sonra hacimdeki bir azalma, ideal bir gazın durum denklemine göre basınçta bir artışa yol açacaktır. Ancak, belirli bir basınçta kritik sıcaklığın altındaki bir sıcaklıkta buhar yoğuşması meydana gelirse, artık kapta sıvı oluşumu gözlemlenmeyecektir. Kritik sıcaklığın üzerinde bir gaz herhangi bir basınçta sıvıya dönüşemez.
Kritik sıcaklık kavramının ana anlamı budur.






