Hidrojen atomu Balmer formülünün emisyon spektrumu. Hidrojen atomunun spektrumunu incelemek
Atomların en basiti olan hidrojen atomu, Bohr'un teorisi için bir tür test nesnesiydi. Teori oluşturulduğunda, deneysel olarak iyi çalışılmıştı. Tek bir elektron içerdiği biliniyordu. Bir atomun çekirdeği proton - yükü elektronun yüküne mutlak değerde eşit olan ve kütlesi elektronun kütlesinin 1836 katı olan pozitif yüklü bir parçacık. Ayrıca erken XIX yüzyılda ayrık keşfedildi spektral çizgiler hidrojen atomunun görünür radyasyon bölgesinde (sözde çizgi spektrumu ). Daha sonra, çizgi spektrumunun dalga boylarının (veya frekanslarının) uyduğu modeller nicel olarak iyi bir şekilde incelenmiştir (I. Balmer, 1885). Spektrumun görünür kısmındaki hidrojen atomunun spektral çizgileri kümesi olarak adlandırıldı. Balmer serisi . Daha sonra, spektrumun ultraviyole ve kızılötesi kısımlarında benzer spektral çizgi serileri bulundu. 1890'da Johannes Rydberg, spektral çizgilerin frekansları için ampirik bir formül türetmiştir:
Bu, iki alüminyum atomu ve üç oksijen atomundan oluşan bir bileşiğin oluşumuna yol açabilir. Bir bileşik oluşturmak için iki oksijen atomu ile birleşecektir. Periyodik tablo o zamanlar büyük bir başarı olmasına rağmen, bu tabloya uymayan yeni elementlerin keşfi, başka bir sınıflandırma sistemi arayışına yol açtı.
Ayrıca Mendeleev, tabloda yeri olmayan lantan, iterbiyum, erbiyum, terbiyum, praseodimyum ve neodimyum gibi bazı nadir toprak elementlerini de biliyordu. Atom numarasının, özelliklerinin periyodikliğini gösteren elementlerin bir özelliği olduğu keşfedildiğinde sorun çözüldü. Günümüzde elementler değerlerine göre soldan sağa ve yukarıdan aşağıya doğru sıralanmıştır. atom numaraları, yani atomlarının çekirdeğindeki proton sayısı ile.
Balmer serisi için m = 2, n= 3, 4, 5, ... . Ultraviyole serisi için (Lyman serisi) m = 1, n= 2, 3, 4, ... . Devamlı R bu formülde denir Rydberg sabiti . sayısal değeri R= 3.29 10 15 Hz. Bohr'dan önce, çizgi spektrumlarının ortaya çıkma mekanizması ve spektral hidrojen çizgilerinin (ve bir dizi başka atomun) formüllerinde yer alan tam sayıların anlamı anlaşılmaz kaldı.
Aynı sıraya aynı sayıda elektron katmanına sahip olan ve özellikleri giderek değişen elementler yerleştirilirken, son katmanda aynı sayıda elektrona sahip olan ve dolayısıyla benzer özelliklere sahip olan elementler aynı sütuna yerleştirilir. Birinci periyot ile ikinci ve üçüncü periyot kısa periyotlar olarak adlandırılır; sekiz elementli dördüncü ve beşinci uzun ve 32 elementli altıncı ve yedinci çok uzun. Son ikisi, geçiş metallerine ek olarak, nadir toprak elementleridir.
Bohr'un varsayımları, yeni bir bilimin - atomun kuantum fiziğinin - gelişme yönünü belirledi. Ancak, durağan durumların (yörüngelerin) parametrelerini ve karşılık gelen enerji değerlerini belirlemek için bir reçete içermiyorlardı. En.
Hidrojen atomunun durağan durumlarının enerjilerinin deneysel olarak tutarlı değerlerine yol açan niceleme kuralı Bohr tarafından tahmin edildi. Çekirdek etrafında dönen bir elektronun açısal momentumunun yalnızca Planck sabitinin katları olan ayrık değerler alabileceğini öne sürdü. Dairesel yörüngeler için Bohr niceleme kuralı şu şekilde yazılır:
Periyodik sistem elemanlarının özelliklerindeki desenler. Elementlerin artan atom numarası sırasına göre sınıflandırılması, diğer iki kriterin kullanılmasını içerir: atom kütlesi ve özelliklerde benzerlik. Bu elemanlar büyüklüklerine göre küçükten büyüğe doğru sıralanırsa atom kütlesi, argin, modern periyodik tabloda potasyumun kapladığı konumda görünmelidir. Ancak argon soy gazdır ve oldukça reaktif metaller olan lityum ve sodyum grubundan olamaz.
Atom numarasına göre sıralanırlarsa, argon 18 ve potasyum 19'dur, yani her biri kendi grubundadır. Elementlerin özelliklerinin benzerliğinin nedeni, tam olarak atomlarındaki elektronların sayısı ve dağılımında yatmaktadır. Atomları son katmanlarında veya enerji seviyelerinde aynı sayıda elektrona sahip olan elementler benzer özelliklere sahiptir. Kimyasal özellikler ve bu nedenle periyodik tablo ile aynı gruptadır.
![]()
Burada m e - elektron kütlesi, υ - hızı, rn sabit dairesel yörüngenin yarıçapıdır. Bohr'un kuantizasyon kuralı, bir hidrojen atomundaki bir elektronun durağan yörüngelerinin yarıçaplarını hesaplamayı ve enerji değerlerini belirlemeyi mümkün kılar. Bir yarıçaplı dairesel yörüngede dönen bir elektronun hızı r Newton'un ikinci yasasından aşağıdaki gibi çekirdeğin Coulomb alanında, ilişki tarafından belirlenir
İlk 10 elementin elektronik dağılımı aşağıdaki gibidir. Siz ilerledikçe elektronik seviyelerin veya seviyelerin tamamlandığını lütfen unutmayın. belirli bir süre. 1. ve 2. periyotların son elementleri olan Helyum ve Neon, tam elektron katmanlarına sahiptir.
Tüm alkalilerin son seviyede tek bir elektronu vardır. Elektronik konfigürasyonu. Aynı gruptaki tüm elemanlar son seviyede aynı konfigürasyona sahiptir. Hepsi benzer özelliklere sahiptir. Genel olarak, ister aynı ister farklı olsun, maddeyi oluşturan atomlar birleştirilir, ancak doğada bir grubun elementleri gibi izole atomlardan oluşan maddeler de vardır.

nerede e - temel ücret, ε 0 - elektrik sabiti. Elektron hızı υ ve sabit yörünge yarıçapı rn Bohr kuantizasyon kuralı ile ilişkilidir. Sabit dairesel yörüngelerin yarıçaplarının şu ifadeyle belirlendiği sonucu çıkar.
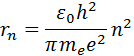
Grup 18 elementlerinin özelliklerinden biri, sadece iki tanesine sahip olan helyum hariç, hepsinin dış katmanında sekiz elektrona sahip olmalarıdır. Bu yapı en kararlı olanıdır, böylece bu elementlerin atomları genellikle etkileşime girmez. kimyasal reaksiyonlar. Bu nedenle, asil veya inert gazlar takma adını alırlar. Elementlerin geri kalanının son katmanlarında 8 elektrona sahip olmaya çalışma şekli, kimyasal davranışlarını haklı çıkarır.
Bu nedenle, atomların bir araya gelme eğiliminde olduğu sonucuna varabiliriz. kimyasal maddeler orijinal atomlardan daha kararsız enerjiye sahip belirli özelliklere sahip. Bu tür bağlantıya kimyasal bağlanma denir. Kimyasal bağ, atomları farklı atom kümelerinde tutan çekici bir kuvvettir.
Çekirdeğe en yakın yörünge, değere karşılık gelir. n= 1. İlk yörüngenin yarıçapı olarak adlandırılan Bohr yarıçapı , eşittir

Sonraki yörüngelerin yarıçapları orantılı olarak artar n 2 .
Tamamlamak mekanik enerji E bir atom çekirdeği ve yarıçaplı sabit bir dairesel yörüngede dolaşan bir elektron sistemi rn, eşittir
Helyum atomunun son bir tam katmanı vardır, bu da ona büyük bir stabilite sağlar. Buna karşılık, son ve tek katmanında bir elektrona sahip olan hidrojen atomu çok daha az kararlıdır. Ancak, iki hidrojen atomu elektronlarını paylaşarak elektron katmanlarını birbirine bağlayacak kadar birbirine yakınsa bu kararlılık artar. Böyle bir bağlantı mümkündür çünkü atomun dış bölgesinin çoğu boş uzaydır. Diyagram, bu koşullar altında bir dizi elektrostatik kuvvetin ortaya çıktığını göstermektedir: iki çekirdek aynı elektrik şarjı ve birbirini iter, iki elektron gibi; bununla birlikte, çekirdekler ve elektronlar arasında karşılıklı bir çekim vardır ve dört parçacık, çekici kuvvetlerin itme kuvvetlerine tam olarak karşı koyacağı şekilde düzenlenmiştir.

bu not alınmalı E p< 0, так как между электроном и ядром действуют силы притяжения. Подставляя в эту формулу выражения для υ 2 и rn, şunu elde ederiz:

tamsayı n= 1, 2, 3, ... atomun kuantum fiziğinde denir Ana kuantum sayısı .
Bu olduğunda, bir Kimyasal bağ. Kararlılıklarını diğer atomlarla paylaşarak elde eden atomlar, bir kovalent bağla bağlanır. Bir çift hidrojen atomu, normal sıcaklıkta hidrojenin en kararlı şeklidir.
Hidrojen gibi iki atom içeren moleküllere iki atomlu moleküller denir. İkiden fazla atom içeriyorlarsa çok atomlu olarak adlandırılırlar. Benzer şekilde iki klor atomu eklenir. Tek bir atomun son katmanında yedi elektron bulunur. İki klor atomu birbirine yaklaşıp elektron katmanlarını bağladığında bir çift elektronları olur. Böylece, her atom sekiz elektronla çevrili olarak kabul edilebilir. İki klor atomu bir molekül olarak bağlı kalır.
Bohr'un ikinci varsayımına göre, bir elektronun enerji ile sabit bir yörüngeden geçişi sırasında En enerjili başka bir sabit yörüngeye Em < En atom bir kuantum ışık yayar, frekans ν nm hangi Δ eşittir Enm / h:
![]()
Bu formül, sabiti ayarlarsak, hidrojen atomunun spektral serisi için Rydberg ampirik formülüyle tam olarak örtüşür. R eşit
daha bir çok gaz var kimyasal elementler normal sıcaklıkta oksijen, azot, flor gibi biatomik moleküller şeklinde meydana gelen. Bir kovalent bağın temsili. Kovalent bağ, iki çekirdeğin aralarındaki elektron çiftlerine uyguladığı çekim kuvvetidir: tekli bağda bir çift, ikili bağda iki çift ve üçlü bağda üç çift. Bir kovalent bağ birkaç şekilde temsil edilebilir; örneğin, bir florür molekülündeki iki atom arasındaki bir bağ iki şekilde belirtilebilir.
Sayısal Değerleri Değiştirme m e, e, ε 0 ve h bu formüle sonucu verir
ampirik değerle çok iyi uyuşan R. Pirinç. 6.3.1, bir elektronun yüksek durağan yörüngelerden daha düşük yörüngelere geçişi sırasında bir hidrojen atomunun radyasyonunda spektral serilerin oluşumunu gösterir.
Şek. 6.3.2. hidrojen atomunun enerji seviyelerinin bir diyagramı gösterilmiş ve farklı spektral serilere karşılık gelen geçişler belirtilmiştir.
Kovalent elementlerin özellikleri. Erime ve kaynama noktaları düşüktür. Serbest elektronlar olmadığı, ancak bulundukları için bu elementler iletmezler. elektrik. Kovalent kristallerde atomlar yalnızca üç boyutlu bir ağ oluşturan kovalent bağlarla bir arada tutulur.
Elmas sadece karbon atomları içerir ve bu nedenle bu elementin bulunduğu formlardan biridir. Karbon atomu son katmanda son dört elektrona sahiptir ve soy gaz yapısına sahip olmak için dört tane daha eksiktir ve bu elektronların her birini diğer dört karbon atomuyla paylaşarak elde edilebilir.
Bohr'un hidrojen atomu teorisi ile deney arasındaki mükemmel uyum, geçerliliği lehine önemli bir argüman olarak hizmet etti. Ancak, bu teoriyi daha karmaşık atomlara uygulama girişimleri başarılı olmamıştır. Bohr, nicemleme kuralının fiziksel bir yorumunu veremedi. Bu, on yıl sonra de Broglie tarafından dalga özellikleri aa parçacıklar. De Broglie, hidrojen atomundaki her yörüngenin, atomun çekirdeği etrafında bir daire içinde yayılan bir dalgaya karşılık geldiğini öne sürdü. Sabit bir yörünge, dalga çekirdeğin etrafındaki her bir dönüşten sonra sürekli olarak kendini tekrarladığında meydana gelir. Başka bir deyişle, durağan bir yörünge, yörüngenin uzunluğu boyunca dairesel duran bir de Broglie dalgasına karşılık gelir (Şekil 6.3.3). Bu fenomen, sabit uçlu bir ipte duran dalgaların durağan resmine çok benzer.
Böylece istikrarlı bir elektronik yapı, son katmanda dört çift elektron ile neon yapısına benzer. İyot maddesi, kristal veya üç boyutlu bir ağ oluşturan moleküller arası kuvvetlerle bağlanan iyot molekülleri tarafından oluşturulur. Moleküller arasındaki bu çekici kuvvetler zayıf olduğu için bu kristaller kolayca yok edilebilir.
Karbon yapı diyagramında sadece merkezi elemanın son katmana sahip olduğu görülmektedir. Bu, diğer dört atomun her birinin sırayla diğer dört atomla kovalent bağlar oluşturmasını ve böylece elektronik katmanlarını doldurmasını sağlar. Her atom bunu yaparken dev bir ağ oluşur.
sabit durumda kuantum hali de Broglie'nin fikrine göre, bir hidrojen atomunun bir tamsayı dalga boyu λ, yani
Bu bağıntının yerine de Broglie dalga boyu λ = h / p, nerede p = m e υ - elektron momentumu, şunu elde ederiz:
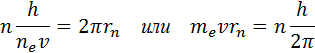
Elmasta karbon atomları, her yönde son derece kararlı olan üç boyutlu bir ağ şeklindedir. Elmas en çok katılar bilinen ve çok katı halde kalan yüksek sıcaklıklar. Kovalent atomik kristallerin özellikleri.
Bunların tüm özellikleri katı kristaller onları oluşturan parçacıklar arasında çok güçlü kuvvetlerin kurulduğunu gösterir. Teorem bize bu kuvvetlerin atomları arasındaki kovalent bağlardan kaynaklandığını söyler. Elmas çok serttir, erime ve kaynama noktaları çok yüksektir. kovalent bağlar Ağı oluşturan karbon atomları arasında o kadar güçlüdür ki yapıyı yok etmek için önemli miktarda enerji gerekir. Serbest elektronları olmadığı için elektriği iletmez.
Bu nedenle Bohr kuantizasyon kuralı elektronların dalga özellikleri ile ilgilidir.
Bohr'un teorisinin hidrojen atomunun incelenmesindeki spektral kalıpları açıklamadaki başarısı şaşırtıcıydı. Atomların kuantum sistemleri olduğu ortaya çıktı ve enerji seviyeleri atomların durağan durumları ayrıktır. Bohr'un teorisinin yaratılmasıyla hemen hemen aynı anda, atomun durağan durumlarının varlığı ve enerji kuantizasyonu için doğrudan deneysel kanıtlar elde edildi. Atomun enerji durumlarının ayrıklığı, 1913'te, elektronların cıva atomlarıyla çarpışmasının incelendiği D. Frank ve G. Hertz deneyinde gösterildi. Elektronların enerjisi 4.9 eV'den azsa, cıva atomlarıyla çarpışmalarının kesinlikle elastik etki yasasına göre gerçekleştiği ortaya çıktı. Elektron enerjisi 4,9 eV'ye eşitse, cıva atomlarıyla çarpışma esnek olmayan bir etkinin karakterini kazanır, yani hareketsiz cıva atomlarıyla çarpışmanın bir sonucu olarak, elektronlar kinetik enerjilerini tamamen kaybeder. Bu, cıva atomlarının elektronun enerjisini emdiği ve temel durumdan ilk uyarılmış duruma geçtiği anlamına gelir.
İki atomu yaklaştırırken, aşağıdaki durumlar meydana gelebilir. Elektronlar ve çekirdekler arasında yaklaştıkça artan itici kuvvetler vardır ve iki helyum atomunu birbirine yaklaştırmaya çalışmak gibi hiçbir zaman bir bağ oluşmaz. Bir atomun çekirdeği ile diğerinin elektronları arasında çekim kuvvetleri ortaya çıkar ve bunun tersi de geçerlidir. Bu durumda sistemin enerjisi belli bir mesafe kadar azalır; sonra iki atom arasında bir bağ oluşur.
Bağ oluşumu sürecinde, enerji her zaman serbest bırakılır. Bu nedenle, bir elementi veya bileşiği oluşturan atomları ayırmak için, bağ oluşumu sırasında açığa çıkan enerjiye eşit veya daha büyük bir enerji sağlamak gerekir. Grafit, doğada bulunan başka bir karbon şeklidir. Bu durumda, karbon atomları altı üyeli halkalar halinde düzenlenmiştir. Her karbon atomu diğer üç atoma kovalent olarak bağlanmıştır. Böylece elektronlar hareket özgürlüğü bırakır ve böylece grafit elektriği iletir.
|
E 2 - E 1 = 4,9 eV. |
Bohr kavramına göre, bir atomun ters spontane geçişi sırasında, cıva belirli bir frekansta kuanta yaymalıdır.
![]()
Cıva atomlarının emisyon spektrumunun ultraviyole kısmında böyle bir frekansa sahip bir spektral çizgi tespit edildi.
Birbirine hafifçe yapışık ve birbiri üzerinde kayan slipler halinde sunulduğu için, parlak, yumuşak ve dokunulduğunda renksiz siyah bir maddedir. Elektriği iletme özelliğinden dolayı elektrot yapımında, bilgisayarlar için kalem milleri ve yazıcı şeritleri yapımında kullanılır.
Metaller, belirli bir bağ tipinin varlığını artıran diğer maddelerden çok farklı özelliklere ve onları mümkün kılan özelliklere sahiptir. Metalik elementler genellikle dış katmanlarında 1, 2 veya 3 elektron içeren atomlara sahiptir. Bu elektronlar zayıf bir şekilde bağlıdır. atom çekirdeği böylece kolayca geri dönüştürülebilirler.
Ayrık durumlar kavramı klasik fizikle çelişir. Bu nedenle, kuantum teorisinin yasalarını çürütüp çürütmediği sorusu ortaya çıktı.
Kuantum fiziği, enerjinin korunumu, momentum, elektrik boşalması vb. Temel klasik yasaları iptal etmedi. N. Bohr'a göre uygunluk ilkesi , kuantum fiziği klasik fizik yasalarını içerir ve belirli koşullar altında kuantumdan klasik kavramlara yumuşak bir geçişi tespit etmek mümkündür. Bu, hidrojen atomunun enerji spektrumu örneğinde görülebilir (Şekil 6.3.2). Büyük kuantum sayıları için n>> 1 ayrık düzeyler yavaş yavaş birbirine yaklaşır ve klasik fizikten gelen sürekli spektrum bölgesine yumuşak bir geçiş olur.
Metalik bir elementin birbirinden ayrılmış ve mümkün olduğunca birbirine yaklaşan bir dizi atomunu hayal edin. Bu koşullar altında, atomların dış elektron katmanları tamamen örtüşür ve belirli bir elektron katmanından orijinal olarak yayılan herhangi bir elektron, artık belirli bir atomla ilişkili değildir, ancak kümedeki tüm atomlar tarafından paylaşılır. Bu atomlar metalik bir bağ ile bağlanır.
Metalik bir kristal, delokalize olan ve bu nedenle herhangi bir atoma ait olmayan bir elektron denizine daldırılmış pozitif yüklü sabit atomlardan oluşur. Çok kompakt oldukları için metaller oldukça serttir, ancak bir atom tabakası diğerinin üzerinde hareket ettirilebildiğinden, teller oluşturmak üzere gerilebilirler.
Bohr'un gönülsüz, yarı-klasik teorisi, fiziğe girişi mekanik ve elektrodinamiğin radikal bir yeniden yapılanmasını gerektiren kuantum kavramlarının gelişiminde önemli bir aşamaydı. Böyle bir yeniden yapılanma, XX yüzyılın 20'li - 30'lu yıllarında gerçekleştirildi.
Bohr'un elektronların bir atomda hareket ettiği belirli yörüngeler fikrinin çok koşullu olduğu ortaya çıktı. Aslında, bir atomdaki bir elektronun hareketi, gezegenlerin veya uyduların hareketine çok az benzerlik gösterir. Fiziksel anlam, dalga fonksiyonunun modülünün karesi ile tanımlanan şu veya bu yerde bir elektron bulma olasılığıdır |Ψ| 2. Dalga fonksiyonu Ψ ana denklemin çözümüdür Kuantum mekaniği - Schrödinger denklemleri . Bir atomdaki bir elektronun durumunun, bir dizi kuantum sayısı ile karakterize edildiği ortaya çıktı. Ana kuantum sayısı n atomun enerjisinin kuantizasyonunu belirler. Açısal momentumu nicelemek için, sözde yörünge kuantum sayısı l . Açısal momentumun uzayda ayırt edilen herhangi bir yöne izdüşümü (örneğin, vektörün yönü) manyetik alan) ayrıca ayrı bir dizi değer alır. Açısal momentumun izdüşümünü nicelemek için, manyetik kuantum sayısı m . Kuantum sayıları n, ben, m belirli niceleme kurallarına bağlıdır. Örneğin, yörünge kuantum sayısı ben 0 ile ( arasında tamsayı değerleri alabilir n- bir). Manyetik kuantum sayısı m± aralığında herhangi bir tamsayı değeri alabilir ben. Böylece, asal kuantum sayısının her değeri n atomun enerji durumunu belirleyen , kuantum sayılarının bir dizi kombinasyonuna karşılık gelir ben ve m. Bu tür kombinasyonların her biri belirli bir olasılık dağılımına karşılık gelir |Ψ| 2 uzayda çeşitli noktalarda bir elektronun tespiti ("elektron bulutu").
yörünge kuantum sayısının olduğu durumlar ben= 0, küresel simetrik olasılık dağılımlarıyla tanımlanır. Onlar aranmaktadır s-durumlar (1 s, 2s, ..., ns, ...). değerler için ben> 0 elektron bulutunun küresel simetrisi bozulur. beri Devletler ben= 1 denir p- devletler, ile ben = 2 - d-devletler vb.
Şek. 6.3.4 olasılık dağılım eğrilerini gösterir ρ ( r) = 4π r 2 |Ψ| 2 durum 1'de çekirdekten çeşitli mesafelerde bir hidrojen atomundaki bir elektronun tespiti s ve 2 s.
Olarak Şekil l'de görülebilir. 6.3.4, elektron durum 1'de s(hidrojen atomunun temel durumu) çekirdekten çeşitli mesafelerde tespit edilebilir. İTİBAREN büyük ihtimalle yarıçapa eşit bir mesafede tespit edilebilir rİlk Bohr yörüngesinin 1. 2. durumda bir elektron bulma olasılığı s maksimum mesafe r = 4r 1 çekirdekten. Her iki durumda da hidrojen atomu, merkezinde çekirdek olan küresel simetrik bir elektron bulutu olarak temsil edilebilir.
Hidrojen atomunun spektral serisi.
Seyreltilmiş gazların emisyon spektrumları (yani, tek tek atomların emisyon spektrumları) üzerine yapılan çalışmalar, her gazın belirli bir yönetilen bireysel spektral çizgilerden veya yakın aralıklı çizgi gruplarından oluşan bir spektrum. Bu özellikle en basit hidrojen atomunun spektrumunda belirgindir.
İsviçreli bilim adamı I. Balmer, o sırada bilinen hidrojen atomunun tüm spektral çizgilerini tanımlayan ampirik bir formül aldı. spektrumun görünür bölgesi:
nerede n=3;4;5;6.
Balmer serisinin yanı sıra, dalga sayıları benzer formüllerle gösterilebilen atomik hidrojen spektrumunda başka seriler de bulundu.
AT ultraviyole Lyman serisi alanları:
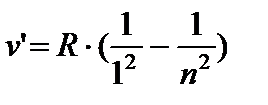 n = 2;3… (8.4)
n = 2;3… (8.4)
AT kızılötesi alanlar:
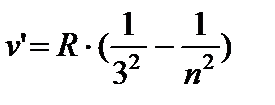 - Paschen serisi, n =4;5…
- Paschen serisi, n =4;5…
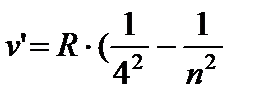 ) - Braketin serisi, n = 5;6… (8.5)
) - Braketin serisi, n = 5;6… (8.5)
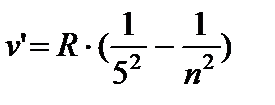 - Pfund serisi, n = 6;7…
- Pfund serisi, n = 6;7…
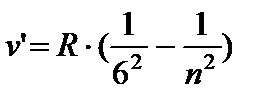 - Humphrey serisi, n = 7;8…
- Humphrey serisi, n = 7;8…
(8.3) - (8.5) ilişkilerini analiz ederek, tüm atomik hidrojen serilerinin temsil edilebileceğini söyleyebiliriz. Genel formül aranan genelleştirilmiş Balmer formülü ile:
 (8.6)
(8.6)
nerede m verilen her seride sabit bir değere sahiptir, m=1;2;3;4;5;6 (seri tanımlar); a n=m+1, m+2,… (bu dizinin tek tek satırlarını tanımlar).
Atomun durağan halinin enerjisi:  (8.9)
(8.9)
"-" işareti var koşullu değer, yalnızca fiziksel anlam– pozitif bir çekirdeğin alanındaki bir elektronun enerjisi negatiftir. (8.9)'dan, durağan hallerin enerjisinin n=1;2;3… için ayrık bir seri oluşturduğu görülebilir.
Bohr tarafından öne sürülen varsayımlar, hidrojen atomunun ve hidrojen benzeri sistemlerin (yüklü bir çekirdekten oluşan sistemler) spektrumunu hesaplamayı mümkün kıldı. Z ve bir elektron (örneğin iyonlar Değil + , Li+) ve teorik olarak Rydberg sabitini hesaplayın.
Bohr'u izleyerek, hidrojen benzeri bir sistemdeki elektronun hareketini, kendimizi dairesel durağan yörüngelerle sınırlayalım. Potansiyel enerji elektronun çekirdekle etkileşimi:
 (9.1),
(9.1),
r yörüngenin yarıçapıdır. Kinetik enerjiçekirdek etrafında hareket eden elektron: 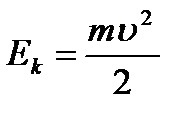 (9.2).
(9.2).
O zamanlar toplam enerji atom:
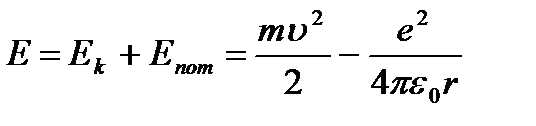 (9.3).
(9.3).
Çekirdeğin etrafındaki elektron ivme ile hareket eder. 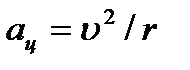 Coulomb kuvvetinin etkisi altında:
Coulomb kuvvetinin etkisi altında:  .
.
Newton'un ikinci yasasına göre ( ma = Fk) yazılabilir:
 (9.4);
(9.4);
buradan 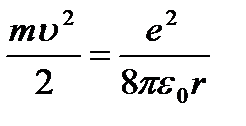 (9.5).
(9.5).
(9.5)'i (9.3)'e koyarız: 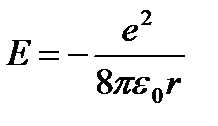 (9.6).
(9.6).
Bohr bir seçim kuralı veya niceleme kuralı önerdi (Bohr'un üçüncü varsayımı): bir elektronun tüm olası yörüngelerinden, yalnızca elektronun açısal momentumunun Planck sabitinin katı olduğu yörüngeler gerçekleştirilebilir:
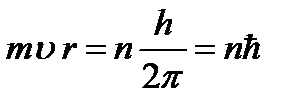 (9.7),
(9.7),
nerede n=1,2,3,… ana kuantum sayısıdır. (9.4) ve (9.7) bağıntılarını kullanarak, durağan elektron yörüngesinin yarıçapını belirleriz:

 (9.8),
(9.8),
at (ilk yörüngenin yarıçapı).
(9.8)'den itibaren şu şekildedir: 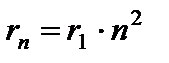 . (9.8)'i (9.10) ile değiştirerek, için bir ifade elde ederiz. durağan hal enerjileri:
. (9.8)'i (9.10) ile değiştirerek, için bir ifade elde ederiz. durağan hal enerjileri:
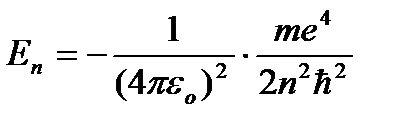 =
= 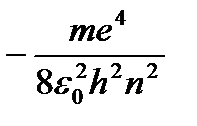 (9.9)
(9.9)
- Birinci durağan halin enerjisi.
bir enerji durumunda E1 bir atom sonsuza kadar kalabilir. Hidrojen atomunu iyonize etmek için, yani. ondan bir elektron koparmak için 13.55 eV enerji verilmesi gerekir.
 eV;
eV;  ;
;
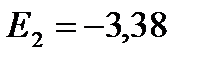 eV;
eV; 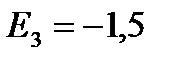 eV;
eV; ![]() eV, vb.
eV, vb.
, ,… durumu uyarılmış bir atoma karşılık gelir. Bu eyaletlerdeki yaşam düzeni  . Bu süre zarfında elektron, çekirdeğin etrafında yaklaşık 100 milyon devir yapmayı başarır.
. Bu süre zarfında elektron, çekirdeğin etrafında yaklaşık 100 milyon devir yapmayı başarır.
vermek n farklı tamsayı değerleri, hidrojen atomu için formül (9.9)'a göre olası enerji seviyelerini elde ederiz. Artan hidrojen atom enerjisi P artar ve enerji seviyeleri, değere karşılık gelen sınıra yaklaşır. n=¥. Hidrojen atomu bu nedenle minimum enerjiye (E 1 \u003d -13.55 eV) sahiptir. n=1 ve maksimum (E ¥ =0) P=¥ . Bu nedenle, E ¥ = 0 değeri atomun iyonlaşmasına (bir elektronun ondan ayrılması) karşılık gelir. Bohr'un ikinci varsayımına göre, bir hidrojen atomunun durağan durumdan geçişi sırasında n kararlı bir duruma t daha az enerjiyle bir kuantum yayılır:

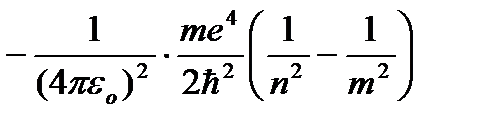 ,
,
radyasyon frekansı nereden:
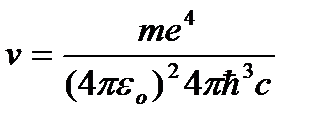
 =R
=R  , (9.10)
, (9.10)
nerede  .
.
Hesaplamada kullanma R modern değerler evrensel sabitler, hidrojen atomu için ampirik formüllerde Rydberg sabitinin deneysel değeri ile çakışan bir değer elde ederiz: ![]() .
.
Bu çakışma, Bohr'un hidrojen benzeri bir sistemin enerji seviyeleri için elde ettiği formülün doğruluğunu kanıtlar.
Örneğin, formül (9.10) içinde yer değiştirme m=1 ve n=2, 3, 4, ..., Lyman serisini oluşturan ve uyarılmış seviyelerden elektronların geçişlerine karşılık gelen bir grup çizgi elde ederiz. (n= 2, 3, 4, ...) ana (t= 1). Benzer şekilde, yerine koyarken t= 2, 3, 4, 5, 10 ve bunlara karşılık gelen değerler n Balmer, Paschen, Bracket, Pfund ve Humphrey serilerini elde ederiz (bazıları Şekil 9.1'de şematik olarak sunulmuştur). Sonuç olarak, hidrojen atomunun spektrumunu nicel olarak açıklayan Bohr'un teorisine göre, spektral seriler, bir atomun bunun üzerinde bulunan uyarılmış durumlardan belirli bir duruma geçişinden kaynaklanan radyasyona karşılık gelir.
 Bohr'un teorisi, klasik fiziğin atom içi olaylara uygulanamadığını ve kuantum yasalarını mikro kozmosta uygulama ihtiyacını gösterdi. Ancak helyum atomu için benzer bir teori oluşturma girişimi başarısız oldu. Bohr'un teorisi ne tutarlı bir şekilde klasik ne de tutarlı bir şekilde kuantum teorisiydi. Bohr'un teorisinin eksiklikleri, yeni bir teori yaratılarak giderilebilir. kuantum teorisi mikropartiküllerin davranış ve hareketinin kendi yasalarına uyduğu. Bu, kuantum mekaniğinin yaratılmasında yapıldı.
Bohr'un teorisi, klasik fiziğin atom içi olaylara uygulanamadığını ve kuantum yasalarını mikro kozmosta uygulama ihtiyacını gösterdi. Ancak helyum atomu için benzer bir teori oluşturma girişimi başarısız oldu. Bohr'un teorisi ne tutarlı bir şekilde klasik ne de tutarlı bir şekilde kuantum teorisiydi. Bohr'un teorisinin eksiklikleri, yeni bir teori yaratılarak giderilebilir. kuantum teorisi mikropartiküllerin davranış ve hareketinin kendi yasalarına uyduğu. Bu, kuantum mekaniğinin yaratılmasında yapıldı.
Bir atomdaki bir elektronun durumu, bir değil, birkaç tane ile karakterize edilir. Kuantum sayıları.
Öncelikle kuantum sayıları - asal kuantum sayısı: n=
bir; 2;3,… Bir atomdaki elektronun enerji seviyelerini belirler:  ve sabit yörüngelerin yarıçapları
ve sabit yörüngelerin yarıçapları  . Bu ifadeler, Schrödinger denkleminin çözümünden gelir ve Bohr tarafından elde edilen karşılık gelen formüllerle örtüşür.
. Bu ifadeler, Schrödinger denkleminin çözümünden gelir ve Bohr tarafından elde edilen karşılık gelen formüllerle örtüşür.
İkinci kuantum sayısı - yörünge kuantum sayısı, verilen de n 0, 1, 2, ... değerleri alabilir, n-bir . Bu sayı yörünge açısal momentumunu belirler.  çekirdeğe göre elektron. Bir atomdaki bir elektronun açısal momentumu aşağıdaki formülle nicelenir:
çekirdeğe göre elektron. Bir atomdaki bir elektronun açısal momentumu aşağıdaki formülle nicelenir: 
Üçüncü kuantum sayısı - manyetik kuantum sayısı verildiğinde 0 değerlerini alan; ±1; ±2,…, ± ; toplam 2+1 değerler. Bu sayı, elektronun yörünge açısal momentumunun keyfi olarak seçilen bir Z yönü üzerindeki izdüşümlerini belirler. Sadece açısal momentum vektörünün bu tür yönelimleri mümkündür, bunun için vektörün dış manyetik alan yönüne (OZ ekseni) izdüşümü değerleri alır: 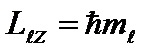
Dördüncü kuantum sayısı - döndürmek(manyetik dönüş) kuantum sayısı Hanım
. Sadece iki değer alabilir 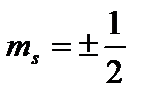 ve elektronun spininin (içsel mekanik açısal momentum) Z ekseni üzerindeki projeksiyonun olası değerlerini karakterize eder:
ve elektronun spininin (içsel mekanik açısal momentum) Z ekseni üzerindeki projeksiyonun olası değerlerini karakterize eder: 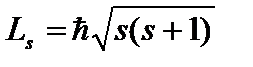 , nerede
, nerede ![]() spin kuantum sayısıdır. Uzamsal spin kuantizasyonu, spin vektörünün dış manyetik alan yönüne izdüşümü şu formülle bulunur:
spin kuantum sayısıdır. Uzamsal spin kuantizasyonu, spin vektörünün dış manyetik alan yönüne izdüşümü şu formülle bulunur:  .
.
1924'te İsviçreli fizikçi Pauli şu ilkeyi formüle etti: herhangi bir atomda, bir dizi dört kuantum sayısı ile belirlenen iki özdeş durağan durumda olan iki elektron olamaz - ana n; orbital; manyetik m ve spin m s. Pauli ilkesi, elektronlara ek olarak, yarım tamsayılı bir dönüşe (birim olarak) sahip diğer parçacıklara uyar.
Elektron sayısını belirli bir sayı ile belirleyelim.
=0 olan elektronlara denir s 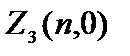 = 2(2×0+1)=2.
= 2(2×0+1)=2.
=1 olan elektronlara denir R-elektronlar, maksimum sayıları 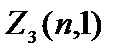 =2(2×1+1)=6.
=2(2×1+1)=6.
=2 olan elektronlara denir d-elektronlar, maksimum sayıları  =2(2 2+1)=10.
=2(2 2+1)=10.
=3 olan elektronlara denir f-elektronlar, maksimum sayıları  2(2×3+1)=14 vb.
2(2×3+1)=14 vb.
Azami sayı değer tarafından belirlenen durumlarda elektronlar n Ana kuantum sayısı
= 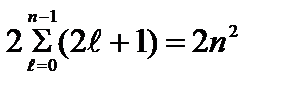
Temel kuantum sayısının aynı değerine sahip bir dizi durumu işgal eden elektronlar n elektron kabuğu oluşturur. Aşağıdaki elektron kabukları (veya katmanlar): K-katmanı n = 1; L- katman n = 2; M- katman n = 3; N- katman n=4 vb. Bir atomun her kuantum kabuğunda elektronlar, yörünge kuantum sayısının belirli bir değerine karşılık gelen alt kabuklar arasında dağıtılır; elektrona bağlı olarak sembolleri olan bir alt gruptadır s, p, d, f vb.
| Ana kuantum sayısı | Elektronik kabuk (katman) | Durumlardaki elektron sayısı | Maksimum elektron sayısı | |||
| s ( =0) | p ( =1) | d ( =2) | f ( =3) | |||
| K | – | – | – | |||
| L | – | – | ||||
| M | – | |||||
| N |
Asal kuantum sayısı tarafından belirlenen bir durumda n= 1, iki farklı spin yönelimli sadece iki s-elektronu olabilir (bkz. Şekil 10.1).
Eğer bir n= 2, o zaman devre Şekil 1'de gösterilen forma sahiptir. 10.2.
Kimyasal elementlerin atomlarındaki elektronik durumların doldurulma sırası, Pauli ilkesi ile açıklanmaktadır.
Bu ilke, D.I. Mendeleev tarafından oluşturulan periyodik sistemdeki kimyasal elementlerin özelliklerinin periyodikliğini açıklar.
İki prensibe uyan periyodik sistemin (veya atomun katmanlarının elektronlarla doldurulmasının) yapısını izleyelim: a) doldurma en düşük enerjiden (en kararlı durum) başlar; b) Pauli dışlama ilkesi.
Periyodik tablodaki ilk element bir hidrojen atomudur. H, bunun için Z = 1. Kuantum sayıları olan bir elektrona sahiptir: n \u003d 1, \u003d 0, m e \u003d 0, m s \u003d +1/2 veya -1/2, yani. elektronik konfigürasyon hidrojen atomunun: 1S1.
Bir sonraki element helyum Değil iki elektron vardır, kuantum sayıları: n \u003d 1, \u003d 0, m e \u003d 0, m s \u003d ±1/2, yani. helyum atomunun elektronik konfigürasyonu: 1S 2. Elektron sayısı N = 2 olan K katmanı tamamen doldurulur.
Üçüncü element lityumdur. Li. Üçüncü elektronunun kuantum sayıları vardır: n \u003d 2, \u003d 0, m e \u003d 0, m s \u003d +1/2 veya - 1/2, yani. atom 1S 2 2S 1'in elektronik konfigürasyonu.
berilyum ve: Z = 4 atomunun elektronik konfigürasyonu 1S 2 2S 2 .
Sonraki altı element, 2p ile doldurulmuş kabuklara sahiptir. Sonuç olarak, Z = 10 olan neon Ne, 1S 2 2S 2 2P 6 atomunun elektronik konfigürasyonuna sahiptir, yani. L- katman tamamen doldurulur ve bu, periyodik tablonun ikinci katmanını bitirir. He, Ne ve ayrıca s- veya s- ve p-alt gruplarının tamamen elektronlar tarafından işgal edildiği diğer atomlar, özellikler bakımından benzerdir ve kimyasal olarak inerttir.
| Z | eleman sembolü | Öğe adı | Elektronik konfigürasyon |
| H | hidrojen | 1s 1 | |
| Değil | helyum | 1s2 | |
| Li | lityum | 1s1 2s1 | |
| olmak | berilyum | 1s2 2s2 | |
| B | bor | 1s 2 2s 2 2p 1 | |
| C | karbon | 1s 2 2s 2 2p 2 | |
| N | azot | 1s 2 2s 2 2p 3 | |
| Ö | oksijen | 1s 2 2s 2 2p 4 | |
| F | flor | 1s 2 2s 2 2p 5 | |
| Ne | neon | 1s 2 2s 2 2p 6 | |
| Na | sodyum | 1s 2 2s 2 2p 6 3s 1 | |
| mg | magnezyum | 1s 2 2s 2 2p 6 3s 2 | |
| Al | alüminyum | 1s 2 2s 2 2p 6 3s 2 3p 1 | |
| Si | silikon | 1s 2 2s 2 2p 6 3s 2 3p 2 | |
| R | fosfor | 1s 2 2s 2 2p 6 3s 2 3p 3 | |
| S | kükürt | 1s 2 2s 2 2p 6 3s 2 3p 4 | |
| Cl | klor | 1s 2 2s 2 2p 6 3s 2 3p 5 | |
| Ar | argon | 1s 2 2s 2 2p 6 3s 2 3p 6 |
Katmanların doldurulması sırasında ihlaller, 4s kabuğunun doldurulmasının doldurulmamış bir 3d ile başladığı Z=19 (potasyum K) olan bir elementte gözlenir:
ve böylece 3d kabuk dolana kadar.
Bu ihlal, durumu n=3, n=4, vb. ana kuantum sayıları ile karakterize edilen elektronlar arasındaki etkileşim ile ilişkilidir. Etkileşim sonucunda öyle bir durum ortaya çıkar ki büyük bir devlet n, ancak küçük olanı enerjik olarak daha uygun olabilir.
Benzer bir durum, 5s, 5p, 6s kabuklarının doldurulmamış bir 4 ile doldurulduğu nadir toprak elementlerinde veya lantanitlerde (58-71 numaralı atomlar) gözlenir. f kabuk. Hepsinin bir dış kabuğu var 6s 2 . Başka bir sapma, aktinitler (90-103 numaralı atomlar) için geçerlidir, burada 5 f dış kabuğu doldurduktan sonra kabuk 7s 2 .
Konu 29. Optik kuantum jeneratörleri
Seçim kuralları nedeniyle, birçok elementin atomları, bir elektronun doğrudan daha düşük bir seviyeye geçemeyeceği enerji seviyelerine sahiptir. Bu seviyeler denir yarı kararlı devletler. Bir elektron, başka bir elektronla çarpışırken veya daha yüksek bir seviyeden hareket ederken böyle bir seviyeye gidebilir. yüksek seviye. Bir elektronun yarı kararlı durumda kalma süresi 10–3 s mertebesindeyken, uyarılmış bir durumda 10–8 s'dir.
Bir atomun uyarılmış halden temel duruma kendiliğinden geçişi sırasında yayılan radyasyona ne ad verilir? kendiliğinden emisyon. spontan emisyon çeşitli atomlar tutarlı bir şekilde gerçekleşmez, çünkü her atom radyasyonu diğerlerinden bağımsız olarak başlatır ve bitirir (Şekil 15.1a).
İçinden geçişin olduğu bir atom tarafından enerji emisyonu yarı kararlı durum esas olarak denir Elektromanyetik radyasyon karşılık gelen frekans denir zorla veya uyarılmış, radyasyon (Şekil 15.1b).
Frekans çakıştığında uyarılmış emisyon olasılığı keskin bir şekilde artar elektromanyetik alan uyarılmış atomun doğal radyasyon frekansı ile. Uyarılmış radyasyon, uyarıcı radyasyonla aynı frekansa, faza, polarizasyona ve yayılma yönüne sahiptir. Sonuç olarak, uyarılmış emisyon Uyarıcı radyasyonla kesinlikle tutarlıdır, yani yayılan foton, atomdaki foton olayından ayırt edilemez. Yayılan fotonlar, bir yönde hareket eder ve diğer uyarılmış atomlarla buluşur, daha fazla uyarılmış geçişleri uyarır ve fotonların sayısı çığ gibi büyür.
Bununla birlikte, uyarılmış emisyonla birlikte, rekabet eden bir süreç olan absorpsiyon da mümkündür. Termodinamik dengede olan bir atom sisteminde, gelen radyasyonun absorpsiyonu, zorlanan radyasyona üstün gelecektir, yani. Olay radyasyonu, maddeden geçerken zayıflayacaktır.
Ortamın üzerine düşen radyasyonu büyütmesi için, sistemin dengesiz durumu, uyarılmış durumdaki atomların sayısı, temel durumdaki sayılarından daha büyük olacaktır. Bu tür devletlere devlet denir. ters nüfuslu. Maddenin dengede olmayan bir durumunu yaratma sürecine (sistemi popülasyon inversiyonu olan bir duruma aktarma) denir. pompalanmış. Pompalama optik, elektrik ve diğer yöntemlerle yapılabilir. Ters durumlara sahip medyaya aktif denir. Negatif absorpsiyon katsayısına sahip ortamlar olarak kabul edilebilirler, çünkü gelen ışık demeti bu ortamlardan geçerken güçlendirilecektir.
İlk kez, 1939'da Rus fizikçi V.A. Fabrikant tarafından uyarılmış emisyon nedeniyle ışığın güçlendirilebileceği ortam elde etme olasılığına dikkat çekildi. Bir elektrik boşalmasıyla uyarılan cıva buharının uyarılmış emisyonunu deneysel olarak keşfetti. Elektromanyetik dalgaların amplifikasyon fenomeninin keşfi ve amplifikasyonunun icat yöntemi (V.A. Fabrikant, M.M. Vudynsky, F.A. Butaeva; 1951), hükümleri daha sonra kuantum yükselteçleri ve kuantum uygulamasını mümkün kılan kuantum elektroniğinin temelini oluşturdu. ışık jeneratörleri.
Ortamın pratik olarak ters durumu, optik kuantum jeneratörlerinde veya lazerlerde gerçekleştirilir (İngilizce adının ilk harflerinden Işık Amplification by Stimulated Emission of Radiation - uyarılmış emisyonla ışık amplifikasyonu). Lazerler görünür, kızılötesi ve yakın morötesi bölgelerde (optik aralıkta) üretir. Maserlerde (radyo dalgalarının santimetre aralığında çalışan jeneratörler ve amplifikatörler) ve lazerlerde uygulanan, niteliksel olarak yeni bir elektromanyetik dalgaların amplifikasyonu ve üretilmesi fikri fikri, Rus bilim adamları N.G. Basov ve A.M. Prokhorov ve Amerikalı fizikçi C. Ödül alan ilçeler Nobel Ödülü 1964
en önemlisi mevcut tipler lazerler katı hal, gaz, yarı iletken ve sıvıdır (böyle bir bölümün temeli aktif ortamın türüdür). Daha doğru bir sınıflandırma, pompalama yöntemlerini de dikkate alır - optik, termal, kimyasal, elektroiyonizasyon, vb. Ek olarak, sürekli veya darbeli üretim modunu dikkate almak gerekir.
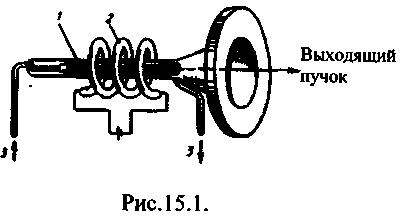 Lazerin mutlaka üç ana bileşeni vardır: 1) aktif ortam, nüfus inversiyonlu durumların oluşturulduğu; 2) pompalama sistemi(aktif ortamda inversiyonlar oluşturmak için cihaz); 3) optik rezonatör(foton demetinin seçici yönünü uzaya ayıran ve giden ışık demetini oluşturan bir cihaz).
Lazerin mutlaka üç ana bileşeni vardır: 1) aktif ortam, nüfus inversiyonlu durumların oluşturulduğu; 2) pompalama sistemi(aktif ortamda inversiyonlar oluşturmak için cihaz); 3) optik rezonatör(foton demetinin seçici yönünü uzaya ayıran ve giden ışık demetini oluşturan bir cihaz).
Spektrumun görünür bölgesinde (radyasyon dalga boyu 0.6943 μm) çalışan ilk katı hal lazeri, 1960 yılında oluşturulan bir yakut lazerdi (T. Maiman, ABD). Şekil 16.1, bir yakut lazerin şemasını göstermektedir. İçinde, seviyelerin ters popülasyonu, 1955'te N. G. Basov ve A. M. Prokhorov tarafından önerilen üç seviyeli bir şemaya göre gerçekleştirilir. Bir yakut kristali, Al atomlarından bazılarının üç değerlikli Cre + iyonları ile değiştirildiği kristal kafeste alüminyum oksit Al 2 Oz'dur (sırasıyla pembe ve kırmızı yakut krom iyonlarının %0.03 ve %0.05'i). Optik pompalama için, yakut bir çubuk (1) etrafında spiral olarak bükülmüş darbeli bir gaz deşarj lambası (2) kullanılır. Bir yakut, güçlü bir flaş lambasının ışığı ile yoğun bir şekilde ışınlandığında, krom atomları alt seviyeden geniş bir bant seviyelerine geçer. 3 (Şek. 16.2). Uyarılmış haldeki krom atomlarının ömrü kısa olduğu için (10 -7 s'den az), ya kendiliğinden 3®1 geçişleri meydana gelir (önemsizdirler) ya da seviyeye en olası ışımasız geçişler. 2 (buna yarı kararlı denir) fazla enerjinin yakut kristal kafese aktarılmasıyla. 2®1 geçişi seçim kuralları tarafından yasaklanmıştır, bu nedenle uyarılmış durumun süresi 2 10 -3 s mertebesinde krom atomları, yani. devlet için daha büyük yaklaşık dört büyüklük sırası 3. Bu, 2. seviyede krom atomlarının "birikmesine" yol açar. . Yeterli pompa gücü ile 2. seviyedeki konsantrasyonları 1. seviyeden çok daha yüksek olacaktır. , yani, 2. düzey ters bir popülasyonla bir ortam ortaya çıkar.
Yakut lazer çubuğu, uçları dikkatlice parlatılan ve bir ucu tamamen ışığı yansıtacak ve diğeri kısmen yansıyan ve kısmen aktarılan bir gümüş tabakası ile kaplanmış bir silindirdi. Pompa lambası yanıp söndüğünde, çeşitli frekanslardaki fotonlar yakut çubuğa girer. Belirli bir enerjinin fotonlarının bir kısmını emen krom atomları, uyarılmış bir duruma geçer. Sınırlı spontan geçişler nedeniyle, kendi ekseni boyunca sıkı bir şekilde yayılan ve rol oynayan uç aynalardan gelen çoklu yansımalarla güçlendirilen çubukta uyarılmış radyasyon ortaya çıkabilir. boşluk rezonatörü. Sonuç olarak, güçlü monokromatik radyasyon ortaya çıkar - bir kısmı yarı saydam bir aynadan çıkan bir ışık darbesi. Böyle bir darbenin süresi 10–3 s'dir. Bunun nedeni, bu süre zarfında tüm uyarılmış krom iyonlarının uyarılmamış duruma geçmesidir. Lazer ışık demeti kesinlikle yönlendirilir ve küçük bir sapmaya sahiptir. Lazerin kavite rezonatörü, pozitif bir geri besleme oluşturmaya ve lazer çıkış ışınının geometrik parametrelerini oluşturmaya hizmet eder.
Yakut çubuk tarafından emilen enerjinin tamamı lazer radyasyonuna dönüştürülmez. Oldukça önemli bir kısmı (% 50), çubuğu ısıtmak için harcanır, bu nedenle lazer tasarımı soğutma sağlar 3. Yaklaşık 1000 K'lık bir çubuk sıcaklığında yakut lazeri yok edilir.
Çok sayıda lazer malzemesi vardır: neodim iyonlarının dahil edildiği cam, samaryum iyonlu kalsiyum florit vb. Işık radyasyonu verirler. çeşitli uzunluklar dalgalar: yakut lazer - 0.694 mikron, neodim cam lazer - 1.06 mikron (kızılötesi radyasyon). Lazerlerde aktif ortam olarak gazlar veya gaz karışımları (Ne, Ar, Ne–He, CO 2 vb.) kullanılabilir. Gaz lazerlerinde, aktif ortamın atomları genellikle yüksek frekanslı bir deşarj ile uyarılır. Kural olarak, gaz lazerlerinin emisyonu süreklidir. Yarı iletken, kimyasal, gaz-dinamik ve diğer lazerler oluşturulmuştur.
Lazer radyasyonu aşağıdaki özelliklere sahiptir:
1) zamansal ve mekansal tutarlılık;
2) katı tek renklilik;
3) yüksek enerji akışı yoğunluğu;
4) kirişte çok küçük açısal sapma.
Olağandışı Özellikler Lazer radyasyonu geniş uygulama bulmuşlardır. Örneğin, ışık huzmesi makinelerinde, bir lazer ışını kullanılarak, yakut, elmastan yapılmış saat taşlarında, refrakter alaşımlarda ve kesilmesi zor metallerde delikler açılır. Mikroelektronikte lazerler, mikro devreler için çeşitli bağlantıları kaynaklamak, yarı iletken katmanları biriktirmek vb. için kullanılır.
Konu 30. Kuantum mekaniğinin unsurları
Işığın ikili parçacık-dalga doğası hakkında fikirler geliştiren Fransız bilim adamı Louis de Broglie, 1923'te parçacık-dalga ikiliğinin evrenselliği hakkında bir hipotez ortaya koydu. De Broglie, ışığın özellikleri ile maddesel parçacıkların özellikleri arasında derin bir benzerlik olduğunu savundu; bu nedenle, madde parçacıklarının da ikili bir doğası vardır, yani. belirli koşullar altında, dalga özellikleri kendini gösterir.
 De Broglie, momentumlu bir parçacığın
De Broglie, momentumlu bir parçacığın ![]() dalga boyuna karşılık gelir:
dalga boyuna karşılık gelir:  (1.2)
(1.2)
Bu bağıntı (de Broglie'nin formülü) momentumlu herhangi bir parçacık için geçerlidir. R.
Yakında de Broglie'nin hipotezi deneysel olarak doğrulandı. Amerikalı fizikçiler 1927'de K. Davisson ve L. Germer, Şekil 1'de gösterilen kurulumu kullanarak bir nikel tek kristali üzerindeki elektronların saçılmasını inceledi. Elektron tabancasından 1 elektron ışını nikel kristaline 2 yönlendirildi, kristalden saçılan elektronlar 3, hassas bir galvanometreye bağlı özel bir alıcı 4 tarafından yakalandı. Yansıyan ışının yoğunluğu, galvanometreden geçen akımın gücünden belirlendi. Deneyler, belirli bir geliş açısında, elektronların kristal yüzeyinden farklı açılarda yansıdığını ve bazı yönlerde yansıyan elektron sayısının maksimum, diğerlerinde minimum, yani bir kırınım modelinin gözlemlendiğini göstermiştir. Bu fenomen, de Broglie elektron dalga boyu 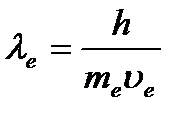 kristaldeki atomlar arası uzaklık mertebesindedir. Kırınım maksimumu Wulf-Braggs formülüne karşılık geldi
kristaldeki atomlar arası uzaklık mertebesindedir. Kırınım maksimumu Wulf-Braggs formülüne karşılık geldi ![]() , ve Bragg dalga boyu tam olarak olduğu ortaya çıktı uzunluğa eşit formül (1.2) ile hesaplanan dalga.
, ve Bragg dalga boyu tam olarak olduğu ortaya çıktı uzunluğa eşit formül (1.2) ile hesaplanan dalga.
Daha sonra, PS Tartakovskii ve G. Thomson, hızlı elektronların ince metal filmlerden geçişini araştırdı. Aynı zamanda, bu filmlerin arkasındaki fotoğraf plakalarında, kırınımda olduğu gibi bir kırınım deseni elde edildi. röntgen polikristaller üzerinde.
1849'da V.A. Fabrikant, L.M. Biberman ve N.G. Sushkin, cihazda çok düşük bir akımla elektron kırınımı üzerinde deneyler yaptılar, yani her elektron rastgele yerlerde bir fotoğraf plakası tarafından kaydedildi. Uzun bir pozlama ile, yüksek akım gücüne sahip kısa bir pozlama ile aynı kırınım modeli elde edildi. Bu, dalga özelliklerinin her elektronda ayrı ayrı olduğu anlamına gelir, ancak bir elektronun kırınımı, akıştan kırınım ile elde edilen tüm nokta sistemini vermez. Bir elektronun izi, kırınım koşulunun izin verdiği yalnızca bir noktada olacaktır. Bu, bir elektron yayılamadığından elektronların parçacık yapısını gösterir. Elektronun hangi yerlere düşeceğini söylemek mümkün değil. Sadece uzayda bir noktaya çarpma olasılığından bahsedebiliriz.
Böylece elektron ikili bir doğaya sahiptir, yani. hem parçacıkların hem de dalgaların özelliklerini birleştirir. Elektronların dalga doğası, kırınımları üzerinde yapılan deneylerle doğrulanır. Elektronların parçacık yapısı, elektronun parçalara ayrılmadan bir bütün olarak hareket etmesi gerçeğinde kendini gösterir.
Daha sonra, nötronlar, protonlar, atomik ve moleküler ışınlar için de kırınım olayları keşfedildi. Bu nihayet mikropartiküllerin dalga özelliklerinin varlığının bir kanıtı olarak hizmet etti ve mikropartiküllerin hareketini, de Broglie formülü (1.2) ile hesaplanan belirli bir dalga boyu ile karakterize edilen bir dalga süreci şeklinde tanımlamayı mümkün kıldı.






