Hidrojen atomunun spektral çizgileri. Laboratuvar çalışması yapma prosedürü. Hidrojenin izoelektronik dizisi
Bohr'un teorisi ortaya çıktığında, hidrojen atomu oldukça iyi çalışılmıştı. Atomların en basitidir. Tek bir elektron çekirdeğinin etrafında döner. Hidrojenin çizgi spektrumu da basittir. Bu nedenle, açıklaması elde edildi açıklamalardan önce diğer atomların spektrumları.
Moleküler spektrum, bir molekül absorpsiyona veya emisyona maruz kaldığında gözlenir. Elektromanyetik radyasyon enerjide bir artış veya azalma sonucu. Hangi buharların enerji değişikliklerine katılabileceği ve radyasyonun ne ölçüde emildiği veya yayıldığı konusunda yasalar tarafından getirilen kısıtlamalar vardır. Bu iki fenomen sırasıyla indüklenmiş absorpsiyon ve olarak adlandırılır. Ayrıca, uyarılmış enerji durumundaki bir molekül kendiliğinden elektromanyetik radyasyon yayabilir ve indükleyici radyasyon olmadan daha düşük bir enerji seviyesine geri dönebilir.
Bohr'un ilk varsayımına göre, bir atomda, çekirdeğin etrafındaki elektronlar hiçbirinde değil, yalnızca "izin verilen" olarak adlandırılan belirli sabit yörüngelerde dönebilir. Bu durumda, enerji atom tarafından ne yayılır ne de emilir. Bu tür her bir yörünge belirli bir enerji seviyesi atom. Bir atomun enerjisi ancak elektron başka bir yörüngeye veya başka bir enerji düzeyine geçtiğinde değişir. Bu gerçekleştiğinde, bir kuantum enerjinin emilmesi veya salınması.
Atomun yapısını zaten öğrendiniz. çevreleyen elektronlar atom çekirdeği, artan enerji seviyelerinde düzenlenir. Her element, benzersiz bir konfigürasyonda benzersiz sayıda elektrona sahiptir, bu nedenle her elementin kendi enerji seviyeleri vardır. Enerji seviyelerinin bu düzenlemesi, atomun benzersiz bir damgası olarak hizmet eder.
Bununla birlikte, benzer sıcaklıklara ısıtılan bir gaz, yalnızca belirli belirli dalga boylarında ışık yayabilir. Bu gözlemin nedeni o zaman anlaşılamadı. Bilim adamları bu etkiyi bir deşarj tüpü kullanarak incelediler. Akış borusu, her iki ucunda bir metal plaka bulunan gazla doldurulmuş bir cam borudur. İki metal plaka arasında yeterince büyük bir voltaj farkı varsa, tüp içindeki gaz atomları, elektronlarının bir kısmının çıkmasına neden olacak kadar enerji emecek, yani gaz atomları iyonlaşacaktır.
Bohr'un teorisindeki hidrojen atomu
Bohr'a göre hidrojen atomu
Bohr, teorisinde, bir atomun çekirdeğinin hareketsiz olduğunu ve elektronun onun etrafında dairesel bir yörüngede döndüğünü varsayıyordu. Fakat modern bilim elektronun hareket ettiği izin verilen yörüngenin sabit bir daire çizgisi olmadığı bilinmektedir. Aslında, bu, merkezi bir atomun çekirdeği olan ve bir elektronun görünümünün büyük olasılıkla olduğu bir top şeklinde ince bir eşmerkezli katman olan belirli bir uzay bölgesidir. Bu bölgeye atomun elektron kabuğu denir veya orbital.
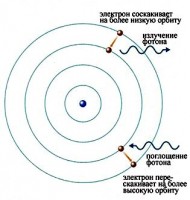
Bu elektronlar gaz içinde hareket etmeye başlar ve diğer atomlardaki elektronların bir kısmını daha yüksek enerji seviyelerine yükselten bir akım yaratır. Daha sonra atomlardaki elektronlar geri düştüğünde elektromanyetik radyasyon yayarlar. Aşağıda hidrojen gazı ile doldurulmuş boşalmış bir tüp için emisyon spektrumu adı verilen farklı dalga boylarında yayılan ışık miktarı gösterilmiştir. Şekildeki çizgilerin gösterdiği gibi, ışığın yalnızca belirli dalga boyları gözlemlenir.
Sonunda bilim adamları, bu çizgilerin, atomun belirli enerji seviyeleri arasında geçiş yapan elektronlar tarafından yayılan belirli bir enerjinin fotonlarından geldiğini fark ettiler. Şekil bunun bir örneğini göstermektedir. Bir atomdaki bir elektron daha yüksek bir enerji seviyesinden daha düşük bir enerji seviyesine düştüğünde, fazla enerjiyi uzaklaştırmak için bir foton yayar.
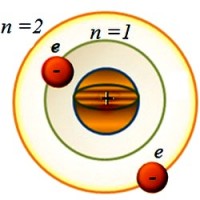
Bir atomun birden fazla elektron kabuğu olabilir. Her biri karakterize edilir Ana kuantum sayısı n . 1, 2, 3, ..., 7, ... tamsayı değerlerini alır, enerji seviyesinin sayısını belirtir ve verilen yörüngede bulunan elektronların enerjisini belirler. Değer ne kadar büyükse n , elektron çekirdekten ne kadar uzaksa ve o kadar fazla enerjisi vardır. fizikte elektron kabukları daha sık harflerle gösterilir K, L, M, N, O, P, Q . Çekirdeğe en yakın olan İle -kabuk. Onun için n = 1. Üzerinde bulunan elektron en düşük enerji değerine sahiptir. Örneğin, bir kabuk için L n = 2, vb.
Daha önce tartıştığımız gibi, bir fotonun frekansı, enerjisiyle bir denklem aracılığıyla ilişkilidir. Belirli bir foton frekansı bize belirli bir renk verdiğinden, her bir renk çizgisinin belirli bir geçişle nasıl ilişkilendirildiğini görebiliriz. Görünür ışık değil tek tür yayılan elektromanyetik radyasyon. Daha enerjik veya daha az enerjik geçişler, ultraviyole veya kızılötesi radyasyon üretebilir. Bununla birlikte, her atomun kendi enerji seviyeleri olduğu için, her atomun kendi emisyon spektrumu vardır.
Atomlar sadece foton yaymazlar; fotonları da emerler. Bir foton bir atoma çarparsa ve fotonun enerjisi atomdaki elektronların iki enerji seviyesi arasındaki boşlukla eşleşirse, daha düşük enerji seviyesindeki elektron fotonu emebilir ve daha yüksek enerji seviyesine atlayabilir. Fotonun enerjisi, iki enerji seviyesi arasındaki farka karşılık gelmiyorsa, foton soğurulmayacaktır.
Ama Bohr gibi, sorunu basitleştirelim ve elektronun çekirdeğin etrafında dairesel bir yörüngede döndüğünü varsayalım. Elektron birinci yörüngede ise ( n =1), o zaman atomun bu durumuna denir ana. Bu istikrarlı bir durumdur. Ve bu durumda enerjisi minimum bir değere sahiptir.
Ve bir elektronun daha uzak bir yörüngeye hareket etmesi için neye ihtiyacı vardır? Bunu yapmak için, pozitif yüklü bir çekirdeğin çekiciliğinin üstesinden gelmesi gerekiyor. Ve bu, dışarıdan ek enerji aldığında mümkündür. Ve sonra sayı ile yörüngede olacak n ˃ 1 (n =2, 3, 4, …). Bu durumda atomun enerjisi artar. Ve denilen bir duruma giriyor heyecanlı.
Bu etkiyi kullanarak, farklı enerjilere sahip bir foton kaynağımız varsa, farklı malzemeler için absorpsiyon spektrumları elde edebiliriz. Bir absorpsiyon spektrumu elde etmek için, ilgilendiğiniz malzemenin bir örneğine beyaz ışık tutmanız yeterlidir. Beyaz ışık tüm farklı dalga boylarından oluşur görülebilir ışık birlikte toplanır. Absorpsiyon spektrumunda boşluklar olacaktır. Boşluklar, belirli bir element için enerji seviyelerinde karşılık gelen bir farkın olduğu enerjilere karşılık gelir.
Soğurulan fotonlar siyah çizgiler olarak görünür çünkü bu dalga boylarındaki fotonlar emilir ve görünmez. Bu nedenle, absorpsiyon spektrumu, emisyon spektrumunun tam tersidir. Aşağıdaki iki şekle bakın. Şekilde hidrojen hattının emisyon spektrumunu görebilirsiniz. Şekil absorpsiyon spektrumunu göstermektedir. Bu, radyasyon spektrumunun tam tersidir! Bir atomun enerji seviyeleri hakkında aynı bilgiyi elde etmek için hem emisyon hem de absorpsiyon yöntemleri kullanılabilir.
Max Planck bile atomların kesin olarak tanımlanmış kısımlarda enerji emdiğini veya yaydığını fark etti. nicelik. Ve bu enerjinin büyüklüğü, ışık titreşimlerinin frekansı ile orantılıdır.
Ε = ħ· ѵ ,
Koyu çizgiler, gaz tarafından emilen ışığın frekanslarına karşılık gelir. Işık fotonları elektronlar tarafından emildiğinde, elektronlar daha yüksek enerji seviyelerine hareket eder. Bu radyasyonun tersi bir süreçtir. Koyu çizgiler, absorpsiyon çizgileri, aynı elementin emisyon spektrumunun frekanslarına karşılık gelir. Bir elektron tarafından daha fazla hareket etmek için emilen enerji miktarı yüksek seviye, başlangıç enerji düzeyine dönerken salınan enerji miktarı ile çakışır.
Cam bir kapta bilinmeyen bir gazım var. Gazın hidrojen olabileceğine dair bir önsezim var. Ne verilir ve ne yapılması gerekir? 642 nm'de bir absorpsiyon hattımız var. Bu, cam kaptaki maddenin 642 nm dalga boyuna sahip fotonları emdiği anlamına gelir. Hidrojenin hangi 2 enerji seviyesinin bu geçişe karşılık geldiğini hesaplamamız gerekiyor. Bu yüzden fotonların ne kadar enerji emdiğini bilmemiz gerekiyor.
nerede ѵ - Sıklık kuantum radyasyonu,
ħ Planck sabitidir.
Ve bir elektron uzak bir yörüngeden çekirdeğe daha yakın bir yörüngeye hareket ettiğinde, bir enerji kuantumu yayılır.
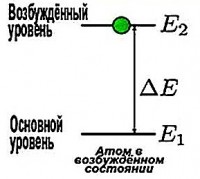
Hidrojen atomunun sadece bir elektronu olduğundan, çoğunlukla zemin kararlı durumdadır ( n =1), aynı anda hiçbir şey yaymadan oldukça uzun bir süre kalabilir. Ancak bu, ek bir kuantum enerji alana kadar devam eder. Ve onu aldıktan sonra, elektron daha büyük bir yarıçapta izin verilen başka bir yörüngeye atlar ve atom uyarılmış bir duruma girer. Ancak bu durumda uzun süre kalamaz. Temel duruma geri dönen atom, bir foton (kuantum ışık) yayar. Bu kuantumun enerjisi, uyarılmış ve temel durumların enerjileri arasındaki farka eşittir.
Soğurulan fotonların enerjisini hesaplayın. Soğurulan fotonların enerjisi 3,1 × 10 -19 J'dir. Görünür dalga boylarında radyasyona yol açan geçişlerin enerjisini bulun. Şekil, farklı enerji seviyesi geçişlerini göstermektedir. Görünür dalga boylarıyla ilişkili geçişler, enerji seviyesinde başlayan veya biten geçişler olarak etiketlenir. Bu geçişlerin enerjisini bulalım ve az önce hesapladığımız soğurulan fotonların enerjisiyle karşılaştıralım.
2. enerji seviyesinden 3. enerji seviyesine geçiş enerjisi. 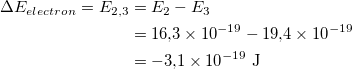
Bu nedenle, bir elektronun 2. enerji seviyesinden 3. enerji seviyesine geçmek için absorbe etmesi gereken bir fotonun enerjisi 3.1 × 10 -19 J'dir. Bu, kaptaki gaz tarafından absorbe edilen fotonlarla aynı enerjidir! Dolayısıyla tüm elementlerin geçişleri benzersiz olduğu için kaptaki gazın hidrojen olduğu söylenebilir. Geçiş, bir fotonun enerji seviyesi 2 ile enerji seviyesi arasında soğurulmasıdır.
Hidrojen atomunun spektrumu neden çizgilidir?
Bir hidrojen atomunun emisyon spektrumu
19. yüzyılın başlarında, hidrojen atomunun görünür kısımdaki spektrumunun 4 ayrı çizgiden oluştuğu tespit edildi: kırmızı, yeşil, mavi ve mor. Bu nasıl açıklanabilir? Sonuçta, sadece bir elektronu var.
Mesele şu ki, bir elektron yayılırken, örneğin dördüncü yörüngeden sadece üçüncüye değil, aynı zamanda ikinci ve birinciye ve üçüncüden ikinciye vb.
Emisyon ve absorpsiyon spektrumlarının uygulanması
Bir fotonun enerjisi, bir enerji seviyesinin enerjisine karşılık gelmez, iki enerji seviyesi arasındaki enerji farkına karşılık gelir. Astronomide yıldızların ve galaksilerin spektrumlarının çalışmasına spektroskop denir. Spektroskopi, astronomik nesneler hakkında farklı şeyler bulmak için astronomide yaygın olarak kullanılan bir araçtır.
Spektrumlarını kullanarak astronomik nesnelerdeki elementlerin tanımlanması
Bir yıldızdan gelen ışık tayfını ölçmek, gökbilimcilere bir yıldızın neyden yapıldığını söyleyebilir. Her bir element yalnızca belirli dalga boylarında ışık yaydığı veya absorbe ettiği için, gökbilimciler tayflarındaki çizgilerden yıldızlarda hangi elementlerin olduğunu belirleyebilirler. Birçok yıldızın tayfını inceleyerek, çok sayıda yıldız olduğunu biliyoruz. farklı şekiller farklı elementler ve farklı miktarlarda içeren yıldızlar.
Elektronun ikinci yörüngede olduğunu varsayalım. Bir fotonu emdikten sonra üçüncü yörüngeye geçer. Ve emilen fotonun enerjisinin değeri, bu seviyelerin enerjileri arasındaki farka eşittir.
Ε = E3 – E2
Spektroskopi kullanarak galaksi hızlarının belirlenmesi
Doppler etkisi ve frekansın nasıl değiştiği hakkında Bölüm 9'da zaten öğrenmiştiniz. ses dalgaları Sesi yayan nesnenin size doğru mu yoksa sizden uzağa mı hareket ettiğine bağlı olarak. Aynı şey elektromanyetik radyasyonda da olur. Işık yayan bir cisim bize doğru hareket ediyorsa ışığın dalga boyu kısalır. Bir cisim bizden uzaklaşırsa, ışığının dalga boyu uzar.
Doppler etkisi, Dünya'daki bize göre hareketlerine bağlı olarak uzaydaki nesnelerin spektrumlarını etkiler. Örneğin, bizden belirli bir hızla uzaklaşan uzak bir galaksiden gelen ışık kırmızı olacaktır. Bu, galaksinin spektrumundaki emisyon ve absorpsiyon çizgilerinin daha uzun bir dalga boyuna kaydırılacağı anlamına gelir. Spektrumdaki her bir çizginin, galaksi hareket etmiyorsa tipik olarak nerede olacağını bilmek ve onu kırmızıya kaymış konumuyla karşılaştırmak, gökbilimcilerin galaksinin Dünya'ya göre hızını doğru bir şekilde ölçmesine olanak tanır.
Ancak komşu enerji seviyeleri arasındaki enerji farkı, sabit değer. Bir elektron çekirdekten ne kadar uzaksa o kadar küçüktür. Buna göre, yayılan fotonların enerjisi ve elektromanyetik salınımların radyasyon frekansı farklı olacaktır. Değeri, frekans kuralı veya Bohr'un ikinci varsayımı kullanılarak belirlenebilir.
Küresel ısınma ve sera gazları
Güneş, esas olarak spektrumun görünür kısmında bulunan bir dizi dalga boyunda radyasyon yayar. Bu dalga boylarındaki radyasyon, aşağıdaki karaları ve okyanusları ısıtmak için atmosferdeki gazlardan geçer. Sıcak hava daha sonra bu ısıyı uzun kızılötesi dalga boylarında yayar. Atmosferdeki karbondioksit, kızılötesi radyasyonu emmesine izin veren kızılötesi dalga boylarına karşılık gelen enerji seviyelerine sahiptir. Daha sonra da her yöne kızılötesi dalga boylarında yayılır.
Bir elektron yörüngeden hareket ettiğinde m yörüngeye n değeri şu ilişki ile hesaplanan bir kuantum enerji yayılır:
Ε = ħ· ѵ = E m – E n , m ˃ n ;
nerede ѵ - kuantum radyasyon frekansı,
ħ Planck sabitidir.
Buradan ѵ = (E m – E n)/ ħ
Gördüğümüz gibi, radyasyon frekansı, geçişin gerçekleştiği yörüngelerdeki enerji farkına bağlıdır. Ve her frekans, bir atomun emisyon spektrumundaki bir çizgiye karşılık gelir. Bu, hidrojen atomunun spektrumunda tek tek çizgilerin varlığını açıklar.
Bu etki, atmosferin ve dünyanın ısınmasına neden olan büyük miktarda kızılötesi radyasyonun atmosferden kaçmasını engeller. Geri dönenlerden daha fazla radyasyon girer. Rydberg denklemi, kuantum durumları, elektronik yapı. Işık rengi, dalga boyu veya frekansı ile tanımlanır - bu üç nitelikten herhangi biri bir ışık dalgasının temel yapısını belirler. Işık dalgaları etrafımızda sekerek milyonlarca yüzeyden sekerek sonsuz sayıda renkle sonuçlanır. ışık bir kırılma ızgarası, prizma veya bulut bulutundan geçer, ışık gökkuşağının tüm renklerine bölünür.
Hidrojen atomunun tam spektrumu
Hidrojen atomunun spektral serisi
Herhangi bir gazın emisyon spektrumunda bireysel spektral çizgilerin veya yakın aralıklı çizgi gruplarının gözlendiği söylenmelidir. Ve bu çizgiler rastgele değil, belli bir sıraya göre dizilmiştir.
Ancak bir atomun içinden gelen ışık, yansıyan ışıktan çok farklıdır. Işığın sadece çok az dalga boyu içerdiğini bulduk. Atomların yaydığı ışık ve benzersiz özellikleri, bize atomun kaçtığı yapı hakkında bir fikir verir.
Bu deneyde, uyarılmış helyum ve ardından hidrojen atomları tarafından yayılan ışığı incelemek için bir spektrometre kullanacaksınız. Bir elementin yaydığı ışığın etrafımızdaki doğal ışıktan ve başka bir elementin yaydığı ışıktan nasıl farklı olduğunu göreceksiniz. Spektrometrenizi helyum gazı ile kalibre edecek ve ardından hidrojen emisyonlarını ölçmek için spektrometreyi kullanacaksınız. Hidrojen atomundaki mevcut enerji seviyelerini hesaplayacak ve daha sonra ölçtüğünüz hidrojen spektrumundaki her bir çizgiye, her dalga boyuna karşılık gelen bu nicelenmiş enerji seviyeleri arasındaki geçişleri belirleyeceksiniz.
Konumun matematiksel açıklaması spektral çizgiler hidrojen atomu İsviçreli bir bilim adamı tarafından yapıldı Johann Jacob Balmer 1855'te

Johann Jacob Balmer
Balmer bir matematikçiydi ve çeşitli tamsayı kombinasyonlarının birçok sayının bağlantısını açıklayabileceğine inanıyordu. fiziksel olaylar. İsviçreli bir fizikçi olan Balmer'in bir arkadaşının, hidrojen spektrumunun dört görünür çizgisinin her birinin dalga boyunu hesaplamanıza izin veren bir formülün ortaya çıkmasında rol oynadığını söylüyorlar. Eduard Hagenbach-Bischoff, ona hidrojen spektrumunun kırmızı, yeşil, mavi ve mor çizgilerini tanımlaması için meydan okudu. Ve Balmer ampirik olarak aşağıdaki formülü türetmiştir:
![]()
nerede λ - dalga boyu;
n = 3, 4, 5, 6 (ana kuantum sayısı başlangıç enerji seviyesi);
b = 3645.6 A (angstrom).
Balmer'in formülünün o zamanki fiziksel anlamı kimse tarafından açıklanamadı. Ve sadece 1913'te Niels Bohr, formüldeki tam sayıların izin verilen yörüngeler olduğunu ve spektral çizgilerin bir yörüngeden diğerine elektron geçişlerinin sonucu olduğunu fark etti.
Ancak hidrojen atomunun radyasyon spektrumundaki spektral serilerin sadece görünür kısımda olmadığı ortaya çıktı. Daha sonra ultraviyole ve kızılötesi bölgelerde bulundular.
Bir hidrojen atomunun çeşitli aralıklarda yaydığı dalga boyu, 1889'da İsveçli fizikçi tarafından türetilen formülle hesaplanabilir. Johannes Rydberg:
![]() ,
,
nerede R ≈ 109737.3157 cm–1 (hidrojen atomu için Rydberg sabiti);
λ - dalga boyu;
n - bütün sayı;
n" spektral serilerin sayısıdır ve n" < n .

Johannes Rydberg
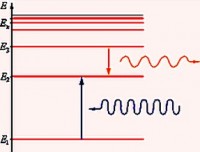
emisyon spektrumunda Balmer serisi elektronların uyarılmış enerji düzeylerinden geçişi sırasında gözlenen n ˃ 2 (n = 3, 4, 5,…) ikinci enerji seviyesine ( n" = 2). Absorpsiyon spektrumunda, elektronların ikinci seviyeden daha yüksek enerji seviyelerine geçişi sırasında oluşur.
Bu durumda Rydberg formülü şu şekildedir:
![]()
Spektrumun ultraviyole kısmında bulunan seriye denir. Lyman serisi. 1906'da Amerikalı bir fizikçi tarafından keşfedildi. Theodore Lyman. Bu seri, emisyon spektrumunda elektronların uyarılmış enerji düzeylerinden birinci düzeye geçişi sırasında, absorpsiyon spektrumunda ise birinci düzeyden en yüksek düzeye geçiş sırasında oluşur.
Lyman serisi için Rydberg'in formülü:
![]()
n" = 1;
n = 2, 3, 4…
Kızılötesi aralıkta 4 seri tespit edildi: Paschen serisi, Braket serisi, Pfund serisi ve Humphrey serisi.
Paschen Serisi 1908 yılında Avusturyalı bir fizikçi tarafından keşfedilmiştir. Friedrich Paschen.
Paschen serisi için Rydberg formülü:
![]()
nerede n" = 3;
n = 4, 5, 6, …
Sonraki seri Amerikalı bir fizikçi tarafından açıldı. Frederick Summer Brackett'in fotoğrafı. 1922'de Rydberg formülüne karşılık gelir. n' = 4 ve n = 5, 6, 7…
Pfund serisi Amerikalı bir fizikçi tarafından keşfedildi. Ağustos Hermann Pfund 1924'te. Bu seri için n' = 5 ve n = 6, 7, 8, …
Humphrey serisi için 1953'te açıldı. Amerikalı fizikçi Curtis Humphrey, n' = 6 ve n = 7, 8, 9, …:
Rydberg formülüne karşılık gelen değerlerin değiştirilmesi n" ve n , hidrojen atomunun spektrumunun tüm serileri için formüller elde ederiz.
Bohr'un teorisi, hidrojen atomunun spektrumunun çizgi modelini ve döteryum ve trityumun ağır izotoplarını içeren hidrojen benzeri atomların spektrumlarını ve ayrıca yalnızca bir elektronu kalmış herhangi bir iyonu, örneğin iyonize bir helyum'u açıklar. atom. Ancak ne yazık ki daha karmaşık atomlara uygulanamaz.
Amaç:
1. Hidrojen atomunun spektrumunun görünür kısmını keşfedin.
2. Rydberg sabitini ve hidrojen atomunun iyonlaşma enerjisini belirleyin.
Çalışmanın ana teorik hükümleri.
Klasik fizik yasaları sürekli süreçleri tanımlar. Bu yasalara göre, pozitif yüklü bir çekirdek ve onu çevreleyen elektronlardan oluşan bir atom, ancak elektronlar çekirdeğin etrafında belirli yörüngelerde sürekli hareket ederse dengede olacaktır. Ancak klasik elektrodinamik açısından, ivme ile hareket eden elektronlar elektromanyetik dalgalar yayarlar, bunun sonucunda enerji kaybederler ve yavaş yavaş çekirdeğe düşerler. Bu koşullar altında elektron devir frekansı sürekli değişir ve atomun emisyon spektrumu sürekli olmalıdır. Bir elektron çekirdeğe çarptığında atomun varlığı sona erer.
Basit hesaplamalarla, elektronun çekirdeğe düştüğü zaman aralığının 10-11 s olduğundan emin olunabilir. Deney, atomik spektrumların tek tek çizgilerden veya çizgi gruplarından oluştuğunu gösterir. Bütün bunlar, mikro-nesnelerin dahil olduğu süreçlerin süreksizlik (ayrıklık) ile karakterize edildiğini ve genel olarak konuşursak, klasik fizik yöntemlerinin atom içi hareketlerin tanımına uygulanamayacağını gösterir.
1913'te N. Bohr, hidrojen atomunun yapısını başarıyla açıklayan tutarlı bir teori oluşturmayı başardı. Bohr, M. Planck'ın (1900) osilatörlerin kararlı durağan durumlarının (türetme için gerekli bir önkoşul) varlığına ilişkin Postülatını genişletti. doğru formül siyah cisim radyasyonu) herhangi bir atomik sisteme. Bohr'un teorisi iki önermeye dayanmaktadır:
1. Bir atom ve atomik sistemler, yalnızca kendilerinde meydana gelen yüklü parçacıkların hareketlerine rağmen enerji yaymadıkları veya emmedikleri belirli (durağan) durumlarda uzun süre kalabilirler. Bu durumlarda, atomik sistemlerin ayrı bir dizi oluşturan enerjileri vardır: E 1 , E 2 , …, E n . Bu durumlar kararlılıkları ile karakterize edilir: elektromanyetik radyasyonun emilmesi veya yayılması veya bir çarpışma sonucunda enerjideki herhangi bir değişiklik ancak bir durumdan diğerine tam bir geçiş (atlama) ile meydana gelebilir.
2. Bir durumdan diğerine geçiş sırasında, atomlar yalnızca kesin olarak tanımlanmış bir frekansta radyasyon yayar (veya emer). E m enerjili bir durumdan E n durumuna geçiş sırasında yayılan (veya soğurulan) radyasyon monokromatiktir ve frekansı koşuldan belirlenir.
Her iki önerme de klasik elektrodinamiğin gereksinimleriyle çelişir. İlk varsayım, atomları oluşturan elektronların hızlandırılmış hareket yapmasına rağmen (kapalı yörüngelerde dolaşım) atomların ışıma yapmadığını belirtir. İkinci varsayıma göre, yayılan frekansların elektronların periyodik hareketlerinin frekanslarıyla hiçbir ilgisi yoktur.
Bir maddenin emisyon spektrumu, bileşimini, yapısının bazı özelliklerini, atomların ve moleküllerin özelliklerini belirlemenize izin veren önemli özelliğidir.
Gaz atomları olarak adlandırılan bireysel spektral çizgi gruplarından oluşan çizgi spektrumları yayarlar. spektral seri. En basit spektrum hidrojen atomunun spektrumudur. Daha 1885'te Balmer, spektrumun görünür kısmında yer alan dört çizginin dalga boylarının ampirik formülle çok doğru bir şekilde temsil edilebileceğini gösterdi.
burada n = 3, 4, 5, 6,…, V ampirik bir sabittir.
Bu formül tarafından ifade edilen düzenlilik, şu anda genellikle kullanıldığı biçimde sunulursa özellikle belirginleşir:
![]() (3)
(3)
Miktar bazen ile gösterilir ve denir spektroskopik dalga sayısı. sabit denir Rydberg sabiti. Böylece, sonunda elde ederiz
![]() . (4)
. (4)
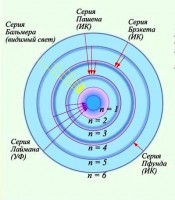
Satır numarası n arttıkça, satır yoğunluğu azalır. Bitişik çizgilerin dalga sayıları arasındaki fark da azalır. n = ∞ için sabit bir = değeri elde edilir. (4) ile tanımlanan spektral çizgilerin konumunu şematik olarak gösterirsek ve yoğunluklarını çizginin uzunluğuna göre koşullu olarak gösterirsek, Şekil 1'de gösterilen resmi elde ederiz.
Sıralamalarında ve yoğunluk dağılımında Şekil 1'de gösterilen düzenliliği ortaya çıkaran spektral çizgiler kümesine denir. spektral seri. Çizgilerin n → ∞ olarak kalınlaştığı sınırlayıcı dalga boyuna denir. seri sınırı. Formül (4) ile tanımlanan seriye Balmer serisi denir.
Balmer serisinin yanı sıra, hidrojen atomunun spektrumunda tamamen benzer formüllerle temsil edilen bir dizi başka seri bulundu.
Ultraviyole bölgesinde Lyman serisi bulundu:
![]() (5)
(5)
Spektrumun kızılötesi bölgesinde bulundu
Paschen Serisi
![]() (6)
(6)
Braket Serisi
![]() (7)
(7)
Pfund serisi
![]() (8)
(8)
Humphrey serisi
![]() (9)
(9)
Böylece, bilinen tüm atomik hidrojen serileri, sözde ile temsil edilebilir. genelleştirilmiş Balmer formülü ile:
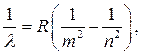 (10)
(10)
burada her dizideki m sabit bir değere sahiptir ve n, m+1'den başlayan bir tamsayı değerleri dizisidir.
Arama fiziksel duyu formüller (10) yaratılmasına yol açtı kuantum teorisi bir hidrojen atomu. Bunun için Schrödinger denklemi şu şekilde yazılır:
![]() (11)
(11)
burada Ψ(r) atomdaki elektronun durumunu tanımlayan dalga fonksiyonudur, E elektronun toplam enerjisidir.
Bu denklemin çözümü, olası değerlerin spektrumudur. tam Enerji hidrojen atomu:
![]() (12)
(12)
(1)'e göre, durumlar arasındaki geçiş sıklığı şu şekilde belirlenir:
Öte yandan, iyi bilinen formüle göre
(12), (13) ve (14)'ü birleştirerek şunu elde ederiz:
![]() (15)
(15)
genelleştirilmiş Balmer formülü ile örtüşmektedir.
Rydberg sabitinin (16) teorik değeri, spektroskopik ölçümlerden elde edilen deneysel değerden hala önemli ölçüde farklıdır. Bunun nedeni, formül (16) türetilirken iki varsayımın yapılmasıdır: a) bir atomun çekirdeğinin kütlesi, bir elektronun kütlesine kıyasla sonsuz derecede büyüktür (dolayısıyla a sabiti) ve b) çekirdek hareketsizdir. Gerçekte, örneğin bir hidrojen atomu için çekirdeğin kütlesi elektronun kütlesinin sadece 1836.1 katıdır. Bu durumun muhasebeleştirilmesi aşağıdaki formüle yol açar:
burada M atom çekirdeğinin kütlesidir. Bu yaklaşımda, Rydberg sabiti çekirdeğin kütlesine bağlıdır ve bu nedenle farklı hidrojen benzeri atomlar için değerleri birbirinden farklıdır (Şekil 2).
Şekil.2 Şekil.3
Atomla ilgili tüm bilgileri elde etmek için enerji düzeyi diyagramını kullanmak uygundur (Şekil 3). Yatay düz çizgiler, hidrojen atomunun farklı enerji durumlarına karşılık gelir. Durum sayısı arttıkça komşu seviyeler arasındaki mesafe azalır ve limitte kaybolur. Birleşme noktasının üzerinde, nicemlenmemiş pozitif enerjilerin sürekli bir bölgesi bulunur. Sıfır enerji seviyesi, n = ∞ olan seviyenin enerjisi olarak alınır. Bu değerin altında enerji seviyeleri kesiklidir. Atomun toplam enerjisinin negatif değerlerine karşılık gelirler. Bu durum, bir elektronun bu tür durumlardaki enerjisinin, atomdan ayrıldığı ve sonsuzda durduğu durumdaki enerjisinden daha az olduğunu gösterir. uzun mesafe yani elektron bağlı durumda.
Bağlı olmayan elektronların varlığı, sürekli enerji spektrumunun durumları arasında ve ayrıca bu tür durumlar ve ayrık enerji spektrumunun durumları arasında kuantum geçişlerini mümkün kılar. Bu formda kendini gösterir. sürekli spektrumüzerine bindirilmiş emisyon veya absorpsiyon çizgi spektrumu atom. Bu nedenle, spektrum serinin sınırında durmaz, bunun ötesinde sürekli hale geldiği daha kısa dalga boylarına doğru devam eder. Sürekli spektrum durumlarından (atomun iyonize olduğu durumlar) ayrık spektrum durumlarına geçişlere, bir elektronun rekombinasyonu eşlik eder ve pozitif iyon. Ortaya çıkan radyasyon denir rekombinasyon.
Bir atomun ayrık spektrumun normal durumundan daha yüksek bir enerji düzeyine geçişi, atomun uyarılması. Bir atomun kesikli spektrum düzeylerinden birinden sürekli spektrum bölgesine geçişi, atomu bağlı olmayan bir sisteme dönüştürür. Bu bir süreçtir atomun iyonlaşması. Uzun dalgalar tarafından sürekli spektrumun başlangıcındaki dalga sayısına (seri sınırının dalga numarası) karşılık gelen enerji, iyonlaşma enerjisi, yani bir elektronu bir atomdan ayırmak ve onu sonsuz bir mesafeye çıkarmak için gereken enerji. Böylece Lyman serisinin sınırının dalga sayısı, hidrojen atomunun zemindeki iyonlaşma enerjisini, en kararlı halini verir.
Bu yazıda, aşağıdaki adlandırmalara sahip Balmer serisinin ilk dört satırını inceliyoruz:
Kırmızı çizgi (n = 3),
Mavi - mavi çizgi (n = 4),
Mavi çizgi (n=5),
Mor çizgi (n = 6).






