Procese termodinamice în coordonate p v. Ciclul de refrigerare a compresorului de abur. Procesul de gaz adiabatic
Fiecare dintre aceste ecuații conține doi factori. Se caracterizează calitatea sau intensitatea energiei ( ω2− pătratul vitezei, H- inaltime de ridicare, T- temperatura, p−presiunea), iar al doilea exprimă cantitatea sau capacitatea corpului în raport cu o energie dată ( m – masa corpului, V − volum specific, S – entropie). Primul factor este un factor intensiv, iar al doilea este un factor extensiv. Adică, entropia este capacitatea unui sistem termodinamic în raport cu tensiunea termică.
Clausius a formulat prima și a doua lege a termodinamicii.
Energia universului este constantă.
Entropia universului tinde spre maxim.
Astfel, acest lucru ar trebui să ducă la moartea termică a universului atunci când temperatura se uniformizează. Dar aceasta contrazice faptul că legea creșterii entropiei a fost obținută pentru sistem izolat.
TS - diagrama.
În această diagramă, temperatura este reprezentată de-a lungul axei ordonatelor, iar entropia este reprezentată de-a lungul axei absciselor.
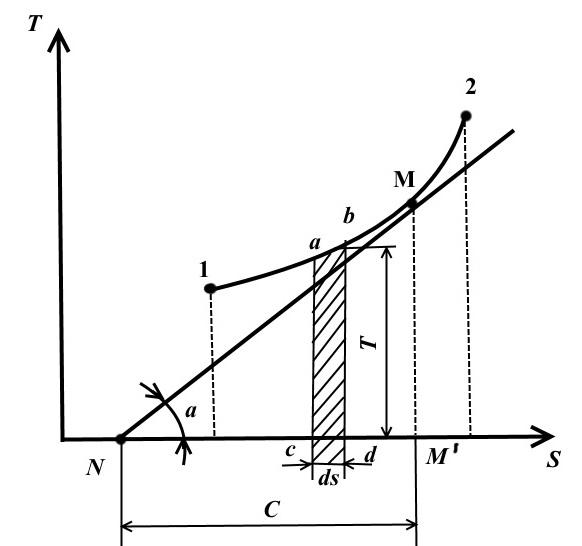
Starea de echilibru în diagrama TS este reprezentată de puncte cu coordonatele corespunzătoare valorilor temperaturii și entropiei.
Procesul termodinamic reversibil de schimbare a stării fluidului de lucru din starea inițială 1 în starea finală 2 este descris în TS − diagrama unei curbe continue care trece între aceste puncte.
Pătrat abdc este egal cu TdS = dq , acestea. exprimă cantitatea elementară de căldură primită sau degajată de sistem într-un proces reversibil.
Aria de sub curba 1-2 este
Adică aria de sub curba în TS − diagramă, reprezintă căldura furnizată sistemului sau scoasă din acesta.
De aceea TS − diagrama se numeste termica.
Desenați într-un punct arbitrar M pe curba 1-2 tangentă la această curbă
Valoarea reprezintă adevărata capacitate termică a procesului.
![]()
Procesele de gaze înTS − diagramă.
Proces izotermic.
Într-un proces izoterm T= const. De aceea TS- în diagramă, este reprezentat printr-o linie dreaptă paralelă cu axa x.
Ținând cont de faptul că dT=0 , dependențele modificării entropiei unui gaz ideal într-un proces izoterm vor lua forma
(termenul din partea dreaptă pleacă)
Procesul 1-2 este un proces în care entropia crește și, prin urmare, căldura este furnizată gazului, iar gazul efectuează o muncă de expansiune echivalentă cu această căldură.
Procesul 2-1 este un proces de compresie în care căldura echivalentă cu munca de compresie este îndepărtată din gaz și entropia este redusă.
zona figurii S 1 12 S 2 corespunde cantității de căldură q la gazul furnizat și, în același timp, lucrează l (proces izotermic)
proces adiabatic
Într-un proces adiabatic q=0 și dq=0, si in consecinta dS=0.
Prin urmare, într-un proces adiabatic S= const si in TS− în diagramă, procesul adiabatic este reprezentat printr-o dreaptă paralelă cu axa T.
Pentru că într-un proces adiabatic S= const, atunci procesele reversibile adiabatice se mai numesc si isentropice.
În timpul compresiei adiabatice, temperatura fluidului de lucru crește, iar în timpul expansiunii scade. Prin urmare, procesul 1-2 este un proces de contracție, iar procesul 2-1 este un proces de expansiune.
Din ecuație
![]() (3)
(3)
La k= const primim
![]()
Pentru un proces adiabatic reversibil S 1 = S 2 = const, apoi de la (*)
− ecuaţia adiabatică în coordonate p și V.
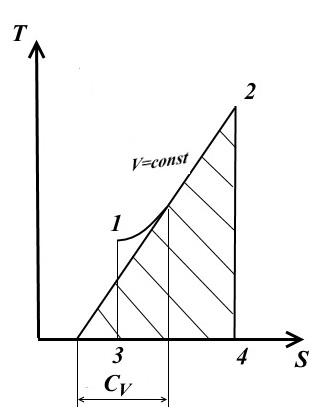
Procesul izocor
Pentru proces izocor V= const, dV=0.
La o capacitate termică constantă (din ecuația (1))
− vedere a TS - diagrama
Subtangenta la curba procesului în orice punct determină valoarea capacității termice adevărate C V .
Subtangenta va fi pozitivă numai dacă curba este convexă în jos.
Aria sub curba procesului 1-2 TS - diagrama oferă o cantitate scalată de căldură furnizată (sau eliminată în procesul 2-1) q, egal cu schimbarea energie interna U 2 - U 1 .
proces izobaric
Într-un proces izobaric, presiunea este constantă. p= const
În acest caz
![]() de la (2)
de la (2)
Prin urmare, la p= const ca și în cazul V= const izobara este o curbă logaritmică, urma se ridică la dreapta și este convexă în jos.
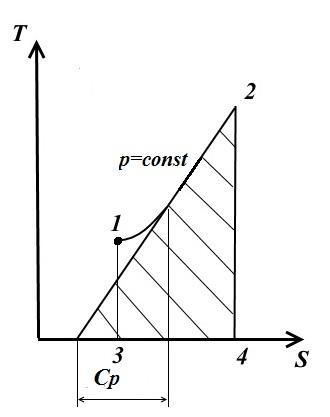
Tangenta la curba 1-2 în orice punct oferă valorile capacității reale de căldură C p .
Aria de sub curbă oferă cantitatea de căldură q, care este raportat la gaz la p= const, egal cu modificarea entalpiei i 2 - i 1 .
Proces politropic
Într-un proces politropic.capacitatea termică în acest proces
![]()
Prin urmare, pentru modificarea finală a stării gazului
![]()
Procesul politropic TS - diagrama este reprezentată de o curbă, a cărei locație depinde de indicator n.
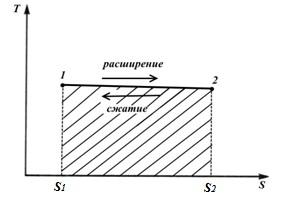
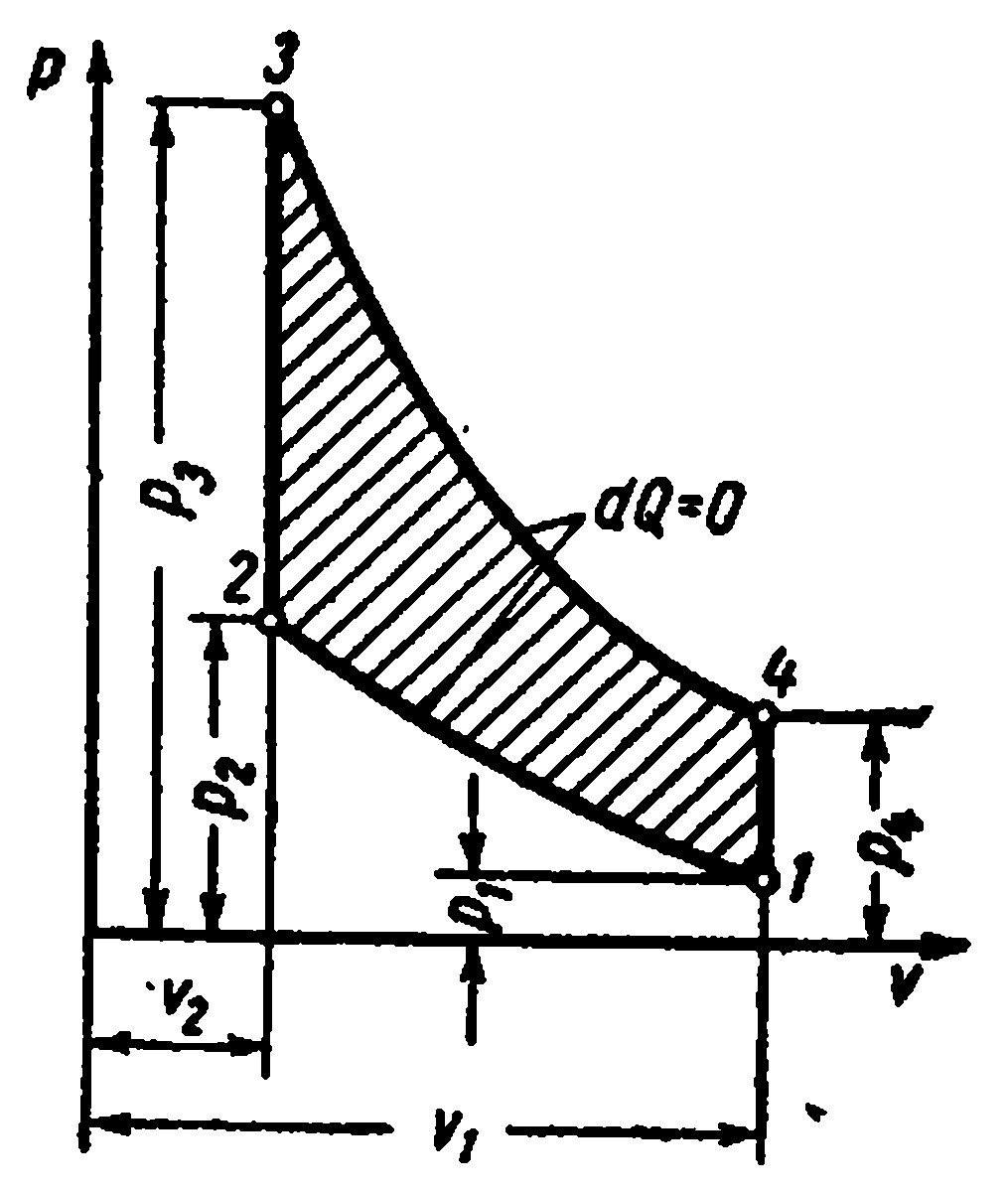
proces circular. Ciclul Carnot.
Să ne înfățișăm în TS – diagrama unui ciclu reversibil arbitrar 1 A2 b1 .

În procesul 1 A2 corpul de lucru primește cantitatea de căldură q 1 , numeric egal cu aria de sub curbă 1 A2, și în acest proces 2- b-1 dă cantitatea de căldură q 2 , numeric egal cu aria de sub curba 2- b-1.
O parte din căldură
intră în ciclu l (∆ u=0 în buclă).
Lucrul ciclului este pozitiv dacă ciclul trece în sensul acelor de ceasornic și negativ dacă este în sens invers acelor de ceasornic (direcția ciclului este în pVșiTS− diagrame este la fel).
Eficiență termică proces circular
Modificarea entropiei în orice ciclu este zero.
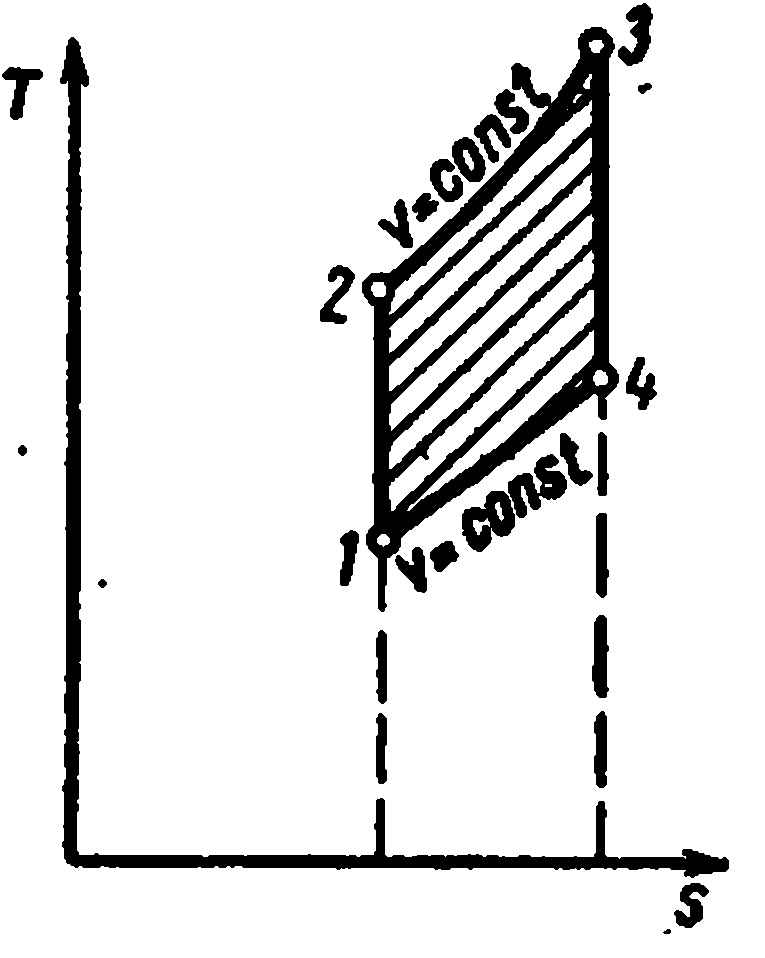
Ciclul Carnot este format din două izoterme și două adiabate. LA TS- în diagramă, va fi afișat ca dreptunghi (liniile orizontale sunt izoterme, liniile verticale sunt adiabate)
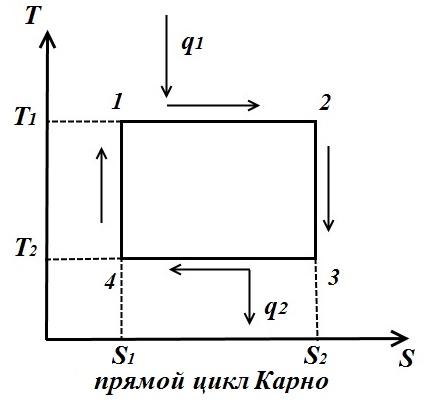
Cantitatea de căldură furnizată fluidului de lucru este numeric egală cu aria dreptunghiului 12 S 2 S 1 :
Cantitatea de căldură transferată la frigider corespunde zonei dreptunghiului 34 S 1 S 2 :
Căldură echivalentă cu munca ciclului, egală cu aria ciclului
Eficiență termică ciclu
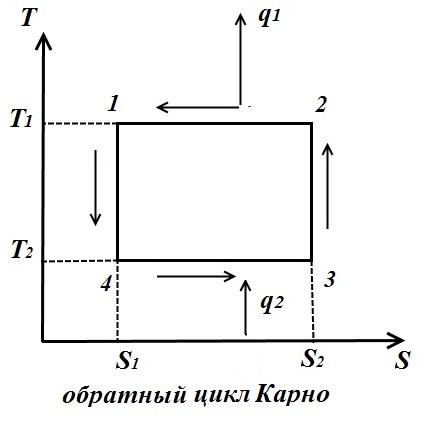
Pentru ciclu invers (fig. dreapta)
Coeficientul de performanță al ciclului invers
![]()
Temperatura medie integrală
Într-un ciclu reversibil arbitrar, căldura este furnizată și îndepărtată la temperaturi variabile. Pentru a simplifica studiile termodinamice, este introdus conceptul de temperatură medie integrală.
Luați în considerare un proces politropic arbitrar în TS- o diagramă în care se furnizează căldură fluidului de lucru q(procesul 1-2).
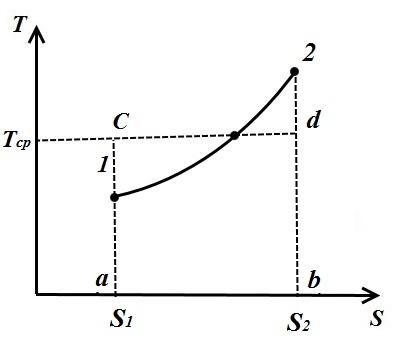
Sub temperatura medie integrală a fluidului de lucru în procesul 1-2 se înțelege temperatura, care este egală cu înălțimea dreptunghiului abdc zonă egală A12 b sub curba procesului 1-2, adică
![]()
Pentru că
și segmentul
Astfel, temperatura medie integrală a gazului pentru orice proces este egală cu raportul dintre cantitatea, căldură, furnizată gazului sau preluată din acesta, și modificarea entropiei.
Pentru orice proces politropic
![]()
și temperatura medie integrală (de la (*))

Aceasta arată că temperatura medie integrală în orice proces politropic depinde doar de inițială T 1 si finala T 2 temperaturile și nu depinde de natura procesului.
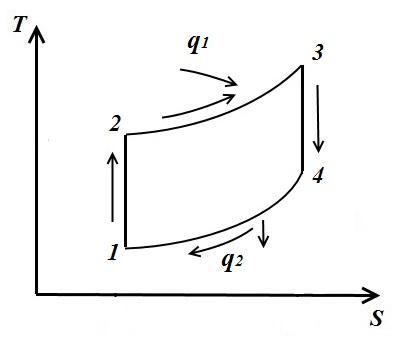
Într-un ciclu arbitrar în care compresia și expansiunea gazului sunt adiabatice (secțiunile 1-2, 3-4), cantitatea de căldură furnizată secțiunii 2-3
și retras la secțiunea 4-1
Apoi randamentul termic ciclu
![]() ,
,
adică eficiența termică ciclu arbitrar este egal cu randamentul termic. Ciclul Carnot, realizat între temperaturile medii integrale ale proceselor, în rezumat T 1 cpși luând T 2 cp căldură.
Ciclul Carnot generalizat
Ciclul Carnot are cea mai mare eficiență termică. sunt totuşi posibile şi alte cicluri care, în anumite condiţii suplimentare, pot avea o eficienţă termică egală cu randamentul. ciclul Carnot.
Luați în considerare un exemplu de astfel de ciclu din Fig. prezintă ciclul Carnot 1-2-3-4, format din două adiabate 2-3, 4-1 și două izoterme 1-2, 3-4.
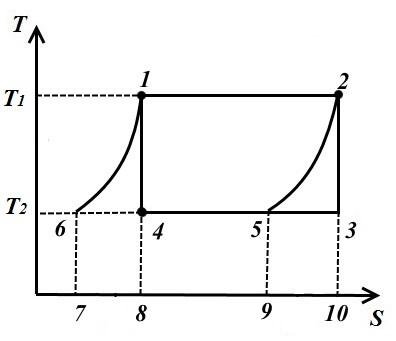
Desenați două curbe echidistante 1-6 și 2-5 din punctele 1 și 2 până când se intersectează cu izoterma T 2 = constși considerăm ciclul invers 1-2-5-6, format din două izoterme și două curbe echidistante 6-1 (politropi) și 2-5.
În procesul 1-2 la fluidul de lucru la o temperatură T 1 = const cantitatea de căldură furnizată
În procesul 2-5, o cantitate de căldură egală cu aria figurii 9-5-2-10 este îndepărtată din fluidul de lucru.
În procesul 5-6 din fluidul de lucru la T 2 = const cantitatea de căldură îndepărtată
În procesul 6-1, cantitatea de căldură este furnizată fluidului de lucru q 6-1 , egal cu aria lui 7-6-1-8.
Deoarece curbele 1-6, 2-5 sunt echidistante, atunci mp 7618 = pl. 952-10 prin urmare, cantitatea de căldură este și ea aceeași.
Aceasta arată că radiatoarele intermediare și dispozitivele de transfer de căldură sunt doar regeneratoare de căldură, care preiau căldură din fluidul de lucru în procesul 2-5 și o dau în aceeași cantitate fluidului de lucru în procesul 6-1. Astfel, 1-2-5-6 surse externe valide sunt un dispozitiv de transfer termic cu temperatura T 1 și un radiator cu temperatură T 2 .
Căldura transformată în lucru într-un ciclu
Eficiență termică este determinat de formula
Adică randamentul termic ciclul considerat este egal cu randamentul. ciclul Carnot.
Ciclul termodinamic în care căldura este îndepărtată din fluidul de lucru în unul sau mai multe procese ale ciclului pentru furnizarea în unul sau mai multe procese se numește ciclu regenerativ.
Spre deosebire de ciclul Carnot, ciclul regenerativ necesită o sursă intermediară de stocare a căldurii.
Scala de temperatură termodinamică
Când se utilizează diferite corpuri termodinamice, scara este neuniformă din cauza particularităților expansiunii termice a acestor substanțe.
A doua lege a termodinamicii vă permite să construiți o scară de temperatură care nu depinde de proprietățile unui corp termometric (propus de Kelvin)
În ciclul Carnot, eficiența termică nu depinde de proprietățile fluidului de lucru, ci este o funcție de temperaturile sursei calde și reci.
Eficiență termică
Astfel, raportul dintre temperaturile fluidului de lucru poate fi determinat de raportul de căldură. Rezultă că, dacă ciclurile Carnot (Fig.) se formează folosind izoterme echidistante, atunci în aceste cicluri aceeași cantitate de căldură este convertită în muncă.

Lasă temperatura izotermei T 0 și T k corespund temperaturilor de topire a gheții (0 °C) și a apei de fierbere (100 °C).
În ciclul Carnot 1234 căldura este transformată în muncă q egal cu aria figurii 1234 . Dacă această zonă este împărțită de o grilă de izoterme echidistante în 100 de părți egale, în fiecare dintre ciclurile Carnot rezultate, cantitatea de căldură va fi convertită în lucru 0,01 q. Intervalul de temperatură dintre izoterme va fi de 1 °С.
În mod similar, se poate construi o scară care se află sub izoterma cu temperatura T 0 (0 °C).
Punctul inferior al scalei termodinamice este considerat temperatura la care eficiența termică Ciclul Carnot =1. Conform
la T 2 =0 . O temperatură mai scăzută nu poate exista, deoarece în acest caz , ceea ce contrazice legea a doua a termodinamicii.
prin urmare T=0 (-273.15 ) este cea mai scăzută temperatură posibilă și poate fi luată ca punct natural constant inițial pe scara temperaturii. Astfel, temperatura absolută nu poate avea valori negative.
Scala de temperatură termodinamică a fost obținută pentru un gaz ideal.
În termodinamică sunt studiate o mare varietate de procese. Cu toate acestea, ei disting patru procese principale considerate reversibile:
izocoric, curgând la volum constant;
izobaric, curgând la presiune constantă;
izotermic, curgând la temperatura constanta(denumirea procesului provine din combinarea cuvintelor grecești „isos” – egal și „terme” – căldură);
adiabatic, care curge fără furnizarea și îndepărtarea căldurii (în greacă „adiabatos” – impenetrabil).
În plus față de cele patru procese de bază enumerate în termodinamică, așa-numitele politropică procese (în greacă „poli” – mult, „tropos” – un mod). În aceste procese, toți parametrii fluidului de lucru se pot schimba simultan și, în plus, căldura este furnizată sau îndepărtată. După cum va fi explicat mai jos, cele patru procese de bază sunt cazuri speciale ale procesului politropic.
Metodologie pentru studiul proceselor termodinamice
În primul rând, trebuie remarcat faptul că orice proces de gaz în care
c = const se numește politropică cu ecuația generală pvn= const.
n numit indice politropic.
Tehnica de studiere a proceselor termodinamice este următoarea:
1. Setați ecuația pentru acest proces și produceți-o imagine graficăîn pvși Ts sisteme de coordonate (cel din urmă este discutat mai jos).
2. Setați raportul dintre p,vși T.
3. Conform formulei de calcul comună pentru toate procesele, determinăm modificarea energiei interne ( du= c v dT).
4. Prin ecuație generală munca determină munca unui proces termodinamic dat.
5. Căldura acestui proces este determinată de formula q = .
Procesul izocor
1. Ecuația politropică pv n= const poate fi scris ca p v=const, ceea ce arată că pentru un proces izocor n ia valoarea.
2. Din ecuațiile de stare p 1 v = RT 1 și p 2 v = RT 2 primim.
În practică, acest proces are loc ca componentă procesele care au loc la motoarele cu ardere internă (formarea de explozie (combustie combustibil) la motoarele cu carburator) și în timpul răcirii sau încălzirii gazului într-un cilindru (Fig. 9, a).
5.q = u acestea. toată căldura furnizată merge la creșterea energiei interne. Coeficientul arată ponderea de căldură folosită pentru modificarea energiei interne; 1 –z arată cât de mult din aportul de căldură este folosit pentru a lucra. Isochora în T-s coordonatele (Fig. 9, b) este reprezentată printr-o curbă logaritmică (vezi 6.5).
proces izobaric
1. Din ecuația politropică pv n= const, se poate observa că se transformă în ecuația procesului izobar ( R= const) când n= 0.
2. Din ecuațiile de stare pv 1 = RT 1 și pv 2 = RT 2 avem
3. u= cu v(T 2 – T 1). (47)
4. adică . (48)
5.dq = du + d . (49)
Să determinăm cum este distribuită căldura furnizată:
z = = ,
acestea. din toată căldura furnizată.
Acest proces este parte integrantă Cicluri ICEşi turbine cu gaz (Fig. 10). Isobar în T-s coordonatele este reprezentată de o curbă logaritmică care este mai plată decât izocorul (deoarece cu p > cu v, vezi 6.5).
Proces izotermic
1.T= const , pvn = const . Din ecuatii de stare pv=RT rezultă că pentru acest proces n ar trebui să fie egal cu 1, adică pv= const. Izotermă în p-v coordonatele este reprezentată de o hiperbolă isoscelă (Fig. 11, a), iar în T-s coordonate - o linie dreaptă (Fig. 11, b).
2. p 1 v 1 = p 2 v 2 ; . (50)
3. du=0, t .la. dT= 0.
5. q= , în acest proces toată căldura intră în lucru.
Acesta este cel mai avantajos procedeu pentru comprimarea compresoarelor, ca temperatura de compresie este constantă
z= 1 – z= 1.
proces adiabatic
Un proces adiabatic este un proces care nu face schimb de căldură cu mediul. Toate procesele rapide (împușcare, explozie, flux de abur prin partea de curgere a turbinei etc.) se apropie foarte mult de adiabatic.
Din acest motiv, în cele ce urmează, procesele termice reale care se desfășoară destul de rapid, cu o eroare de inginerie acceptabilă, vor fi considerate procese adiabatice (de exemplu, procesele de compresie și dilatare în motoarele termice).
1. dq = cu v dT + pdv; dq= 0, atunci
cu v dT + pdv = 0. (52)
Diferențiază pv=R.T. obține pdv+vdp=RdT, Unde . Să înlocuim cele primite dTîn (52): . Împarte la si ia pdv= 0. Cu toate acestea, = k-1, atunci pdv + vdp + (k– 1)pdv = 0.
pdv + vdp + kpdv – pdv= 0. Împărțiți la p v: . Ne integrăm și obținem ln p+ln v k= const sau ln( p.v.k) = const. LA forma finala se obtine ecuatia adiabatica:
pv k = const . (53)
LA p-v coordonatele adiabatice este o hiperbolă cu laturi inegale care merge mai abruptă decât izoterma ( n=k= 1.4, fig. 12a).
2. Din ecuația adiabatică p 1 v 1 k = p 2 v 2k. . De aici
Scriem ecuația caracteristică pentru punctele 1 și 2: p 1 v 1 =RT 1 și p 2 v 2 =RT 2 și împărțiți primul la al doilea. obține
Acum să folosim expresia (54), înlocuind-o în expresia (55):
Pentru a obține relația dintre temperaturi și presiuni, înlocuim în (55) , exprimat prin raportul de presiune din (54):
3, 4. În procesul adiabatic, schimbarea energiei interne este utilizată pentru a efectua munca: O = d + du, prin urmare d = -du sau .
După integrare, obținem sau (pentru că odată cu extinderea )
Din ecuația lui Mayer c p – c v = R. c p = kc v. De aici kcv – cv = Rși .
Înlocuiți valoarea rezultată c vîn formula (58):
Din ecuația Clapeyron ( pv=RT) poate fi scris și luând p 1 v 1 în afara parantezelor, obținem
5. q= 0.
Într-un proces adiabatic, entropia rămâne constantă ( s= const), deci acest proces este uneori numit izoentropic (vezi 5.6).
Coeficient z nu are sens.
Proces politropic
Toate procesele considerate mai sus au avut o caracteristică: în fiecare dintre ele, a fost impusă o restricție asupra oricăreia dintre cantități ( R= const, t= const, v= const, dq= 0). Prin urmare, aceste procese pot fi considerate cazuri speciale de modificări ale stării gazului.
În plus, o consecință a acestor limitări este că căldura de intrare sau de ieșire q distribuită între şi în aşa fel încât să capete o anumită valoare.
Cu toate acestea, este evident că pot exista procese în care nu există aceste restricții și z poate lua alte valori. Singura limitare pentru astfel de procese va fi persistența z, adică și constanța capacității termice (deoarece, q = Cu ).
Prin integrarea lui cu n= const, obținem ecuația politropică
pvn= const. (65)
După cum sa menționat mai sus, indicatorul n capătă o valoare specifică pentru fiecare proces.
Deoarece ecuația politropică nu diferă ca formă de ecuația adiabatică, toate relațiile dintre parametrii principali sunt reprezentate prin formule similare procesului adiabatic
Același lucru se poate spune despre expresiile pentru determinarea lucrului procesului politropic
n1.docx
*Prima lege a dinamicii.
Parametrii corpului de lucru p, V, T, U, i, S.
Energia internă a corpului de lucru
Energia internă a corpului de lucru. sens fizicși dimensiune.
Procesele sunt reversibile și ireversibile. Echilibru și dezechilibru.
Entalpie. proprietăți fizice.
Capacitatea termică a fluidului de lucru
Proces de gaz izocoric
Procesul de gaz izobar.
Proces de gaz izotermic.
proces de gaz adiabatic.
A doua lege a termodinamicii
Formulări ale celei de-a doua legi a termodinamicii.
Ciclul Carnot și proprietățile sale.
Tabele vaporilor de apă.
i – S diagrama vaporilor de apa.
proces adiabatic p – V , i – S și T – S diagrame.
Compresie în mai multe etape în compresor.
Ciclul ICE cu ardere la V= const
Ciclul ICE cu ardere la p= const
Ciclu ICE cu alimentare de căldură la Vșip = const
Ciclu ICE cu alimentare mixtă de căldură.
Ciclul unei instalații cu turbine cu gaz
Ciclu de alimentare cu abur. Ciclul Rankine.
Ciclul de refrigerare al compresorului de aer.
Ciclul de refrigerare a compresorului de abur.
Procesul de vaporizare în p – V diagramă.
Proces p = const vapor de apă. Procesați imaginea în p – V , i – S și T – S diagrame.
Reîncălzire cu abur.
Proces T= const vapor de apă. Procesați imaginea în p – V , i – S și T – S diagrame.
Tabele capacităților termice medii. Determinarea căldurii folosind tabele.
Consumul specific de abur și căldură în centralele cu abur
Ciclul centralei cu turbine pe gaz cu regenerare.
Ecuația de stare a fluidului de lucru.
Formula Mayer.
Conceptul de „coeficient de răcire”.
Prima lege a termodinamicii este un caz special al legii generale a conservării și transformării energiei în raport cu procesele de transformare reciprocă a căldurii și a muncii. Legea prevede că suma tuturor tipurilor de energie dintr-un sistem izolat rămâne constantă pentru orice procese care au loc în sistem:
În timpul implementării unui proces termodinamic, căldura este furnizată corpului Q merge să-și schimbe energia internă și să efectueze lucrări mecanice:
Pentru 1 kg fluid de lucru
PARAMETRII CORPULUI DE LUCRUP , V , T , U , eu , S .
Se numesc mărimile care caracterizează corpul într-o stare dată parametrii state. Cel mai adesea, starea corpului este determinată de următorii parametri: volum specific, presiune, entalpie și temperatură.
Volum specific (v) corpul este volumul unei unități de masă. În termodinamica tehnică, un kilogram (kg) este luat ca unitate de masă, iar un metru cub (m 3) este luat ca unitate de volum. În cazul în care un V - volumul în m 3 ocupat de masa corporală M în kg, apoi volumul specific
Densitate este reciproca volumului specific
presiune pîn sistem international unitățile (SI) se măsoară în pascali. Pascal (Pa) - presiune cauzată de o forță de 1 newton (N), distribuită uniform pe o suprafață normală cu o suprafață de 1 m 2. Astfel, în unitățile SI, pascalul se măsoară în newtoni pe metru pătrat (N/m 2).
Temperatura caracterizează gradul de încălzire a corpului. Se măsoară fie pe scara de temperatură termodinamică, fie pe scara practică internațională de temperatură. Unitatea de măsură a temperaturii termodinamice este kelvinul (K), care este 1/273,16 din temperatura termodinamică a punctului triplu al apei.
Entalpie
u si functioneaza pv .
Unde dl t ( dl t = - vdp ).
Valoare i p , v , T , și. Sensul fizic al cantității i poate fi explicată pe baza ecuației dq = di - vdp, care pentru proces p = const va fi scris astfel:
dq p = di . (86)
De unde rezultă că di
Modificarea entalpiei în orice proces este determinată doar de stările inițiale și finale ale corpului și nu depinde de natura procesului.
Entropie este o funcție de stare, prin urmare modificarea sa în procesul termodinamic este determinată numai de valorile inițiale și finale ale parametrilor de stare. Modificarea entropiei în procesele termodinamice de bază:
în izocoric
în izobar
în izotermă
în adiabatic
în politropic
ENERGIA INTERNĂ A CORPULUI DE LUCRU, SENSUL FIZIC ȘI DIMENSIONALITATEA.
Energie interna- aceasta este toată energia conținută în corpul sau sistemul de corpuri. Această energie poate fi reprezentată ca sumă anumite tipuri energii: energia cinetică a moleculelor, inclusiv energia de translație și mișcare de rotație molecule și mișcare oscilatorie atomi din molecula însăși; energia electronilor; energie intranucleară; energiile de interacțiune dintre nucleul unei molecule și electroni; energia potențială sau energia poziției moleculelor în orice câmp extern de forțe; energia radiațiilor electromagnetice.
Energia internă totală a corpului este de obicei indicată U(J)și energia internă specifică tu (j/kg) .
Energia internă este:
Unde este interiorul energie kinetică molecule, interne energie potențială molecule, este constanta integrării.
În termodinamica tehnică, sunt luate în considerare doar astfel de procese în care componentele cinetice și potențiale ale energiei interne se modifică.
Modificarea energiei interne a unui gaz ideal pentru orice proces cu o schimbare infinitezimală de stare (pentru 1 kg)
În calculele termice, de obicei se cere să se cunoască modificarea energiei interne, și nu valoarea sa absolută; prin urmare, punctul de referinţă (0 K sau 0 0 C) pentru rezultat final() irelevant.
unde este capacitatea medie de căldură în masă la un volum constant în interiorul
Astfel, modificarea energiei interne a unui gaz ideal pentru orice proces este egală cu produsul dintre capacitatea termică medie la un volum constant și diferența de temperatură a gazului.
PROCESELE SUNT REVERSIBILE ȘI IREVERSIBILE. ECHILIBRI ŞI NEECHILIBRI
Un proces termodinamic este o schimbare secvențială a stării unui corp care are loc ca urmare a interacțiunii energetice a corpului de lucru cu mediul.
Conceptele de proces termodinamic reversibil și ireversibil sunt strâns legate de echilibrul sistemului. Să luăm în considerare un astfel de sistem termodinamic în care nu există schimb de căldură cu mediul (sistem termodinamic adiabatic). Procesele termodinamice care au loc într-un astfel de sistem se numesc reversibile dacă sistemul revine la starea inițială în timpul proceselor directe și inverse fără niciun efect termic suplimentar. mediu inconjurator la sistem. Dacă sistemul nu poate reveni la starea inițială în timpul procesului invers sau acest lucru necesită alimentare cu căldură, atunci un astfel de proces este numit ireversibil.
Procesul cu fiecare modificare a presiunii și a temperaturii poate fi reversibil numai dacă, de-a lungul întregului proces de la un punct la altul al sistemului termodinamic, presiunea este constantă și temperatura în fiecare punct este egală cu temperatura ambiantă sau diferența lor este infinit mică. .
Procesele termodinamice reversibile sunt cazul ideal sau teoretic. Toate procesele reale sunt ireversibile, deoarece în practică este dificil de satisfăcut condiția cvasi-statică. În plus, ireversibilitatea proceselor este cauzată de prezența frecării interne în fluidul de lucru și a frecării de suprafață în echipamentele tehnice (curgerea în duză, frecarea suprafeței pistonului față de peretele cilindrului etc.). Pentru a depăși frecarea, este întotdeauna necesar să cheltuiți o cantitate de muncă mecanică, care în cursul procesului este transformată în căldură.
ENTALPIE. PROPRIETĂȚI FIZICE
Entalpia unui corp termodinamic este suma energiei interne u si functioneaza p v .
Unde dl t - există o diferență în munca tehnică ( dl t = - vdp ).
Ecuația rezultată este și a doua formulare a primei legi a termodinamicii, folosind conceptele de entalpie și de lucru tehnic. 
Valoare i poate fi considerat și ca un parametru al stării unui corp termodinamic alături de cel introdus anterior p , v , T , u . Sensul fizic al cantității i poate fi explicat pe baza ecuației ( dq = di - vdp), care pentru proces p = const se va scrie ca: dq p = di .
De unde rezultă că di
este o cantitate elementară de căldură furnizată unui corp termodinamic în procesul de presiune constantă.
Modificarea entalpiei în orice proces este determinată numai de stările inițiale și finale ale corpului și nu depinde de stările intermediare și de natura procesului.
CAPACITATEA TERMICA A MEDIULUI DE LUCRU
capacitate termică numiți cantitatea de căldură care trebuie transmisă unui corp (gaz) pentru a crește temperatura oricărei unități cantitative cu 1 ° C.
Pentru a determina valorile capacităților termice enumerate mai sus, este suficient să cunoașteți valoarea uneia dintre ele. Cel mai convenabil este să aveți valoarea capacității de căldură molare, apoi capacitatea de căldură în masă:
și capacitatea termică volumetrică:
Capacitățile termice volumetrice și de masă sunt interconectate prin dependență:
unde este densitatea gazului în condiții normale.
Capacitatea termică a unui gaz depinde de temperatura acestuia. Pe această bază, se distinge capacitate termică medie și reală.
În cazul în care unq-
cantitatea de căldură raportată unei unități de cantitate de gaz (sau luată din aceasta) atunci când temperatura gazului se schimbă de la t 1
inainte de t 2
apoi
Reprezintă capacitate termică medieîn. Limita acestui raport, atunci când diferența de temperatură tinde spre zero, se numește capacitate termică adevărată.
PROCESUL DE GAZ ISOCORIC
Procesul izocor- procesul de comunicare sau îndepărtare a căldurii la un volum constant de gaz (
v
=
const).
La un volum constant, presiunea unui gaz se modifică direct proporțional cu temperaturile absolute:
Munca externă gaz la v
=
const este nul l=0.
cantitatea de căldură sau modificarea energiei interne a gazului:
Procesul izocor pv- diagrama afișat printr-o linie dreaptă verticală - izocor. Cu o cantitate pozitivă de căldură, linia merge de jos în sus.
Modificarea entropiei este:
PROCESUL DE GAZ ISOBARIC.
Proces izobaric - procesul de comunicare sau îndepărtare a căldurii la presiune constantă (R
= const)
Curba procesului se numește izobară.
Pentru că într-un proces izobaric dp=0
atunci nu se efectuează nicio lucrare tehnică în sistem, iar cantitatea de căldură necesară pentru a transfera corpul din starea 1 în starea 2 este determinată astfel:
Astfel, într-un proces termodinamic izobaric, cantitatea de căldură furnizată (eliminată) corpului este proporțională cu modificarea entalpiei în acest proces. Această concluzie este valabilă atât pentru procesele reversibile, cât și pentru cele ireversibile, cu condiția ca sistemul să fie în echilibru termodinamic la începutul și la sfârșitul procesului.
Pentru un proces reversibil:
proces izobaric pv –
diagrama este afișată ca o linie orizontală dreaptă. Când se adaugă căldură procesului, linia se extinde de la stânga la dreapta.

Lucru mecanic într-un astfel de proces:
Muncă externă specifică de unică folosință (utilă):
Din ecuația de stare pentru un gaz ideal, se poate obține următoarea relație pentru un proces izobar:
Astfel, într-un proces izobaric, volumul unui gaz ideal este proporțional cu temperatura absolută. Când un gaz se dilată, temperatura crește; când este comprimat, scade.
Modificarea entropiei într-un proces izobaric poate fi calculată după cum urmează:
PROCESUL DE GAZ IZOTERM.
Proces izotermic - procesul de comunicare sau. îndepărtarea căldurii la temperatură constantă (
t
-
const)
Pentru un proces izoterm al unui gaz ideal, relația dintre parametrii inițiali și finali este determinată de formulele:
La temperatură constantă, volumul unui gaz se modifică invers cu presiunea acestuia.
Pe pv-
Diagramele izoterme ale gazelor ideale sunt reprezentate printr-o hiperbolă echilaterală. Aria de sub curba procesului exprimă numeric lucrul mecanic într-un proces dat. 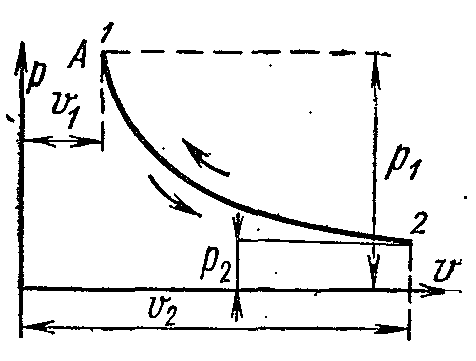
Lucrul a 1 kg dintr-un gaz ideal se găsește din ecuațiile:
Întrucât într-un proces izoterm t
= const, apoi pentru un gaz ideal
Modificarea entropiei într-un proces izoterm
Exprimat prin următoarea formulă:
PROCESUL GAZ ADIABATIC.
Procesul se desfășoară fără furnizarea și îndepărtarea căldurii, de ex. în absența schimbului de căldură cu mediul, se numește adiabatic, iar curba acestui proces se numește adiabatic. Conditii de proces: dq=0 , q=0.
pentru că dq=0 , apoi conform primei legi a termodinamicii:
Astfel realizat de corpul de lucru munca mecanicaîntr-un proces termodinamic adiabatic este egal cu o scădere a energiei interne a corpului, în timp ce munca tehnică este proporțională cu modificarea (scăderea) entalpiei. Într-un proces diabatic reversibil, entropia unui corp termodinamic nu se modifică: S= Const.
Ecuația adiabatică în sistemul de coordonate pv – diagrame la capacitate termică constantă () pentru un gaz ideal: unde este exponentul adiabatic
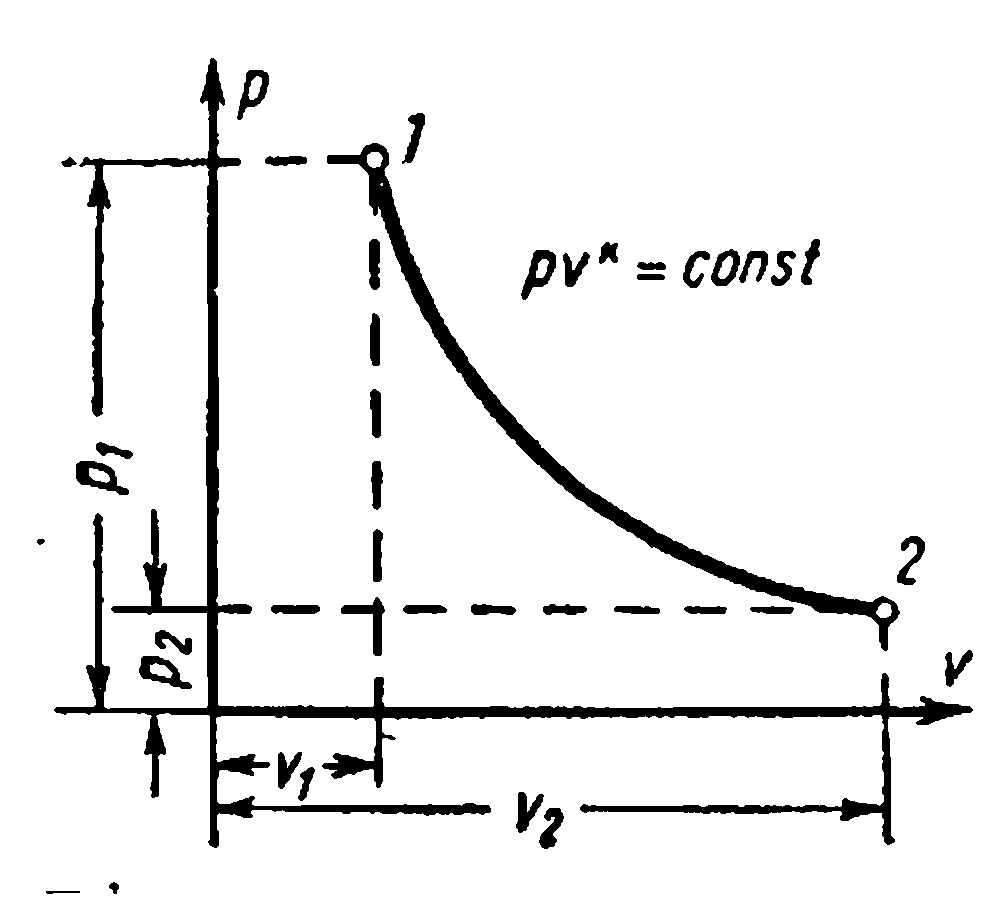
Dependenţe între parametrii iniţiali şi finali ai procesului: între R și v ,
între T și v
între R și T
Lucrul a 1 kg de gaz se constată prin următoarele formule
Modificarea energiei interne a gazului și activitatea procesului adiabatic sunt egale ca mărime și semn opus. .
Modificarea energiei interne a unui gaz ideal într-un proces adiabatic poate fi exprimată și prin ecuație
A doua lege a termodinamicii
A doua lege a termodinamicii stabilește direcția fluxului proceselor termice spontane în natură și determină condițiile pentru transformarea căldurii în muncă. Legea spune că căldura în natură trece spontan doar de la corpurile care sunt mai fierbinți la mai puțin fierbinți.
În conformitate cu cea de-a doua lege a termodinamicii, pentru a transforma căldura în lucru în orice motor termic, este necesar să existe două corpuri cu temperaturi diferite. Un corp mai fierbinte va fi o sursă de căldură pentru muncă, un corp mai puțin încălzit va fi un radiator. În acest caz, eficiența motorului termic va fi întotdeauna mai mică decât unitatea.
A doua lege a dinamicii poate fi exprimată matematic:
Unde dS –
o creștere infinitezimală a entropiei sistemului;
dQ – o cantitate infinitezimală de căldură primită de sistem de la o sursă de căldură;
T - temperatura absolută a sursei de căldură.
Semnul inegalității corespunde proceselor ireversibile și este egal cu cele reversibile. Prin urmare, expresia analitică pentru cea de-a doua lege a termodinamicii pentru un proces reversibil infinit mic ia forma
dQ= TdS
iar din moment ce conform primei legi a termodinamicii
dQ=dU+pdV
TdS=dU+pdV.
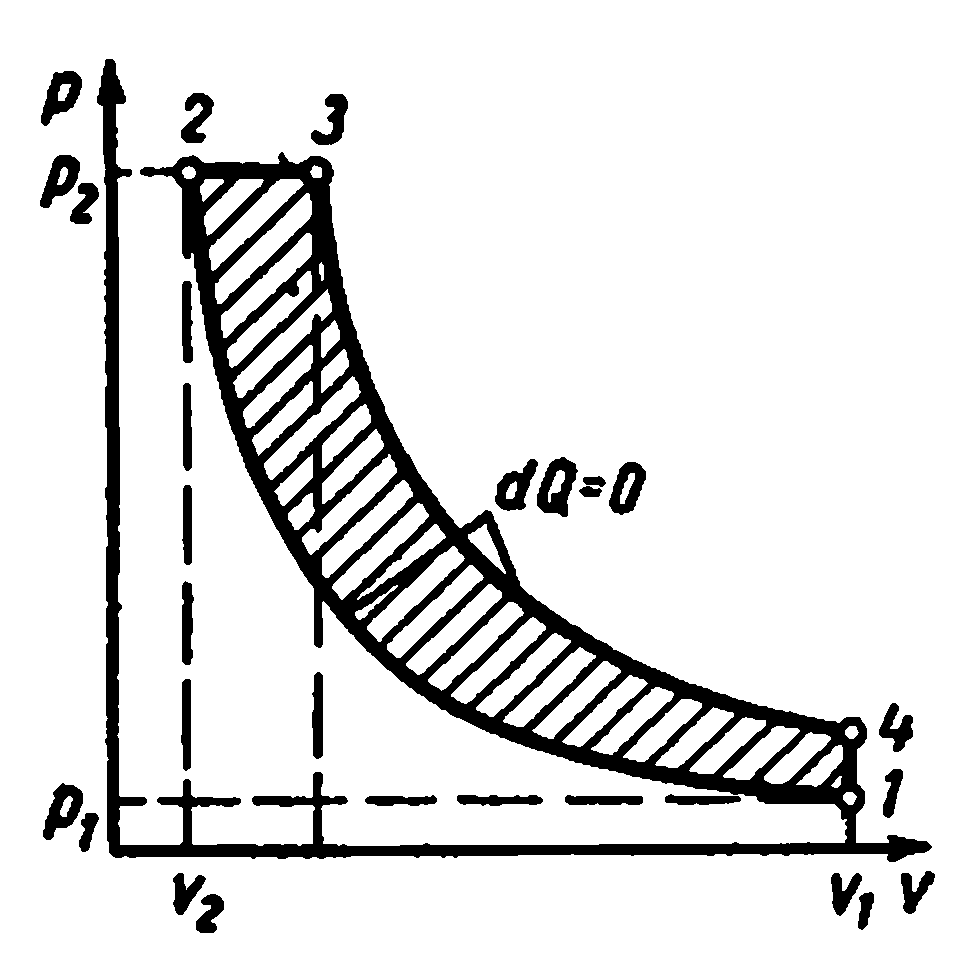
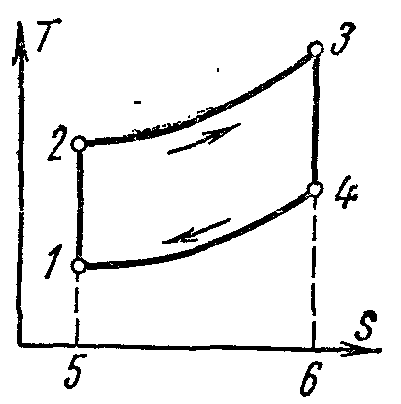
Ciclul Carnot și proprietățile sale.
Ciclul Carnot. Este format din două izoterme și două adiabate. Acest ciclu este un proces închis efectuat de fluidul de lucru într-un motor termic ideal în prezența a două surse de căldură: un încălzitor și un frigider.

ciclul lui Carnot pv-diagramă
Procesele 1-2 și 3-4 sunt izoterme, în timp ce procesele 2-3 și 4-1 sunt adiabatice. Se ia temperatura inițială a fluidului de lucru în ciclu egal cu temperaturaîncălzitorT 1 . În timpul expansiunii izoterme de la starea 1 la starea 2, fluidul de lucru primește de la încălzitor cantitatea de căldurăq 1 la o temperaturăT 1 . În secțiunea 2-3, fluidul de lucru se extinde adiabatic. În același timp, temperatura fluidului de lucru scade de laT 1 inainte de T 2 iar presiunea scade din p 2 inainte de p 3 . Când este comprimată de-a lungul izotermei 3-4, cantitatea de căldură este îndepărtată din fluidul de lucru la frigider.q 2 la o temperaturăT 2 . Contracție adiabatică în continuare4-1 duce la o creștere a temperaturii fluidului de lucru dinT 2 inainte de T 1 , iar fluidul de lucru revine la starea inițială.
Ciclu total de lucrul c reprezentată grafic printr-o zonă de 12341.
Eficiența ciclului termic:
Lucrarea ciclului Carnot
Eficiență termică ciclu:

Caracteristicile ciclului:
Rata compresiei
Raportul de presiune
Cantitatea de căldură furnizată:
Cantitatea de căldură îndepărtată:
Ciclu de lucru
Eficiență termică ciclu:
Un ciclu cu alimentare de căldură la presiune constantă este format din două adiabate, un izobar și un izocor.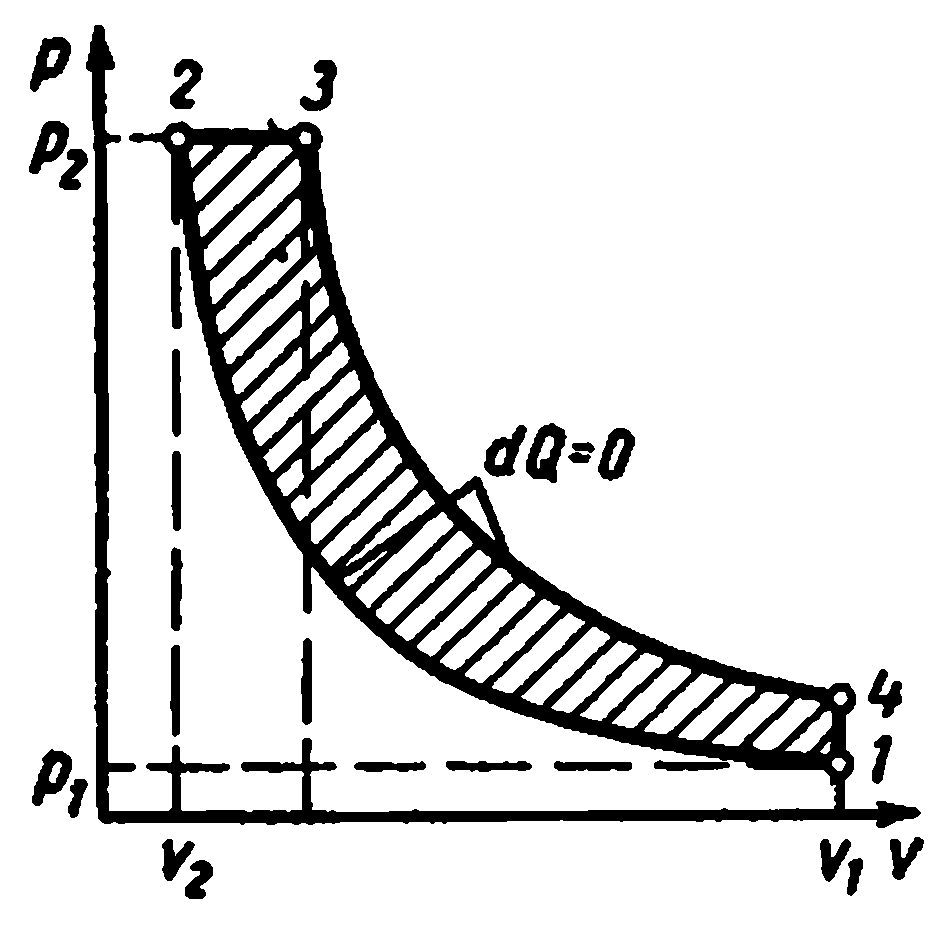
Caracteristicile ciclului:
Rata compresiei
Cantitatea de căldură furnizată:
Cantitatea de căldură îndepărtată:
Ciclu de lucru
Eficiență termică ciclu:
Ciclu cu alimentare combinată de căldură constă din două adiabate, două izocore și o izobară

Caracteristicile ciclului
Cantitatea de căldură furnizată
Cantitatea de căldură îndepărtată
Eficiență termică ciclu
Tabele vaporilor de apă.
abur supraîncălzit sau abur saturat în proprietățile lor diferă semnificativ de gaze ideale. Ecuațiile pentru starea vaporilor sunt foarte complexe și nu sunt utilizate în practica de calcul. În scopuri practice, se folosesc tabele și diagrame, întocmite pe baza datelor experimentale și teoretice. Tabelele sunt întocmite cu un grad ridicat de precizie pentru supraîncălzit și vapori saturati până la o temperatură de 1000 0 C şi o presiune de 98,0 MPa.
În tabelele pentru abur saturat temperaturi de saturație, presiuni, valori volume specifice, entalpia și entropia aburului lichid și uscat, căldura de vaporizare. În tabelele de abur supraîncălzit, sunt date valorile parametrilor principali pentru diferite presiuni și temperaturi: volum specific, entalpie și entropie.
i – S diagrama vaporilor de apa.
mare demnitate este diagrama este că munca tehnică și cantitatea de căldură implicată în procese sunt reprezentate de segmente de linie, nu de zone. La construirea este- diagrame trasate de-a lungul axei y entalpie specifică pereche, iar de-a lungul abscisei este entropia specifică. Originea coordonatelor este considerată a fi starea apei în punct triplu, Unde, .
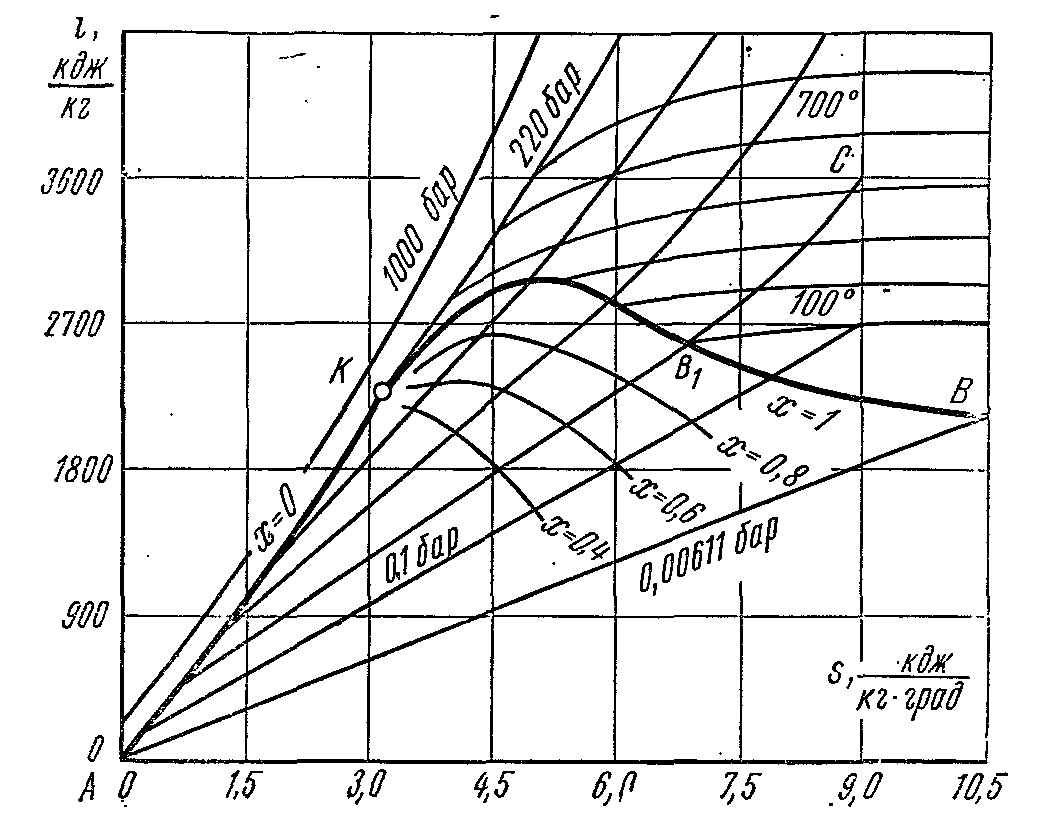
Folosind datele tabelelor vaporilor de apă, pe diagramă sunt trasate curbele limită ale lichidului și vaporilor, convergând în punctul critic K. Curba limită a lichidului părăsește originea, deoarece în acest moment, entropia și entalpia sunt luate egale cu zero. Starea apei este marcată cu puncte pe izobarele corespunzătoare. Liniile izobare din zonă abur umed sunt linii drepte înclinate care ies în evantai din curba limitei fluidului. Într-un proces izobaric:
Panta izobarei la abscisă în fiecare punct al diagramei este numeric egală cu temperatura absolută a stării date. pentru că în zona aburului umed, izobara coincide cu izoterma, apoi, conform ultimei ecuații, izobara aburului umed sunt linii drepte:
Și aceasta este ecuația unei linii drepte. În regiunea aburului supraîncălzit, izobarele au o curbură cu o convexitate îndreptată în jos. În zona aburului umed, se aplică o grilă de linii de uscăciune constantă a aburului (x=const), care converg în punctul critic K.
Izotermele din regiunea aburului umed coincid cu izobarele. În zona aburului supraîncălzit, ele diverg: izobarele se ridică, iar izotermele sunt linii curbe cu o convexitate în sus. Diagramei i se aplică o grilă de izocore, care au forma unor curbe care se ridică mai abrupt în comparație cu izobarele. Un proces adiabatic reversibil este reprezentat de o linie dreaptă verticală. Zona de sub izobara punctului triplu ilustrează stările amestecului de abur + gheață.
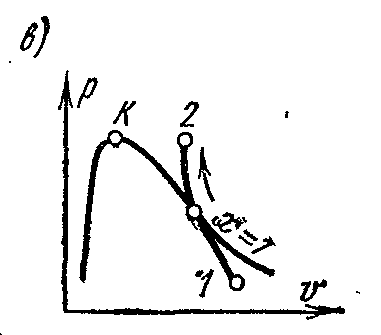
proces adiabaticp – V , i – S șiT – S diagrame.
Procesul adiabatic are loc fără furnizarea și îndepărtarea căldurii, iar entropia fluidului de lucru în procesul reversibil rămâne valoare constantă: s=const. Prin urmare, pe este
și
Ts-
Diagramele adiabatice sunt reprezentate prin linii drepte verticale: fig. a și b 

În timpul expansiunii adiabatice, presiunea și temperatura vaporilor scad; aburul supraîncălzit se transformă în abur uscat și apoi în abur umed. Din condițiile de constanță a entropiei, este posibil să se determine parametrii finali ai aburului dacă sunt cunoscuți parametrii stării inițiale și un parametru ai stărilor finale.
Pe pv- în diagramă, un proces adiabatic reversibil este reprezentat printr-o anumită curbă (Fig. c)
Lucrarea specifică într-un proces adiabatic este determinată din ecuația:
Modificarea energiei interne specifice:
Compresie în mai multe etape în compresor.
Compresoarele cu mai multe trepte sunt folosite pentru a produce gaz de înaltă presiune
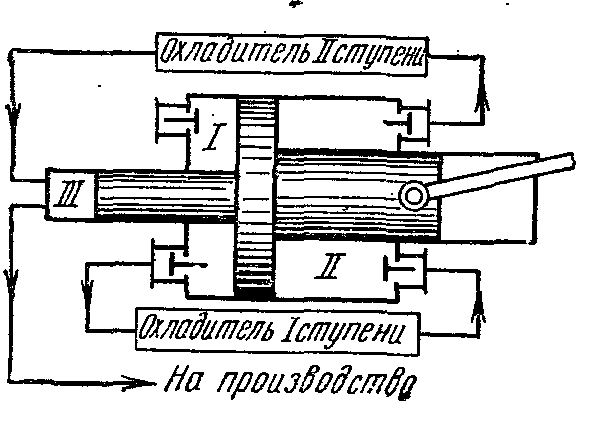
În care comprimarea gazului se realizează politropic în mai mulți cilindri conectați în serie cu răcirea sa intermediară după fiecare compresie.
Utilizarea compresiei gazului în mai multe cilindri scade raportul de presiune în fiecare dintre ele și crește eficiența volumetrică. compresor. În plus, răcirea intermediară a gazului după fiecare etapă îmbunătățește condițiile de lubrifiere a pistonului din cilindru și reduce consumul de energie pentru antrenarea compresorului.

Diagrama indicatoare ideală a unui compresor în trei trepte, unde 0-1 este linia de aspirație la prima treaptă;
1-2 - proces de compresie politropică în prima etapă; 2-a - linie de injecție de la prima treaptă la primul răcitor; a-3 - conductă de aspirație la a doua treaptă; 3-4 - proces de compresie politropică în a doua etapă; 4-c - linia de refulare de la a doua treaptă la al doilea răcitor; c-5 - conductă de aspirație la a treia treaptă; 5-6 - proces de compresie politropică în a treia etapă; 6-c - linie de injecție de la a treia etapă la rezervor sau la producție. Segmentele 2-3, 4-5 descriu scăderea volumului de gaz în proces la presiune constantă de la răcire în primul și al doilea răcitor. Răcirea fluidului de lucru în toate răcitoarele se realizează la aceeași temperatură egală cu T 1 inițial, prin urmare, temperaturile gazului la punctele 1, 3 și 5 sunt aceleași și se află pe izoterma 1 - 7.
Raportul presiunilor în toate etapele este de obicei luat același:
Cu aceleași rapoarte de presiune în toate etapele, egalitatea temperaturilor inițiale și egalitatea indicatorilor politropici, temperaturile finale ale gazului în treptele individuale ale compresorului sunt egale între ele:
Gradul de creștere a presiunii în fiecare treaptă sau la trepte z
Gradul de creștere a presiunii în fiecare etapă este egal cu rădăcina gradul z din rapoartele finale de presiune
Înapoi la inițială
Cu temperaturi egale ale gazului la intrarea în fiecare treaptă și rapoarte de presiune egale în toți cilindrii, obținem egalitatea muncii cheltuite în toate etapele compresorului:
În a doua etapă
Lucrați în a treia etapă
Unde l 1
=l 2
=l 3
Lucru specific total în jouli cheltuit pentru compresia gazului în trei trepte de compresor: l la =3 l 1
În aceleași condiții de compresie a gazului, cantitățile de căldură îndepărtate din gaz în etape individuale sunt egale între ele:
Căldura îndepărtată din gaz în orice răcitor în timpul procesului de răcire izobară se găsește după formula:

LA Ts- În diagrame, procesele de compresie adiabatică sunt prezentate prin liniile drepte 1-2, 3-4, 5-6, iar procesele de răcire prin curbele 2-3, 4-5, 6-7.
Procesele de compresie politropică sunt prezentate prin curbele 1-2, 3-4, 5-6, iar procesele de răcire în răcitoare - prin liniile 2-3, 4-5, 6-7.
Ciclul ICE cu ardere laV = const
![]()
Figura prezintă o diagramă indicatoare a unui motor care funcționează cu combustibil cu ardere rapidă la un volum constant. Ca combustibil se folosesc benzina, gaz de iluminat sau generator, alcooli etc.
Când pistonul se mișcă din poziția moartă din stânga la extrema dreaptă, amestecul combustibil este aspirat prin supapa de aspirație. Acest proces este descris printr-o curbă 0-1, numită linie de aspirație, nu este un proces termodinamic, deoarece. în ea, parametrii principali nu se modifică, ci se schimbă doar masa și volumul amestecului din cilindru. Când pistonul se deplasează înapoi, supapa de aspirație se închide, iar amestecul combustibil este comprimat. Este reprezentată de curba 1-2, numită linie de compresie. La punctul 2, amestecul combustibil se aprinde de la o scânteie electrică. Arderea amestecului combustibil are loc aproape instantaneu, adică. la volum aproape constant. Acest proces este descris de curba 2-3. Ca urmare a arderii combustibilului, temperatura gazului crește brusc, iar presiunea crește (punctul 3). Apoi produsele de ardere se extind. Pistonul se deplasează în poziția moartă corectă, iar gazele fac o muncă utilă. Pe diagrama indicator, procesul de expansiune este descris printr-o curbă 3-4, numită linie de expansiune. La punctul 4, supapa de evacuare se deschide și presiunea din cilindru scade la presiunea aproape exterioară. Odată cu deplasarea în continuare a pistonului de la dreapta la stânga, produsele de ardere sunt îndepărtate din cilindru prin supapa de evacuare la o presiune care depășește ușor Presiunea atmosferică. Este descrisă ca o curbă 4-0 și se numește linia de evacuare. Un astfel de flux de lucru este finalizat în patru timpi ale pistonului sau în două rotații ale arborelui. Astfel de motoare se numesc în patru timpi.
Ciclul cu alimentare de căldură la volum constant este format din două adiabate și două izocore
Caracteristicile ciclului sunt:
- rata compresiei
– gradul de creștere a presiunii
Cantitatea de căldură furnizată:
Cantitatea de căldură îndepărtată:
Ciclu de lucru
Eficiență termică ciclu:
Ciclul ICE cu ardere lap = const
Studiul ciclurilor cu furnizare de căldură la un volum constant a arătat că pentru a crește randamentul unui motor care funcționează conform acestui ciclu este necesar să se aplice rapoarte de compresie mari. Aerul la compresie ridicată are o temperatură atât de ridicată încât combustibilul furnizat cilindrului se aprinde spontan fără aprinderi. Comprimarea separată a aerului și a combustibilului permite utilizarea oricărui combustibil lichid greu și ieftin - ulei, păcură, rășini, uleiuri de cărbune.
Acest avantaj este deținut de motoarele care funcționează cu arderea treptată a combustibilului la presiune constantă. În ele, aerul este comprimat în cilindrul motorului, iar combustibilul lichid este pulverizat cu aer comprimat din compresor.
Ciclul motor ideal cu arderea treptată a combustibilului la presiune constantă, de ex. ciclul cu furnizarea de căldură la presiune constantă se realizează astfel.

Lichid de lucru gazos cu parametri inițiali p 1 , v 1 , T 1 se micșorează de-a lungul 1-2 adiabatic; apoi o anumită cantitate de căldură este transmisă corpului de-a lungul izobarei 2-3 q 1 . Din punctul 3, corpul de lucru se extinde de-a lungul 3-4 adiabatic. Conform izocorului 4-1, fluidul de lucru revine la starea inițială, în timp ce căldura este îndepărtată în radiatorul. q 2 .
Caracteristicile ciclului:
Rata compresiei
Gradul de pre-expansiune.
Cantitatea de căldură furnizată:
Cantitatea de căldură îndepărtată:
Ciclu de lucru
Eficiență termică ciclu:
Ciclu ICE cu alimentare de căldură laV și p = const
Într-un motor de înaltă compresie fără compresor cu un aport de căldură mixt, combustibilul lichid este furnizat de o pompă de combustibil printr-un injector de combustibil către chiulasa sub formă de picături mici. Intrând în aerul încălzit, combustibilul se aprinde și arde spontan pe toată perioada cât duza este deschisă: mai întâi la un volum constant și apoi la o presiune constantă.

Ciclul ideal al unui motor cu un aport de căldură mixt este prezentat în pv- șiTs- diagrame.
Corp de lucru cu parametrii inițiali p 1 , v 1 , T 1 este comprimat de-a lungul adiabaticului 1-2 până la punctul 2. Prima fracțiune de căldură este furnizată fluidului de lucru de-a lungul izocorului 2-3. A doua parte a căldurii este furnizată de-a lungul izobarei 3-4. Din punctul 4, corpul de lucru se extinde de-a lungul 4-5 adiabatic. De-a lungul izocorului 5-1, fluidul de lucru revine la starea inițială - la punctul 1, în timp ce căldura este îndepărtată în radiatorul.
Caracteristicile ciclului sunt:
Rata compresiei
– gradul de creștere a presiunii
Gradul de pre-expansiune.
Definiți termic eficienta ciclului cu condiţia ca capacitatea termică c p ,
c v
și exponent adiabatic k=
c p /
c v
constant:
Prima parte a căldurii furnizate:
A doua parte a cantității de căldură furnizată:
Cantitatea de căldură îndepărtată:
Eficiența ciclului termic
Ciclul unei instalații cu turbine cu gaz
Fluidul de lucru din instalațiile cu turbine cu gaz sunt produse ale arderii combustibililor lichizi sau gazoși.

Figura prezintă o diagramă a celui mai comun tip de instalație de turbină cu gaz cu ardere a combustibilului la presiune constantă.
Compresorul K, situat pe același arbore cu o turbină cu gaz T, aspiră aer din atmosferă și îl comprimă la o anumită presiune. Aerul comprimat intră în camera de ardere KS; aceeasi pompa de combustibil TN este furnizat combustibil lichid. Arderea are loc la presiune constantă. Din camera de ardere intră gazele în duze DIN, din care ei de mare viteză intră în lamele de lucru L turbine și pune rotorul în rotație. Gaze de evacuare prin conducta de evacuare P eliberat în atmosferă.
Ciclul turbinei cu gaz cu furnizarea de căldură în procesp
=
const
.
Ciclul ideal al unei centrale cu turbine cu gaz la pv- șiTs- diagrame cu aport de căldură la p=
const.
Ciclul este format din doi adiabați și două izobare.
Căldura este îndepărtată din fluidul de lucru nu de-a lungul izocorului, ca într-un motor cu ardere internă, ci de-a lungul izobarei. Corp de lucru cu parametrii inițiali p 1 , v 1 , T 1 este comprimat de-a lungul adiabaticului 1-2 până la punctul 2. Din punctul 2, o anumită cantitate specifică de căldură este furnizată fluidului de lucru q 1 de-a lungul izobarei 2-3. Apoi fluidul de lucru se extinde de-a lungul 3-4 adiabatic până la presiunea inițială și revine de-a lungul izobarei 4-1 la starea sa inițială, în timp ce cantitatea specifică de căldură este îndepărtată. q 2 .
Caracteristicile ciclului sunt gradul de presurizare în compresor și gradul de expansiune izobară.
Cantitatea de căldură aportă:
Cantitatea de căldură îndepărtată:
Eficiența ciclului termic
Ciclu de alimentare cu abur. Ciclul Rankine.
Ciclul ideal Rankine este considerat ciclul principal într-o instalație de turbine cu abur. În acest ciclu, fluidul de lucru este complet condensat în condensator, drept urmare, în locul unui compresor voluminos ineficient, se folosește o pompă de alimentare cu apă pentru alimentarea cu apă a cazanului, care are dimensiuni mici și eficiență ridicată.
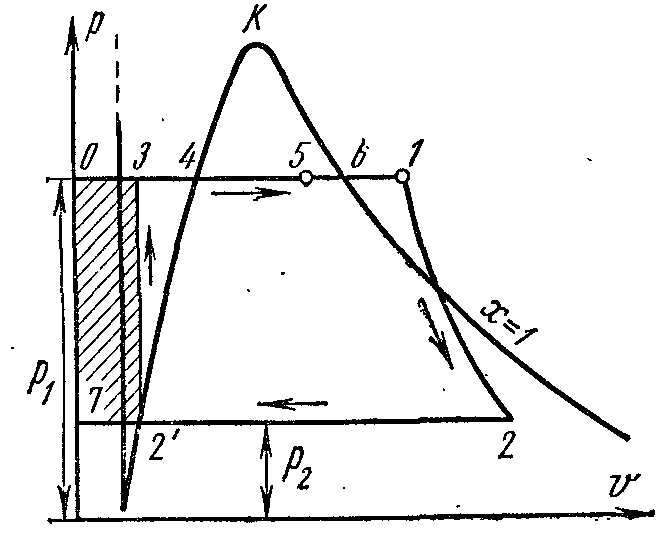
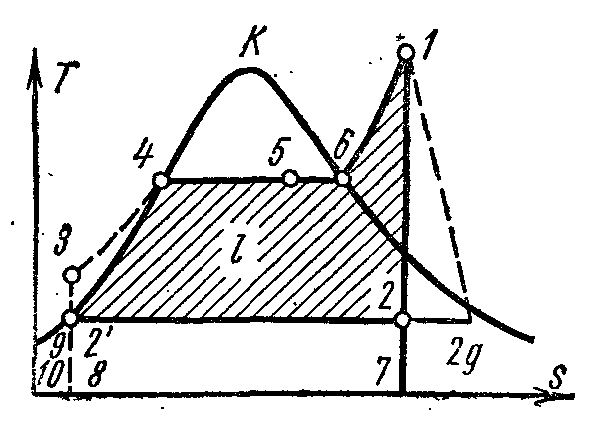
Pe pv- punctul 4 din diagramă caracterizează starea apei de fierbere în cazan la presiune p 1 . Linia 4-5 descrie procesul de generare a aburului în cazan; apoi aburul este uscat într-un supraîncălzitor la o presiune p 1 . Aburul rezultat se extinde de-a lungul 1-2 adiabatic din cilindrul motorului cu abur la o presiune p 2 în condensator. În procesul 2, aburul este complet condensat până la starea de lichid în fierbere la presiune p 2 prin transferul căldurii de vaporizare în apa de răcire. Procesul de comprimare a apei se realizează în pompă; creșterea rezultată a temperaturii apei este neglijabilă și este neglijată în studiile la presiuni de până la 3,0–4,0 MPa. Linia 3-4 ilustrează modificarea volumului de apă atunci când este încălzită de la temperatura din condensator la punctul de fierbere. Funcționarea pompei este afișată ca un pătrat umbrit. 03 7. Entalpia aburului la ieșirea supraîncălzitorului la punctul 1 este egală cu i 1 și pe Ts-diagramăînfățișat pl. 9 34617109. Entalpia aburului la intrarea în condensator în punctul 2 este egală cu i 2 și pe Ts-diagramăînfățișat pl. 9 . Entalpia apei la părăsirea condensatorului într-un punct este egală cu i 1 și pe Ts-diagramăînfățișat pl. 9 8109. Munca utilă a aburului în ciclul Rankine lînfățișat pe pv- diagramă pătrată. .
Dacă ciclul Rankine ia în considerare funcționarea pompei, atunci procesul de comprimare adiabatică a apei în ea va fi reprezentat de Ts- diagrama adiabatic, iar izobarul 3-4 corespunde încălzirii apei în cazan la presiune p 1 până la punctul de fierbere corespunzător.
Eficiența termică a ciclului Rankine este determinată de formula:
Cantitatea specifică de căldură din ciclu este furnizată la p=
const
în procesele 3-4 (încălzirea apei până la punctul de fierbere), 4-6 (vaporizarea) și 6-1 (supraîncălzirea aburului) și este egală cu diferența dintre entalpiile punctelor inițiale și finale ale procesului:
Această cantitate specifică de căldură este afișată în Ts-diagramă mp opt . Îndepărtarea cantității specifice de căldură q 2
se efectuează în condensator de-a lungul izobarei 2-, prin urmare
Căldura îndepărtată înfățișat pe Ts-diagramă mp
Eficiența termică a ciclului Rankine:
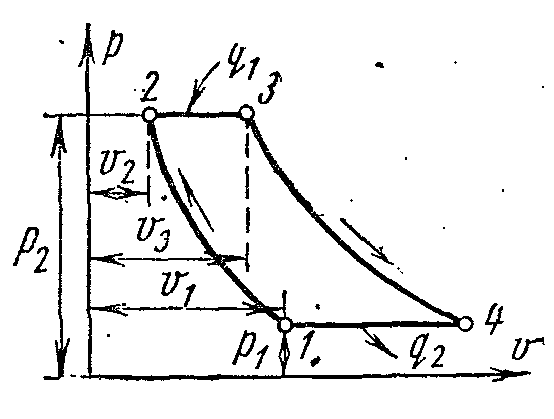
Ciclul de refrigerare a compresorului de aer
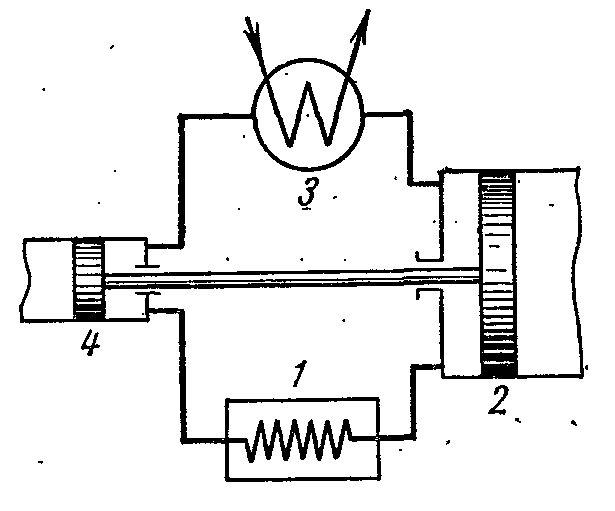
Figura prezintă o diagramă a unei unități de refrigerare cu aer, în care aerul este utilizat ca fluid de lucru, care este cel mai convenabil, inofensiv și mai accesibil fluid de lucru. Unitatea de refrigerare cu aer funcționează după cum urmează.
Aerul care răcește încăperea 1 este comprimat în compresorul 2, drept urmare temperatura acestuia crește. Aerul comprimat la o presiune constantă este injectat în schimbătorul de căldură 3, în care este răcit cu apă la temperatura ambiantă. După aceea, aerul comprimat intră în cilindrul de expansiune, sau expandorul 4, unde se extinde la presiunea inițială. La dilatare, temperatura aerului scade la -60 sau -70 0 C iar aerul frigorific este trimis pentru a răci camera, unde, încălzit, intră din nou în compresor.

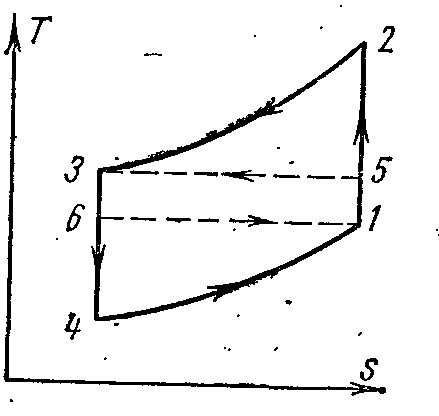
LA pv- șiTs- diagrame:
Aerul din procesul 1-2 este comprimat adiabatic prin presiune p 1 inainte de p 2 . În procesul izobaric 2-3, cantitatea specifică de căldură este îndepărtată din aer către o sursă externă, iar temperatura acesteia scade de la T 2 la T 3 . Cu expansiunea adiabatică în procesul 3-4, aerul este răcit suplimentar de la temperatură T 3 la T 4 . În plus, în procesul izobaric 4-1, căldura este îndepărtată din încăperea răcită (transmițător de căldură), în urma căreia aerul este încălzit din T 4 la T 1 .
Munca cheltuită la implementarea ciclului este egală cu diferența dintre cantitățile specifice de căldură q 1 și q 2. Presupunând că capacitatea termică este constantă, avem:
Apoi coeficientul de refrigerare al ciclului:
=
Din procesele adiabatice 1-2 și 3-4
Și
Dar p 2
=
p 3
, A p 1
=
p 4
apoi
În sfârșit avem
Unde T 1
este temperatura încăperii care trebuie răcită sau temperatura aerului aspirat în compresor.
T 2 este temperatura aerului comprimat.
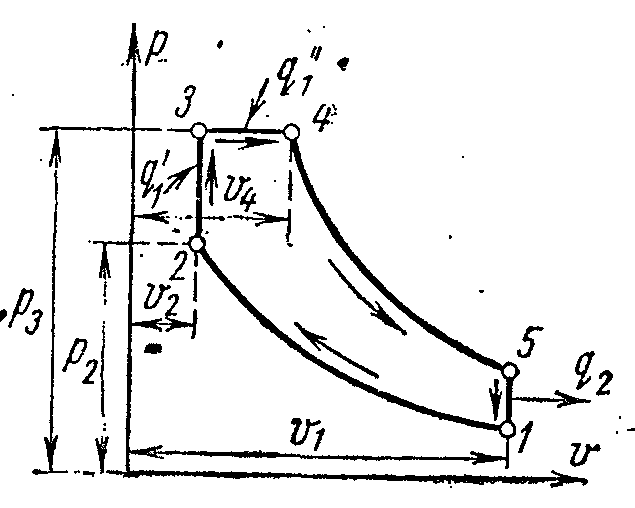
Ciclul de refrigerare a compresorului de abur
Cele mai răspândite pentru corpurile de răcire la o temperatură de -20 0 C sunt unitățile frigorifice în care agentul frigorific este lichide cu punct de fierbere scăzut - amoniac, freoni, dioxid de sulf și altele la presiuni joase (de preferință apropiate de atmosferă).
Figura prezintă o diagramă a unui compresor care funcționează pe vapori de amoniac NH 3 .
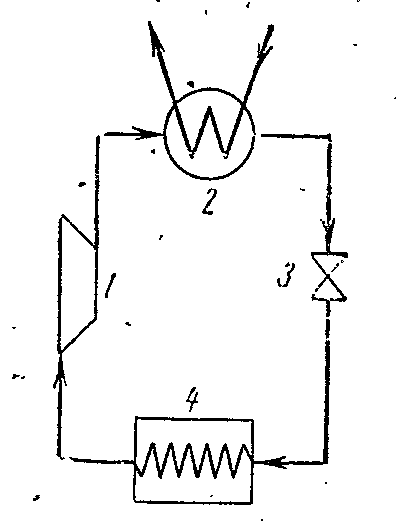

1- compresor; 2- condensator; 3- supapa de acceleratie; 4 - camera frigorifica (evaporator)
Compresorul comprimă aburul saturat uscat de amoniac sau aburul umed cu un grad ridicat de uscare de-a lungul 1-2 adiabatic până la starea de abur supraîncălzit la punctul 2. Din compresor, aburul este injectat în condensator, unde se transformă complet într-un lichid (procesul 2-3-4). Din condensator, amoniacul lichid trece printr-o supapă de accelerație, unde este reglat, ceea ce este însoțit de o scădere a temperaturii și a presiunii. Apoi amoniacul lichid cu temperatură scăzută intră în răcitor, unde, primind cantitatea de căldură (în procesul 5-1), se evaporă și răcește saramura, care circulă în camerele răcite. Procesul de throttling ca proces ireversibil este descris în diagrama curbei condiționate 4-5.
Într-o instalație de compresor de abur, un cilindru de expansiune (expansor) nu este utilizat, iar fluidul de lucru este reglat în supapa de control. Înlocuirea cilindrului de expansiune cu un șoc este însoțită de o creștere a entropiei, ceea ce determină o oarecare pierdere a capacității de răcire, dar această înlocuire simplifică foarte mult instalarea și face posibilă reglarea cu ușurință a presiunii aburului și obținerea unei temperaturi ireversibile în răcitor.
Lucrări specifice petrecute pe ciclu: =
Coeficientul de refrigerare al unității compresoare de amoniac:
Unde este cantitatea specifică de căldură percepută de vaporii de amoniac din răcitor.
Factorul de răcire al instalației
Valorile entalpiei din ecuație sunt determinate de este-diagramă sau conform tabelului cu amoniac.
Unitățile frigorifice cu abur au un mare avantaj față de refrigerarea cu aer. Sunt compacte, ieftine și au un COP mai mare.
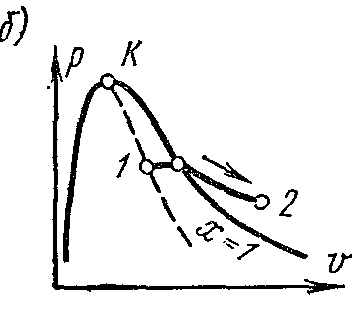
Procesul de vaporizare înp – V diagramă
Fază pv- diagramă a unui sistem format din lichid și abur este un grafic al dependenței volumelor specifice de apă și abur de presiune.
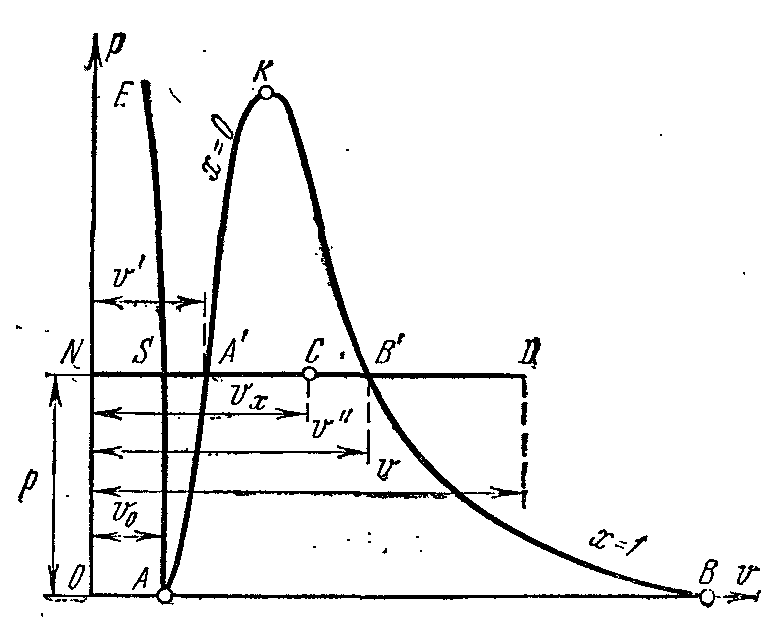
Lăsați apa la o temperatură 0 0 DIN si ceva presiune? ocupă un anumit volum v 0 (segment NS). Întreaga curbă AE exprimă dependenţa volumului specific de apă de presiunea la temperatură 0 0 DIN. pentru că apa este o substanta aproape incompresibila apoi o curba AE aproape paralel cu axa y. Dacă căldura este transmisă apei la presiune constantă, atunci temperatura acesteia va crește și volumul specific va crește. La o anumită temperatură t s apa fierbe și volumul ei specific v’ la punct DAR' atinge valoarea maximă la o presiune dată. Pe măsură ce presiunea crește, temperatura lichidului de fierbere crește. t s și volum v’ crește de asemenea. grafic de dependență v’ AK care se numeste curba la limita fluidului. Caracteristica curbei este gradul de uscăciune X=0 . În cazul furnizării ulterioare de căldură la presiune constantă, va începe procesul de vaporizare. În același timp, cantitatea de apă scade, cantitatea de abur crește. La sfârşitul vaporizării la punct LA' aburul va fi uscat și saturat. Volum specific se notează aburul saturat uscat v’’ .
Dacă procesul de vaporizare se desfășoară la o presiune constantă, atunci temperatura acestuia nu se schimbă și procesul A’ B’ este atât izobar, cât și izoterm. La puncte A’ și B’ substanța este într-o stare monofazată. În punctele intermediare, substanța constă dintr-un amestec de apă și abur. Acest amestec de corpuri se numește sistem bifazat.
Complot de volum specific v’’ de la presiune este reprezentată printr-o curbă KV, care se numește curba limită de vapori.
Dacă căldura este furnizată aburului saturat uscat la presiune constantă, atunci temperatura și volumul acestuia vor crește, iar aburul va trece de la saturat uscat la supraîncălzit (punctul D). Ambele curbe AKși HFîmpărțiți diagrama în trei părți. La stânga curbei la limita fluidului AK regiunea lichidă este situată înaintea izotermei zero. Între curbe AKși HF există un sistem bifazic format dintr-un amestec de apă și abur uscat. la dreapta de HFși sus din punct de vedere La există o zonă de abur supraîncălzit sau stare gazoasă corp. Ambele curbe AKși HF converg la un moment dat La numit punct critic.
Punctul critic este punctul final faza de tranzitie lichid - vapori, începând din punctul triplu. De mai sus punct critic existenţa materiei în stare bifazată este imposibilă. Nicio cantitate de presiune nu poate transforma un gaz în stare lichida la temperaturi peste critice.
Parametrii punctului critic pentru apă:
t la =374,12 0 DIN;v la =0,003147 m 3 /kg;
? la =22,115 MPa;i la =2095,2 kJ/kg
s la =4,424 kJ/(kg K).
Procesp = const vapor de apă. Procesați imaginea înp – V , i – S șiT – S diagrame.
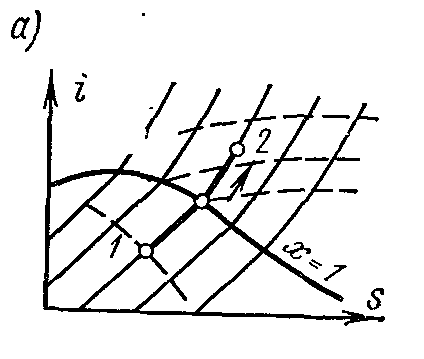
Pe este- diagrama izobara din regiunea vaporilor saturați este reprezentată de o linie dreaptă care traversează curbele limită ale lichidului de vapori. Când căldura este furnizată aburului umed, gradul de uscare a acestuia crește și (la o temperatură constantă) trece în uscat, iar cu alimentare suplimentară de căldură - în abur supraîncălzit. Izobara din regiunea aburului supraîncălzit este o curbă cu o convexitate în jos.
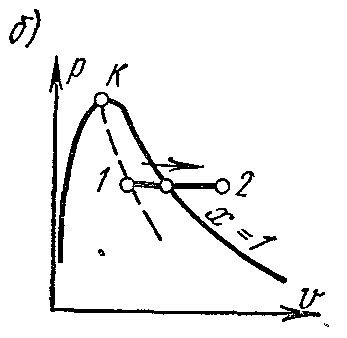
Pe pv- diagrama procesul izobar este reprezentat de un segment de linie dreaptă orizontală, care în regiunea aburului umed înfățișează și un proces izoterm în același timp.
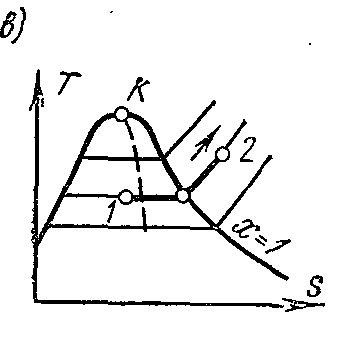
Pe Ts- diagramaîn regiunea aburului umed, izobara este reprezentată printr-o linie orizontală dreaptă, iar în regiunea aburului supraîncălzit, printr-o curbă convexă în jos. Valorile tuturor cantităților necesare pentru calcul sunt preluate din tabelele de vapori saturați și supraîncălziți.
Modificarea energiei interne specifice a aburului:
Lucrari externe:
Cantitatea specifică de căldură furnizată:
În acel caz când q dat și este necesar să se găsească parametrii celui de-al doilea punct, care se află în regiunea stărilor cu două faze, se aplică formula pentru entalpia aburului umed:
Proces T = const vapor de apă. Procesați imaginea înp – V , i – S șiT – S diagrame.
proces izotermic.

Pe este- diagramaîn regiunea aburului umed, izoterma coincide cu izobara și este o linie dreaptă în pantă. În zona aburului supraîncălzit, izoterma este reprezentată de o curbă cu o convexitate în sus.
Pe pv- diagramaîn regiunea aburului umed, procesul izoterm este reprezentat de o linie dreaptă orizontală. Pentru aburul saturat, acest proces coincide cu cel izobar. În regiunea de supraîncălzire, presiunea vaporilor scade, iar procesul este descris printr-o curbă cu o convexitate față de axa absciselor.
![]()
Pe Ts- diagrama procesul izoterm este reprezentat de un segment orizontal.
Energia internă specifică a vaporilor de apă, spre deosebire de energia internă a unui gaz ideal, se modifică ca urmare a unei modificări a componentei potențiale, prin urmare, atunci când T=
const
Cantitatea specifică însumată de căldură în proces:
Munca externă este determinată din prima lege a termodinamicii:
Formula Mayer.
De o importanță deosebită în termodinamică sunt capacitățile termice ale unui gaz la presiune constantă, adică într-un proces izobaric - și la un volum constant, i.e. într-un proces izocor. Aceste capacități termice sunt legate de formula Mayer
Raportul capacitatii termice
Unde k este indicele adiabatic.
Conceptul de „coeficient de răcire”
COP cantitate adimensională (de obicei mai mult de unul), care caracterizează eficiența energetică a munciiaparat frigorific; este egal cu raportulcapacitate de racirela cantitatea de energie (muncă) cheltuită pe unitatea de timp pentru implementare ciclu de refrigerare. Este determinată de tipul ciclului frigorific în funcție de care funcționează mașina, de perfecțiunea elementelor sale principale, iar pentru aceeași mașină depinde de condițiile de temperatură ale funcționării acesteia.
Coeficientul de performanță al unei mașini frigorifice ideale care funcționează pe ciclul Carnot invers:
Unde T minși T Max sunt, respectiv, mai mici și temperatură mai mareîntr-un ciclu.
Coeficientul de performanță al unui răcitor de aer (figura),
Unde T 1 și T 2 sunt temperaturile de la începutul și respectiv de la sfârșitul compresiei adiabatice;
T 3
și T 4
sunt temperaturile de la începutul și sfârșitul expansiunii adiabatice în expandor.
p nși T n)
conform formulei
Ciclul unei centrale cu turbine cu gaz cu regenerare
Eficiența termică a turbinelor cu gaz cu ardere a combustibilului la p= const crește odată cu creșterea presiunii. Cu toate acestea, odată cu creșterea, crește și temperatura gazelor la sfârșitul arderii combustibilului. T 3 ca urmare, paletele și duzele turbinei sunt distruse rapid, a căror răcire este dificilă. Pentru a crește eficiența turbinelor cu gaz, acestea și-au schimbat parțial condițiile de lucru. Instalațiile au început să utilizeze recuperarea căldurii, comprimarea aerului în mai multe etape în compresor, arderea în mai multe etape etc. Acest lucru a dat un efect semnificativ și a crescut gradul de perfecțiune al conversiei muncii în căldură în instalații.
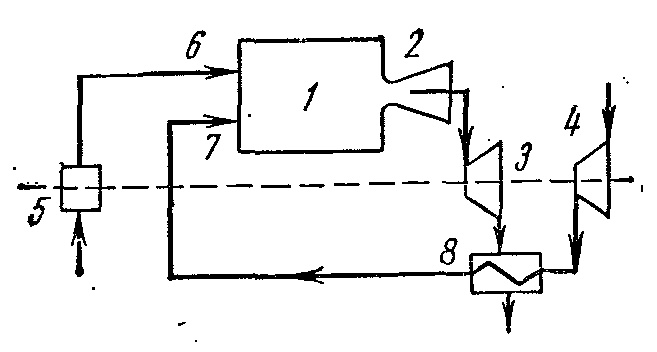
Aerul comprimat de la turbocompresorul 4 este trimis la regeneratorul 8 unde primește căldură la o presiune constantă de la gazele care ies din camera de ardere 1 prin duza 2 în turbina 3. Aerul încălzit de la regenerator 8 prin duza 7, iar combustibilul de la pompa de combustibil 5 prin duza 6 este trimis în camera de ardere 1.
Ciclul ideal al unei astfel de instalări în diagrame:

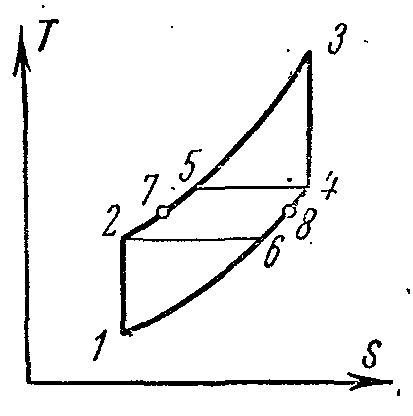
1-2 compresie adiabatică a aerului din compresor;
2-5 alimentare izobară de căldură în regenerator;
5-3 furnizare de căldură la presiune constantă în camera de ardere;
3-4 expansiunea adiabatică a produselor de ardere în duzele turbinei;
4-6 îndepărtarea izobară a căldurii din gazele din regenerator;
6-1 îndepărtarea izobară de căldură din gaze la ieșirea regeneratorului către radiatorul.
Dacă presupunem că gazele din regenerator sunt răcite la temperatura aerului care intră în acesta, adică. din T 4 la T 6 =T 2 regenerarea este completă.
Eficiența termică a ciclului la regenerare completă când T 4
-T 6
=T 5
-T 2
situat:
Unde
Temperaturile în punctele principale ale ciclului:
eficienta ciclului
Consumul specific de abur și căldură în centralele cu abur
La calcularea instalațiilor de turbine cu abur și a elementelor individuale din acestea, cunoașterea consumului specific de abur, notat d.
Consumul specific teoretic de abur și căldură în kilograme per 1 MJ:
Unde i 1
și i 2
–entalpie, kJ/kg.
Consumul specific teoretic de abur și căldură în kilograme la 1 kWh:
Reîncălzire cu abur
Un studiu al funcționării unei instalații cu turbine cu abur arată că o creștere a presiunii inițiale și o scădere a presiunii finale duce la o creștere a eficienței ciclului. Cu toate acestea, o creștere a presiunii inițiale crește conținutul final de umiditate al aburului. Pentru a reduce umiditatea aburului la sfârșitul creșterii expansiunii temperatura de pornire a lui. Una dintre modalitățile de a crește gradul de uscare a aburului la ieșirea turbinei este supraîncălzirea sa secundară. Aburul supraîncălzit din cazan cu presiune și temperatură inițială intră în primul cilindru al turbinei, format din mai multe etape, unde se extinde adiabatic la o anumită presiune p 1 . Aburul rezultat este îndepărtat într-un supraîncălzitor special, unde este supus unei supraîncălziri secundare la presiune constantă. Apoi este returnat din nou la turbină, unde aburul continuă să se extindă până la presiunea condensatorului.

Punctul 1 corespunde stării inițiale a aburului; punctul 2 - starea finală a aburului după turbină după supraîncălzirea secundară. Gradul final de uscăciune ca urmare a introducerii supraîncălzirii intermediare crește de la X 2 inainte de X 1 . În plus, supraîncălzirea secundară a aburului dă un efect economic (2-3%) dacă temperatura medie de alimentare cu căldură în ciclul suplimentar 7-2-2 ’-6-7 este mai mare temperatura medie furnizarea de căldură într-un ciclu cu o singură supraîncălzire, iar efectul va fi mai mare, cu cât temperatura este mai mare în punctele inițiale și finale ale supraîncălzirii intermediare. La presiuni apropiate de critică și supercritică, se folosesc uneori două sau mai multe supraîncălziri intermediare. Apoi randamentul termic al ciclului
Unde este căderea de căldură adiabatică în primul și al doilea cilindru al turbinei;
- cantitatea de căldură furnizată cazanului și primului supraîncălzitor;
Cantitatea de căldură furnizată celui de-al doilea supraîncălzitor.
Consum specific de abur






