Formula cu abur nesaturat. Abur saturat și nesaturat
Vapori nesaturați și saturați
Deasupra suprafeței libere a unui lichid, există întotdeauna vapori ai acestui lichid, care se formează ca urmare a evaporării. Dacă spațiul de deasupra suprafeței libere a lichidului nu este limitat de niciun perete, moleculele sau atomii substanței evaporate, făcând mișcare termică haotică, se îndepărtează de suprafața lichidului. Îndepărtarea particulelor de vapori de pe suprafața unui lichid este facilitată de fenomenul de difuzie, precum și de convecția naturală sau artificială a straturilor de aer. Concentrația particulelor de vapori la temperatura constantaîn aceste condiţii, poate varia într-o gamă largă, atât în direcţia scăderii, cât şi în direcţia creşterii. Astfel de perechi se numesc nesaturate.
O imagine diferită este observată dacă există un spațiu limitat deasupra suprafeței libere a lichidului. Indiferent dacă este umplut cu orice alte substanțe gazoase, cu excepția vaporilor lichidului care se evaporă sau nu, nu contează. Este important de reținut că procesul de evaporare într-un spațiu închis poate avea loc doar până la o anumită limită. Cu cât devine mai mare concentrația de molecule sau atomi ai substanței care se evaporă în stare de vapori, cu atât va fi mai mare presiunea acestor vapori la o temperatură constantă. În acest caz, un număr tot mai mare de molecule sau atomi se pot întoarce prin suprafața liberă înapoi în lichid. Dacă spațiul acordat vaporilor este suficient de mic și lichidul este suficient de mare, echilibrul dinamic se poate stabili: numărul de particule care părăsesc lichidul pe unitatea de timp este egal cu numărul de particule care se întorc în lichid în aceeași perioadă de timp . În acest caz, o masă constantă de vapori va fi deasupra lichidului și nu se poate obține o concentrație mai mare a particulelor acestuia în aceste condiții. Un astfel de abur se numește saturat.
Presiune abur saturat a unei substanțe la o temperatură dată poate avea una – singura valoare definită.
O scădere a volumului spațiului furnizat unui vapor saturat al unei substanțe date la o temperatură constantă duce la condensarea unei părți a vaporilor într-un lichid, deoarece concentrația particulelor sale nu poate depăși o anumită valoare. Această compresie izotermă vapori saturati diferă de compresia vaporilor nesaturați, care se comportă ca gazele ideale obișnuite. Prin urmare, legea Boyle-Mariotte nu este valabilă pentru vaporii saturați.
Legea lui Gay-Lussac nu se aplică nici vaporilor saturați, deoarece volumul furnizat acestora este independent de temperatură.
Nu se aplică vaporilor saturați și legii lui Charles. Odată cu creșterea temperaturii gaze ideale sau vapori nesaturațiîn procesul izocor, media energie kinetică particulele lor, ceea ce duce la ciocnirile lor mai frecvente între ele și cu pereții vasului, adică. la o creștere a presiunii.
Este posibil să vorbim cu încredere că un anumit vas închis conține exact vaporii saturati ai unei substanțe numai dacă vasul conține această substanță în stare lichida iar masa fazei sale lichide nu se modifică.
De exemplu, ei pun în fața noastră un vas de sticlă închis și ne cer să stabilim fără nicio măsurătoare dacă conține vapori de apă saturați sau nesaturați.
Pentru a răspunde la această întrebare, trebuie să așteptați câteva minute, astfel încât conținutul vasului să aibă timp să intre în echilibru termodinamic cu aerul din jur. Acest lucru este cauzat de faptul că nu știm la ce temperatură a fost adus vasul din cameră, iar o modificare a temperaturii aburului la un volum constant poate aduce aburul dintr-o stare nesaturată la o stare saturată și invers. . Dacă, după stabilirea echilibrului, nu există condensarea apei pe pereții interiori ai vasului, trebuie să spunem că la temperatura la care se face observația, vasul conține vapori nesaturați. Dacă pe pereții vasului apar picături de apă, aburul este saturat.
Vaporii de apă în aer
Atmosfera Pământului conține întotdeauna vapori de apă. Prezența lor trebuie luată în calcul foarte des. În special, umiditatea aerului trebuie evaluată cu precizie în încăperi închise sau slab ventilate, camere de uscare etc.
Pentru cuantificare Conținutul de vapori de apă din aer utilizează două valori - umiditatea absolută (f) și umiditatea relativă (B).
Umiditatea absolută se numește cantitate fizica, măsurată prin masa vaporilor de apă conținută într-un metru cub de aer. În acest fel, umiditate absolută coincide cu dimensiunea densității, dar în practică folosesc de obicei o unitate - 1 g / m 3.
Această din urmă împrejurare se datorează faptului că umiditatea absolută f, exprimată în g/m 3 , diferă puțin ca valoare numerică de presiunea parțială a vaporilor de apă p în aceleași condiții, măsurată în milimetri de mercur.
Raportul procentual dintre presiunea parțială p a vaporilor de apă din aer și presiunea vaporilor de apă saturati p n.p. la o anumită temperatură se numește umiditate relativă:
Când se calculează umiditatea relativă folosind această formulă, presiunea p și p n.s. trebuie măsurat în aceleași unități. De obicei, acestea sunt măsurate nu în pascali, ci în milimetri de mercur. Valoarea lui p n.s se determină din tabele.
Temperatura la care aerul devine saturat cu vapori de apă în timpul răcirii se numește punct de rouă.
Prelegerea #2
BAZELE TRANSFERULUI DE CĂLDURĂ
Transferul de căldură este o știință care studiază modelele proceselor de transfer de căldură între corpuri și distribuția căldurii într-un singur corp. Studiul legilor transferului de căldură este necesar pentru a controla fluxurile de căldură care apar aproape peste tot în procesele de lucru ale mașinilor, motoarelor, aparatelor etc.
În teoria transferului de căldură, sunt luate în considerare două întrebări principale:
I. Determinarea cantității de căldură care este transferată de la un corp la altul sau care trece dintr-o parte a corpului în alta în condiții date.
II. Determinarea temperaturii în diferite părți ale corpului implicate în procesul de transfer de căldură.
O condiție necesară și suficientă pentru transferul de căldură este diferența de temperatură.
Căldura este transferată în trei moduri: conducție, convecție și radiație.
Conductivitatea termică este procesul de distribuție a energiei termice prin contactul direct al părților individuale ale corpului cu diferite temperaturi.
Convecția este procesul de transfer de energie atunci când se deplasează volume de lichid sau gaz în spațiu dintr-o zonă cu o temperatură într-o zonă cu o temperatură diferită.
Radiația (transferul radiant de căldură) este procesul de transfer de energie prin unde electromagnetice. Transferul de căldură prin radiație este o dublă transformare a energiei: un corp mai fierbinte radiază energie sub formă de oscilații electromagnetice, un alt corp mai puțin încălzit absoarbe energie și se încălzește.
De obicei, schimbul de căldură între corpuri are loc în toate cele trei moduri simultan. Combinația dintre ele poate fi cea mai diversă. În acest caz, o metodă poate prevala asupra celeilalte, în funcție de condițiile în care are loc transferul de căldură.
Cu toate acestea, atunci când studiem procesele de transfer de căldură, ar trebui să distingem clar și să ia în considerare separat diferite metode de transfer de căldură (conducție termică, convecție și radiație), deoarece acestea respectă legi diferite.
Procesele de transfer de căldură în dispozitivele de inginerie termică pot avea loc atât în mod constant (staționar), cât și în mod nestaționar (nestaționar). Un regim termic staționar (staționar) este un regim în care temperatura în orice punct al corpului nu depinde de timp. Un regim staționar este întotdeauna precedat de un regim non-staționar.
Procesele care au loc în condițiile condițiilor termice nestaționare (procese de încălzire și răcire) sunt foarte complexe, iar luarea în considerare a acestora nu este inclusă în programul acestui curs. Prin urmare, aici sunt luate în considerare numai procesele staționare de transfer de căldură.
CONDUCTIVITATE TERMICĂ
Noțiuni de bază
Conductivitatea termică este transferul molecular de căldură în continuum datorită prezenței unei diferențe de temperatură.
Această metodă de transfer de căldură are loc în principal în solide atât în interiorul unui corp, cât și între două corpuri atunci când acestea intră în contact unul cu celălalt. Conductivitatea termică poate fi realizată și printr-un strat de lichid sau gaz. Cu toate acestea, gazele și lichidele, cu excepția metalelor topite, sunt foarte slabe conductoare de căldură.
câmp de temperatură. Procesul de conducere a căldurii, precum și alte tipuri de transfer de căldură, se efectuează numai cu condiția ca temperatura să nu fie aceeași în diferite puncte ale corpului. După cum știți, temperatura este un parametru al stării corpului și caracterizează gradul de încălzire a acestuia. Setul de valori ale temperaturii în toate punctele spațiului considerat în acest moment timpul se numește câmp de temperatură. Matematic, câmpul de temperatură este exprimat în funcție de coordonate
O suprafață în toate punctele a căror temperatură este aceeași se numește izotermă.
Pentru că nici doi oameni nu pot fi în același punct în spațiu în același timp. temperaturi diferite, atunci diferite suprafețe izoterme nu se intersectează niciodată. Toate acestea fie se termină pe suprafața corpului, fie se află în întregime în interiorul acestuia.
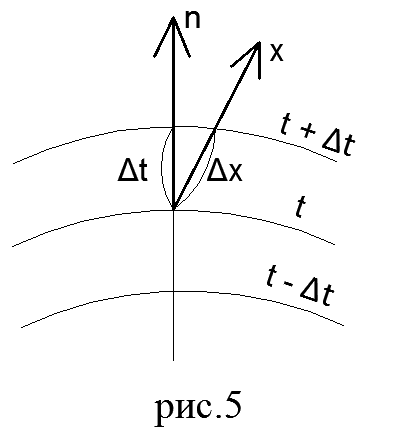 legea lui Fourier. Fluxul de căldură este cantitatea de căldură Q care trece pe unitatea de timp printr-o suprafață arbitrară. Vectorul fluxului de căldură este întotdeauna îndreptat în direcția scăderii temperaturii.
legea lui Fourier. Fluxul de căldură este cantitatea de căldură Q care trece pe unitatea de timp printr-o suprafață arbitrară. Vectorul fluxului de căldură este întotdeauna îndreptat în direcția scăderii temperaturii.
Cantitativ, intensitatea transferului de căldură este caracterizată de densitatea fluxului de căldură q.
Densitatea fluxului de căldură sau fluxul de căldură specific este cantitatea de căldură care trece prin unitatea de suprafață F pe unitatea de timp τ:
Relația (51) exprimă legea de bază a conductibilității termice și se numește legea Fourier.
Semnul minus din partea dreaptă a relației (51) înseamnă că fluxul de căldură și vectorii gradientului de temperatură sunt direcționați în direcții opuse.
Coeficientul de proporționalitate λ în expresia (51) este un parametru fizic al substanței, numit coeficient de conductivitate termică. Caracterizează capacitatea unei substanțe de a conduce căldura.
Dimensiunea coeficientului de conductivitate termică se determină din expresia (51):
În consecință, valoarea coeficientului de conductivitate termică este numeric egală cu fluxul de căldură specific printr-un perete de grosime unitară la o diferență de temperatură de 1 o C. Cu cât λ este mai mare, cu atât substanța este mai bine conducătoare de căldură.
Metalele sunt bune conductoare de căldură; aerul uscat, calm este un slab conductor de căldură. Materialele poroase ușoare nu conduc bine căldura, deoarece porii lor sunt umpluți cu aer. Materialele a căror conductivitate termică este mai mică de 0,2 W / (m-grade) sunt numite termoizolante. Apa are o conductivitate termică slabă, cu toate acestea, conductivitatea termică a unui material umed crește brusc în comparație cu conductibilitatea termică în stare uscată. Acest lucru se datorează faptului că apa conduce căldura de 20-25 de ori mai bine decât aerul. Prin urmare, umplerea porilor corpului cu apă reduce drastic proprietățile sale de izolare termică.
Valoarea coeficientului de conductivitate termică λ pentru fiecare corp se găsește experimental. Rezultatele sunt rezumate în tabele care sunt utilizate în calcule.
Conductibilitatea termică a peretelui
Un singur perete plat. Figura 6 prezintă un perete plat cu un singur strat de grosimea δ realizat dintr-un material omogen (cărămidă, metal, lemn sau orice altul).
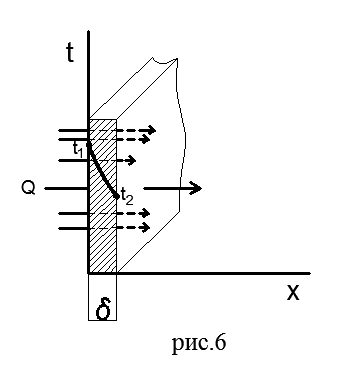 Să presupunem că coeficientul de conductivitate termică a materialului λ nu depinde de temperatură. Pe suprafețele exterioare ale peretelui se mențin temperaturi constante t 1 >t 2; temperatura se schimbă numai în direcția axei x, care este perpendiculară pe planul peretelui, adică câmpul de temperatură este unidimensional, iar gradientul de temperatură este egal cu dt/dx.
Să presupunem că coeficientul de conductivitate termică a materialului λ nu depinde de temperatură. Pe suprafețele exterioare ale peretelui se mențin temperaturi constante t 1 >t 2; temperatura se schimbă numai în direcția axei x, care este perpendiculară pe planul peretelui, adică câmpul de temperatură este unidimensional, iar gradientul de temperatură este egal cu dt/dx.
Să aflăm densitatea fluxului de căldură care trece printr-un perete dat și să stabilim natura schimbării de temperatură de-a lungul grosimii peretelui.
Să selectăm în interiorul peretelui un strat elementar de grosime dx delimitat de două suprafețe izoterme. Ecuația Fourier pentru acest strat are forma
După integrare
Din această ecuație se poate determina densitatea fluxului de căldură care trece prin peretele considerat. Punând în ecuația (53) x=δ, obținem t= t2, Unde
| | (54) |
Densitatea fluxului de căldură într-un perete plat este direct proporțională cu coeficientul de conductivitate termică λ, diferența de temperatură () și invers proporțională cu grosimea peretelui δ. Trebuie avut în vedere că fluxul de căldură este determinat nu de valoarea absolută a temperaturilor, ci de diferența lor - diferența de temperatură.Ecuația (54) este formula de calcul pentru conductibilitatea termică a unui perete plat. Conectează patru mărimi q, λ, δ și:
Raportul dintre grosimea peretelui și coeficientul de conductivitate termică δ/λ se numește rezistența termică a peretelui.
Ecuația (55) arată că fluxul de căldură specific este direct proporțional cu diferența de temperatură și invers proporțional cu rezistența termică a peretelui. Într-adevăr, cu cât numitorul fracției din ecuația (55) este mai mare, adică δ/λ, cu atât densitatea fluxului de căldură q este mai mică. În consecință, cu o creștere a grosimii peretelui δ sau cu o scădere a conductibilității termice λ, densitatea fluxului de căldură q scade.
După ce am determinat densitatea fluxului de căldură prin formula (54), putem determina cantitatea totală de căldură Q în jouli transferată prin peretele plat de suprafața F în timpul τ:
Această ecuație este ecuația unei linii drepte. Astfel, la o valoare constantă a coeficientului de conductivitate termică, temperatura se modifică liniar pe grosimea unui perete omogen. In cazurile in care conductivitatea termica depinde de temperatura, este o variabila iar formulele de calcul sunt ceva mai complicate.
Lecția #2/5 2
Subiectul nr. 26: „Modelul structurii unui lichid. saturate si vapori nesaturați. Umiditatea aerului.”
1 Model structura fluidului
Lichidul este unul dintre state agregate substante. Proprietatea principală a unui lichid, care îl deosebește de alte stări de agregare, este capacitatea de a-și schimba forma la nesfârșit sub acțiunea unor tensiuni mecanice tangențiale, chiar arbitrar de mici, păstrând practic volumul.
Fig.1
Starea lichidă este de obicei considerată intermediară între solide și gazoase : un gaz nu păstrează nici volum, nici formă, dar un solid le păstrează pe amândouă.
molecule lichidele nu au o pozitie definita, dar in acelasi timp nu au libertate totala de miscare. Există o atracție între ei, suficient de puternică încât să-i țină aproape.
O substanță în stare lichidă există într-un anumit interval temperaturile , sub care intrăstare solidă(se produce cristalizarea sau transformarea într-o stare amorfă în stare solidă - sticlă), deasupra - în gaz (are loc evaporarea). Limitele acestui interval depind de presiune .
Toate lichidele sunt de obicei împărțite în lichide pure și amestecuri . Unele amestecuri de fluide sunt esențiale pentru viață: sânge, apă de mare etc Lichidele pot îndeplini funcția solvenți.
Fluiditatea este principala proprietate a lichidelor. Dacă aplicați pe o secțiune a unui fluid aflat în echilibru forta externa , atunci există un flux de particule de fluid în direcția în care se aplică această forță: fluidul curge. Astfel, sub acțiunea forțelor exterioare dezechilibrate, lichidul nu păstrează forma și dispunerea relativă a pieselor și, prin urmare, ia forma vasului în care se află.
Spre deosebire de solidele din plastic, lichidele nu auputerea de curgere: este suficient să aplicați o forță externă arbitrar mică pentru ca lichidul să curgă.
Una dintre proprietățile caracteristice ale unui lichid este că are anumită sumă ( cu neschimbat conditii externe). Lichidul este extrem de greu de comprimat mecanic deoarece, spre deosebire de gaz , intre molecule este foarte putin spatiu liber. Presiunea exercitată asupra unui lichid închis într-un vas este transmisă fără modificare în fiecare punct al volumului acestui lichid ( legea lui pascal , valabil și pentru gaze). Această caracteristică, împreună cu compresibilitatea foarte scăzută, este utilizată în mașinile hidraulice.
Lichidele de obicei cresc în volum (se extind) când sunt încălzite și scad în volum (se contractă) când sunt răcite. Cu toate acestea, există excepții, de exemplu, apă se micsoreaza la incalzire, la presiune normala si la temperaturi intre 0°C si aproximativ 4°C.
În plus, lichidele (cum ar fi gazele) se caracterizează prin viscozitate . Este definită ca abilitatea de a rezista mișcării uneia dintre părți față de cealaltă - adică ca frecare internă.
Când straturile adiacente ale unui lichid se mișcă unul față de celălalt, are loc inevitabil o coliziune de molecule în plus față de cea datoratămișcarea termică. Există forțe care încetinesc mișcarea ordonată. În acest caz, energia cinetică a mișcării ordonate este convertită în energie termică - energia mișcării haotice a moleculelor.
Lichidul din vas, pus în mișcare și lăsat singur, se va opri treptat, dar temperatura îi va crește.Într-un vapor, ca un gaz, aproape se pot ignora forțele de coeziune și se consideră mișcarea ca un zbor liber al moleculelor și ciocnirea lor între ele și cu corpurile înconjurătoare (pereții și lichidul care acoperă fundul vasului). Într-un lichid, moleculele, ca și într-un solid, interacționează puternic, ținându-se unele pe altele. Cu toate acestea, în timp ce într-un corp solid fiecare moleculă păstrează o poziție definită de echilibru nedefinit în interiorul corpului și mișcarea sa este redusă la oscilație în jurul acestei poziții de echilibru, natura mișcării într-un lichid este diferită. Moleculele lichide se mișcă mult mai liber decât moleculele solide, deși nu la fel de liber ca moleculele de gaz. Fiecare moleculă dintr-un lichid se mișcă înainte și înapoi o perioadă de timp, fără a se îndepărta, totuși, de vecinii săi. Această mișcare amintește de oscilația unei molecule solide în jurul unei poziții de echilibru. Totuși, din când în când, o moleculă lichidă iese din mediul său și se mută într-un alt loc, căzând într-un mediu nou, unde efectuează din nou o mișcare asemănătoare oscilației de ceva timp.
Astfel, mișcarea moleculelor lichide este ceva ca un amestec de mișcări într-un corp solid și într-un gaz: mișcarea „oscilativă” într-un loc este înlocuită cu o tranziție „liberă” dintr-un loc în altul. În conformitate cu aceasta, structura unui lichid este ceva între structura unui corp solid și structura unui gaz. Cu cât temperatura este mai mare, adică cu cât energia cinetică a moleculelor lichidului este mai mare, cu atât este mai mare rolul jucat de mișcarea „liberă”: cu atât intervalele stării „oscilatorii” a moleculei sunt mai scurte și cu atât este mai des „liberă”. „tranziții, adică cu cât lichidul seamănă mai mult cu un gaz. Când suficient temperatura ridicata caracteristic fiecărui lichid (așa-numita temperatură critică), proprietățile lichidului nu diferă de proprietățile unui gaz puternic comprimat.
2 Vaporii saturați și nesaturați și proprietățile acestora
Deasupra suprafeței libere a unui lichid există întotdeauna vapori ai acestui lichid. Dacă vasul cu lichid nu este închis, atunci concentrația particulelor de vapori la o temperatură constantă poate varia într-un interval larg în direcția de scădere și creștere.
Proces de evaporare într-un spațiu închis(recipient închis cu lichid)poate apărea la o anumită temperatură numai până la o anumită limită. Acest lucru se datorează faptului că condensarea vaporilor are loc concomitent cu evaporarea lichidului. În primul rând, numărul de molecule emise din lichid în 1 s, mai mult număr moleculele revin înapoi, iar densitatea și, prin urmare, presiunea vaporilor, crește. Acest lucru duce la o creștere a vitezei de condensare. După un timp, se stabilește echilibrul dinamic, la care densitatea vaporilor peste lichid devine constantă.
Un vapor care se află în echilibru dinamic cu lichidul său se numește abur saturat. Un vapor care nu este în echilibru dinamic cu lichidul său se numește nesaturat.
Experiența arată că vaporii nesaturați se supun tuturor legile gazelor , și cu cât sunt mai precise, cu atât sunt mai departe de saturație. Pentru vaporii saturați, sunt caracteristice următoarele proprietăți:
- densitatea și presiunea aburului saturat la o anumită temperatură sunt densitatea și presiunea maximă pe care le poate avea aburul la o anumită temperatură;
- densitatea și presiunea vaporilor saturați depind de tipul de substanță. Cu cât căldura specifică de vaporizare a unui lichid este mai mică, cu atât acesta se evaporă mai repede și presiunea și densitatea vaporilor acestuia sunt mai mari;
- presiunea și densitatea aburului saturat sunt determinate în mod unic de temperatura acestuia (nu depind de modul în care aburul a atins această temperatură: în timpul încălzirii sau în timpul răcirii);
- presiunea vaporilor și densitatea cresc rapid odată cu creșterea temperaturii (Fig. 1, a, b).
Experiența arată că atunci când un lichid este încălzit, nivelul lichidului într-un vas închis scade. În consecință, masa și densitatea vaporilor cresc. O creștere mai puternică a presiunii vaporilor saturați în comparație cu un gaz ideal (legea Gay-Lussac nu este aplicabilă vaporilor saturați) se explică prin faptul că aici presiunea crește nu numai datorită creșterii energiei cinetice medii a molecule (ca într-un gaz ideal), dar și datorită creșterii concentrației de molecule;
- la temperatură constantă, presiunea și densitatea vaporilor saturați nu depind de volum. Figura 2 prezintă pentru comparație izotermele gazului ideal (a) și aburului saturat (b).

Orez. 2
Experiența arată că în timpul expansiunii izoterme nivelul lichidului din vas scade, în timp ce în timpul compresiei crește, adică. numărul de molecule de vapori se modifică astfel încât densitatea vaporilor să rămână constantă.
3 Umiditate
Aerul care conține vapori de apă se numește umed . Pentru a caracteriza conținutul de vapori de apă din aer se introduc o serie de cantități: umiditatea absolută, presiunea vaporilor de apă și umiditatea relativă.
umiditate absolutăρ aerul se numeste o valoare egala numeric cu masa vaporilor de apa continuta in 1 m 3 aer (adică densitatea vaporilor de apă în aer în condiții date).
Presiunea vaporilor de apă p este presiune parțială vaporii de apa continuti in aer. Unitățile SI pentru umiditate absolută și elasticitate sunt, respectiv, kilogramul pe metru cub (kg/m 3) și pascal (Pa).
Dacă se cunoaște doar umiditatea absolută sau presiunea vaporilor de apă, este totuși imposibil să se judece cât de uscat sau umed este aerul. Pentru a determina gradul de umiditate a aerului, este necesar să se știe dacă vaporii de apă sunt aproape sau departe de saturație.
umiditate relativă aer φ numit raportul procentual dintre umiditatea absolută și densitateρ 0 abur saturat la o anumită temperatură (sau raportul dintre presiunea vaporilor de apă și presiune p0 abur saturat la o temperatură dată):
Cu cât umiditatea relativă este mai mică, cu atât aburul este mai departe de saturație, cu atât evaporarea este mai intensă. Presiunea aburului saturat p0 la o temperatură dată - o valoare tabelară. Elasticitatea vaporilor de apă (și, prin urmare, umiditatea absolută) este determinată de punctul de rouă.
Cu răcire izobară la o temperatură tp aburul devine saturat si starea lui este reprezentata printr-un punct LA . Temperatura t p la care vaporii de apă devin saturați se numește punct de condensare . Când este răcit sub punctul de rouă, începe condensarea vaporilor: apare ceață, roua cade, geamurile se aburin.
4 Măsurarea umidității
Folosit pentru a măsura umiditatea aerului instrumente de masura higrometre. Există mai multe tipuri de higrometre, dar principalele sunt: păr și psihrometrice.
Deoarece este dificil să se măsoare direct presiunea vaporilor de apă din aer, se măsoară umiditatea relativă a aeruluiîntr-un mod indirect.
Principiul de funcționarehigrometru pentru părpe baza proprietății părului degresat (uman sau animal)schimba lungimea acestuiain functie de umiditatea aerului in care se afla.

Păr întins peste un cadru metalic. Modificarea lungimii părului este transmisă săgeții care se deplasează de-a lungul scalei. Higrometrul de păr în timpul iernii este principalul instrument de măsurare a umidității exterioare.
Un higrometru mai precis este un higrometru psicrometric - psicrometru
(după alte cuvinte grecești „psychros” înseamnă frig).
Se știe că umiditatea relativă depinde rata evaporarii.
Cu cât umiditatea aerului este mai mică, cu atât umiditatea se evaporă mai ușor.

Psihrometrul are două termometre . Unul este obișnuit, se numește uscat. Măsoară temperatura aerului din jur. Balonul altui termometru este învelit într-un fitil de țesătură și coborât într-un recipient cu apă. Al doilea termometru nu arata temperatura aerului, ci temperatura fitilului umed, de unde si denumirea umezit termometru. Cu cât umiditatea aerului este mai mică, cu atât mai intens umiditatea se evaporă din fitil, cu cât este mai mare cantitatea de căldură pe unitatea de timp eliminată din termometrul umed, cu atât citirile sale sunt mai mici, prin urmare, cu atât diferența dintre citirile termometrelor uscate și umede este mai mare.
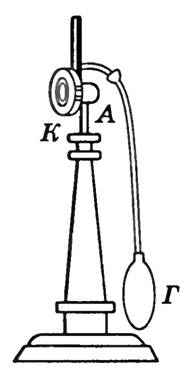
Punctul de rouă este determinat cu ajutorul higrometrelor. Higrometrul de condens este o cutie de metal DAR , peretele frontal La care este bine lustruit (Fig. 2) Un lichid care se evapora usor - eter - se toarna in cutie si se introduce un termometru. Trecerea aerului prin cutie cu un bec de cauciuc G , provoacă evaporarea puternică a eterului și răcirea rapidă a cutiei. Termometrul măsoară temperatura la care apar picături de rouă pe suprafața lustruită a peretelui. La . Presiunea din zona adiacentă peretelui poate fi considerată constantă, deoarece această zonă comunică cu atmosfera, iar scăderea presiunii datorată răcirii este compensată de o creștere a concentrației de vapori. Apariția rouei indică faptul că vaporii de apă au devenit saturati. Cunoscând temperatura aerului și punctul de rouă, puteți găsi presiunea parțială a vaporilor de apă și umiditatea relativă.
Orez. 2
5 sarcini pentru o soluție independentă
Sarcina 1
Ploaia rece de toamnă cade afară. În ce caz rufele agățate în bucătărie se vor usca mai repede: când fereastra este deschisă sau când este închisă? De ce?
Sarcina 2
Umiditatea este de 78%, iar citirea becului uscat este de 12°C. Ce temperatură arată un termometru cu bulb umed?(Răspuns: 10 °C.)
Sarcina 3
Diferența dintre citirile termometrului uscat și umed este de 4°C. Umiditatea relativă a aerului 60%. Care sunt citirile bulbului uscat și umed?(Răspuns: t c -l9 ° С, t m \u003d 10 ° С.)
Procesele de evaporare și condensare sunt continue și paralele între ele.
Într-un vas deschis, cantitatea de lichid scade în timp, deoarece. evaporarea prevalează asupra condensului.
Vaporii care se află deasupra suprafeței unui lichid atunci când evaporarea prevalează asupra condensului sau vapori în absența lichidului se numesc nesaturat.
Într-un vas închis ermetic, nivelul lichidului nu se modifică în timp, deoarece evaporarea și condensarea se compensează reciproc: câte molecule zboară din lichid, deoarece multe dintre ele revin la el în același timp, se produce un echilibru dinamic (mobil) între vapori și lichidul său.
Un vapor care se află în echilibru dinamic cu lichidul său se numește saturate.
La o temperatură dată, vaporii saturati ai unui lichid au cea mai mare densitate ( ) și creează presiune maximă ( ) pe care vaporii acelui lichid îl pot avea la acea temperatură.
Presiunea și densitatea vaporilor saturați la aceeași temperatură depind de tipul de substanță: mai multă presiune creează vapori saturati ai lichidului care se evaporă mai repede. De exemplu, și
Proprietățile vaporilor nesaturați: Vaporii nesaturați respectă legile gazelor lui Boyle - Mariotte, Gay-Lussac, Charles și li se poate aplica ecuația de stare a gazului ideal.
Proprietățile vaporilor saturati:1. Cu volum constant, odata cu cresterea temperaturii, presiunea vaporilor saturati creste, dar nu direct proportional (legea lui Charles nu este indeplinita), presiunea creste mai repede decat cea a unui gaz ideal. , cu creșterea temperaturii ( ) , masa vaporilor crește și, prin urmare, crește concentrația de molecule de vapori () și presiunea vaporilor saturați se va topi din două motive (
3 1 – abur nesaturat ( gaz ideal);
2 2 - abur saturat; 3 - abur nesaturat,
1 obtinut din abur saturat in acelasi
volum atunci când este încălzit.
2. Presiunea vaporilor saturați la o temperatură constantă nu depinde de volumul pe care îl ocupă.
Odată cu creșterea volumului, masa vaporilor crește, iar masa lichidului scade (o parte din lichid trece în vapori), cu o scădere a volumului vaporilor, acesta devine mai mic, iar lichidul devine mai mare (parte vaporilor trec în lichid), densitatea și concentrația moleculelor de vapori saturati rămân constante, prin urmare, iar presiunea rămâne constantă ().
lichid
(sat. abur + lichid)
Nesaturat aburi
Vaporii saturați nu respectă legile gazelor lui Boyle - Mariotte, Gay-Lussac, Charles, deoarece masa de abur din procese nu rămâne constantă, ci toate legile gazelor obţinut pentru o masă constantă. Ecuația de stare pentru un gaz ideal poate fi aplicată aburului saturat.
Asa de, aburul saturat poate fi transformat în abur nesaturat, fie prin încălzire la volum constant sau mărirea volumului său la o temperatură constantă. Aburul nesaturat poate fi transformat în abur saturat fie prin răcirea lui la un volum constant, fie prin comprimarea lui la o temperatură constantă.
Situatie critica
Prezența unei suprafețe libere într-un lichid face posibilă indicarea locului în care se află faza lichidă a substanței și unde este cea gazoasă. Diferența puternică dintre un lichid și vaporii acestuia se explică prin faptul că densitatea unui lichid este de multe ori mai mare decât cea a unui vapor. Dacă un lichid este încălzit într-un vas închis ermetic, atunci din cauza expansiunii, densitatea acestuia va scădea, iar densitatea vaporilor de deasupra acestuia va crește. Aceasta înseamnă că diferența dintre un lichid și vaporii săi saturati este netezită și dispare cu totul la o temperatură suficient de ridicată. Temperatura la care diferă proprietăți fiziceîntre un lichid și vaporii săi saturati, iar densitățile lor devin aceleași, se numeștetemperatura critica.
Pentru formarea lichidului din gaz, media energie potențială atracția moleculelor trebuie să depășească energia lor cinetică medie.
Temperatura critica – Temperatura maxima la care vaporii sunt transformați în lichid. Temperatura critică depinde de energia potențială a interacțiunii moleculare și, prin urmare, este diferită pentru diferite gaze. Datorită interacțiunii puternice a moleculelor de apă, vaporii de apă pot fi transformați în apă chiar și la o temperatură de . În același timp, lichefierea azotului are loc numai la o temperatură mai mică de = -147˚, deoarece moleculele de azot interacţionează slab unele cu altele.
Un alt parametru macroscopic care afectează tranziția vapori-lichid este presiunea. Odată cu creșterea presiunii externe în timpul comprimării gazului, distanța medie dintre particule scade, forța de atracție dintre ele crește și, în consecință, energia potențială medie a interacțiunii lor.
Presiunese numește abur saturat la temperatura sa critică critic. Aceasta este cea mai mare presiune a vaporilor de saturație posibilă a unei substanțe date.
Stare a materiei cu parametri critici se numește critic(punct critic) . Fiecare substanță are propria temperatură și presiune critică.
LA condiție critică căldura specifică de vaporizare şi coeficientul tensiune de suprafata lichide. La temperaturi peste critice, chiar și la foarte presiuni mari este imposibil să transformi un gaz într-un lichid, adică. peste temperatura critică, lichidul nu poate exista. La temperaturi supercritice este posibilă doar starea de vapori a materiei.
Lichefierea gazelor este posibilă numai la temperaturi sub temperatura critică. Pentru lichefiere, gazele sunt răcite la o temperatură critică, de exemplu, prin expansiune adiabatică, și apoi comprimate izotermic.
Fierbere
În exterior, fenomenul arată astfel: din întregul volum de lichid, bule cu creștere rapidă se ridică la suprafață, ele izbucnesc la suprafață, iar vaporii sunt eliberați în mediu.
MKT explică fierberea astfel:în lichid există întotdeauna bule de aer, în care are loc evaporarea din lichid. Volumul închis al bulelor se dovedește a fi umplut nu numai cu aer, ci și cu abur saturat. Presiunea vaporilor saturați din ele atunci când lichidul este încălzit crește mai repede decât presiunea aerului. Când presiunea vaporilor saturați din bule dintr-un lichid suficient de încălzit devine mai mare decât presiunea exterioară, aceștia cresc în volum, iar forța de flotabilitate, care depășește gravitația lor, ridică bulele la suprafață. Bulele plutitoare încep să izbucnească atunci când, la o anumită temperatură, presiunea vaporilor saturați din ele depășește presiunea de deasupra lichidului. Temperatura unui lichid la care presiunea vaporilor saturați din bule este egală sau mai mare decât presiunea exterioară asupra lichidului se numește Punct de fierbere.
Punctul de fierbere al diferitelor lichide este diferit, deoarece presiunea vaporilor saturați din bulele lor este comparată cu aceeași presiune externă la diferite temperaturi. De exemplu, presiunea vaporilor de saturație din bule este egală cu presiunea atmosferică normală pentru apă la 100°C, pentru mercur la 357°C, pentru alcool la 78°C, pentru eter la 35°C.
Punctul de fierbere rămâne constant în timpul procesului de fierbere, deoarece toată căldura care este furnizată lichidului încălzit este cheltuită pentru vaporizare.
Punctul de fierbere depinde de presiunea exterioară asupra lichidului: odată cu creșterea presiunii, temperatura crește; pe măsură ce presiunea scade, temperatura scade. De exemplu, la o altitudine de 5 km deasupra nivelului mării, unde presiunea este de 2 ori mai mică decât presiunea atmosferică, punctul de fierbere al apei este de 83 ° C, în cazanele motoarelor cu abur, unde presiunea aburului este de 15 atm. (), temperatura apei este de aproximativ 200˚С.
Umiditatea aerului
În aer există întotdeauna vapori de apă, așa că putem vorbi despre umiditatea aerului, care se caracterizează prin următoarele valori:
1.Umiditate absolută este densitatea vaporilor de apă din aer (sau presiunea pe care o creează acești vapori ( .
Umiditatea absolută nu dă o idee despre gradul de saturație a aerului cu vapori de apă. Aceeași cantitate de vapori de apă temperatură diferită creează o senzație diferită de umiditate.
2.Umiditate relativă este raportul dintre densitatea (presiunea) vaporilor de apă conținut în aer la o temperatură dată și densitatea (presiunea) vaporilor saturați la aceeași temperatură : sau
este umiditatea absolută la o temperatură dată; - densitate, presiunea vaporilor saturați la aceeași temperatură. Densitatea și presiunea vaporilor de apă saturați la orice temperatură pot fi găsite în tabel. Tabelul arată că cu cât temperatura aerului este mai mare, cu atât densitatea și presiunea vaporilor de apă din aer trebuie să fie mai mari pentru ca acesta să fie saturat.
Cunoscând umiditatea relativă, puteți înțelege câte procente din vaporii de apă din aer la o anumită temperatură sunt departe de saturație. Dacă vaporii din aer sunt saturati, atunci . În cazul în care un , atunci nu sunt suficienți vapori în aer până la o stare de saturație.
Faptul că vaporii din aer devin saturati se apreciază după apariția umidității sub formă de ceață, rouă. Se numește temperatura la care vaporii de apă din aer devin saturați punct de condensare.
Vaporii din aer pot fi saturați prin adăugarea de vapori datorită evaporării suplimentare a lichidului fără modificarea temperaturii aerului sau prin scăderea temperaturii acestuia cu cantitatea de vapori din aer.
Umiditatea relativă normală, cea mai favorabilă pentru om, este de 40 - 60%. Mare importanță are cunoștințe de umiditate în meteorologie pentru prognoza meteo. În țesut, producția de cofetărie, este necesară o anumită umiditate pentru desfășurarea normală a procesului. Depozitarea operelor de artă și a cărților necesită menținerea umidității la nivelul necesar.
Instrumente de umiditate:
1. Higrometru de condensare (vă permite să determinați punctul de rouă).
2. Higrometrul de păr (pe baza lungimii părului fără grăsime față de umiditate) măsoară umiditatea relativă în procente.
3. Psihrometrul este format din două termometre uscate și umede. Becul umed este învelit într-o cârpă înmuiată în apă. Datorită evaporării din țesătură, temperatura umezelii este mai mică decât cea a uscatului. Diferența dintre citirile termometrului depinde de umiditatea aerului din jur: cu cât aerul este mai uscat, cu atât evaporarea din țesătură este mai intensă, cu atât diferența dintre citirile termometrului este mai mare și invers. Dacă umiditatea aerului este de 100%, atunci citirile termometrelor sunt aceleași, adică. diferența de citiri este 0. Pentru a determina umiditatea cu ajutorul unui psicrometru, se folosește un tabel psicrometric.
Topire și cristalizare
La topire corp solid distanța dintre particulele care formează rețeaua cristalină crește, iar rețeaua în sine este distrusă. Procesul de topire necesită energie. Când un corp solid este încălzit, energia cinetică a moleculelor care vibrează crește și, în consecință, amplitudinea oscilațiilor acestora. La o anumită temperatură, numit punct de topire, ordinea în aranjarea particulelor în cristale este perturbată, cristalele își pierd forma. Substanța se topește din stare solidăîn stare lichidă.
În timpul cristalizării există o convergență a moleculelor care formează o rețea cristalină. Cristalizarea poate avea loc numai atunci când lichidul eliberează energie. Când substanța topită este răcită, energia cinetică medie și viteza moleculelor scad. Forțele atractive pot menține particulele în apropierea poziției de echilibru. La o anumită temperatură, numit temperatura de solidificare (cristalizare), toate moleculele sunt într-o poziție de echilibru stabil, aranjamentul lor devine ordonat - se formează un cristal.
Topirea unui solid are loc la aceeași temperatură la care substanța se solidifică.
Fiecare substanță are propriul punct de topire. De exemplu, punctele de topire pentru heliu sunt -269,6˚С, pentru mercur -38,9˚С, pentru cupru 1083˚С.
În timpul procesului de topire, temperatura rămâne constantă. Cantitatea de căldură furnizată din exterior se duce la distrugerea rețelei cristaline.
În timpul procesului de întărire, deși căldura este îndepărtată, temperatura nu se schimbă. Energia eliberată în timpul cristalizării este folosită pentru a menține o temperatură constantă.
Până când toată substanța se topește sau toată substanța se solidifică, adică. atâta timp cât fazele solidă și lichidă ale unei substanțe există împreună, temperatura nu se modifică.
TV+lichid lichid + tv
, unde - cantitatea de căldură; - cantitatea de căldură necesară pentru a topi substanța eliberată în timpul cristalizării masei de masă a substanței
- căldură specifică de fuziune– cantitatea de căldură necesară pentru a topi o substanță de 1 kg la punctul ei de topire.
Ce cantitate de căldură este cheltuită în timpul topirii unei anumite mase a unei substanțe, aceeași cantitate de căldură este eliberată în timpul cristalizării acestei mase.
Numit si căldura specifică cristalizare.
La punctul de topire, energia internă a unei substanțe în stare lichidă este mai mare energie interna aceeași masă de materie în stare solidă.
La un numar mare Când o substanță se topește, volumul ei crește, iar densitatea ei scade. La întărire, dimpotrivă, volumul scade, iar densitatea crește. De exemplu, cristalele solide de naftalină se scufundă în naftalină lichidă.
Unele substanțe, de exemplu, bismut, gheață, galiu, fontă etc., se micșorează atunci când se topesc și se extind atunci când se solidifică. Aceste abateri de la regula generala explicată prin caracteristicile structurale ale rețelelor cristaline. Prin urmare, apa este mai densă decât gheața, gheața plutește în apă. Expansiunea apei în timpul înghețului duce la distrugerea rocilor.
Modificarea volumului metalelor în timpul topirii și solidificării este esențială în activitatea de turnătorie.
Experiența arată că modificarea presiunii externe asupra solid afectează punctul de topire al substanței. Pentru acele substanțe care se dilată în timpul topirii, o creștere a presiunii externe duce la creșterea punctului de topire, deoarece. împiedică procesul de topire. Dacă substanțele sunt comprimate în timpul topirii, atunci pentru ele o creștere a presiunii externe duce la o scădere a temperaturii de topire, deoarece ajută la procesul de topire. Doar o creștere foarte mare a presiunii modifică vizibil punctul de topire. De exemplu, pentru a scădea punctul de topire al gheții cu 1˚C, presiunea trebuie crescută cu 130 atm. Punctul de topire al unei substanțe la normal presiune atmosferică numit punctul de topire al substanței.






