Entropia termică. Entropie. A doua lege a termodinamicii. Mașini termice și frigorifice. Ciclul Carnot și eficiența acestuia
Principalele procese din termodinamică sunt:
· izocoric, care curge la volum constant;
· izobaric, curgând la presiune constantă;
· izotermic, având loc la temperatura constanta;
· adiabatic, la care schimbul de căldură cu mediu inconjurator dispărut.
Procesul izocor
Dacă un proces mecanic invers, cum ar fi mișcarea unui pendul sau ciocnirea bilelor de biliard, este filmat și apoi reluat, imaginea va părea destul de credibilă. În același timp, procesele ireversibile care însoțesc creșterea entropiei spun că arderea unui scânteietor, ruginirea unui cui, pare puțin probabilă într-o astfel de vedere. Astfel, entropia face posibilă distingerea trecutului de viitor.
Un dispozitiv care arată cantitatea de entropie nu există. În același timp, se poate calcula entropia sau modificarea acesteia. Aici avem această reacție în care dacă avem un mol de metan și reacționează cu doi moli de oxigen, vom produce un mol de dioxid de carbon și doi moli de apă. În acest videoclip, dorim să răspundem la întrebarea dacă această reacție este spontană. Și în ultimul clip, am aflat că, pentru a răspunde la această întrebare, trebuie să ne referim la energia liberă Gibbs, sau mai precis, la schimbarea energiei libere Gibbs.
Într-un proces izocor, condiția V= const.
Din ecuația de stare a gazelor ideale ( pV = RT) urmează:
p/ T = R/V= const,
adică presiunea gazului este direct proporțională cu aceasta temperatura absolută:
p2 / p1 = T2/T 1 .
Modificarea entropiei într-un proces izocor este determinată de formula:
Și modificarea energiei libere este egală cu modificarea entalpiei reacției minus temperatura la care are loc și totul este înmulțit cu modificarea entropiei. Și dacă este mai mică de zero, atunci apare o reacție spontană. Am făcut asta acum câteva clipuri. Puteți vizualiza doar temperatura cauzată de fiecare dintre aceste produse. Apa o va inmulti cu 2 daca are 2 luni. Deci avem căldură generată din acești produse, eliminăm aceeași din alți reactanți. Și asta sugerează că avem o reacție exotermă.
Că această parte a ecuației conține mai puțină energie - ne putem gândi cumva la asta - din această parte. Deci puțină energie trebuie eliberată. Lasă-mă să scriu, precum și energia de eliberat. De aceea este o reacție exotermă. Dar întrebarea noastră este: spontană? Pentru a afla dacă acest lucru este spontan, trebuie să ne găsim deltele. Și pentru a ne ajuta să găsim delte, de-a lungul timpului ne-am uitat la entropia molară standard pentru fiecare dintre aceste molecule. Standardul aici este să adăugați caracterul zero - entropia molară standard - iar „standard” înseamnă 298 de grade Kelvin.
s 2 -s 1 = Δ s = CV ln( p2/p 1 ) = CV ln( T2/T 1 )
proces izobaric
Un proces izobaric este unul care are loc la presiune constantă. p= const.
Din ecuația de stare pentru un gaz ideal rezultă:
V/T = R/p= const.
Modificarea entropiei va fi:
s 2 – s 1 = Δ s = cp ln( T 2 / T 1 ).
De fapt, nu trebuie să vorbesc despre grade Kelvin. Acesta este 298 Kelvin, nu trebuie să folosiți cuvântul „grade” aici când vorbim despre Kelvin. Deci sunt 298 kelvin, adică 25 de grade Celsius, deci este temperatura camerei. Prin urmare, este considerată temperatura standard. Deci, dacă avem 1 mol de metan, avem 186 jouli de entropie Kelvin. Astfel, modificarea totală a entropiei acestei reacții este diferența totalului entropia standard produse și entropia standard totală a reactanților.
Proces izotermic
La proces izotermic temperatura fluidului de lucru rămâne constantă T= const, deci:
pV = RT= const
Modificarea entropiei este:
s 2 -s 1 = Δ s = R ln( p1/p 2 ) = R ln( V2/V 1 ).
proces adiabatic
Un proces adiabatic este o schimbare a stării unui gaz care are loc fără schimb de căldură cu mediul ( Q = 0).
Am procedat la fel cu entalpia. Și din moment ce am văzut deja acest lucru, acest număr este aproape de acest număr, dar este mult mai mult. Apa pură este mult mai mică - aceasta este entropia apei pure. Are o entropie mult mai mică decât oxigenul gazos. Din moment ce fluidul s-a format, există foarte puține stări. Tot lichidul cade pe fundul recipientului, de parcă prinde formă și se extinde. Cu alte cuvinte, un singur gaz va avea o entropie mult mai mare decât un lichid. Doar uitându-ne la asta, putem deja să vedem că produsele noastre vor avea entropie mai mică decât reactanții.
Ecuația curbei proces adiabatic(adiabatica) in p-V diagrama arata asa:
pV k= const.
În această expresie k se numește exponent adiabatic(numit și raportul lui Poisson).
Modificarea entropiei este:
Δ S = S 2 – S 1 = 0, acestea.S 2 = S 1 .
Și probabil va fi un număr negativ. Acum este posibil ca aceste unități să nu aibă sens pentru tine și știi cu adevărat că sunt unități convenționale. Dar putem spune, hei, devine din ce în ce mai greu. Și există ceva sens, pentru că există o tonă de gaz. Avem 3 molecule separate, 1 aici și 2 molecule de oxigen. Și din nou mergem la 3 molecule, dar acum apa este limpede. Și are sens, în opinia mea, în pierderea entropiei. Există mai multe condiții în care lichidul, în primul rând, poate fi.
Dar să aflăm dacă această reacție este spontană. Nu trebuie să fim atât de precisi. Presupunem că suntem la temperatura camerei, sau 298 de grade Kelvin. Care este de 25 de grade Celsius ori mai mare decât schimbarea entropiei. Acesta va fi un minus. Acum putem spune, ei bine, minus 242, ar putea dori să-l punem acolo. Dar trebuie să fim foarte, foarte, foarte atenți. Și dacă vrem să scriem totul în kilojuli după ce l-am notat deja, să scriem în kilojulii.
Tranziții de fază
Într-o tranziție de fază reversibilă, temperatura rămâne constantă, iar căldura faza de tranzitie la presiune constantă este H fp, deci modificarea entropiei este:
 .
.
În timpul topirii și fierberii, căldura este absorbită, astfel încât entropia în aceste procese crește: S televizor< Sși< S d. În acest caz, entropia mediului scade cu valoare S f.p. , deci modificarea entropiei Universului este 0, așa cum era de așteptat pentru un proces reversibil într-un sistem izolat.
Astfel, energia noastră gratuită Gibbs aici va fi minus 890 kilojuli minus 290, din care minus aici și încă un minus plus plus. Și are sens - entropia va face energia Gibbs mai pozitivă. Care, după cum știm, atunci când vrem să o punem sub 0 aici, se va lupta cu spontaneitate. Dar să vedem dacă entalpia reală, natura sa exotermă, poate fi depășită. Pare posibil pentru că înmulțim fracția cu aceasta și obținem mai puțin. Aceasta este schimbarea entropiei noastre ori 298, temperatura minus.
Și acest concept devine - pune un minus acolo - și devine plus 72. Este entropia la temperatura standard. Putem vedea deja că entalpia este un număr mult mai negativ decât termenul de temperatură pozitiv înmulțit cu schimbarea entropiei. Deci, de data aceasta, câștigătorul. Și deși pierdem entropia în această reacție, ea eliberează atât de multă energie încât va fi spontană. Care este cu siguranță mai puțin de 0, deci va exista o reacție spontană. După cum putem vedea, aceste probleme de energie liberă Gibbs nu sunt atât de dificile.
A doua lege a termodinamicii și „moartea termică a universului”
Clausius, luând în considerare a doua lege a termodinamicii, a ajuns la concluzia că entropia Universului ca sistem închis tinde spre maxim și, în cele din urmă, toate procesele macroscopice din Univers se vor termina. Această stare a Universului se numește „moarte termică” – haos global, în care nu mai este posibil niciun proces. Pe de altă parte, Boltzmann și-a exprimat opinia că starea actuală a Universului este o fluctuație gigantică, ceea ce implică că de cele mai multe ori Universul este încă într-o stare de echilibru termodinamic („moartea termică”).
Trebuie doar să găsiți acele dimensiuni. Ne uităm doar la temperaturile de formare a tuturor produselor, scoatem reactivii și bineînțeles că așteptăm șansele. Și apoi, pentru a găsi modificarea entropiei, facem același lucru. Trebuie să ne uităm la entropia molară standard de masă a produselor după coeficienți, să scoatem reactanții și apoi să o înlocuim aici, după care în esență am obținut energie gratis Gibbs. Și în acest caz a fost negativ. Acum ne putem imagina o situație în care suntem mult mai mult temperatura ridicata.
Potrivit lui Landau, cheia rezolvării acestei contradicții constă în domeniul relativității generale: întrucât Universul este un sistem într-un câmp gravitațional variabil, legea creșterii entropiei nu i se aplică.
Deoarece a doua lege a termodinamicii (în formularea lui Clausius) se bazează pe presupunerea că universul este un sistem închis, sunt posibile alte tipuri de critică la adresa acestei legi. În conformitate cu conceptele fizice moderne, putem vorbi doar despre partea observabilă a Universului. În această etapă, omenirea nu are ocazia să demonstreze că universul este sistem închis, nici invers.
Apoi, dintr-o dată, lucrurile devin interesante. Astfel, acest termen pozitiv va depăși acest lucru și, eventual, nu un răspuns spontan la o temperatură foarte, foarte, foarte, foarte ridicată. Și gândește-te altfel. Reacția care produce temperatura care separă - căldura degajată - nu este atât de mare când există deja o cantitate mare de căldură la mijloc sau energie kinetică. Dacă temperatura ar fi suficient de mare, această reacție nu ar fi spontană, deoarece probabilitatea de entropie ar fi depășită.
Puteți căuta totul pe Internet și puteți învăța ceva spontan. Cu o modificare simultană a două sau trei dintre aceste valori, proces de gaz. Un gaz ideal este un model al unui gaz fizic în care se fac următoarele aproximări. Gazele reale nu diferă în proprietăți de un gaz ideal la temperatura camerei și normal presiune atmosferică. Diferențele sunt importante la temperaturi foarte scăzute și la presiuni de sute de ori mai mari decât presiunile atmosferice.
Măsurarea entropiei
În experimente reale este foarte dificil să se măsoare entropia unui sistem. Tehnicile de măsurare se bazează pe determinarea termodinamică a entropiei și necesită calorimetrie extrem de precisă.
Pentru simplitate, vom explora sistem mecanic, ale cărui stări termodinamice vor fi determinate prin volumul său V si presiune P. Pentru a măsura entropia unei anumite stări, trebuie mai întâi să măsurăm capacitatea termică la volum constantși presiune (marcată CVși C P respectiv) pentru un set reușit de stări între starea inițială și cea dorită.
În aceste condiții, se pot realiza trei izomeri, izotermi și izobari. Legile izolării se aplică gazelor reale care îndeplinesc cerințele unui model de gaz ideal. Legea a fost introdusă pentru prima dată de britanicul Robert Boyle și francezul Edme Marriot. Într-un proces izoterm, produsul presiunii și volumului unei cantități date de gaz este valoare constantă. Graficul procesului de pe diagrama p este o curbă numită izotermă.
Legea a fost votată de francezul Jacques Charles. În timpul procesului de izolație, raportul dintre presiune și temperatură rămâne constant. Graficul procesului de pe diagrama p este o linie dreaptă numită izocor. Animația arată un ciclu care include două procese cu presiune constantă și două procese cu volum continuu. Laturile orizontale ale dreptunghiului sunt linii drepte - imagini iar laturile verticale - linii drepte - izochori. Comportarea gazelor într-un proces izocratic explică cu ușurință interdicția de a lăsa sticlele și buteliile de gaz în lumina directă a soarelui.
Capacitățile termice sunt legate de entropie S si cu temperatura T dupa formula:

unde este indicele X se referă la volum și presiune constantă. Putem integra pentru a obține modificarea entropiei:
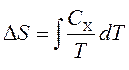
Legea a fost emisă de francezul Joseph Gauss-Lusak. În procesul modificat, raportul dintre volum și temperatură rămâne constant. Graficul procesului de pe diagrama p este o linie dreaptă, care se numește imagine. Legile Boyle-Marriott, Charles și Gay-Lusak sunt doar gaze ideale. Modelul de gaz ideal nu ia în considerare volumul și interacțiunea moleculelor.
La temperaturi foarte scăzute, gazele reale se lichefiază și legile gazelor ideale nu se mai aplică acestora. Ca măsură a disipării ireversibile a energiei, Clausius a introdus termenul de entropie. Entropia este o funcție a stării sistemului, adică în fiecare stare poate fi comparată o valoare de entropie complet definită.
Astfel, putem obține valoarea entropiei oricărei stări ( P,V) față de starea inițială ( P 0 ,V 0). Formula exactă depinde de alegerea noastră a stărilor intermediare. De exemplu, dacă starea inițială are aceeași presiune ca starea finală, atunci
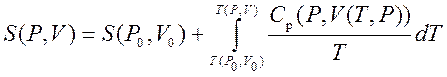 .
.
De exemplu, pentru procesele reversibile, modificarea acesteia este exprimată după cum urmează. modificarea entropiei în diferite proceseîn sisteme. Entropia este o măsură a probabilității sau tulburării în sistem fizic. Exprimă numărul de configurații sau aranjamente posibile ale elementelor constitutive ale unui sistem în care acesta forma generala, forma și caracteristicile fizice, nu se schimbă.
Semnificația fizică a creșterii entropiei este că sistemul cu o particulă izolată trebuie să intre în starea de ordinul cel mai mic al mișcării particulelor. Aceasta este cea mai simplă stare a sistemului sau a echilibrului termodinamic, în care mișcarea particulelor este haotică. Direcția ireversibilă a proceselor de conversie a energiei în sisteme izolate duce mai devreme sau mai târziu la transformarea tuturor tipurilor de energie în căldură. Acesta va fi împrăștiat și distribuit uniform între toate elementele sistemului. Entropia maximă înseamnă echilibru termodinamic complet, fără oprirea deplasărilor atomilor și moleculelor, întreruperea schimbului de energie între ambele părți ale sistemului și mediu - există haos statistic sau termodinamic.
În plus, dacă calea dintre prima și ultima stare trece prin orice tranziție de fază de ordinul întâi, căldură latentă asociate cu tranziția trebuie, de asemenea, luate în considerare.
Entropia stării inițiale trebuie determinată independent. În mod ideal, starea inițială este aleasă ca stare la o temperatură extrem de ridicată, la care sistemul există sub formă de gaz. Entropia în această stare este similară cu cea a unui gaz ideal clasic, plus contribuții din rotațiile moleculare și vibrațiile, care pot fi determinate spectroscopic.
Dacă universul este închis, așteaptă o moarte fierbinte. Grecii antici susțin că a provenit din haos și, sub presupunerea termodinamicii clasice, se va întoarce acolo. Dacă universul ar fi evoluat doar către haos, cum ar fi putut să ia ființă și să ajungă la starea sa actuală structurată?
Termodinamica clasică, formată într-o epocă în care nimeni nu punea întrebarea despre natura staționară a universului. În acel moment, singura umbră a legilor termodinamicii a fost aruncată din teoria evoluției lui Darwin. Potrivit ei, procesul de dezvoltare a florei și faunei se caracterizează prin complicații constante, cu creșterea organizării și ordinii. Natura vie rezistă echilibrului termodinamic și haosului. Evident, legile dezvoltării naturii neînsuflețite și a celei vii se contrazic reciproc.
Teorie munca de laborator
Informații teoretice
În această lucrare, este necesar să se măsoare temperatura de tranziție de fază - punctul de topire al staniului, ceea ce ne va permite să determinăm creșterea entropiei.
Deoarece pentru procesele reversibile incrementul de entropie d S=d Q/T, și schimbarea entropiei în timpul tranziției sistemului de la stare Aîntr-o stare b
 ,
,
atunci modificarea entropiei în timpul încălzirii și topirii staniului este definită ca suma variației entropiei în timpul încălzirii până la punctul de topire și în timpul topirii staniului:
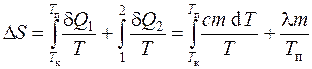 sau
sau
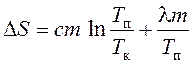 , (10)
, (10)
unde D Q este o cantitate infinitezimală de căldură transferată sistemului la o temperatură T;
d Q 1 și d Q 2 - cantități infinit de mici de căldură primite de staniu în timpul încălzirii și în timpul topirii;
T k este temperatura inițială (cameră);
T n este punctul de topire;
l \u003d 59 10 -3 J / kg - căldura specifică topire;
c = 0,23 10 -3 J/(kg K) – căldura specifică,
m = 0,20 kg este masa staniului.
Câteva formulări ale celei de-a doua legi a termodinamicii
1. Fiecare sistem, lăsat singur, se modifică în medie în direcția stării cu probabilitate maximă (G. Lewis).
2. Starea cu entropie maximă este starea cea mai stabilă pt sistem izolat(E. Fermi).
3. În cursul oricărui proces real, este imposibil să se furnizeze mijloace pentru a readuce fiecare dintre sistemele care participă la el la starea sa originală (G. Lewis).
4. Fiecare individ sau proces chimicîn natură se desfăşoară în aşa fel încât suma entropiei tuturor corpurilor care participă la acest proces creşte (M. Planck).
5. Transferul spontan de căldură de la un corp mai rece la unul mai fierbinte este imposibil.
6. Recepția informației este o scădere a entropiei (G. Lewis).
7. Entropia este săgeata timpului* (A. Eddington).
Modificări de entropie în reacțiile chimice
Entropia unui mol dintr-o substanță în ea stare standard la temperatura corespunzătoare se numește entropia molară standard. Entropia molară standard este notată cu simbolul S „și are dimensiunea JK-1 mol-1. Tabelul 5.12 prezintă entropiile molare standard ale unui număr de elemente și compuși la o temperatură de 25 ° C. Rețineți că entropia molară standard de gaze, de regulă, are valori mult mai mari comparativ cu entropia solide. Entropia oricărei cantități fixe de materie crește în următoarea secvență:
Solid = Lichid = Gaz
Entropiile molare standard sunt uneori numite entropii absolute. Ele nu sunt modificări de entropie care însoțesc formarea unui compus din elementele sale libere. De asemenea, trebuie remarcat faptul că entropiile molare standard ale elementelor libere (sub formă substanțe simple) nu sunt egale cu zero.
A treia lege a termodinamicii afirmă că entropia unui cristal ionic ideal la o temperatură de zero absolut (O K) este zero.
Tabelul 5.12. Entropii molare standard S°(298 K) (J/(K mol))
Modificarea entropiei molare standard în reactie chimica este determinată de ecuație
Trebuie remarcat faptul că modificarea entropiei din exemplul considerat se dovedește a fi negativă. Acest lucru ar putea fi de așteptat dacă luăm în considerare faptul că, conform ecuației reacției luate în considerare, cantitatea totală de reactanți gazoși este de 1,5 moli, iar cantitatea totală de produși gazoși este de numai 1 mol. Astfel, ca urmare a reacției, are loc o scădere a cantității totale de gaze. În același timp, știm că reacțiile de ardere sunt reacții exoterme. În consecință, rezultatul fluxului lor este disiparea energiei, iar acest lucru ne face să ne așteptăm la o creștere a entropiei, și nu la scăderea acesteia. În plus, trebuie avut în vedere faptul că arderea hidrogenului gazos la 25°C, cauzată de inițierea inițială, are loc apoi spontan și cu mare intensitate. Dar modificarea entropiei în această reacție nu ar trebui să fie pozitivă în acest caz, așa cum este cerut de a doua lege a termodinamicii? Se dovedește - nu, sau cel puțin nu neapărat. A doua lege a termodinamicii cere ca, ca urmare a unui proces spontan, entropia totală a sistemului și a mediului său să crească. Modificarea entropiei calculată mai sus caracterizează doar sistemul chimic considerat, care constă din reactanți și produși care participă la arderea hidrogenului gazos la 25°C. Dar cum se calculează modificarea entropiei pentru mediul acestui sistem?






