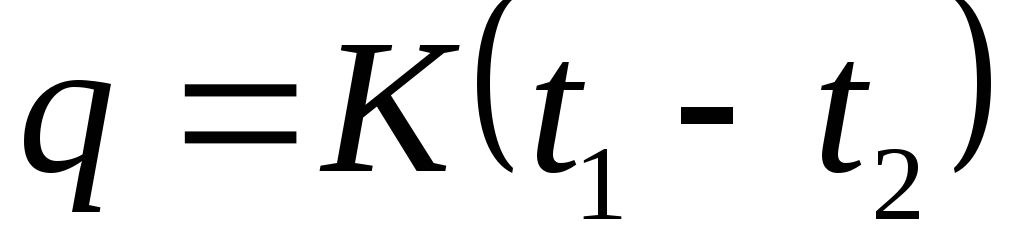Ce proces de gaz are loc la presiune constantă. Capacitate termica. Procese termodinamice cu un gaz ideal
Proprietățile termodinamice de bază ale gazelor ideale
În studiul proceselor termodinamice se utilizează ecuația de stare
și expresia matematică a primei legi a termodinamicii
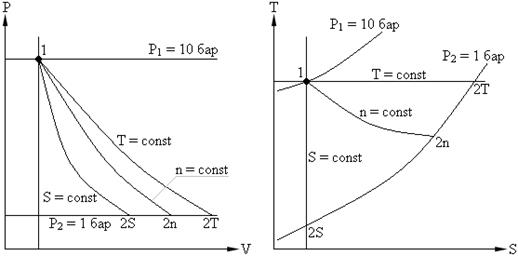
La studierea proceselor termodinamice ale gazelor ideale, în cazul general, se impune determinarea ecuației curbei procesului în PV , PT , VT diagramă, stabiliți o relație între parametrii termodinamici și determinați următoarele mărimi:
− schimbare energie interna corp de lucru
![]()
(formula este valabilă nu numai pentru V = const, dar și pentru orice proces)
− determinarea lucrului specific extern (termodinamic).
și munca specifică disponibilă
este cantitatea de căldură implicată în procesul termodinamic
Unde este capacitatea termică a procesului
– modificarea entalpiei într-un proces termodinamic
(formula este valabilă nu numai pentru p = const, dar și în orice proces)
- proporția de căldură care este cheltuită pentru modificarea energiei interne în acest proces:
este proporția de căldură transformată în muncă utilă în acest proces
În cazul general, oricare doi dintre cei trei parametri termodinamici ( P , V , T) poate fi modificată în mod arbitrar. Pentru practică, următoarele procese sunt de cel mai mare interes:
Procesele la volum constant (V = const) este izocor.
La presiune constantă ( P = const) este izobar.
La temperatura constanta (T = const) este izotermă.
Proces dq =0 (curge fără schimb de căldură al fluidului de lucru cu mediul) este un proces adiabatic.
Un proces politropic, care, în anumite condiții, poate fi considerat generalizat în raport cu toate procesele principale.
În viitor, vom lua în considerare prima lege a termodinamicii și cantitățile incluse în ea, ca fiind legate de 1 kg de masă.
Procesare la volum constant
(proces izocor)
Un astfel de proces poate fi realizat printr-un fluid de lucru, de exemplu, situat într-un vas care nu își schimbă volumul, dacă căldura este furnizată fluidului de lucru de la o sursă de căldură sau căldura este îndepărtată din fluidul de lucru la frigider.
Într-un proces izocor V = const și dV =0 . Ecuația procesului izocor se obține din ecuația de stare la V = const .
– legea lui Charles (*)
Adică la V = const presiunea gazului este proporțională cu temperatura absolută. Când se furnizează căldură, presiunea crește, iar când căldura este îndepărtată, aceasta scade.
Să descriem procesul la V = constîn pV , pTși VT diagrame.


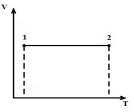
LA p V - diagrama izocoră 1-2 - linie dreaptă verticală paralelă cu axa p . În procesul 1-2 se furnizează căldură gazului, presiunea crește și, în consecință, din ecuația (*), temperatura crește. În procesul invers 2-1, căldura este îndepărtată din gaz, în urma căruia energia internă a gazului scade și temperatura acestuia scade, adică. procesul 1-2 - încălzire, 2-1 - răcire cu gaz.
LA p T - diagramă izocoră - linii drepte care ies de la origine cu o pantă (factor de proporționalitate)
Mai mult, cu cât nivelul volumului este mai mare, cu atât izocorul este mai scăzut.
În VT - diagrama izocore - linii drepte paralele cu axa T.
Lucrul extern al gazului în procesul izocor:
pentru că
Lucrări specifice disponibile
![]()
Modificarea energiei interne a unui gaz într-un proces izocor, dacă
![]()
Căldura specifică furnizată fluidului de lucru, la
![]()
De la ora V = const gazul nu merge dl =0 ), atunci ecuația primei legi a termodinamicii va lua forma:
![]()
Adică în proces V = const toată căldura furnizată fluidului de lucru este cheltuită pentru creșterea energiei interne, adică pentru creșterea temperaturii gazului. Când un gaz este răcit, energia sa internă scade cu cantitatea de căldură îndepărtată.
Proporția de căldură consumată pentru a modifica energia internă
Proporția de căldură cheltuită pentru a lucra
Proces la presiune constantă
(proces izobar)
Un proces izobaric, de exemplu, poate avea loc într-un cilindru sub un piston care se mișcă fără frecare, astfel încât presiunea din cilindru să rămână constantă.
Cu un proces izobaric p = const , dp =0
Ecuaţia procesului izobar se obţine când p = const din ecuația de stare:
– Legea Gay-Lussac (*)
În proces la p = const Volumul gazului este proporțional cu temperatura, adică atunci când gazul se dilată, temperatura și, prin urmare, energia internă, crește, iar atunci când este comprimat, scade.
Să descriem procesul în pV , pT , VT - diagrame.
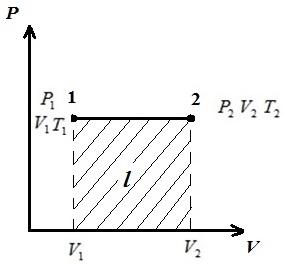
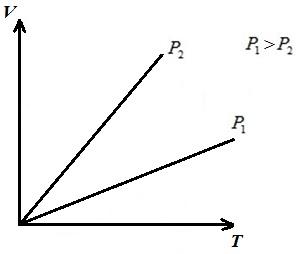

LA pV-diagrama proceselor la p = const descrise ca linii drepte paralele cu axa V . Aria dreptunghiului 12 dă, la scara corespunzătoare, munca gazului l. În procesul 1-2, căldura este adăugată gazului pe măsură ce volumul specific crește și, prin urmare, conform ecuației (*), temperatura crește. În procesul invers 2-1, căldura este îndepărtată din gaz, ca urmare, energia internă și temperatura gazului scad, adică. procesul 1-2 este încălzirea, iar 2-1 este răcirea gazului.
LA VT- diagrama izobară este o dreaptă care iese din originea coordonatelor, cu o pantă .
LA pT- diagrama izobară este o dreaptă paralelă cu axa T .
Lucrul unui gaz într-un proces izobaric ( p = const )
![]()
De atunci
Adică, dacă temperatura gazului crește, atunci munca este pozitivă.
Job disponibil
pentru că ,.
Modificarea energiei interne a gazului, dacă
![]()
Cantitatea de căldură raportată gazului atunci când este încălzit (sau eliberată de acesta când este răcit), dacă
![]()
Adică, căldura furnizată fluidului de lucru în procesul izobaric crește entalpia acestuia, adică. într-un proces izobaric este un diferențial total.
Ecuația primei legi a termodinamicii are forma
![]()
Fracția de căldură consumată pentru a modifica energia internă în procesul izobaric,
![]()
Unde k este indicele adiabatic.
Proporția de căldură consumată pentru a efectua munca la p = const ,
![]()
În MKT, n este numărul de grade de libertate.
Pentru un gaz monoatomic n =3 și apoi φ=0,6, ψ=0,4, adică 40% din căldura transmisă gazului merge pentru a efectua lucrări externe, iar 60% merge pentru a schimba energia internă a corpului.
Pentru un gaz diatomic n =5 și apoi φ=0,715, ψ=0,285, adică ≈28,5% din căldura furnizată gazului merge pentru a efectua lucrări externe și 71,5% merge pentru a schimba energia internă.
Pentru un gaz triatomic n =6 și apoi φ=0,75, ψ=0,25, adică 25% din căldură (motor cu abur) merge pentru a efectua lucrări externe.
Procesare la temperatura constanta
(proces izoterm)
Un astfel de proces termodinamic poate avea loc în cilindrul unei mașini cu piston dacă, pe măsură ce căldura este furnizată fluidului de lucru, pistonul mașinii se mișcă, crescând volumul atât de mult încât temperatura fluidului de lucru rămâne constantă.
La proces izotermic T = const , dT =0.
Din ecuația de stare
− Legea Boyle-Mariotte.
Prin urmare, într-un proces la temperatură constantă, presiunea gazului este invers proporțională cu volumul, adică. Cu dilatarea izotermă, presiunea scade, iar cu compresia crește.
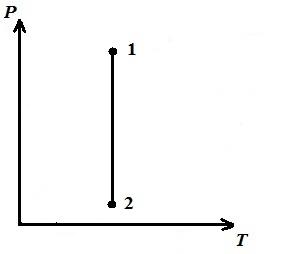
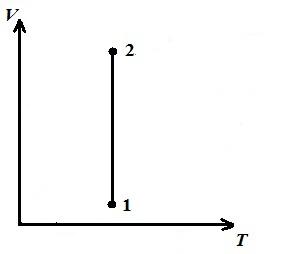
Prezentăm un proces izoterm în pV , pT , VT − diagrame.
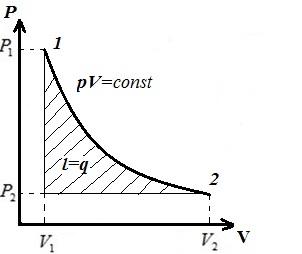
LA pV- diagramă - procesul izoterm este reprezentat de o hiperbolă echilaterală, iar cu cât temperatura este mai mare, cu atât izoterma este mai mare.
LA pT − diagramă - izoterme - drepte, paralele cu axa p .
LA VT − diagramă - linii drepte, paralele cu axa V .
dT =0, apoi
Acesta este U = const , i = const – energia internă și entalpia nu sunt modificate.
Ecuația primei legi a termodinamicii ia forma ( T = const)
Adică, toată căldura transmisă gazului în procesul izoterm este cheltuită pentru munca de expansiune. În procesul invers, în procesul de comprimare, căldura este îndepărtată din gazul egal cu munca externă comprimare.
Lucru specific într-un proces izoterm
Lucrări specifice de unică folosință
Din ultimele două ecuații rezultă că într-un proces izoterm pentru un gaz ideal, munca disponibilă este egală cu munca procesului.
Căldura transmisă gazului în procesul 1-2,
Prima lege a termodinamicii
De aici rezultă că atunci când T = const l = l 0= q , acestea. munca, munca disponibilă și cantitatea de căldură primită de sistem sunt egale.
Pentru că într-un proces izoterm dT =0, q = l = o anumită valoare finală, apoi din
![]()
obținem asta în procesul izoterm C =∞. Prin urmare, pentru a determina cantitatea de căldură transmisă gazului într-un proces izoterm, folosind căldura specifică imposibil.
Proporția de căldură consumată pentru a modifica energia internă la T = const
și proporția de căldură consumată pentru efectuarea muncii,
Proces fără schimb de căldură cu mediul
(proces adiabatic)
Într-un proces adiabatic, schimbul de energie al fluidului de lucru cu mediul are loc numai sub formă de muncă. Se presupune că fluidul de lucru este izolat termic de mediu inconjurator, adică nu există transfer de căldură între acesta și mediu;
q =0, si in consecinta dq =0
Apoi, ecuația primei legi a termodinamicii va lua forma
Astfel, schimbarea energiei interne și a muncii într-un proces adiabatic sunt echivalente ca mărime și opus ca semn.
Prin urmare, munca proces adiabatic dilatarea are loc ca urmare a scaderii energiei interne a gazului si, in consecinta, temperatura gazului va scadea. Munca de compresie adiabatică merge în întregime la creșterea energiei interne, adică. pentru a-i crește temperatura.
Obținem ecuația adiabatică pentru un gaz ideal. Din prima lege a termodinamicii
la dq =0 primim ( du = CV dT )
Capacitate termica , Unde
Diferențierea ecuației de stare pV = RT primim
Înlocuind RdT de la catre (*)
sau împărțirea prin pV ,
Integrarea la k = const , primim
![]()
Ultima ecuație se numește ecuația Poisson și este ecuația adiabatică pentru .
Din ecuația lui Poisson rezultă că
adică în timpul expansiunii adiabatice, presiunea scade, iar în timpul compresiei, aceasta crește.
Reprezentăm procesul izocor în pV , pT și VT - diagrame
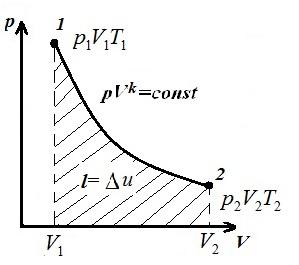
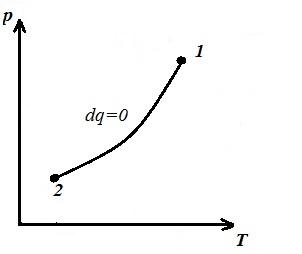
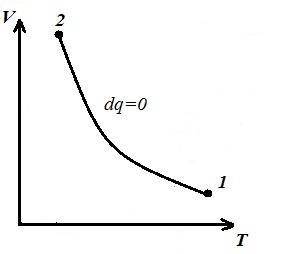
Pătrat V 1 12 V 2 sub adiabaticul 1-2 pe pV – diagrama dă lucru l egal cu modificarea energiei interne a gazului
Comparând ecuația adiabatică cu legea Boyle-Mariotte ( T = const ) putem concluziona că, întrucât k >1, apoi, la extinderea de-a lungul adiabatului, presiunea scade mai puternic decât de-a lungul izotermei, adică. în pV – diagrama adiabatică este mai mare decât izoterma, adică. adiabatul este o hiperbolă inegală care nu intersectează axele de coordonate.
Obținem ecuația adiabatică în pT și VT − diagrame. Într-un proces adiabatic, toți cei trei parametri se modifică ( p , V , T ).
Obținem relația dintre T și V . Ecuații de stare pentru punctele 1 și 2
de unde împărțind a doua ecuație la prima
Înlocuind raportul de presiune din ecuația adiabatică Poisson
sau TVk -1= const este ecuația adiabatică în VT - diagramă.
Înlocuind în (*) (3) raportul volumelor din ecuația adiabatică (Poisson)
sau − ecuația adiabatică în pT - diagramă. Aceste ecuații se obțin în ipoteza că k = const .
Lucrați într-un proces adiabatic la CV = const
Având în vedere relația dintre temperatură Tși V
![]()
Având în vedere raportul dintre T și p

Schimbarea energiei interne u=- l.
Muncă disponibilă, având în vedere asta
![]() ,
,
Acestea. munca disponibila in k de ori mai multă muncă a procesului adiabatic l .
φ și ψ nu găsim.
Proces politropic
Un proces politropic este orice proces arbitrar care are loc la o capacitate termică constantă, de exemplu.
Apoi, ecuația primei legi a termodinamicii va lua forma
![]() (*)
(1)
(*)
(1)
Astfel, dacă C = constși CV = const , atunci distribuția cantitativă a căldurii între energia internă și lucru într-un proces politropic rămâne constantă (de exemplu, 1:2).
Proporția de căldură consumată pentru a modifica energia internă a fluidului de lucru
![]()
Proporția de căldură cheltuită pentru muncă externă,
![]()
Obținem ecuația procesului politropic. Pentru a face acest lucru, folosim ecuația primei legi a termodinamicii (*)
De aici, de la (*) și (**)
Împărțirea celei de-a doua ecuații (4) la prima (3)
Introducem o mărime numită exponent politropic. Apoi,
Integrând această expresie, obținem
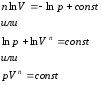
Această ecuație este ecuația politropică în pV − diagramă. Indicele potlitrop n este constantă pentru un anumit proces și poate varia de la -∞ la +∞.
Folosind ecuația de stare, putem obține ecuația politropică în VT și pT- diagrame.
Din ![]() - ecuația politropică în VT -
diagramă.
- ecuația politropică în VT -
diagramă.
Din ![]()
− ecuația politropică în pT - diagramă.
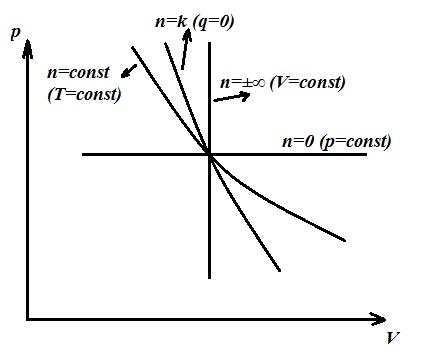
Procesul politropic este generalizator, iar procesele principale (izocoric, izotermic, adiabatic) sunt cazuri speciale ale procesului politrop, fiecare având propria sa valoare. n . Astfel, pentru fiecare proces izocor n =±∞, izobaric n =0, izotermic n =1, adiabatic n = k .
Deoarece ecuațiile politropice și adiabatice sunt aceleași ca formă și diferă doar ca mărime n(exponent politrop în loc de k − exponent adiabatic), putem scrie
funcţionarea procesului politropic
![]()
lucru de unică folosință a unui proces politropic
Capacitatea termică a gazului de la , de unde
![]()
Mai mult, in functie de n capacitatea termică a procesului poate fi pozitivă, negativă, egală cu zero și variază de la -∞ la +∞.
În procesele C<0 всегда l> q acestea. pentru a efectua lucrarea de dilatare, pe lângă căldura furnizată, se consumă o parte din energia internă a gazului.
Modificarea energiei interne a unui proces politropic
![]()
Căldura transmisă gazului într-un proces politropic
![]()
Modificarea entalpiei fluidului de lucru
![]()
A doua lege a termodinamicii
Prima lege a termodinamicii caracterizează procesele de conversie a energiei din punct de vedere cantitativ, i.e. el sustine ca caldura poate fi transformata in munca, iar munca in caldura, fara a stabili conditiile in care aceste transformari sunt posibile. Astfel, stabilește doar echivalența diferitelor forme de energie.
A doua lege a termodinamicii stabilește direcția și condițiile procesului
Ca primă lege a termodinamicii, a doua lege a fost derivată din date experimentale.
Experiența arată că conversia căldurii în muncă utilă poate avea loc numai atunci când căldura trece de la un corp încălzit la unul rece, adică. când există o diferență de temperatură între radiatorul și radiatorul. Este posibil să schimbați direcția naturală a transferului de căldură în sens opus numai în detrimentul costului muncii (de exemplu, în frigidere).
Conform legii a 2-a a termodinamicii
Este imposibil un proces în care căldura s-ar transfera spontan de la corpurile reci la corpurile încălzite.
Nu toată căldura primită din transferul de căldură poate intra în lucru, ci doar o parte din ea. O parte din căldură trebuie să ajungă la radiatorul.
Astfel, crearea unui dispozitiv care, fără compensare, ar transforma complet căldura oricărei surse în lucru și numit mașină cu mișcare perpetuă de al doilea fel, imposibil!
Procese reversibile și ireversibile
Pentru orice sistem termodinamic se pot imagina două stări între care (Fig) vor avea loc două procese: unul de la prima stare la a doua și celălalt invers, de la a doua stare la prima.
Primul proces se numește direct proces, iar al doilea verso.
Dacă un proces direct este urmat de un proces invers și sistemul termodinamic revine la starea inițială, atunci astfel de procese sunt considerate a fi reversibil.
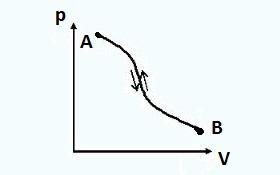
În procesele reversibile, sistemul în procesul invers trece prin aceleași stări de echilibru ca și în procesul direct. În acest caz, nici în mediul înconjurător, nici în sistemul în sine, există efecte reziduale (fără modificare a parametrilor, lucrări efectuate etc.). Printr-un proces direct AB , iar apoi invers BA starea finală a sistemului va fi identică cu starea inițială.
Figura prezintă o configurare a procesului reversibilă mecanic. Instalația constă din cilindrul 1, pistonul 2 cu masa 3 și nisip pe acesta. Sub piston, cilindrul conține gaz, care este sub presiunea nisipului de pe masă.
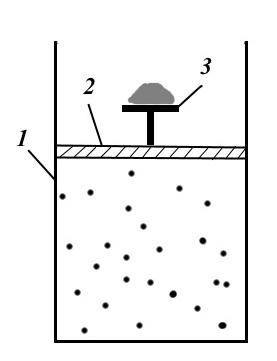
Pentru a crea un proces reversibil, este necesar să îndepărtați infinit lent un fir de nisip după altul. Atunci procesul va fi izoterm, iar presiunea va fi egală cu presiunea exterioară, iar sistemul va fi constant într-o stare de echilibru. Dacă procesul se desfășoară în direcția opusă, de ex. aruncați infinit încet grăunte de nisip pe tabelul 3, apoi sistemul va trece succesiv prin aceleași stări de echilibru și va reveni la starea inițială (dacă nu există frecare).
La extindere, corpul de lucru într-un proces reversibil produce muncă maximă.
Scurtă parte teoretică
Raportul dintre căldura δq primită de o cantitate unitară de substanță și modificarea temperaturii dt se numește căldură specifică.
(1.1)Deoarece cantitatea de căldură δq depinde de natura procesului, capacitatea de căldură a sistemului CX depinde și de condițiile procesului.
Capacitatea termică, în funcție de cantitatea de substanță, poate fi de masă - C, volumetrică - C "și molară µC. Relația dintre ele:
Semnificația fizică a capacităților termice ale unei substanțe ideale la V = const și P = const rezultă din luarea în considerare a relațiilor termodinamice diferențiale de forma:
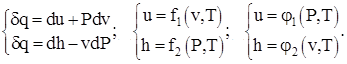 (1.3)
(1.3)
După transformări corespunzătoare, ținând cont de proprietățile unui gaz ideal, obținem:
(1.4)Aceasta indică faptul că modificările energiei interne și ale entalpiei sunt definite astfel:
(1.5)acestea. indiferent de natura procesului.
Relațiile dintre CP și CV:
În conformitate cu teoria cinetică moleculară a gazelor, capacitatea de căldură molară la V = Const este proporțională cu numărul gradelor lor de libertate, exprimat în echivalent Joule, iar pentru un mol de gaz este µСV = 3 × 4,19 = 12,5 J/ (mol × K). Apoi, în conformitate cu legea lui Mayer, µСP = 5 × 4,19 = 20,8 J / (mol × K), ceea ce permite, în funcție de atomicitatea gazului și de gradele lor de libertate, să se reprezinte valorile capacităților de căldură molare în urmatoarea forma:
Tabelul nr. 1.1.
Capacitatea termică determinată de ecuația (4.1) pentru parametrii de stare dați (P, v, T) se numește adevărată și poate fi exprimată ca:
CX = CX0 + ΔCX,(1,7)
unde СX0 este capacitatea termică a gazului în stare de descărcare (la P " 0) și depinde numai de temperatură, iar ΔСX determină dependența capacității de căldură de presiune și volum.
Capacitatea termică medie CXm în intervalul de temperatură de la T1 la T2 este exprimată astfel:
 (1.8)
(1.8)
Dacă acceptăm că una dintre limite, de exemplu T1 = 273,15 K, atunci putem calcula capacitățile termice medii ale gazelor în intervalul de temperatură de la t1 = 0 °C la t2 = x °C și să le prezentăm valorile în tabel. formular, vezi Anexa, Tabelul Nr. 2 - Nr. 4.
Cantitatea de căldură transferată în sistem conform ecuației (4.8) și folosind datele capacității termice, tabelele nr. 2 - nr. 4, ținând cont de (4.2), în funcție de proces, se calculează prin formulele:
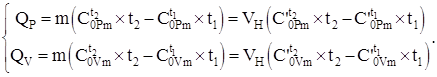 (1.9)
(1.9)
Pentru calcule aproximative ale cantității de căldură la nu foarte temperaturi mari putem lua C = Const și apoi ecuațiile (1.14) ținând cont de (1.2) - (1.4) și de valorile tabelului nr. 4.1. va arata ca:
 (1.15)
(1.15)
Sarcina numărul 1-1. Aerul având un volum V = 15 m3 la o temperatură t1 = 1500 °C și o presiune P = 760 mmHg este răcit izobar la o temperatură t2 = 250 °C. Determinați căldura îndepărtată QP dacă: a) luați în considerare constanta capacității termice, b) utilizați formula µСP = 6,949 + + 0,000576×t.
Sarcina numărul 1-2. Debitul de aer este măsurat folosind un încălzitor electric instalat în conducta de aer. Temperatura aerului înainte și după încălzitor este măsurată cu două termometre. Determinați debitul orar de aer G kg / h, dacă, atunci când încălzitorul electric cu o putere de 0,75 kW este pornit, temperatura aerului în fața încălzitorului T1 = 288 K și în spatele încălzitorului T2 = 291,1 K. De asemenea, determinați debitul de aer din spatele încălzitorului, dacă presiunea acestuia este (acceptată de noi neschimbată) P = 870 mmHg, iar diametrul conductei de aer d = 90 mm.
Sarcina numărul 1-3. Ca urmare a arderii complete a carbonului într-o atmosferă de oxigen pur, în vas s-a format dioxid de carbon CO2 la o presiune de P = 6,04 bar și o temperatură de T1 = 1673 K. Câtă căldură va fi eliberată când CO2 se răcește la o temperatură de T2 = 293 K. Determinați, de asemenea, ce presiune se va stabili în același timp în vas și ce presiune a avut oxigenul în vas înainte de ardere, dacă temperatura acestuia a fost de 10 ° C. Volumul vasului se ia neschimbat și egal cu 5 litri.
Sarcina numărul 1-4. Aflați cantitatea de căldură necesară pentru a încălzi 1 Nm3 dintr-un amestec de gaze de compoziție τ(CO2) = 14,5%; τ(O2) = 6,5%; τ(N2) = 79,0% de la 200 la 1200 °C la P = Dependența constantă și neliniară a capacității termice de temperatură.
Exemplu. Aerul în cantitate de 6 m3 la presiunea P1 = 3 bari și temperatura t1 = 25 °C este încălzit în procesul P = Const la t2 = 130 °C. Determinați cantitatea de căldură furnizată, luând în considerare C \u003d Const și C \u003d f (T).
QP \u003d m × CP × (t2 - t1) \u003d VH × C "P × (t2 - t1);
QP \u003d m × (CPm × t2 - CPm × t1) \u003d VH × (C "Pm × t2 - C" Pm × t1).
m = (P1 × V1 × µ) / (R × T1) = (3 × 105 × 6 × 2,896 × 10–2) / (8,314 × 298,15) = 21,03 kg.
VН = (Р1 × V1 × TN) / (РН × T1) = (3 × 105 × 6 × 273,15) / (101325 Pa × 298,15) = 16,28 nm3.
QP = 21,03 × (29,33/2,896 × 10–2) × (130 – 25) = 16,28 × (29,33/2,24 × 10–2) × (130 – 25) = 2236, 4 kJ.
QP = 21,03 kg × (1,0079 × 130 - 1,0042 × 25) = 16,28 × (1,3026 × 130 - 1,298 × 25) = 2227,5 kJ.
Discrepanță 0,40%.
Sarcina numărul 1-5. Un vas închis cu o capacitate de V = 0,5 m5 conține dioxid de carbon la P = 6 bar și T = 800 K. Cum se va schimba presiunea gazului dacă din acesta se scad 100 kcal? Acceptați dependența C = f(T) ca liniară.
Sarcina numărul 1-6. Un vas cu o capacitate de 90 litri contine aer la o presiune de 8 bar si la o temperatura de 303 K. Determinati cantitatea de caldura care trebuie transmisa aerului pentru a-i creste presiunea la V = Const la 16 bar. Acceptați dependența C = f(T) ca neliniară. Dați răspunsul în kcal.
Sarcina numărul 1-7. Ce cantitate de căldură trebuie consumată pentru a încălzi 2 m3 de aer la o suprapresiune constantă PM = 2 bar de la t1 = 100 °C la t2 = 500 °C? câtă muncă se face prin aer? Presiunea aerului pe barometru este luată egală cu 760 mmHg.
Sarcina numărul 1-8. Sub încălzire izobară de la T1 = 313 K la T2 = 1023 K, un gaz omogen lucrează l = 184 kJ/kg. Determinați ce fel de gaz este, câtă căldură îi este comunicată și cum s-a schimbat presiunea acestuia în acest caz.
Sarcina numărul 1-9. În procesul de alimentare cu căldură la presiune constantă, temperatura de 0,9 nm3 de azot crește de la T1 = 288 K la T2 = 1873 K. Determinați modificările entalpiei azotului și proporția de căldură consumată pentru creșterea energiei interne.
Sarcina numărul 1-10. Cilindrul cu piston mobil conține oxigen în cantitate de VH = 0,3 nm3 la T1 = 318 K și P1 = 776 mmHg. O anumită cantitate de căldură este transmisă oxigenului la P = Const, iar apoi este răcită la temperatura inițială (318 K) la V = Const. Determinați cantitatea de căldură introdusă, modificarea entalpiei, energia internă și munca efectuată pentru ambele procese dacă se știe că la sfârșitul răcirii izocorice presiunea oxigenului P3 = 0,588 bar. Desenați stările gazelor în coordonatele P-V și T-S.
Procese termodinamice cu un gaz ideal.
Scurtă parte teoretică
Un proces termodinamic este înțeles ca interacțiunea vehiculului cu mediul înconjurător, în urma căreia vehiculul este transferat dintr-o anumită stare inițială într-o anumită stare finală.
Dacă vehiculul în care rulează procesul poate fi readus la starea inițială astfel încât în timpul Mediul extern nu are loc nicio schimbare, se spune că procesul este reversibil. Dacă starea inițială a vehiculului fără modificări ale mediului extern este ireversibilă, atunci procesul se numește ireversibil.
Doar procesele reversibile pot fi descrise grafic pe diagramele de stare, deoarece pe ele fiecare punct reprezintă o stare de echilibru.
Principiul conservării energiei, formulat de prima lege a termodinamicii (formulele (2.1) - (2.3)), conduce în cele din urmă la un bilanț energetic care raportează modificarea rezervei de energie a TS (energie internă) cu energia care trece de limitele sistemului atunci când procesul este finalizat sub formă de muncă sau căldură.
Un grup de procese care, în anumite condiții, se generalizează pentru toate procesele și se caracterizează printr-o capacitate termică constantă se numește politropic.
Pentru toate procesele, se stabilește o metodă generală de cercetare, care este următoarea:
se deduce ecuația procesului;
stabilește relația dintre principalii parametri ai stării vehiculului;
se determină capacitatea termică a procesului;
· Se determină modificări ale funcţiilor de stare: energie internă, entalpie, entropie;
se calculează funcțiile procesului: căldură și lucru;
· se oferă o interpretare grafică a proceselor termodinamice în coordonatele P – V și T – S.
Procesele luate în considerare sunt considerate a fi reversibile.
Principalele rapoarte conform punctelor 1 - 5 sunt date în tabelele Nr. 2.1 - Nr. 2.3.
Tabelul nr. 2.1
Tabelul nr. 2.2
Tabelul nr. 2.3
Capacitatea termică într-un proces politropic este:
Figura de mai jos prezintă procesele politropice în coordonatele P–V și T–S.

Exemplu. Aerul având un volum V = 0,01 m3, la P1 = 10 bar și T1 = 298 K, se dilată într-un cilindru cu piston mobil la o presiune P2 = 1 bar. Determinați volumul final, temperatura, lucrul de dilatare, aportul de căldură, modificarea energiei interne, entalpie și entropie dacă are loc dilatarea: 1. izotermic; 2. adiabatic; 3. politropic cu indice politropic n = 1,3. Prezentați procesul în coordonatele P - V și T - S.
Expansiune izotermă.
Volumul la sfârșitul expansiunii:
V2 = V1 × (P1/P2) = 0,01 × (10/1) = 0,1 m3.
Lucrari de extindere:
L = P1 × V1 × ln(P1/P2) = 106 × 0,01 × ln(10/1) = 23 kJ.
QT = L = 23 kJ.
Deoarece T1 = T2 = 298 K, atunci Δh = 0 și Δu = 0.
Modificarea entropiei:
ΔS \u003d Q / T \u003d 23/298 \u003d 0,07718 kJ / K.
expansiunea adiabatică.
Masa gazului din cilindru:
m = (P1 × V1 × μ) / R × T1 = (106 × 0,01 × 2,896 × 10–2) / (8,314 × 298 K) = 0,117 kg.
Volumul final:
V2 = V1 × (P1/P2) 1/k = 0,01 × (10/1) 1/1,4 = 0,0518 m3.
Temperatura aerului la sfârșitul procesului:
T2 = T1 × (P2/P1) (k – 1) /k = 298 × (1/10) (1,4 – 1) /1,4 = 154,35 K.
Lucrul gazului în timpul expansiunii:
L \u003d (P1 × V1 - P2 × V2) / (k - 1) \u003d (106 × 0,01 - 105 × 0,0518) / (1,4 - 1) \u003d 12 kJ.
Entalpie:
Δh \u003d CP × (T2 - T1) \u003d 1,0189 × (154,35 - 298) \u003d - 146,36 kJ / kg;
ΔH \u003d m × Δh \u003d 0,117 × (- 146,36) \u003d - 17,12 kJ.
Energie interna:
Δu \u003d CV × (T2 - T1) \u003d 0,7317 × (154,35 - 298) \u003d - 105,11 kJ / kg;
ΔU \u003d m × Δu \u003d 0,117 × (- 105,11) \u003d - 12,30 kJ.
La determinarea modificării funcțiilor de stare, datorită unei schimbări semnificative a temperaturii în proces (298 - 154,35 = 146,65 K), folosim dependența capacității termice de temperatura C = f(T) (vezi Tabelul nr. 3 din Apendice).
Extensie politropică cu n = 1,3.
Volumul final:
V2 = V1 × (P1/P2) 1/n = 0,01 × (10/1) 1/1,3 = 0,0588 m3.
Temperatura finala:
T2 = T1 × (V1/V2) n – 1 = 298 × (0,01/0,0588) 1,3 – 1 = 175,15 K.
Lucrul gazului în timpul expansiunii:
L \u003d (P1 × V1 - P2 × V2) / (n - 1) \u003d (106 × 0,01 - 105 × 0,0588) / (1,3 - 1) \u003d 13,7 kJ.
Cantitatea de căldură furnizată:
qP = CV × [(n – k) /(n – 1)] × (T2 – T1) = 0,7317 × [(1,3 – 1,4) /(1,3 – 1)] × (175 ,15 – – 298) = 29,96 kJ/kg;
QP = m × qP = 0,117 × 29,96 = 3,51 kJ.
Schimbarea în proces a fost:
Entalpie:
Δh \u003d CP × (T2 - T1) \u003d 1,0189 × (175,15 - 298) \u003d - 125,17 kJ / kg;
ΔH = m × Δh = 0,117 × (–125,17) = – 14,64 kJ.
Energie interna:
Δu \u003d CV × (T2 - T1) \u003d 0,7317 × (175,15 - 298) \u003d - 89,89 kJ / kg;
ΔU = m × Δu = 0,117 × (–89,89) = – 10,52 kJ.
Sarcini pentru soluție independentă.
Sarcina numărul 2-1. Într-o încăpere închisă cu un volum de V = 25 m3, există aer la o presiune de P1 = 730 mmHg și o temperatură de T1 = 283 K. Ca urmare a alimentării cu căldură, presiunea a crescut la P2 = 2,3 bar. Determinați cantitatea de căldură furnizată QV, modificarea energiei interne ΔU și entalpia ΔH.
Sarcina numărul 2-2.6. kg de azot efectuează lucru LP = 343 kJ în procesul de expansiune izobară. Determinați modificările energiei interne a azotului, dacă temperatura de pornire este egal cu T1 = 373 K.
Sarcina numărul 2-3. Monoxidul de carbon se află la o presiune în exces de PM = 3,92 bar și ocupă un volum de V = 5 m3, în timp ce presiunea barometrică este egală cu RB = 755 mmHg. Determinați modificarea energiei interne și cantitatea de muncă cheltuită dacă monoxidul de carbon este răcit izobar de la T1 = 573 K la T2 = 373 K.
Sarcina numărul 2-4. Cum se vor schimba energia internă și entalpia a 20 nm3 de oxigen în timpul încălzirii izobare de la 373 K la 1173 K dacă presiunea P = 9,8 bar. Care este munca efectuată de gaz?
Sarcina nr. 2-5,0,6 nm3 de aer cu alimentare izobară de căldură funcționează LP = 15,68 kJ. Determinați temperatura T2 și volumul aerului V, dacă în starea inițială temperatura și presiunea acestuia erau, respectiv, P1 = 4,42 bar și T1 = 293 K.
Sarcina numărul 2-6. Oxigenul la o temperatură T1 = 353 K și o presiune PB egală cu 320 mmHg este comprimat la T = Const la o suprapresiune PM = 12 bar. De câte ori scade volumul de oxigen dacă presiunea barometrică РБ = 745 mmHg?
Sarcina numărul 2-7. 10 kg de oxigen se dilată la T = 423 K = Const de la presiunea inițială P1 = 14,7 bar și produc lucru LT = 2969,4 kJ. Determinați presiunea la sfârșitul expansiunii și descrieți procesul în coordonatele P - V și T - S.
Sarcina numărul 2-8. Un cilindru cu piston mobil conține 3,5 m3 de azot la o presiune P1 = 1,47 bar. În timpul compresiei izoterme, se îndepărtează 461 kJ de căldură. Determinați presiunea P2 și volumul V2 de azot la sfârșitul compresiei.
Sarcina numărul 2-9. 0,4 kg de aer la T1 = 573 K și P1 = 1,98 bari se extind izotermic până la V2 = 1,68 m3/kg, apoi sunt comprimate izobar și, în final, prin încălzire izocoră, revin din nou la starea lor inițială. Determinați pentru fiecare proces ΔH, ΔS, ΔU, precum și căldura și lucrul L. De asemenea, determinați parametrii (P, v, T) pentru toate punctele și descrieți procesele în coordonatele P - V și T - S.
Sarcina numărul 2-10. 0,3 Nm3 de aer este comprimat izotermic din starea inițială P1 = 7,35 bar, T1 = 573K până la o stare finală P2, V2. Determinați valorile P2 și V2 dacă se știe că 167,6 kJ de căldură au fost îndepărtate în timpul compresiei izoterme. Determinați și modificarea energiei interne și a entalpiei aerului.
Sarcina numărul 2-11. 1. Nm3 de aer se extinde adiabatic din starea inițială 1 (P1 = 6 atm, t1 = 300 °C) până la starea în care V2 = 3V3; apoi se comprimă izotermic până la valoarea iniţială a volumului specific V3 = V1. Determinați parametrii (P, v, T) ai punctelor 1, 2 și 3 și munca totală efectuată de gaz. Reprezentați procesul în coordonatele P - V și T - S.
Sarcina numărul 2-12. Munca petrecută la comprimarea adiabatică a 3 kg de aer este (- 471) kJ. Starea inițială a aerului este caracterizată de parametrii T1 = 288 K și P1 = 1 bar. Determinați temperatura finală și modificarea energiei interne.
Sarcina numărul 2-13. 1. kg de aer la presiunea P1 = 4 bari și temperatura T1 = 373 K se extinde la presiunea P2 = 1 bar. Determinați temperatura finală, cantitatea de căldură și munca efectuată dacă dilatarea are loc: a) izocoric, b) izotermic, c) adiabatic și d) politropic cu exponent n = 1,2. Prezentați procesul în coordonatele P - V și T - S.
Problema #2-14. Un cilindru cu o capacitate de 100 litri contine aer la o presiune P1 = 50 bar si o temperatura T1 = 293 K. Presiunea ambientala P2 = 1 bar. Determinați munca utilă care poate fi efectuată de aer atunci când acesta se extinde la presiunea ambientală de-a lungul izotermei și adiabatic, precum și temperatura finală a aerului din balon după expansiunea adiabatică.
Sarcina numărul 2-15. 1 kg de aer la o temperatură T1 = 290 K este comprimat adiabatic până la un volum care este 1/5 din volumul inițial, apoi se extinde izotermic până la volumul inițial. Determinați munca efectuată de aer ca rezultat al ambelor procese. Prezentați procesul în coordonatele P - V și T - S.
Problema #2-16. Cu o expansiune politropică de 1 kilomol de gaz, volumul său a crescut cu 20% și temperatura absolută a scăzut cu 12%. Determinați indicele politropic, valoarea muncii lP kJ/mol, dacă T1 = 490 K.
Problema #2-17. 50 kJ/kg de căldură sunt furnizate la 1 kg de aer în timpul comprimării acestuia în procesul politropic. Determinați indicele politropic, modificarea energiei interne și munca de compresie dacă temperatura aerului a crescut cu 100 K în timpul procesului.
Problema numărul 2-18. 1 kg de azot în starea inițială are parametrii P1 = 25 bar și T1 = 973 K. După expansiune politropică (n = 1,18), presiunea azotului devine egală cu P2 = 105 N/m2. Determinați ΔU, ΔН în proces, precum și cantitatea de căldură qP și munca de dilatare lP.
1. Un proces care are loc la un volum constant se numește ___ izocor ________
2. Un proces care are loc la presiune constantă se numește ___ izobar ______
3. Un proces care are loc la o temperatură constantă se numește ___ izoterm ___
4. Un proces care se desfășoară fără schimb de căldură cu mediul extern se numește _______________adiabatic ___________________________
5. Un proces termodinamic generalizant, în care proporția de căldură folosită pentru a modifica energia internă a sistemului rămâne constantă, se numește _________politropic____________
6. Cantitatea de căldură care trebuie transmisă unui corp pentru a-și schimba temperatura cu un kelvin sau un grad Celsius se numește ____ capacitate termică _______
7. Pentru un ciclu de motor termic, raportul dintre munca efectuată pe ciclu și cantitatea de căldură aportă este ______ eficiența ciclului ______
8. Cantitatea de căldură necesară pentru a transforma 1 kg dintr-un lichid încălzit până la punctul de fierbere la presiune constantă în abur saturat uscat se numește ________________ căldură de vaporizare ____________
9. Metoda moleculară de transfer de căldură într-un mediu continuu în prezența unui gradient de temperatură se numește ____________ conductivitate termică ______________________________
10. Transferul de căldură, realizat prin acțiunea combinată a conducției de căldură și a convecției, se numește ___________ transfer de căldură convectiv ___________________________
11. Cantitatea de căldură transferată prin orice suprafață pe unitate de timp se numește ____________ flux de căldură __________
12. Fluxul de căldură pe unitatea de suprafață a suprafeței prin care trece se numește _____ densitate_flux de căldură __________________________
13. Parametrii stării unui sistem termodinamic sunt
15. Se numește un sistem care poate face schimb cu mediul și cu materia și energia
|
1) deschis |
3) adiabatic |
|
2) închis |
4) închis |
16. Se numește un sistem care poate schimba energie, dar nu materie cu mediul
18. Ecuația de stare pentru o cantitate arbitrară de gaz ideal are forma
Următoarele denumiri sunt acceptate în opțiunile de răspuns:
p - presiunea
v- volum specific
m este masa gazului
T - temperatura termodinamică
t- temperatura în Celsius
M este numărul de kilomoli de gaz
R- constanta gazului
Constanta universală de gaz
19. Transformarea reciprocă are loc în sistemele termomecanice
20. Un proces fără schimb de căldură cu mediul se numește
21. Un proces care are loc la o temperatură constantă se numește
|
1) izocoric |
4) adiabatic |
|
2) izobar |
5) izoentropic |
|
3) izotermă |
22. Un proces care are loc la un volum constant se numește
24. Factorul care are cea mai mare influență asupra capacității termice specifice a unui gaz este
25. Se numește combustibilul condiționat
1) combustibilul cel mai potrivit pentru condiții specifice de utilizare
2) cărbune de calitate medie
3) combustibil cu o putere calorică mai mică de 29,31 MJ/kg
4) combustibil cu o putere calorică mai mică de 35,0 MJ/kg
26. Figurile prezintă diagrame de instalare
1) a) puterea aburului; b) turbină cu gaz; c) refrigerare cu compresor de vapori
2) a) refrigerare cu compresor de vapori; b) turbină cu gaz; c) puterea aburului
3) a) refrigerare cu absorbţie; b) turbină cu gaz; c) puterea aburului
4) a) turbină cu gaz; b) refrigerare cu compresor de vapori; c) puterea aburului
27. O pompă de căldură este
1) o mașină frigorifică utilizată pentru furnizarea de căldură (încălzire).
2) o pompă de orice tip utilizată pentru pomparea lichidului
lichide de răcire
3) un dispozitiv pentru transferul căldurii de la o sursă „fierbinte” la una „rece”.
4) un dispozitiv pentru pomparea temperaturii de la o sursă de căldură la
28. Densitatea fluxului de căldură în timpul transferului de căldură se calculează prin formula
|
1)
|
3)
|
|
2)
|
4)
|
Următoarele notații sunt utilizate în opțiunile de răspuns date:
 -coeficient de conductivitate termica
-coeficient de conductivitate termica
 -coeficient de transfer termic
-coeficient de transfer termic
 - coeficient de transfer termic
- coeficient de transfer termic
 - grosimea peretelui
- grosimea peretelui
 și
și  – temperatura purtătorilor de căldură
– temperatura purtătorilor de căldură
 și
și 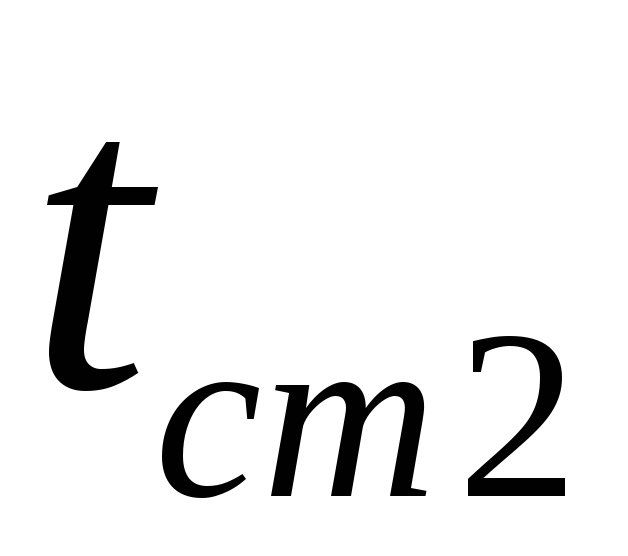 sunt temperaturile suprafețelor pereților
sunt temperaturile suprafețelor pereților
|
Potriviți răspunsurile |
29. În ciclul Otto prezentat în diagrame
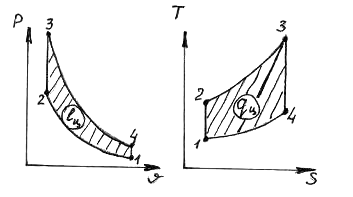
procesele de notare
1) 1-2 A) alimentare izocoră de căldură
2) 2-3 B) alimentare izobară de căldură
3) 3-4 V) îndepărtare izocorică a căldurii
4) 4-1 D) îndepărtarea izobară a căldurii
D) alimentare izotermă cu căldură
E) îndepărtarea izotermă a căldurii
G) expansiune adiabatică
H) compresie adiabatică
1.__z___; 2.__a___; 3.__f___; 4.__în___