Vaporii de apă se numesc saturati dacă. Abur saturat și nesaturat
Un vapor saturat este un vapor care este în echilibru cu un lichid sau solid. Presiunea vaporilor de saturație a unei substanțe depinde de natura și temperatura acesteia.
Echilibrul dintre lichid și vapori este dinamic: între ele are loc un schimb continuu de particule (atomi, molecule), iar pe unitatea de timp, prin unitățile de interfață, tot atâtea particule zboară în vapori pe măsură ce revin.
Presiunea vaporilor saturați crește odată cu creșterea temperaturii. Cantitativ, această dependență este exprimată prin ecuația Clausius-Clapeyron
unde Р este presiunea aburului saturat; T este temperatura absolută;
ΔН este căldura molară de vaporizare; R este constanta universală a gazului.
Integrând această ecuație, presupunând ΔН=f(T), obținem
lnP = - + const(2)
ln = - ( - ). (3)
Ecuația (2) corespunde unei dependențe rectilinie în coordonatele lnP – . Prin tangenta pantei dreptei, se poate determina căldura de evaporare ΔН, deoarece ΔН = -Rtgα, unde α este unghiul format de dreapta și axa absciselor. Valoarea constantei de integrare depinde de dimensiunea în care se exprimă presiunea și poate fi găsită din orice valoare a lnP pe linia dreaptă obținută.
În conformitate cu regula fazei Gibbs, un sistem lichid-vapori de echilibru are un grad de libertate. Aceasta înseamnă că presiunea vaporilor de saturație a unei substanțe depinde numai de temperatură. În această lucrare, variabila independentă este presiunea externă, care este stabilită de experimentator, iar variabila dependentă este punctul de fierbere.
Obiectiv- faceți cunoștință cu metoda dinamică de măsurare a presiunii vaporilor saturați, determinați dependența presiunii vaporilor saturați de temperatură pentru o anumită substanță și calculați căldura de evaporare din grafic.
PROCEDURA DE LUCRU
Metoda dinamică se bazează pe determinarea punctelor de fierbere ale unui lichid la diferite presiuni. Deoarece fierberea are loc la temperatura la care presiunea vaporilor de saturație este egală cu presiunea externă, prin urmare, măsurătorile temperaturilor de fierbere la diferite presiuni dau dependența presiunii vaporilor de saturație de temperatură.
Instalația pentru efectuarea lucrării este prezentată în figură.
Este format dintr-un vas de lucru 1, în care lichidul se evaporă; un condensator de reflux 2 în care aburul este condensat; manometru 3; încălzitorul 4 cu o baie de apă 5. Un termometru 6 este introdus prin dop în vasul de lucru cu lichidul de testare, al cărui capăt este legat cu bumbac de
măsurați punctul de fierbere direct pe suprafață și evitați erorile din cauza supraîncălzirii lichidului.
|

Munca se reduce la faptul că în spațiul de deasupra lichidului investigat se creează succesiv diverse grade de rarefacție de către pompa Komovsky 7 și se determină punctele de fierbere. Pe parcursul experimentului, vidul este redus prin deschiderea supapei 9. Vasul 8 este un recipient suplimentar care permite umplerea relativ lent a sistemului evacuat cu aer. Presiunea sub care are loc fierberea este determinată de citirea manometrului.
Închideți robinetul, evacuați sistemul la presiunea stabilită de manager. Verificați etanșeitatea sistemului. Se consideră suficient dacă în 10 minute presiunea crește cu cel mult 2,6·10 -3 atm. Lăsați apa în frigider deschizând cu grijă robinetul de apă. Porniți încălzitorul și urmăriți cum crește temperatura lichidului. Încetarea creșterii mercurului în termometru indică fierberea lichidului. Înregistrați citirile
termometru și manometru. Folosind un robinet, comunicând dispozitivul cu atmosfera, crește presiunea cu 0,04 atm. În acest caz, mercurul din termometru crește și se oprește la punctul de fierbere corespunzător noii presiuni. Repetați operațiunile de câte ori este necesar pentru a aduce presiunea din sistem până la presiunea barometrică.
Înregistrați rezultatele măsurătorilor în tabel:
Pe baza datelor obținute: 1) reprezentați grafic dependența presiunii de vapori a lichidului investigat de temperatură în coordonatele Р – T, 0 С și lnP – , K; 2) se determina grafic caldura de vaporizare a lichidului si conform ecuatiei (3) pentru trei intervale de temperatura; 3) determinați modificarea entropiei în timpul evaporării a 1 mol de substanță.
ÎNTREBĂRI DE TEST
pe tema „Echilibre de fază într-un sistem monocomponent”
1. Tranziții de fază de primul și al doilea fel.
2. Condiția de echilibru a coexistenței fazelor.
3. Ecuația Clausius-Clapeyron (derivare).
4. Ce relație dintre temperatură și presiune este tipică pentru echilibrul lichid-vapori? De ce?
5. Ce relație dintre presiune și punctul de topire este cea mai tipică pentru majoritatea substanțelor? De ce este această relație diferită pentru apă?
6. Cum și de ce depinde căldura de evaporare de temperatură?
7. În ce coordonate este relația dintre presiunea vaporilor saturați și temperatură exprimată ca linie dreaptă și cum poate fi determinată valoarea medie a căldurii de evaporare în acest caz?
8. Ce este echilibrul dinamic și presiunea aburului saturat?
9. Diagrama stării apei. Cum se Presiunea atmosferică punctul de fierbere al apei? De ce?
10. Există dependențe lnP - pentru diferite substanțe. Ce determină panta acestor drepte?
Tema 2. TRANZIȚII DE FAZA.
Faza de tranzitie ( transformare de fază) este trecerea unei substanțe de la o fază la alta cu o modificare a condițiilor externe (de exemplu, temperatură, presiune, câmpuri magnetice și electrice etc.), însoțită de o modificare proprietăți fiziceși parametrii substanței.
Valoarea temperaturii, a presiunii sau a altora cantitate fizica la care are loc tranziția de fază se numește punct de tranziție. Există două tipuri de tranziție de fază.
TRANZIȚII DE FAZĂ DE PRIMUL FEL
În timpul unei tranziții de fază de primul fel, astfel de termodinamică
caracteristicile unei substanțe, cum ar fi densitatea, concentrația componentelor, volum specific, cantitatea de energie internă stocată, adică este eliberată sau absorbită o anumită cantitate de căldură, care se numește căldură de tranziție. Mai mult, aceasta se referă la schimbarea bruscă a acestor cantități nu în timp, ci cu o schimbare a temperaturii, presiunii etc. Cele mai comune exemple de tranziții de fază de ordinul întâi sunt:
- topirea si cristalizarea
- evaporare și condensare
- sublimare și desublimare
TRANZIȚII DE FAZĂ DE AL DOILEA FEL
În timpul unei tranziții de fază de ordinul doi, densitatea și energie interna nu schimba, deci cu ochiul liber astfel de faza de tranzitie poate fi invizibil. Saltul este experimentat de derivatele lor în ceea ce privește temperatura și presiunea: capacitatea termică, coeficientul de dilatare termică, diverse susceptibilități etc. I.e. tranzițiile de fază de al doilea fel sunt însoțite de o modificare a simetriei structurii substanței și nu de eliberarea sau absorbția de energie (căldură). Cele mai comune exemple de tranziții de fază de ordinul doi sunt:
- trecerea sistemului printr-un punct critic
- tranziție paramagnetic-feromagnetică
- trecerea metalelor și aliajelor la starea de supraconductivitate
- trecerea heliului lichid într-o stare superfluid
- trecerea materialelor amorfe la starea sticloasă
Fizica modernă investighează, de asemenea, sistemele care au tranziții de fază de ordinul trei sau superior. Recent utilizare largă a primit conceptul de tranziție de fază cuantică, i.e. tranziție de fază controlată nu de fluctuațiile termice clasice, ci de cele cuantice, care există chiar și la zero absolut temperaturi, unde tranziția clasică de fază nu poate fi realizată datorită teoremei Nernst.
Să luăm în considerare mai detaliat fenomenele de interes pentru noi, care sunt asociate cu tranzițiile de fază de ordinul întâi.
EVAPORARE, CONDENSARE, FICERERE.
PERECHI SATURATE SI NESATURI.
Orice substanță în anumite condiții poate fi în diferite stări de agregare - solidă, lichidă și gazoasă. treceri de la unul starea de agregare la al doilea sunt tranziții de fază de ordinul întâi.
Evaporareși condensare sunt tranziții de fază între faza lichidă și cea gazoasă a unei substanțe.
Toate gaze reale(oxigen, azot, hidrogen etc.) în anumite condiții se pot transforma într-un lichid. Cu toate acestea, o astfel de transformare poate avea loc numai la temperaturi sub o anumită, așa-numita temperatura critica T cr. De exemplu, pentru apă, temperatura critică este de 647,3 K, pentru azot 126 K, pentru oxigen 154,3 K. La temperatura camerei (≈ 300 K), apa poate fi atât în stare lichidă, cât și în stare gazoasă, în timp ce azotul și oxigenul există doar în formă de gaze.
prin evaporare se numește tranziție de fază de la starea lichidă la starea gazoasă. Din punctul de vedere al teoriei cinetice moleculare, evaporarea este un proces în care cele mai rapide molecule zboară de pe suprafața unui lichid, energie kinetică care depăşeşte energia legării lor cu restul moleculelor lichidului. Acest lucru duce la o scădere a energiei cinetice medii a moleculelor rămase, adică la răcirea lichidului (dacă nu există o sursă de energie din corpurile înconjurătoare).
Condensare este procesul invers de evaporare. În timpul condensării, moleculele de vapori revin în lichid.
Într-un vas închis, un lichid și vaporii săi pot fi într-o stare echilibru dinamic, când numărul de molecule care părăsesc lichidul este egal cu numărul de molecule care se întorc în lichid din vapori, adică atunci când ratele de evaporare și condensare sunt aceleași. Un astfel de sistem se numește în două faze . Un vapor aflat în echilibru cu lichidul său se numește bogat.
Numărul de molecule emise dintr-o unitate de suprafață a unui lichid într-o secundă depinde de temperatura lichidului. Numărul de molecule care se întorc din vapori în lichid depinde de concentrația moleculelor de vapori și de viteza medie mișcarea lor termică, care este determinată de temperatura aburului. Rezultă că pentru o substanță dată, concentrația moleculelor de vapori la echilibrul unui lichid și vaporii acestuia este determinată de temperatura lor de echilibru. Stabilirea echilibrului dinamic între procesele de evaporare și condensare odată cu creșterea temperaturii are loc la concentrații mai mari de molecule de vapori. Deoarece presiunea unui gaz (abur) este determinată de concentrația și temperatura acestuia, putem concluziona: presiune abur saturat p 0 dintr-o substanță dată depinde numai de temperatura acesteia și nu depinde de volum. Prin urmare, izotermele gazelor reale de pe plan ( p, V) conţin secţiuni orizontale corespunzătoare unui sistem bifazat (Fig. 3.4.1).
Pe măsură ce temperatura crește, presiunea vaporilor de saturație și densitatea acesteia cresc, în timp ce densitatea lichidului scade din cauza dilatației termice. La o temperatură egală cu temperatura critică T kr pentru o substanță dată, densitățile de vapori și lichide devin aceleași. La T > T cr dispar diferentele fizice dintre lichid si sa abur saturat.
Dacă este comprimat izotermic abur saturat la T < T cr, atunci presiunea sa va crește până când devine egală cu presiunea vaporilor saturați. Odată cu o scădere suplimentară a volumului, în fundul vasului se formează un lichid și se stabilește un echilibru dinamic între lichid și vaporii săi saturati. Odată cu scăderea volumului, o parte din ce în ce mai mare a vaporilor se condensează, iar presiunea acestuia rămâne neschimbată (secțiune orizontală pe izotermă). Când toți vaporii se transformă în lichid, presiunea crește brusc cu o scădere suplimentară a volumului datorită compresibilității scăzute a lichidului.
Se poate trece de la starea gazoasă la cea lichidă ocolind regiunea bifazică. Pentru a face acest lucru, trebuie să finalizați procesul ocolind punctul critic K. Unul dintre posibilele procese de acest fel este prezentat în Fig. 1 printr-o linie întreruptă ABC.
LA aerul atmosferic vaporii de apă sunt întotdeauna prezenți la o anumită presiune parțială p, care este de obicei mai mică decât presiunea vaporilor de saturație p 0 . Atitudine p / p 0 , exprimat ca procent, se numește umiditate relativă aer.
| |
Aburul nesaturat poate fi descris teoretic folosind ecuația de stare gaz ideal sub restricțiile obișnuite pentru gazele reale: presiunea vaporilor nu trebuie să fie prea mare (practic p≤ (10 6 –10 7) Pa), iar temperatura acestuia este mai mare decât o anumită valoare definită pentru fiecare substanță. Legile unui gaz ideal pot fi aplicate aproximativ și aburului saturat, cu condiția ca pentru fiecare temperatură T presiune p 0 abur saturat este determinat de curba de echilibrup 0 (T) pentru o substanță dată.
Presiune p 0 de abur saturat crește foarte rapid odată cu creșterea temperaturii T. Dependenta p 0 (T) nu poate fi obținută din legile gazelor ideale. Presiunea unui gaz la o concentrație constantă de molecule crește direct proporțional cu temperatura. În aburul saturat, pe măsură ce temperatura crește, nu numai energia cinetică medie a mișcării moleculare crește, ci și concentrația acestora. Prin urmare, presiunea vaporilor saturați crește mai repede odată cu creșterea temperaturii decât presiunea unui gaz ideal la o concentrație constantă de molecule.
Evaporarea poate apărea nu numai de la suprafață, ci și în cea mai mare parte a lichidului. Lichidele conțin întotdeauna bule de gaz minuscule. Dacă presiunea de saturație a vaporilor unui lichid este egală sau mai mare decât presiunea externă (adică presiunea gazului în bule), lichidul se va evapora în bule. Bulele pline cu abur se extind și plutesc la suprafață. Acest proces se numește fierbere . Astfel, fierberea unui lichid începe la o temperatură la care presiunea acestuia vapori saturati devine egală cu presiunea exterioară.
În special, la presiunea atmosferică normală, apa fierbe la 100°C. Aceasta înseamnă că la această temperatură presiunea vaporilor saturați ai apei este de 1 atm. La escaladarea munților, presiunea atmosferică scade și, prin urmare, punctul de fierbere al apei scade (aproximativ 1 ° C la fiecare 300 de metri de înălțime). La o altitudine de 7 km, presiunea este de aproximativ 0,4 atm, iar punctul de fierbere scade la 70 °C.
Într-un vas închis ermetic, lichidul nu poate fierbe, deoarece la fiecare valoare a temperaturii se stabilește un echilibru între lichid și vaporii săi saturati. De-a lungul curbei de echilibru p 0 (T) se poate determina punctul de fierbere al unui lichid la diferite presiuni.
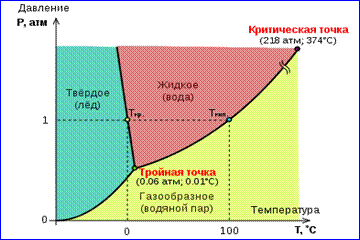
Imaginea izotermelor reale de gaz prezentată în Fig. 1 descrie procesele de evaporare și condensare, adică tranziția de fază între fazele gazoase și lichide ale unei substanțe. De fapt, această imagine este incompletă, deoarece orice substanță poate trece de la gazos și lichid la stare solidă. La o temperatură dată T echilibrul termodinamic între două faze ale aceleiași substanțe este posibil doar la o anumită presiune în sistem. Dependența presiunii de echilibru de temperatură se numește curba de echilibru de fază . Un exemplu este curba de echilibru p 0 (T) vapori saturati si lichid. Dacă curbele de echilibru între diferite faze ale unei substanțe date sunt trasate pe plan ( p, T), apoi împart acest plan în zone separate în care substanța există într-o stare omogenă de agregare - solidă, lichidă sau gazoasă (Fig. 2). Înfățișat în sistemul de coordonate ( p, T) se numesc curbele de echilibru diagramă de fază .
Curba 0 T, corespunzător echilibrului dintre fazele solidă și gazoasă, se numește curba de sublimare. Curba TK echilibrul dintre lichid și vapori se numește curba de evaporare, se termină în punctul critic K. Curba TM echilibrul dintre un solid și un lichid se numește curba de topire.
Curbele de echilibru converg într-un punct T, în care toate cele trei faze pot coexista în echilibru. Acest punct se numește punct triplu.
Pentru multe substanţe presiunea p tr în punctul triplu este mai mic de 1 atm ≈ 10 5 Pa. Astfel de substanțe se topesc atunci când sunt încălzite la presiunea atmosferică. De exemplu, punct triplu apa (Fig. 3) are coordonate T tr = 273,16 K, p tr \u003d 6,02 10 2 Pa și este folosit ca referință pentru calibrarea scalei de temperatură absolută a Kelvin.
 Există, totuși, și așa Diagrama în 3 faze a apei
Există, totuși, și așa Diagrama în 3 faze a apei
substante care au p tr
depășește 1 atm. Prin urmare
presiunea dioxidului de carbon (CO 2).
p tr = 5,11 atm și temperatura
T tr = 216,5 K. Prin urmare, la atmosferă
presiune, bioxid de carbon solid
există doar la temperaturi scăzute și în stare lichida la p= 1 atm nu exista deloc. În stare solidă, dioxidul de carbon este în echilibru cu vaporii săi la presiunea atmosferică la o temperatură de 173 K sau -80 °C. Aceasta este o „gheață carbonică” utilizată pe scară largă, care nu se topește niciodată, ci doar se evaporă (sublimează).
După fierbere, temperatura apei încetează să crească și rămâne neschimbată până la evaporarea completă. Vaporizarea este procesul de trecere de la starea lichidă la starea de vapori, care are același indice de temperatură ca un lichid în fierbere. Această evaporare se numește abur saturat. Când toată apa s-a evaporat, orice adăugare ulterioară de căldură crește temperatura. Aburul încălzit dincolo de nivelul saturat se numește supraîncălzit. În industrie, aburul saturat este utilizat în mod obișnuit pentru încălzire, gătit, uscare sau alte aplicații. Supraîncălzirea este utilizată exclusiv pentru turbine. Diferite tipuri de abur au energii potențiale de schimb diferite și acest lucru justifică utilizarea lor în scopuri complet diferite.
Abur ca una dintre cele trei stări fizice
Înțelegerea structurii moleculare și atomice generale a materiei și aplicarea acestor cunoștințe la gheață, apă și abur vă poate ajuta să înțelegeți mai bine proprietățile aburului. O moleculă este cea mai mică unitate a oricărui element sau compus. Acesta, la rândul său, este alcătuit din particule și mai mici numite atomi, care definesc elementele de bază precum hidrogenul și oxigenul. Combinațiile specifice ale acestor elemente atomice oferă o combinație de substanțe. Unul dintre acești compuși este formula chimica H 2 O, ale cărui molecule constau din 2 atomi de hidrogen și 1 atom de oxigen. Carbonul este, de asemenea, abundent, este o componentă cheie a întregii materii organice. Majoritatea mineralelor pot exista în trei stări fizice ( solid, lichid și vapori), care se numesc faze.
Procesul de generare a aburului
Pe măsură ce apa se apropie de punctul său de fierbere, unele molecule câștigă suficientă energie cinetică pentru a atinge viteze care le permit să se separe momentan de lichidul din spațiu deasupra suprafeței înainte de a reveni. Încălzirea ulterioară provoacă mai multă excitare și numărul de molecule dispuse să părăsească lichidul crește. La presiunea atmosferică, temperatura de saturație este de 100 °C. Aburul cu un punct de fierbere la această presiune se numește abur saturat uscat. Ca și tranziția de fază de la gheață la apă, procesul de evaporare este, de asemenea, reversibil (condensare). Punct critic este cea mai ridicată temperatură la care apa poate fi în stare lichidă. Peste acest punct vaporii pot fi considerați ca un gaz. Starea gazoasă este asemănătoare stării difuze, în care moleculele au o posibilitate aproape nelimitată de mișcare.
Relația variabilelor
La o anumită temperatură, există o anumită presiune a vaporilor care există în echilibru cu apa lichidă. Dacă acest indicator crește, aburul se supraîncălzi și se numește uscat. Există o relație între presiune și temperatură: cunoscând o valoare, o poți determina pe cealaltă. Starea aburului este determinată de trei variabile: presiune, temperatură și volum. Aburul saturat uscat este starea în care aburul și apa pot fi prezente în același timp. Cu alte cuvinte, acest lucru se întâmplă atunci când viteza de vaporizare este egală cu viteza de condensare.
Aburul saturat și proprietățile acestuia
Când discutăm despre proprietățile aburului saturat, acesta este adesea comparat cu un gaz ideal. Au ceva în comun sau este doar o concepție greșită? În primul rând, la un nivel constant de temperatură, densitatea nu depinde de volum. Din punct de vedere vizual, acest lucru poate fi imaginat după cum urmează: trebuie să reduceți vizual volumul rezervorului de abur fără a schimba indicatorii de temperatură. Numărul de molecule condensate va depăși numărul celor care se evaporă, iar vaporii vor reveni la starea de echilibru. Ca rezultat, densitatea va fi un parametru constant. În al doilea rând, caracteristici precum presiunea și volumul sunt independente unele de altele. În al treilea rând, având în vedere invariabilitatea caracteristicilor volumetrice, densitatea moleculelor crește atunci când temperatura crește și devine mai mică atunci când scade. De fapt, atunci când este încălzită, apa începe să se evapore mai repede. Echilibrul în acest caz va fi perturbat și nu va fi restabilit până când densitatea vaporilor va reveni la pozițiile anterioare. În schimb, în timpul condensării, densitatea vaporilor saturați va scădea. Spre deosebire de un gaz ideal, aburul saturat nu poate fi numit sistem închis deoarece este în contact permanent cu apa.

Avantaje in domeniul incalzirii
Aburul saturat este abur pur în contact direct cu apa lichidă. Are multe caracteristici care o fac o sursă excelentă de energie termică, în special temperaturi mari(peste 100 °C). Unii dintre ei:

Diverse tipuri de abur
Aburul este faza gazoasă a apei. Folosește căldură în timpul formării sale și eliberează o cantitate mare de căldură după aceea. Prin urmare, el
poate fi folosit ca substanță de lucru pentru motoarele termice. Sunt cunoscute următoarele stări: saturată umedă, saturată uscată și supraîncălzită. Aburul saturat este preferat în locul aburului supraîncălzit ca mediu de transfer de căldură în schimbătoarele de căldură. Când este eliberat în atmosferă din conducte, o parte din el se condensează, formând nori de evaporare albă, umedă, care conțin picături minuscule de apă. abur supraîncălzit nu va fi supus condensului, chiar și atunci când intră în contact direct cu atmosfera. LA stare supraîncălzită va avea un transfer de căldură mai mare datorită accelerării mișcării moleculelor și a unei densități mai mici. Prezența umidității provoacă decantarea, coroziunea și reducerea duratei de viață a cazanelor sau a altor echipamente de schimb de căldură. Prin urmare, aburul uscat este de preferat deoarece generează mai multă putere și nu este coroziv.

Sec și saturat: care este contradicția
Mulți oameni se confundă cu termenii „uscat” și „bogat”. Cum poate ceva să fie ambele în același timp? Răspunsul se află în terminologia pe care o folosim. Termenul „uscat” este asociat cu absența umidității, adică „nu umed”. „Saturat” înseamnă „înmuiat”, „ud”, „inundat”, „așezat” și așa mai departe. Toate acestea par să confirme contradicția. Cu toate acestea, în ingineria aburului, termenul „saturat” are un alt sens și în acest context înseamnă o stare în care are loc fierberea. Astfel, temperatura la care are loc fierberea este cunoscută din punct de vedere tehnic ca temperaturi de saturație. Aburul uscat în acest context nu conține umiditate. Dacă te uiți la un fierbător care fierbe, poți vedea vapori albi ieșind din duza ibricului. De fapt, este un amestec de vapori uscați incolori și vapori umezi care conține picături de apă care reflectă lumina și sunt colorate în culoare alba. Prin urmare, termenul „abur saturat uscat” înseamnă că aburul este deshidratat și nu supraîncălzit. Fără particule lichide, este o substanță în stare gazoasă care nu respectă legile generale ale gazelor.
Lichidele tind să se evapore. Dacă am scăpa o picătură de apă, eter și mercur pe masă (doar nu o faceți acasă!), Am putea urmări cum picăturile dispar treptat - se evaporă. Unele lichide se evaporă mai repede, altele mai încet. Procesul de evaporare a unui lichid se mai numește și vaporizare. Procesul invers de transformare a vaporilor în lichid este condensarea.
Aceste două procese ilustrează faza de tranzitie- procesul de tranziție a substanțelor de la o stare de agregare la alta:
- evaporare (tranziție de la lichid la stare gazoasă);
- condensare (trecerea de la starea gazoasă la starea lichidă);
- desublimare (trecerea de la o stare gazoasă la o stare solidă, ocolind faza lichidă);
- sublimare, este și sublimare (trecerea de la starea solidă la starea gazoasă, ocolirea lichidului).
Acum, apropo, este sezonul potrivit pentru a observa procesul de desublimare în natură: înghețul și înghețul pe copaci și obiecte, modelele înghețate pe ferestre sunt rezultatul acestuia.
Cum se formează aburul saturat și nesaturat?
Dar să revenim la vaporizare. Vom continua să experimentăm și să turnăm un lichid - apă, de exemplu, într-un vas deschis și vom conecta un manometru la acesta. Invizibil pentru ochi, evaporarea are loc în vas. Toate moleculele lichide sunt în continuă mișcare. Unii se mișcă atât de repede încât energia lor cinetică este mai puternică decât cea care leagă moleculele lichidului.
După ce părăsesc lichidul, aceste molecule continuă să se miște aleatoriu în spațiu, marea majoritate a acestora se disipă în el - așa abur nesaturat. Doar o mică parte dintre ele revine înapoi în lichid.
Dacă închidem vasul, moleculele de vapori vor deveni treptat din ce în ce mai multe. Și din ce în ce mai mulți dintre ei se vor întoarce la lichid. Acest lucru va crește presiunea aburului. Acest lucru va fi înregistrat de un manometru conectat la vas.
După ceva timp, numărul de molecule care părăsesc lichidul și se întorc la acesta va fi egal. Presiunea vaporilor va înceta să se mai schimbe. Ca urmare saturație cu abur se stabileşte echilibrul termodinamic al sistemului lichid-vapori. Adică, evaporarea și condensarea vor fi egale.
Proprietățile aburului saturat
Pentru a le ilustra clar, folosim un alt experiment. Apelați la toată puterea imaginației voastre pentru a vă imagina. Deci, să luăm un manometru cu mercur, format din doi genunchi - tuburi comunicante. Mercurul este turnat în ambele, un capăt este deschis, celălalt este sigilat, iar deasupra mercurului mai conține puțin eter și vaporii săi saturati. Dacă coborâți și ridicați genunchiul nelipit, și nivelul de mercur din cel lipit va crește și va scădea.
În acest caz, se va modifica și cantitatea (volumul) de vapori de eter saturat. Diferența dintre nivelurile coloanelor de mercur din ambii genunchi ai manometrului arată presiunea vaporilor saturati ai eterului. Va rămâne neschimbat în orice moment.
Aceasta implică proprietatea aburului saturat - presiunea acestuia nu depinde de volumul pe care îl ocupă. Presiunea vaporilor de saturație a diferitelor lichide (apă și eter, de exemplu) este diferită la aceeași temperatură.
Cu toate acestea, temperatura aburului saturat contează. Cu cât temperatura este mai mare, cu atât presiunea este mai mare. Presiunea aburului saturat crește mai repede odată cu creșterea temperaturii decât în cazul aburului nesaturat. Temperatura și presiunea vaporilor nesaturați sunt legate printr-o relație liniară.
Mai poate fi efectuat un experiment interesant. Luați un balon gol fără vapori de lichid, închideți-l și conectați un manometru. Treptat, picătură cu picătură, introduceți lichid în balon. Pe măsură ce lichidul intră și se evaporă, se stabilește presiunea vaporilor saturați, care este cea mai mare pentru un anumit lichid la o anumită temperatură.
Mai multe despre temperatură și abur saturat
Temperatura aburului afectează și viteza de condensare. La fel cum temperatura unui lichid determină viteza de evaporare - numărul de molecule care scapă de pe suprafața lichidului pe unitatea de timp, cu alte cuvinte.
Vaporii saturati au aceeasi temperatura ca si lichidul. Cu cât temperatura aburului saturat este mai mare, cu atât presiunea și densitatea acestuia sunt mai mari, cu atât densitatea lichidului este mai mică. Când este atinsă temperatura critică pentru substanță, densitatea lichidului și a vaporilor este aceeași. Dacă temperatura vaporilor este peste temperatura critică pentru substanță, diferențele fizice dintre vaporii lichidi și saturați sunt șterse.
Determinarea presiunii vaporilor de saturație în amestecuri cu alte gaze
Am vorbit despre constantă temperatura constanta presiunea aburului saturat. Am determinat presiunea în condiții „ideale”: când un vas sau un balon conține lichid și vapori dintr-o singură substanță. Luați în considerare și un experiment în care moleculele unei substanțe sunt împrăștiate în spațiu într-un amestec cu alte gaze.
Pentru a face acest lucru, luăm doi cilindri de sticlă deschisi și îi punem în ambele vase închise cu eter. Ca de obicei, conectăm manometre. Deschidem un vas cu eter, după care manometrul înregistrează creșterea presiunii. Diferența dintre această presiune și presiunea din cilindru cu vasul închis de eter vă permite să aflați presiunea vaporilor saturati ai eterului.
Despre presiune și fierbere
Evaporarea este posibilă nu numai de la suprafața lichidului, ci și în volumul acestuia - atunci se numește fierbere. Pe măsură ce temperatura lichidului crește, se formează bule de vapori. Când presiunea vaporilor de saturație este mai mare sau egală cu presiunea gazului din bule, lichidul se evaporă în bule. Și se extind și se ridică la suprafață.
Lichidele fierb la temperaturi diferite. În condiții normale, apa fierbe la 100 0 C. Dar odată cu modificarea presiunii atmosferice, se modifică și punctul de fierbere. Așadar, la munte, unde aerul este foarte rarefiat și presiunea atmosferică este mai scăzută, pe măsură ce urci munții, scade și punctul de fierbere al apei.
Apropo, într-un vas închis ermetic, fierberea este deloc imposibilă.
![]()
Un alt exemplu de relație dintre presiunea vaporilor și evaporare este demonstrat de o asemenea caracteristică a conținutului de vapori de apă din aer precum umiditate relativă aer. Reprezintă relația presiune parțială vapori de apă la presiunea vaporilor saturați și se determină prin formula: φ \u003d p / p aproximativ * 100%.
Când temperatura aerului scade, concentrația de vapori de apă din acesta crește, adică. devin mai intense. Această temperatură se numește punct de rouă.
Rezumând
Folosind exemple simple, am analizat esența procesului de evaporare și aburul nesaturat și saturat rezultat. Toate aceste fenomene le poți observa în jurul tău în fiecare zi: de exemplu, poți vedea bălți care se usucă după ploaie pe străzi sau o oglindă din baie aburită de abur. În baie, puteți chiar observa cum se produce mai întâi vaporizarea, iar apoi umiditatea acumulată pe oglindă se condensează înapoi în apă.
De asemenea, puteți folosi aceste cunoștințe pentru a vă face viața mai confortabilă. De exemplu, iarna, în multe apartamente, aerul este foarte uscat, iar acest lucru are un efect negativ asupra bunăstării. Puteți folosi un umidificator modern pentru a-l face mai umed. Sau, la modă veche, puneți un recipient cu apă în cameră: evaporând treptat, apa va satura aerul cu vaporii săi.
www.site, cu copierea integrală sau parțială a materialului, este necesară un link către sursă.









