Doymuş buhar basıncı nedir? Doymuş buhar basıncının sıcaklığa bağımlılığı. Kaynamak
Konu: Moleküler kinetik teorinin temelleri
Ders: Basınç bağımlılığı doymuş buhar sıcaklıktan. Kaynamak
Önceki derslerde, ideal gaz kavramını, içinde her şeyin bulunduğu bir model olarak tanıtmıştık. gaz yasaları ki biz okuduk. Bununla birlikte, bu, moleküler fiziğin ve özellikle moleküler-kinetik teorinin sadece bilimin incelenmesiyle sınırlı olduğu anlamına gelmez. ideal gazlar. Gerçek gazlar için elbette "moleküler-kinetik teorinin temelleri" konusundaki hesaplamalarımız geçerlidir. Ancak, gerçek gazların parametreleri arasındaki ilişkinin, ideal gazlar için bu ilişkiden biraz farklı bir forma sahip olması beklenir.
Doymuş buhar gibi gerçek bir gaz düşünün. Yalnızca varsayılan feribotun çağrıldığını hatırlayın gaz hali belirli bir madde (çoğunlukla “buhar” dedikleri zaman, tam olarak su buharı anlamına gelir). Doymuş buhar şu anlama gelir:
Tanım. doymuş buhar Sıvısıyla dinamik dengede olan bir buhar. Yani, belirli bir süre boyunca sıvıyı terk eden sıvı moleküllerinin sayısı, ortalama olarak sıvıya geri dönen buhar moleküllerinin sayısına eşittir (bkz. Şekil 1). Herhangi bir sıvı yüzeyinin üzerinde her zaman doymuş bir buhar bölgesi vardır. Daha geniş bir alan yaratmak için buhar moleküllerinin çevreye kaçması engellenmelidir (damı hava geçirmez şekilde kapatın).
Doymuş buhar ile ideal gaz arasındaki farkları anlamak için iki deney hayal etmeniz gerekir.
İlk olarak, su ile hava geçirmez şekilde kapatılmış bir kap alalım ve ısıtmaya başlayalım. Sıcaklık arttıkça, sıvı moleküller artan bir etkiye sahip olacaktır. kinetik enerji, ve artan sayıda molekül sıvıdan kaçabilecektir (bkz. Şekil 2), bu nedenle buhar konsantrasyonu ve dolayısıyla basıncı artacaktır. Yani ilk pozisyon:

Pirinç. 2. T 2 > T 1
Ancak, bu hüküm oldukça beklenen bir durumdur ve aşağıdaki kadar ilgi çekici değildir. ile bir sıvı koyarsanız doymuş buhar hareketli pistonun altında ve bu pistonu indirmeye başlayın, o zaman şüphesiz hacimdeki azalma nedeniyle doymuş buhar konsantrasyonu artacaktır. Ancak bir süre sonra buhar, fazla miktarda buharı yoğunlaştırarak sıvı ile birlikte yeni bir dinamik dengeye hareket edecek ve sonunda basınç değişmeyecektir. Doymuş buhar teorisinin ikinci konumu:
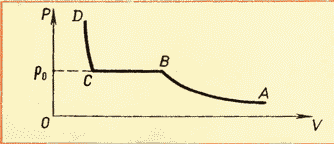
Şimdi, doymuş buhar basıncının, ideal bir gaz gibi sıcaklığa bağlı olmasına rağmen, ancak bu bağımlılığın doğasının biraz farklı olduğu belirtilmelidir. Gerçek şu ki, MKT'nin temel denkleminden bildiğimiz gibi, gaz basıncı hem sıcaklığa hem de gaz konsantrasyonuna bağlıdır. Bu nedenle, doymuş buharın basıncı, buhar konsantrasyonu artana kadar, yani tüm sıvı buharlaşana kadar sıcaklığa doğrusal olmayan bir şekilde bağlıdır. Aşağıdaki grafik (Şekil 3) doymuş buhar basıncının sıcaklığa bağımlılığının doğasını göstermektedir,

Pirinç. 3
dahası, doğrusal olmayan bir bölümden doğrusal olana geçiş, sadece tüm sıvının buharlaşma noktası anlamına gelir. Doymuş bir gazın basıncı yalnızca sıcaklığa bağlı olduğundan, belirli bir sıcaklıkta doymuş buhar basıncının ne olacağını kesin olarak belirlemek mümkündür. Bu oranlar (doymuş buhar yoğunluğunun değerlerinin yanı sıra) özel bir tabloda listelenmiştir.
Şimdi dikkatimizi önemli olana çevirelim. fiziksel süreç kaynar gibi. Sekizinci sınıfta kaynama, buharlaşmadan daha yoğun bir buharlaşma süreci olarak tanımlanıyordu. Şimdi bu kavramı biraz genişleteceğiz.
Tanım. Kaynamak- sıvının hacmi boyunca meydana gelen buharlaşma süreci. Kaynama mekanizması nedir? Gerçek şu ki, suda her zaman çözünmüş hava vardır ve sıcaklık artışının bir sonucu olarak çözünürlüğü azalır ve mikro kabarcıklar oluşur. Kabın tabanı ve duvarları tam olarak pürüzsüz olmadığından, bu kabarcıklar kabın içindeki düzensizliklere yapışır. Artık su-hava bölümü sadece suyun yüzeyinde değil, aynı zamanda su hacminin içinde de var ve su molekülleri kabarcıkların içine geçmeye başlıyor. Böylece baloncukların içinde doymuş buhar ortaya çıkar. Ayrıca bu baloncuklar, hacimce artan ve içlerine daha fazla su molekülü alarak yüzmeye başlar ve yüzeye yakın patlayarak çevreye doymuş buharı serbest bırakır (Şekil 4).
Pirinç. 4. Kaynatma işlemi ()
Bu kabarcıkların oluşumu ve yükselmesi için koşul aşağıdaki eşitsizliktir: doymuş buhar basıncı, atmosfer basıncından büyük veya ona eşit olmalıdır.
Doymuş buhar basıncı sıcaklığa bağlı olduğundan kaynama noktası basınç tarafından belirlenir. çevre: ne kadar küçükse, sıvı o kadar düşük sıcaklıkta kaynar ve bunun tersi de geçerlidir.
Bir sonraki derste, katı cisimlerin özelliklerini ele almaya başlayacağız.
bibliyografya
- Myakishev G.Ya., Sinyakov A.Z. moleküler fizik. Termodinamik. - M.: Toy kuşu, 2010.
- Gendenstein L.E., Dick Yu.I. Fizik 10. sınıf. - E.: İleksa, 2005.
- Kasyanov V.A. Fizik 10. sınıf. - M.: Toy kuşu, 2010.
- Fizik.ru ().
- Chemport.ru ().
- Narod.ru ().
Ev ödevi
- Sayfa 74: Sayı 546-550. Fizik. Görev kitabı. 10-11 derece. Rymkevich A.P. - E.: Bustard, 2013. ()
- Dağcılar neden yumurtaları irtifada kaynatamaz?
- Sıcak çayı soğutmanın bazı yolları nelerdir? Onları fizik açısından doğrulayın.
- Su kaynattıktan sonra brülördeki gaz basıncı neden düşürülmelidir?
- * Su nasıl yüz santigrat derecenin üzerinde ısıtılabilir?
Çeşitli sıcaklıklarda gerçek bir gazın izotermlerine aşinalık (bkz. Şekil 6.4), şu sonuca varmamızı sağlar: artan sıcaklıkla doygun buhar basıncının arttığını göstermektedir. Doymuş buhar basıncı hacme bağlı olmadığı için sadece sıcaklığa bağlıdır. Ancak, bağımlılık p(T), deneysel olarak bulunan, ideal bir gazda olduğu gibi orantılı değildir. sabit hacim(Charles yasası). Artan sıcaklıkla, doymuş buharın basıncı, ideal bir gazın basıncından daha hızlı artar (Şekil 6.5, eğrinin bölümü). AB). Bu, özellikle noktadan bir izokor çizersek belirginleşir. ANCAK(kesik çizgi). Bu neden oluyor?
Bir sıvı kapalı bir kapta buharla ısıtıldığında sıvının bir kısmı buhara dönüşür. Sıcaklık arttıkça buharlaşma hızı artar ve sıvı ile buhar arasındaki denge bozulur. Moleküllerin konsantrasyonu ve buna bağlı olarak buhar yoğunluğu artar. Bu, buhar yoğunluğu o kadar çok artar ki, yoğuşma süreci buharlaşma sürecini dengeleyene kadar devam eder. Sonuç olarak, formüle göre p =nkT doymuş buharın basıncı sadece sıcaklıktaki bir artıştan dolayı değil, aynı zamanda buharın moleküllerinin konsantrasyonundaki (yoğunluktaki) bir artıştan dolayı da artar. Bu durumda, doymuş buhar basıncının arttırılmasındaki ana rol, sıcaklığındaki bir artış değil, buhar moleküllerinin konsantrasyonundaki bir artış ile oynanır.
İdeal bir gazın ve doymuş buharın davranışındaki temel fark, kapalı bir kaptaki buharın sıcaklığı değiştiğinde (veya buharın hacmi sabit bir sıcaklıkta değiştiğinde), buharın kütlesinin değişmesidir. Sıvı kısmen buhara dönüşür veya tersine buhar kısmen yoğunlaşır. İTİBAREN Ideal gaz böyle bir şey olmaz.
Tüm sıvı buharlaştığında, daha fazla ısıtma üzerine buhar doymuş olmayı bırakacak ve sabit hacimdeki basıncı, Charles yasasına göre mutlak sıcaklıkla doğru orantılı olarak artacaktır (bkz. Şekil 6.5, bölüm BC).
Deneysel olarak elde edilen gerçek bir gazın izotermleri, gazın durumunu, gaz ve sıvı arasındaki dengeyi ve sıvı durumunu tanımlar. Doymuş buhar basıncının sıcaklığa bağımlılığını izlemek için kullanılabilirler.
§ 6.4. Kritik sıcaklık. Kritik durum
madde içinde olabilir sıvı hal herhangi bir sıcaklıkta değil. Bir sınır var.
Kritik sıcaklık
Yeterince yüksek sıcaklıklarda, gerçek bir gazın izoterminin yatay bölümü (bkz. Şekil 6.4) çok kısalır ve belirli bir sıcaklıkta bir noktaya dönüşür (Şekil 6.4'te - nokta İLE). Bu sıcaklığa kritik denir. Kritik sıcaklık, farklılıkların oluştuğu sıcaklıktır. fiziksel özellikler Onunla dinamik dengede olan bir sıvı ve bir buhar arasında. Her maddenin kendi kritik sıcaklığı vardır. Örneğin, karbondioksit CO2 için kritik sıcaklık t ile = 31 °С ve su için - t ile = 374 °С.
Kritik durum
Bir noktaya karşılık gelen durum İLE, izotermin yatay bölümünün bir sıcaklıkta döndüğü T = T ile , kritik durum (kritik nokta) olarak adlandırılır. Bu durumdaki basınç ve hacim kritik olarak adlandırılır. Karbondioksit için kritik basınç 7,4 106 Pa (73 atm) ve su için 2,2 107 Pa (218 atm)'dir. Kritik durumda, sıvının maksimum hacmi vardır ve doymuş buhar- maksimum basınç.
Doymuş buhar basıncının sıcaklığa bağımlılığı. Doymuş buharın durumu, ideal bir gazın (3.4) durum denklemi ile yaklaşık olarak tanımlanır ve basıncı yaklaşık olarak formül ile belirlenir.
Sıcaklık arttıkça basınç yükselir. Doymuş buhar basıncı hacme bağlı olmadığı için sadece sıcaklığa bağlıdır.
Ancak deneysel olarak bulunan bu bağımlılık, sabit hacimdeki ideal bir gazda olduğu gibi doğru orantılı değildir. Artan sıcaklıkla, doymuş buharın basıncı, ideal bir gazın basıncından daha hızlı artar (Şekil 52, AB eğrisinin bölümü).
Bu, aşağıdaki nedenden dolayı olur. Bir sıvı kapalı bir kapta buharla ısıtıldığında sıvının bir kısmı buhara dönüşür. Sonuç olarak, formül (5.1)'e göre, buhar basıncı sadece sıcaklıktaki bir artıştan dolayı değil, aynı zamanda buharın molekül konsantrasyonundaki (yoğunluktaki) bir artıştan dolayı da artar. İdeal gaz ve doymuş buharın davranışındaki temel fark, kapalı bir kaptaki buharın sıcaklığı değiştiğinde (veya hacim değiştiğinde) olmasıdır. Sabit sıcaklık) buharın kütlesi değişir. Sıvı kısmen buhara dönüşür veya tersine buhar kısmen yoğunlaşır. İdeal gazda böyle bir şey olmaz.
Tüm sıvı buharlaştığında, daha fazla ısıtıldığında buhar doygunluğu sona erecek ve sabit hacimdeki basıncı ile doğru orantılı olarak artacaktır. mutlak sıcaklık(Şekil 52'deki Bölüm BC).
Kaynamak. Doymuş buhar basıncının sıcaklığa bağımlılığı, bir sıvının kaynama noktasının neden basınca bağlı olduğunu açıklar. Kaynama sırasında, yüzeye çıkan sıvının hacmi boyunca hızla büyüyen buhar kabarcıkları oluşur. Açıkça, içindeki doymuş buharın basıncı, sıvının yüzeyindeki hava basıncının (dış basınç) ve sıvı sütununun hidrostatik basıncının toplamı olan sıvıdaki basıncı biraz aştığında, bir buhar kabarcığı büyüyebilir. .
Kaynama, kabarcıklardaki doymuş buhar basıncının sıvıdaki basınca eşit olduğu bir sıcaklıkta başlar.
Dış basınç ne kadar büyük olursa, kaynama noktası o kadar yüksek olur. Böylece buhar kazanında Pa'ya ulaşan bir basınçta su 200°C sıcaklıkta bile kaynamaz. Tıbbi kurumlarda, hermetik olarak kapatılmış kaplarda - otoklavlarda (Şek. 53) - kaynayan su da yüksek basınçta oluşur. Bu nedenle kaynama noktası 100°C'den çok daha yüksektir. Otoklavlar cerrahi aletleri, pansumanları vb. sterilize etmek için kullanılır.
Tersine, basıncı düşürerek kaynama noktasını düşürürüz. Şişeden bir pompa ile hava ve su buharını dışarı pompalayarak suyu oda sıcaklığında kaynatabilirsiniz (Şek. 54). Dağlara tırmanırken atmosfer basıncı azalır. Bu nedenle kaynama noktası düşer. yüksek


7134 m (Pamirlerde Lenin Zirvesi) basınç yaklaşık olarak Pa'ya (300 mm Hg) eşittir. Oradaki suyun kaynama noktası yaklaşık 70 °C'dir. Bu koşullar altında örneğin et pişirmek mümkün değildir.
Sıvıların kaynama noktalarındaki fark, basınçlarındaki farkla belirlenir. doymuş buharlar. Doymuş buhar basıncı ne kadar yüksek olursa, ilgili sıvının kaynama noktası o kadar düşük olur, çünkü daha düşük sıcaklıklarda doymuş buhar basıncı atmosfer basıncına eşit olur. Örneğin, 100 °C'de doymuş su buharının basıncı (760 mm Hg) ve cıva buharı sadece 117 Pa (0,88 mm Hg)'dir. Cıva normal basınçta 357°C'de kaynar.
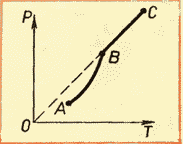
Kritik sıcaklık. Sıcaklıktaki bir artışla, aynı anda doymuş buhar basıncındaki bir artışla yoğunluğu da artar. Tersine, buharıyla dengede olan bir sıvının yoğunluğu, ısıtıldığında sıvının genleşmesi nedeniyle azalır. Bir şekilde bir sıvının yoğunluğunun ve buharının sıcaklığa bağımlılığı için eğriler çizersek, sıvı için eğri aşağı iner ve buhar için yukarı çıkar (Şekil 55).
Kritik sıcaklık olarak adlandırılan belirli bir sıcaklıkta her iki eğri birleşir, yani sıvının yoğunluğu buharın yoğunluğuna eşit olur.

Kritik sıcaklık, sıvı ile doymuş buharı arasındaki fiziksel özelliklerdeki farklılıkların ortadan kalktığı sıcaklıktır.
Kritik sıcaklıkta, doymuş buharın yoğunluğu (ve basıncı) maksimum olur ve buharla dengedeki sıvının yoğunluğu minimum olur. Özısı artan sıcaklıkla buharlaşma azalır ve kritik sıcaklıkta sıfır olur.
Her maddenin kendi kritik sıcaklığı vardır. Örneğin suyun kritik sıcaklığı, sıvı karbon monoksit (IV)






