Temel termodinamik potansiyeller. termodinamik potansiyeller
TERMODİNAMİK POTANSİYELLER- belirli bir termodinamik setinin işlevleri. tüm termodinamiği bulmanızı sağlayan parametreler. Bu parametrelerin bir fonksiyonu olarak sistem karakteristikleri. Tüm P. t. birbirine bağlıdır: herhangi biri için, parametrelerine göre farklılaşma yardımı ile diğer tüm potansiyeller bulunabilir.
P. t. yöntemi 1874 yılında J. W. Gibbs (J. W. Gibbs) tarafından geliştirilmiştir ve tüm yöntemlerin temelidir. termodinamikçok bileşenli, çok fazlı ve heterojen sistemler teorisi ve ayrıca termodinamik dahil. teori faz geçişleri. P. t.'nin varlığı 1. ve 2. ilkelerin bir sonucudur. istatistiksel fizik, bir sistem olarak maddenin yapısı kavramına dayanarak P. t.'yi hesaplamayı mümkün kılar. Büyük bir sayı etkileşen parçacıklar.
İçsel enerji
U(S, V, N) sistemin durumu ile karakterize edildiğinde bir P. t. entropi S, hacim V ve parçacık sayısı N, tek bileşenli izotropik sıvılar ve gazlar için tipiktir. sen aranan ayrıca izokorik-adyabatik. potansiyel. Tam diferansiyel sen eşittir:
Burada bağımsız değişkenler üç kapsamlıdır (orantılı) V) değerler 5, V, N, ve bağımlı olanlar onunla ilişkili yoğun (termodinamik limitte sonlu) miktarlardır - sıcaklık T, baskı yapmak r ve kimyasal potansiyelŞu koşuldan sen toplam diferansiyel ise, bağımlı değişkenler T, r, kısmi türevleri olmalıdır sen:
İkinci türev sen hacme göre adyabatik katsayısını verir. esneklik:
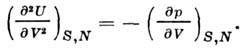
DC'de ısı kapasitesi hacim
![]()
Ancak bu, P. t'yi belirleyen tek olası bağımsız değişken seçimi değildir. Dört ayrıştırma ile seçilebilirler. Bir termal ve iki mekanik bağımsız olduğunda yollar. değerler: S, V, N; S, p, N; T, V, N; T, p, N. (1) tipinin toplam diferansiyelinde bağımsız değişkenlerden birini onun eşleniğiyle değiştirmek için, şunu yapmalıyız: Legendre dönüşümü, yani, iki eşlenik değişkenin çarpımını çıkarın.
O. entalpi elde edilebilir H(S, p, N) (Gibbs termal fonksiyonu, ısı içeriği, izokorik - bağımsız değişkenli izotermal potansiyel S, p, N):
bunu nereden takip ediyor
Bilgi H DC'deki ısı kapasitesini bulmanızı sağlar. baskı yapmak
Bedava enerji
F(T,D,N)(Helmholtz enerjisi, ısı içeriği, değişkenlerde izobarik-izotermal potansiyel T, V, N) değişkenlerin Legendre dönüşümü kullanılarak elde edilebilir. S, V, N ile T, V, N:
nerede
İkinci türevler F V p G'ye göre DC'deki ısı kapasitesini verir. izotermal hacim. katsayı baskı yapmak
ve izokorik katsayı. baskı yapmak
Son bağıntı, P. t.'nin ikinci karma türevinin türev düzeninden bağımsızlığına dayanır. Aynı yöntem ve arasındaki farkı bulmak için kullanılabilir:
ve adyabatik arasındaki oran. ve izotermal katsayı sıkıştırma:
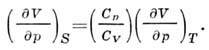
Gibbs enerjisi (izobarik - değişkenlerde izotermal potansiyel T, p, N) Legendre dönüşümü ile P. t ile ilişkilidir. U, H, F:
nerede
orantılılık G parçacık sayısı, özellikle teoride uygulamalar için çok uygun hale getirir faz geçişleri. İkinci türevler G postta ısı kapasitesi verin. baskı yapmak
![]()
ve izotermal katsayı sıkıştırma
(3), (5), (6), (8) denklemlerinden P. t. U, H, F, G bağlı:
to-çavdar bölümü oluşturmak için kullanılır. P. t. ex-perim'e göre. termal veriler. ve kalori. ur-niyah devleti. Bunun için gerekli sınır koşulları, ideal gaz sınırına geçişle verilir ve Nernst teoremi olduğunu belirleyen S=0 limit dahilinde T Ah ve öylesine U=F ve G - H.
Kapalı olmayan sistemler için, N sabit değil, değişkenlerde P. t.'yi seçmek uygundur TELEVİZYONözel bir isim almayan ve genellikle gösterilen ![]()
toplam diferansiyeli
Tüm P. t. çeşitli ile ilişkilidir Gibbs dağılımları. P.t.
büyük kanon ile ilişkilidir. İlişkiye göre Gibbs dağılımı
nerede - istatistiksel integral faz değişkenleri üzerinde ve toplam üzerinde N klasik durumda mekanik veya bölme fonksiyonuüzerinde kuantum durumları. P.t. F(T, V, N) kanonik ile ilişkilidir Gibbs Topluluğu:
nerede bir istatistik. klasik integral vaka ve istatistik miktar kuantum. P.t. H izobarik-izotermal ile ilişkilidir. S. A. Boguslavsky (1922) tarafından önerilen Gibbs Ensemble. P. t. / 7 mikrokanonik ile ilişkilidir. Entropi yoluyla Gibbs dağılımı:
nerede W(U, V, N) - istatistik. ağırlık, to-ry, mikrokanonik için bir normalleştirme faktörüdür. Gibbs dağılımı. Toplam entropi diferansiyeli
bu (1) denklemine eşdeğerdir.
istatistiksel integraller veya istatistikler. Prensipte toplamlar, klasikte Hamilton'un f-tionuna dayanarak hesaplanabilir. durum veya çok sayıda etkileşen parçacıktan oluşan bir sistem için kuantum durumunda Hamilton operatörü vb. P. t.'yi istatistiksel yöntemlerle hesaplayın. mekanik.
Listelenen P. t.'ye ek olarak, örneğin diğerleri de kullanılır. Massieux fonksiyonları - F(T, V, N)IT, Planck fonksiyonları - ![]() Genel durumda, belirli bir entropiye sahip bir sistem bir termodinamik ile tanımlandığında parametreler ve bunlarla ilişkili termodinamik parametreler. kuvvetler
Genel durumda, belirli bir entropiye sahip bir sistem bir termodinamik ile tanımlandığında parametreler ve bunlarla ilişkili termodinamik parametreler. kuvvetler ![]()

ve benzer şekilde sabit sistemler için enerji.
Polarize edilebilir ortam için, P. t. elektrik vektörlerine bağlıdır. ve magn. indüksiyon D
ve AT
. P. t. yöntemi, elektriğin tensörlerini bulmanızı sağlar. ve magn. geçirgenlik. İzotropik durumda, dielektrik geçirgenlik denklemlerden belirlenir

P. t. yönteminin kullanımı, örneğin parametreler arasında bağlantı olduğu durumlarda özellikle etkilidir. termodinamiğin koşullarını incelemek. bitişik fazlar ve ayrışmadan oluşan heterojen bir sistemin dengesi. bileşen. Bu durumda, dış etkenleri ihmal etmek mümkünse kuvvetler ve yüzey olayları, bkz. her fazın enerjisi ![]() bileşenin parçacık sayısı nerede i fazda k. Bu nedenle, her bir aşama için
bileşenin parçacık sayısı nerede i fazda k. Bu nedenle, her bir aşama için
(- fazdaki i bileşeninin kimyasal potansiyeli k). P.t. sen her bileşenin toplam parçacık sayısı, her fazın toplam entropisi ve hacminin sabit kalması koşuluyla minimumdur.
Yöntem P. t., termodinamiğin kararlılığını keşfetmenizi sağlar. Sistemin termodinamiğindeki küçük değişimlere göre dengesi. parametreler. Denge, maks. bağımsız termodinamik deneysel koşullara karşılık gelen entropinin değeri veya P. t.'nin minimumu (iç enerji, entalpi, serbest enerji, Gibbs enerjisi). değişkenler.
Yani, bağımsız ile S, V, N denge için minimum int olması gerekir. enerji, yani değişkenlerde küçük değişiklikler ve sabitlik ile S, V, N. Bu nedenle, denge için gerekli bir koşul olarak, tüm fazların basınç ve sıcaklığının sabitliği ve kimyasalın eşitliği. Bir arada var olan fazların potansiyelleri. Ancak termodinamik için sürdürülebilirlik yeterli değildir. P. t.'nin minimallik koşulundan ikinci varyasyonun pozitifliği gelir: > 0. Bu, termodinamik koşullarına yol açar. sürdürülebilirlik, örn. DC'de artan hacim ve pozitif ısı kapasitesi ile basınçta bir azalmaya. Ses. P. t. yöntemi, çok fazlı ve çok bileşenli sistemler kurmanıza izin verir. Gibbs faz kuralı Buna göre, dengede bir arada bulunan fazların sayısı, bağımsız bileşenlerin sayısını ikiden fazla aşmaz. Bu kural, bağımsız parametrelerin sayısının, faz dengesinde belirlenmeleri için denklem sayısını geçemeyeceği gerçeğinden kaynaklanmaktadır.
Bir termodinamik oluşturmak için dikkate alan teoriler yüzey olayları, P. t.'nin varyasyonlarında, temas eden fazların yüzeyindeki varyasyonlarla orantılı terimler dikkate alınmalıdır. Bu terimler orantılı yüzey gerilimi s, mantıklı değişkenler. P. t.'nin herhangi birinin yüzeye göre türevi.
P. yöntemi, sürekli uzamsal olarak homojen olmayan ortamlara da uygulanabilir. Bu durumda, P. t. termodinamiğin fonksiyonelleridir. değişkenler ve termodinamik. eşitlikler, fonksiyonel türevlerde denklem şeklini alır.
Aydınlatılmış.: Vaals I.D. you der, Konstamm F., Termostatik kursu, bölüm 1. Genel termostatik, çev. Almancadan., M., 1936; Munster A., Kimyasal termodinamik, çev. Almanca'dan., M., 1971; Gibbs J. B., Termodinamik. İstatistiksel mekanik, çev. English, M., 1982'den; Novikov I.I., Termodinamik, M., 1984. D.N. Zubarev.
Termodinamikteki tüm hesaplamalar, termodinamik potansiyeller adı verilen durum fonksiyonlarının kullanımına dayanmaktadır. Her bağımsız parametre seti kendi termodinamik potansiyeline sahiptir. Herhangi bir işlem sırasında meydana gelen potansiyel değişiklikleri, sistol tarafından yapılan işi veya sistem tarafından alınan ısıyı belirler.
Termodinamik potansiyeller göz önüne alındığında, (103.22) bağıntısını kullanacağız ve bunu formda sunacağız.
Eşit işareti tersine çevrilebilir süreçleri, eşitsizlik işareti - geri döndürülemez süreçleri ifade eder.
Termodinamik potansiyeller durum fonksiyonlarıdır. Bu nedenle, potansiyellerden herhangi birinin artışı, ifade edildiği fonksiyonun toplam diferansiyeline eşittir. Değişkenlerin ve y fonksiyonunun toplam diferansiyeli, ifade ile belirlenir.
![]()
Bu nedenle, dönüşümler sırasında belirli bir değer artışı için formun bir ifadesini elde edersek
bu niceliğin parametrelerin bir fonksiyonu olduğu ve fonksiyonların fonksiyonun kısmi türevleri olduğu iddia edilebilir.
İçsel enerji. Termodinamik potansiyellerden birine zaten aşinayız. Bu sistemin iç enerjisidir. Tersinir bir süreç için ilk yasa ifadesi şu şekilde temsil edilebilir:
![]() (109.4)
(109.4)
(109.2) ile karşılaştırma, S ve V değişkenlerinin potansiyel V için sözde doğal değişkenler olarak hareket ettiğini gösterir. (109.3)'den şu sonuç çıkar:
![]()
Bu durumda - vücut ısı alışverişi yapmadığında ilişkiden çıkar. dış ortam, yaptığı iş eşittir
![]()
veya integral formda:
Böylece dış ortam ile ısı alışverişi olmadığında yapılan iş, vücudun iç enerjisindeki azalmaya eşittir.
anda, sabit hacim
Bu nedenle, - sabit hacimdeki ısı kapasitesi eşittir
![]() (109.8)
(109.8)
Bedava enerji. (109.4)'e göre, tersinir ile ısı tarafından üretilen iş izotermal süreç, olarak temsil edilebilir
durum işlevi
![]() (109.10)
(109.10)
vücudun serbest enerjisi denir.
Tersinir bir izotermal süreçte "(109.9) ve (109.10) formüllerine göre, iş vücudun serbest enerjisindeki azalmaya eşittir:
![]()
Formül (109.6) ile yapılan karşılaştırma, izotermal süreçlerde serbest enerjinin, adyabatik süreçlerde iç enerji ile aynı rolü oynadığını göstermektedir.
Formülün (109.6) hem tersinir hem de tersinmez süreçler için geçerli olduğunu unutmayın. Formül (109.12) sadece tersinir süreçler için geçerlidir. Geri dönüşü olmayan süreçlerle (bkz.). Bu eşitsizliği bağıntıya koyarak, tersinmez izotermal süreçler için bunu elde etmek kolaydır.
Bu nedenle, serbest enerji kaybı, sistemin izotermal bir süreçte yapabileceği iş miktarının üst sınırını belirler.
(109.10) fonksiyonunun diferansiyelini alalım. (109.4) dikkate alındığında şunları elde ederiz:
(109.2) ile yapılan karşılaştırmadan, serbest enerji için doğal değişkenlerin T ve V olduğu sonucuna varıyoruz. (109.3)'e göre
(109.1) dQ'da şunu değiştirelim ve elde edilen ilişkiyi ( - zaman) ile bölelim. Sonuç olarak, alıyoruz
![]()
Sıcaklık ve hacim sabit kalırsa, bağıntı (109.16) forma dönüştürülebilir.
Bu formülden, sabit sıcaklık ve hacimde meydana gelen geri dönüşü olmayan bir sürece, vücudun serbest enerjisinde bir azalma eşlik eder. Dengeye ulaşıldığında, F zamanla değişmeyi bırakır. Böylece; sabit T ve V'de denge durumu, serbest enerjinin minimum olduğu durumdur.
Entalpi. İşlem “sabit basınçta gerçekleşirse, vücut tarafından alınan ısı miktarı aşağıdaki gibi gösterilebilir:
durum işlevi
![]()
entalpi veya ısı fonksiyonu denir.
(109.18) ve (109.19)'dan, izobatik işlem sırasında vücut tarafından alınan ısı miktarının eşit olduğu sonucu çıkar.
veya integral formda
![]()
Dolayısıyla basıncın sabit kalması durumunda cismin aldığı ısı miktarı entalpi artışına eşittir. (109.19) ifadesinin (109.4)'e göre farklılaştırılması şunu verir:
Buradan sonuca varıyoruz. entalpi, değişkenlerdeki termodinamik potansiyeldir.Kısmi türevleri
![]()
Sıcaklık ve basınç sabit kalırsa, bağıntı (109.16) şu şekilde yazılabilir:
Bu formülden, sabit sıcaklık ve basınçta meydana gelen tersinmez bir sürece termodinamik Gibbs potansiyelinde bir azalmanın eşlik ettiği sonucu çıkar. Dengeye ulaşıldığında, G zamanla değişmeyi bırakır. Böylece, sabit T'de ve denge durumu, termodinamik Gibbs potansiyelinin minimum olduğu durumdur (bkz. (109.17)).
Masada. 109.1, termodinamik potansiyellerin temel özelliklerini gösterir.
Tablo 109.1

Konuyla ilgili ders: “Termodinamik potansiyeller”
1. Enerji boyutuna sahip “E F G H” potansiyelleri grubu.
2. Termodinamik potansiyellerin parçacık sayısına bağımlılığı. Termodinamik potansiyel olarak entropi.
3. Çok bileşenli sistemlerin termodinamik potansiyelleri.
4. Termodinamik potansiyeller yönteminin pratik uygulaması (kimyasal denge sorunu örneğinde).
Modern termodinamiğin ana yöntemlerinden biri termodinamik potansiyeller yöntemidir. Bu yöntem, büyük ölçüde, değişiminin yapılan işle ilişkilendirildiği ve potansiyelin kendisinin bir termodinamik sistemin bir enerji özelliği olduğu klasik mekanikte potansiyellerin kullanılması nedeniyle ortaya çıktı. Tarihsel olarak, başlangıçta tanıtılan termodinamik potansiyeller, isimlerini belirleyen enerji boyutuna da sahipti.
Bahsedilen grup aşağıdaki sistemleri içerir:
İçsel enerji;
Serbest enerji veya Helmholtz potansiyeli;
Gibbs termodinamik potansiyeli;
Entalpi.
İç enerjinin potansiyeli bir önceki konuda gösterilmişti. Kalan miktarların potansiyelini ifade eder.
Termodinamik potansiyellerin diferansiyelleri şu şekildedir:
(3.1) bağıntılarından, karşılık gelen termodinamik potansiyellerin aynı termodinamik sistemi farklı yöntemlerle karakterize ettiği görülebilir. açıklamalar (bir termodinamik sistemin durumunu ayarlama yöntemleri). Yani, adyabatik olarak yalıtılmış sistem, değişkenlerde açıklanan, iç enerjiyi bir termodinamik potansiyel olarak kullanmak uygundur.Daha sonra, potansiyellere termodinamik olarak eşlenik olan sistemin parametreleri, ilişkilerden belirlenir:
Tanımlama yöntemi olarak değişkenler tarafından verilen bir "termostat içindeki sistem" kullanılıyorsa, potansiyel olarak serbest enerjiyi kullanmak en uygunudur. Buna göre, elde ettiğimiz sistem parametreleri için:
Daha sonra, onu tanımlamanın bir yolu olarak “piston altındaki sistem” modelini seçeceğiz. Bu durumlarda durum fonksiyonları bir set () oluşturur ve termodinamik potansiyel olarak Gibbs potansiyeli G kullanılır.Daha sonra sistem parametreleri aşağıdaki ifadelerden belirlenir:
Ve bir "piston üzerinde adyabatik sistem" durumunda, fonksiyonlar tarafından verilen durumda, termodinamik potansiyelin rolü entalpi H tarafından oynanır. Daha sonra sistem parametreleri şu şekli alır:
(3.1) ilişkileri tanımladığından toplam diferansiyeller termodinamik potansiyeller, ikinci türevlerini eşitleyebiliriz.
Örneğin, verilen
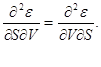
alırız
Benzer şekilde, termodinamik potansiyel ile ilgili sistemin kalan parametreleri için şunu yazıyoruz:
Karşılık gelen termodinamik fonksiyonların potansiyeline dayalı olarak sistemin termodinamik durumunun diğer parametre kümeleri için de benzer kimlikler yazılabilir.
Bu nedenle, potansiyeli olan bir “termostattaki sistem” için elimizde:
Gibbs potansiyeline sahip “piston üstü” sistem için eşitlikler geçerli olacaktır:
Ve son olarak, H potansiyeline sahip adyabatik pistonlu bir sistem için şunu elde ederiz:
(3.6) - (3.9) biçimindeki eşitliklere termodinamik özdeşlikler denir ve bazı durumlarda pratik hesaplamalar için uygun oldukları ortaya çıkar.
Termodinamik potansiyellerin kullanılması, sistemin işleyişini ve termal etkiyi belirlemeyi oldukça kolaylaştırır.
Böylece, (3.1) bağıntıları şunları ima eder:
Eşitliğin ilk bölümünden itibaren, iç enerjisindeki azalma nedeniyle termal olarak yalıtılmış bir sistemin () çalışmasının yapıldığı iyi bilinen konumu izler. İkinci eşitlik, serbest enerjinin, izotermal süreçte tamamen işe dönüştürülen iç enerjinin kısmı olduğu anlamına gelir (sırasıyla, iç enerjinin "kalan" kısmına bazen bağlı enerji denir).
Isı miktarı şu şekilde temsil edilebilir:
Son eşitlikten entalpinin neden ısı içeriği olarak da adlandırıldığı açıktır. Yanarken ve diğerleri kimyasal reaksiyonlar sabit basınçta () meydana geldiğinde, açığa çıkan ısı miktarı entalpideki değişime eşittir.
Termodinamiğin ikinci yasasını (2.7) hesaba katan (3.11) ifadesi, ısı kapasitesini belirlememizi sağlar:
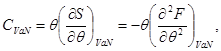

Enerji türünün tüm termodinamik potansiyelleri toplamsallık özelliğine sahiptir. Bu nedenle şunları yazabiliriz:
Gibbs potansiyelinin yalnızca bir katkı parametresi içerdiğini görmek kolaydır, yani. Gibbs'in özgül potansiyeli bağlı değildir. Daha sonra (3.4)'den şu sonuç çıkar:
Yani, kimyasal potansiyel spesifik Gibbs potansiyelidir ve eşitlik gerçekleşir.
Termodinamik potansiyeller (3.1), bir potansiyelden diğerine geçişi mümkün kılan doğrudan ilişkilerle birbirine bağlıdır. Örneğin, tüm termodinamik potansiyelleri iç enerji cinsinden ifade edelim.
Bunu yaparken, tüm termodinamik potansiyelleri () fonksiyonu olarak elde ettik. Bunları diğer değişkenlerde ifade etmek için yeniden prosedürünü kullanın.
Değişkenlerde basınç verilsin ():
Son ifadeyi bir durum denklemi olarak yazalım, yani. formu bul
Durum () değişkenlerinde verilirse, termodinamik potansiyelin iç enerji olduğunu görmek kolaydır.(3.2) sayesinde, buluruz
(3.18) S için bir denklem olarak ele alındığında, çözümünü buluruz:
(3.19)'u (3.17) yerine koyarsak şunu elde ederiz:
Yani değişkenlerden () değişkenlere () geçtik.
Termodinamik potansiyellerin ikinci grubu, yukarıda ele alınanlara ek olarak, kimyasal potansiyel termodinamik değişkenler olarak dahil edildiğinde ortaya çıkar. İkinci grubun potansiyelleri de enerji boyutuna sahiptir ve ilişkiler yoluyla birinci grubun potansiyelleriyle ilişkilendirilebilir:
Buna göre potansiyel diferansiyeller (3.21) şu şekildedir:
Birinci grubun termodinamik potansiyellerinin yanı sıra, potansiyeller (3.21) için termodinamik kimlikler oluşturulabilir, bir termodinamik sistemin parametreleri için ifadeler bulunabilir, vb.
Grubun diğer potansiyelleri arasında (3.22) yarı serbest enerjiyi ifade eden ve pratikte en sık kullanılan “omega potansiyeli”nin karakteristik ilişkilerini ele alalım.
Potansiyel, sanal duvarlarla termodinamik sistemi tanımlayan değişkenlerde () verilir. Bu durumda sistem parametreleri ilişkilerden belirlenir:
Potansiyelden gelen termodinamik kimlikler şu şekildedir:
İkinci grubun termodinamik potansiyellerinin toplamsal özellikleri oldukça ilginçtir. Bu durumda partikül sayısı sistemin parametreleri arasında olmadığı için hacim toplamsal parametre olarak kullanılır. Sonra elde ettiğimiz potansiyel için:
Burada - 1'e göre spesifik potansiyel (3.23) dikkate alındığında şunları elde ederiz:
Buna göre, (3.26)
(3.26)'nın geçerliliği, (3.15) temelinde de kanıtlanabilir:
Potansiyel, formda yazılan termodinamik fonksiyonları forma dönüştürmek için de kullanılabilir. Bunun için N için bağıntı (3.23):
aşağıdakilerle ilgili izin verilir:
Sadece sistemin enerji karakteristikleri değil, aynı zamanda (3.1) bağıntısında yer alan diğer nicelikler de termodinamik potansiyeller olarak hareket edebilir. Önemli bir örnek olarak, entropiyi bir termodinamik potansiyel olarak düşünün. Entropi için ilk diferansiyel bağıntı, termodinamiğin I ve II ilkelerinin genelleştirilmiş gösteriminden çıkar:
Dolayısıyla entropi, parametrelerle verilen bir sistem için termodinamik potansiyeldir. Diğer sistem parametreleri şöyle görünür:
İlki (3.28) çözülerek, değişkenlerden değişkenlere geçiş nispeten mümkündür.
Entropinin toplamsal özellikleri bilinen ilişkilere yol açar:
Bir termodinamik sistemin verilen makroskopik durumları temelinde termodinamik potansiyellerin belirlenmesine geçelim. Hesaplamaları basitleştirmek için harici alanların () olmadığını varsayıyoruz. Bu, sonuçların genelliğini azaltmaz, çünkü ek sistemler basitçe sonuç ifadelerinde görünür.
Örnek olarak, hal denklemini, kalorik hal denklemini ve sistemin davranışını başlangıç olarak kullanarak serbest enerji için ifadeler bulalım. (3.3) ve (3.12)'yi dikkate alarak şunları buluruz:
Sistemin ikinci denklemini (3.30) aşağıdaki sınır koşulunu dikkate alarak entegre edelim:
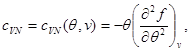
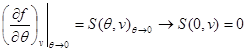

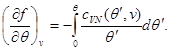
Daha sonra sistem (3.30) şu şekli alır:
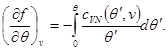
(3.31) sisteminin çözümü, formdaki özgül serbest enerjiyi bulmayı mümkün kılar.
Spesifik serbest enerjinin kaynağı, aşağıdaki koşullardan da bulunabilir:
Sonra (3.32) şu şekli alır:
ve bir katkı sabitine kadar sistemin tüm serbest enerjisinin ifadesi şu şekildedir:
Daha sonra sistemin harici bir alanın dahil edilmesine tepkisi, durum değişkenleri kümesine bağlı olarak aşağıdaki forma sahip olan ek bir durum denklemi ile verilir:
Daha sonra sıfırdan sıfıra dahil edilmesiyle ilişkili ilgili termodinamik potansiyeldeki değişiklik ifadelerden belirlenir:
Bu nedenle, makroskopik teoride termodinamik potansiyelin belirlenmesi, yalnızca kullanım temelinde mümkündür. verilen denklemler termodinamik potansiyellerin ayarlanması temelinde elde edilen termodinamik durumlar. Bunu kırmak" kısır döngü” yalnızca sistemin durumunun istatistiksel özellikler dikkate alınarak dağıtım fonksiyonları temelinde verildiği mikroskobik teori temelinde mümkündür.
Elde edilen sonuçları çok bileşenli sistemler için genelleştirelim. Bu genelleme, parametrenin bir küme ile değiştirilmesiyle gerçekleştirilir. Belirli örneklere bir göz atalım.
varsayalım ki termodinamik durum sistem parametrelerle verilir, yani. Birkaç bileşenden oluşan bir termostattaki bir sistemi ele alıyoruz, bu tanımda termodinamik potansiyel olan serbest enerjiye eşit olan parçacıkların sayısı şu şekildedir:
(3.37)'deki katkı parametresi parçacıkların sayısı değil, V sisteminin hacmidir. Daha sonra sistemin yoğunluğu ile gösterilir. İşlev, toplamsal olmayan bağımsız değişkenlerin toplamsal olmayan bir işlevidir. Bu oldukça uygundur, çünkü sistem parçalara ayrıldığında, işlev her parça için değişmez.
Ardından termodinamik sistemin parametreleri için şunu yazabiliriz:
sahip olduğumuz düşünüldüğünde
Tek bir bileşenin kimyasal potansiyeli için şunu yazıyoruz:
Serbest enerjinin katkı özelliklerini hesaba katmanın başka yolları da vardır. Bileşenlerin her birinin parçacık sayısının göreli yoğunluklarını tanıtalım:

sistemin hacminden bağımsız V. Burada - toplam sayısı Sistemdeki parçacıklar. O zamanlar
Bu durumda kimyasal potansiyelin ifadesi daha karmaşık bir biçim alır:
ve türevlerini hesaplayın ve bunları son ifadede değiştirin:
Aksine, baskı ifadesi basitleştirilecektir:
Gibbs potansiyeli için de benzer ilişkiler elde edilebilir. Yani, hacim toplamsal bir parametre olarak verilirse, (3.37) ve (3.38) dikkate alınarak şunu yazarız:
aynı ifade (3.yu)'dan da elde edilebilir, ki bu birçok parçacık durumunda şu şekli alır:
(3.39) ifadesini (3.45) ile değiştirerek şunu buluruz:
(3.44) ile tamamen örtüşmektedir.
Geleneksel Gibbs potansiyel kaydına geçmek için (durum değişkenleri () aracılığıyla) denklemini (3.38) çözmek gerekir:
V hacmi ile ilgili olarak ve sonucu (3.44) veya (3.45) ile değiştirin:
N sistemindeki toplam parçacık sayısı toplamsal bir parametre olarak verilirse, Gibbs potansiyeli (3.42) dikkate alındığında aşağıdaki formu alır:
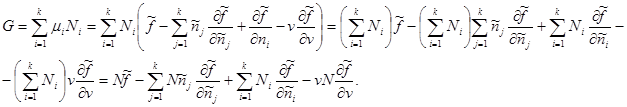
Belirli değerlerin türünü bilerek: , şunu elde ederiz:
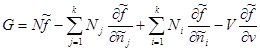
Son ifadede, toplama bitti jüzerinde toplama ile değiştirin i. Sonra ikinci ve üçüncü terimlerin toplamı sıfır olur. Sonra Gibbs potansiyeli için sonunda şunu elde ederiz:
Aynı bağıntı başka bir yolla da elde edilebilir ((3.41) ve (3.43)'ten):
Daha sonra elde ettiğimiz bileşenlerin her birinin kimyasal potansiyeli için:
(3.48)'ün türetilmesinde, (3.42)'nin türetilmesinde kullanılanlara benzer dönüşümler hayali duvarlar kullanılarak gerçekleştirilmiştir. Sistem durumu parametreleri bir küme () oluşturur.
Termodinamik potansiyelin rolü, şu şekli alan potansiyel tarafından oynanır:
(3.49)'dan görülebileceği gibi, bu durumda tek toplamsal parametre sistem V'nin hacmidir.
Böyle bir sistemin bazı termodinamik parametrelerini belirleyelim. Bu durumda parçacıkların sayısı şu ilişkiden belirlenir:
Bedava enerji için F ve Gibbs potansiyeli G yazılabilir:
Bu nedenle, çok bileşenli sistemler durumunda termodinamik potansiyeller ve parametreler için ilişkiler, yalnızca her bileşenin partikül sayısını (veya kimyasal potansiyellerini) hesaba katma ihtiyacı nedeniyle değiştirilir. Aynı zamanda, termodinamik potansiyeller yöntemi ve buna dayalı hesaplamalar fikri değişmeden kalır.
Termodinamik potansiyeller yöntemini kullanmanın bir örneği olarak, kimyasal denge problemini düşünün. Tepkimeye giren üç maddenin karışımında kimyasal denge koşullarını bulalım. Ek olarak, ilk reaksiyon ürünlerinin seyrekleştirilmiş gazlar olduğunu varsayıyoruz (bu, moleküller arası karşılıklı üretimi göz ardı etmemize izin veriyor) ve sistem şu şekilde devam ediyor: Sabit sıcaklık ve basınç, (böyle bir işlem pratikte uygulanması en kolay olanıdır, bu nedenle endüstriyel tesislerde kimyasal bir reaksiyon için basınç ve sıcaklık sabitliği koşulu yaratılır).
Bir termodinamik sistemin denge durumu, tanımlanma şekline bağlı olarak, sistemin maksimum entropisi veya sistemin minimum enerjisi tarafından belirlenir (daha fazla ayrıntı için, bkz. Bazarov Termodinamiği). Daha sonra sistem için aşağıdaki denge koşullarını elde edebiliriz:
1. Adyabatik olarak izole edilmiş bir termodinamik sistemin, () parametreleri tarafından verilen denge durumu, bir entropi maksimumu ile karakterize edilir:
(3.53a)'daki ikinci ifade, denge durumunun kararlılığını karakterize eder.
2. Parametreler () tarafından verilen bir izokorik-izotermal sistemin denge durumu, minimum serbest enerji ile karakterize edilir. Bu durumda denge koşulu şu şekildedir:
3. Parametreler () tarafından verilen izobarik-izotermal sistemin dengesi, koşullarla karakterize edilir:
4. Değişken sayıda partikül içeren bir termostatta, parametrelerle () tanımlanan bir sistem için, denge koşulları potansiyel minimumlarla karakterize edilir:
Bizim durumumuzda kimyasal dengenin kullanımına dönelim.
Genel durumda, bir kimyasal reaksiyonun denklemi şu şekilde yazılır:
İşte semboller kimyasal maddeler, - sözde stokiyometrik sayılar. yani tepki için
Basınç ve sıcaklık sistemin parametreleri olarak seçildiğinden sabit olduğu varsayılır. Gibbs potansiyelini termodinamik potansiyelin bir durumu olarak düşünmek uygundur. G. O zaman sistem için denge koşulu, potansiyelin sabitliği şartından oluşacaktır. G:
Üç bileşenli bir sistem düşündüğümüz için, Ek olarak, (3.54)'ü dikkate alarak parçacık sayısı () için denge denklemini yazabiliriz:
Bileşenlerin her biri için kimyasal potansiyelleri tanıtarak: ve yapılan varsayımları dikkate alarak şunları buluruz:
Denklem (3.57) ilk olarak 1876'da Gibbs tarafından elde edildi. ve istenen kimyasal denge denklemidir. (3.57) ve (3.54)'ü karşılaştırarak, kimyasal denge denkleminin kimyasal reaksiyon denkleminden, basitçe reaksiyona giren maddelerin sembollerini kimyasal potansiyelleriyle değiştirerek elde edildiğini görmek kolaydır. Bu teknik, keyfi bir reaksiyon için kimyasal denge denklemi yazılırken de kullanılabilir.
Genel durumda, (3.57) denkleminin çözümü, üç bileşen için bile yeterince yüklenmiştir. Bunun nedeni, ilk olarak, tek bileşenli bir sistem için bile kimyasal potansiyel için açık ifadeler elde etmenin çok zor olmasıdır. İkincisi, bağıl konsantrasyonlar ve küçük miktarlar değildir. Yani üzerlerinde seri genişletme yapmak imkansızdır. Bu, kimyasal denge denklemini çözme problemini daha da karmaşık hale getirir.
Fiziksel olarak belirtilen zorluklar, yeniden yapılanmanın dikkate alınması gerekliliği ile açıklanmaktadır. elektron kabukları reaksiyona giren atomlardır. Bu, makroskopik yaklaşımı da etkileyen mikroskobik tanımlamada belirli zorluklara yol açar.
Kendimizi gaz seyreltme çalışmasıyla sınırlamaya karar verdiğimiz için, modeli kullanabiliriz. Ideal gaz. Reaksiyona giren tüm bileşenlerin, toplam hacmi dolduran ve basınç oluşturan ideal gazlar olduğunu varsayıyoruz. p. Bu durumda, gaz karışımının bileşenleri arasındaki herhangi bir etkileşim (kimyasal reaksiyonlar hariç) ihmal edilebilir. Bu, kimyasal potansiyelin olduğunu varsaymamızı sağlar. i-th bileşeni yalnızca aynı bileşenin parametrelerine bağlıdır.
Burada - kısmi basıncı i-th bileşeni ve:
(3.58) dikkate alındığında, üç bileşenli sistem (3.57) için denge koşulu şu şekli alır:
Daha fazla analiz için, formda yazdığımız ideal bir gazın durum denklemini kullanırız:
Burada, daha önce olduğu gibi, termodinamik sıcaklığı ifade ediyoruz. Daha sonra okuldan bilinen kayıt (3.60)'da yazılan : , şeklini alır.
Sonra karışımın her bir bileşeni için şunu elde ederiz:
İdeal bir gazın kimyasal potansiyelinin ifadesinin biçimini belirleyelim. (2.22)'den aşağıdaki gibi, kimyasal potansiyel şu şekildedir:
Formda yazılabilen (3.60) denklemi dikkate alındığında, kimyasal potansiyelin belirlenmesi sorunu, özgül entropi ve özgül iç enerjinin belirlenmesine indirgenir.
Spesifik entropi için denklem sistemi, termodinamik kimliklerden (3.8) ve ısı kapasitesi ifadesinden (3.12) gelir:
Durum denklemini (3.60) dikkate alarak ve belirli özelliklere geçiş yaparak şunları elde ederiz:
Çözüm (3.63) şu şekildedir:
İdeal bir gazın özgül iç enerjisi için denklem sistemi (2.23)'ten aşağıdaki gibidir:
Bu sistemin çözümü şu şekilde yazılabilir:
(3.64) - (3.65)'i (3.66) yerine koyarsak ve ideal gazın hal denklemini hesaba katarsak, şunu elde ederiz:
İdeal gazların bir karışımı için (3.66) ifadesi şu şekli alır:
(3.67)'yi (3.59) ile değiştirirsek:
Dönüşümleri gerçekleştirerek şunu yazıyoruz:

Son ifadede güçlendirme yaparak, elimizde:
(3.68) bağıntısına kütle hareketi yasası denir. Değer yalnızca sıcaklığın bir fonksiyonudur ve kimyasal reaksiyonun bileşeni olarak adlandırılır.
Böylece, bir kimyasal reaksiyonun kimyasal dengesi ve yönü, basınç ve sıcaklığın büyüklüğü ile belirlenir.
Termodinamik potansiyeller, Schuka, s.36
Termodinamik potansiyeller, Schuka, s.36
Yalıtılmış sistemler için bu ilişki, entropinin asla azalmayacağı klasik formülasyona eşdeğerdir. Bu sonuç, Nobel ödüllü I. R. Prigozhy tarafından yapılmıştır. açık sistemler. ilkesini de ileri sürmüştür. dengesizlik bir düzen kaynağı olarak hizmet edebilir.
Üçüncü başlangıç termodinamik, mutlak sıfıra yakın bir sistemin durumunu tanımlar. Termodinamiğin üçüncü yasasına göre entropi referans noktasını belirler ve herhangi bir sistem için sabitler. saat T 0, termal genleşme katsayısını, herhangi bir işlemin ısı kapasitesini ortadan kaldırır. Bu, şu sonuca varmamızı sağlar: tamamen sıfır sıcaklıkta, durumdaki herhangi bir değişiklik, entropide bir değişiklik olmadan gerçekleşir. Bu ifadeye Nobel ödüllü V. G. Nernst'in teoremi veya termodinamiğin üçüncü yasası denir.
Termodinamiğin üçüncü yasası diyor ki :
mutlak sıfır temelde ulaşılamaz çünkü T = 0 ve S = 0.
Sıfıra eşit bir sıcaklığa sahip bir cisim olsaydı, o zaman termodinamiğin ikinci yasasıyla çelişen ikinci türden bir sürekli hareket makinesi yapmak mümkün olurdu.
Sistemdeki kimyasal dengeyi hesaplamak için termodinamiğin üçüncü yasasının değiştirilmesi Nobel ödüllü M. Planck tarafından bu şekilde formüle edilmiştir.
Planck'ın varsayımı : mutlak sıfır sıcaklığında, entropi değeri alır S 0 , basınçtan, kümelenme durumundan ve maddenin diğer özelliklerinden bağımsızdır. Bu değer sıfıra ayarlanabilir veyaS 0 = 0.
İstatistiksel teoriye göre, entropi değeri şu şekilde ifade edilir: S = ln, nerede Boltzmann sabitidir, – makro durumların istatistiksel ağırlığı veya termodinamik olasılığı. -potansiyel olarak da adlandırılır. İstatistiksel ağırlık altında, belirli bir makro durumun gerçekleştirildiği mikro durumların sayısını kastediyoruz. İdeal bir kristalin entropisi T = 0 K, 'ye tabi = 1 veya makro durumun tek bir mikro durum tarafından gerçekleştirilebildiği durumda, sıfıra eşittir. Diğer tüm durumlarda, mutlak sıfırdaki entropinin değeri sıfırdan büyük olmalıdır.
3.3. termodinamik potansiyeller
Termodinamik potansiyeller, sistemin tüm termodinamik özelliklerini aynı parametrelerin bir fonksiyonu olarak bulmanızı sağlayan belirli termodinamik parametre setlerinin fonksiyonlarıdır..
Termodinamik potansiyeller, sistemin termodinamik durumunu tamamen belirler ve herhangi bir sistem parametresi, farklılaşma ve entegrasyon yoluyla hesaplanabilir.
Ana termodinamik potansiyeller aşağıdaki işlevleri içerir: .
1. İç enerji sen, bağımsız değişkenlerin bir fonksiyonudur:
entropi S,
Ses V,
parçacık sayısı N,
genelleştirilmiş koordinatlar x i
veya sen = sen(S, V, N, x i).
2. Helmholtz serbest enerjisi F sıcaklığın bir fonksiyonudur T, Ses V, parçacık sayısı N, genelleştirilmiş koordinat x i böyle F = F(T, V, N, x t).
3. Gibbs termodinamik potansiyeli G = G(T, p, N, x i).
4. Entalpi H =H(S, P, N, x i).
5. Bağımsız değişkenleri sıcaklık olan termodinamik potansiyel T, Ses V, kimyasal potansiyel x, = (T, V, N, x i).
Termodinamik potansiyeller arasında klasik ilişkiler vardır:
sen = F + TS = H – PV,
F = sen – TS = H – TS – PV,
H = sen + PV = F + TS + PV,
G = sen – TS + PV = F + PV = H – TS,
= sen – TS – V = F – N = H – TS – N, (3.12)
sen = G + TS – PV = + TS + N,
F = G – PV = + N,
H = G + TS = + TS + N,
G = + PV + N,
= G – PV – N.
Termodinamik potansiyellerin varlığı, termodinamiğin birinci ve ikinci yasalarının bir sonucudur ve sistemin iç enerjisinin sen sadece sistemin durumuna bağlıdır. Sistemin iç enerjisi, tüm makroskopik parametrelere bağlıdır, ancak bu duruma nasıl ulaşıldığına bağlı değildir. İç enerjiyi diferansiyel biçimde yazıyoruz
dU = TdS– PdV– X i dx i + dN,
T = ( sen/ S) V, N, x= sabit ,
P = –( sen/ V) S, N, x= sabit ,
= ( sen/ N) S, N, x= konst.
Benzer şekilde, biri yazabilir
dF = – SDG–PdV – X t dx t + dN,
dH= TdS+VdP– X t dx t + dN,
dG= – SDT+VdP – X i dx i + dN,
d = – SDG–PdV – X t dx t – Ndn,
S = – ( F/ T) V ; P = –( F/ V) T ; T = ( sen/ S) V ; V = ( sen/ P) T ;
S = – ( G/ T) P ; V = ( G/ P) S ; T = ( H/ S;); P = – ( sen/ V) S
S = – ( F/ T); N = – ( F/); = ( F/ N); X = – ( sen/ x).
Bu denklemler denge süreçleri için geçerlidir. Termodinamik izobarik-izotermal potansiyele dikkat edelim. G, aranan Gibbs serbest enerjisi,
G = sen – TS + PV = H –TS, (3.13)
ve izokorik-izotermal potansiyel
F = sen – TS, (3.14)
buna Helmholtz serbest enerjisi denir.
Sabit basınç ve sıcaklıkta meydana gelen kimyasal reaksiyonlarda,
G = sen – TS + PV = N, (3.15)
nerede kimyasal potansiyeldir.
Sistemin bazı bileşenlerinin kimyasal potansiyeli altında i diğer termodinamik değişkenlerin sabit değerlerinde bu bileşenin miktarına göre termodinamik potansiyellerin herhangi birinin kısmi türevini anlayacağız.
Kimyasal potansiyel bir maddenin bir parçacığı eklendiğinde sistemin enerjisindeki değişimi belirleyen bir miktar olarak da tanımlanabilir, örneğin,
i = ( sen/ N) S , V= maliyet , veya G = i N i .
Son denklemden = G/ N i , yani, parçacık başına Gibbs enerjisidir. Kimyasal potansiyel J/mol cinsinden ölçülür.
Omega potansiyeli büyük bir bölme fonksiyonu ile ifade edilir Z nasıl
= – T içinde Z, (3.16)
nerede [toplam bitti N ve k(N)]:
Z= exp[( N – E k (N))/T].






