Bir maddenin kimyasal potansiyeli. Kimyasal potansiyel
Sistemdeki partikül sayısını değiştirirken ve gerekli özellikleri açıklamak için açık sistemler(değişken sayıda parçacıkla).
X. s. m i
içok bileşenli bir sistemin inci bileşeni, termodinamiğin herhangi birinin kısmi türevine eşittir. bu bileşenin postadaki sayısına (parçacık sayısı) göre potansiyeller. kalan termodinamiğin değerleri. bu termodinamiği belirleyen değişkenler. potansiyel, örn. m ben = (dF/dN ben) T,V,N (F-bedava enerji, T-temp-ra, V-Ses, ji). Böylece alternatifli sistemlerde örneğin diferansiyel için ifadedeki parçacıkların sayısı. dF, değeri ekleyin:
![]()
nerede R- baskı yapmak, S-entropi. Naib. sadece X. p. termodinamik ile ilişkilidir. potansiyel G(santimetre. Gibbs enerjisi):. Tek bileşenli bir sistem için X. n. m = G/N,
yani, parçacık başına Gibbs enerjisidir. Katkıdan dolayı G, basınç ve sıcaklığa ek olarak-ry, X.p. sadece otd konsantrasyonuna bağlıdır. bileşenlerine bağlıdır, ancak her bileşendeki parçacıkların sayısına bağlı değildir. En basit durumda ideal gazlar m i sadece konsantrasyona bağlıdır i-inci bileşen:
toplam parçacık sayısı nerede, m ~ i-X. saf i inci
bileşen. Genellikle değerler m i bağımsız termodinamik olarak kullanıma uygundur. bunun yerine değişkenler ben. değişkenlerde TELEVİZYON, m i sistemin durumu termodinamiği karakterize eder. potansiyel
![]()
X.p. termodinamiktir. parametre Gibbs büyük kanonik dağılımı AC sistemleri için parçacıkların sayısı. Normalizasyon sabiti olarak X. p. parçacıklar için Boltzmann, Bose - Einstein ve Fermi - Dirac dağılımlarına girer ideal gazlar(santimetre. istatistiksel fizik) Boltzmann veya Bose-Einstein istatistiklerinin uygulanabilir olduğu sistemlerde X. p. her zaman negatiftir. İçin fermi gazı X. p. sıfır sıcaklıkta pozitiftir ve sınırı belirler Fermi enerjisi(santimetre. Fermi yüzeyi)ve dejenerasyon sıcaklığı. Eğer bir
sistemdeki toplam parçacık sayısı sabit değildir, ancak termodinamik koşuldan belirlenmelidir. denge, örneğin fononlar içinde sağlam vücut yada ... için fotonlar denge termal durumunda, denge sıfır X'e eşitlik ile karakterize edilir. p.
x.p. kavramı, koşulları formüle etmemizi sağlar. termodinamik denge. Koşullardan biri, herhangi bir bileşenin X.p.'sinin ayrıştırmada aynı olmasıdır. aşamalarda ve bir aşamanın farklı yerlerinde. Bu, X.p'nin eşitlenmesine yol açan parçacıkların yeniden dağıtılması olasılığından kaynaklanmaktadır. Mekansal olarak homojen olmayan bir ext. denge alanı şu anlama gelir
![]()
nerede i 0 - X. s. bir alanın yokluğunda, ben (r)-potansiyel parçacık enerjisi i th bileşeni ext. alan. Yerçekimi alanındaki bir gaz için bu durum barometrik gaz için filtre. şarj olması durumunda Elektrikteki parçacıklar. alan (örneğin yarı iletkenlerde) değer m i aranan elektrokimyasal potansiyel, m için X. p. adını bırakarak i 0 . Aynı bileşenin farklı fazlarda bulunan parçacıkları için X.p. değerlerinin eşitliği, faz geçişleri için denge koşullarını belirler (
Faz geçişlerinin termodinamiği. Tanımlar
olduğu sistemlerin termodinamiğini ele alalım. faz geçişleri. ile madde alışverişi yapabilen termodinamik bir sistemdir. çevre, aranan açık.
Termodinamik sistem denir homojen veya homojen, eğer her küçük parçasında fiziksel özellikler maddeler ve yoğun termodinamik parametreler aynı veya uzayda sürekli olarak değişir.
Bir maddenin fiziksel özelliklerinin ve yoğun parametrelerin sistem içindeki bazı yüzeylerde aniden değiştiği termodinamik sistemlere termodinamik sistemler denir. heterojen. Heterojen bir sisteme bir örnek, kaynayan bir sıvıdır.
Homojen veya sürekli değişen özellik ve parametrelere sahip heterojen bir sistemdeki alanlara denir. aşamalar. Dış alanların yokluğunda heterojen bir sistemin dengesinde, her fazdaki yoğun parametreler sabittir.
Ancak bu yoğun parametrelerin farklı aşamalarda aynı olması gerekmez. Homojen bir sistem bu nedenle tek fazlıdır.
Genel durumda, fazların her biri, aralarında kimyasal olarak saf maddelerin homojen bir karışımı olabilir. kimyasal reaksiyonlar. Karışımdaki kimyasal olarak saf maddelere denir bileşenler. Genel durumdaki fazlar, yalnızca iş veya ısı biçimindeki enerjiyi değil, aynı zamanda maddeyi de değiştirebilir. Maddenin bir halden başka bir hale geçmesine denir faz geçişi.
Tek bileşenli tek fazlı bir TD sistemi açık olsun ve yalnızca sistemi oluşturan madde kabuğun içinden geçebilir. Ve sistemin dengede olmasına izin verin.
Değiştirmek içsel enerji Böyle bir sistem, yalnızca ısı temini ve üzerindeki iş performansı nedeniyle değil, aynı zamanda kütlesindeki bir değişiklik nedeniyle de ortaya çıkacaktır. Kabuğa nüfuz eden madde, kendi doğal enerjisini taşır. Daha sonra dördünün her biri için Gibbs denklemleri termodinamik potansiyeller(5.3) ve (5.5), sistemin kütlesindeki değişimle orantılı bir terim daha ile tamamlanmalıdır, yani.
Değer μ , kısmi türevlerle belirlenir
denir kimyasal potansiyel ve sistemin bir veya daha fazla bağımsız parametre çiftinin sabitini korurken, kütlesi bir değiştiğinde bir termodinamik sistemin enerjisini değiştirmek mantıklıdır.
Kimyasal potansiyelin sistemin diğer potansiyelleriyle bağlantısını bulalım. Bunu yapmak için (4.12)'deki dördüncü ifadeyi göz önünde bulundurun. Gibbs serbest enerjisi Φ, entropi S ve sistem hacmi Vözel değerleri aracılığıyla yazıyoruz:
Gibbs serbest enerji diferansiyelinin ifadesi ile değiştirilmesi ![]() ve terimleri yeniden düzenlersek şunu elde ederiz:
ve terimleri yeniden düzenlersek şunu elde ederiz:
(4.5)'e göre M= sabit = 1 kg ![]() , kütle diferansiyeli d'nin keyfiliği göz önüne alındığında M, bulduk:
, kütle diferansiyeli d'nin keyfiliği göz önüne alındığında M, bulduk:
şunlar. Bir maddenin kimyasal potansiyeli, ona özgü Gibbs serbest enerjisidir.
4.6. Çok fazlı sistemlerin termodinamik dengesi için koşullar. Gibbs faz kuralı
Düşünmek tek bileşenli sistem etkileşimli iki aşamadan oluşur. Her fazın kendi iç dengesinde olmasına izin verin, yani. her biri kendi parametre seti ile karakterize edilir. Fazlar arasındaki denge sorununu inceleyelim. Bunu yapmak için tüm sistemi bir yalıtım kabuğuna yerleştiriyoruz (Şekil 4.1). Daha sonra, her bir fazın (alt sistemlerin) durumundaki küçük bir değişiklikle, onlar için termodinamik kimlikler (4.1)'e göre yazılabilir.
 (4.15)
(4.15)
Büyük miktarların eklenmesi nedeniyle ![]() , sistemin kapalılığı ve sürecin tersinirliği, elimizdeki
, sistemin kapalılığı ve sürecin tersinirliği, elimizdeki
![]()
şunlar. (4.5) eşitliklerini topladıktan sonra şunu elde ederiz:
Diferansiyellerin keyfiliği sayesinde ![]() , bu diferansiyellerde parantez içindeki faktörler sıfıra eşit olmalıdır, buradan istenen sistemin termodinamik denge koşullarını elde ederiz:
, bu diferansiyellerde parantez içindeki faktörler sıfıra eşit olmalıdır, buradan istenen sistemin termodinamik denge koşullarını elde ederiz:
 (4.16)
(4.16)
Tanım olarak kimyasal potansiyelin kendisi doğal bir çift değişkenin fonksiyonudur, bu nedenle faz denge koşulu şu şekilde yazılabilir:
İşlevlerin türü T ve p genel durumda fazların her biri için farklıdır, dolayısıyla (4.17) koşulu bir özdeşlik değildir. Bu, aralarında ısı, iş ve maddenin değiş tokuş edildiği, aynı anda var olan etkileşimli iki fazdan oluşan bir denge sistemindeki sıcaklık ve basıncı ilişkilendiren cebirsel bir denklemdir.
Bu nedenle, iki fazlı tek bileşenli bir sistemde sıcaklık ve basınç benzersiz bir şekilde ilişkilidir. Sistemin hacmi, fazların kütleleri arasındaki orana bağlı olarak keyfi bir değer alabilir. İki fazlı bir sistemin denge durumuna doyma durumu denir ve fazlar için eşit sıcaklık ve basınca doyma parametreleri denir. T s , p s .
Dengeyi düşünün üç fazlı tek bileşenli sistem. Bu durumda:
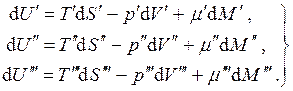 (4.18)
(4.18)
Ama için kapalı sistem:
Neyi hesaba katarak, denklemleri (4.8) ekleyerek elde ederiz:
Buradaki tüm diferansiyeller bağımsız ve değerleri keyfi olduğundan, denge koşullarını buluyoruz:
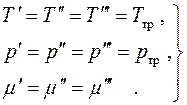 (4.19)
(4.19)
Kimyasal denge, yani fazların kimyasal potansiyellerinin eşitliği, iki cebirsel denklem şeklinde yazılabilir
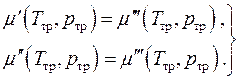 (4.20)
(4.20)
Bu, iki bilinmeyenli iki denklem sistemidir. Tek bileşenli bir denge sistemi aynı anda mevcut olabilir. üç fazlar sadece kesin olarak tanımlanmış basınç ve sıcaklık değerlerinde. Sistemin bu durumuna denir üçlü nokta.
bir denge için dört fazlı tek bileşenli sistem:
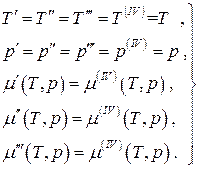 (4.21)
(4.21)
iki bilinmeyenli üç denklem sistemi. Böyle bir denklem sistemi, herhangi ikisinin birbiriyle orantılı olduğu durumlar dışında tutarsızdır, yani. dört aşamadan ikisi gerçekten ayırt edilemez olduğunda ve bu zaten üç fazlı bir sistem olacaktır. Böylece, tek bileşenli bir denge sisteminde, üç fazdan fazlasının aynı anda bir arada bulunması mümkün değildir. Bir denge termodinamik sistemi çok bileşenli ise, aynı anda bir arada bulunan fazların sayısı üçten fazla olabilir, yani
nerede n sistem bileşenlerinin sayısıdır. Bu sonuca denir Gibbs faz kuralları.
DERS PLANI:
1. Dersin organizasyonel kısmı: Harbiyelilerin derse hazır olup olmadığına dair bir rapor alınır, devamsızlıklar dergide not edilir (süre 3-5 dakika).
2. "Isı ve Kütle Transferi" bölümüne giriş.
Ders soruları:
Isı transfer mekanizmaları.
sıcaklık alanı.
sıcaklık gradyanı.
Isı iletiminin temel yasası.
· Termal iletkenlik katsayısı.
· Isı iletiminin diferansiyel denklemi.
· Sınır şartları.
3. Sonuç.
Bir sonraki sınıf için öğrenciler şunları yapmalıdır:
BİLMEK: diferansiyel denklem termal iletkenlik; ısı ve termal yayılım katsayılarının belirlenmesi.
YAPABİLMEK: Fourier denklemindeki problemleri çözerken sınır koşullarını uygular.
BİR SUNUMUNUZ VAR: farklı yapı ve kümelenme durumundaki cisimlerde ısı transferi mekanizmaları hakkında.
4. Kendi kendine eğitim için görevler:
_____________/ profesör Fizik ve Isı Transferi, Fizik ve Matematik Doktoru, P.V. Skripov
Bölüm başkanlığında yapılan toplantıda konu görüşüldü ve onaylandı.
Protokol No. _______ tarihli "_____" ______ 2011
Fizik ve Isı Transferi Bölüm Başkanı
profesör, d.t.s. __________________ / N.M. barbi
"_____"______________ 2011
Sistemin serbest enerjisi (Gibbs enerjisi G ve Helmholtz enerjisi F) bağlıdır dış koşullar:
Bu bağımlılık, bir bileşenden oluşan en basit sistemler için tamamlanmıştır.
Bir termodinamik sistem bir veya daha fazla bileşenden oluşabilir. Açıkçası, çok bileşenli bir sistemin serbest enerjisinin değeri hem dış koşullara ( T,R, veya V) ve sistemi oluşturan maddelerin doğası ve miktarı, yani herhangi bir termodinamik fonksiyon gibi serbest enerji, sistemin kapsamlı bir özelliğidir. Sistemin bileşimi zamanla değişiyorsa (yani sistemde bir kimyasal reaksiyon meydana geliyorsa), bileşim değişikliğinin sistemin serbest enerjisinin değeri üzerindeki etkisini hesaba katmak gerekir.
Aşağıdakilerden oluşan bir termodinamik sistem düşünün: k bileşenler. İzin vermek n 1 , n 2 , …, n k- 1., 2., ..., mol sayısı, k bileşenleri. O halde Gibbs serbest enerjisi aşağıdaki değişkenlerin bir fonksiyonudur:
G = f(p, T, n 1 , n 2 , …, n k )
Tüm değişkenlere göre ayırt edin:
 (2.1)
(2.1)
Notasyonu tanıtalım:
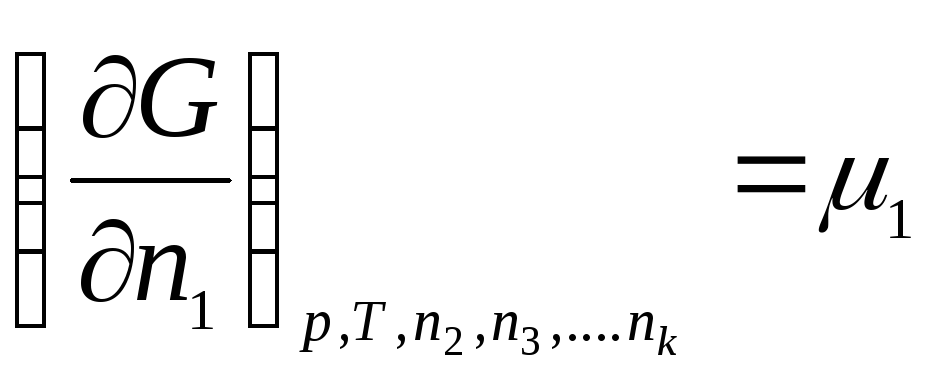
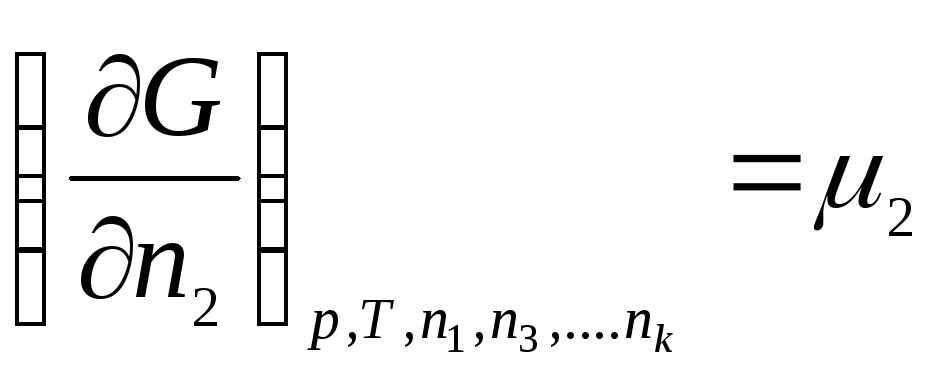
………………….
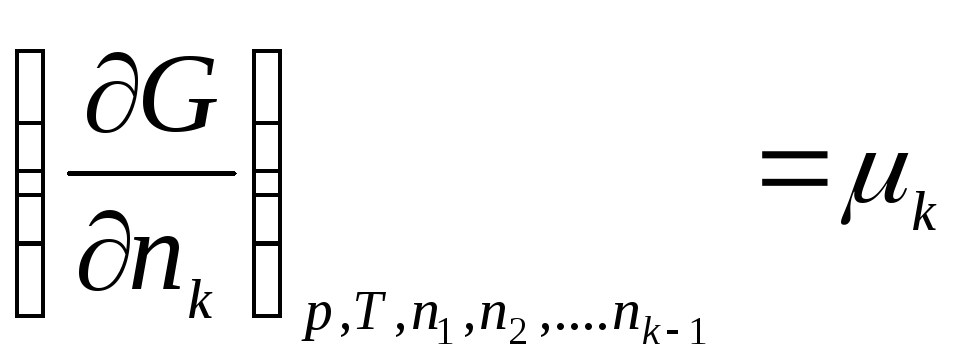 ,
,
nerede μ 1 , μ 2 , …, μ k– 1., 2., …'nin kimyasal potansiyelleri, k th bileşenleri sırasıyla.
Genel olarak
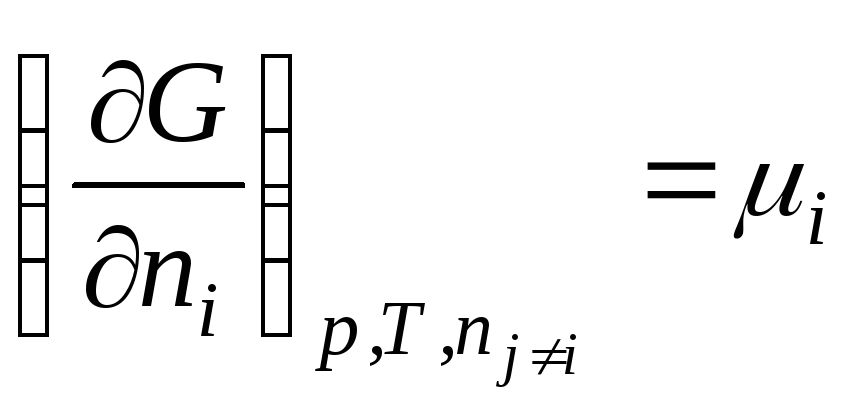 .
.
Helmholtz serbest enerjisi için benzer bir ifade elde ederiz:
F = f(V, T, n 1 , n 2 , …, n k )
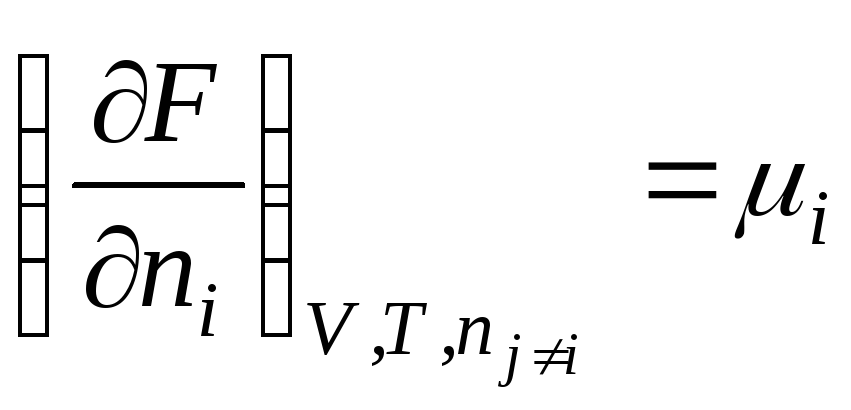 .
.
Böylece, kimyasal potansiyel mol sayısına göre serbest enerjinin kısmi türevidir i-inci bileşen, karşılık gelen harici parametrelerin sabitliği ve diğer tüm bileşenlerin mol sayısı. Böylece, kimyasal potansiyel kısmi molar Gibbs enerjisidir (en R, T = const):
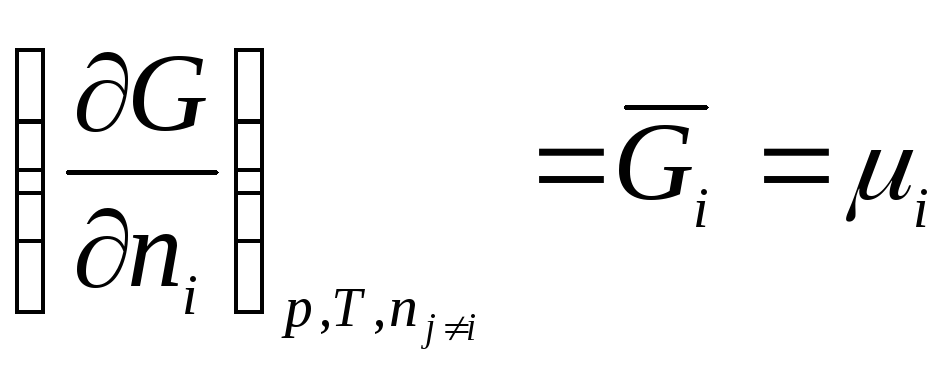 .
.
Serbest enerji ortak mülk sistemlerde, kimyasal potansiyel, sisteme dahil olan tek bir bileşenin özelliklerini karakterize eder. Kimyasal potansiyel, sistemin yoğun bir özelliğidir, çünkü sistemin kütlesine bağlı değildir.
saat p, T =const denklem (2.1) şu şekildedir:
![]() .
(2.2)
.
(2.2)
Bu durumda, Gibbs enerjisindeki değişim, yani sistemin faydalı işi, sadece sistemin bileşimindeki bir kimyasal reaksiyon sonucu veya sistem arasındaki madde alışverişi nedeniyle meydana gelen değişiklikten kaynaklanmaktadır. ve çevre.
Denklem (2.2), sistemin genel özelliği ile bileşenlerinin her birinin özellikleri arasındaki ilişkiyi ifade eder. Kimyasal potansiyelin sabit bir değer olduğunu varsayarak (2.2) denklemini entegre ederiz:
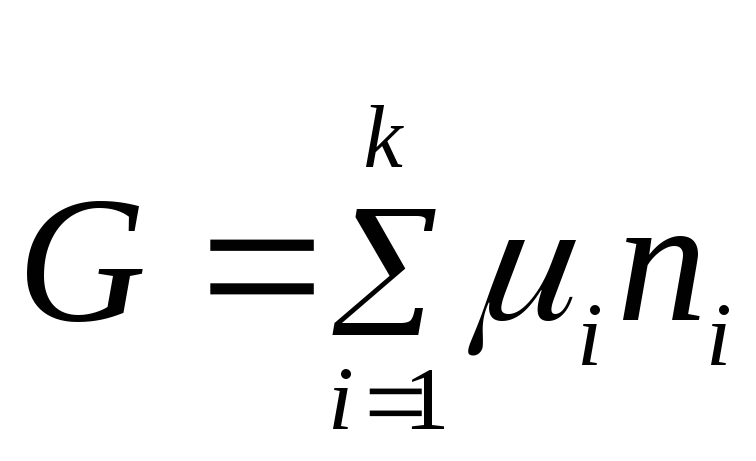 .
.
Entegrasyon sabiti sıfırdır çünkü hepsi n i= 0, Gibbs enerjisi de sıfıra eşittir.
Tek bir madde için
 ,
,
şunlar. tek bir maddenin kimyasal potansiyeli Gibbs molar enerjisine eşittir.
dengede dG = 0 ve denklem (2.1) şu şekli alır:
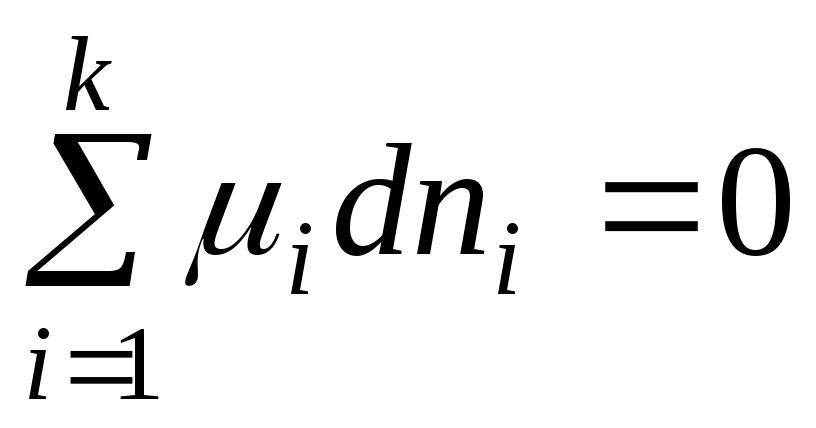 . (2.3)
. (2.3)
Ortaya çıkan denklem, değişken bileşimli bir sistemde genel bir denge koşuludur. R,T =const.
Tek bir ideal gazın kimyasal potansiyeli.
İdeal gaz olan bir termodinamik sistem düşünün. Kimyasal potansiyel Ideal gaz eşittir:
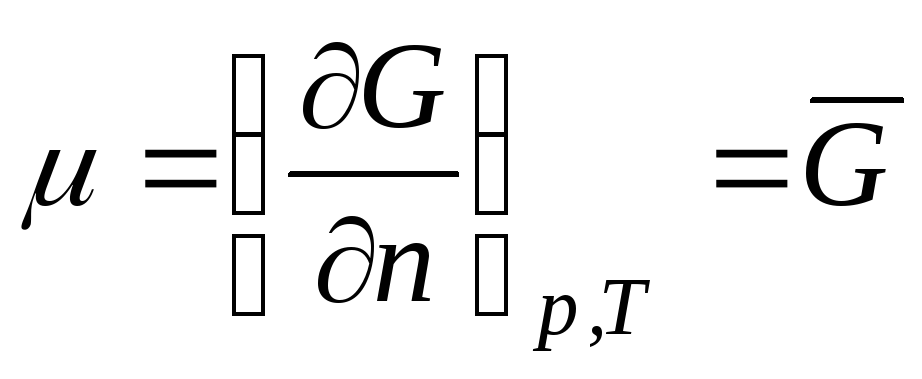 ,
,
nerede  Gibbs molar enerjisidir (1 mol ideal gazın izobarik potansiyeli).
Gibbs molar enerjisidir (1 mol ideal gazın izobarik potansiyeli).
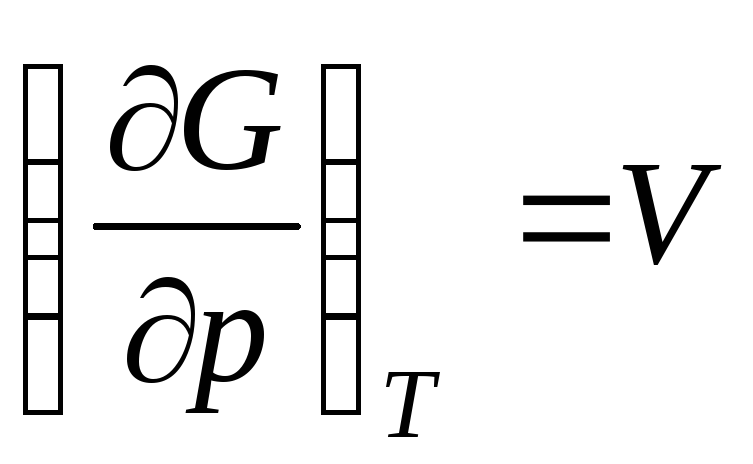 ,
,
sonra 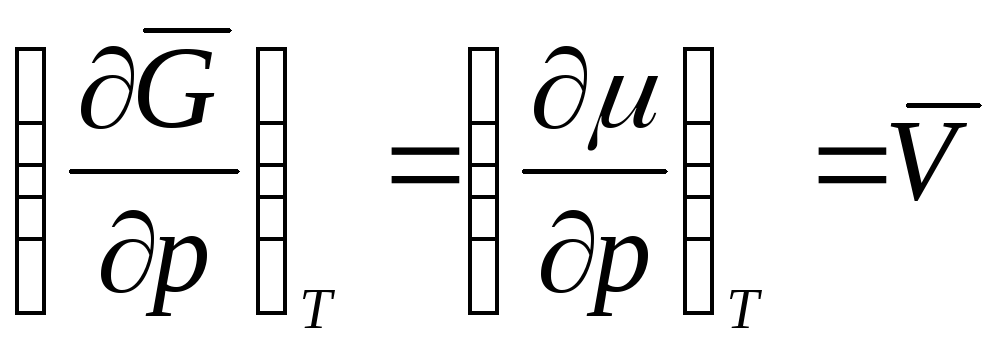 ,
,
nerede  ideal bir gazın molar hacmidir (1 mol gazın hacmi).
ideal bir gazın molar hacmidir (1 mol gazın hacmi).
İşlem şu anda çalışıyorsa T =const, kısmi türev toplam ile değiştirilebilir. O zamanlar

1 mol ideal gazın hal denklemi:
 ;
;
 ,
,
![]()
aralığından integralini alalım. R 0 önceki R:
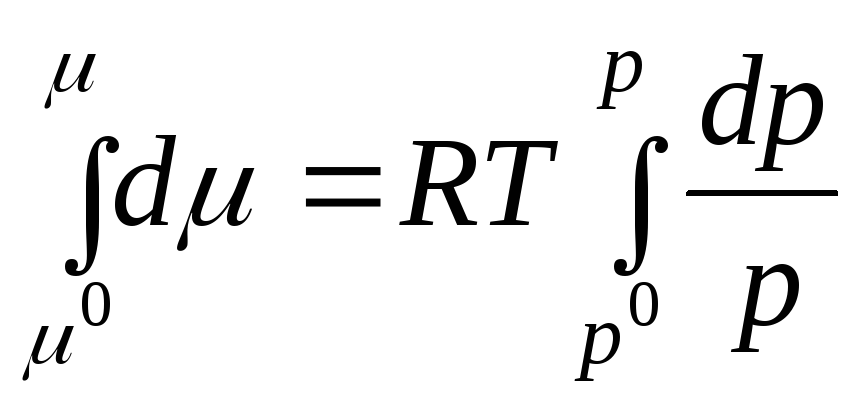
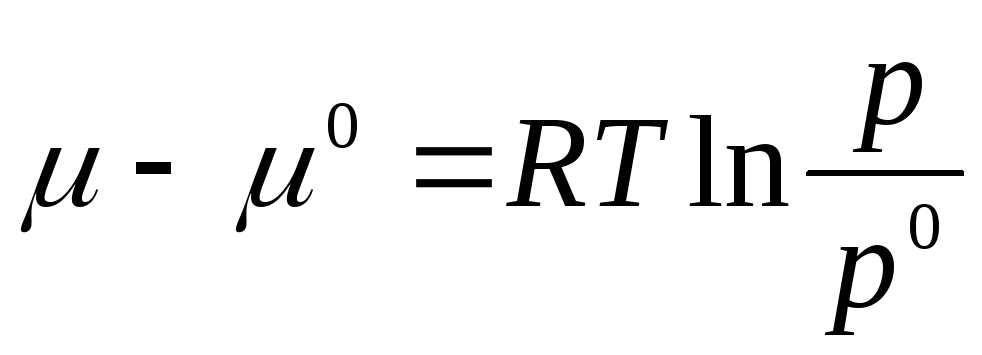
nerede μ 0 , R 0, standart durumda ideal bir gazın kimyasal potansiyeli ve basıncıdır.
Standart durum, ideal gazın durumu olarak alınır. R 0 = 1 atm.
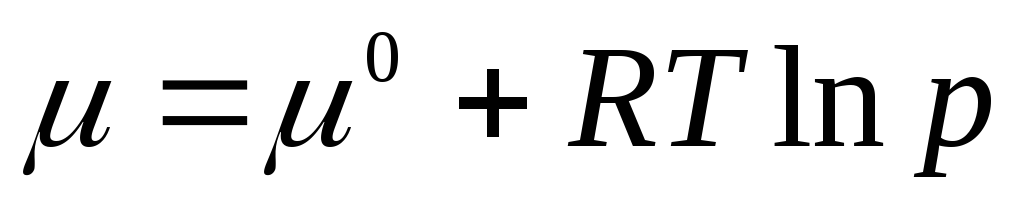 .
(2.3)
.
(2.3)
Standart kimyasal potansiyel, 1 atm gaz basıncındaki kimyasal potansiyeldir. Standart durumda kimyasal potansiyel μ 0 sadece sıcaklığa bağlıdır ve basınca bağlı değildir, yani. μ 0 = f(T). Denklem (2.3), logaritmanın işaretinin altında basınç oranına eşit boyutsuz bir nicelik olduğunu gösterir. R standart basınca R 0 = 1 atm.
Çünkü μ
=
 , yazılabilir
, yazılabilir
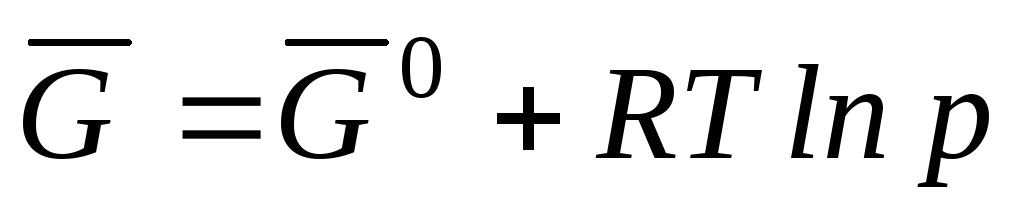
nerede  Gibbs standart molar enerjisidir.
Gibbs standart molar enerjisidir.
İdeal çözümlerin bir bileşeninin kimyasal potansiyeli.
Gaz karışımının toplam basıncı küçükse, her gaz kendi basıncını uygular, üstelik sanki tek başına tüm hacmi kaplıyormuş gibi. Bu basınç denir kısmi. Toplam gözlemlenen basınç R her gazın kısmi basınçlarının toplamına eşittir (Dalton yasası):
 .
.
İdeal bir gaz karışımının bir bileşeninin kimyasal potansiyeli:
 ,
,
nerede R i gazın kısmi basıncıdır.
Bir gazın kısmi basıncını ifade etme R i toplam basınç ve gazın mol fraksiyonu yoluyla x i, kimyasal potansiyelin bağımlılığı için ifadeyi alın i mol kesrinin -th bileşeni:
nerede  ideal bir gazın kimyasal potansiyeli x i= 1 (yani bireysel durumda) basınçta R ve sıcaklık T;
ideal bir gazın kimyasal potansiyeli x i= 1 (yani bireysel durumda) basınçta R ve sıcaklık T;
 hem sıcaklığa hem de basınca bağlıdır.
hem sıcaklığa hem de basınca bağlıdır.
İçin ideal sıvı çözümler uygulanabilir denklem
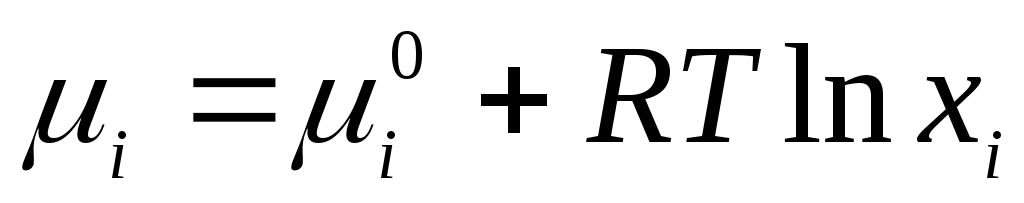 ,
,
nerede 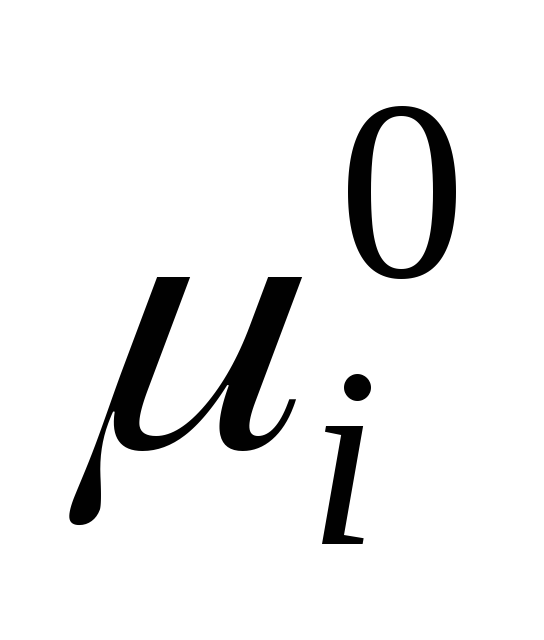 sıvı haldeki tek bir bileşenin standart kimyasal potansiyelidir (
sıvı haldeki tek bir bileşenin standart kimyasal potansiyelidir (  ) sıcaklığa ve basınca bağlıdır; x i, bileşenin mol kesridir.
) sıcaklığa ve basınca bağlıdır; x i, bileşenin mol kesridir.
Gerçek çözümlerin bir bileşeninin kimyasal potansiyeli .
Gerçek çözümler için, dikkate alınan tüm bağımlılıklar uygulanamaz. Bileşenin kimyasal potansiyeli gerçek gaz çözümü Lewis yöntemi kullanılarak hesaplanmıştır. Bu durumda, kısmi basınç yerine termodinamik denklemlerin şeklini korumak için hayali bir miktar sunarlar. f i, denir kısmi fugasite, veya oynaklık. O zamanlar
![]() ,
,
nerede  standart durumda gerçek bir gaz karışımının bir bileşeninin kimyasal potansiyelidir.
standart durumda gerçek bir gaz karışımının bir bileşeninin kimyasal potansiyelidir.
volatilite oranı kısmi basıncı gerçek gaz çözeltisine uçuculuk katsayısı denir:
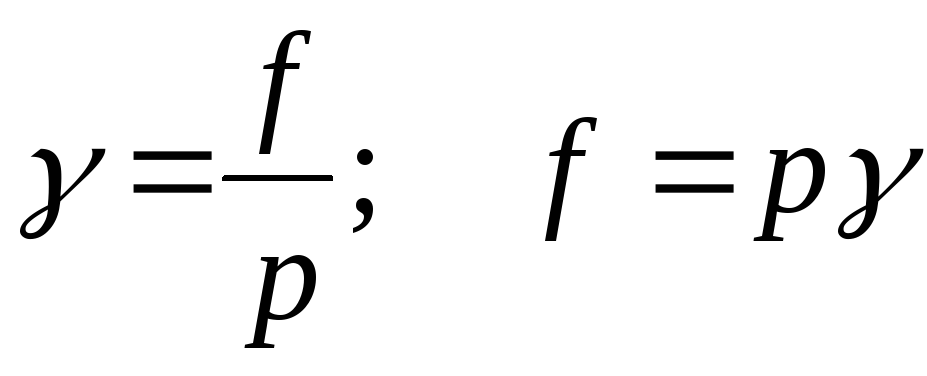 ;
;
Benzer şekilde, sıvı gerçek çözümler gerçek konsantrasyon, karşılık gelen hayali değerle değiştirilir - aktivite a i :
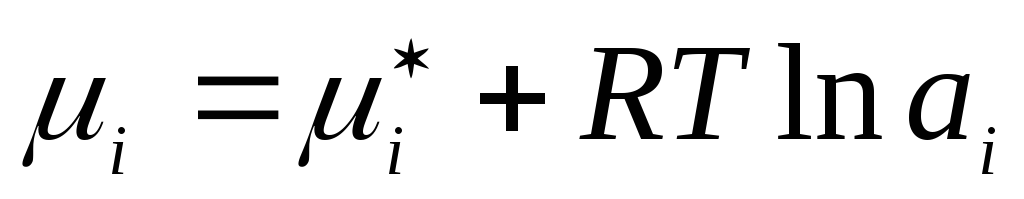 ,
,
nerede  standart durumda gerçek bir sıvı çözeltinin bir bileşeninin kimyasal potansiyelidir.
standart durumda gerçek bir sıvı çözeltinin bir bileşeninin kimyasal potansiyelidir.
Aktivite, aktivite katsayısı aracılığıyla konsantrasyonla ilgilidir:
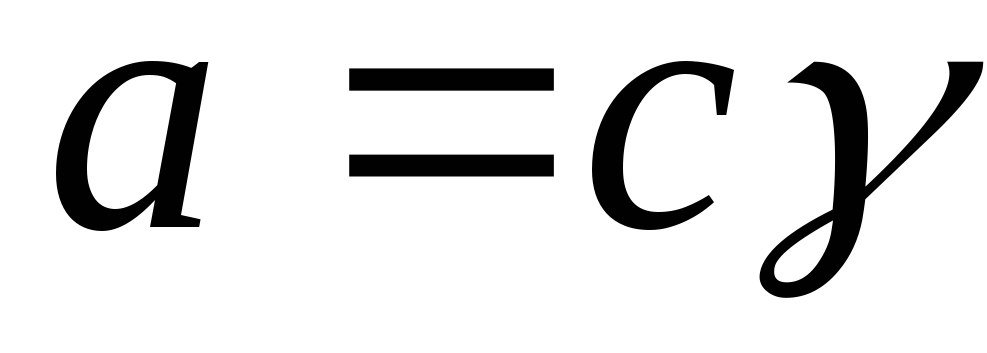 ,
,
burada γ i aktivite katsayısıdır.
Bir çözeltinin konsantrasyonunu ifade etme yöntemine bağlı olarak, rasyonel, molar ve molal aktivite katsayıları ayırt edilir:

Aktivite katsayısı çözeltinin konsantrasyonuna bağlıdır. Sonsuz seyreltik çözeltilerde γ → 1, a i ve f i → c i ve p i sırasıyla.
Kimyasal potansiyel denklemini formda yeniden yazalım.
 ,
,
bu nedenle termodinamik aktivite 1 mol transfer işidir. i standart çözümden verilen gerçek çözüme.
Seçmenin iki ana yolu vardır standart durum- simetrik ve asimetrik.
simetrik yol.Çözücü ve çözünen için aynı standart durum seçilir - çözelti sıcaklığındaki saf bileşenin durumu. Daha sonra standart durumda x i = 1, a i = 1ve y i = 1. Bu yöntem daha çok elektrolit olmayan çözeltiler için kullanılır.
asimetrik yol.Çözücü ve çözünen için farklı bir standart durum seçilir. Çözücü için - simetrik yöntemde olduğu gibi: x i → 1, a i → 1ve y i → 1. bir çözünen için standart durum, maddenin sonsuz seyreltik bir çözeltideki halidir: x i → 0, a i → x i ve y i → 1. Yöntem en çok elektrolit çözeltilerinin termodinamiğinde kullanılır.






