Yüzey olayları örneklerdir. Diğer sözlüklerde "Yüzey olayları" nın neler olduğunu görün
YÜZEY OLGULARI
YÜZEY OLGULARI
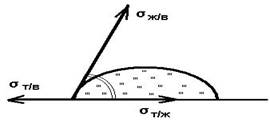
Fazlalığın neden olduğu fenomenler bedava enerji sınır tabakasında - yüzey enerjisi, yüzey tabakasının moleküllerinin artan aktivitesi ve yönü, yapısının ve bileşiminin özellikleri. P. i. kimya olduğu gerçeği de belirlenir. ve fiziksel cisimlerin etkileri öncelikle yüzey katmanlarında meydana gelir. Ana P. i. yüzey alanıyla orantılı olarak yüzey enerjisinde bir azalma ile ilişkilidir. Bu nedenle, büyümeleri sırasında kristallerin yanı sıra sıvı damlalarının veya gaz kabarcıklarının denge formlarının oluşumu DC'deki minimum serbest enerji ile belirlenir. Ses. P. I., moleküler kuvvetlerin birleşik etkisinden kaynaklanan ( yüzey gerilimi ve ıslatma) ve ext. kuvvetler (yerçekimi) ve sıvı ara yüzeylerinin eğriliğine neden olur. kılcal olaylar.
P. i. televizyonda. cisimler öncelikle dışta yer alır. vücut yüzeyi. Bunlar şunları içerir: yapışma (kohezyon), (yapışma), sürtünme. Ayrışma sırasında kristalin minimum serbest yüzey enerjisi koşullarından. gerilimi farklı olan yüzler, matematiksel olarak tüm olası kristal formları türetilir. çokyüzlü geom okudu. kristalografi.
P. i. içeride gerçekleşir. kristal kusurlar temelinde gelişen yüzeyler. ızgaralar. TV'nin herhangi bir imhası. gücünün üstesinden gelmekle ilişkili olan gövde, yeni bir arayüz oluşumunda ifade edildiğinden, esasen P. I.'dir. Başlangıçta homojen bir ortamda yeni bir fazın çekirdeklerinin oluşumu ve gelişimi. yarı kararlı durum, ayrıca P. I. (bununla ilişkili, küçük damlaların ve kristallerin çözünürlüğünde bir artış ve bunların üzerindeki basınçta bir artıştır. doymuş buhar; (bkz. KELVIN DENKLEM)).
Anlamına geliyor. grup P.I. kimyasalın değiştiği adsorpsiyon olaylarını oluşturur. yüzey tabakasının bileşimi (bkz. ADSORPSİYON). Bu fenomen grubu Aralık'ta bitişiktir. aktif ve kimyasal vakalar. adsorpsiyon, yüzey kimyasına dönüşüyor. kimyasal bir yüzey tabakasının oluşumu ile reaksiyonlar. bağlantılar. Buna fark dahildir. Topokhem. (örneğin, metalin tuzlarının bir çözeltisinden indirgenmesi sırasında yüzeylerde metalik aynaların oluşumu, ısıtma yüzeylerinde kireç oluşumu vb.). Kemisorpsiyon monomoleküler tabaka-kaplamaların oluşumu, vücuttaki monomoleküler yüzey ışığını ve onun üzerindeki etkisinin doğasını değiştirmek için etkili bir yöntemdir. çevre. Adsorpsiyon katmanları, sınırda yapısal ve mekanik ile ilişkili olan emülsiyonların, köpüklerin, süspansiyonların stabilitesini önemli ölçüde artırabilir. bu katmanların azizleri (yüksek, elastikiyet ve güç).
Yüzey katmanlarındaki termal hareketin özellikleri iskeleye yol açar. ışığın yüzeyler tarafından saçılması. Diğer olaylar grubu şunları içerir: termiyonik emisyon, potansiyel sıçramaların oluşumu ve arayüzde çift elektrik katmanının oluşumu. Bu P.I. iyonların ve dipol moleküllerinin adsorpsiyonu ile ilişkilidir. P. i. termodinamiği etkiler. fazların dengesi, yalnızca kolloidal sistemlerde ayrılmalarının çok gelişmiş bir yüzeyi olması durumunda. Isı transfer oranları ve kütle transfer süreçleri - çözünme, yoğuşma, heterojen kimya. süreçler (örneğin, korozyon) - arayüzün boyutuna ve St.'sine göre belirlenir ve bu nedenle iskeleye keskin bir şekilde bağlıdır. bu yüzeyin doğası ve yapısı. Adsorpsiyon katmanları yaratıkları çağırabilir. değişim, arayüzey değişim süreçlerini yavaşlatır. Bu nedenle, örneğin belirli yüzey aktif maddelerin tek katmanları. su yüzeyindeki setil alkol, buharlaşmasını önemli ölçüde yavaşlatabilir. Aynı şey, korozyon işlemlerinin etkisi altında yavaşlamasıdır. yüzey katmanları oksitlerin önleyicileri veya koruyucu filmleri vb. kimyasal. metal yüzeydeki bileşikler.
P. i. arayüzeylerin (damlalar, kabarcıklar ve sıvı jetleri, damlalara ayrılma, kılcal damar) hareketi sırasında sınır koşullarının özelliklerini belirler. Adsorpsiyon filleri, yüzey geriliminde yerel farklılıklar, yani sınır hidrodinamiğindeki değişiklikler nedeniyle kılcal dalgaların sönümlenmesine neden olur. koşullar.
P. i. Belirli bir ortamda malzeme ve yapıların dayanıklılığını belirler. Sadece çözünme ve korozyon değil, tersine çevrilebilir korozyon bile katıların deformasyonlarının giderilmesine ve tahribatına neden olur. cisimler, yeni yüzeylerin oluşum çalışmalarını azaltır. İçeride adsorbe edilen küçük safsızlıklar bir monomol oluşturur. arayüzler üzerindeki katmanlar, birçoğunu kontrol etmenize izin verir. St. sen malzemeler. Monomoleküler yüzey katmanlarının incelenmesi, molekülleri incelemek ve boyutlarını belirlemek için yeni yöntemlere yol açar. P. i. kayaların yıpranması ve toprak oluşumu, nemin buharlaşması ve yoğunlaşması ve diğerleri gibi süreçleri belirler. Canlı organizmalardaki süreçler. P.'nin kullanımında I. birçok teknolojik kurdu işlemler (yağlama, ıslatma, yüzdürme vb.).
Fiziksel Ansiklopedik Sözlük. - M.: Sovyet Ansiklopedisi. . 1983 .
YÜZEY OLGULARI
-
olaylar, adsorpsiyon, yüzey enerjisinin ortaya çıkışı, yüzey gerilimi, yüzey elektriği. Yüzey katmanları moleküler boyutlar ölçeğinde homojen değildir ve fazların kümelenme durumundan bağımsız olarak anizotropiktir; fizikselin yığın fazlarından farklıdırlar. özellikler (yoğunluk, viskozite, kristaller ve boşluklar mikroskobiktir. Yüzeyde ve yüzeylerin kesişiminde iki boyutlu faz geçişlerinin varlığında, fazlar arası çizgiler oluşur - arayüz yüzeylerinin tek boyutlu analogları, doğrusal fenomenler varlığı ile ilişkili Homojen olmayan bir doğrusal bölge, yüzey tabakasının tek boyutlu bir analogudur ve doğrusal bir gerilime, doğrusal serbest enerjiye vb. sahiptir. Uzak doğrusal termodinamik potansiyeller, yalnızca birim uzunluğa atıfta bulundukları için yüzey olanlardan farklıdır. (J/m cinsinden ölçülür). Doğrusal fenomenler yalnızca çok küçük nesneler için önemlidir (iki boyutlu fazların çekirdekleri, .P.).
P.I.'nin Düzenlilikleri Laplace yasası ve Young denklemi ile tanımlanır (bkz. ıslatma), genelleştirilmiş Gibbs ur-Niemadsorpsiyonunun yanı sıra:
keserek bir yüzey birimi oluşturma işi nerede (bkz. yüzey gerilimi),- atım entropi (bkz. Yüzey enerjisi),- yüzey gerilimi tensörü, - birim tensörü, - tensörü deformasyonlar(":" sembolü, tensörlerin skaler çarpımı anlamına gelir),- kimyasal potansiyeller
moleküller (veya iyonların elektrokimyasal potansiyelleri), G i- adsorpsiyonları, toplama, yığın fazı ile yüzey tabakası arasında dengenin mümkün olduğu tüm bileşenler üzerinde gerçekleştirilir. Sıvı yüzeyler için - yüzey gerilimi ve deformasyon. üye eksik. Gibbs adsorpsiyonunun önemi, en önemli P. I. - adsorpsiyon ve yüzey aktivitesi (bkz. yüzey aktif maddeler).
Önemli etki, P. I. makrosistemlerin özellikleri. Bu, bu tür sistemlerde yüzey alanındaki artıştan, kılcal olaylardan kaynaklanmaktadır. Yalnızca eğri yüzeyli heterojen bir sistemde, Gibbs faz kuralı onun klasiğinde (işaretiyle birlikte) dağınık sistemlerin stabilitesine katkıda bulunan ince filmlerin kama basıncı (film üzerindeki dış basınç ile aynı anda filmin bileşenlerinden oluşan toplu fazdaki basınç arasındaki fark olarak tanımlanır). filmdeki gibi sıcaklık ve kimyasal değerler.P.I.'nin önemli bir grubu elektro yüzey olaylarıdır: yüzey, yüzey elektrik, emisyon vb. Hepsi arayüzdeki oluşum ile ilişkilidir. çift elektrik katmanı emisyon sonucu veya spesifik olarak. P.I.'ye ilgili olmak yapışma, yapışma, gözenekli cisimlerin ıslatılması, yağlanması ve yıkanması, sürtünmesi, emprenye edilmesi. P. i. etkiler (örn. adsorpsiyon gücü azalması - Rehbinder etkisi). P. i. faz süreçlerinde önemli bir rol oynar. aralarındaki ısı ve kütle transfer hızı. Yüzey tabakalarının ve filmlerin moleküler yapılarıyla ilişkili geçirgenliği, özellikle biyol için önemli olan membran fenomenlerine neden olur. sistemler. Aydınlatılmış.: Rusanov A.I., Faz dengesi ve yüzey olayları, L., 1967; Adem A., Fiziksel kimya yüzeyler, ANCAK. I. Rusanov.
Fiziksel ansiklopedi. 5 ciltte. - M.: Sovyet Ansiklopedisi. Genel Yayın Yönetmeni A. M. Prokhorov. 1988 .
"YÜZEY FENOMENİ" nin diğer sözlüklerde neler olduğunu görün:
Modern Ansiklopedi
Yüzey olayları- YÜZEY OLGULARI, özel fiziksel ve kimyasal özellikler cisimlerin sınırındaki ince madde katmanları (ortamlar, fazlar). En önemli yüzey olayı adsorpsiyondur. Malzemelerin mukavemetini ve dayanıklılığını belirleyin. Bir yüzey ile... Resimli Ansiklopedik Sözlük
Vücudu oluşturan parçacıklar arasındaki etkileşim kuvvetlerinin yüzeyinde dengelenmemesi nedeniyle bir grup fenomen. Yüzey fenomenleri arasında yüzey gerilimi, kılcal fenomenler, yüzey aktivitesi… Büyük Ansiklopedik Sözlük
yüzey olayları- - fiziksel kimyasal olaylar Arayüze yakın çözücü ve çözünen moleküllerin eşit olmayan dağılımı nedeniyle. Genel Kimya: ders kitabı / A. V. Zholnin ... kimyasal terimler
YÜZEY OLGULARI- yüzey tabakasında, ortamlar arasındaki arayüzlerde meydana gelen ve yüzey tabakasının moleküllerinin artan aktivitesi ve oryantasyonu, yapısının ve bileşiminin özelliklerinin yanı sıra kimyasalın neden olduğu fenomenler. ve fiziksel etkileşimler... Büyük Politeknik Ansiklopedisi
Fizik kimya sıvıların ve katıların yüzey katmanlarının özel (yığına kıyasla) özelliklerinden kaynaklanan fenomenler. Naib. bu katmanlardaki yaygın ve önemli sv, aşırı svob'dur. enerji F \u003d sS, burada s yüzey (arayüz) gerilimidir, için ... ... Kimya Ansiklopedisi
Yüzey olayları fazların ara yüzeyindeki ince madde katmanlarının özel özelliklerinden kaynaklanan bir dizi fenomen. Yüzey olayları, arayüzde, arayüz yüzeyinde meydana gelen süreçleri içerir ... ... Wikipedia
Yüzey katmanlarının özel özelliklerinin ifadesi, yani cisimler (ortam, fazlar) arasındaki arayüzde ince madde katmanları. Bu özellikler, yüzey tabakasının aşırı serbest enerjisinden (Bkz. Serbest enerji), özelliklerinden kaynaklanmaktadır ... ... Büyük Sovyet Ansiklopedisi
Yüzey– iki iletişim ortamı arasındaki arayüz
Yüzey olayları- bitişik maddeler arasındaki sınırdaki fiziksel ve kimyasal özelliklerden kaynaklanan bir dizi fenomen.
Yani bunlar yüzey enerjisi nedeniyle yüzeyde meydana gelen olaylardır.
Yüzey altı malzeme katmanları bir alt sistem olarak kabul edilir. ortak sistem deforme olabilen malzeme.
Belirli yüzey alanı: S vuruş = S/V
Yüzey olayları şunları içerir:
2) kılcal fenomen(bir sıvının başka bir ortamla sınırında, yüzeyinin eğriliği ile ilişkili yüzey fenomeni)
Laplace fonksiyonu (kılcal basınç formülü) P = σ(dS/dV)
3) yapışma(bir fazdaki bir maddenin başka bir faza yapışmasını karakterize eder) ve uyum(aynı homojen cismin parçalarının yapışması (sıvı veya katı))
4) sürtünme
5) adsorpsiyon ve desorpsiyon olayları
Gibbs adsorpsiyon denklemi: Γ = -(∂σ/∂μ) T
6) ıslatma(bir sıvı, üçüncü bir fazın, bir gazın (buhar) veya birinciyle karışmayan başka bir sıvının mevcudiyetinde katı bir cisme temas ettiğinde gözlemlenen bir yüzey olgusu. Özellikıslatma - üç fazlı temas hatlarının varlığı (ıslatma hatları).
Islanmanın ana termodinamik özellikleri, denge ıslatma açısı q 0 , yapışma işi W a , ıslanma ısısı q W . Islanmanın denge temas açısı, sıvının yüzeyinin (örneğin damlaların) ıslattığı katı cismin yüzeyine olan eğimi ile belirlenir; köşenin tepe noktası ıslatma çizgisi üzerindedir. Denge temas açısı Young denklemi ile belirlenir:
cosq 0 \u003d (s s -s sl) / s sl,
nerede s s ve s sl - sırasıyla. Bir gazla sınırında ve ıslatan bir sıvı ile temas halinde olan bir katının özgül yüzey enerjisi, s l sıvının yüzey gerilimidir.
Yüzey termodinamiği:
yüzey olayları genellikle termodinamiğin birinci ve ikinci yasalarının birleşik denklemine göre sınıflandırılır.
Bu denklem şu şekilde yazılır:
nerede σdS – yüzey enerjisi[J/m^2=N/m]
Yüzey enerjisi - arayüzde yoğunlaşan enerji, hacimdeki enerjiye kıyasla fazla. kristal maddeler yüzey enerjisi anizotropisi ile karakterize edilir: en düşük yüzey enerjisine sahip yüzler en yüksek yoğunluk parçacıklar.
Yüzey gerilimi: σ = (dG/dS) T , p , ni
Yani, yüzey gerilimi, dengedeki iki faz arasındaki arayüzün termodinamik bir özelliğidir, bu arayüzün bir birim alanının tersinir izotermokinetik oluşumu çalışmasıyla belirlenir, ancak sistemin sıcaklığı, hacmi ve tüm kimyasal potansiyelleri sağlanır. her iki fazdaki bileşenler sabit kalır.
Yüzey enerjisinin minimuma eğilimi, sıvı yüzeyinin eğriliğine neden olur. Bu nedenle, yüzey enerjisi ve form arasında bir bağlantının varlığını varsayabiliriz.
elektronik özellikler yüzeylerözellikle elektronik mevcudiyeti ile toplu olanlardan farklıdır yüzey durumları. Elektronların karşılık gelen dalga fonksiyonları, yüzeyden uzaklaştıkça katlanarak azalır.
İnce filmler ve filamanlar, dar yarıklar ve gözenekler, damlalar, kristaller ve mikroskobik boyutlardaki boşluklar gibi yüzey katmanlarıyla ilgili küçük (en az bir boyutta) nesnelerin de özel özellikleri vardır. İnce filmler ve monomoleküler tabakaların incelenmesi, moleküller arası etkileşimin doğası ve moleküllerin yapısı hakkında bilgi sağlar.
iki boyutlu varsa faz geçişleri ve ayrıca yüzeyler kesiştiğinde, arayüzey çizgileri oluşur - varlığı doğrusal fenomenlerle ilişkili olan arayüzey yüzeylerinin tek boyutlu analogları. Homojen olmayan bir lineer bölge, bir yüzey tabakasının tek boyutlu bir analogudur ve lineer gerilime, lineer serbest enerjiye vb. sahiptir. Spesifik lineer termodinamik potansiyeller yüzey olanlardan yalnızca bir uzunluk birimine atıfta bulunmaları bakımından farklıdır (J / m cinsinden ölçülür). Doğrusal fenomenler yalnızca çok küçük nesneler için önemlidir (iki boyutlu fazların çekirdekleri, ıslatma mikrodamlacıkları, vb.).
Adsorpsiyon ve desorpsiyon olayları
Gazların katılar üzerinde adsorpsiyonunda, adsorpsiyonun yapısını belirleyen etkileşimlerinin doğası farklı olabileceğinden, adsorbat ve adsorban moleküller arasındaki etkileşimin tanımı çok karmaşık bir problemdir. Bu nedenle, adsorpsiyonun fiziksel veya kimyasal kuvvetlerden kaynaklandığı, sırasıyla fiziksel ve kimyasal adsorpsiyon gibi iki uç durum göz önüne alınarak problem genellikle basitleştirilir.
fiziksel adsorpsiyon van der Waals etkileşimleri nedeniyle ortaya çıkar. Tersinirlik ve artan sıcaklıkla adsorpsiyonda bir azalma ile karakterize edilir, yani. ekzotermiktir ve fiziksel adsorpsiyonun ısı etkisi genellikle adsorbat sıvılaşma ısısına yakındır (10 – 80 kJ/mol). Örneğin, inert gazların kömür üzerinde adsorpsiyonu böyledir.
kimyasal adsorpsiyon(kemisorpsiyon) tarafından gerçekleştirilir. kimyasal etkileşim adsorban ve adsorbat molekülleri. Kemisorpsiyon genellikle geri döndürülemez; fiziksel adsorpsiyonun aksine kimyasal adsorpsiyon lokalizedir; adsorbat molekülleri adsorbanın yüzeyi üzerinde hareket edemez. kemisorpsiyon olduğundan kimyasal işlem 40 - 120 kJ / mol mertebesinde bir aktivasyon enerjisi gerektiren, sıcaklıktaki bir artış oluşumuna katkıda bulunur. Kimyasal adsorpsiyona bir örnek, oksijenin yüksek sıcaklıklarda tungsten veya gümüş üzerine adsorpsiyonudur.
Fiziksel ve kimyasal adsorpsiyon fenomeni çok nadir durumlarda açıkça ayırt edilir. Ara seçenekler genellikle, adsorbe edilen maddenin büyük kısmı nispeten zayıf bağlandığında ve sadece küçük bir kısmı sıkıca bağlandığında gerçekleştirilir. Örneğin, düşük sıcaklıklarda metaller üzerindeki oksijen veya nikel üzerindeki hidrojen, fiziksel adsorpsiyon yasalarına göre adsorbe edilir, ancak sıcaklık arttıkça kimyasal adsorpsiyon oluşmaya başlar. Sıcaklıktaki bir artışla, belirli bir sıcaklıktan kimyasal adsorpsiyondaki artış, fiziksel adsorpsiyondaki azalmayla örtüşmeye başlar, bu nedenle bu durumda adsorpsiyonun sıcaklığa bağımlılığı açıkça tanımlanmış bir minimuma sahiptir.
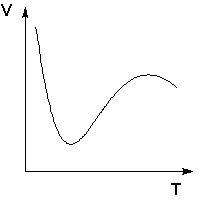
Nikel tarafından adsorbe edilen hidrojen hacminin sıcaklığa bağımlılığı
Adsorpsiyon türleri:
Langmuir'in monomoleküler adsorpsiyon teorisi
Amerikalı kimyager I. Langmuir tarafından geliştirilen monomoleküler adsorpsiyon teorisi aşağıdaki hükümlere dayanmaktadır.
1) Adsorpsiyon lokalizedir ve kimyasallara yakın kuvvetlerden kaynaklanır.
2) Adsorpsiyon, adsorbanın tüm yüzeyinde değil, adsorbanın yüzeyindeki çıkıntılar veya çöküntüler olan ve sözde varlığı ile karakterize edilen aktif merkezlerde meydana gelir. serbest değerler. Aktif merkezler bağımsız (yani bir aktif merkez diğerlerinin adsorpsiyon kapasitesini etkilemez) ve özdeş olarak kabul edilir.
3) Her aktif merkez sadece bir adsorbat molekülü ile etkileşime girebilir; sonuç olarak, yüzeyde yalnızca bir adsorbe molekül tabakası oluşabilir.
4) Adsorpsiyon işlemi tersine çevrilebilir ve denge - adsorbe edilen molekül aktif merkez tarafından bir süre tutulur, ardından desorbe edilir; böylece bir süre sonra adsorpsiyon ve desorpsiyon süreçleri arasında dinamik bir denge kurulur.
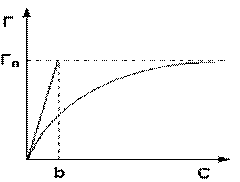
Monomoleküler adsorpsiyon izotermi
Denge durumunda adsorpsiyon hızı desorpsiyon hızına eşittir. Desorpsiyon hızı, dolu aktif merkezlerin (x) oranı ile doğru orantılıdır ve adsorpsiyon hızı, adsorbat konsantrasyonunun ürünü ve serbest aktif merkezlerin fraksiyonu (1 - x) ile doğru orantılıdır:
Denklemin sağ tarafının payını ve paydasını k A 'ya bölerek şunu elde ederiz:

Adsorpsiyon To'nun mümkün olan maksimum değeri, tüm aktif merkezlerin adsorbat molekülleri tarafından işgal edilmesi koşuluyla elde edilir, yani. x = 1. Dolayısıyla x = r / r o'dur.
Denklem, adsorpsiyon değeri G'yi adsorbat konsantrasyonu C ile ilişkilendiren bir monomoleküler adsorpsiyon izotermidir. Burada b, belirli bir adsorban-adsorbat çifti için (desorpsiyon oranı ve adsorpsiyon hızı sabitleri), sayısal olarak adsorbat konsantrasyonuna eşit bir sabit değerdir, aktif merkezlerin yarısının işgal edildiği. Langmuir adsorpsiyon izoterminin grafiği, Şek. b sabiti, C = 0 noktasında adsorpsiyon izotermine bir teğet çizilerek grafiksel olarak belirlenebilir.
Denklemde gazların adsorpsiyon sürecini tanımlarken, konsantrasyon orantılı bir değerle değiştirilebilir. kısmi basıncı gaz:
Langmuir'in monomoleküler adsorpsiyon teorisi, gazların ve çözünmüş maddelerin adsorbat düşük basınçlarında (konsantrasyonlarında) adsorpsiyonunun bazı işlemlerini tanımlamak için geçerlidir.
Polanyi'nin polimoleküler adsorpsiyon teorisi
Uygulamada, sıklıkla (özellikle buharların adsorpsiyonunda) sözde vardır. Belirli bir basınç değerinden başlayarak, adsorbe edilen moleküllerin adsorbat ile olası etkileşimini gösteren S-şekilli adsorpsiyon izotermleri.

Polimoleküler adsorpsiyon izotermi
Bu tür adsorpsiyon izotermlerini tanımlamak için M. Polyany, aşağıdaki ana hükümlere dayanan bir polimoleküler adsorpsiyon teorisi önerdi:
1. Adsorpsiyona tamamen fiziksel kuvvetler neden olur.
2. Adsorbanın yüzeyi homojendir, yani. üzerinde aktif merkez yok; adsorpsiyon kuvvetleri, adsorbanın yüzeyinin yakınında sürekli bir kuvvet alanı oluşturur.
3. Adsorpsiyon kuvvetleri belli bir mesafede etki eder, daha büyük adsorbat molekülleri. Başka bir deyişle, adsorpsiyon sırasında adsorbat molekülleri ile dolan adsorbanın yüzeyine yakın belirli bir adsorpsiyon hacmi vardır.
Yüzey tabakasının atomik yapısının özellikleri:
Katıların yüzeyine yakın atomik yapının özgüllüğü, sözde yüzey gevşemesi ve yeniden yapılandırmasında kendini gösterir. Gevşeme sırasında, yüzeylere paralel atom düzlemlerinin yapısı kütledekiyle aynı kalır, ancak yüzeye yakın düzlemler arası mesafeler değişir. Yeniden oluşturma sırasında, yüzeye yakın bölgedeki kafesin simetrisi, kütledekinden keskin bir şekilde farklıdır. Bu fenomen öncelikle kovalent bağa sahip kristaller için karakteristiktir (örn. Si ve Ge). Kovalent etkileşimin yüksek derecede anizotropik doğası nedeniyle, yüzeyin oluşumu sırasında kafesin periyodikliğinin ihlali, yüzeye yakın atomlar arası bağların geometrisinin radikal bir şekilde yeniden düzenlenmesini gerektirir. Bir dizi geçiş ve soy metalin yüzeyinin yeniden yapılandırılması da bulundu.
Yüzey gevşemesi - kristalin yüzeye yakın tabakasının modifikasyonu, burada üst tabakanın atomik yapısı, hacimdeki karşılık gelen atomik düzlemlerinkiyle aynı kalır, ancak birinci ve ikinci tabakalar arasındaki mesafe veya bunların karşılıklı konumu, hacimde olanlar.
Gevşeme ikiye ayrılır normal ve yanal, paralel veya teğet olarak da adlandırılır. Normal gevşeme, üst katmanın atomik yapısının kütledeki ile aynı olduğu, ancak üst ve ikinci katmanlar arasındaki mesafenin kütledeki düzlemler arasındaki mesafeden farklı olduğu duruma karşılık gelir (Şekil a). Saf haliyle metallerde normal gevşeme gözlenir. Çoğu durumda, ilk ara katman mesafesinde bir azalma olur; daha derin katmanlar için, ara katman mesafesinin toplu değerinden sapma derinlikle azalır. Bazen yüzeye paralel üst tabakanın düzgün bir yer değiştirmesi de vardır (Şekil b); bu durumda paralel veya teğetsel gevşemeden söz edilir. Esas olarak, düşük bir atom konsantrasyonuna sahip yüksek indeksli düzlemlerde gözlenir.
Yüzey olayları
Yüzey olayları- fazların ara yüzeyindeki ince madde katmanlarının özel özelliklerinden kaynaklanan bir dizi fenomen. Yüzey olayları, faz sınırında, arayüzey yüzey tabakasında meydana gelen ve konjuge fazların etkileşiminden kaynaklanan süreçleri içerir.
Yüzey olayları, fazlar arası sınırlardaki yüzey katmanlarında farklı kompozisyon ve temas eden fazların yapısı ve buna bağlı olarak, farklı fazlar tarafındaki yüzey atomlarının ve moleküllerinin bağlarındaki farklılık nedeniyle, doymamış bir atomlar arası, moleküller arası kuvvetler alanı vardır. Sonuç olarak, yüzey katmanlarındaki atomlar ve moleküller özel bir yapı oluşturur ve madde, çeşitli özelliklerle fazların hacmindeki durumundan farklı olan özel bir hal alır. Yüzey olayları kolloid kimyası ile incelenir.
Yüzey olaylarının sınıflandırılması
Yüzey olayları genellikle, ana enerji türlerini içeren termodinamiğin birinci ve ikinci yasalarının birleşik denklemine göre sınıflandırılır. Herhangi bir heterojen sistem için aşağıdaki biçimde yazılabilir:
Bu denklem, diğer enerji türlerinin artışlarının cebirsel toplamı yoluyla Gibbs enerjisinin artışını gösterir. Yüzey enerjisinin aşağıdaki enerji türlerine dönüşebileceği açıktır:
- Gibbs enerjisi
- kimyasal enerji
- mekanik enerji
- Elektrik enerjisi
Yüzey enerjisinin listelenen enerji türlerinden birine dönüşümü, dağılım, yapışma ve ıslanma, kılcallık, adsorpsiyon, elektriksel olaylardaki bir değişiklikle reaktivitedeki bir değişiklik gibi belirli yüzey fenomenlerine karşılık gelir.
Yüzey Olaylarının Önemi
Yüzey olayları kimya mühendisliğinde yaygındır. hemen hemen her kimyasal üretim dağınık sistemler ve yüzey olayları kullanılarak gerçekleştirilir. Kural olarak, kimya teknolojisindeki tüm heterojen işlemler şu anda gerçekleştirilir: maksimum yüzey faz teması. Bunu yapmak için, madde sistemleri süspansiyonlar, tozlar, emülsiyonlar, sisler, tozlar durumuna aktarılır. Hammaddelerin ve ara ürünlerin öğütülmesi, zenginleştirme, dağınık sistemlerde devam eder, ıslanma, kılcallık, adsorpsiyon, sedimantasyon, pıhtılaşma gibi olaylarda önemli bir rol oynar. Gözenekli adsorbanlar ve katalizörler, kimya teknolojisinde yaygın olarak kullanılmaktadır. dağınık sistem katı bir dispersiyon ortamı ile.
Yüzey olaylarının seyrinin düzenlilikleri, özellikle yapı oluşumu, teorik temel istenilen özelliklere sahip malzemelerin elde edilmesi: seramikler, çimentolar, cam seramikler, sorbentler, katalizörler, polimerler, tozlar, ilaçlar vb.
Edebiyat
Frolov Yu.G. Peki kolloid kimyası. - LLC TID "İttifak", 2004. - 464 s. - ISBN 5-98535-003-7
Wikimedia Vakfı. 2010 .
Diğer sözlüklerde "Yüzey olayları" nın ne olduğunu görün:
Yüzey enerjisinin sınır tabakasındaki fazla serbest enerjinin neden olduğu olaylar, yüzey tabakasının moleküllerinin artan aktivitesi ve oryantasyonu, yapısının ve bileşiminin özellikleri. P. i. kimya olduğu gerçeği de belirlenir. ve fiziksel vz…… Fiziksel Ansiklopedi
Modern Ansiklopedi
Yüzey olayları- YÜZEY OLGULARI, cisimlerin (ortam, fazlar) sınırındaki ince madde katmanlarının özel fiziksel ve kimyasal özelliklerinden kaynaklanmaktadır. En önemli yüzey olayı adsorpsiyondur. Malzemelerin mukavemetini ve dayanıklılığını belirleyin. Bir yüzey ile... Resimli Ansiklopedik Sözlük
Vücudu oluşturan parçacıklar arasındaki etkileşim kuvvetlerinin yüzeyinde dengelenmemesi nedeniyle bir grup fenomen. Yüzey fenomenleri arasında yüzey gerilimi, kılcal fenomenler, yüzey aktivitesi… Büyük Ansiklopedik Sözlük
yüzey olayları- - arayüzey yakınında çözücü ve çözünen moleküllerin eşit olmayan dağılımının neden olduğu fizikokimyasal olaylar. Genel kimya: ders kitabı / A. V. Zholnin ... kimyasal terimler
YÜZEY OLGULARI- yüzey tabakasında, ortamlar arasındaki arayüzlerde meydana gelen ve yüzey tabakasının moleküllerinin artan aktivitesi ve oryantasyonu, yapısının ve bileşiminin özelliklerinin yanı sıra kimyasalın neden olduğu fenomenler. ve fiziksel etkileşimler... Büyük Politeknik Ansiklopedisi
Fizik kimya sıvıların ve katıların yüzey katmanlarının özel (yığına kıyasla) özelliklerinden kaynaklanan fenomenler. Naib. bu katmanlardaki yaygın ve önemli sv, aşırı svob'dur. enerji F \u003d sS, burada s yüzey (arayüz) gerilimidir, için ... ... Kimya Ansiklopedisi
Yüzey katmanlarının özel özelliklerinin ifadesi, yani cisimler (ortam, fazlar) arasındaki arayüzde ince madde katmanları. Bu özellikler, yüzey tabakasının aşırı serbest enerjisinden (Bkz. Serbest enerji), özelliklerinden kaynaklanmaktadır ... ... Büyük Sovyet Ansiklopedisi
Vücudu oluşturan parçacıklar arasındaki etkileşim kuvvetlerinin yüzeyinde dengelenmemesi nedeniyle bir grup fenomen. Yüzey olayları, yüzey gerilimi, kılcal olaylar, yüzey aktivitesi, ... ... ansiklopedik sözlük
YÜZEY OLGULARI- bitişik cisimler arasındaki sınırda yüzey katmanlarının özel özellikleri ile ilişkili bir dizi fenomen. Yüzey olayları, yüzey enerjisinin varlığından kaynaklanmaktadır. Yüzey olayları, yüzey gerilimini içerir, ... ... Metalurji Sözlüğü
Kitabın
- Fiziksel kimya. Yüzey olayları ve dispers sistemler. Ders Kitabı, A. G. Morachevsky. Fiziksel kimya. Yüzey olayları ve dağılma sistemleri: Uch. ödenek, 2. baskı, silindi. ISBN:978-5-81141-857-2…
Yüzey olayları- fazların ara yüzeyindeki ince madde katmanlarının özel özelliklerinden kaynaklanan bir dizi fenomen. Yüzey olayları, faz sınırında, arayüzey yüzey tabakasında meydana gelen ve konjuge fazların etkileşiminden kaynaklanan süreçleri içerir.
Yüzey olayları, interfaz sınırlarındaki yüzey katmanlarında, temas eden fazların farklı kompozisyon ve yapısından ve buna bağlı olarak, farklı fazlardan yüzey atomlarının ve moleküllerinin bağlarındaki farklılıktan dolayı, atomlar arası, moleküller arası kuvvetlerin doymamış alanı. Sonuç olarak, yüzey katmanlarındaki atomlar ve moleküller özel bir yapı oluşturur ve madde, çeşitli özelliklerle fazların hacmindeki durumundan farklı olan özel bir hal alır. Yüzey olayları kolloid kimyası ile incelenir.
Yüzey olaylarının sınıflandırılması
Yüzey olayları genellikle, ana enerji türlerini içeren termodinamiğin birinci ve ikinci yasalarının birleşik denklemine göre sınıflandırılır. Herhangi bir heterojen sistem için aşağıdaki biçimde yazılabilir:
d G = − S d T + V d P + σ d s _ + Σ μ ben d n ben + φ d q (\displaystyle dG=-SdT+VdP+(\underline (\sigma ds))+\Sigma \mu _(i)dn_ (i)+\varphi dq)Bu denklem, diğer enerji türlerinin artışlarının cebirsel toplamı yoluyla Gibbs enerjisinin artışını gösterir. Yüzey enerjisinin aşağıdaki enerji türlerine dönüşebileceği açıktır:
- Gibbs enerjisi
- kimyasal enerji
- mekanik enerji
- Elektrik enerjisi
Yüzey enerjisinin listelenen enerji türlerinden birine dönüşümü, dağılım, yapışma ve ıslanma, kılcallık, adsorpsiyon, elektriksel olaylardaki bir değişiklikle reaktivitedeki bir değişiklik gibi belirli yüzey fenomenlerine karşılık gelir.
Yüzey Olaylarının Önemi
Yüzey olayları kimya mühendisliğinde yaygındır. Hemen hemen her kimyasal üretim, dağınık sistemler ve yüzey olayları kullanılarak gerçekleştirilir. Kural olarak, kimya teknolojisindeki tüm heterojen işlemler, maksimum faz temas yüzeyinde gerçekleştirilir. Bunu yapmak için, madde sistemleri süspansiyonlar, tozlar, emülsiyonlar, sisler, tozlar durumuna aktarılır. Hammaddelerin ve ara ürünlerin öğütülmesi, zenginleştirme, dağınık sistemlerde devam eder, ıslanma, kılcallık, adsorpsiyon, sedimantasyon, pıhtılaşma gibi olaylarda önemli bir rol oynar. Katı bir dispersiyon ortamı ile dağılmış bir sistem olan gözenekli adsorbanlar ve katalizörler, kimya teknolojisinde yaygın olarak kullanılmaktadır.
Yüzey olaylarının kalıpları, özellikle yapı oluşumu, istenen özelliklere sahip malzemelerin elde edilmesi için teorik bir temel görevi görür: seramikler, çimentolar, cam-seramikler, sorbentler, katalizörler, polimerler, tozlar, ilaçlar, vb.
Su yüzeylerindeki olaylar
Yağ-su arayüzünün görsel incelemedeki basitliği ile seviyedeki karmaşıklığı arasında belirgin bir karşıtlık vardır. mikroskobik ölçek tr , sınırın moleküler yapısında ve hidrojen bağlarının dinamiklerinde kendini gösterir. Poisson ve Maxwell ile başlayan büyük miktarda çalışma, suyun yapısını ve arayüzdeki reaktivitesini incelemeye ayrıldı, ancak çoklu su skandalı nedeniyle su yapısı konusu bilimsel aktivitede bir düşüş yaşadı.
Petrol-su ara yüzeyindeki yüzey olayları, misel ve membran oluşumu, protein katlanması, kimyasal ayırma, yağ geri kazanımı, nanoparçacık oluşumu ve arayüzeyde polimerizasyon tr.
Ara yüzeyde oluşan "genişletilmiş" hidrofobik yüzeylerle temas halindeki suyun yapısı, örneğin bir heksan emülsiyonunda olduğu gibi, bundan çok farklıdır. nemlendirme kabuğu metan gibi basit çözünen maddeler. Homojen bir metan çözeltisinde, moleküller su kabuğu metan molekülünün küresine teğet olarak yönlendirilmiş; bir heksan emülsiyonundayken, yüzey suyu moleküllerinin yaklaşık %25'i bir hidrojen bağını kaybeder ve ortaya çıkan serbest gruplar ey heksan miseline nüfuz eder. Kimyager Y. Chon ve R. A. Markus'un hipotezine göre, serbest grupların varlığı ey bazılarının nedeni bu su yüzeylerinde organik reaksiyonlar tr yüzlerce kez hızlandırılır.
Ayrıca bakınız
Notlar
Edebiyat
- Frolov Yu.G. Kolloid kimyası dersi. - LLC TID "İttifak", 2004. - 464 s. - ISBN 5-98535-003-7.
- Chaplin, M. Kolloidal yüzeylerde su yapılanması // Biyomedikal ve Çevre Bilimlerinde Yüzey Kimyası: [ingilizce ] / J.P. Blitz, V.M. Gun'ko (Ed.). - Springer Hollanda, 2006. - S. 1-10. - DOI:10.1007/1-4020-4741-X_1 .
- Jung, Y.
Arayüzde meydana gelen süreçlere yüzey olayları denir. Yüzey olaylarının nedeni, doğrudan arayüze bitişik katmanlardaki moleküllerin özel durumudur, çünkü bu katmanlar farklı iç katmanlar fiziksel ve kimyasal özellikleri (özgül enerji, yoğunluk, viskozite, elektriksel iletkenlik, bileşim). Ayrıca, daha büyük spesifik sistem enerjisi, özellikler ne kadar güçlüyse ve yüzey olaylarının bir bütün olarak sistemin davranışı üzerindeki etkisi o kadar güçlü olur.
moleküler basınç. Madde moleküllerinin faz hacmindeki ve yüzey katmanındaki enerji durumu aynı değildir. Fazın hacminde bulunan moleküller, onu çevreleyen moleküllerden aynı çekimi (ve itmeyi) deneyimler ve bu nedenle moleküler kuvvetlerin bileşkesi sıfırdır. Örneğin, A noktasındaki sıvı bir molekül. Faz sınırında bulunan bir molekül (B noktası) üzerinde, farklı (bitişik)
gaz fazının çekici güçlerinden daha fazla. Gaz moleküllerinden gelen çekim ihmal edilebilirse, o zaman yüzeyin çekim kuvveti sıvı moleküller 1 m 2 'lik bir alanı kaplayan derin katmanların molekülleri tarafından sıvının iç (moleküler) basıncına eşittir, yani. Bir hacimdeki sıvının molekülleri arasındaki çekim kuvveti. Sıvının iç basıncının büyüklüğü çok büyüktür ve sıvının polaritesine bağlıdır. Maddeler ne kadar polarsa ve moleküllerinin çekiciliği ne kadar büyükse, iç basınç da o kadar büyük olur. Örneğin, su için 14800 atm. Ve benzen için - 3800 atm.
yüzey gerilimi. Serbest yüzey enerjisi. Sıvının yüzeyini artırmak için (yani, maddenin fazın hacminden yüzey katmanına aktarılması), iç basıncın kuvvetini yenmek ve iş yapmak gerekir. Bu iş ne kadar büyükse, oluşturulan yüzeyin alanı o kadar büyük ve yüzey gerilimi o kadar yüksek olur. Moleküllerin yüzey tabakasının tek taraflı gerilimine yüzey gerilimi denir ( σ ). Belirli bir durumda belirli bir maddenin molekülleri arasındaki kohezyon kuvvetlerinin bir ifadesidir.
Yüzeyi oluşturmak için harcanan enerji, moleküllerin enerjisini arttırmak ve onları fazın derinliğinden yüzeye çıkarmak için kullanılacaktır. Birim yüzey alanı başına iç moleküllerin enerjisine kıyasla yüzey moleküllerinin fazla enerjisine serbest yüzey enerjisi denir: F= σ . S (J / m 2 veya erg / cm 2 olarak ölçülür). Görüldüğü gibi
formülden, yüzey gerilimi, bir birim yüzey alanı veya spesifik serbest enerjinin oluşum çalışmasına sayısal olarak eşittir: . Bu enerji ifadesi yüzey gerilimi. Kuvvet tanımı yüzey gerilimi: Bu, bir yüzeye teğet olarak etki eden ve cismin serbest yüzeyini en küçük sınırlara indirmeye çalışan bir kuvvettir. Bu durumda N/m cinsinden ölçülür.
Termodinamiğin II yasasına göre, sistemin serbest yüzey enerjisi kendiliğinden minimum olma eğilimindedir. Bu, yüzey alanını azaltarak veya yüzey gerilimini azaltarak serbest yüzey enerjisinin azaltılabileceği anlamına gelir. Moleküler basınç kuvvetlerinin etkisi altında yüzey alanında bir azalma sadece sıvılar için mümkündür, çünkü moleküllerinin yapışkan kuvvetleri çok büyük değildir. Bu nedenle, küçük damlalar daha büyük olanlara birleşir ve aerosoller, sisler ve emülsiyonlardaki sıvı damlalar küresel bir şekle sahiptir.
Yüzey gerilimindeki azalmaya bağlı olarak serbest yüzey enerjisindeki azalma hem sıvılarda hem de katılarda doğaldır. Yüzey gerilimi, başka bir maddenin, özellikle bir yüzey aktif maddenin moleküllerinin yüzeyinde birikmesi nedeniyle düşebilir. Bu moleküller, çekimleriyle, belirli bir fazın yüzey moleküllerinin hacmin içine geri çekilmesini kısmen telafi eder ve sistem daha kararlı hale gelir.
Serbest yüzey enerjisi ve yüzey gerilimi sıcaklığa, fazların doğasına, çözünmüş maddelerin doğasına ve konsantrasyonuna bağlıdır.
Artan sıcaklıkla yüzey gerilimi azalır, çünkü Moleküllerin karşılıklı çekimi azalır. Kritik noktada yüzey gerilimi sıfıra ulaşır, çünkü bu durumda farklılıklar ve faz sınırı ortadan kalkar.
Basınçtaki bir artış, yalnızca "gaz-sıvı" sisteminde yüzey gerilimini azaltır, çünkü aynı zamanda gaz, fizikokimyasal özellikler açısından sıvıya yaklaşır.
Ayrıca yüzey gerilimini sadece sıvıların ölçebildiğine dikkat edilmelidir. Katılar için bu imkansızdır, çünkü katı bir cismin yüzeyini tahribatı nedeniyle yapay olarak germek imkansızdır. Katıların yüzey gerilimi hesaplama ile belirlenir. Sıvıların yüzey gerilimini ölçmek için, statik (kılcal yükselme yöntemleri, yatan veya asılı damlalar), yarı statik yöntemler (bir gaz kabarcığının maksimum basıncı yöntemi, halkayı yırtma yöntemi, dikmemetrik yöntem (yöntem) tartım veya sayma damlaları) kullanılır.Bunlardan basit ve yeterli, dikmemetrik yöntem doğrudur, sıvı damlanın kılcal damarının ucundan yerçekimi etkisi altında ayrılma anında, ağırlığının pratikte olduğu gerçeğine dayanır. güce eşit kılcal damarın çevresine uygulanan yüzey gerilimi.
Yoğunluğu suyun yoğunluğundan çok az farklı olan seyreltik çözeltiler için, yüzey gerilimi denklem (mJ / m 2) kullanılarak hesaplanabilir: ![]() .
.
yapışma ve kohezyon. Eczacılıkta yüzey olayları önemlidir, çünkü çoğu ilaç - tozlar, tabletler, emülsiyonlar, süspansiyonlar, aerosoller, merhemler, vb. dağınık sistemlerdir. İlaç üretiminde genellikle adsorpsiyon, ıslatma ve yapışma gibi fenomenlerle uğraşmak gerekir.
Birbirine benzemeyen (katı veya sıvı) iki cisim arasında temas ettiklerinde meydana gelen çekime yapışma denir (Latince adhaesio çekimi, yapışma). Benzer olmayan maddelerin yapışma kuvvetini karakterize eder ve bir fazın moleküllerinin başka bir fazın moleküllerinden ayrılması için harcanan çalışma ile ölçülür (J / m 2 olarak ölçülür). Bu çalışma Dupre-Young denklemine göre hesaplanır: W A \u003d σ iyi-g (1 + cosӨ). Yapıştırıcıların, bağlayıcıların, kaplamaların etkisi, yapışma fenomenine dayanır. Tabletlerin parçalanmasını, kabukların mukavemetini, katı dozaj formlarının çözünmesini etkiler ve cerrahi ve diş hekimliğinde kullanılan malzemeleri karakterize etmek için kullanılır.
Her tür moleküller arası, atomlar arası ve iyonlar arası çekim içeren homojen moleküllerin, atomların, iyonların bir faz içinde yapışmasına kohezyon (lat. “bağ”) denir. Bir maddenin gücünü karakterize eder ve maddeyi kırmak (moleküller arasındaki kohezyon kuvvetlerinin üstesinden gelmek) ve iki yeni yüzey birimi oluşturmak için gereken iş ile ölçülür. Yapışma değeri sayısal olarak yüzey gerilimi değerinin iki katına eşittir: W cog. = 2σ.
Adsorpsiyon proseslerinin temel kavramları. Sağlam veya yüzeyinde adsorpsiyonun meydana geldiği sıvıya adsorban denir ve adsorbe edilen maddeye adsorbat veya adsorbat denir. Bir maddenin arayüzeyde kendiliğinden birikmesi sürecine adsorpsiyon (D) denir. Bir birim yüzey veya kütle tarafından adsorbe edilen madde miktarı (mol/m2, mol/g) ile ifade edilir. Van der Waals kuvvetleri ve hidrojen bağlarının etkisi altında gerçekleşen adsorpsiyona adsorpsiyon denir. fiziksel. Olaya dayalı adsorpsiyon kovalent bağlar adsorban ve adsorban molekülleri arasındaki kimyasal veya kemisorpsiyon. Fiziksel adsorpsiyon tersine çevrilebilir bir süreçtir ve desorpsiyon (yüzeyin adsorbe edilen maddeden kurtulması) eşlik eder. Adsorpsiyon ve desorpsiyon arasında, konumu sıcaklığa bağlı olan dinamik bir denge kurulur. Sıcaklıktaki bir artış, fiziksel adsorpsiyonu azaltır ve kimyasal adsorpsiyonu artırır. Desorpsiyon, adsorbanın yok edilmesi, sıcaklıkta bir değişiklik ve adsorpsiyon etkileşim kuvvetlerinde bir azalma ile gerçekleştirilir. İkincisi, elüsyon şeklinde yaygın olarak kullanılmaktadır. Elüsyon, maddeyi desorbe etmek için, örneğin bir çözelti gibi adsorbana bitişik fazdaki bir değişikliktir. Elüsyon sırasında, adsorbe edilen madde, yeni bir çözücünün molekülleri tarafından veya yeni bir çözeltide çözünen maddelerin adsorpsiyon afinitesindeki bir azalmanın bir sonucu olarak (çoğunlukla adsorban ve adsorban moleküllerinin yükünü değiştirerek) adsorbandan yer değiştirir. pH'da bir değişiklik veya çözeltinin iyonik gücü).
Adsorpsiyonun karakteristik bir özelliği seçiciliğidir (özgüllüğü). Bu, her adsorbanın bir veya daha fazla spesifik maddeyi adsorbe ettiği anlamına gelir. Adsorpsiyonun seçiciliği, adsorban ve adsorban moleküllerinin elektron yoğunluğunun "anahtar kilidi" tipine göre dağılımında rastgele bir çakışma anlamına gelir, yani. adsorban ve adsorbat arasındaki kimyasal afinite.






