Care este presiunea vaporilor de saturație. Dependența presiunii vaporilor saturați de temperatură. Fierbere
Tema: Fundamentele teoriei cinetice moleculare
Lecția: Dependența de presiune abur saturat de la temperatură. Fierbere
În lecțiile anterioare, am introdus conceptul de gaz ideal ca model în care toate legile gazelor pe care le-am studiat. Totuși, aceasta nu înseamnă că fizica moleculară și, în special, teoria cinetică moleculară se limitează la studiul numai gaze ideale. Pentru gazele reale, calculele noastre pe tema „fundamentele teoriei molecular-cinetice”, desigur, sunt valabile. Cu toate acestea, relația dintre parametrii gazelor reale este de așteptat să aibă o formă ușor diferită de această relație pentru gazele ideale.
Luați în considerare un astfel de gaz real ca aburul saturat. Amintiți-vă că doar feribotul implicit este numit stare gazoasă o anumită substanță (cel mai adesea, când se spune „abur”, înseamnă exact vapori de apă). Aburul saturat înseamnă următoarele:
Definiție. Abur saturat Un vapor în echilibru dinamic cu lichidul său. Adică, numărul de molecule de lichid care părăsesc lichidul într-o anumită perioadă de timp este, în medie, egal cu numărul de molecule de vapori care se întorc înapoi în lichid (vezi Fig. 1). Există întotdeauna o regiune de vapori saturati deasupra oricărei suprafețe lichide. Pentru a crea o zonă mai largă, moleculele de vapori trebuie împiedicate să scape în mediu (închideți ermetic vasul).
Pentru a înțelege diferențele dintre aburul saturat și un gaz ideal, trebuie să vă imaginați două experimente.
Mai întâi, să luăm un vas închis ermetic cu apă și să începem să-l încălzim. Pe măsură ce temperatura crește, moleculele lichide vor avea o creștere energie kinetică, iar un număr tot mai mare de molecule vor putea scăpa din lichid (vezi Fig. 2), prin urmare, concentrația de vapori și, în consecință, presiunea acestuia va crește. Deci prima pozitie:

Orez. 2. T 2 > T 1
Cu toate acestea, această prevedere este destul de așteptată și nu la fel de interesantă ca următoarele. Dacă puneți un lichid cu abur saturat sub pistonul mobil și începeți să coborâți acest piston, apoi, fără îndoială, concentrația de abur saturat va crește din cauza scăderii volumului. Cu toate acestea, după ceva timp, vaporii se vor deplasa odată cu lichidul la un nou echilibru dinamic prin condensarea unei cantități în exces de vapori, iar presiunea nu se va schimba în final. A doua pozitie a teoriei aburului saturat:
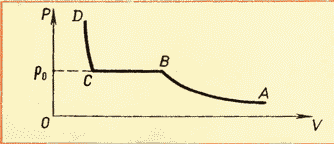
Acum trebuie remarcat faptul că presiunea vaporilor saturați, deși depinde de temperatură, ca un gaz ideal, dar natura acestei dependențe este oarecum diferită. Faptul este că, după cum știm din ecuația de bază a MKT, presiunea gazului depinde atât de temperatură, cât și de concentrația gazului. Și, prin urmare, presiunea vaporilor saturați depinde de temperatură în mod neliniar până când concentrația de vapori crește, adică până când tot lichidul s-a evaporat. Graficul de mai jos (Fig. 3) arată natura dependenței presiunii vaporilor saturați de temperatură,

Orez. 3
în plus, trecerea de la o secțiune neliniară la una liniară înseamnă doar punctul de evaporare a întregului lichid. Deoarece presiunea unui gaz saturat depinde numai de temperatură, este posibil să se determine absolut fără ambiguitate care va fi presiunea vaporilor saturati la o anumită temperatură. Aceste rapoarte (precum și valorile densității vaporilor saturați) sunt enumerate într-un tabel special.
Să ne îndreptăm acum atenția către important proces fizic ca fierberea. În clasa a VIII-a, fierberea era deja definită ca un proces de vaporizare mai intens decât evaporarea. Acum vom extinde oarecum acest concept.
Definiție. Fierbere- procesul de vaporizare care are loc pe tot volumul lichidului. Care este mecanismul de fierbere? Faptul este că întotdeauna există aer dizolvat în apă și, ca urmare a creșterii temperaturii, solubilitatea acestuia scade și se formează microbule. Deoarece fundul și pereții vasului nu sunt perfect netede, aceste bule se agață de neregularitățile din interiorul vasului. Acum secțiunea apă-aer există nu numai la suprafața apei, ci și în interiorul volumului de apă, iar moleculele de apă încep să treacă în bule. Astfel, în interiorul bulelor apare aburul saturat. În plus, aceste bule încep să plutească, crescând în volum și luând în sine un număr mai mare de molecule de apă și izbucnesc la suprafață, eliberând abur saturat în mediu (Fig. 4).
Orez. 4. Procesul de fierbere ()
Condiția pentru formarea și ascensiunea acestor bule este următoarea inegalitate: presiunea vaporilor saturați trebuie să fie mai mare sau egală cu presiunea atmosferică.
Astfel, deoarece presiunea vaporilor de saturație depinde de temperatură, punctul de fierbere este determinat de presiune mediu inconjurator: cu cât este mai mic, cu atât lichidul fierbe la temperatură mai scăzută și invers.
În lecția următoare, vom începe să luăm în considerare proprietățile corpurilor rigide.
Bibliografie
- Myakishev G.Ya., Sinyakov A.Z. Fizica moleculară. Termodinamica. - M.: Dropia, 2010.
- Gendenstein L.E., Dick Yu.I. Fizica clasa a 10-a. - M.: Ileksa, 2005.
- Kasyanov V.A. Fizica clasa a 10-a. - M.: Dropia, 2010.
- Physics.ru ().
- Chemport.ru ().
- Narod.ru ().
Teme pentru acasă
- Pagină 74: nr. 546-550. Fizică. Caiet de sarcini. 10-11 clase. Rymkevici A.P. - M.: Dropia, 2013. ()
- De ce alpiniștii nu pot fierbe ouă la altitudine?
- Care sunt câteva modalități prin care poți răci ceaiul fierbinte? Justificați-le din punct de vedere fizic.
- De ce este necesar să se reducă presiunea gazului pe arzător după fierberea apei?
- * Cum poate fi încălzită apa peste o sută de grade Celsius?
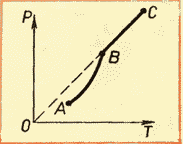
Familiarizarea cu izotermele unui gaz real la diferite temperaturi (vezi Fig. 6.4) ne permite să concluzionăm că că presiunea vaporilor de saturație crește odată cu creșterea temperaturii. Deoarece presiunea vaporilor de saturație nu depinde de volum, ea depinde deci doar de temperatură. Totuși, dependență p(T), găsit experimental, nu este proporțional, ca într-un gaz ideal la volum constant(Legea Charles). Odată cu creșterea temperaturii, presiunea vaporilor saturați crește mai repede decât presiunea unui gaz ideal (Fig. 6.5, secțiunea curbei). AB). Acest lucru devine deosebit de evident dacă trasăm un izocor prin punct DAR(linie întreruptă). De ce se întâmplă asta?
Când un lichid este încălzit cu abur într-un vas închis, o parte din lichid se transformă în abur. Pe măsură ce temperatura crește, viteza de evaporare crește și echilibrul dintre lichid și vapori este perturbat. Concentrația de molecule și, în consecință, densitatea vaporilor crește. Aceasta continuă până când densitatea vaporilor crește atât de mult încât procesul de condensare echilibrează procesul de evaporare. Ca urmare, conform formulei p =nkT presiunea aburului saturat crește nu numai din cauza creșterii temperaturii, ci și din cauza creșterii concentrației de molecule (densitate) aburului. În acest caz, rolul principal în creșterea presiunii vaporilor saturați îl joacă o creștere a concentrației de molecule de vapori și nu o creștere a temperaturii acestuia.
Principala diferență în comportamentul unui gaz ideal și al aburului saturat este că atunci când temperatura vaporilor dintr-un vas închis se modifică (sau când volumul vaporilor se modifică la o temperatură constantă), masa vaporilor se modifică. Lichidul se transformă parțial în vapori sau, dimpotrivă, vaporii se condensează parțial. DIN gaz ideal nu se intampla asa ceva.
Când tot lichidul se evaporă, vaporii, la încălzirea ulterioară, vor înceta să fie saturati, iar presiunea sa la volum constant va crește direct proporțional cu temperatura absolută în conformitate cu legea lui Charles (vezi Fig. 6.5, secțiunea BC).
Izotermele unui gaz real, obținute experimental, descriu starea gazului, echilibrul dintre gaz și lichid și starea lichidă. Ele pot fi utilizate pentru a urmări dependența presiunii vaporilor saturați de temperatură.
§ 6.4. temperatura critica. Situatie critica
Substanța poate fi în stare lichida nu la orice temperatură. Există o limită.
Temperatura critica
La temperaturi suficient de ridicate, secțiunea orizontală a izotermei unui gaz real (vezi Fig. 6.4) devine foarte scurtă și la o anumită temperatură se transformă într-un punct (în Fig. 6.4 - punct LA). Această temperatură se numește critică. Temperatura critică este temperatura la care diferă proprietăți fiziceîntre un lichid şi un vapor aflat în echilibru dinamic cu acesta. Fiecare substanță are propria sa temperatură critică. De exemplu, temperatura critică pentru dioxidul de carbon CO 2 este t la = 31 °С, iar pentru apă - t la = 374 °С.
Situatie critica
Starea corespunzătoare unui punct LA,în care se întoarce secțiunea orizontală a izotermei la o temperatură T = T la , numită stare critică (punct critic). Presiunea și volumul în această stare sunt numite critice. Presiunea critică pentru dioxid de carbon este 7,4 10 6 Pa (73 atm), iar pentru apă 2,2 10 7 Pa (218 atm). În stare critică, lichidul are un volum maxim, iar vaporii saturati- presiune maxima.
Dependența presiunii vaporilor saturați de temperatură. Starea vaporilor saturați este aproximativ descrisă de ecuația de stare a unui gaz ideal (3.4), iar presiunea acestuia este determinată aproximativ de formula
Pe măsură ce temperatura crește, presiunea crește. Deoarece presiunea vaporilor de saturație nu depinde de volum, ea depinde deci doar de temperatură.
Totuși, această dependență găsită experimental nu este direct proporțională, ca într-un gaz ideal la volum constant. Odată cu creșterea temperaturii, presiunea vaporilor saturați crește mai repede decât presiunea unui gaz ideal (Fig. 52, secțiunea curbei AB).
Acest lucru se întâmplă din următorul motiv. Când un lichid este încălzit cu abur într-un vas închis, o parte din lichid se transformă în abur. Ca urmare, conform formulei (5.1), presiunea vaporilor crește nu numai din cauza creșterii temperaturii, ci și din cauza creșterii concentrației de molecule (densitatea) vaporilor. Principala diferență în comportamentul unui gaz ideal și al aburului saturat este aceea că atunci când temperatura vaporilor dintr-un vas închis se modifică (sau când volumul se modifică la temperatura constanta) se modifică masa vaporilor. Lichidul se transformă parțial în vapori sau, dimpotrivă, vaporii se condensează parțial. Nimic de genul acesta nu se întâmplă cu un gaz ideal.
Când tot lichidul s-a evaporat, vaporii, la încălzirea ulterioară, vor înceta să fie saturati, iar presiunea sa la volum constant va crește direct proporțional cu temperatura absolută(Secțiunea BC din Figura 52).
Fierbere. Dependența presiunii vaporilor de saturație de temperatură explică de ce punctul de fierbere al unui lichid depinde de presiune. La fierbere, se formează bule de vapori cu creștere rapidă în volumul lichidului, care plutesc la suprafață. Evident, o bulă de vapori poate crește atunci când presiunea vaporilor saturați din interiorul acesteia depășește puțin presiunea din lichid, care este suma presiunii aerului de la suprafața lichidului (presiunea exterioară) și presiunea hidrostatică a coloanei de lichid.
Fierberea începe la o temperatură la care presiunea vaporilor saturați din bule este egală cu presiunea din lichid.
Cu cât presiunea exterioară este mai mare, cu atât este mai mare punctul de fierbere. Astfel, la o presiune într-un cazan de abur care ajunge la Pa, apa nu fierbe nici măcar la o temperatură de 200°C. În instituțiile medicale, fierberea apei în vase închise ermetic - autoclave (Fig. 53) - are loc și la presiune ridicată. Prin urmare, punctul de fierbere este mult mai mare de 100°C. Autoclavele sunt folosite pentru sterilizarea instrumentelor chirurgicale, pansamentelor etc.
În schimb, prin reducerea presiunii, scădem astfel punctul de fierbere. Pompând aerul și vaporii de apă din balon cu o pompă, puteți face apa să fiarbă la temperatura camerei (Fig. 54). Când urcăm munți Presiunea atmosferică scade. Prin urmare, punctul de fierbere scade. La inaltime


7134 m (Vârful Lenin în Pamir) presiunea este aproximativ egală cu Pa (300 mm Hg). Punctul de fierbere al apei acolo este de aproximativ 70 °C. Este imposibil să gătești, de exemplu, carnea în aceste condiții.
Diferența dintre punctele de fierbere ale lichidelor este determinată de diferența de presiune a acestora vapori saturati. Cu cât presiunea vaporilor saturați este mai mare, cu atât este mai scăzut punctul de fierbere al lichidului corespunzător, deoarece la temperaturi mai scăzute presiunea vaporilor saturați devine egală cu presiunea atmosferică. De exemplu, la 100 ° C, presiunea vaporilor de apă saturați este de (760 mm Hg), iar vaporii de mercur este de numai 117 Pa (0,88 mm Hg). Mercurul fierbe la 357°C la presiune normală.
temperatura critica. Odată cu creșterea temperaturii, concomitent cu creșterea presiunii vaporilor saturați, crește și densitatea acestuia. Densitatea unui lichid aflat în echilibru cu vaporii săi, dimpotrivă, scade din cauza expansiunii lichidului la încălzire. Dacă într-o figură desenăm curbe pentru dependența densității unui lichid și a vaporilor acestuia de temperatură, atunci pentru lichid curba va coborî, iar pentru abur va crește (Fig. 55).
La o anumită temperatură, numită temperatură critică, ambele curbe se îmbină, adică densitatea lichidului devine egală cu densitatea vaporilor.

Temperatura critică este temperatura la care dispar diferențele de proprietăți fizice dintre lichid și vaporii saturați.
La temperatura critică, densitatea (și presiunea) vaporilor saturați devine maximă, iar densitatea lichidului în echilibru cu vaporii devine minimă. Căldura specifică vaporizarea scade odată cu creșterea temperaturii și devine zero la temperatura critică.
Fiecare substanță are propria sa temperatură critică. De exemplu, temperatura critică a apei, în timp ce monoxidul de carbon lichid (IV)






