Fizica moleculară. Perechi saturate și nesaturate. Instalații de abur și condensat de abur ale întreprinderii
Tabelul prezintă proprietățile termofizice ale vaporilor de apă pe linia de saturație în funcție de temperatură. Proprietățile aburului sunt date în tabel în intervalul de temperatură de la 0,01 la 370°C.
Fiecare temperatură corespunde presiunii la care vaporii de apă sunt în stare de saturație. De exemplu, la o temperatură a vaporilor de apă de 200°C, presiunea acestuia va fi de 1,555 MPa, sau aproximativ 15,3 atm.
Capacitatea termică specifică a aburului, conductivitatea termică și creșterea acesteia odată cu creșterea temperaturii. De asemenea, densitatea vaporilor de apă crește. Vaporii de apă devin fierbinți, grei și vâscoși, cu o capacitate termică specifică mare, ceea ce are un efect pozitiv asupra alegerii aburului ca purtător de căldură în unele tipuri de schimbătoare de căldură.
De exemplu, conform tabelului, căldura specifică vapor de apă Cp la o temperatură de 20°C este egală cu 1877 J/(kg grade), iar când este încălzit la 370°C, capacitatea termică a aburului crește la o valoare de 56520 J/(kg grade).
Tabelul oferă următoarele proprietăți termofizice ale vaporilor de apă la linia de saturație:
- presiunea vaporilor la o temperatură specificată p 10 -5, Pa;
- densitatea vaporilor ρ″ , kg / m 3;
- entalpie specifică (de masă). h″, kJ/kg;
- căldură de vaporizare r, kJ/kg;
- capacitatea termică specifică a aburului Cp, kJ/(kg grade);
- coeficient de conductivitate termică λ 10 2, W/(m grade);
- difuzivitate termică a 10 6, m2/s;
- vascozitate dinamica μ 10 6, Pa s;
- vâscozitatea cinematică v 10 6, m2/s;
- numărul Prandtl Relatii cu publicul.
Căldura specifică de vaporizare, entalpia, difuzibilitatea termică și vâscozitatea cinematică a vaporilor de apă scad odată cu creșterea temperaturii. Vâscozitatea dinamică și numărul Prandtl al aburului cresc în acest caz.
Atenție! Conductivitatea termică din tabel este dată puterii lui 10 2 . Nu uitați să împărțiți la 100! De exemplu, conductivitatea termică a aburului la o temperatură de 100°C este de 0,02372 W/(m deg).
Conductibilitatea termică a vaporilor de apă la diferite temperaturi și presiuni
Tabelul prezintă valorile conductivității termice a apei și aburului la temperaturi de la 0 la 700 ° C și la presiune de la 0,1 la 500 atm. Unitatea de unitate de conductivitate termică este W/(m deg).
Linia de sub valorile din tabel înseamnă tranziția de fază a apei la abur, adică numerele de sub linie se referă la abur, iar deasupra acestuia, la apă. Conform tabelului, se poate observa că valoarea coeficientului și a vaporilor de apă crește odată cu creșterea presiunii.
Notă: conductivitatea termică din tabel este dată puterii lui 10 3 . Nu uitați să împărțiți la 1000!
Conductibilitatea termică a vaporilor de apă la temperaturi ridicate
Tabelul prezintă valorile conductivității termice ale vaporilor de apă disociați în W/(m deg) la temperaturi de la 1400 la 6000 K și la presiuni de la 0,1 la 100 atm.
Conform tabelului, conductivitatea termică a vaporilor de apă la temperaturi mari crește semnificativ în zona 3000...5000 K. La presiuni mari, coeficientul maxim de conductivitate termică se realizează la temperaturi mai ridicate.
Atenție! Conductivitatea termică din tabel este dată puterii lui 10 3 . Nu uitați să împărțiți la 1000!
Tema „Cupluri saturate. Umiditatea ”pentru școlari este destul de complicată. În cadrul lecțiilor i se acordă puțină atenție, iar fenomenele considerate de interacțiune interfață lichid-vapori sunt neobișnuite.
Baza pentru rezolvarea problemelor de mai sus este ideea că lichidul și vaporii săi saturati se află într-o stare de echilibru dinamic, când ratele de evaporare și condensare sunt aceleași. Presiunea și concentrația moleculelor abur saturat depinde doar de temperatura acestuia. De asemenea, pentru a calcula caracteristicile aburului saturat, puteți utiliza ecuația Mendeleev-Claiperon.
De obicei, la examen, astfel de sarcini sunt rare. Cu toate acestea, sarcinile sunt foarte interesante și vă permit să simți diferențele dintre comportament gaze idealeși vapori saturati. În opinia noastră, după ce ați înțeles soluția lor, nu veți mai întâmpina dificultăți în înțelegerea acestui subiect.
Sarcina numărul 1. Presiune, numărul de molecule de vapori saturati dintr-un vas închis (partea A, nivel de bază)
Soluţie:
O situație tipică: într-un volum închis, vaporii și lichidul sunt în echilibru. Chiar și fără o indicație directă în textul problemei, este clar că aburul este saturat. Temperatura nu se modifică, ceea ce înseamnă că concentrația moleculelor de vapori este constantă, numărul și masa moleculelor sunt proporționale cu volumul. Dacă volumul scade de 3 ori, numărul de molecule va scădea și el de 3 ori.
Raspunsul numarul 4.
Sarcina numărul 2. Presiunea, masa, concentrația moleculelor de vapori saturati într-un vas închis (partea A, nivel de bază)

De fapt, aceeași problemă într-o formulare diferită.
Sarcina numărul 3. Citirile psicrometrului (Partea A, Linia de referință)

Soluţie:
Sarcina este de fapt munca de laborator pentru a măsura umiditatea cu un psicrometru, trebuie doar să preziceți citirea becului umed.
Pentru a rezolva, citim citirile termometrelor: uscat - 23, umed -16 grade Celsius. Conform tabelului, determinăm că aceasta corespunde cu 48% umiditate. Dacă umiditatea crește cu 7% (până la 55%), atunci (o găsim în aceeași linie a tabelului, în stânga) diferența dintre citirile termometrelor va deveni 6 grade. Prin urmare, umed va arăta 23-6=17 grade. Raspunsul numarul 3.
Sarcina numărul 4. Presiunea vaporilor saturați într-un vas închis (partea A, nivel ridicat)

Soluţie:
Într-un volum închis, vaporii și lichidul sunt în echilibru, prin urmare, vaporii sunt saturati. Pe măsură ce volumul crește, apa se va evapora și aburul va rămâne saturat cât mai mult timp posibil. Evident, toată apa se va evapora și aburul va rămâne saturat până când volumul se va dubla (deoarece masa lichidului este inițial egală cu masa vaporilor). În acest caz, presiunea nu se schimbă.
Odată cu o creștere suplimentară a volumului de vapori va înceta să fie saturată, parametrii săi pot fi descriși în termeni de proces izotermic. O creștere a volumului de încă 2 ori va duce la o scădere de două ori a presiunii.
În total, cu o creștere a volumului de 4 ori în acest sistem, presiunea va scădea de 2 ori.
Raspunsul numarul 2.
În varianta nr. 2 a testării, a existat o problemă inversă, dar putea fi rezolvată doar știind că la 100 de grade Celsius, presiunea vaporilor este de 100 kPa (1 atm), care este folosit în rezolvarea problemei nr. 6. Această valoare a presiunii este ușor de reținut, știind că fierberea unui lichid începe la o temperatură la care presiunea sa de vapori saturați devine egală cu presiunea exterioară.
Sarcina numărul 5. Dependența presiunii de volum pentru saturate și vapori nesaturați(partea C, nivel avansat)

Sarcina numărul 6. Nivelul apei într-un tub etanș cu vapori saturați (partea C, nivel ridicat)
Un tub de sticlă lat de aproximativ o jumătate de metru lungime, sigilat la un capăt, este umplut complet cu apă și așezat vertical cu capătul deschis în jos, scufundând fundul tubului câțiva centimetri într-un lighean cu apă. La temperatura camerei, tubul rămâne complet umplut cu apă. Apa din bazin este încălzită încet. Unde va fi setat nivelul apei din tub când apa din bazin începe să fiarbă? Explicați răspunsul folosind legile fizice.
Soluţie.
La temperatura camerei, apa ocupă întregul volum al tubului și nu se revarsă din el, deoarece presiunea vaporilor de apă saturați la temperatura camerei este foarte scăzută și un „gol toricellian” umplut cu vapori de apă saturați va apărea numai deasupra apei. dacă înălțimea coloanei de apă este de aproximativ 10 metri.
Pe măsură ce temperatura apei crește, presiunea vaporilor ei saturați crește până când, la punctul de fierbere, ea devine egală cu presiunea atmosferică externă.
Când temperatura se apropie de punctul de fierbere, deasupra apei va apărea o zonă plină cu vapori de apă saturati. Pe măsură ce temperatura crește și mai mult, nivelul apei din tub va scădea. La punctul de fierbere, presiunea vaporilor de apă saturați din tub este egală și presiune atmosferică, deci nivelul apei din tub și din bazin va fi același.
Sarcina numărul 7. Masa de abur saturat (partea A, linia de baza)

Soluţie:
Problema este ușor de rezolvat folosind ecuația Mendeleev-Claiperon, având în vedere că presiunea vaporilor saturați la o anumită temperatură este egală cu cea atmosferică.
În timpul evaporării, concomitent cu trecerea moleculelor de la lichid la vapor, are loc și procesul invers. Mișcându-se aleatoriu deasupra suprafeței lichidului, unele dintre moleculele care l-au părăsit revin din nou în lichid.
Presiunea aburului saturat.
Când vaporii saturați sunt comprimați, a căror temperatură este menținută constantă, echilibrul va începe mai întâi să fie perturbat: densitatea vaporilor va crește și, ca urmare, vor trece mai multe molecule din gaz în lichid decât din lichid în gaz; aceasta va continua până când concentrația de vapori în noul volum devine aceeași, corespunzătoare concentrației de vapori saturați la o temperatură dată (și echilibrul este restabilit). Acest lucru se explică prin faptul că numărul de molecule care părăsesc lichidul pe unitatea de timp depinde doar de temperatură.
Deci, concentrația de molecule de vapori saturati la temperatura constanta nu depinde de volumul ei.
Deoarece presiunea unui gaz este proporțională cu concentrația moleculelor sale, presiunea unui vapor saturat nu depinde de volumul pe care îl ocupă. Presiune p 0, la care lichidul este în echilibru cu vaporii săi, se numește presiunea aburului saturat.
Când aburul saturat este comprimat, cea mai mare parte este transformat în stare lichida. Un lichid ocupă un volum mai mic decât un vapor de aceeași masă. Ca urmare, volumul de vapori la o densitate constantă scade.
Dependența presiunii vaporilor saturați de temperatură.
Pentru un gaz ideal, dependență liniară presiunea față de temperatură la volum constant. Aplicat la abur saturat cu presiune p 0 această dependență este exprimată prin egalitatea:
p 0 = nkT.
Deoarece presiunea vaporilor saturați nu depinde de volum, atunci, prin urmare, depinde doar de temperatură.
Dependență determinată experimental p 0 (T) diferit de dependenta ( p 0 = nkT) pentru gaz ideal.
Odată cu creșterea temperaturii, presiunea vaporilor saturați crește mai repede decât presiunea unui gaz ideal (secțiunea curbei AB pe imagine). Acest lucru devine deosebit de evident dacă trasăm un izocor prin punct A(linie întreruptă). Acest lucru se întâmplă deoarece, atunci când lichidul este încălzit, o parte din acesta se transformă în vapori, iar densitatea vaporilor crește. Prin urmare, conform formulei ( p 0 = nkT), presiunea vaporilor saturați crește nu numai ca urmare a creșterii temperaturii lichidului, ci și datorită creșterii concentrației de molecule (densitatea) vaporilor. Principala diferență în comportamentul unui gaz ideal și al aburului saturat este modificarea masei aburului cu o schimbare a temperaturii la un volum constant (într-un vas închis) sau cu o modificare a volumului la o temperatură constantă. Nimic de genul acesta nu se poate întâmpla cu un gaz ideal (teoria cinetică moleculară a unui gaz ideal nu prevede faza de tranzitie gaz la lichid).
După evaporarea întregului lichid, comportamentul vaporilor va corespunde comportamentului unui gaz ideal (secțiunea soare curba din figura de mai sus).
abur nesaturat.
Dacă într-un spațiu care conține vaporii unui lichid, poate avea loc o evaporare suplimentară a acestui lichid, atunci vaporii din acest spațiu sunt nesaturat.
Un vapor care nu este în echilibru cu lichidul său se numește nesaturat.
Vaporii nesaturați pot fi transformați într-un lichid prin simpla comprimare. Odată ce această transformare a început, vaporii aflati în echilibru cu lichidul devin saturati.
Pagina 1 din 5
7.1. Tabelul 8 prezintă presiunea vaporilor de apă care saturează spațiul la temperaturi diferite. Cum se face un tabel din aceste date m mase de vapori de apă în volum V \u003d 1 m 3 aer saturat cu vapori de apă la diferite temperaturi De exemplu, rezolvați problema la o temperatură t\u003d 50 ° C.
7.2. Aflați densitatea p și vaporii de apă saturati la temperatură t=50°C.

7.3. De câte ori densitatea pși vapori de apă saturati la o temperatură t= cu 16°C mai puțină densitate p apă.

7.4. Câte densități diferite p și 1 de vapori de apă saturați la o temperatură t 1 \u003d 200 ° C este mai mare decât densitatea p n2 vapori de apă saturați la o temperatură t 1 \u003d 100 ° C?

7.5. Care este masa m vapori de apa continuti in volum V\u003d 1m 3 de aer într-o zi de vară la o temperatură de t \u003d 30 ° C și umiditate relativă w = 0,75 ?

7.6. Într-un spațiu închis V= 1 m 3 umiditate relativă aer w = 0,6 la temperatură t\u003d 20 ° C. Care este masa d m apa trebuie încă evaporată din acest volum pentru ca vaporii de apă să devină saturati?

7.7. Temperatura camerei / g = 18 ° C, umiditate relativă co = 0,5 . S-a turnat apă rece într-un ibric de metal, care este temperatura tz apă, la care fierbătorul nu va mai aburi?


7.8. Găsiți un număr n molecule de vapori de apă saturați conținute într-o unitate de volum la o temperatură t 1 = 30 ° C.

7.9. Masa m=0,5 g vapori de apă ocupă volumul V 1\u003d 10 l la o temperatură de t \u003d 50 ° C, care este umiditatea relativă w? Ce masă dm de vapori va fi condensată dacă volumul este redus izotermic de la V 1 la V 2 \u003d V 1 / 2?


7.10. O cameră cu nor cu un volum de K = 1 litru conține aer saturat cu vapori de apă. Temperatura initiala camera r = 20 ° C. Când pistonul s-a deplasat, volumul camerei a crescut la
V 2 = 1,25k,. Expansiunea este considerată adiabatică, iar exponentul adiabatic este 1,4. Aflați: a) presiunea vaporilor de apă înainte de dilatare; b) masa m 1 vapori de apă în cameră înainte de expansiune; c) densitatea p 1 a vaporilor de apă înainte de dilatare; d) temperatura t2 abur după expansiune (neglijarea schimbărilor de temperatură din cauza degajării de căldură în timpul condensării aburului); e) masa dm abur condensat; f) densitate p2 vapor de apă
după condensare; g) gradul de suprasaturare, i.e. raportul dintre densitatea vaporilor de apă după expansiune (dar înainte de condensare) și densitatea vaporilor de apă care saturează spațiul la temperatura stabilită după condensare


7.11. Aflați volumul specific v al apei în stare lichidă și vapori în condiții normale.
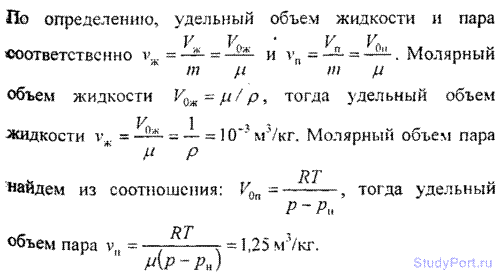
7.12. Folosind prima lege a termodinamicii și datele din tabelul 7 și 8, găsiți căldura specifică de vaporizare r apă la t = 200 ° C. Pentru apă, temperatura critică T la= 647 K, presiune critică p= 22 MPa. Verificați corectitudinea rezultatului obținut conform tabelului 9.
7.13. Ce parte din căldura de vaporizare a apei la o temperatură de t \u003d 100 ° C crește energie interna sisteme?

7.14. Căldura specifică de vaporizare a benzenului (C 6 H 6) la o temperatură t \u003d 77 ° C este egală cu r = 398 kJ/kg. Găsiți modificarea energiei interne d Wîn timpul evaporării masei dm = 20 g de benzen.

7.15. Folosind ecuația Clausius-Clapeyron și datele din tabelul 8, găsiți căldura specifică de vaporizare r
apă la o temperatură t = 5 ° C. Verificați corectitudinea rezultatului obținut conform tabelului 9.


7.16. Presiunea vaporilor de mercur saturat la temperaturi t 1 \u003d 100 ° C și t2 = 120 ° C sunt p 1 \u003d 37,3 Pa și p 2 \u003d 101,3 Pa.
Găsiți media căldura specifică vaporizare r mercur în intervalul de temperatură specificat.


7.17. Punctul de fierbere al benzenului (C 6 H 6) la o presiune p \u003d 0,1 MPa este t k \u003d 80,2 ° C. Aflați presiunea p vapori saturați de benzen la o temperatură t = 15,6° C. Valoarea medie a căldurii specifice de vaporizare a benzenului în acest interval de temperatură se ia egală cu r = 0,4 MJ/kg.

7.18. Presiunea vaporilor saturați de alcool etilic (C 2 H 5 OH) la temperaturi t 1 \u003d 40 ° C și t 2 \u003d 60 ° C sunt egale
p1 =17,7 kPa și p2 =67,9 kPa. Aflați modificarea entropiei dS în timpul evaporării masei d m = 1 G alcool etilic la o temperatură t\u003d 50 ° C.

7.19. Modificarea entropiei în timpul evaporării cantității dv \u003d 1 mol de lichid la o temperatură de t 1 \u003d 50 ° C este dS \u003d 133J / K. Presiunea vaporilor saturați la o temperatură t 1 = 50 ° C este p 1 = 12,33 kPa. Cu cât se modifică presiunea vaporilor saturați a unui lichid odată cu schimbarea temperaturii de la t 1 = 50°C până la t1\u003d 51 0 C?


7.20. Până la ce limită de presiune p se poate evacua vasul folosind o pompă de difuzie a mercurului care funcționează fără capcană de mercur dacă temperatura mantalei de apă a pompei este t = 15°C? Presiunea vaporilor saturați de mercur la o temperatură t 0 \u003d 0 ° C este p0\u003d 0,021 Pa, valoarea medie a căldurii specifice de vaporizare a mercurului în acest interval de temperatură este luată egală cu r = 10,08 MJ/kt.
DEFINIȚIE
vapor de apă- aceasta este stare gazoasă apă.
Nu are nici culoare, nici gust, nici miros. Apa este cea mai comună substanță în natură. Pe lângă faptul că există ca gaz, poate fi și în stare lichidă sau solidă (gheață), fiecare dintre acestea fiind determinată de temperatură și presiune (Fig. 1).
Orez. 1. Diagrama stării apei.
Curba AO corespunde echilibrului în sistemul gheață-abur, DO - echilibrului în sistemul suprarăcit apă-abur, curba OC - echilibrului în sistemul apă-abur și curba OB - echilibrului în sistemul gheata-apa. În punctul O, toate curbele se intersectează. Acest punct se numește punct tripluși corespunde echilibrului în sistemul gheață-apă-abur.
Formula empirică a vaporilor de apă coincide cu formula empirică a apei și are forma 2 O. După cum se știe, greutatea moleculară a unei molecule este egală cu suma relativă. mase atomice atomii care alcătuiesc molecula (valorile maselor atomice relative luate din Tabelul periodic al lui D.I. Mendeleev sunt rotunjite la numere întregi).
Mr(H20) = 2×Ar(H) + Ar(O);
Domnul(H 2 O) \u003d 2 × 1 + 16 \u003d 2 + 16 \u003d 18.
Masa molară (M) este masa a 1 mol dintr-o substanță. Este ușor de arătat că valorile numerice ale masei molare M și ale masei moleculare relative M r sunt egale, totuși, prima valoare are dimensiunea [M] = g/mol, iar a doua este adimensională:
M = N A × m (1 molecule) = N A × M r × 1 a.m.u. = (N A ×1 amu) × M r = × M r .
Înseamnă că Masă molară vaporii de apă sunt 18 g/mol.
Exemple de rezolvare a problemelor
EXEMPLUL 1
| Exercițiu | Câte grame de zinc au reacţionat cu acidul clorhidric dacă s-au format 0,5 g de hidrogen gazos? |
| Soluţie | Scriem ecuația reacției pentru interacțiunea zincului cu acidul clorhidric: Zn + 2HCl \u003d ZnCl 2 + H 2. Să aflăm masa molară a hidrogenului molecular (valoarea masei atomice relative, luată din Tabelul periodic al lui D.I. Mendeleev, va fi rotunjită la un număr întreg). Se știe că M \u003d Mr, ceea ce înseamnă (H 2) \u003d 2 × Ar (H) \u003d 2 × 1 \u003d 2 g / mol. Calculați cantitatea de substanță hidrogen: n(H)=m(H)/M(H); n (H) \u003d 0,5 / 2 \u003d 1 mol. Conform ecuației reacției n (H 2): n (Zn) \u003d 1: 1, ceea ce înseamnă că n (Zn) \u003d 1 mol. Să aflăm masa molară a zincului (valoarea masei atomice relative, luată din Tabelul periodic al lui D.I. Mendeleev, rotunjită la un număr întreg). Se știe că M = Mr, ceea ce înseamnă (Zn) = 65 g/mol. Determinați masa zincului: m(Zn) = n (Zn) × M (Zn); m(Zn) = 1 × 65 = 65 g. |
| Răspuns | Masa zincului este de 65 g. |
EXEMPLUL 2
| Exercițiu | Ce masă de oxid de cupru (II) este necesară pentru a obține 128 g de cupru din acesta atunci când este redus cu hidrogen? |
| Soluţie | Scriem ecuația pentru reducerea oxidului de cupru (II) cu hidrogen: CuO + H 2 \u003d Cu + H 2 O. Să aflăm masa molară a cuprului (valoarea masei atomice relative, luată din Tabelul periodic al lui D.I. Mendeleev, rotunjită la un număr întreg). Se știe că M = Mr, ceea ce înseamnă (Cu) = 64 g/mol. Calculați cantitatea de substanță de cupru: n(Cu)= m(Cu)/ M(Cu); n (Cu) \u003d 128/ 64 \u003d 2 mol. Conform ecuației reacției n(Cu) :n(CuO) = 1: 1, deci n(CuO) = 2 mol. Să găsim masa molară a oxidului de cupru (II) (valorile maselor atomice relative luate din Tabelul periodic al lui D.I. Mendeleev sunt rotunjite la numere întregi). După cum se știe, masa molară a unei molecule este egală cu suma maselor atomice relative ale atomilor care alcătuiesc molecula (M = Mr): M(CuO) = Ar(Cu) + Ar(O) = 64 + 16 = 80 g/mol. Să determinăm masa oxidului de cupru (II): m(CuO) = n(CuO) × M(CuO); m(CuO) \u003d 2 × 80 \u003d 160 g. |
| Răspuns | Masa oxidului de cupru (II) este de 160 g |






