Tensiunea superficială a apei
Parte principală.
Pentru a înțelege proprietățile și modelele de bază stare lichida substanțe, trebuie luate în considerare următoarele aspecte:
Structura lichidului. Mișcarea moleculelor lichide.
Un fluid este ceva care poate curge.
Așa-numita ordin de rază scurtă este observată în aranjamentul particulelor lichide. Aceasta înseamnă că, în ceea ce privește orice particulă, locația celor mai apropiați vecini este ordonată.
Cu toate acestea, pe măsură ce se îndepărtează de o anumită particulă, aranjarea altor particule în raport cu aceasta devine din ce în ce mai puțin ordonată și destul de repede ordinea în aranjamentul particulelor dispare complet.
Moleculele lichide se mișcă mult mai liber decât moleculele solide, deși nu la fel de liber ca moleculele de gaz.
Fiecare moleculă de lichid de ceva timp se mișcă ici și colo, fără a se îndepărta, însă, de vecinii săi. Dar, din când în când, o moleculă lichidă iese din mediul său și merge în alt loc, intrând într-un mediu nou, unde din nou de ceva timp face mișcări similare cu oscilațiile. Un merit semnificativ în dezvoltarea unui număr de probleme în teoria stării lichide aparține omului de știință sovietic Ya. I. Frenkel.
Potrivit lui Frenkel, mișcarea termică în lichide are următorul caracter. Fiecare moleculă oscilează în jurul unei anumite poziții de echilibru pentru un timp. Din când în când, molecula își schimbă locul de echilibru, sărind într-o nouă poziție, separată de cea anterioară printr-o distanță de ordinul mărimii moleculelor înseși. Adică, moleculele se mișcă lent în interiorul lichidului, rămânând o parte din timp în apropierea anumitor locuri.Astfel, mișcarea moleculelor unui lichid este ceva ca un amestec de mișcări într-un solid și într-un gaz: mișcare oscilantăîntr-un loc este înlocuită de o trecere liberă dintr-un loc în altul.
Presiunea lichidului
Experiența de zi cu zi ne învață că lichidele acționează cu forțe cunoscute pe suprafața solidelor aflate în contact cu ele. Aceste forțe se numesc forțe de presiune a fluidului.
Acoperind deschiderea unui robinet de apă deschis cu un deget, simțim forța presiunii lichidului asupra degetului. Dureri de urechi resimțite de un înotător după scufundare adâncime mare, cauzată de forțele presiunii apei asupra timpan ureche. Termometrele de adâncime trebuie să fie foarte puternice, astfel încât presiunea apei să nu le zdrobească.
Presiunea dintr-un lichid se datorează unei modificări a volumului său - compresie. În raport cu o modificare a volumului, lichidele au elasticitate. Forțele elastice dintr-un fluid sunt forțe de presiune. Astfel, dacă un fluid acționează cu forțe de presiune asupra corpurilor în contact cu el, aceasta înseamnă că este comprimat. Deoarece densitatea unei substanțe crește în timpul compresiei, se poate spune că lichidele au elasticitate în raport cu o modificare a densității.
Presiunea dintr-un lichid este perpendiculară pe orice suprafață plasată în lichid. Presiunea din lichid la adâncimea h este egală cu suma presiunii de la suprafață și o valoare proporțională cu adâncimea:
Datorita faptului ca lichidele pot transmite presiune statica, practic nu mai mica decat densitatea lor, ele pot fi folosite in aparate care dau un castig de rezistenta: presa hidraulica.
Legea lui Arhimede
Forțele de presiune acționează pe suprafața unui corp solid scufundat într-un lichid. Deoarece presiunea crește odată cu adâncimea, forțele de presiune în sus de pe fundul fluidului sunt mai mari decât forțele de jos de pe partea superioară și ne putem aștepta ca rezultanta forțelor de presiune să fie în sus. Forța rezultantă de presiune asupra unui corp scufundat într-un lichid se numește forța de susținere a lichidului.
Dacă un corp scufundat într-un lichid este lăsat singur, atunci se va scufunda, rămâne în echilibru sau va pluti la suprafața lichidului, în funcție de faptul dacă forța de susținere este mai mică decât forța gravitațională care acționează asupra corpului, egală cu ea sau mai mare decât ea.
Principiul lui Arhimede afirmă că un corp dintr-un fluid este supus unei forțe de plutire în sus egală cu greutatea fluidului deplasat. Un corp scufundat într-un lichid este supus unei forțe de plutire (numită forță Arhimede)
![]()
unde ρ este densitatea lichidului (gazului), este accelerația cădere liberă, A V- volumul corpului scufundat (sau partea din volum a corpului sub suprafață).
Dacă un corp scufundat într-un lichid este suspendat de o cântar, atunci cântarul arată diferența dintre greutatea corpului în aer și greutatea lichidului deplasat. Prin urmare, legii lui Arhimede i se dă uneori următoarea formulare: un corp scufundat într-un lichid pierde în greutate atât de mult cât cântărește lichidul deplasat de acesta.
Este interesant de observat un astfel de fapt experimental că, aflându-se în interiorul unui alt lichid de un mai mare gravitație specifică, lichidul conform legii lui Arhimede „își pierde” din greutate și își ia forma naturală, sferică.
Evaporare
In stratul superficial si in apropierea suprafetei lichidului actioneaza forte care asigura existenta suprafetei si nu permit ca moleculele sa paraseasca din volumul lichidului. Datorită mișcării termice, unele dintre molecule au viteze suficient de mari pentru a depăși forțele care țin moleculele în lichid și a părăsi lichidul. Acest fenomen se numește evaporare. Se observă la orice temperatură, dar intensitatea sa crește odată cu creșterea temperaturii.
Dacă moleculele care au părăsit lichidul sunt îndepărtate din spațiul de lângă suprafața lichidului, atunci, în final, tot lichidul se va evapora. Dacă moleculele care au părăsit lichidul nu sunt îndepărtate, ele formează vapori. Moleculele de vapori care au căzut în regiunea din apropierea suprafeței lichidului sunt atrase în lichid de forțele de atracție. Acest proces se numește condensare.
Astfel, dacă moleculele nu sunt îndepărtate, viteza de evaporare scade cu timpul. Odată cu o creștere suplimentară a densității vaporilor, se ajunge la o situație în care numărul de molecule care părăsesc lichidul într-un anumit timp va fi egal cu numărul de molecule care se întorc în lichid în același timp. Apare o stare de echilibru dinamic. Vaporii aflati in stare de echilibru dinamic cu un lichid se numesc saturati.
Pe măsură ce temperatura crește, densitatea și presiunea vaporilor saturați cresc. Cu cât temperatura este mai mare, cu atât Mai mult moleculele unui lichid au energie suficientă pentru evaporare și densitatea vaporilor trebuie să fie mai mare, astfel încât condensarea să poată fi egală cu evaporarea.
Fierbere
Când un lichid este încălzit la o temperatură la care presiunea vapori saturati egală cu presiunea exterioară se stabilește un echilibru între lichid și acesta abur saturat. Când o cantitate suplimentară de căldură este comunicată lichidului, masa corespunzătoare de lichid este imediat convertită în abur. Acest proces se numește fierbere.
Fierberea este evaporarea intensă a unui lichid, care are loc nu numai de la suprafață, ci în întregul său volum, în interiorul bulelor de vapori rezultate. Pentru a trece de la lichid la vapori, moleculele trebuie să dobândească energia necesară pentru a depăși forțele atractive care le țin în lichid. De exemplu, pentru a evapora 1 g de apă la o temperatură de 100 ° C și o presiune corespunzătoare presiunii atmosferice la nivelul mării, este necesar să cheltuiți 2258 J, dintre care 1880 merg pentru a separa moleculele de lichid, iar restul merg sa lucreze la cresterea volumului ocupat de sistem, impotriva fortelor presiune atmosferică(1 g de vapori de apă la 100°C și presiune normală ocupă un volum de 1,673 cm3, în timp ce 1 g de apă în aceleași condiții este de doar 1,04 cm3).
Punctul de fierbere este temperatura la care presiunea vaporilor devine egală cu presiunea exterioară. Pe măsură ce presiunea crește, punctul de fierbere crește, iar pe măsură ce presiunea scade, aceasta scade.
Datorită schimbării presiunii în lichid cu înălțimea coloanei sale, fierbinte diverse niveluriîntr-un lichid apare, strict vorbind, la diferite temperaturi. Doar o anumită temperatură abur saturat deasupra suprafeței lichidului care fierbe. Temperatura sa este determinată numai de presiunea externă. La această temperatură se înțelege atunci când vorbim despre punctul de fierbere.
Punctele de fierbere ale diferitelor lichide sunt foarte diferite unele de altele, iar acest lucru este utilizat pe scară largă în tehnologie, de exemplu, în distilarea produselor petroliere.
Cantitatea de căldură care trebuie furnizată pentru a transforma izoterm o anumită cantitate de lichid în vapori, la o presiune externă egală cu presiunea vaporilor săi saturați, se numește căldură latentă de vaporizare. De obicei, această valoare este legată de un gram sau o molă. Cantitatea de căldură necesară pentru evaporarea izotermă a unui mol de lichid se numește căldură molară latentă de vaporizare. Dacă această valoare este împărțită la greutatea moleculară, atunci specificul căldură latentă vaporizare.
Tensiunea superficială a lichidului
Proprietatea unui lichid de a-și reduce suprafața la minim se numește tensiune superficială. Tensiunea superficială este un fenomen de presiune moleculară asupra unui lichid, cauzat de atracția moleculelor din stratul de suprafață către moleculele din interiorul lichidului. La suprafața unui lichid, moleculele experimentează forțe care nu sunt simetrice. Pe molecula din interiorul lichidului, în medie, forța de atracție, de coeziune, acționează în medie uniform din toate părțile. Dacă suprafața lichidului este mărită, atunci moleculele se vor mișca împotriva acțiunii forțelor de reținere. Astfel, forța care tinde să scurteze suprafața lichidului acționează în direcția opusă forței exterioare de tracțiune de pe suprafață. Această forță se numește forță de tensiune superficială și se calculează prin formula:
Coeficient de tensiune de suprafață ()
Lungimea limitei suprafeței lichide
Rețineți că lichidele care se evaporă ușor (eter, alcool) au o tensiune superficială mai mică decât lichidele nevolatile (mercur). Tensiunea superficială a hidrogenului lichid și, în special, a heliului lichid este foarte scăzută. În metalele lichide, tensiunea superficială, dimpotrivă, este foarte mare. Diferența de tensiune superficială a lichidelor se explică prin diferența dintre forțele de coeziune ale diferitelor molecule.
Măsurătorile tensiunii superficiale a unui lichid arată că tensiunea superficială depinde nu numai de natura lichidului, ci și de temperatura acestuia: odată cu creșterea temperaturii, diferența de densitate a lichidului scade și, prin urmare, coeficientul de tensiunea superficială – scade.
Datorită tensiunii superficiale, orice volum de lichid tinde să reducă suprafața, reducând astfel energia potențială. Tensiunea superficială este una dintre forțele elastice responsabile de mișcarea ondulațiilor pe apă. În umflături, gravitația de suprafață și tensiunea superficială trage particulele de apă în jos, având tendința de a face suprafața netedă din nou.
Filme lichide
Toată lumea știe cât de ușor este să scoți spuma din apa cu săpun. Spuma este un set de bule de aer delimitate de cea mai subțire peliculă de lichid. O peliculă separată poate fi obținută cu ușurință din lichidul care formează spumă.
Aceste filme sunt foarte interesante. Pot fi extrem de subțiri: în părțile cele mai subțiri, grosimea lor nu depășește o sută de miimi de milimetru. În ciuda subțirii lor, sunt uneori foarte stabili. Filmul de săpun poate fi întins și deformat, iar un curent de apă poate curge prin pelicula de săpun fără a o distruge.
Cum se poate explica stabilitatea filmelor? O condiție indispensabilă pentru formarea unui film este adăugarea de substanțe solubile în acesta la un lichid pur, în plus, cele care reduc foarte mult tensiunea superficială.
În natură și tehnologie, de obicei ne întâlnim nu cu filme individuale, ci cu o colecție de filme - spumă. Puteți vedea adesea în pâraie, unde pâraiele mici cad în apă calmă, o formare abundentă de spumă. În acest caz, capacitatea apei de a spuma este asociată cu prezența în apă a unei substanțe organice speciale eliberate din rădăcinile plantelor. În echipamentele de construcții se folosesc materiale care au o structură celulară, cum ar fi spuma. Astfel de materiale sunt ieftine, ușoare, nu conduc căldura și sunetul bine și sunt suficient de puternice. Pentru fabricarea lor, la soluțiile din care se formează materialele de construcție se adaugă substanțe care favorizează spumarea.
umezire
Picăturile mici de mercur plasate pe o placă de sticlă capătă o formă sferică. Acesta este rezultatul forțelor moleculare care tind să reducă suprafața lichidului. Mercurul plasat pe suprafața unui solid nu formează întotdeauna picături rotunde. Se întinde pe placa de zinc, iar suprafața totală a picăturii va crește fără îndoială.
O picătură de anilină este, de asemenea, sferică numai atunci când nu atinge peretele vasului de sticlă. De îndată ce atinge peretele, se lipește imediat de sticlă, întinzându-se de-a lungul lui și dobândind o suprafață comună mare.
Acest lucru se explică prin faptul că, în cazul contactului cu un corp solid, forțele de aderență ale moleculelor lichide cu moleculele corpului solid încep să joace un rol semnificativ. Comportamentul unui lichid va depinde de care este mai mare: aderența dintre moleculele lichide sau aderența unei molecule lichide la o moleculă solidă. În cazul mercurului și sticlei, forțele de coeziune dintre mercur și moleculele de sticlă sunt mici în comparație cu forțele de coeziune dintre moleculele de mercur, iar mercurul se adună într-o picătură.
Un astfel de lichid se numește neumezitoare solid. În cazul mercurului și zincului, forțele de coeziune dintre moleculele lichidului și solidului depășesc forțele de coeziune care acționează între moleculele lichidului, iar lichidul se răspândește peste solid. În acest caz, lichidul se numește umezire solid.
De aici rezultă că, vorbind despre suprafața unui lichid, trebuie să avem în vedere nu numai suprafața în care lichidul se învecinează cu aerul, ci și suprafața care se învecinează cu alte lichide sau cu un corp solid.
În funcție de faptul că lichidul udă sau nu pereții vasului, forma suprafeței lichidului în punctul de contact cu peretele solid și gazul are o formă sau alta. În cazul neumezirii, forma suprafeței lichidului de la margine este rotundă, convexă. În cazul umezirii, lichidul de la margine ia o formă concavă.
Fenomene capilare
În viață, avem de-a face adesea cu corpuri străpunse de multe canale mici (hârtie, fire, piele, diverse Materiale de construcție, pământ, copac). Intrând în contact cu apa sau alte lichide, astfel de corpuri le absorb adesea. Aceasta este baza pentru acțiunea unui prosop la uscarea mâinilor, acțiunea unui fitil într-o lampă cu kerosen etc. Fenomene similare pot fi observate și în tuburile înguste de sticlă. Tuburile înguste sunt numite capilare sau păr.
Când un astfel de tub este scufundat cu un capăt într-un vas larg într-un vas larg, se întâmplă următoarele: dacă lichidul udă pereții tubului, atunci se va ridica peste nivelul lichidului din vas și, în plus, mai înalt, cu atât tubul este mai îngust; dacă lichidul nu udă pereții, atunci, dimpotrivă, nivelul lichidului din tub este setat mai jos decât într-un vas larg. Se numește modificarea înălțimii nivelului lichidului în tuburi înguste sau goluri capilaritate.În sens larg, fenomenele capilare sunt înțelese ca toate fenomenele datorate existenței tensiunii superficiale.
Înălțimea creșterii lichidului în tuburile capilare depinde de raza canalului din tub, de tensiunea superficială și de densitatea lichidului. Între lichidul din capilar și din vasul larg se stabilește o astfel de diferență de nivel h astfel încât presiunea hidrostatică rgh să echilibreze presiunea capilară:
unde s este tensiunea superficială a lichidului
R este raza capilară.
Înălțimea creșterii unui lichid într-un capilar este proporțională cu tensiunea superficială a acestuia și invers proporțională cu raza canalului capilar și cu densitatea lichidului (legea lui Jurin)
Răspunsuri la întrebări
1. Ce este tensiunea superficială și în ce unități se măsoară? Care sunt motivele apariției sale?
Tensiunea superficială este o caracteristică termodinamică a interfeței dintre două faze aflate în echilibru, determinată de munca de formare izotermocinetică reversibilă a unei unități de suprafață a acestei interfețe, cu condiția ca temperatura, volumul sistemului și potențialele chimice ale tuturor componentelor din ambele faze să rămână. constant.
Tensiunea superficială are o dublă semnificație fizică - energie (termodinamică) și forță (mecanică). Definiția energiei (termodinamice): tensiunea superficială este munca specifică de creștere a suprafeței atunci când aceasta este întinsă, cu condiția ca temperatura să fie constantă. Definiția forței (mecanice): Tensiunea superficială este forța care acționează pe unitatea de lungime a unei linii care limitează suprafața unui lichid.
Forța de tensiune superficială este direcționată tangențial la suprafața lichidului, perpendicular pe secțiunea conturului pe care acționează și este proporțională cu lungimea acestei secțiuni. Coeficientul de proporționalitate - forța pe unitatea de lungime a conturului - se numește coeficient de tensiune superficială. Se măsoară în newtoni pe metru. Dar este mai corect să definim tensiunea de suprafață ca energia (J) per unitate de rupere a suprafeței (m²). În acest caz, apare un sens fizic clar al conceptului de tensiune superficială.
Măsurat în J/m2.
2. Cum depinde tensiunea superficială de natura substanței care formează suprafața?
Tensiunea superficială depinde de natura lichidului, adică. asupra forțelor de atracție dintre moleculele unui lichid dat și asupra temperaturii (tensiunea superficială scade odată cu creșterea temperaturii).
3. Cum și de ce depinde tensiunea superficială de temperatură? Care este punctul critic de fierbere?
Pe măsură ce temperatura crește, tensiunea superficială scade și este egală cu zero la temperatura critică. Cea mai cunoscută dependență empirică a tensiunii superficiale de temperatură a fost propusă de Lorand Eötvös, așa-numita regulă Eötvös (ing. Eö televizorö s reguli). În prezent, s-a obținut o concluzie cu privire la dependența teoretică a tensiunii superficiale de temperatura din regiune până la temperaturile critice, ceea ce confirmă regula Eötvös.
4. Ce metode se folosesc pentru a determina tensiunea superficială a lichidelor și solidelor? Care este baza pentru măsurarea tensiunii superficiale a lichidelor prin metoda presiunii celei mai mari a unei bule de aer?
Metodele de determinare a tensiunii superficiale sunt împărțite în statice și dinamice. În metodele statice, tensiunea superficială este determinată la o suprafață formată care este în echilibru. Metodele dinamice sunt asociate cu distrugerea stratului de suprafață. În cazul măsurării tensiunii superficiale a soluțiilor (în special polimeri sau agenți tensioactivi), trebuie utilizate metode statice. În unele cazuri, echilibrul la suprafață poate apărea în câteva ore (de exemplu, în cazul soluțiilor concentrate de polimeri cu vâscozitate mare). Metodele dinamice pot fi aplicate pentru a determina tensiunea superficială de echilibru și tensiunea superficială dinamică. De exemplu, pentru o soluție de săpun după amestecare, tensiunea superficială este de 58 mJ/m², iar după decantare - 35 mJ/m². Adică, tensiunea superficială se modifică. Până la stabilirea unui echilibru, acesta va fi dinamic.
Metode statice:
Metoda creșterii capilare
metoda Wilhelmy
metoda picăturii sesile
Metodă de determinare prin forma unei picături suspendate.
Metoda picăturii rotative
Metode dinamice:
Metoda Du Nouy (metoda ruperii inelului).
Stalagmometrică sau metoda de numărare a picăturilor.
Metoda de presiune maximă a bulelor.
Metoda cu jet oscilant
Metoda undei staţionare
Metoda undelor calatorii
5. Ce se numește adsorbție și cum este caracterizată cantitativ? Scrieți ecuația fundamentală a adsorbției Gibbs și definiți excesul de adsorbție (D).
Adsorbția - o creștere a concentrației unui dizolvat la interfața a două faze (fază solidă - lichid, fază condensată - gaz) datorită forțelor necompensate ale interacțiunii intermoleculare la separarea fazelor. Adsorbția este un caz special de sorbție, procesul, inversul adsorbției - desorbție.
Adsorbția fizică este un proces spontan care vine cu o scădere a energiei de suprafață liberă și este descrisă de ecuația lui Gibbs: Г i = - (dσ/dμ i) t, unde Г i este excesul de componentă i în stratul de suprafață în comparație cu concentrația sa de echilibru în faza vrac; σ - tensiunea superficială; μ i - potenţialul chimic al componentei i-a; T este temperatura. Adsorbția fizică din soluții poate fi pozitivă (în care soluția este absorbită) sau negativă (în care este absorbit solventul). Substanțele cu adsorbție pozitivă care provoacă o scădere a tensiunii superficiale sunt numite tensioactive (surfactanți), iar negativ - inactive la suprafață (SIV).
Valoarea excesului de adsorbție Gibbs a fost calculată prin formula:
G= [( Cu-Cu R)V]/m
unde Г este excesul de adsorbție Gibbs, mmol/g; Cu– concentrația inițială de dimetilamină, mmol/dm3; Cu R– concentrația de echilibru a dimetilaminei, mmol/dm3; V este volumul soluției de testat, dm 3 ; m este masa probei de adsorbant, g.
6. Ce substanțe se numesc tensioactive, care este structura moleculelor lor?
Surfactanți ( surfactant) - compuși chimici care, concentrându-se pe interfața fazelor termodinamice, determină scăderea tensiunii superficiale.
Principala caracteristică cantitativă a agenților tensioactivi este activitatea de suprafață - capacitatea unei substanțe de a reduce tensiunea superficială la limita de fază - aceasta este derivata tensiunii superficiale în raport cu concentrația surfactantului, deoarece C tinde spre zero. Cu toate acestea, agenții tensioactivi au o limită de solubilitate (așa-numita concentrare criticămicelizarea sau CMC), cu realizarea cărora, atunci când se adaugă un agent tensioactiv într-o soluție, concentrația la limita de fază rămâne constantă, dar în același timp are loc autoorganizarea moleculelor de surfactant într-o soluție în vrac (formarea sau agregarea micelelor). ). Ca rezultat al acestei agregari, se formează așa-numitele micelii. O caracteristică distinctivă a formării micelelor este turbiditatea soluției de surfactant. Soluțiile apoase de agenți tensioactivi, în timpul formării micelelor, capătă și o nuanță albăstruie (nuanță gelatinoasă) datorită refracției luminii de către micelii.
De regulă, surfactanții sunt compuși organici care au amfifilstructura, adică moleculele lor conţin o parte polară, o componentă hidrofilă (grupe funcţionale -OH, -COOH, -SOOOH, -O- etc., sau, mai des, sărurile lor -ONa, -COONa, -SOOONa etc. .) și o parte nepolară (hidrocarbură), o componentă hidrofobă. Un exemplu de surfactant este săpunul obișnuit (un amestec de săruri de sodiu ale acizilor carboxilici grași -oleat, stearat de sodiu etc.) și SMS (detergenți sintetici), precum și alcooli, acizi carboxilici, amine etc.
Răspunsuri la întrebări
1. Definiți termenii: adsorbție, adsorbant, adsorbat, adsorbat.
Adsorbția (latină. anunț- pe, la; sorbeo- Absorb) - o creștere a concentrației unei substanțe dizolvate la interfața a două faze (fază solidă-lichid, fază condensată - gaz) datorită forțelor necompensate de interacțiune intermoleculară la separarea fazelor. Adsorbția este un caz special de sorbție, procesul invers de adsorbție – desorbție.
Adsorbanții sunt materiale naturale sau artificiale foarte dispersate, cu o suprafață specifică mare, pe care substanțele sunt adsorbite din gaze sau lichide în contact cu acestea. Adsorbanții sunt utilizați în măștile de gaz, ca purtători de catalizatori, pentru purificarea gazelor, alcoolilor, uleiurilor, pentru separarea alcoolilor, în rafinarea petrolului și în medicină pentru absorbția gazelor și a otrăvurilor.
Substanța absorbită, care se află încă în volumul fazei, se numește adsorbant, absorbit - adsorbat.
2. Care sunt caracteristicile adsorbției la interfața solid-lichid?
În timpul adsorbției la interfața solid-lichid, excesul de substanță adsorbită devine în funcție de concentrația molară a soluției.Adsorbția din soluții are diferențe semnificative față de adsorbția gazului. Acest lucru se datorează următoarelor motive:
nu numai solutul poate fi adsorbit pe adsorbant, ci și solventul în sine. Cu cât adsorbția solventului are loc mai bine, cu atât va fi mai dificilă adsorbția solutului;
solventul poate dizolva adsorbantul. Cu cât solventul dizolvă mai bine adsorbantul, cu atât este mai dificilă adsorbția;
viteza de adsorbție din soluție depinde de viteza de difuzie. Ca urmare a epuizării substanței extrase în straturile de apă adiacente adsorbantului, adsorbția ulterioară este determinată de viteza de difuzie a substanței absorbite la adsorbant. După cum se știe, difuzia în lichide este un proces destul de lent; prin urmare, pentru a accelera adsorbția, se recurge la amestecarea soluției.
Aceste trei caracteristici introduc erori semnificative în izoterma de adsorbție.
Regula de aliniere a polarității (M.A. Rebinder): pe adsorbanții polari, adsorbații polari din solvenți nepolari sunt cel mai bine adsorbiți, iar pe adsorbanții nepolari, adsorbații nepolari din solvenți polari sunt cel mai bine adsorbiți.
Absorbția unei substanțe dizolvate dintr-o soluție depinde de structura acesteia.
3. Care este suprafața specifică, ce metode de determinare cunoașteți?
Suprafața specifică este o caracteristică medie a dimensiunilor cavităților interne (canale, pori) ale unui corp poros sau ale particulelor unei faze zdrobite a unui sistem dispers.
Suprafața specifică este exprimată ca raportul dintre suprafața totală a unui corp poros sau dispersat într-un mediu dat și volumul sau masa acestuia. Suprafața specifică este proporțională cu dispersitatea sau, ceea ce este aceeași, invers proporțională cu dimensiunea particulelor fazei dispersate.
Suprafața specifică este determinată cel mai adesea de cantitatea de gaz inert adsorbită de material și de permeabilitatea la aer a stratului de pulbere sau material poros. Metodele de adsorbție oferă cele mai fiabile date.
Pentru a determina suprafața specifică și distribuția porilor de-a lungul razelor corpurilor poroase conform teoriei BET prin metoda sorbției azotului la temperatura azotului lichid, compania italiană Carlo Erba a produs dispozitivul Sorptomatic (timpul de măsurare este de aproximativ o probă pe zi).
În primul rând, să discutăm proprietățile speciale pe care le au moleculele stratului apropiat de suprafață al unui lichid în comparație cu moleculele în vrac.
Orez. 1. Diferența dintre moleculele stratului apropiat de suprafață și moleculele din cea mai mare parte a lichidului
Luați în considerare două molecule A și B. Molecula A se află în interiorul lichidului, molecula B se află la suprafața sa (Fig. 1). Molecula A este înconjurată de alte molecule lichide în mod uniform, astfel încât forțele care acționează asupra moleculei A din moleculele care cad în sfera interacțiunii intermoleculare sunt compensate sau rezultanta lor este zero.
Ce se întâmplă cu molecula B, care se află la suprafața lichidului? Amintiți-vă că concentrația de molecule de gaz care este deasupra lichidului este mult mai mică decât concentrația de molecule de lichid. Molecula B este înconjurată pe o parte de molecule lichide, iar pe de altă parte de molecule de gaz foarte rarefiate. Deoarece mult mai multe molecule acționează asupra acestuia din partea lichidului, rezultanta tuturor forțelor intermoleculare va fi direcționată în interiorul lichidului.
Astfel, pentru ca o moleculă din adâncimea lichidului să intre înăuntru Strat de suprafață, trebuie să lucrați împotriva forțelor intermoleculare necompensate.
Amintiți-vă că munca înseamnă schimbare. energie potențială luate cu semnul minus.
Aceasta înseamnă că moleculele stratului apropiat de suprafață, în comparație cu moleculele din interiorul lichidului, au energie potențială în exces.
Această energie în exces este o componentă a energiei interne a fluidului și se numește energie de suprafață. Este desemnată și se măsoară, ca orice altă energie, în jouli.
Evident, cu cât suprafața lichidului este mai mare, cu atât mai multe astfel de molecule care au exces de energie potențială și, prin urmare, cu atât energia de suprafață este mai mare. Acest fapt poate fi scris ca următoarea relație:
,
unde este aria suprafeței și este factorul de proporționalitate, pe care îl vom numi tensiune de suprafata, acest coeficient caracterizează unul sau altul lichid. Să scriem o definiție riguroasă a acestei cantități.
Tensiunea superficială a unui lichid (coeficientul tensiunii superficiale a unui lichid) este cantitate fizica, care caracterizează un lichid dat și este egal cu raportul dintre energia de suprafață și aria suprafeței lichidului
Coeficientul de tensiune superficială se măsoară în newtoni împărțit la un metru.
Să discutăm de ce depinde coeficientul de tensiune superficială a unui lichid. Pentru început, să reamintim că coeficientul de tensiune superficială caracterizează energia specifică a interacțiunii moleculelor, ceea ce înseamnă că factorii care modifică această energie vor modifica și coeficientul de tensiune superficială a lichidului.
Deci, coeficientul de tensiune superficială depinde de:
1. Natura lichidului (pentru lichidele „volatile”, precum eterul, alcoolul și benzina, tensiunea superficială este mai mică decât cea a „nevolatile” - apă, mercur și metale lichide).
2. Temperatura (cu cât temperatura este mai mare, cu atât tensiunea superficială este mai mică).
3. Prezența agenților tensioactivi care reduc tensiunea superficială (agenții tensioactivi), precum săpunul sau praful de spălat.
4. Proprietăţile unui gaz alăturat unui lichid.
Rețineți că coeficientul de tensiune superficială nu depinde de suprafața, deoarece pentru o moleculă individuală aproape de suprafață este absolut neimportant câte dintre aceleași molecule sunt în jur. Acordați atenție tabelului, care arată coeficienții tensiunii superficiale diverse substanțe, la o temperatură:
Tabelul 1. Coeficienții tensiunii superficiale a lichidelor la limita cu aerul, la
Deci, moleculele stratului apropiat de suprafață au un exces de energie potențială în comparație cu moleculele din cea mai mare parte a lichidului. În cursul mecanicii, s-a demonstrat că orice sistem tinde spre un minim de energie potențială. De exemplu, un corp aruncat de la o anumită înălțime va tinde să cadă. În plus, te simți mult mai confortabil întins, deoarece în acest caz centrul de masă al corpului tău este situat cât mai jos. La ce duce dorința de a-și reduce energia potențială în cazul unui lichid? Deoarece energia de suprafață depinde de suprafață, înseamnă că este nefavorabil din punct de vedere energetic ca orice lichid să aibă o suprafață mare. Cu alte cuvinte, în stare liberă, lichidul va tinde să-și minimizeze suprafața.
Acest lucru este ușor de verificat prin experimentarea cu o peliculă de săpun. Dacă un cadru de sârmă este scufundat într-o soluție de săpun, atunci se formează o peliculă de săpun pe acesta, iar filmul capătă o astfel de formă încât suprafața sa este minimă (Fig. 2).


Orez. 2. Cifre dintr-o soluție de săpun
Puteți verifica existența forțelor de tensiune superficială folosind un experiment simplu. Dacă un fir este legat de inelul de sârmă în două locuri și în așa fel încât lungimea firului să fie ceva mai mare decât lungimea coardei care leagă punctele de atașare ale firului, iar inelul de sârmă este scufundat în săpun soluție (Fig. 3a), pelicula de săpun va strânge întreaga suprafață a inelului, iar firul se va așeza pe folie de săpun. Dacă acum filmul este rupt pe o parte a firului, pelicula de săpun rămasă pe cealaltă parte a firului se va micșora și întinde firul (Fig. 3b).

Orez. 3. Experimentați pentru a detecta forțele de tensiune superficială
De ce s-a întâmplat asta? Cert este că soluția de săpun rămasă deasupra, adică lichidul, tinde să-și reducă suprafața. Astfel, firul este tras în sus.
Deci, suntem convinși de existența forței de tensiune superficială. Acum să învățăm cum să o calculăm. Pentru a face acest lucru, să facem un experiment de gândire. Să coborâm un cadru de sârmă, a cărui latură este mobilă, în soluția de săpun (Fig. 4). Vom întinde pelicula de săpun, acționând cu forță pe partea mobilă a cadrului. Astfel, există trei forțe care acționează asupra barei transversale - o forță externă și două forțe de tensiune superficială care acționează de-a lungul fiecărei suprafețe a filmului. Folosind a doua lege a lui Newton, putem scrie asta
![]()
Orez. 4. Calculul forței de tensiune superficială
Dacă se află sub influență forta externa bara transversală se va deplasa la o distanță, apoi această forță externă va face treaba
Desigur, datorită performanței acestei lucrări, suprafața filmului va crește, ceea ce înseamnă că va crește și energia de suprafață, ceea ce o putem determina prin coeficientul de tensiune superficială:
Modificarea zonei, la rândul său, poate fi determinată după cum urmează:
unde este lungimea părții mobile a cadrului de sârmă. Având în vedere acest lucru, putem scrie că munca forței externe este egală cu
Echivalând părțile potrivite în (*) și (**), obținem o expresie pentru forța de tensiune superficială:
Astfel, coeficientul de tensiune superficială este numeric egal cu puterea tensiunea superficială, care acționează pe unitatea de lungime a liniei care delimitează suprafața
Deci, am văzut din nou că lichidul tinde să ia o astfel de formă încât suprafața sa este minimă. Se poate demonstra că pentru un volum dat, aria suprafeței va fi minimă pentru o sferă. Astfel, dacă nicio altă forță nu acționează asupra fluidului sau dacă acțiunea lor este mică, fluidul va tinde să capete o formă sferică. Deci, de exemplu, apa se va comporta cu gravitație zero (Fig. 5) sau cu bule de săpun (Fig. 6).

Orez. 5. Apa în gravitate zero

Orez. 6. Baloane de săpun
Prezența forțelor de tensiune superficială poate explica și de ce un ac metalic „se întinde” pe suprafața apei (Fig. 7). Acul, care este așezat cu grijă pe suprafață, îl deformează, crescând astfel suprafața acestei suprafețe. Astfel, apare o forță de tensiune superficială, care tinde să reducă o astfel de modificare a zonei. Forța rezultantă a tensiunii superficiale va fi îndreptată în sus și va compensa forța gravitațională.
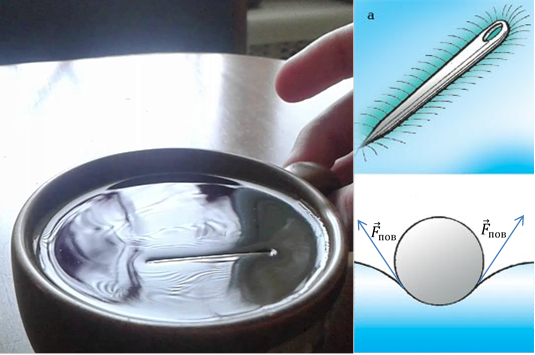
Orez. 7. Ac pe suprafața apei
Principiul de funcționare al pipetei poate fi explicat în același mod. Picătura, asupra căreia acționează forța gravitației, este trasă în jos, crescându-și astfel suprafața. În mod firesc, apar forțe de tensiune superficială, a căror rezultată este opusă direcției gravitației și care nu permit picăturii să se întindă (Fig. 8). Când apăsați pe capacul de cauciuc al pipetei, creați o presiune suplimentară care ajută la gravitație, determinând căderea picăturii.
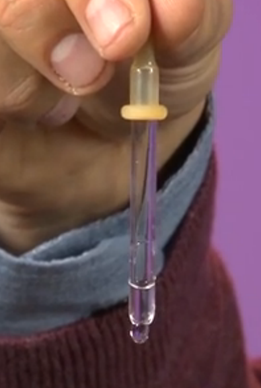
Orez. 8. Cum funcționează pipeta
Să luăm un alt exemplu de la Viata de zi cu zi. Dacă înmuiați o pensulă într-un pahar cu apă, firele de păr se vor umfla. Dacă scoți acum această perie din apă, vei observa că toate firele de păr sunt lipite unul de celălalt. Acest lucru se datorează faptului că suprafața apei care aderă la perie va fi atunci minimă.
Și încă un exemplu. Dacă doriți să construiți un castel de nisip uscat, este puțin probabil să reușiți, deoarece nisipul se va prăbuși sub influența gravitației. Cu toate acestea, dacă udați nisipul, acesta își va păstra forma datorită tensiunii superficiale a apei dintre boabele de nisip.
În cele din urmă, observăm că teoria tensiunii superficiale ajută la găsirea unor analogii frumoase și simple atunci când se rezolvă probleme mai complexe. sarcini fizice. De exemplu, atunci când trebuie să construiți o structură ușoară și în același timp puternică, fizica a ceea ce se întâmplă în bulele de săpun vine în ajutor. Și a fost posibil să se construiască primul model adecvat al nucleului atomic prin compararea acestuia nucleul atomic o picătură de lichid încărcat.
Bibliografie
- G. Ya. Myakishev, B. B. Buhovtsev, N. N. Sotsky. „Fizica 10”. - M.: Educație, 2008.
- Ya. E. Geguzin „Bubbles”, Biblioteca Kvant. - M.: Nauka, 1985.
- B. M. Yavorsky, A. A. Pinsky „Fundamentals of Physics” vol. 1.
- G. S. Landsberg „Manual elementar de fizică” vol. 1.
- Nkj.ru ().
- Youtube.com().
- Youtube.com().
- Youtube.com().
Teme pentru acasă
- După ce ați rezolvat sarcinile pentru această lecție, vă veți putea pregăti pentru întrebările 7,8,9 din GIA și întrebările A8, A9, A10 ale examenului unificat de stat.
- Gelfgat I.M., Nenashev I.Yu. "Fizică. Culegere de probleme nota 10 „5.34, 5.43, 5.44, 5.47 ()
- Pe baza problemei 5.47, determinați coeficientul de tensiune superficială a soluției de apă și săpun.
Lista de întrebări și răspunsuri
Întrebare: De ce se modifică tensiunea superficială odată cu temperatura?
Răspuns: Pe măsură ce temperatura crește, moleculele lichidului încep să se miște mai repede și, prin urmare, moleculele depășesc mai ușor forțele potențiale de atracție. Acest lucru duce la o scădere a forțelor de tensiune superficială, care sunt forțe potențiale care leagă moleculele stratului apropiat de suprafață al lichidului.
Întrebare: Coeficientul de tensiune superficială depinde de densitatea lichidului?
Răspuns: Da, da, deoarece energia moleculelor stratului apropiat de suprafață al lichidului depinde de densitatea lichidului.
Întrebare: Care sunt modalitățile de a determina coeficientul de tensiune superficială al unui lichid?
Răspuns: LA curs şcolar studiază două moduri de a determina coeficientul de tensiune superficială a unui lichid. Prima este metoda de rupere a firului, principiul ei este descris în problema 5.44 din teme pentru acasă, a doua este metoda de numărare a picăturilor descrisă în problema 5.47.
Întrebare: De ce se prăbușesc bulele de săpun după un timp?
Răspuns: Cert este că, după un timp, sub influența gravitației, bula devine mai groasă în partea de jos decât în partea de sus și apoi, sub influența evaporării, se prăbușește la un moment dat. Acest lucru are ca rezultat ca întreaga bulă să fie ca balon, se prăbușește sub acțiunea forțelor de tensiune superficială necompensate.
Moleculele unui lichid sunt situate foarte aproape unele de altele, astfel încât forțele de atracție ating o valoare semnificativă. Fiecare moleculă experimentează atracția din partea moleculelor învecinate.
Dacă molecula se află în interiorul lichidului (Fig. 16), atunci rezultanta forțelor care acționează asupra acesteia este zero. Situația este diferită dacă molecula se află în stratul superficial al lichidului. Densitatea vaporilor (sau gazului) cu care se învecinează lichidul este de multe ori mai mică decât densitatea lichidului, prin urmare rezultanta forțelor care acționează din partea moleculelor de vapori va fi, de asemenea, mult mai mică decât rezultanta forțelor. acţionând din partea moleculelor lichide. Ca urmare, fiecare moleculă situată în stratul de suprafață va fi afectată de o forță direcționată în interiorul lichidului.
Orez. 16. Apariția forțelor de tensiune superficială
Când o moleculă trece de la adâncimea lichidului la stratul de suprafață, lucru negativ este efectuat deasupra moleculei de forțele care acționează asupra acesteia în acest strat. în care energie kinetică molecula scade, transformându-se în potențial. Astfel, moleculele din stratul de suprafață au energie potențială suplimentară. Stratul de suprafață în ansamblu are energie suplimentară, care intră parte integrantăîn energie interna lichide.
Prezența acestei energii suplimentare face ca lichidul să aibă tendința de a-și reduce suprafața. Lichidul se comportă ca și cum ar fi închis într-o peliculă elastică întinsă care tinde să se micșoreze. De fapt, nu există peliculă, stratul de suprafață este format din aceleași molecule ca întregul lichid.
Să identificăm mental o secțiune de pe suprafața lichidă delimitată de un contur închis de lungime l. Tendința de contractare a acestei secțiuni duce la faptul că va acționa asupra restului suprafeței cu forțe tangențiale la suprafață. Aceste forțe se numesc forțe de tensiune superficială. Pentru cuantificare forțele de suprafață introduc o valoare numită coeficient de tensiune superficială (sau tensiune superficială).
Coeficientul de tensiune superficială (α) este o mărime fizică scalară egală cu raportul dintre modulul forței de tensiune superficială F, acţionând asupra limitei stratului de suprafaţă cu lungimea l, la această lungime:
 (33)
(33)
Pentru a schimba aria stratului de suprafață la temperatura constanta prin suma dS, trebuie făcută treaba
δA = αdS, (34)
unde α este coeficientul de tensiune superficială.
La schimbarea zonei din S1 inainte de S2 munca va fi egala cu:
A = α(S2 – S1). (35)
Când faceți lucrarea A, energia stratului de suprafață se modifică în funcție de cantitate ΔW.
A= ΔW.= α(S2 – S1) = αdS.
![]() (36)
(36)
Dimensiunea α:
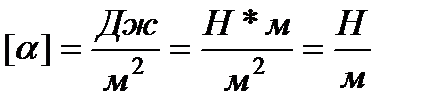 .
.
Astfel, poate fi dată încă o definiție a coeficientului de tensiune superficială.
Coeficientul de tensiune superficială este o mărime fizică scalară egală cu raportul dintre modificarea energiei potențiale a stratului de suprafață și modificarea suprafeței acestui strat.
Coeficientul de tensiune superficială depinde de compoziție chimică lichid și temperatura acestuia. Pe măsură ce temperatura crește, α scade și dispare la temperatura critică.
Tensiunea superficială depinde în mod semnificativ de impuritățile prezente în lichide. Substanțele care reduc tensiunea superficială a unui lichid se numesc surfactanți. Săpunul este cel mai cunoscut surfactant pentru apă. Își reduce semnificativ tensiunea superficială (aproximativ de la 7,5*10 -2 la 4,5*10 -2 N/m). În ceea ce privește apa, eteri, alcooli, uleiuri etc. sunt tensioactivi. Din punct de vedere molecular, influența surfactanților se explică prin faptul că forțele de atracție dintre moleculele unui lichid sunt mai mari decât forțele de atracție dintre moleculele unui lichid și o impuritate. Moleculele lichide din stratul de suprafață sunt atrase în lichide cu o forță mai mare decât moleculele de impurități. Ca rezultat, moleculele lichide se deplasează din stratul de suprafață adânc în acesta, iar moleculele de surfactant sunt deplasate la suprafață.
Surfactanții sunt utilizați ca agenți de umectare, reactivi de flotație, agenți de spumă, dispersanți - reductori de duritate, aditivi de plastifiare, modificatori de cristalizare etc.
Tot ceea ce s-a spus despre condițiile speciale în care se găsesc moleculele stratului de suprafață se aplică în întregime și solidelor. Prin urmare, solidele, ca și lichidele, au tensiune superficială.
Când luăm în considerare fenomenele de la interfață diverse medii trebuie avut în vedere că energia de suprafață a unui lichid sau solid depinde nu numai de proprietățile lichidului sau solidului dat, ci și de proprietățile substanței cu care se învecinează. Strict vorbind, este necesar să se ia în considerare energia totală de suprafață α 12 a două substanțe alăturate. Numai dacă o substanță este gazoasă, nu reacționează chimic cu o altă substanță și se dizolvă puțin în ea, putem vorbi pur și simplu de energia de suprafață (sau coeficientul de tensiune superficială) a celui de-al doilea corp lichid sau solid.

Orez. 17. Limita corpului lichid, gazos și solid
Dacă trei substanțe se învecinează simultan: solide, lichide și gazoase (Fig. 17), atunci întregul sistem capătă o configurație corespunzătoare minimului energiei potențiale totale (suprafață, în câmpul gravitațional etc.) . În special, conturul de-a lungul căruia se învecinează toate cele trei substanțe este situat pe suprafața unui corp solid în așa fel încât suma proiecțiilor tuturor forțelor de tensiune superficială aplicate fiecărui element al conturului pe direcția în care elementul de contur se poate deplasa (adică pe direcția tangentei la suprafața unui corp solid) a fost egal cu zero. Din fig. 17 rezultă că condiția de echilibru pentru un element de contur cu o lungime Δl se va scrie astfel:
Δlα TG = Δlα TG + Δlα TG cosθ (37)
Unde α TG, α TG iar α ZhG sunt coeficienții tensiunii superficiale la limitele: solid - gaz, solid - lichid și lichid - gaz.
Unghiul θ măsurat în interiorul lichidului între tangentele la suprafața solidului și la suprafața lichidului se numește unghi de contact. Conform (37)
 . (38)
. (38)
Unghiul de contact se determină prin expresia (38) numai cu condiţia ca
 . (39)
. (39)
Dacă (39) nu este satisfăcută, i.e. |α TG – α TG | > α ZhG, nu se poate stabili un echilibru pentru orice valoare a lui θ. Acest lucru are loc în două cazuri.
1) α TG > α TG + α FG. Indiferent cât de mic este unghiul θ, forța α TG depășește celelalte două (Fig. 18, a). În acest caz, lichidul se răspândește la infinit pe suprafața unui corp solid - există umezire completă. Înlocuirea suprafeței solid - gaz cu două suprafețe, solid - lichid și lichid - gaz, se dovedește a fi favorabilă din punct de vedere energetic. Cu umezirea completă, unghiul de contact este zero.
2) α TG > α TG + α FG. Indiferent cât de aproape este unghiul θ de π, forța α TL depășește celelalte două (Fig. 18,b). Înlocuirea suprafeței solid-lichid cu două suprafețe, solid-gaz și lichid-gaz, se dovedește a fi favorabilă din punct de vedere energetic. Cu neumezire completă, unghiul de contact este egal cu π .

Orez. 18. Udare completă și neumezire completă
Dacă condiția (39) este îndeplinită, unghiul de contact se poate dovedi acut sau obtuz, în funcție de raportul dintre α TG și α TG. Dacă α TG > α TG, atunci cosθ > 0 și unghiul θ este acut (Fig. 19a). În acest caz, are loc umezirea parțială. Dacă α TG< α ТЖ, то cosθ < 0, и угол θ - тупой (рис. 19,б). В этом случае имеет место частичное несмачивание.

Fig.19. Udare parțială și neumezire parțială
Tensiunea superficială a apei este una dintre cele mai interesante proprietăți ale apei.
Iată o definiție a acestui termen dintr-o sursă competentă.
Tensiunea superficială este...
Marea Enciclopedie Medicală
Tensiunea superficială (P. n.) este forța de atracție cu care fiecare secțiune a peliculei de suprafață (suprafața liberă a unui lichid sau orice interfață dintre două faze) acționează asupra părților adiacente ale suprafeței. Presiunea internă și P. n. Stratul de suprafață al lichidului se comportă ca o membrană elastică întinsă. Conform ideii dezvoltate de Cap. arr. Laplace (Laplace), această proprietate a suprafețelor lichide depinde de „forțele moleculare de atracție, care scad rapid cu distanța. În interiorul unui lichid omogen, forțele care acționează asupra fiecărei molecule din moleculele care o înconjoară sunt echilibrate reciproc. Dar aproape de suprafață, rezultanta forțelor de atracție moleculară este îndreptată spre interior; tinde să atragă molecule de suprafață în cea mai mare parte a lichidului. Ca urmare, întregul strat de suprafață, ca o peliculă elastică întinsă, exercită o presiune foarte semnificativă asupra masei interne a lichidului în direcția normală la suprafață. Conform calculelor, această „presiune internă”, sub care se află întreaga masă a lichidului, ajunge la câteva mii de atmosfere. Crește pe o suprafață convexă și scade pe una concavă. În virtutea tendinței energiei libere la minim, orice lichid tinde să ia o formă la care suprafața sa - locul de acțiune al forțelor de suprafață - are cea mai mică valoare posibilă. Cu cât suprafața lichidului este mai mare, cu atât este mai mare suprafața ocupată de filmul său de suprafață, cu atât este mai mare cantitatea de energie de suprafață liberă eliberată în timpul contracției sale. Tensiunea cu care fiecare secțiune a peliculei suprafeței contractante acționează asupra părților adiacente (în direcția paralelă cu suprafața liberă) se numește tensiune de tensiune. Spre deosebire de tensiunea elastică a unui corp elastic întins, P. n. nu slăbește pe măsură ce filmul de suprafață este comprimat. … Tensiunea de suprafață este egală cu munca care trebuie făcută pentru a crește suprafața liberă a lichidului cu una. P. n. observat la limita unui lichid cu un gaz (tot cu vapori proprii), cu un alt lichid nemiscibil sau cu un corp solid. În același mod, un corp solid are un P. n. la interfaţa cu gazele şi lichidele. Spre deosebire de P. n., un lichid tăiat (sau corp solid) are pe suprafața sa liberă, învecinată cu un mediu gazos, tensiune pe limita interioară a două faze lichide (sau lichide și solide), este convenabil să se desemneze un termen special. adoptat în literatura germană, termenul „tensiune de frontieră” (Grenzflachenspannung). Dacă se dizolvă în lichid, coborând-o P. n., atunci energie gratis scade nu numai prin reducerea dimensiunii suprafeței limită, ci și prin adsorbție: o substanță activă la suprafață (sau activă capilar) este colectată într-o concentrație crescută în stratul de suprafață ...
…Enciclopedie medicală mare. 1970
Toate cele de mai sus pot fi rezumate în acest fel - moleculele care se află pe suprafața oricărui lichid, inclusiv a apei, sunt atrase de restul moleculelor din interiorul lichidului, în urma cărora apare tensiunea superficială. Subliniem că aceasta este o înțelegere simplificată a acestei proprietăți.
Tensiunea superficială a apei
Pentru o mai bună înțelegere a acestei proprietăți, prezentăm mai multe manifestări ale tensiunii superficiale a apei în viața reală:
- Când vedem cum apa picură din vârful robinetului și nu se toarnă, aceasta este tensiunea superficială a apei;
- Când o picătură de ploaie în zbor ia o formă rotunjită, ușor alungită, aceasta este tensiunea superficială a apei;
- Când apa de pe o suprafață impermeabilă capătă o formă sferică, aceasta este tensiunea superficială a apei;
- Ondulările care apar atunci când vântul suflă la suprafața corpurilor de apă este, de asemenea, o manifestare a tensiunii superficiale a apei;
- Apa din spațiu capătă o formă sferică datorită tensiunii superficiale;
- Insecta strider de apă rămâne la suprafața apei datorită tocmai acestei proprietăți a apei;
- Dacă un ac este așezat cu grijă pe suprafața apei, acesta va pluti;
- Dacă într-un pahar se toarnă alternativ lichide de densitate și culoare diferită, vom vedea că nu se amestecă;
- Baloanele de săpun iridescente sunt, de asemenea, o manifestare minunată a tensiunii superficiale.
Coeficientul de tensiune superficială
Dicționar terminologic explicativ politehnic
Coeficientul de tensiune superficială este forța liniară a tensiunii superficiale pe suprafața unui lichid sau la interfața dintre două lichide nemiscibile.
Politehnică terminologică dicţionar. Alcătuit de: V. Butakov, I. Fagradyants. 2014
Mai jos oferim valorile coeficientului de tensiune superficială (C.T.S.) pentru diferite lichide la o temperatură de 20 ° C:
- K. p. n. acetonă - 0,0233 Newton / metru;
- K. p. n. benzen - 0,0289 Newton / metru;
- K. p. n. apă distilată - 0,0727 Newton / metru;
- K. p. n. glicerina - 0,0657 Newton / metru;
- K. p. n. kerosen - 0,0289 Newton / metru;
- K. p. n. mercur - 0,4650 Newton / metru;
- K. p. n. alcool etilic - 0,0223 Newton / metru;
- K. p. n. eter - 0,0171 Newton / metru.
Coeficientul de tensiune superficială al apei
Coeficientul de tensiune superficială depinde de temperatura lichidului. Să prezentăm valorile sale pentru diverse temperaturi apă.
- La o temperatură de 0 ° C - 75,64 σ, 10 -3 Newton / metru;
- La o temperatură de 10 ° C - 74,22 σ, 10 -3 Newton / metru;
- La o temperatură de 20 ° C - 72,25 σ, 10 -3 Newton / metru;
- La o temperatură de 30°C - 71,18 σ, 10 -3 Newton/Metru;
- La o temperatură de 40 ° C - 69,56 σ, 10 -3 Newton / metru;
- La o temperatură de 50 ° C - 67,91 σ, 10 -3 Newton / metru;
- La o temperatură de 60 ° C - 66,18 σ, 10 -3 Newton / metru;
- La o temperatură de 70 ° C - 64,42 σ, 10 -3 Newton / metru;
- La o temperatură de 80 ° C - 62,61 σ, 10 -3 Newton / metru;
- La o temperatură de 90°C - 60,75 σ, 10 -3 Newton/Metru;
- La o temperatură de 100°C - 58,85 σ, 10 -3 Newton/Metru.






