Spectrul de emisie al atomului de hidrogen formula lui Balmer. Studierea spectrului atomului de hidrogen
Cel mai simplu dintre atomi, atomul de hidrogen, a fost un fel de obiect de testare pentru teoria lui Bohr. Până când teoria a fost creată, aceasta fusese bine studiată experimental. Se știa că conține un singur electron. Nucleul unui atom este proton - o particulă încărcată pozitiv, a cărei sarcină este egală în valoare absolută cu sarcina electronului, iar masa este de 1836 de ori masa electronului. De asemenea, în începutul XIX secolului au fost descoperite discrete linii spectraleîn regiunea vizibilă de radiație a atomului de hidrogen (așa-numitul spectrul de linii ). Ulterior, modelele la care se supun lungimile de undă (sau frecvențele) spectrului de linii au fost bine studiate cantitativ (I. Balmer, 1885). A fost numit setul de linii spectrale ale atomului de hidrogen din partea vizibilă a spectrului Seria Balmer . Mai târziu, serii similare de linii spectrale au fost găsite în părțile ultraviolete și infraroșii ale spectrului. În 1890, Johannes Rydberg a derivat o formulă empirică pentru frecvențele liniilor spectrale:
Acest lucru poate duce la formarea unui compus format din doi atomi de aluminiu și trei atomi de oxigen. Se va combina cu doi atomi de oxigen pentru a forma un compus. Deși tabelul periodic a avut un mare succes la acea vreme, descoperirea unor elemente noi care nu se potriveau acestui tabel a dus la căutarea unui alt sistem de clasificare.
În plus, Mendeleev cunoștea câteva elemente de pământuri rare precum lantanul, itterbiul, erbiul, terbiul, praseodimiul și neodimul, care nu aveau loc în tabel. Problema a fost rezolvată când s-a descoperit că numărul atomic este o caracteristică a elementelor, denotând periodicitatea proprietăților sale. Astăzi, elementele sunt ordonate de la stânga la dreapta și de sus în jos în ordinea crescătoare a valorii lor. numerele atomice, adică prin numărul de protoni din nucleul atomilor lor.
Pentru seria Balmer m = 2, n= 3, 4, 5, ... . Pentru seria ultraviolete (seria Lyman) m = 1, n= 2, 3, 4, ... . Constant Rîn această formulă se numește constanta Rydberg . Valoarea sa numerică R= 3,29 10 15 Hz. Înainte de Bohr, mecanismul apariției spectrelor de linii și semnificația numerelor întregi incluse în formulele liniilor spectrale de hidrogen (și un număr de alți atomi) au rămas de neînțeles.
În același rând sunt așezate elementele care au același număr de straturi de electroni și ale căror proprietăți se modifică progresiv, în timp ce elementele care au același număr de electroni în ultimul strat și care deci au proprietăți similare sunt plasate în aceeași coloană. Prima perioadă, ca și a doua și a treia, se numesc perioade scurte; al patrulea și al cincilea, cu opt elemente, sunt lungi, iar al șaselea și al șaptelea, cu 32 de elemente, sunt foarte lungi. Ultimele două, pe lângă metalele de tranziție, sunt elemente de pământuri rare.
Postulatele lui Bohr au determinat direcția de dezvoltare a unei noi științe - fizica cuantică a atomului. Dar nu conțineau o rețetă pentru determinarea parametrilor stărilor staționare (orbite) și a valorilor energetice corespunzătoare En.
Regula de cuantificare care duce la valori consistente experimental ale energiilor stărilor staționare ale atomului de hidrogen a fost ghicită de Bohr. El a sugerat că momentul unghiular al unui electron care se rotește în jurul nucleului poate lua doar valori discrete care sunt multipli ai constantei lui Planck. Pentru orbitele circulare, regula de cuantizare Bohr se scrie ca
Modele în proprietățile elementelor sistemului periodic. Clasificarea elementelor în ordinea crescătoare a numărului atomic presupune utilizarea altor două criterii: masa atomică și asemănarea în proprietăți. Dacă aceste elemente sunt ordonate de la cel mai mic la cel mai mare în funcție de lor masă atomică, argina ar trebui să apară în poziția pe care o ocupă potasiul în tabelul periodic modern. Dar argonul este un gaz nobil și nu poate fi în grupul litiului și sodiului, care sunt metale foarte reactive.
Dacă sunt ordonate după numărul atomic, argonul este 18 și potasiul este 19, deci fiecare este în grupul său respectiv. Motivul asemănării proprietăților elementelor constă tocmai în numărul și distribuția electronilor în atomii lor. Elementele ai căror atomi au același număr de electroni în ultimul lor strat sau nivel de energie au similare Proprietăți chimiceși prin urmare sunt în aceeași grupă cu tabelul periodic.
![]()
Aici m e - masa electronului, υ - viteza acestuia, rn este raza orbitei circulare staționare. Regula de cuantizare a lui Bohr face posibilă calcularea razelor orbitelor staționare ale unui electron dintr-un atom de hidrogen și determinarea valorilor energetice. Viteza unui electron care se rotește pe o orbită circulară de o anumită rază rîn câmpul Coulomb al nucleului, după cum rezultă din a doua lege a lui Newton, este determinată de relația
Distribuția electronică a primelor 10 elemente este următoarea. Vă rugăm să rețineți că nivelurile sau nivelurile electronice sunt finalizate pe măsură ce progresați dincolo anumită perioadă. Heliul și Neonul, care sunt ultimele elemente ale perioadelor 1 și 2, au straturile lor de electroni pline.
Toate alcalinele au un singur electron la ultimul nivel. Configurația sa electronică. Toate elementele care se află în același grup au aceeași configurație la ultimul nivel. Toate au proprietăți similare. În general, atomii care alcătuiesc materia, aceiași sau diferiți, sunt combinați, deși în natură există și substanțe formate din atomi izolați, precum elementele unui grup.

Unde e - sarcina elementara, ε 0 - constantă electrică. Viteza electronilor υ și raza orbitei staționare rn sunt legate prin regula de cuantizare Bohr. Rezultă că razele orbitelor circulare staționare sunt determinate de expresie
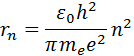
Una dintre caracteristicile elementelor din grupa 18 este că toate au opt electroni în stratul lor exterior, cu excepția heliului, care are doar doi. Această structură este cea mai stabilă, astfel încât atomii acestor elemente nu interferează de obicei cu reacții chimice. Prin urmare, primesc porecla de gaze nobile sau inerte. Modul în care restul elementelor încearcă să aibă 8 electroni în ultimul lor strat justifică comportamentul lor chimic.
Prin urmare, putem concluziona că atomii tind să se combine pentru a se forma substanțe chimice cu anumite caracteristici care sunt mai instabile energetic decât atomii originali. Acest tip de conexiune se numește legătură chimică. O legătură chimică este o forță atractivă care ține atomii în grupuri atomice diferite.
Orbita cea mai apropiată de nucleu corespunde valorii n= 1. Raza primei orbite, care se numește raza Bohr , este egal cu

Razele orbitelor ulterioare cresc proportional n 2 .
Complet energie mecanică E un sistem format dintr-un nucleu atomic și un electron care circulă pe o orbită circulară staționară cu o rază rn, este egal cu
Atomul de heliu are un ultim strat plin, ceea ce îi conferă o mare stabilitate. În schimb, atomul de hidrogen, care are un electron în ultimul și singurul său strat, este mult mai puțin stabil. Cu toate acestea, această stabilitate crește dacă doi atomi de hidrogen sunt suficient de aproape unul de celălalt pentru a-și conecta straturile de electroni prin împărțirea electronilor. O astfel de conexiune este posibilă deoarece cea mai mare parte a regiunii exterioare a atomului este spațiu gol. Din diagramă se arată că în aceste condiții se manifestă o serie de forțe electrostatice: două nuclee au același incarcare electricași se resping reciproc, ca doi electroni; cu toate acestea, există atracție reciprocă între nuclee și electroni, iar cele patru particule sunt aranjate în așa fel încât forțele de atracție contracarează exact forțele de respingere.

Trebuie remarcat faptul că E p< 0, так как между электроном и ядром действуют силы притяжения. Подставляя в эту формулу выражения для υ 2 и rn, primim:

Întreg n= 1, 2, 3, ... se numește în fizica cuantică a atomului număr cuantic principal .
Când se întâmplă acest lucru, a legătură chimică. Atomii care își ating stabilitatea prin împărțirea electronilor cu alți atomi sunt legați printr-o legătură covalentă. O pereche de atomi de hidrogen este cea mai stabilă formă de hidrogen la temperatură normală.
Moleculele care, ca și hidrogenul, conțin doi atomi se numesc molecule diatomice. Dacă conțin mai mult de doi atomi, se numesc poliatomici. Doi atomi de clor sunt adăugați în mod similar. Un atom individual are șapte electroni în ultimul său strat. Când doi atomi de clor se apropie unul de celălalt și își conectează straturile de electroni, ei au o pereche de electroni. Astfel, fiecare atom poate fi considerat înconjurat de opt electroni. Cei doi atomi de clor rămân atașați ca o moleculă.
Conform celui de-al doilea postulat al lui Bohr, în timpul tranziției unui electron de pe o orbită staționară cu energie En pe o altă orbită staționară cu energie Em < En atomul emite un cuantum de lumină, frecvența ν nm care este egal cu Δ Enm / h:
![]()
Această formulă coincide exact cu formula empirică Rydberg pentru seria spectrală a atomului de hidrogen, dacă stabilim constanta R egal
Există multe alte gaze elemente chimice, care la temperatura normală apar sub formă de molecule biatomice, precum oxigen, azot, fluor. Reprezentarea unei legături covalente. O legătură covalentă este forța de atracție pe care două nuclee o exercită asupra perechilor de electroni dintre ei: o pereche într-o legătură simplă, două perechi într-o legătură dublă și trei perechi într-o legătură triplă. O legătură covalentă poate fi reprezentată în mai multe moduri; de exemplu, o legătură între doi atomi dintr-o moleculă de fluor poate fi specificată în două moduri.
Înlocuirea valorilor numerice m e, e, ε 0 și hîn această formulă dă rezultatul
care concordă foarte bine cu valoarea empirică R. Orez. 6.3.1 ilustrează formarea unor serii spectrale în radiația unui atom de hidrogen în timpul tranziției unui electron de la orbitele staționare înalte la cele inferioare.
Pe fig. 6.3.2. este prezentată o diagramă a nivelurilor de energie ale atomului de hidrogen și sunt indicate tranzițiile corespunzătoare diferitelor serii spectrale.
Proprietățile elementelor covalente. Punctele sale de topire și de fierbere sunt scăzute. Deoarece nu există electroni liberi, dar sunt localizați, aceste elemente nu conduc electricitate. În cristalele covalente, atomii sunt ținuți împreună numai prin legături covalente care formează o rețea tridimensională.
Diamantul conține doar atomi de carbon și, prin urmare, este una dintre formele în care este prezent acest element. Atomul de carbon are ultimii patru electroni în ultimul strat și încă patru lipsesc pentru a avea o structură de gaz nobil și poate fi obținut prin împărțirea fiecăruia dintre acești electroni cu alți patru atomi de carbon.
Excelentul acord dintre teoria lui Bohr despre atomul de hidrogen și experiment a servit drept argument de mare importanță în favoarea validității acestuia. Cu toate acestea, încercările de a aplica această teorie la atomi mai complecși nu au avut succes. Bohr nu a putut oferi o interpretare fizică a regulii de cuantizare. Acest lucru a fost făcut un deceniu mai târziu de de Broglie pe baza ideilor despre proprietățile valurilor ah particule. De Broglie a propus că fiecare orbită a atomului de hidrogen corespunde unei unde care se propagă într-un cerc în jurul nucleului atomului. O orbită staționară are loc atunci când unda se repetă continuu după fiecare rotație în jurul nucleului. Cu alte cuvinte, o orbită staționară corespunde unei undă de Broglie stătătoare circulară pe lungimea orbitei (Figura 6.3.3). Acest fenomen este foarte asemănător cu imaginea staționară a undelor staționare într-un șir cu capete fixe.
Astfel, capătă un stabil structura electronica, similar cu structura neonului, cu patru perechi de electroni în ultimul strat. Substanța iodul este formată din molecule de iod conectate prin forțe intermoleculare formând o rețea cristalină sau tridimensională. Deoarece aceste forțe atractive dintre molecule sunt slabe, aceste cristale pot fi ușor distruse.
În diagrama structurii carbonului se observă că doar elementul central are ultimul strat. Acest lucru permite fiecăruia dintre ceilalți patru atomi să formeze, la rândul lor, legături covalente cu alți patru atomi și astfel să-și umple straturile electronice. Pe măsură ce fiecare atom face acest lucru, se creează o rețea uriașă.
În staționar stare cuantică al unui atom de hidrogen, conform ideii lui de Broglie, un număr întreg de lungimi de undă λ, adică,
Inlocuind in aceasta relatie lungimea de unda de Broglie λ = h / p, Unde p = m e υ - impulsul electronilor, obținem:
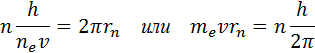
În diamant, atomii de carbon sunt sub forma unei rețele tridimensionale care este extrem de stabilă în toate direcțiile. Diamantul este unul dintre cele mai multe solide, care este cunoscut și rămâne în stare solidă la foarte temperaturi mari. Proprietățile cristalelor atomice covalente.
Toate proprietățile acestora cristale solide arată că între particulele care le formează se stabilesc forțe foarte puternice. Teorema ne spune că aceste forțe se datorează legăturilor covalente dintre atomii lor. Diamantul este foarte dur, punctele sale de topire și fierbere sunt foarte mari. legaturi covalente dintre atomii de carbon care formează rețeaua sunt atât de puternice încât este necesară o cantitate semnificativă de energie pentru a distruge structura. Deoarece nu are electroni liberi, nu conduce electricitatea.
Astfel, regula de cuantizare Bohr este legată de proprietățile undei electronilor.
Succesul teoriei lui Bohr în explicarea tiparelor spectrale în studiul atomului de hidrogen a fost uimitor. A devenit clar că atomii sunt sisteme cuantice și niveluri de energie stările staționare ale atomilor sunt discrete. Aproape simultan cu crearea teoriei lui Bohr, s-au obținut dovezi experimentale directe pentru existența stărilor staționare ale atomului și pentru cuantificarea energiei. Discretitatea stărilor energetice ale atomului a fost demonstrată în 1913, în experimentul lui D. Frank și G. Hertz, în care s-a studiat ciocnirea electronilor cu atomii de mercur. S-a dovedit că, dacă energia electronilor este mai mică de 4,9 eV, atunci ciocnirea lor cu atomii de mercur are loc conform legii impactului absolut elastic. Dacă energia electronului este egală cu 4,9 eV, atunci ciocnirea cu atomii de mercur capătă caracterul unui impact neelastic, adică, ca urmare a unei coliziuni cu atomii imobili de mercur, electronii își pierd complet energia cinetică. Aceasta înseamnă că atomii de mercur absorb energia electronului și trec de la starea fundamentală la prima stare excitată,
Când se aproximează doi atomi, pot apărea următoarele cazuri. Există forțe de respingere între electroni și nuclei care cresc pe măsură ce se apropie și nu se formează niciodată o legătură, cum ar fi încercarea de a aproxima doi atomi de heliu. Forțele de atracție apar între nucleul unui atom și electronii altuia și invers. În acest caz, energia sistemului scade cu o anumită distanță; atunci se formează o legătură între cei doi atomi.
În procesul de formare a legăturilor, energia este întotdeauna eliberată. Prin urmare, pentru a separa atomii care formează un element sau compus, este necesar să se asigure o energie egală sau mai mare decât energia eliberată în timpul formării unei legături. Grafitul este o altă formă de carbon găsită în natură. În acest caz, atomii de carbon sunt aranjați în inele cu șase atomi. Fiecare atom de carbon este legat covalent de alți trei atomi. Astfel, electronii lasă libertatea de mișcare, astfel încât grafitul conduce electricitatea.
|
E 2 - E 1 = 4,9 eV. |
Conform conceptului Bohr, în timpul tranziției spontane inverse a unui atom, mercurul ar trebui să emită cuante cu o frecvență
![]()
O linie spectrală cu o astfel de frecvență a fost de fapt detectată în partea ultravioletă a spectrului de emisie a atomilor de mercur.
Este o substanta neagra, lucioasa, moale si incolora la atingere, intrucat se prezinta in slipuri usor atasate intre ele si care aluneca una peste alta. Este folosit pentru a face electrozi pentru proprietatea lor de a conduce electricitatea și pentru a face axuri de creion și benzi de imprimantă pentru computere.
Metalele au proprietăți foarte diferite de alte substanțe care sporesc existența unui anumit tip de legătură și caracteristică care le face posibile. Elementele metalice au de obicei atomi care conțin 1, 2 sau 3 electroni în stratul lor exterior. Acești electroni sunt slab legați de nucleul atomic astfel încât să poată fi reciclate cu ușurință.
Conceptul de stări discrete contrazice fizica clasică. Prin urmare, a apărut întrebarea dacă teoria cuantică își respinge legile.
Fizica cuantică nu a anulat legile clasice fundamentale de conservare a energiei, impulsului, descărcării electrice etc. Potrivit lui N. Bohr principiul conformității , fizica cuantică include legile fizicii clasice, iar în anumite condiții este posibil să se detecteze o tranziție lină de la conceptele cuantice la cele clasice. Acest lucru poate fi văzut în exemplul spectrului energetic al atomului de hidrogen (Fig. 6.3.2). Pentru numere cuantice mari n>> 1 niveluri discrete se apropie treptat unul de celălalt și există o tranziție lină către regiunea spectrului continuu, care decurge din fizica clasică.
Imaginează-ți un set de atomi ai unui element metalic care sunt separați și se apropie cât mai mult posibil. În aceste condiții, straturile de electroni exterioare ale atomilor se suprapun complet și orice electron care emană inițial dintr-un anumit strat de electroni nu este acum asociat cu niciun atom anume, ci este împărtășit de toți atomii din set. Acești atomi sunt legați printr-o legătură metalică.
Un cristal metalic este format din atomi staționari încărcați pozitiv cufundați într-o mare de electroni care se delocalizează și, prin urmare, nu aparțin niciunui atom anume. Pentru că sunt foarte compacte, metalele sunt destul de dure, dar pot fi întinse pentru a forma fire, întrucât un strat de atomi poate fi mutat peste altul.
Teoria semiclasică a lui Bohr a reprezentat o etapă importantă în dezvoltarea conceptelor cuantice, a căror introducere în fizică a necesitat o restructurare radicală a mecanicii și electrodinamicii. O astfel de restructurare a fost efectuată în anii 20-30 ai secolului XX.
Ideea lui Bohr despre anumite orbite de-a lungul cărora electronii se mișcă într-un atom s-a dovedit a fi foarte condiționată. De fapt, mișcarea unui electron într-un atom seamănă foarte puțin cu mișcarea planetelor sau a sateliților. Sensul fizic este doar probabilitatea de a găsi un electron într-un loc sau altul, descrisă de pătratul modulului funcției de undă |Ψ| 2. Funcția de undă Ψ este soluția ecuației principale mecanica cuantică - Ecuații Schrödinger . S-a dovedit că starea unui electron într-un atom este caracterizată de un întreg set de numere cuantice. Numărul cuantic principal n determină cuantificarea energiei atomului. Pentru a cuantifica momentul unghiular, așa-numitul numărul cuantic orbital l . Proiecția momentului unghiular pe orice direcție distinsă în spațiu (de exemplu, direcția vectorului camp magnetic) ia și o serie discretă de valori. Pentru a cuantifica proiecția momentului unghiular, introducem numărul cuantic magnetic m . numere cuantice n, l, m legate de anumite reguli de cuantizare. De exemplu, numărul cuantic orbital l poate lua valori întregi de la 0 la ( n- unu). Numărul cuantic magnetic m poate lua orice valori întregi în intervalul ± l. Astfel, fiecare valoare a numărului cuantic principal n, care determină starea energetică a atomului, corespunde unui număr de combinații de numere cuantice lși m. Fiecare astfel de combinație corespunde unei anumite distribuții de probabilitate |Ψ| 2 detectarea unui electron în diferite puncte din spațiu ("nor de electroni").
Stări în care numărul cuantic orbital l= 0 sunt descrise prin distribuții de probabilitate sferic simetrice. Sunt chemați s-stari (1 s, 2s, ..., ns, ...). Pentru valori l> 0 simetria sferică a norului de electroni este întreruptă. State de atunci l= 1 sunt numite p- state, cu l = 2 - d-state etc.
Pe fig. 6.3.4 prezintă curbele de distribuție a probabilității ρ ( r) = 4π r 2 |Ψ| 2 detectarea unui electron într-un atom de hidrogen la diferite distanțe de nucleu în stările 1 sși 2 s.
După cum se poate observa din fig. 6.3.4, electron în starea 1 s(starea fundamentală a atomului de hidrogen) poate fi detectată la diferite distanțe de nucleu. DIN cel mai probabil poate fi detectat la o distanta egala cu raza r 1 a primei orbite Bohr. Probabilitatea de a găsi un electron în starea 2 s distanta maxima r = 4r 1 din miez. În ambele cazuri, atomul de hidrogen poate fi reprezentat ca un nor de electroni simetric sferic, în centrul căruia se află nucleul.
Seria spectrală a atomului de hidrogen.
Studiile privind spectrele de emisie ale gazelor rarefiate (adică spectrele de emisie ale atomilor individuali) au arătat că fiecare gaz are un anumit stăpânit un spectru format din linii spectrale individuale sau grupuri de linii apropiate. Acest lucru este deosebit de pronunțat în spectrul celui mai simplu atom de hidrogen.
Omul de știință elvețian I. Balmer a luat o formulă empirică care descrie toate liniile spectrale ale atomului de hidrogen cunoscut la acea vreme în regiunea vizibilă a spectrului:
Unde n=3;4;5;6.
Alături de seria Balmer, în spectrul hidrogenului atomic s-au găsit și alte serii, ale căror numere de undă pot fi reprezentate prin formule similare.
LA ultraviolet Zonele seriei Lyman:
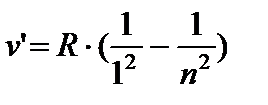 n = 2;3... (8,4)
n = 2;3... (8,4)
LA infraroşu zone:
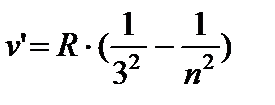 - seria Paschen, n =4;5…
- seria Paschen, n =4;5…
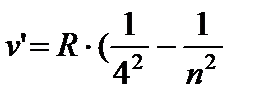 ) - Seria parantezei, n = 5;6… (8.5)
) - Seria parantezei, n = 5;6… (8.5)
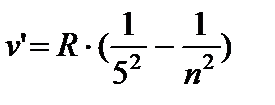 - seria Pfund, n = 6;7…
- seria Pfund, n = 6;7…
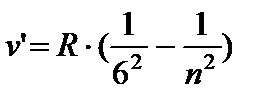 - seria Humphrey, n = 7;8...
- seria Humphrey, n = 7;8...
Analizând relațiile (8.3) - (8.5), putem spune că toate seriile de hidrogen atomic pot fi reprezentate formula generala numit prin formula generalizată Balmer:
 (8.6)
(8.6)
Unde m are o valoare constantă în fiecare serie dată, m=1;2;3;4;5;6 (definește seria); A n=m+1, m+2,... (definește liniile individuale ale acestei serii).
Energia stării staționare a atomului:  (8.9)
(8.9)
Semnul „-” are valoare condiționată, pură sens fizic– energia unui electron în câmpul unui nucleu pozitiv este negativă. Din (8.9) se poate observa că energia stărilor staționare formează o serie discretă pentru n=1;2;3...
Postulatele propuse de Bohr au făcut posibilă calcularea spectrului atomului de hidrogen și al sistemelor asemănătoare hidrogenului (sisteme constând dintr-un nucleu cu sarcină). Zeși un electron (de exemplu, ioni Nu + , Li +), și teoretic calculați constanta Rydberg.
Urmând Bohr, să luăm în considerare mișcarea unui electron într-un sistem asemănător hidrogenului, limitându-ne la orbite staționare circulare. Energie potențială interacțiunile unui electron cu un nucleu:
 (9.1),
(9.1),
r este raza orbitei. Energie kinetică electronul care se deplasează în jurul nucleului: 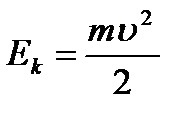 (9.2).
(9.2).
Apoi energie totală atom:
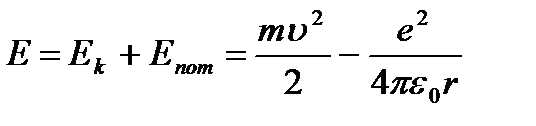 (9.3).
(9.3).
Electronul din jurul nucleului se mișcă cu accelerație 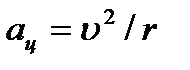 sub influența forței Coulomb:
sub influența forței Coulomb:  .
.
Conform celei de-a doua legi a lui Newton ( ma = Fk) se poate scrie:
 (9.4);
(9.4);
de aici 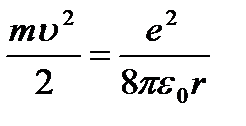 (9.5).
(9.5).
Punem (9.5) în (9.3): 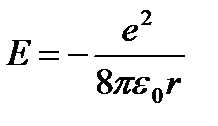 (9.6).
(9.6).
Bohr a propus o regulă de selecție sau o regulă de cuantizare (al treilea postulat al lui Bohr): dintre toate orbitele posibile ale unui electron, se realizează numai acelea pentru care momentul unghiular al electronului este un multiplu al constantei lui Planck:
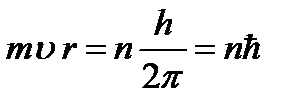 (9.7),
(9.7),
Unde n=1,2,3,... este numărul cuantic principal. Folosind relațiile (9.4) și (9.7), determinăm raza orbitei staționare a electronilor:

 (9.8),
(9.8),
la (raza primei orbite).
Din (9.8) rezultă 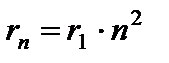 . Înlocuind (9.8) în (9.10) se obține o expresie pentru energii de stare staționară:
. Înlocuind (9.8) în (9.10) se obține o expresie pentru energii de stare staționară:
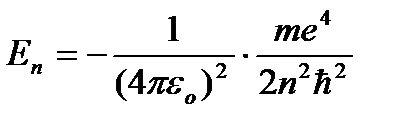 =
= 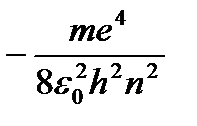 (9.9)
(9.9)
La - energia primei stări staţionare.
Într-o stare de energie E 1 un atom poate rămâne la infinit. Pentru a ioniza atomul de hidrogen, i.e. pentru a rupe un electron din el, trebuie să i se acorde o energie de 13,55 eV.
 eV;
eV;  ;
;
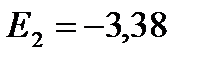 eV;
eV; 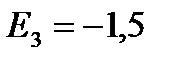 eV;
eV; ![]() eV etc.
eV etc.
Starea , ,... corespunde unui atom excitat. Durata de viață în aceste stări este de ordin  . În acest timp, electronul reușește să facă aproximativ 100 de milioane de rotații în jurul nucleului.
. În acest timp, electronul reușește să facă aproximativ 100 de milioane de rotații în jurul nucleului.
Dăruind n valori întregi diferite, obținem pentru atomul de hidrogen, conform formulei (9.9), nivelurile de energie posibile. Energia atomului de hidrogen cu creștere P crește și nivelurile de energie se apropie de limita corespunzătoare valorii n=¥. Atomul de hidrogen are astfel o energie minimă (E 1 \u003d -13,55 eV) la n=1 și maxim (E ¥ =0) la P=¥ . Prin urmare, valoarea lui E ¥ = 0 corespunde ionizării atomului (separarea unui electron de acesta). Conform celui de-al doilea postulat al lui Bohr, în timpul tranziției unui atom de hidrogen din starea staționară n la o stare de echilibru t o cuantică este emisă cu mai puțină energie:

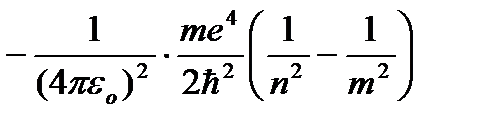 ,
,
de unde frecventa radiatiei:
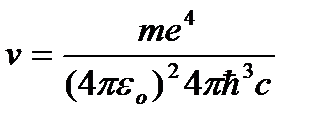
 =R
=R  , (9.10)
, (9.10)
Unde  .
.
Folosind în calcul R valorile moderne constante universale, obținem o valoare care coincide cu valoarea experimentală a constantei Rydberg în formulele empirice pentru atomul de hidrogen: ![]() .
.
Această coincidență demonstrează corectitudinea formulei obținute de Bohr pentru nivelurile de energie ale unui sistem asemănător hidrogenului.
Înlocuind, de exemplu, în formula (9.10) m=1și n=2, 3, 4, ..., obținem un grup de linii care formează seria Lyman și corespund tranzițiilor electronilor de la nivelurile excitate (n= 2, 3, 4, ...) pe principal (t= 1). La fel, la înlocuire t= 2, 3, 4, 5, 10 și valorile lor corespunzătoare n obținem seriile Balmer, Paschen, Bracket, Pfund și Humphrey (unele dintre ele sunt prezentate schematic în Fig. 9.1.). În consecință, conform teoriei lui Bohr, care explica cantitativ spectrul atomului de hidrogen, seriile spectrale corespund radiațiilor rezultate din trecerea unui atom la o stare dată din stările excitate situate deasupra acesteia.
 Teoria lui Bohr a arătat inaplicabilitatea fizicii clasice la fenomenele intra-atomice și necesitatea aplicării legilor cuantice în microcosmos. Dar încercarea de a construi o teorie similară pentru atomul de heliu a eșuat. Teoria lui Bohr nu a fost nici în mod constant clasică, nici în mod constant teoria cuantică. Neajunsurile teoriei lui Bohr ar putea fi eliminate prin crearea unui nou teoria cuantica, în care comportamentul și mișcarea microparticulelor se supune propriilor legi. Acest lucru a fost făcut la crearea mecanicii cuantice.
Teoria lui Bohr a arătat inaplicabilitatea fizicii clasice la fenomenele intra-atomice și necesitatea aplicării legilor cuantice în microcosmos. Dar încercarea de a construi o teorie similară pentru atomul de heliu a eșuat. Teoria lui Bohr nu a fost nici în mod constant clasică, nici în mod constant teoria cuantică. Neajunsurile teoriei lui Bohr ar putea fi eliminate prin crearea unui nou teoria cuantica, în care comportamentul și mișcarea microparticulelor se supune propriilor legi. Acest lucru a fost făcut la crearea mecanicii cuantice.
Starea unui electron într-un atom este caracterizată nu de unul, ci de mai multe numere cuantice.
Primul numerele lor cuantice - număr cuantic principal: n=
unu; 2;3,... Determină nivelurile de energie ale unui electron dintr-un atom:  și razele orbitelor staționare
și razele orbitelor staționare  . Aceste expresii rezultă din soluția ecuației Schrödinger și coincid cu formulele corespunzătoare obținute de Bohr.
. Aceste expresii rezultă din soluția ecuației Schrödinger și coincid cu formulele corespunzătoare obținute de Bohr.
Al doilea număr cuantic - numărul cuantic orbital, care la dat n poate lua valori 0, 1, 2, ..., n-unu . Acest număr determină momentul unghiular orbital  electronul în raport cu nucleul. Momentul unghiular al unui electron dintr-un atom este cuantificat cu formula:
electronul în raport cu nucleul. Momentul unghiular al unui electron dintr-un atom este cuantificat cu formula: 
Al treilea număr cuantic - număr cuantic magnetic, care, atunci când este dat, ia valorile 0; ±1; ±2,…, ± ; total 2+1 valori. Acest număr determină proiecțiile momentului unghiular orbital al electronului pe o direcție Z aleasă în mod arbitrar. Sunt posibile doar astfel de orientări ale vectorului momentului unghiular, pentru care proiecția vectorului pe direcția câmpului magnetic extern (axa OZ) ia valorile: 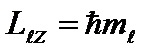
Al patrulea număr cuantic - a învârti(spin magnetic) număr cuantic Domnișoară
. Nu poate lua decât două valori 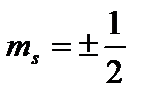 și caracterizează valorile posibile ale proiecției pe axa Z a spinului (momentul unghiular mecanic intrinsec) al electronului:
și caracterizează valorile posibile ale proiecției pe axa Z a spinului (momentul unghiular mecanic intrinsec) al electronului: 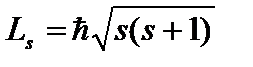 , Unde
, Unde ![]() este numărul cuantic de spin. Cuantizarea spin spațială înseamnă că proiecția vectorului spin pe direcția câmpului magnetic extern se găsește prin formula:
este numărul cuantic de spin. Cuantizarea spin spațială înseamnă că proiecția vectorului spin pe direcția câmpului magnetic extern se găsește prin formula:  .
.
În 1924, fizicianul elvețian Pauli a formulat principiul că: în orice atom nu pot exista doi electroni care se află în două stări staționare identice, determinate de un set de patru numere cuantice - principalul n; orbital; m magnetic și spin m s. Principiul Pauli, pe lângă electroni, se supune altor particule care au un spin semiîntreg (în unități).
Să determinăm numărul de electroni cu un anumit .
Se numesc electronii cu =0 s 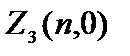 = 2(2×0+1)=2.
= 2(2×0+1)=2.
Electronii cu =1 se numesc R-electroni, numărul lor maxim este  =2(2×1+1)=6.
=2(2×1+1)=6.
Electronii cu =2 se numesc d-electroni, numărul lor maxim este  =2(2 2+1)=10.
=2(2 2+1)=10.
Electronii cu =3 se numesc f-electroni, numărul lor maxim este  2(2×3+1)=14 etc.
2(2×3+1)=14 etc.
Număr maxim electroni în stări determinate de valoare n număr cuantic principal
= 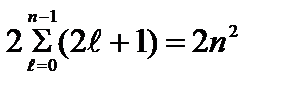
Electroni care ocupă un set de stări cu aceeași valoare a numărului cuantic principal n formează o înveliș de electroni. Există următoarele învelișuri de electroni (sau straturi): strat K la n = 1; L- strat la n = 2; M- strat la n = 3; N- strat la n=4 etc. În fiecare înveliș cuantic al unui atom, electronii sunt distribuiți între subînvelișuri corespunzătoare unei anumite valori a numărului cuantic orbital; in functie de electron se afla intr-un subgrup cu simboluri s, p, d, f etc.
| Numărul cuantic principal | Carcasă electronică (strat) | Numărul de electroni în stări | Numărul maxim de electroni | |||
| s ( =0) | p ( =1) | d ( =2) | f ( =3) | |||
| K | – | – | – | |||
| L | – | – | ||||
| M | – | |||||
| N |
Într-o stare determinată de numărul cuantic principal n= 1, pot exista doar doi electroni s cu două orientări diferite de spin (vezi Fig. 10.1).
În cazul în care un n= 2, atunci circuitul are forma prezentată în Fig. 10.2.
Secvența de umplere a stărilor electronice în atomii elementelor chimice este explicată de principiul Pauli.
Acest principiu explică periodicitatea proprietăților elementelor chimice în sistemul periodic creat de D.I. Mendeleev.
Să urmărim construcția sistemului periodic (sau umplerea straturilor atomului cu electroni), care se supun a două principii: a) umplerea pleacă de la cea mai joasă energie (starea cea mai stabilă); b) principiul excluderii Pauli.
Primul element din tabelul periodic este un atom de hidrogen H, pentru aceasta Z = 1. Are un electron, numerele cuantice pentru care sunt: n \u003d 1, \u003d 0, m e \u003d 0, m s \u003d +1/2 sau -1/2, adică configurația electronică a atomului de hidrogen: 1S1.
Următorul element este heliul Nu există doi electroni, numere cuantice: n \u003d 1, \u003d 0, m e \u003d 0, m s \u003d ±1/2, adică configurația electronică a atomului de heliu: 1S 2. Stratul K cu numărul de electroni N = 2 este complet umplut.
Al treilea element este litiul Li. Al treilea electron al său are numere cuantice: n \u003d 2, \u003d 0, m e \u003d 0, m s \u003d +1/2 sau - 1/2, adică configurația electronică a atomului 1S 2 2S 1.
beriliu Ve: Z = 4 configuraţia electronică a atomului 1S 2 2S 2 .
Următoarele șase elemente au cochilii umplute cu 2p. Ca urmare, neonul Ne cu Z = 10 are configurația electronică a atomului 1S 2 2S 2 2P 6, adică. L- stratul este complet umplut și se încheie cu al doilea strat al tabelului periodic. He, Ne, precum și alți atomi în care subgrupele s- sau s- și p sunt complet ocupate de electroni, sunt similare ca proprietăți și sunt inerte din punct de vedere chimic.
| Z | simbolul elementului | Numele elementului | Configuratie electronica |
| H | hidrogen | 1s 1 | |
| Nu | heliu | 1s2 | |
| Li | litiu | 1s1 2s1 | |
| Fi | beriliu | 1s2 2s2 | |
| B | bor | 1s 2 2s 2 2p 1 | |
| C | carbon | 1s 2 2s 2 2p 2 | |
| N | azot | 1s 2 2s 2 2p 3 | |
| O | oxigen | 1s 2 2s 2 2p 4 | |
| F | fluor | 1s 2 2s 2 2p 5 | |
| Ne | neon | 1s 2 2s 2 2p 6 | |
| N / A | sodiu | 1s 2 2s 2 2p 6 3s 1 | |
| mg | magneziu | 1s 2 2s 2 2p 6 3s 2 | |
| Al | aluminiu | 1s 2 2s 2 2p 6 3s 2 3p 1 | |
| Si | siliciu | 1s 2 2s 2 2p 6 3s 2 3p 2 | |
| R | fosfor | 1s 2 2s 2 2p 6 3s 2 3p 3 | |
| S | sulf | 1s 2 2s 2 2p 6 3s 2 3p 4 | |
| Cl | clor | 1s 2 2s 2 2p 6 3s 2 3p 5 | |
| Ar | argon | 1s 2 2s 2 2p 6 3s 2 3p 6 |
Încălcări în timpul umplerii straturilor sunt observate într-un element cu Z=19 (potasiu K), unde umplerea cochiliei 4s începe cu un 3d neumplut:
și așa mai departe până când shell-ul 3d este umplut.
Această încălcare este asociată cu interacțiunea dintre electroni, a cărei stare este caracterizată de principalele numere cuantice n=3, n=4 etc. Ca urmare a interacțiunii, apare o astfel de situație în care o stare cu o mare n, dar unul mic poate fi energetic mai favorabil.
O situație similară se observă în elementele din pământuri rare sau lantanide (atomi cu numerele 58-71), în care cochiliile 5s, 5p, 6s sunt umplute cu un 4 neumplut. f coajă. Toate au o carcasă exterioară 6s 2 . O altă abatere se aplică actinidelor (atomi cu numerele 90-103), în care 5 f coajă după umplerea carcasei exterioare 7s 2 .
Tema 29. Generatoare cuantice optice
Datorită regulilor de selecție, atomii multor elemente au niveluri de energie de la care un electron nu se poate deplasa direct la un nivel inferior. Aceste niveluri sunt numite metastabil state. Un electron poate ajunge la un astfel de nivel atunci când se ciocnește cu un alt electron sau când se deplasează dintr-un nivel superior nivel inalt. Durata de ședere a unui electron într-o stare metastabilă este de ordinul a 10–3 s, în timp ce în stare excitată este de 10–8 s.
Se numește radiația emisă în timpul tranziției spontane a unui atom de la starea excitată la starea fundamentală emisie spontană. Emisia spontană diverși atomi nu se produce în mod coerent, deoarece fiecare atom începe și termină radiația independent de ceilalți (Fig. 15.1a).
Emisia de energie de către un atom, în care trecerea de la stare metastabilăîn principal se numește radiatie electromagnetica se numește frecvența corespunzătoare forțat sau indus, radiații (Fig. 15.1b).
Probabilitatea de emisie stimulată crește brusc atunci când frecvența coincide câmp electromagnetic cu frecvenţa naturală de radiaţie a atomului excitat. Radiația stimulată are aceeași frecvență, fază, polarizare și direcție de propagare ca și radiația stimulatoare. Prin urmare, emisie stimulata strict coerent cu radiația de stimulare, adică fotonul emis nu se distinge de fotonul incident asupra atomului. Fotonii emiși, care se deplasează într-o direcție și se întâlnesc cu alți atomi excitați, stimulează tranzițiile induse în continuare, iar numărul de fotoni crește ca o avalanșă.
Cu toate acestea, alături de emisia stimulată, este posibil și un proces concurent, absorbția. Într-un sistem de atomi care se află în echilibru termodinamic, absorbția radiației incidente va prevala asupra celei forțate, adică. Radiația incidentă va fi atenuată pe măsură ce trece prin materie.
Pentru ca mediul să amplifice radiația incidentă pe el, este necesar să se creeze starea de neechilibru a sistemului, la care numărul de atomi în stări excitate ar fi mai mare decât numărul lor în starea fundamentală. Astfel de stări se numesc stări. cu populație inversă. Procesul de creare a unei stări de neechilibru a materiei (transferarea sistemului într-o stare cu inversare a populației) se numește pompat. Pomparea se poate face prin metode optice, electrice și alte metode. Mediile cu stări inverse sunt numite active. Ele pot fi considerate ca medii cu un coeficient de absorbție negativ, deoarece fasciculul de lumină incident va fi amplificat pe măsură ce trece prin aceste medii.
Pentru prima dată, posibilitatea de a obține medii în care lumina să poată fi amplificată datorită emisiei stimulate a fost semnalată în 1939 de către fizicianul rus V.A. Fabrikant. El a descoperit experimental emisia stimulată de vapori de mercur excitați de o descărcare electrică. Descoperirea fenomenului de amplificare a undelor electromagnetice și metoda inventată de amplificare a acestora (V.A. Fabrikant, M.M. Vudynsky, F.A. Butaeva; 1951) au stat la baza electronicii cuantice, ale cărei prevederi au făcut ulterior posibilă implementarea amplificatoarelor cuantice și cuantice. generatoare de lumină.
Starea practic inversă a mediului este realizată în generatoare cuantice optice, sau lasere (de la primele litere ale denumirii englezești Light Amplification by Stimulated Emission of Radiation - amplificare luminoasă prin emisie stimulată). Laserele generează în regiunile vizibil, infraroșu și aproape ultraviolete (în domeniul optic). Ideea unui principiu calitativ nou de amplificare și generare de unde electromagnetice, aplicat în masere (generatoare și amplificatoare care funcționează în intervalul centimetric al undelor radio) și lasere, aparține oamenilor de știință ruși N.G. Basov și A.M. Prokhorov și fizicianului american C. Orașe, care au fost premiate Premiul Nobel 1964
Cel mai important dintre tipurile existente laserele sunt în stare solidă, gaz, semiconductor și lichid (baza unei astfel de diviziuni este tipul de mediu activ). O clasificare mai exactă ține cont și de metodele de pompare - optică, termică, chimică, electroionizare etc. În plus, este necesar să se țină cont de modul de generare - continuu sau pulsat.
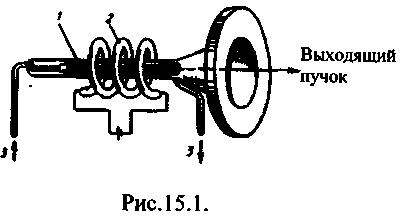 Laserul are în mod necesar trei componente principale: 1) mediu activ,în care se creează state cu inversare a populației; 2) sistem de pompare(dispozitiv pentru crearea inversiilor în mediul activ); 3) rezonator optic(un dispozitiv care separă direcția selectivă a fasciculului de fotoni în spațiu și formează fasciculul de lumină care iese).
Laserul are în mod necesar trei componente principale: 1) mediu activ,în care se creează state cu inversare a populației; 2) sistem de pompare(dispozitiv pentru crearea inversiilor în mediul activ); 3) rezonator optic(un dispozitiv care separă direcția selectivă a fasciculului de fotoni în spațiu și formează fasciculul de lumină care iese).
Primul laser cu stare solidă care a funcționat în regiunea vizibilă a spectrului (lungime de undă de radiație 0,6943 μm) a fost un laser rubin creat în 1960 (T. Maiman, SUA). Figura 16.1 prezintă schema unui laser rubin. În ea, populația inversă a nivelurilor este realizată conform unei scheme cu trei niveluri propusă în 1955 de N. G. Basov și A. M. Prokhorov. Un cristal de rubin este oxid de aluminiu Al 2 Oz, în rețeaua cristalină a căruia unii dintre atomii de Al sunt înlocuiți cu ioni trivalenți de Cr e + (0,03 și, respectiv, 0,05% din ionii de crom de rubin roz și roșu). Pentru pomparea optică, se folosește o lampă cu descărcare în gaz pulsată (2), răsucită spiralat în jurul unei tije de rubin (1). Când un rubin este iradiat intens cu lumina unei lămpi puternice, atomii de crom trec de la nivelul inferior la nivelurile unei benzi largi. 3 (Fig. 16.2). Deoarece durata de viață a atomilor de crom în stările excitate este scurtă (mai puțin de 10 -7 s), fie au loc tranziții spontane 3®1 (sunt nesemnificative), fie cele mai probabile tranziții neradiative la nivel. 2 (se numește metastabil) cu transferul de energie în exces în rețeaua cristalină de rubin. Tranziția 2®1 este interzisă de regulile de selecție, deci durata stării excitate 2 atomi de crom de ordinul a 10 -3 s, i.e. cu aproximativ patru ordine de mărime mai mare decât pentru stat 3. Aceasta duce la „acumularea” de atomi de crom la nivelul 2 . Cu o putere suficientă a pompei, concentrația lor la nivelul 2 va fi mult mai mare decât la nivelul 1 , adică, apare un mediu cu o populație inversă de nivelul 2.
Tija laser rubin era un cilindru, ale cărui capete au fost lustruite cu grijă și acoperite cu un strat de argint, astfel încât un capăt să reflecte complet lumina, iar celălalt parțial reflectat și parțial transmis lumina. Când lampa pompei clipește, fotonii de diferite frecvențe intră în tija de rubin. Atomii de crom, după ce au absorbit o parte din fotonii unei anumite energii, intră într-o stare excitată. Datorită tranzițiilor spontane limitate, în tijă pot apărea radiații stimulate, care se propagă strict de-a lungul axei sale și este amplificată de reflexii multiple din oglinzile de capăt, care joacă rolul rezonator cavitate. Ca rezultat, apare o radiație monocromatică puternică - un impuls luminos, o parte din care iese printr-o oglindă translucidă. Durata unui astfel de impuls este de 10-3 s. Acest lucru se datorează faptului că toți ionii de crom excitați în acest timp trec în starea neexcitată. Fascicul de lumină laser este strict direcționat și are o mică divergență. Rezonatorul cu cavitate al laserului servește la crearea unui feedback pozitiv și la formarea parametrilor geometrici ai fasciculului de ieșire laser.
Nu toată energia absorbită de tija de rubin este transformată în radiație laser. O parte din aceasta, destul de semnificativă (50%), este cheltuită pentru încălzirea tijei, astfel încât designul laser asigură răcirea 3. La o temperatură a tijei de aproximativ 1000 K, laserul rubin este distrus.
Există un număr mare de materiale laser: sticlă, în care se introduc ioni de neodim, fluorit de calciu cu ioni de samariu etc. Ele dau radiații luminoase diverse lungimi unde: laser rubin - 0,694 microni, laser din sticlă neodim - 1,06 microni (radiație infraroșie). În lasere, gazele sau amestecurile de gaze (Ne, Ar, Ne–He, CO 2 etc.) pot fi folosite ca mediu activ. În laserele cu gaz, atomii mediului activ sunt adesea excitați de o descărcare de înaltă frecvență. De regulă, emisia laserelor cu gaz este continuă. Au fost create lasere semiconductoare, chimice, gaz-dinamice și alte lasere.
Radiația laser are următoarele proprietăți:
1) coerența temporală și spațială;
2) monocromaticitate strictă;
3) densitate mare a fluxului energetic;
4) divergență unghiulară foarte mică în fascicul.
Proprietăți neobișnuite radiatii laser au găsit o aplicare largă. De exemplu, la mașinile cu fascicul de lumină, folosind un fascicul laser, se fac găuri în pietre de ceas din rubin, diamant, din aliaje refractare și metale greu de tăiat. În microelectronică, laserele sunt folosite pentru sudarea diferitelor conexiuni pentru microcircuite, depunerea straturilor de semiconductori etc.
Tema 30. Elemente de mecanică cuantică
Omul de știință francez Louis de Broglie, dezvoltând idei despre natura undă corpusculară duală a luminii, a prezentat în 1923 o ipoteză despre universalitatea dualismului unde corpusculare. De Broglie a susținut că există o analogie profundă între proprietățile luminii și proprietățile particulelor materiale; prin urmare, particulele materiale au și o natură dublă, adică. în anumite condiţii, proprietăţile lor de undă se manifestă.
 De Broglie a postulat că o particulă cu impuls
De Broglie a postulat că o particulă cu impuls ![]() corespunde lungimii de undă:
corespunde lungimii de undă:  (1.2)
(1.2)
Această relație (formula lui de Broglie) este valabilă pentru orice particulă cu impuls R.
Curând, ipoteza lui de Broglie a fost confirmată experimental. fizicienilor americani K. Davisson și L. Germer în 1927 au studiat împrăștierea electronilor pe un singur cristal de nichel folosind configurația prezentată în fig. Fasciculul de electroni de la tunul de electroni 1 a fost direcționat către cristalul de nichel 2, electronii 3 împrăștiați din cristal au fost capturați de un receptor special 4 conectat la un galvanometru sensibil. Intensitatea fasciculului reflectat a fost determinată din puterea curentului care trece prin galvanometru. Experimentele au arătat că la un anumit unghi de incidență, electronii sunt reflectați de pe suprafața cristalului în unghiuri diferite, iar maximele numărului de electroni reflectați sunt observate în unele direcții, minime în altele, adică s-a observat un model de difracție. Acest fenomen a fost observat când lungimea de undă a electronului de Broglie 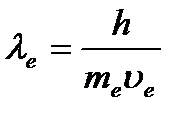 este de ordinul distanței interatomice în cristal. Maximele de difracție corespundeau formulei Wulf-Braggs
este de ordinul distanței interatomice în cristal. Maximele de difracție corespundeau formulei Wulf-Braggs ![]() , iar lungimea de undă Bragg s-a dovedit a fi exact egal cu lungimea val calculat prin formula (1.2).
, iar lungimea de undă Bragg s-a dovedit a fi exact egal cu lungimea val calculat prin formula (1.2).
Mai târziu, PS Tartakovskii și G. Thomson au investigat trecerea electronilor rapizi prin pelicule subțiri de metal. Totodată, pe plăcile fotografice din spatele acestor filme s-a obținut un model de difracție, la fel ca în difracție. raze X pe policristale.
În 1849, V.A. Fabrikant, L.M. Biberman și N.G. Sushkin au efectuat experimente privind difracția electronilor cu un curent foarte scăzut în dispozitiv, adică fiecare electron a fost înregistrat de o placă fotografică în locuri aleatorii. La o expunere lungă, s-a obținut același model de difracție ca și la o expunere scurtă cu o putere mare de curent. Aceasta înseamnă că proprietățile undei sunt inerente fiecărui electron separat, dar difracția unui electron nu dă întregul sistem de puncte, care se obține cu difracția din flux. Urma unui electron va fi doar într-un punct, ceea ce este permis de condiția de difracție. Aceasta arată natura corpusculară a electronilor, deoarece un electron nu se poate răspândi. În care dintre locurile va cădea electronul, este imposibil de spus. Putem vorbi doar despre probabilitatea de a lovi un punct din spațiu.
Astfel, electronul are o natură duală, adică. combină proprietățile atât ale particulelor, cât și ale undelor. Natura ondulatorie a electronilor este confirmată de experimente privind difracția lor. Natura corpusculară a electronilor se manifestă prin faptul că electronul acționează ca un întreg, fără a se rupe în părți.
Ulterior, au fost descoperite fenomene de difracție și pentru neutroni, protoni, fascicule atomice și moleculare. Aceasta a servit în cele din urmă ca o dovadă a prezenței proprietăților de undă ale microparticulelor și a făcut posibilă descrierea mișcării microparticulelor sub forma unui proces de undă caracterizat printr-o anumită lungime de undă calculată prin formula de Broglie (1.2).






