Structura și proprietățile energetice ale cristalelor solide. Relația dintre liniile spectrale și electroni (descoperirea lui Bohr)
13.7. Atom de hidrogen (atom asemănător hidrogenului) conform teoriei lui Bohr
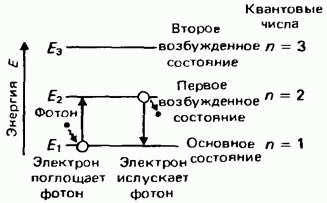
13.7.2. Emisia și absorbția luminii de către un atom
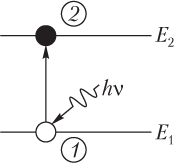
Conform Al doilea postulat al lui Bohr(după regula frecvenței) emisia de lumină are loc în timpul tranziției cuantice a unui atom de la o stare staționară cu o energie mai mare E m la o stare staționară cu o energie mai mică E n ; energia fotonului emis este egală cu diferența dintre energiile stărilor staționare:
E γ = E m − E n .
Trecerea unui electron de la un nivel de energie la altul este întotdeauna însoțită de emisia sau absorbția unui foton de frecvența corespunzătoare.
Când un electron trece dintr-o stare staționară cu o energie mai mare la o stare staționară cu o energie mai mică, atomul emite (Fig. 13.17) un foton cu o frecvență
ν = E 2 − E 1 h ,
unde E 1 este energia unei stări cu o energie mai mică (finală); E 2 - energia starii cu energie mai mare (initiala); h este constanta lui Planck, h = 6,626 ⋅ 10 −34 J ⋅ s.
Trecerea unui electron de la un nivel de energie superior la unul inferior este însoțită de radiații fotonice
Orez. 13.17În timpul tranziției unui electron de la o stare staționară cu o energie mai mică la o stare staționară cu o energie mai mare, atomul absoarbe (Fig. 13.18) un foton cu o frecvență
ν = E 2 − E 1 h ,
unde E 1 este energia unei stări cu o energie mai mică (inițială); E 2 - energia stării cu energie mai mare (finală); h este constanta lui Planck, h = 6,626 ⋅ 10 −34 J ⋅ s.
Trecerea unui electron de la un nivel de energie inferior la unul superior este însoțită de absorbția fotonilor cu o energie egală cu diferenţa dintre energiile celor indicate niveluri de energie.
Pentru procesele de emisie sau absorbție a unui foton în timpul tranzițiilor electronilor între nivelurile de energie, este convenabil să se utilizeze legea conservării energiei:
E 2 \u003d E γ + E 1,
unde E 1 este energia nivelului energetic inferior (cu energie mai mică); E 2 - energia nivelului energetic superior (cu mai multa energie); E γ este energia unui foton (fie emis, fie absorbit).
Setul de frecvențe ale fotonilor emiși sau absorbiți în timpul tranzițiilor unui atom de la o stare staționară la alta este determinat de formula
v = | E n − E m | h,
unde E n , E m sunt energiile nivelurilor de electroni din atomul între care are loc tranziția; h este constanta lui Planck, h = 6,626 ⋅ 10 −34 J ⋅ s.
Se formează setul de posibile frecvențe discrete ale fotonilor absorbiți sau emiși de un atom spectrul de linii atom.
Exemplul 20. Energia stării fundamentale a unui electron dintr-un atom este -28,4 eV. Un electron dintr-un atom este într-o stare excitată cu o energie de -11,6 eV și, emițând un foton, trece în starea fundamentală. Aflați lungimea de undă a fotonului emis.
Soluție. În timpul tranziției unui electron de la o stare staționară cu o energie mai mare la o stare staționară cu o energie mai mică, atomul emite un foton, a cărui energie este determinată de diferența dintre energiile acestor stări:
E γ = E 2 − E 1 ,
unde E 1 este energia stării fundamentale, E 1 = −28,4 eV; E 2 este energia stării excitate, E 2 = −11,6 eV.
Energia fotonului emis este determinată de formula
E γ = h c λ ,
unde h este constanta lui Planck, h = 6,63 ⋅ 10 −34 J ⋅ s; c este viteza luminii în vid, c = 3,00 ⋅ 10 8 m/s; λ este lungimea de undă a fotonului.
În formă explicită, legea conservării energiei pentru tranziția considerată este scrisă după cum urmează:
h c λ = E 2 − E 1 .
Să exprimăm de aici lungimea de undă a fotonului emis:
λ = h c E 2 − E 1
si calculeaza:
λ = 6.63 ⋅ 10 − 34 ⋅ 3.00 ⋅ 10 8 (− 11.6 − (− 28.4)) ⋅ 1.6 ⋅ 10 − 19 = 74.0 ⋅ 10 − 9 m = .74.0
Lungimea de undă a fotonului emis este de 74 nm.
Răspunsuri la colocviul №2 la fizică.
Nivelurile de energie ale atomilor și moleculelor. Tranziții cuantice în atomi și molecule. Absorbția și emisia de energie de către atomi și molecule, spectre de absorbție și emisie.
Nivelurile de energie electronică într-un atom Electronii în starea neexcitată umplu energia inferioară. niveluri, iar nivelurile superioare sunt gratuite. Dacă un atom primește energie ca urmare a unei coliziuni cu alți atomi sau prin absorbția unui cuantum de lumină, atunci acesta intră într-o stare excitată și orice electron al atomului trece de la nivelul inferior la unul dintre cei superiori. După o perioadă scurtă de timp, revine la nivelul inferior, emițând un cuantum de lumină de o anumită frecvență.
Moleculele constau din atomi care interacționează, mișcarea intramoleculară este mai complicată decât cea intraatomică. Într-o moleculă, pe lângă mișcarea electronilor în raport cu nucleele, mișcare oscilantă atomi în jurul poziției lor de echilibru și mișcarea de rotație a moleculei în ansamblu. Mișcarea electronică, vibrațională și de rotație a unei molecule corespunde la trei tipuri de niveluri de energie: Eel, Ekol, Heb. energie totală moleculă este egală cu: E \u003d Eel + Eur + Ekol. Conform mecanicii cuantice, energia vibrațională și rotațională a moleculelor, precum și energia electronică, au un caracter cuantic, adică. schimba discret. Distanța dintre nivelurile vibraționale este mult mai mică decât între cele electronice. Prin urmare, fiecare nivel electronic al unei molecule se descompune într-un număr de niveluri vibraționale (subniveluri). La rândul său, fiecărui nivel vibrațional al moleculei îi corespunde un număr de subniveluri de rotație, distanța dintre care este chiar mai mică decât între nivelurile vibraționale.
Energie staționară. stare: nu este emisă sau absorbită energie. În tranzițiile cuantice, atomi și molecule sare de la o stare staționară la alta, de la un nivel de energie la altul. Acest lucru se datorează tranzițiilor energetice ale electronilor.
Când trece de la niveluri de energie mai înalte la niveluri inferioare, un atom sau o moleculă emite energie, altfel absoarbe. Un atom în starea sa fundamentală poate absorbi doar energie.
Energia emisă de atomi sau molecule formează spectrul de emisie, iar energia absorbită formează spectrul de absorbție.
La tranziția unui electron într-un atom energia este eliberată sau absorbită sub forma unui cuantum de radiație EM. Spectrele de emisie și absorbție atomică sunt asemănătoare liniilor.
Tranziția în molecule:
Ca urmare a faptului că nivelurile electronice dintr-o moleculă se despart în subniveluri vibraționale și rotaționale, numărul posibil tranziții energetice crește semnificativ în comparație cu atomii. Prin urmare, spectrele moleculare devin mai complicate, au un caracter continuu.
∆E >>∆Epol.> ∆Eur.
∆Ee ~ 1-3 EV λ~ 0,5 μV
∆Epol. ~10-2-10-1 EP λ~1-100mkV
∆Ebr. ~ 10 3 -10 -5 V λ~100-1000mkV
absorbția de energie a unei molecule
2- radiația energiei unui atom pe o moleculă
Spectre de luminescență, emisie și absorbție, regula Stokes. Utilizarea luminiscenței în biofizică și medicină.
Luminescență- radiația, care este un exces față de radiația termică la o temperatură dată, și având o perioadă t (10 -15) mai mare decât perioada undei luminoase. Luminescența apare la orice temperatură. Substanțele luminescente strălucesc fără încălzire. Nu este niciodată echilibrat.
În funcție de tipul de excitație, luminiscența este:
1) Fotoluminiscență - excitație prin lumină;
2) Electroluminescență – excitație câmp electric;
3) Chemiluminescență (excitare prin intermediul unei reacții chimice).
Impactul surselor enumerate duce la excitarea atomilor, moleculelor sau ionilor substanței luminiscente. Radiația apare ca urmare a tranzițiilor cuantice ale particulelor de materie din stările excitate la sol (sau mai puțin excitate)
În funcție de durata strălucirii, fotoluminiscența este împărțită în:
Fluorescență - strălucire pe termen scurt
Fosforescență - o strălucire relativ lungă

Spectrul de luminescență este continuu.
Caracteristicile de bază ale luminiscenței.
1) randament cuantic:
ζ= 100% N(emisie)/N(absorbție),
unde N(radiația) este numărul de quante care au dat lumină,
N(absorb) – numărul de quante absorbite.
2) D este densitatea optică a probei.
D=lgI 0 /I λ =Esl, unde E este indicele de absorbție moleculară
3) D= f(λ ) este spectrul de absorbție
eu λ = f(λ ) este spectrul radiațiilor
Regula lui Stokes:
Spectrul de absorbție al unei substanțe date este deplasat în raport cu spectrul de emisie către lungimi de undă mai scurte.
Utilizarea luminiscenței în biofizică și medicină:
Fotoluminiscență:
Detectarea fazei inițiale de alterare a alimentelor
Sortarea preparatelor farmacologice
Diagnosticul anumitor boli (strălucire a părului, solzilor, unghiilor atunci când se diagnostichează deteriorarea lor de către o ciupercă sau lichen)
Pe baza fotoluminiscenței, au fost create surse de lumină al căror spectru este mai asemănător cu lumina zilei decât cel al lămpilor cu incandescență (lămpi fluorescente)
Chemiluminescența - aplicare în diagnosticare
Utilizarea de molecule fluorescente speciale adăugate sistemelor membranare din exterior. Astfel de molecule se numesc sonde sau etichete fluorescente. Schimbarea lor face posibilă detectarea rearanjamentelor conformaționale în proteinele din membrane.
emisie indusă. Populația inversă de niveluri. Generatoare cuantice optice (lasere). Proprietăți radiatii laserși utilizarea lui în medicină.
emisie stimulata este tranziția forțată a particulei excitate la nivelul inferior. În acest caz, numărul de tranziții pe secundă depinde de numărul de fotoni care intră în substanță în același timp, adică. din intensitatea luminii. În plus, tranzițiile forțate vor fi determinate de populația stărilor energetice corespunzătoare. inversarea populaţiei- o astfel de stare a mediului în care numărul de particule la unul dintre nivelurile superioare este mai mare decât chm la cel inferior. Populația inversă de niveluri este asigurată de faptul că electronii pot rămâne la nivelul metastabil de 10 -5 ori mai mult decât la nivelul excitat.
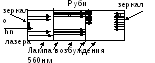
Vv 1960 primul generator cuantic al domeniului vizibil de radiație - laser cu rubine ca substanță de lucru. Acesta creează radiații pulsate cu o lungime de undă de 694,3 nm.
Principiul de funcționare al laserului este similar cu luminiscența.
![]()
![]()
Al 2 O 3 + Cr 2 O 3 - rubin
Proprietățile radiației laser
Radiația laser este întotdeauna monocromatică
Polarizare
Razele nu diverg, strict paralele
Puteți obține intensități foarte mari.
Aplicare laser:
Identificarea ADN-ului și a proteinelor.
Oftalmologie
Tratamentul ulcerelor trofice, al tumorilor maligne
Laserele care funcționează în mod continuu sunt folosite pentru operații pe organe aprovizionate din abundență.
Radiația cu raze X: caracteristică și bremsstrahlung; mecanism de radiație, spectre ale razelor X caracteristice și bremsstrahlung.
radiații cu raze X este o undă electromagnetică în intervalul de la 80 la 10 -4 nm. Radiația cu raze X cu undă lungă este suprapusă de radiația UV cu undă scurtă, unde scurtă cu radiația γ cu undă lungă. Conform metodei de excitare, radiația cu raze X este împărțită în bremsstrahlung și caracteristică
frânăRe-radiații.
Radiația care apare atunci când un electron decelerează în materialul anodului se numește raze X bremsstrahlung. Când electronii încetinesc, doar o parte din energie este folosită pentru a crea un foton, cealaltă parte este cheltuită pentru încălzirea anodului. Deoarece raportul dintre aceste părți este aleatoriu, atunci când un număr mare de electroni decelerează, se formează un spectru continuu de radiații cu raze X.
Spectrul Bremsstrahlung: (1) - la diferite tensiuni in tub cu raze X)
Fluxul de raze X este măsurat prin formula:
Ф=КUа-кIZ 2), unde U, I - tensiunea și curentul în tubul cu raze X, Z - numărul de serie al substanței atomice a anodului, k=10 -9 V -1 - - coeficient de proporționalitate.
Ф=- λ min ˜ ∫Ф λ d λ
Dacă temperatura filamentului catodului crește, atunci emisia de electroni și curentul din tub vor crește. Acest lucru va crește numărul de fotoni de raze X emiși în fiecare secundă. Dar compoziția sa spectrală nu se schimbă.
2) Radiația caracteristică cu raze X.
Creșterea tensiunii pe tubul de raze X duce la faptul că pe fundalul unui spectru continuu, apare o linie, care corespunde radiației caracteristice de raze X. Electronii accelerați de o tensiune înaltă pătrund adânc în atom și scot electronii din straturile sale interioare. Electronii de la nivelurile superioare trec în locuri libere, în urma cărora sunt emiși fotoni de radiații caracteristice.
Spectru de raze X caracteristic atomul nu depinde de compusul chimic în care este inclus acest atom. Spectru:
Interacțiunea razelor X cu materia (împrăștiere coerentă, efect fotoelectric, efect Compton). Legea de atenuare a intensității razelor X. Protecție cu raze X.
Interacțiunea radiațiilor X cu materia
1)
Imprăștire coerentă– împrăștierea razelor X cu lungime de undă lungă Stare: hn hn 1 = hn 2, unde n este frecvența. 2)
efect fotoelectric. hn≥A și. În acest caz, cuanta de raze X este absorbită, iar electronul este detașat de atom. Electronul detașat capătă energie cinetică. Dacă este mare, atunci electronul poate ioniza atomii vecini prin ciocnire. îndepărtarea unui electron - procesul de ionizare hn \u003d Eion + m 0 v 2 / 2 3) Efectul Compton hn>>Ai. În acest caz, electronul se desprinde de atom și capătă o anumită energie cinetică. Energia fotonului în sine scade. Acea. ca urmare a împrăștierii incoerente (efectul Compton), se formează radiații împrăștiate secundare și are loc ionizarea atomilor de materie. hn \u003d Eion + mv 2 / 2 + hn Legea de atenuare a intensității razelor X: Ix \u003d I 0 e -µx µ=µp +µp contribuția fiecărui termen de proces este determinată de energia fotonului. efect fotoelectric Efectul Compton 6. Dispozitivul tubului cu raze X și aparatul cu raze X. Rigiditatea și intensitatea radiațiilor, reglarea acestora. Metoda de obținere a raze X. Utilizarea razelor X în medicină. Dispozitiv cu tub cu raze X: Tubul este un balon de sticla (cu posibil vid inalt), cu doi electrozi: un anod si un catod, carora li se aplica o tensiune mare. Catodul este sursa de electroni. Anodul este o tijă de metal suprafata inclinata pentru a direcționa razele X emergente în unghi față de axa tubului. Sub acțiunea tensiunii înalte, electronii emiși de filamentul catod fierbinte sunt accelerați la energie înaltă. Energie kinetică dobândit de un electron este egal cu munca forțelor electrice și este proporțional cu tensiunea dintre catod și anod. Radiația de raze X apare ca urmare a decelerarii intense a electronilor rapizi din materialul anodului la ciocnirea cu atomii săi (interacțiunea cu un câmp electric nucleul atomicși electroni). Uа-к≈100∙10 3 V λmin= hc/ eUa-k 1) Razele X cu lungime de undă scurtă au de obicei o putere de penetrare mai mare decât cele cu lungime de undă lungă și sunt numite tare și moale cu val lung. Radiația moale este absorbită mai puternic de materie. Creșterea tensiunii pe tubul cu raze X, modificarea compoziției spectrale a radiației și creșterea rigidității. Obținerea cu raze X. Dacă un corp neomogen este plasat pe calea razelor X și un ecran fluorescent este plasat în fața lui, atunci acest corp, absorbind sau atenuând radiația, formează o umbră pe ecran. După natura acestei umbre, se poate judeca forma, densitatea, structura și, în multe cazuri, natura corpurilor. acestea. o diferență semnificativă în absorbția radiațiilor cu raze X de către diferite țesuturi vă permite să vedeți imaginea organelor interne în proiecția umbrei. µ1<µ2
I 2 < aplicarea radiațiilor cu raze X în medicină: Diagnosticare cu raze X: 1) Fluoroscopie (tubul cu raze X este situat în spatele pacientului. Un ecran fluorescent este amplasat în fața acestuia. Se observă o imagine în umbră (pozitivă) pe ecran). 2) radiografie (obiectul este plasat pe o casetă în care este introdusă o peliculă cu o emulsie fotografică specială. Tubul cu raze X este situat deasupra obiectului. Radiografia rezultată dă o imagine negativă, adică invers în contrast cu imaginea observate în timpul transmiterii.În această metodă, există o mai mare claritate a imaginii O variantă promițătoare a acestei metode este tomografia cu raze X și tomografia computerizată). 3) Fluorografie 4) Terapia cu raze X - utilizarea razelor X pentru a distruge tumorile maligne. 7. Principiul tomografiei cu raze X. tomograf cu raze X. Dispozitivul lui. Care sunt principalele diferențe dintre o tomogramă cu raze X și o radiografie? 1) Reabsorbție µ - coeficientul de absorbție, proprietatea țesutului 2) Re-studiu Ia \u003d I 0 e -µ x 1 Iv \u003d I 0 e -µ2 x 2 Iv \u003d I 0 e -µ1x1 e -µ2x2 \u003d I 0 e - (µ1x1 + µ2x2) Scopul diagnosticului. Determinați µ3 și ∆µ3 lnI1/I 0 = -(µ1+µ2)∆х lnI2/I 0 = -(µ3+µ4)∆х lnI3/I 0 = -(µ3+µ1)∆х lnI4/I 0 = -(µ4+µ2)∆х I 0 - set I1,I2,I3,I4 - măsurat (cunoscut) ∆x - set (cunoscut) găsiți µ1µ2µ3µ4 rezolvând un sistem de 4 ecuații 2048∙2048= 4194304 Sistemul teoremelor lui Radon Dacă iau un număr infinit de imagini ale unui obiect, atunci este posibil să-l restabilim cu orice precizie. Soluție tehnică. etapă: măsurători I1,I2,I3,I4... etapa: construirea unei imagini Fiecărei valori de µ, computerul atribuie propria sa luminozitate (culoare) 1 felie - 1 secundă Contrast ∆µ/µ=0,1% (cu 10%) Grosimea stratului - 1-2 mm Limită de rezoluție 0,2 mm Cu tomografie, este posibilă obținerea unei imagini cu raze X stratificate a corpului cu detalii mai mici de 2 mm. Acest lucru vă permite să distingeți între substanța cenușie și cea albă a creierului și să vedeți celule tumorale foarte mici. educaţie 8. Tipuri de radiații ionizante. Acțiunea radiațiilor ionizante asupra materiei. Dozele absorbite, expunerea și biologice (echivalente), relația dintre acestea. Unități de doze în sistemul SI și unități nesistemice utilizate în medicină. În procesul de radiație a fenomenului de radioactivitate au fost descoperite 3 tipuri de raze emise de nucleele radioactive. Dezintegrarea alfa constă în transformarea spontană a nucleului cu emisia de particule α (nucleul de heliu). A Z X → A-4 Z -2 Y+ 4 2 În timpul dezintegrarii α, nucleul fiică poate fi format într-o stare excitată. În acest caz, energia nucleului excitat este cel mai adesea eliberată sub forma unui -cuantic. Prin urmare, dezintegrarea alfa este însoțită de radiații . dezintegrare beta constă în transformarea spontană a nucleului cu emisie de electroni (sau pozitroni). A Z X→ A Z +1 Y + 0 -1 β +ν Unde ν este denumirea particulei antineutrino. Un electron se formează ca urmare a transformării intranucleare a unui neutron într-un proton. Radiația gamma are o natură electromagnetică și este un foton cu o lungime de undă de λ≤10 -10 m Radiațiile de acest tip însoțesc nu numai dezintegrarea , ci și reacții nucleare mai complexe. Interacțiunea cu materia: O particulă încărcată care trece prin materie își pierde energia din cauza rezistenței la ionizare. În același timp, energia sa cinetică este cheltuită pentru excitarea și ionizarea atomilor mediului.Pentru a caracteriza cantitativ interacțiunea unei particule încărcate cu o substanță, se folosesc următoarele cantități: densitatea de ionizare liniară, i, numărul de perechi de ioni formate pe unitatea de cale a particulei: i=dn/dl puterea de oprire liniară a unei substanțe (S) este energia pierdută de o particulă încărcată pe unitatea de drum: S=dE/dl intervalul liniar mediu al unei particule ionizante încărcate (R) este distanța dintre începutul și sfârșitul intervalului de particule dintr-o substanță dată. Trăsături caracteristice ale interacțiunii diferitelor tipuri de radiații cu materia: Radiația alfa: Pe măsură ce particula alfa se mișcă în mediu, I crește mai întâi (cu o scădere a vitezei, timpul petrecut în apropierea moleculei mediului crește, astfel încât probabilitatea de ionizare crește), iar la sfârșitul cursei (x = R ) scade brusc, ceea ce este asociat cu o scădere a vitezei de mișcare. Când energia particulei devine mai mică decât energia necesară pentru ionizare, formarea ionilor se oprește. Graficul dependenței densității de ionizare liniară de calea parcursă de particula alfa în mediu: Ionizarea și excitația sunt procese primare. Secundar: creșterea vitezei mișcării termice moleculare, radiații caracteristice cu raze X, radioluminiscență, procese chimice. Radiația beta. Provoacă ionizare, excitare, radiație cu raze X (când electronii decelerează), radiație caracteristică Cherenkov, când viteza unui electron într-un mediu depășește viteza luminii în acest mediu. Radiația gamma provoacă o ușoară ionizare primară, împrăștiere coerentă și incoerentă, un efect fotoelectric ionizant, formarea de perechi electron-pozitron, reacții fotonucleare datorate interacțiunii unui cuantic cu un nucleu. Doza absorbita (D)
-
o valoare egală cu raportul dintre energia ∆E transferată elementului substanței iradiate și masa m a acestui element: D=∆E /m. În C, unitatea de doză absorbită este gri (Gy). 1 Gy corespunde dozei de radiație la care energia radiației ionizante de 1 J este transferată substanței iradiate cu o greutate de 1 kg.Unitate nesistemică 1rad=10 -2 Gy Doza de expunere radiația (X) caracterizează efectul ionizant al radiațiilor X și γ în aerul din jurul corpului iradiat. Unitatea SI a dozei de expunere este C/kg. Unitatea SI a dozei de expunere este C/kg. 1C/kg corespunde dozei de expunere a radiației fotonice, la care se formează ioni cu o sarcină de 1C din fiecare semn ca urmare a ionizării a 1kg de aer uscat (n.c.). Unitatea de rată a dozei de expunere este 1A/kg, iar unitatea în afara sistemului este 1R/s. Deoarece doza de radiație este proporțională cu radiația ionizantă incidentă, ar trebui să existe o relație proporțională între doza radiată și cea de expunere: D=fХ, unde f este un anumit coeficient de tranziție în funcție de substanța iradiată și de energia fotonului. Doză echivalentă - (N) utilizat pentru a evalua efectul radiațiilor ionizante asupra obiectelor biologice; are aceeași dimensiune ca și doza de radiație absorbită, dar numele este diferit. În SI: Sievert [Sv], 1Sv=1J/kg Unitate în afara sistemului: 1ber=10 -2 Sv. Există o relație între expunere și dozele absorbite: H=KD, unde K este factorul de calitate (arată de câte ori eficiența acțiunii biologice a acestui tip de radiație este mai mare decât cea a radiației fotonice, cu aceeași doză de radiație în țesuturi). 9. rata dozei. Relația dintre rata dozei de expunere și activitatea unui preparat radioactiv. Rata dozei este valoarea care determină doza primită de obiect pe unitatea de timp. Cu un efect uniform al radiației, debitul de doză N este numeric egal cu raportul dintre doza D și timpul t, în care a acționat radiația ionizantă: N=D/t. Unitatea de măsură a ratei dozei de radiație este gri (Gy), care corespunde dozei de radiație la care energia radiației ionizante de 1J este transferată unei substanțe iradiate cu greutatea de 1kg; rata dozei de radiație este exprimată în Gy/sec. Unitatea nesistemică a dozei de radiație este rad (1 rad=10 -2 Gy=100erg/g), puterea sa este rad pe secundă. Doza de expunere la radiații (X) caracterizează efectul ionizant al radiațiilor X și γ în aerul din jurul corpului iradiat. Unitatea SI a dozei de expunere este C/kg. 1C/kg corespunde dozei de expunere a radiației fotonice, la care se formează ioni cu o sarcină de 1C din fiecare semn ca urmare a ionizării a 1kg de aer uscat (n.c.). Unitatea de rată a dozei de expunere este 1A/kg, iar unitatea în afara sistemului este 1R/s. Deoarece doza de radiație este proporțională cu radiația ionizantă incidentă, ar trebui să existe o relație proporțională între doza radiată și cea de expunere: D=fХ, unde f este un anumit coeficient de tranziție în funcție de substanța iradiată și de energia fotonului. Pentru apă și țesuturi moi umane, f=1, prin urmare, doza de radiație în rads este numeric egală cu doza de expunere corespunzătoare în roentgens. Relația dintre rata dozei de expunere și activitatea preparatului radioactiv: De la sursă, fotonii γ zboară în toate direcțiile. Numărul acestor fotoni care pătrund 1m 2 din suprafața unei anumite sfere în 1s este proporțional cu activitatea A și invers proporțional cu aria suprafeței sferei (4πr 2) / Rata dozei de expunere (X / t) în volumul V depinde de numărul de fotoni, deoarece ei sunt cei care provoacă ionizarea: X /t=k γ A/r 2 Unde k γ - care este tipic pentru radionuclidul dat. 10. Legea dezintegrarii radioactive (concluzie). Schema de drept. radioactivitate artificială. Etichetat metoda atomului, aplicare în medicină. dezintegrare radioactivă este un fenomen statistic. Fie ca nucleele dN să se descompună într-un interval scurt de timp dt. Acest număr este proporțional cu intervalul de timp dt, precum și cu numărul total N de nuclee radioactive: dN=-λNdt, unde λ este constanta de dezintegrare, care este proporțională cu probabilitatea de dezintegrare a unui nucleu radioactiv t, care este diferită pentru diferite nuclee radioactive, scade cu timpul. Integram expresia rezultata si obtinem lnN/N 0 =-λt. N= N0e-λt. Aceasta este legea de bază a dezintegrarii radioactive: pentru o perioadă egală de timp, aceeași fracțiune din numărul inițial de nuclee se descompune. Procese de dezintegrare radioactivă pentru două substanțe λ1>λ2. Interpretarea informațiilor date de spectre se realizează folosind teoria atomului. Prin urmare, ne amintim pe scurt unele proprietăți ale atomilor și radiațiile lor. Un atom este un sistem format dintr-un nucleu și electroni ținuți împreună prin atracție electrostatică. Energia unui atom (mai precis, învelișul său de electroni) nu poate avea decât anumite valori, care sunt numite termeni, sau niveluri. Se numește starea cea mai scăzută de energie principal, restul - excitat. Schema nivelurilor de energie ale atomului de hidrogen este prezentată în fig. 4, unde fiecare liniuță reprezintă un nivel (cel de jos îl reprezintă pe cel principal). Distanțele nivelurilor față de starea fundamentală sunt proporționale cu energia atomului măsurată din energia stării fundamentale. Un atom își poate schimba energia trecând de la o stare la alta. Acest lucru se datorează de obicei unei schimbări în mișcarea electronului cel mai exterior. Tranzițiile de la nivelurile superioare la cele inferioare pot avea loc spontan, fără influență externă, iar diferența de energie este emisă cu o „porțiune” de radiație luminoasă, numită cuantic. Frecvența luminii emise este proporțională cu energia cuantică. Întrucât schimbările de energie strict definite corespund diferitelor tranziții, atomul emite cuante de numai anumite frecvențe, care dau naștere la linii individuale în spectru. Tranzițiile „în sus”, adică de la nivelurile inferioare la cele superioare, nu pot apărea spontan; implementarea lor necesită o sursă externă de energie (de exemplu, cuante cu frecvența corespunzătoare). Un astfel de proces se numește prelua. Numărul de niveluri de energie ale unui atom este infinit; se condensează la o limită care corespunde energiei la care electronul se separă complet de atom. Se numește setul de linii format în timpul tranzițiilor la un anumit nivel de la toate cele superioare serie spectrală. Deci, hidrogenul are o serie Lyman corespunzătoare tranzițiilor la primul nivel, o serie Balmer formată în timpul tranzițiilor la al doilea nivel etc. Deoarece primul nivel este foarte departe de celelalte, tranzițiile la acesta sunt însoțite de o schimbare mare a energiei. , iar cuantele din seria Lyman se află în regiunea ultravioletă îndepărtată. De exemplu, linia L α ;, formată în timpul tranziției de la al doilea nivel la primul, are o lungime de undă de 1216 Å 1, în timp ce partea violetă a spectrului corespunde unei lungimi de undă de aproximativ 4000 Å. Liniile din seria Balmer - H α (6563 Å), H β (4861 Å) și altele, se află în partea vizibilă a spectrului. Restul seriei de hidrogen sunt situate în regiunea infraroșu. Nivelurile de energie ale altor elemente sunt mai complexe. Pentru a le reprezenta, trebuie să desenați mai mult de o coloană, ca în Fig. 4, dar mai multe, cu o limită superioară comună. 1 (Å (angstrom) - o unitate de măsură a lungimii de undă în spectroscopie, egală cu 10 -8 cm.) În majoritatea atomilor, nivelurile de energie sunt împărțite în mai multe distanțe apropiate subniveluri. Prin urmare, liniile constau adesea din două sau trei componente sau mai multe, drept urmare sunt numite dublete, tripleți etc., sau în general - multiplete. Se numesc linii simple maitale. La atomii complecși, divizarea nivelului poate fi foarte puternică. Nivelurile atomului de hidrogen constau, de asemenea, din două subniveluri, dar energiile lor sunt practic aceleași. Comparând spectrul și schema de nivel a unui atom al oricărui element, se poate observa că liniile observate nu corespund tuturor tranzițiilor; unele tranziții nu se întâmplă deloc. Astfel de tranziții sunt numite interzisă. Permis tranzițiile corespund unor relații strict definite între nivelurile de energie, numite reguli de selecție. Trebuie remarcat faptul că tranzițiile care încalcă regulile de selecție nu sunt absolut interzise: în anumite condiții, liniile corespunzătoare pot fi încă respectate. „Gradul” de interzicere este cel mai bine caracterizat prin timpul care trebuie să treacă, în medie, până când un atom poate face spontan o anumită tranziție. Pentru o tranziție permisă, acest timp este de obicei de 10 -7 - 10 -8 secunde. Dar pentru pentru a face o tranziție interzisă, atomul trebuie să fie în starea superioară mult mai mult - de la 10 -3 sec la câteva zile sau mai mult, în funcție de gradul de inhibiție. Dacă nu există tranziții „în jos” permise de la un anumit nivel, atunci atomul în anumite condiţii poate rămâne acolo o perioadă relativ lungă de timp.Asemenea niveluri se numesc metastabil. Pentru majoritatea elementelor și ionii lor, nivelurile scăzute aproape de nivelul solului sunt metastabile. Liniile interzise sunt de obicei indicate prin simbolul elementului între paranteze pătrate, cu o cifră romană indicând gradul de ionizare. De exemplu, [OH] înseamnă linia interzisă a oxigenului ionizat, a - linia interzisă a oxigenului dublu ionizat. Liniile permise nu au paranteze pătrate. Pentru ca un atom să emită un cuantic, acesta trebuie să fie la unul dintre nivelurile excitate, adică trebuie să i se acorde o energie corespunzătoare diferenței dintre energiile nivelului luat în considerare și cel inițial. Această energie poate fi transmisă unui atom fie atunci când absoarbe un cuantic, fie când se ciocnește cu o altă particulă, în principal un electron. În acest caz, energia electronului trebuie să fie mai mare decât energia tranziției corespunzătoare. Energia medie a particulelor este proporțională cu temperatura absolută a gazului. Cu toate acestea, chiar dacă energia medie este insuficientă pentru excitare, există întotdeauna electroni în gaz cu energia necesară, dar numărul lor scade rapid odată cu creșterea energiei. Prin urmare, numărul de excitații ale unui nivel a cărui energie este vizibil mai mare decât energia medie va fi relativ mic 1 . 1 (Frecvența de excitație depinde nu numai de numărul de electroni a căror energie este mai mare decât pragul de excitare, ci și de proprietățile atomului însuși, mai precis, de probabilitatea de excitare a unui anumit nivel al atomului de către un electron rapid.) Impactul unui ion sau al unui atom neutru poate transfera atomul într-o stare excitată, dar pentru aceasta energia ionului trebuie să fie de sute sau mii de ori mai mare decât energia nivelului, deoarece o particulă grea transferă întotdeauna doar o o parte foarte mică din energia sa la un electron ușor al unui atom. Prin urmare, excitarea de către particule grele nu are de obicei nicio importanță în condiții astrofizice, cu excepția cazurilor în care nivelul de energie este excepțional de mic. Dacă un electron se ciocnește cu un atom excitat, acesta din urmă își poate transfera energia acestuia. Apoi atomul va merge într-o stare inferioară fără a emite un cuantic, iar electronul care se ciocnește va sări cu energie crescută. Un astfel de proces se numește lovitură de al doilea fel, spre deosebire de procesul de excitare a unui atom în timpul unei coliziuni ( hit-uri de primul fel). Impacturile de al doilea fel sunt esențiale în gazele dense, unde intervalul de timp dintre ciocnirile atomilor este mai mic decât durata de viață a unui atom în stare excitată. În acest caz, atomii se ciocnesc înainte de a avea timp să radieze, astfel încât impacturile de al doilea tip atenuează semnificativ radiația. Pentru nivelurile metastabile, de la care nu sunt permise tranziții „în jos” și unde, prin urmare, atomul rămâne mult mai mult, impacturile de al doilea fel pot fi, de asemenea, semnificative la densitate scăzută. De aceea, în laborator nu observăm linii corespunzătoare tranzițiilor interzise: excitația se termină de obicei cu un impact de ordinul doi, și nu cu radiații. Într-un gaz foarte rarefiat, intervalul dintre ciocniri poate deveni comparabil cu timpul de existență în stare metastabilă, iar liniile interzise vor apărea. După cum se va vedea mai jos, aceste condiții sunt realizate în nebuloase. Dacă un electron dobândește mai multă energie decât limita termenilor, se va desprinde de atom. Un astfel de proces se numește ionizare. Ionizarea unui atom poate avea loc atât atunci când un cuantic este absorbit, cât și atunci când se ciocnește cu un electron rapid. Un electron liber care nu este legat de un atom poate avea orice energie. Prin urmare, spre deosebire de tranzițiile în interiorul unui atom, unde pot fi absorbite cuante de doar o anumită frecvență, ionizarea poate fi produsă de orice cuantă a cărei energie este mai mare decât cea necesară pentru trecerea de la nivelul inițial la energia de ionizare. De exemplu, un atom de hidrogen situat la primul nivel poate absorbi orice cuantă a cărei lungime de undă este mai mică de 912 A, iar de la al doilea nivel - o cuantă cu o lungime de undă mai mică de 3646 A. Dacă energia cuantică este mai mare decât este necesar pentru a detașa un electron, atunci excesul de energie trece în energia cinetică a electronului ejectat. Ionizarea prin impact este posibilă numai dacă energia electronului de impact este mai mare decât cea necesară pentru detașare. Cu cat temperatura gazului este mai mare, cu atat numarul de electroni are energia necesara mai mare, cu atat apar mai des ionizari, si cu atat mai mare, cu toate acestea, proportia atomilor ionizati. O particulă grea poate ioniza un atom doar la energii mari, mult mai mari decât energia de ionizare. Dacă gazul are o temperatură foarte ridicată sau se află într-un câmp de radiații puternic, atunci înainte de a avea timp să prindă electronul înapoi, un al doilea, al treilea electron, etc., poate fi smuls din el. repetat atomi ionizați. Cu toate acestea, detașarea fiecărui electron ulterior necesită din ce în ce mai multă energie, pe măsură ce sarcina ionului crește. Prin urmare, ionizarea multiplă necesită o temperatură foarte ridicată a gazului sau a sursei de radiații ionizante. Procesul invers de ionizare se numește recombinare. Reprezintă captarea unui electron de către un ion. Un electron poate fi captat de un atom la orice nivel. Prin urmare, un atom format ca rezultat al recombinării poate fi fie excitat, fie neexcitat. În timpul recombinării, ar trebui eliberată o energie egală cu diferența dintre energiile unui electron liber și cel legat, de obicei sub forma unui cuantic. Dacă un electron cu energie scăzută se recombină, atunci frecvența cuantumului este aproape de limita seriei nivelului corespunzător. Cu cât energia electronului recombinat este mai mare, cu atât frecvența cuantumului emis este mai mare. Întrucât electronii liberi pot avea orice energie, spectrul emis în timpul recombinărilor are forma unei benzi continue, începând imediat după limita seriei și întinzându-se, slăbind treptat, spre frecvențe mai înalte. Un astfel de spectru se numește continuum. Slăbirea luminozității este cauzată de faptul că fracția de electroni rapizi scade întotdeauna odată cu creșterea energiei. Cu cât temperatura gazului este mai mare, cu atât energia medie a electronilor recombinați este mai mare și cu atât intensitatea scade mai lent dincolo de limita seriei. Am spus deja mai sus că un atom este capabil să emită lumină nu numai în timpul recombinării, ci și în timpul tranzițiilor de la un nivel de energie la altul. Se dovedește că un electron liber, care se mișcă în câmpul electric al unui ion, este, de asemenea, capabil să emită radiații. Un electron liber se mișcă în câmpul unui ion de-a lungul unei orbite hiperbolice, iar diferite orbite corespund unor energii diferite. Așa cum un cuantic este emis sau absorbit în timpul tranziției unui electron legat într-un atom de la o orbită eliptică la alta, un cuantic poate fi emis sau absorbit atunci când un electron trece de pe o orbită hiperbolică pe alta. Un astfel de proces numită tranziție de la liber la liber. Deoarece energia ambelor orbite poate avea orice valoare, emisia și absorbția în timpul tranzițiilor libere au loc într-un spectru continuu. Modificarea energiei în timpul tranzițiilor libere este de obicei o mică parte din energia totală a electronului, astfel încât energia fotonilor emiși este mai mică decât energia medie a electronilor. La o temperatură nu foarte ridicată, radiația liberă a gazului este concentrată în regiunea undelor lungi - de la raze infraroșii la unde radio. Până acum am vorbit despre emisia și absorbția luminii de către atomii individuali. În realitate, radiația dintr-un întreg strat de gaz este întotdeauna observată. Dacă stratul de gaz este transparent la toate frecvențele, radiația atomilor individuali se va rezuma pur și simplu. Acesta va consta din linii luminoase pe fundalul unui spectru continuu mai puțin luminos format în timpul recombinărilor la diferite niveluri și în timpul tranzițiilor libere la libere. Dar dacă creșteți grosimea stratului de gaz, atunci o parte din radiație va fi absorbită de acesta. În primul rând, cuantele care formează liniile vor fi absorbite și, prin urmare, liniile vor fi mai puțin contrastate pe fundalul spectrului continuu. Dacă stratul omogen este practic opac la toate frecvențele, atunci liniile vor dispărea. Radiația va avea un spectru continuu în funcție doar de temperatură, iar intensitatea maximă din acest spectru se va deplasa către unde scurte odată cu creșterea temperaturii stratului de gaz. În același timp, cantitatea totală de energie emisă de o unitate de suprafață va crește. Radiația stelelor este complicată de faptul că stratul nu este omogen - temperatura și densitatea acestuia cresc odată cu adâncimea. Prin urmare, există linii întunecate în spectrul stelelor, iar cursul general al intensității în acesta nu coincide cu spectrul unui strat opac de gaz. De ce elementele gazoase absorb sau emit radiații cu lungimi de undă fixe și nu radiații cu un spectru continuu (continuu)? Răspunsul la această întrebare a fost una dintre cele mai mari realizări ale lui Bohr. El a stabilit o corespondență între liniile spectrului atomic și energiile electronilor din atomi. El a susținut că un electron dintr-un atom nu poate avea valori de energie arbitrare în intervalul de schimbare continuă, ci trebuie să numească, doar anumite valori fixe de energie. Bohr a numit aceste valori ale energiei niveluri discrete sau cuantice. Fiecărei astfel de valori de energie, Bohr i-a atribuit un anumit număr, pe care l-a numit număr cuantic. Un electron poate sări de la un nivel de energie la altul, emițând sau absorbind o anumită cantitate fixă de energie. Această porțiune de energie se numește cuantum de energie. Un electron la cel mai scăzut nivel de energie este considerat a fi în starea fundamentală. Electronii la niveluri mai mari de energie sunt considerați a fi în stări excitate. Tranziția unui electron la un nivel de energie mai înalt se numește excitație. Care sunt exact aceste cuante de energie care sunt absorbite sau emise în timpul tranzițiilor electronilor de la un nivel de energie la altul? Bohr era conștient de rezultatele studiilor lui Planck și Einstein, precum și de faptul că, conform postulatului lui Einstein, lumina este formată din fotoni. Bohr a sugerat că un electron poate sări doar de la un nivel de energie la altul, mai mare, în timp ce absoarbe un foton cu o energie strict definită. Pentru că Niels Bohr (1885-1962), Premiul Nobel pentru Fizică 1922 Orez. 1.10. Tranziții electronice între nivelurile de energie. Energia unui foton absorbită sau emisă în timpul unei tranziții electronice este egală cu diferența dintre energiile acelor niveluri între care are loc tranziția: . (Litera greacă A este folosită pentru a desemna o modificare cantitativă a unei proprietăți sau diferența dintre două dintre valorile acesteia.) Diferența de energie este legată de frecvența v a unui foton prin ecuația , unde A este constanta lui Planck. Astfel, fiecare tranziție este caracterizată de o frecvență bine definită. Această frecvență corespunde unei linii specifice din spectrul atomic. Energia unui foton este legată de lungimea de undă (sau frecvența sa), ceea ce înseamnă că absorbția poate avea loc numai dacă un electron absoarbe un foton care are o frecvență bine definită. În schimb, atunci când un electron coboară de la un nivel de energie mai înalt la un nivel de energie mai scăzut, emite un foton care are o anumită frecvență. Această frecvență corespunde unei linii bine definite în spectru. Astfel, fiecare linie din spectrul atomic corespunde saltului de electroni de la un nivel specific de energie la un alt nivel de energie specific (Fig. 1.10). Sarcina numărul 1.
Ce părți ale unei celule vegetale sunt vizibile la microscopul școlar ușor?
1. Ribozomi 2. Mitocondriile 3. Peretele celular 4. Membrana plasmatica Explicaţie: mari porțiuni de celule sunt vizibile la microscop cu lumină. Dintre cele prezentate, un organel atât de mare este peretele celular (este destul de gros), iar membrana plasmatică este greu de izolat vizual (cu o mică creștere) de peretele celular. Raspunsul corect este 3. Sarcina numărul 2.
Un fragment al unei molecule de ADN, format din 12 nucleotide, stochează informații despre
1. 4 aminoacizi într-o moleculă proteică 2. 16 nucleotide ale unei molecule de ARNt 3. Moleculă de ARNm de 12 aminoacizi 4. 24 de nucleotide moleculă de ARNr Explicaţie: Trei nucleotide ale unei molecule de ADN codifică un aminoacid (această structură se numește triplet), deci 12 nucleotide ale ADN-ului codifică 4 aminoacizi dintr-o moleculă de proteină. Raspunsul corect este 1. Sarcina numărul 3.
Tranziția electronilor la un nivel de energie mai ridicat are loc în faza luminoasă în molecule
1. Clorofila 2. Apa 3. Glucoză 4. Dioxid de carbon Explicaţie:în timpul fotosintezei, molecula de clorofilă este cea care intră într-o stare excitată, deoarece din pigment începe lanțul de reacții biochimice în timpul fotosintezei. Raspunsul corect este 1. Sarcina numărul 4.
În cursul dezvoltării individuale a unui animal, un organism multicelular se dezvoltă dintr-un zigot prin
1. Meioza 2. Mitoza 3. Filogenie 4. Gametogeneza Explicaţie: după formarea unui zigot, zigotul începe să se despartă tocmai prin mitoză (acesta este procesul de diviziune a celulelor somatice), adică două celule diploide se formează dintr-o celulă diploidă: două dintr-o celulă, 4 din două, 8 din patru etc. Raspunsul corect este 2. Sarcina numărul 5.
Particularitatea reproducerii asexuate este că un nou organism se dezvoltă din
1. Gamet masculin 2. Ovul nefertilizat 3. Zigoți cu un set dublu de cromozomi 4. Celulă somatică cu un set dublu de cromozomi Explicaţie: reproducerea asexuată nu este asociată cu celulele germinale, prin urmare, din variantele de răspuns prezentate, reproducerea asexuată este posibilă numai atunci când organismul se dezvoltă dintr-o celulă somatică cu un set dublu de cromozomi. Cu reproducerea vegetativă se obține un organism fiică, identic cu părintele. Raspunsul corect este 4. Sarcina numărul 6.
Determinați modelul de ameliorare dacă se știe că atunci când o roșie cu fructe rotunde, al cărei genotip este necunoscut, este încrucișată cu o roșie în formă de pară (trăsătură recesivă), 50% din urmași au fructe în formă de pară. 1. AA x aa 2. Aa x aa 3. Aa x Aa 4. AA x AA Explicaţie: 50% din urmași vor avea fructe în formă de pară numai dacă un heterozigot este încrucișat cu un homozigot pentru o trăsătură recesivă - Aa x aa. Raspunsul corect este 2. Sarcina numărul 7.
Divergența independentă a cromozomilor omologi în meioză este cauza variabilității
1. Genomic 2. Combinativ 3. Cromozomiale 4. Citoplasmatic Explicaţie: variabilitate combinativă - variabilitatea care apare atunci când genele parentale sunt recombinate. Motivele pot fi încălcări în: trecerea în metafaza meiozei, divergența cromozomilor în meioză, fuziunea celulelor germinale. Raspunsul corect este 2. Sarcina numărul 8.
N.I. Vavilov, în timp ce studia caracteristicile moștenirii trăsăturilor plantelor cultivate, a fundamentat legea 1. Serii omoloage în variabilitatea ereditară 2. Moștenirea independentă a genelor non-alelice 3. Dominanța hibrizilor din prima generație 4. Moștenirea legată de sex Explicaţie: N.I. Vavilov a formulat legea seriei omologice, care este următoarea: datorită similitudinii mari a genotipurilor lor (seturi de gene aproape identice), speciile apropiate au o variabilitate ereditară potențială similară (mutații similare ale genelor identice); pe măsură ce îndepărtarea evolutiv-filogenetică a grupurilor studiate (taxa), datorită diferenţelor genotipice emergente, paralelismul variabilităţii ereditare devine mai puţin complet. În consecință, baza paralelismelor în variabilitatea ereditară sunt mutațiile genelor omoloage și ale regiunilor genotipului la reprezentanții diferiților taxoni, adică variabilitatea ereditară cu adevărat omoloagă. Cu toate acestea, chiar și în cadrul aceleiași specii, caracterele similare în exterior pot fi cauzate de mutații în gene diferite; astfel de mutații fenotipice paralele ale diferitelor gene pot apărea, desigur, și la specii diferite, dar mai degrabă înrudite. Raspunsul corect este 1. Sarcina numărul 9.
Regatul bacteriilor include
1. Chlamydomonas 2. E. coli 3. Infuzorii-pantof 4. Plasmodium Malarial Explicaţie: chlamydomonas, papucul ciliat și plasmodiumul malaric sunt protozoare, iar Escherichia coli ( Escherichia coli - bacterie. Raspunsul corect este 2. Sarcina numărul 10.
Tubercul, bulbul este
1. Organe ale respirației solului 2. Lăstari modificați 3. Organe generatoare 4. Lăstari rudimentari Explicaţie: tuberculul și bulbul (precum și, de exemplu, rizomul) sunt lăstari modificați. Raspunsul corect este 2. Sarcina numărul 11.
Ferigile, spre deosebire de plantele cu flori, se reproduc prin
1. Dispute 2. Rădăcini 3. Rizom 4. Înmugurire Explicaţie: plantele cu flori se reproduc prin semințe, în timp ce ferigile se reproduc prin spori. Raspunsul corect este 1. Sarcina numărul 12.
Ce clasă au artropodele ochi simpli și patru perechi de picioare care merg?
1. Insecte 2. Cefalopode 3. Scoici 4. Arahnide Explicaţie: Privește imaginea și trage la concluzia că răspunsul corect este 4. Sarcina numărul 13.
O rată metabolică ridicată permite păsărilor
1. Aveți grijă de urmași 2. Depuneți ouăle în cuiburi 3. Mănâncă alimente vegetale 4. Cheltuiește multă energie în timpul zborului Explicaţie: o rată metabolică ridicată este una dintre adaptările pentru zbor, așa că alegem să consumăm multă energie în timpul zborului. Raspunsul corect este 4. Sarcina numărul 14.
Dacă o persoană suferă de anemie, atunci în sângele său, în comparație cu norma, conținutul
1. Leucocite 2. Globule roșii 3. Trombocitele 4. Fibrinogen Explicaţie: anemia (un alt nume - anemie) se exprimă într-un conținut redus de globule roșii - eritrocite și/sau hemoglobină. Simptomele bolii: amețeli, oboseală crescută etc. din cauza aprovizionării insuficiente cu oxigen a celulelor. Raspunsul corect este 2. Sarcina numărul 15.
Defalcarea primară a carbohidraților complecși din corpul uman are loc în
1. Cavitatea bucală sub acțiunea enzimei salivare 2. Cavități gastrice sub acțiunea enzimei pepsine 3. Celule hepatice care stochează glicogen 4. Celulele pancreatice care produc hormoni Explicaţie: o enzimă produsă în stomac și cavitatea bucală - amilaza începe descompunerea carbohidraților complecși - polimeri din cavitatea bucală. Raspunsul corect este 1. Sarcina numărul 16.
Funcția de distrugere a microorganismelor străine din sângele uman este îndeplinită de
1. Neuroni 2. Globule roșii 3. Celulele epiteliale 4. Limfocite Explicaţie: limfocitele sunt celule ale sistemului imunitar, adică luptă cu microorganismele străine din sângele uman. Raspunsul corect este 4. Sarcina numărul 17.
Impactul luminii crepusculare este convertit de analizatorul vizual uman în impulsuri nervoase
1. Lentila ochiului 2. Pupila irisului 3. Bastoane retiniene 4. Sclera globului ocular Explicaţie: receptorii care percep semnalele luminoase la amurg și întuneric sunt tijele retiniene. De la ei, semnalul este transmis către sistemul nervos central. Raspunsul corect este 3. Sarcina numărul 18.
Atelea unui membru rupt
1. Reduce sângerarea 2. Reduce edemul membrelor 3. Previne pătrunderea microorganismelor în locul fracturii 4. Previne deplasarea oaselor rupte Explicaţie: se pune o atela pe membrul rupt pentru a preveni deplasarea oaselor. Raspunsul corect este 4. Sarcina numărul 19.
Rolul creator al selecției naturale se manifestă în
1. Întărirea luptei intraspecifice 2. Dezvoltarea de către organisme a noi habitate 3. Apariția de noi mutații 4. Apariția de noi specii Explicaţie: selecția naturală este una dintre forțele motrice ale evoluției. Scopul evoluției este de a crea cele mai adaptate specii în condiții date, de aceea rolul creator al selecției naturale se manifestă și în crearea de noi specii. Raspunsul corect este 4. Sarcina numărul 20.
În știința biologică modernă, o populație este considerată a fi
1. Totalitatea organismelor dintr-un regn 2. Indivizi care formează un lanț trofic 3. Indivizi de diferite specii care formează o biocenoză 4. Indivizi din aceeași specie care trăiesc pe același teritoriu Explicaţie: populație - un grup de indivizi din aceeași specie care trăiesc pe același teritoriu și se încrucișează liber. Raspunsul corect este 4. Sarcina numărul 21.
Seria filogenetică a calului mărturisește (despre)
1. Reversibilitatea procesului de evoluție 2. Revenirea regulată la formele ancestrale 3. Similitudinea dezvoltării postembrionare a organismelor 4. Dezvoltarea istorică a aspectului modern Explicaţie: Luați în considerare seria filogenetică a calului. După cum se poate observa din imagine, seria filogenetică a unei specii este o urmărire a etapelor dezvoltării sale istorice. Raspunsul corect este 4. Sarcina numărul 22.
Care dintre următoarele exemple ilustrează relația competitivă dintre organisme?
1. Veveriță - ciocănitoare 2. Stejar - ciupercă albă 3. Vaca - taur tenia 4. Deja - o broasca Sarcina numărul 23.
Ca urmare a relațiilor biotice pe termen lung, se observă prădător-pradă în biocenoza naturală.
1. Creșterea nereglementată a numărului de prădători 2. Fluctuație regulată a abundenței ambelor grupuri de organisme 3. Acumularea de alele mutante în fondul genetic al victimelor 4. Manifestarea trăsăturilor dominante într-o populație de prădători Explicaţie: cu o relație de lungă durată prădător-pradă, se menține un număr constant din aceste două specii, dar din cauza modificărilor condițiilor de mediu apar valuri de populație și se sting treptat prin constanța acestui sistem (adică un astfel de sistem este destul de stabil). Raspunsul corect este 2. Sarcina numărul 24.
Datorită materiei vii din biosferă, circulației substanțelor
1. Deschide 2. Implică o mulțime de elemente chimice 3. Crește diversitatea agrocenozelor de pe Pământ 4. Asigură acumularea de gaze inerte în atmosferă Explicaţie: datorită organismelor vii (și în special microorganismelor), în natură există cicluri ale multor elemente (și substanțe complexe - dioxid de carbon, apă), precum: carbon, hidrogen, oxigen, sulf și multe altele. altele și chiar fierul. Raspunsul corect este 2. Sarcina numărul 25.
Sunt corecte următoarele afirmații despre formele selecției naturale?
A. Selecția stabilizatoare se manifestă în condițiile unei schimbări bruște a componenței pe sexe a populației.
B. Selecția de conducere contribuie la creșterea numărului de indivizi cu o valoare medie a trăsăturii.
1. Doar A este adevărat 2. Doar B este adevărat 3. Ambele judecăți sunt corecte 4. Ambele judecăți sunt greșite Explicaţie: selecția stabilizatoare funcționează numai în condiții constante de mediu și păstrează indivizii cu o valoare medie a trăsăturii, A - incorectă. Selecția de conducere reține indivizii cu devierea de la valoarea medie a trăsăturii, B - incorect. Raspunsul corect este 4. Sarcina numărul 26.
În timpul spermatogenezei
1. Se formează celule sexuale masculine 2. Se formează celule somatice 3. Reducerea la jumătate a numărului de cromozomi 4. Se formează patru gameți 5. Se formează un ou 6. Se formează celule cu un set diploid de cromozomi Explicaţie: spermatogeneza - procesul de formare a celulelor germinale masculine, în timp ce patru celule germinale haploide sunt formate din celula precursoare (diploidă) (adică setul de cromozomi este înjumătățit). Răspunsul corect este 1, 3, 4. Sarcina numărul 27.
Circulația sistemică în corpul uman
1. Începe în ventriculul stâng 2. Are originea in ventriculul drept 3. Saturat cu oxigen în alveolele plămânilor 4. Furnizează organelor și țesuturilor oxigen și substanțe nutritive 5. Se termină în atriul drept 6. Aduce sânge în partea stângă a inimii Explicaţie: Luați în considerare circulația sistemică. După cum se poate observa din figură, un cerc mare își are originea în ventriculul stâng și transportă sânge (oxigen, hormoni etc.) către toate celulele corpului, iar dioxidul de carbon îl ia din celule și îl duce înapoi la inimă, anume spre atriul drept. Răspunsul corect este 1, 4, 5. Sarcina numărul 28.
Procesele care conduc la formarea de noi specii în natură includ
1. Diviziunea celulară mitotică 2. Proces de mutație asemănător unui salt 3. Variabilitatea modificării 4. Izolarea geografică 5. Reproducerea asexuată a indivizilor 6. Selecția naturală Explicaţie: diverse mutații duc la formarea de noi specii (aceasta este precedată de acumularea și distribuția lor în întreaga populație), izolarea geografică (în absența reproducerii cu indivizi din alte populații poate apărea o nouă specie) și selecția naturală este o proces dirijat în timpul căruia cei mai adaptați supraviețuiesc unui organism și, ulterior, se formează o specie care este adaptată maxim la condițiile de mediu date. Răspunsul corect este 2, 4, 6. Sarcina numărul 29.
Stabiliți o corespondență între caracteristicile nutriției autotrofe și tipul acesteia.
Caracteristic Tip de nutriție autotrofă A. Se utilizează energia de oxidare 1. Fotosinteza substanţe anorganice 2. Chemosinteza B. Sursa de energie – lumina soarelui B. Efectuat în celule vegetale D. Are loc oxidarea amoniacului D. Oxigenul este eliberat în atmosferă Explicaţie: fotosinteza este procesul de transformare a energiei Soarelui în energia legăturilor chimice, realizat de fototrofi. Chemosinteza este procesul de transformare a substanțelor anorganice în substanțe organice folosind energia de oxidare a compușilor chimici. Prin urmare, fotosinteza se referă la: sursa de energie este lumina soarelui, procesul are loc în celulele vegetale și eliberarea de oxigen în atmosferă. Celelalte două prevederi se referă la chimiosinteză. Răspunsul corect este 21121. Sarcina numărul 30.
Stabiliți o corespondență între caracteristica și regnul organismelor.
Regatul caracteristic al organismelor A. Peretele celular contine chitina 1. Ciuperci B. Tipul de nutriție autotrof 2. Plante B. Formează substanțe organice din anorganice D. Nutrientul de rezervă este amidonul. D. În sistemele naturale sunt descompunetori E. Corpul este format din miceliu Explicaţie: compoziția peretelui celular al ciupercilor include chitina, acestea sunt heterotrofe (adică consumă substanțe organice gata preparate) și descompunetoare (descompun substanțele organice în cele anorganice), corpul lor este format din miceliu. Plantele sunt autotrofe (formează substanțe organice din substanțe anorganice, amidonul este substanța de rezervă. Răspunsul corect este 122211. Sarcina numărul 31.
Stabiliți o corespondență între semnul reglării funcțiilor din corpul uman și mecanismul acestuia.
Semn Mecanismul de reglementare A. Efectuat de sistemul endocrin 1. Nervos B. Răspândirea hormonilor 2. Umoral B. Livrat organelor prin sânge D. Viteza de expunere este foarte mare D. Pe baza fenomenelor bioelectrice Explicaţie: reglare nervoasă - reglare cu ajutorul sistemului nervos, adică se efectuează de-a lungul proceselor celulelor nervoase (cu ajutorul impulsurilor electrice), viteza unei astfel de reglementări este foarte mare. Reglarea umorală (hormonală) - reglare cu ajutorul unor substanțe biologic active - hormoni care sunt eliberați organelor de sânge și produși de glandele sistemului endocrin. Răspunsul corect este 22211. Sarcina numărul 32.
Stabiliți o corespondență între tipul de organisme și direcția de evoluție care îi este caracteristică.
Specie Direcția de evoluție A. Şobolan cenuşiu 1. Progres biologic B. Leopardul de zăpadă 2. Regresia biologică B. Tigrul Amur G. Iarbă de grâu târâtoare calul lui D. Przewalski E. păpădie comună Explicaţie: progres biologic - o creștere a aptitudinii indivizilor, însoțită de o creștere a numărului, extinderea gamei și variabilitatea intraspecifică. Regresia biologică - o scădere a aptitudinii indivizilor, însoțită de o scădere a numărului, o scădere a intervalului și extincția în continuare a speciei. Reducerea numărului este tipică pentru leopardul de zăpadă, tigrul Amur și calul Przewalski. Răspunsul corect este 122121. Sarcina numărul 33.
Indicați succesiunea proceselor de speciație geografică.
1. Distribuția unei trăsături într-o populație 2. Apariția mutațiilor în noile condiții de viață 3. Izolarea spațială a populațiilor 4. Selectarea persoanelor cu modificări benefice 5. Formarea unei noi specii Explicaţie: speciația începe cu izolarea, în astfel de condiții încep să apară mutații, dintre care sunt selectate doar cele utile, apoi aceste mutații benefice se răspândesc la toți indivizii din populație. Speciația geografică se încheie, ceea ce este logic, cu formarea unei noi specii. Răspunsul corect este 32415. Sarcina numărul 34.
Care este scopul folosirii ciupercilor de drojdie la coacerea pâinii și a produselor de panificație? Ce proces are loc? Explicaţie: la coacerea pâinii se folosește drojdia, deoarece drojdia desfășoară fermentație (respirație fără oxigen), eliberând dioxid de carbon, care ajută la ridicarea aluatului (se formează bule în aluat), ceea ce dă ulterior splendoarea aluatului. Sarcina numărul 35.
Ce diviziune și ce fază sunt prezentate în figură? Indicați setul de cromozomi (n), numărul de molecule (e) de ADN din această perioadă. Justificați răspunsul. Explicaţie:în figură, perechile de cromozomi omologi sunt aliniate la ecuatorul celulei și sunt gata să diverge (adică aceasta este perioada de dinaintea anafazei 1) și înainte de anafaza 1, metafaza 1. Aceasta înseamnă că diploidul se instalează în celula este 2n (deoarece vedem perechi de cromozomi), iar numărul de molecule ADN - 4c, deoarece fiecare cromozom este format din două cromatide (adică două molecule de ADN). Sarcina numărul 36.
Găsiți erori în textul dat. Indicați numărul de propoziții în care s-au făcut erori, corectați-le.
1. Mitocondriile și plastidele sunt organite cu două membrane. 2. Pigmenții fotosensibili sunt localizați pe membrana interioară a mitocondriilor și plastidelor. 3. Spre deosebire de plastide, mitocondriile conțin propria lor moleculă circulară de acid nucleic. 4. Procesul de fotosinteză are loc în cloroplaste. 5. Funcția principală a mitocondriilor este sinteza lipidelor celulare. Explicaţie: 2 - nu există pigmenți pe membrana mitocondrială (din moment ce nu realizează procesul de fotosinteză). 3 - plastidele conțin și propriul acid nucleic. 5 - funcția principală a mitocondriilor este sinteza ATP (moleculă de energie universală), și nu lipide. Sarcina numărul 37.
Cum este reglarea neuroumorală a separării sucului gastric în corpul uman? Explicați răspunsul. Explicaţie: reglarea nervoasă se realizează în două moduri: 1. Cu ajutorul reflexelor condiționate: la vederea unei lămâi (sau a alimentelor în general) sau a sunetului de oale în gură începe să se elibereze salivă, adică corpul. se pregătește pentru a mânca prin eliberarea de enzime. 2. Cu iritarea receptorilor cavității bucale și stomacului, adică cu ajutorul reflexelor necondiționate. Reglarea umorală se realizează numai atunci când nutrienții intră în sânge în timpul absorbției. Hormonii încep să fie eliberați și transportați către celulele corpului. Sarcina numărul 38.
Specificați ce criterii de tip sunt indicate în text.
Toți indivizii speciilor de șopârle agile au același cariotip. La masculii șopârlei rapide, culoarea corpului este verde, în timp ce la femele este maro. Aceste animale sunt cele mai numeroase în zonele tropicale și subtropicale ale globului. Explicaţie: descrierea cariotipului – criteriu genetic. Descrierea culorii corpului (și diferențele dintre femele și bărbați) este un criteriu morfologic. Descrierea gamei speciilor este un criteriu geografic. Sarcina numărul 39.
ARNt-urile cu anticodoni CCA, GUU și GAA au fost implicate succesiv în sinteza proteinelor. Determinați compoziția moleculelor de ADN și ARNm. Explicaţie: Să începem să scriem compoziția moleculelor în ordine inversă, adică mai întâi ARNt, apoi ARNm și în final ADN. ARNt: CCA GUU GAA ARNm: GGU CAA CUU DNA: CCA GTT GAA Sarcina numărul 40.
Pentru o femelă cu crestă (A) verde (B) a fost efectuată o încrucișare de analiză, s-au obținut patru clase fenotipice la descendenți. Progeniturile crestate rezultate au fost încrucișate între ei. Este posibil să obțineți descendenți fără o creastă în această traversare? Dacă da, ce gen va fi, ce fenotip? La canari, prezența unei creste depinde de o genă autozomală, culoarea penajului (verde sau maro) depinde de o genă legată de cromozomul X. Sexul heterogametic la păsări este feminin. Explicaţie:
Prima cruce: R: AaHVU x aaHvHv G: AHV, AHV, AU, AU X AHV F1: АаХВХв - mascul verde crestat ааХВХв - mascul verde fără creastă AaHvU - femela brună cu creastă Încrucișăm un mascul și o femelă cu o creastă: R: AaHVHv x AaHvU G: AHV, AHV, AHV, AHV x AHV, AU, AHV, AU F2: obținem 16 genotipuri, dintre care se pot distinge doar 4 fenotipuri. Fenotipuri ale indivizilor fără creastă: Femele: ааХВУ - femela verde fără creastă ааХвУ - femela brună fără creastă Masculi: ааХВХв - mascul verde fără creastă ааХвХв - mascul brun fără creastă.