Energia unui electron este maximă la nivel de energie. Calculul numărului de orbitali atomici la subniveluri
1. Sistem periodic de elemente ca formă de reflectare a legii periodice . Formulări ale legii periodice. Principalele regularități ale umplerii orbitalilor atomici cu electroni și formarea perioadelor. s -, p -, d - șif -elementele şi amplasarea lor în sistemul periodic. Structura sistemului periodic: perioade mici și mari, subgrupe principale și secundare. Poziția lantanidelor și actinidelor. Formele moderne ale tabelului periodic. Legea periodică ca bază pentru dezvoltarea chimiei anorganice. Semnificația științifică generală a legii periodice.
1 Cu. 41–46; 2 Cu. 46–55; 4 Cu. 30–40; 5 . Cu. 6–8, 21–32; 8 Cu. 105–106; 11 Cu. 75–203.
Legea periodicăîn termeni moderni: „Proprietățile atomilor elementelor chimice, precum și compoziția și proprietățile substanțelor pe care le formează, sunt într-o dependență periodică de sarcini. nuclee atomice».
Expresia grafică a legii periodice este tabelul sistemului periodic de elemente. Există o singură lege periodică și sunt cunoscute peste 500 de forme ale sistemului periodic de elemente, dintre care cele mai comune perioadă scurtă(8 celule) , perioadă semilungă(18 celule) și perioada lunga(32 celule).
Elementele chimice sunt aranjate în tabelul periodic în ordinea sarcinii crescătoare a nucleelor atomilor lor. Sistemul periodic este format din perioadeși grupuri.
Perioadă- un număr de elemente dispuse în ordinea sarcinii crescătoare a nucleelor atomilor lor, a căror configurație electronică a nivelului de energie externă variază de la ns 1 (metal alcalin) to ns 2 np 6 (gaz nobil). Pentru prima perioadă - de la 1 s 1 (hidrogen) la 1 s 2 (heliu). Se numesc prima, a doua și a treia perioadă mic(sau scurt), restul - mare(sau lung). Sunt 7 perioade în total.
Semnificația fizică a numărului perioadei – este egal numărul de niveluri de energie din atomii elementelor chimice într-o perioadă dată. De exemplu, în atomii elementelor din perioada a 4-a, care se află într-o stare neexcitată, electronii sunt distribuiți pe 4 niveluri de energie (4 învelișuri de electroni).
grup – rând vertical elemente care au similare structura electronica atomi și prezentând astfel proprietăți similare. De regulă, numărul grupului indică numărul de electroni dintr-un atom al unui element care poate participa la formarea unei legături chimice.
2. Periodicitatea proprietăților atomilor elementelor chimice. Factorii care determină natura schimbării proprietăți chimice elemente. „Configurația” și „structura” învelișurilor de electroni ale atomului, schimbarea lor în perioade și grupuri. Razele atomilor și ionilor, raportul dintre valorile lor. Raze efective (covalente, ionice, metalice) și orbitale. Modificarea razelor atomilor și ionilor pe perioade și grupuri.
Energia de ionizare (potenţialul de ionizare) şi afinitatea electronică. Factorii care determină valorile lor: raza atomului, configurația învelișului electron exterior, sarcina efectivă a nucleului atomic. Modele de schimbare a energiei de ionizare și a afinității electronilor în perioade și grupuri.
Conceptul de electronegativitate. Modificarea electronegativității atomilor în perioade și grupuri. Influența diferenței de electronegativitate a atomilor asupra naturii legăturii chimice dintre ei. Modificări ale proprietăților chimice ale elementelor în grupuri și perioade în funcție de structură învelișuri de electroni, precum și razele atomice.
1 Cu. 46–51; 2 Cu. 51–52, 94–98, 423; 99–103; 4 Cu. 40–46; 5 Cu. 6–9, 49–53; 7 Cu. 81–90; 8 Cu. 106–112; 11 Cu. 63–67.
Cei mai importanți factori care determină proprietățile chimice ale atomilor elementelor chimice sunt configurația și structura învelișurilor lor de electroni. O creștere succesivă a încărcăturii nucleelor atomice duce la o schimbare periodică a configurației electronice a învelișurilor lor exterioare de electroni de la ns 1 la ns 2 np 6. Consecința acestui lucru este o schimbare periodică a unor caracteristici ale atomilor cum ar fi raza covalentă, ionică și metalică, energia de ionizare, afinitatea electronică, starea de oxidare, volumul atomic etc.
Strict vorbind, dimensiunea oricărui atom este infinită, deoarece există o probabilitate diferită de zero de a-și găsi electronii la o distanță arbitrar de mare de nucleu. Cu toate acestea, există un maxim principal pe curba distribuției radiale a densității electronilor pentru orice orbital. Pe baza acestui lucru, conceptul raza orbitală atom. El este egal calculat teoretic distanța de la nucleu la maximul principal pe curba de distribuție radială pentru orbitalul exterior.
Vorbind despre dimensiunea unui atom, cel mai adesea ei vorbesc serios efectivrază. Valorile sale determină experimental metode de electronografie sau difracție de raze X, care fac posibilă găsirea distanțelor internucleare în molecule, cristale ionice și metalice. Pe baza valorilor lor, ei calculează în consecință covalent, ionic și metalic razele atomice.
Valoarea razei efective a unui atom depinde de mulți factori: structura substanței, natura legăturii chimice, gradul de oxidare a elementului etc. date și prin urmare diferiți autori poate varia foarte mult.
Modelul de modificare a valorilor razelor atomice ale elementelor chimice are un caracter periodic.
În perioade pe măsură ce sarcina nucleelor atomice crește (o creștere a numărului atomic) raza atomilor scade. De exemplu, opt elemente din a treia perioadă (numai s- și R-elemente), raza scade de la 190 pm (pentru sodiu) la 99 pm (pentru clor), adică de aproape 2 ori, și pentru zece d-elementele perioadei a 4-a, raza scade de la 164 pm (la scandiu) la 153 pm (la zinc), adică doar cu 7%.
In grupuri pe măsură ce sarcina nucleelor crește, raza atomilor crește, în timp ce în grupele A ( s- și p-elemente), o astfel de creștere are loc într-o măsură mai mare decât în grupele B ( d- și f-elemente).
d-Elementele perioadelor a 5-a si a 6-a, situate in aceeasi grupa, au aproape aceleasi raze atomice. De exemplu, razele atomice ale zirconiului și hafniului sunt de 160 pm, respectiv 150 pm, în timp ce cele ale molibdenului și wolframului sunt de 139 pm și, respectiv, 141 pm. Motivul pentru o astfel de apropiere a razelor este că în a 6-a perioadă 14 f-elemente, în atomii cărora este umplut al treilea exterior 4 f-subnivelul energetic, care „protejează” puternic electronii exteriori de nucleu. Ca urmare, o creștere a sarcinii nucleelor atomice are un efect redus asupra mărimii razelor atomice. Acest efect se numește compresia lantanidelor.
Energie de ionizare (E si el. ) – energia minimă necesară pentru a elimina 1 electron dintr-un atom izolat DAR , care este în starea energiei fundamentale:
A 0 → A + + e – – E si el.
Distinge primul ( E 1 secunda ( E 2) și energiile de ionizare ulterioare corespunzătoare detașării primului, celui de-al doilea și următorii electroni. Unitatea de măsură a energiei de ionizare este kJ/mol.
Potential de ionizare (eu ) –cea mai mică tensiune (diferență de potențial) a câmpului electric la care un electron se desprinde dintr-un atom izolat.
Distinge primul ( eu 1 secunda ( eu 2) și potențialele de ionizare ulterioare corespunzătoare detașării primului, celui de-al doilea și următorii electroni. Unitatea de măsură a potențialului de ionizare este electronvoltul, eV. Un eV corespunde la 96,486 kJ/mol.
Valoarea energiei de ionizare a unui atom (și potențialul său de ionizare) depinde de mulți factori: sarcina nucleului, raza atomului, configurația învelișului electronic al atomului.
afinitate electronică (E cf. ) – energia care este eliberată sau absorbită ca urmare a atașării unui electron la un atom neutru izolat A 0:
A 0 + e – → A – ± E cf.
Adăugarea unui electron la un atom este însoțită de eliberare de energie(+e cf.), dacă aceasta rezultă în particulă atomică cu o înveliș de electroni stabil. Acest lucru este tipic, de exemplu, pentru atomii de halogen. Dacă, ca urmare a atașării unui electron la un atom, se formează o particulă atomică cu o înveliș electronic instabil, atunci afinitatea electronică a unui astfel de atom este negativă, adică. energia este absorbită(– e cf.). Acest lucru este inerent, de exemplu, atomilor de metal.
Electronegativitatea (χ) – valoare condiţională care caracterizează capacitatea unui atom de a component chimic a atrage electroni de valență(perechi de electroni comuni).
Valoarea electronegativității unui atom în cel mai simplu caz este determinată pe baza potențialului său de ionizare și a afinității electronice.
Există diverse scale în care valorile χ ale elementelor pot diferi oarecum (electronegativitatea după Pauling, după Mulliken, după Allred-Rochov etc.). Pe majoritatea scalelor, fluorul este elementul cel mai electronegativ, iar franciul este cel mai puțin electronegativ.
Cu creșterea numărului atomic Într-o perioadă, electronegativitatea crește, în timp ce într-un grup, de regulă, scade. De exemplu, electronegativitatea oxigenului este mai mare decât cea a carbonului, deoarece acestea sunt situate în aceeași perioadă, dar oxigenul este situat în dreapta carbonului. Electronegativitatea bariului este mai mică decât cea a magneziului, deoarece valorile sale scad de sus în jos într-un grup.
Dacă doi atomi au aceleași valori χ, atunci se formează o legătură chimică covalentă nepolară între ei. Dacă electronegativitatea atomilor nu diferă foarte mult (diferența dintre valorile electronegativității Δχ nu depășește 1,5), atunci apare o legătură polară covalentă între atomi. Perechile de electroni comuni care o formează se deplasează întotdeauna la un atom cu un χ mai mare, în urma căruia capătă o sarcină negativă parțială (δ–). În consecință, al doilea atom capătă o sarcină pozitivă parțială (δ+).
Consecința rezolvării ecuației Schrödinger pentru atomul de hidrogen sunt trei numere cuantice care caracterizează comportamentul unui electron într-un atom. Acestea la fel numere cuantice caracterizează în mod unic starea electronilor oricărui atom din sistemul periodic de elemente.
Numărul cuantic principal n determină energia electronului și dimensiunea norilor de electroni. Energia unui electron depinde în principal de distanța electronului față de nucleu: cu cât electronul este mai aproape de nucleu, cu atât energia acestuia este mai mică. Prin urmare, putem spune că numărul cuantic principal determină locația electronului pe unul sau altul nivel de energie(stratul cuantic). Numărul cuantic principal are valorile unei serii de numere întregi de la 1 la Când valoarea numărului cuantic principal este egală cu unu, electronul se află în primul nivel de energie situat la distanța minimă posibilă de nucleu. energie totală al unui astfel de electron este cel mai mic.
Electronul de la nivelul energetic cel mai îndepărtat de nucleu are energie maximă. Prin urmare, în timpul tranziției unui electron de la un nivel de energie mai îndepărtat la unul mai apropiat, sunt eliberate porțiuni (cuante) de energie. Nivelurile de energie sunt indicate cu majuscule conform schemei:
Numărul cuantic orbital Conform calculelor mecanice cuantice, norii de electroni diferă nu numai ca mărime, ci și ca formă. Forma norului de electroni este caracterizată de numărul cuantic orbital sau azimutal. Forma diferită de nori de electroni provoacă o schimbare a energiei electronilor într-un singur nivel de energie, adică împărțirea acestuia în subniveluri de energie. Fiecare formă a norului de electroni corespunde unei anumite valori a impulsului mecanic al electronului, determinată de numărul cuantic orbital:
![]()
Numărul cuantic orbital l. poate avea valori de la 0 la toate valorile. Subnivelurile de energie sunt notate cu litere:
Cu valoarea numărului cuantic principal egală cu unu, numărul cuantic orbital are o singură valoare, egală cu zero. Această valoare caracterizează norii de electroni care au simetrie sferică (vezi Fig. 1.3). Electronii al căror număr cuantic orbital este zero se numesc -electroni.
Doar electronii pot fi la primul nivel energetic, notația sa condiționată Când valoarea numărului cuantic principal este egală cu doi, numărul cuantic orbital are două semnificații: Număr orbital,
egal cu unu corespunde formei în formă de gantere a unui nor de electroni (forma unui volum opt) (Fig. 1.4. Electronii al căror număr cuantic orbital este egal cu unu se numesc -electroni).
Al doilea nivel de energie poate conține electroni S- și -, care formează două subniveluri: Când valoarea numărului cuantic principal este trei, numărul cuantic orbital are trei valori: Un număr cuantic orbital egal cu doi corespunde mai multor formă complexă norii de electroni (Fig. 1.5). Electronii cu un număr cuantic orbital de doi se numesc d-electroni.
Al treilea nivel de energie poate conține -electroni, care formează trei subniveluri: Când valoarea numărului cuantic principal este patru, numărul cuantic orbital are patru valori: Un număr orbital egal cu trei corespunde unei forme și mai complexe de nori. electroni,
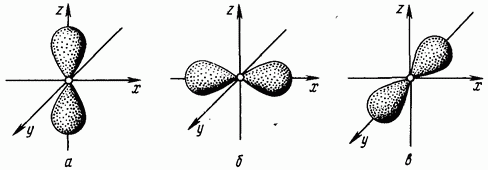
Orez. 1.4. electronice -nori -orbitale; -orbital; în - -orbital

Orez. 1.5. d-nori de electroni - orbital; -orbital; c - orbital; - -orbital; - -orbital
al căror număr cuantic orbital este trei, se numesc -electroni.
Al patrulea nivel energetic poate conține și -electroni, care formează patru subniveluri;
Numărul cuantic magnetic Din soluția ecuației Schrödinger rezultă că norii de electroni sunt orientați în spațiu. Orientarea spațială a norilor de electroni este caracterizată de un număr cuantic magnetic.
Un câmp magnetic sau electric extern modifică orientarea spațială a norilor de electroni, prin urmare, atunci când sunt expuse la un câmp magnetic sau electric, subnivelurile de energie ale electronilor sunt împărțite. în magnetic şi câmpuri electrice se observă scindarea liniilor spectrale atomice.
Numărul cuantic magnetic ia orice valoare numerică întreagă de la până la inclusiv 0. Astfel, numărul de valori posibile ale numărului cuantic magnetic este Dacă valoarea numărului cuantic orbital este zero, numărul cuantic magnetic are doar unul. valoare, egală cu zero (vezi Fig. 1.3). Cu un număr cuantic orbital egal cu unu, numărul cuantic magnetic are trei valori: Trei valori ale numărului magnetic caracterizează trei stări ale electronilor, ceea ce corespunde orientării norilor în spațiu în trei plane reciproc perpendiculare de-a lungul coordonatei axele (vezi Fig. 1.4).
Cu un număr cuantic orbital egal cu doi, numărul cuantic magnetic are cinci valori: . Cele cinci valori ale numărului cuantic magnetic corespund celor cinci poziții spațiale ale norilor d-electroni (Fig. 1.5). Numărul cuantic orbital egal cu trei corespunde șapte valori ale numărului magnetic și șapte poziții spațiale ale norilor.
Orbitali atomici (AO). Pe baza conceptelor de numere cuantice, este posibil să se perfecționeze definiția unui orbital de electroni într-un atom. Setul de poziții ale unui electron într-un atom, caracterizat de anumite valori ale numerelor cuantice, se numește orbital atomic.
2. STRUCTURA ELECTRONICĂ A ATOMILOR. LEGĂTURĂ CHIMICĂ
Orice stare stabilă a unui electron dintr-un atom este caracterizată de anumite valori ale numerelor cuantice: n, l, ml, ms, numite respectiv: principal, orbital, magnetic și spin.
Starea unui electron într-un atom, corespunzătoare anumitor valori ale numerelor cuantice n, ℓ, ml, se numește orbital atomic (a.o.). În caz contrar, orbitalul atomic este spațiul în care electronul este cel mai probabil să rămână.
În funcție de valoarea numărului cuantic orbital, se acceptă următoarea denumire a subnivelurilor de energie:
– subnivelul s (n/a) |
||
ℓ= 2 – d -*- ℓ= 3 – f -*-
Fiecare tip de orbital atomic are propria sa formă a norului de electroni. S este un orbital sferic, p este un orbital în formă de gantere, d este un orbital în formă de rozetă și f este un orbital de formă și mai complexă.
Numărul de orbitali de fiecare tip este determinat de numărul de moduri de orientare a acestora în spațiu, adică. numărul de valori ale numărului cuantic magnetic - ml. Numărul cuantic magnetic are valori (2ℓ + 1).
(Tabelul 2.1).
Calculul numărului de orbitali atomici la subniveluri | Tabelul 2.1 |
||||
Desemnare | Numărul de valori | ||||
subnivel | |||||
2;-1;0; + 1; + 2 | |||||
3;-2;-1;0; + 1;+2;+3 | |||||
Grafic, un orbital atomic este reprezentat sau -. Numărul (z) de orbitali atomici într-un nivel energetic este dat de za.o. = n2 , unde n este numărul cuantic principal.
Conform principiului Pauli, un atom nu poate avea doi electroni caracterizați de același set de numere cuantice. De aici rezultă că fiecare orbital atomic poate fi ocupat de cel mult doi electroni, iar numerele lor cuantice de spin trebuie să fie diferite, ceea ce este notat cu ↓.
Astfel, numărul total de electroni din nivelul de energie este determinat de formula ze = 2n2. Numărul de electroni dintr-un subnivel este determinat de formula 2 (2ℓ + 1). Calculul numărului de electroni și al structurii nivelului poate fi prezentat sub forma unui tabel. 2.2.
Cunoscând structura fiecărui subnivel și nivel, se pot compune formule electronice de elemente.
Starea stabilă (neexcitată) a unui atom multielectron corespunde unei astfel de distribuții a electronilor peste orbitalii atomici, în care energia atomului este minimă. Prin urmare, orbitalii atomici sunt umpluți în ordinea creșterii succesive a energiilor lor. Ordinea în care orbitalii atomici sunt umpluți cu electroni este determinată de regulile Klechkovsky, care iau în considerare dependența energiei unui orbital de valorile numerelor cuantice principale (n) și ale orbitalelor (ℓ). Conform acestor reguli, orbitalii atomici sunt umpluți cu electroni în ordinea creșterii succesive a sumei (n + 1) (prima regulă a lui Klechkovsky), iar pentru aceleași valori ale acestei sume, în ordinea creșterea succesivă a numărului principal n (a doua regulă a lui Klechkovsky).
Amplasarea electronilor în orbitalii atomici într-un subnivel de energie este determinată de regula lui Hund, conform căreia energia minimă a unui atom corespunde unei astfel de distribuții a electronilor în orbitalii atomici ai unui subnivel dat, la care valoarea absolută a spinului total. a atomului este maxim; cu orice alt aranjament de electroni, atomul va fi într-o stare excitată, adică. va avea o energie mai mare.
Sarcini și exerciții
2.1. Cum se desemnează starea unui electron: a) cu n=4, ℓ=2; b) cu n=5, ℓ=3.
Soluție: La înregistrarea stării energetice, numărul indică numărul subnivelului (n), iar litera indică natura subnivelului (s, p, d, f). Pentru n=4 și ℓ=2 scriem 4d; pentru n=5 și ℓ=3 scriem 5f.
Tabelul 2.2
Calculul numărului de electroni
Desemnare | Ze = 2(2ℓ + 1) | Ze = 2n2 | Structura |
|||||
subnivel | ||||||||
2 12 | ||||||||
2 22 | s2 p6 |
|||||||
Sfârșitul mesei. 2.2
Desemnare | Ze = 2(2ℓ + 1) | Ze = 2n2 | Structura |
|||||||||
subnivel | ||||||||||||
2(2 2 + 1) = 10 | ||||||||||||
2 42 = 32 | s 2p 6d 10f 14 |
|||||||||||
2.2. Câți orbiti corespund celui de-al treilea nivel de energie? Câți electroni sunt la acest nivel? În câte subniveluri se împarte acest nivel?
Rezolvare: Pentru al treilea nivel de energie n = 3, numărul de orbitali atomici este 9 (32); acest număr de orbitali este suma 1(s) + 3(p) + 5(d) = 9. Conform principiului Pauli, numărul de electroni din acest nivel este 18. Al treilea nivel de energie este împărțit în trei subniveluri : s, p, d (numărul de subniveluri este același cu numărul de valori ale numărului cuantic principal).
Toate elemente chimice pot fi clasificate în funcție de natura subnivelurilor care trebuie completate în 4 tipuri:
s-elemente - umplere cu electroni ns - subnivel; p-elemente - umplere cu electroni np - subnivel; d- elemente - umplere cu electroni (n-1) d - subnivel; elemente f - umplere cu electroni (n-2) f - subnivel.
Pentru a scrie formula electronică a unui element, trebuie: să indicați numărul nivelului de energie cu o cifră arabă, să scrieți valoarea literală a subnivelului, să scrieți numărul de electroni ca exponent.
De exemplu: 26 FeIV 1s2 2s2 2p6 3s2 3p6 4s2 3d6 .
Formula electronică este întocmită ținând cont de competiția subnivelurilor, adică. reguli energetice minime. Excluzând ultimul electronic
se va scrie formula: 26 Fe1V 1s2 2s2 2p6 3s2 3p6 3d6 4s2 . Valența maximă a unui element este determinată de numărul de orbitali de valență și depinde de tipul electronic al elementului și de numărul perioadei.
Structura electronică a elementelor pe perioade și valența maximă sunt prezentate în Tabel. 2.3.
Tabelul 2.3 Structura electronică și valența maximă a elementelor
Valenţă | ||||||||||||||||
Structura | ||||||||||||||||
orbitali | ||||||||||||||||
1s 1-2 | ||||||||||||||||
1s 22s 1-22p 1-6 | ||||||||||||||||
1s2 2s2 2p6 3s1-2 | 3d) | |||||||||||||||
3p 1-6 | ||||||||||||||||
4d) | ||||||||||||||||
1s2 2s2 2p6 3s2 3p6 | ||||||||||||||||
4s 1-23d 1-104p 1-6 | ||||||||||||||||
5d) | ||||||||||||||||
1s2 2s2 2p6 3s2 3p6 | ||||||||||||||||
4s2 3d10 4p6 5s1-2 | ||||||||||||||||
4d 1-105p 1-6 | ||||||||||||||||
6f) | ||||||||||||||||
1s2 2s2 2p6 3s2 3p6 | 6d) | |||||||||||||||
4s2 3d10 4p6 5s2 | ||||||||||||||||
4d 105p 66s 1-10 | ||||||||||||||||
5d 14f 1-145d 2-10 | ||||||||||||||||
6p 1-6 | ||||||||||||||||
2.3. Care subnivel se umple atomul cu electroni după umplerea subnivelului: a) 4p; b) 4s?
R Rezolvare: a) Subnivelul 4p corespunde sumei (n + l) egală cu 4+1 = 5. Aceeași sumă n+l caracterizează subnivelurile 3d (3+2 = 5)
și 5s (5+0 = 5). Cu toate acestea, starea 3d corespunde unei valori mai mici de n (n = 3) decât starea 4p, astfel încât subnivelul 3d se va umple mai devreme decât subnivelul 4p. Prin urmare, după completarea subnivelului 4p, se vor completa subnivelul 5, ceea ce corespunde unei valori cu o mai mare a lui n (n=5).
b) subnivelul 4s corespunde sumei n+l = 4+0 = 4. Aceeași sumă n+l caracterizează subnivelul 3р, dar umplerea acestui subnivel precede umplerea subnivelului 4, deoarece acesta din urmă corespunde unei valori mai mari a numărului cuantic principal. Prin urmare, după subnivelul 4s, subnivelul cu suma (n+l) = 5 va fi completat, de asemenea, din toate combinațiile posibile n+ℓ corespunzătoare acestei sume (n=3, ℓ=2; n=4, ℓ =1; n= 5, ℓ=0), combinația cu cea mai mică valoare a numărului cuantic principal va fi implementată mai întâi, i.e. subnivelul 4s va fi urmat de subnivelul 3d.
Concluzie: Astfel, umplerea subnivelului d rămâne în urmă cu unu nivel cuantic, umplerea subnivelului rămâne în urmă cu două niveluri cuantice.
2.4. Structura electronică a unui atom este descrisă de formula 1s 2 2s2 2p6 3s2 3d7 4s2 . Ce este acest element?
R Soluție: Acest element aparține tipului electronic
d-elementele 1U perioada, deoarece subnivelul 3d este construit de electroni; numărul de electroni 3d7 indică faptul că acesta este al șaptelea element în ordine. Numărul total de electroni este 27, ceea ce înseamnă că numărul de serie este 27. Acest element este cobalt.
2.5. De ce fosforul și vanadiul sunt plasate în același grup al tabelului periodic? De ce sunt plasați în diferite subgrupe?
R Soluție: Configurații electronice ale atomilor P 1s 2 2s2 2p3 3s 2 3p 3 ; V 1s2 2s2 2p6 3s2 3p6 4s 2 3d 3 . Electronii de valență sunt subliniați.
Aceste elemente au același număr de electroni de valență - 5. Prin urmare, P și V sunt situate în aceeași grupă a 5-a. În același timp, aceste elemente nu sunt contrapartide electronice, deoarece. construiți subniveluri diferite, astfel încât acestea să nu fie plasate în același subgrup.
legătură chimică este rezultatul interacțiunii mecanice cuantice a electronilor.
După natura distribuției densității electronice între atomi, legăturile chimice sunt împărțite în covalente nepolare, polare și ionice (legatura metalică realizată în metale nu este luată în considerare aici). Dacă nu există o deplasare a unei perechi de electroni, atunci legătura se apropie de una covalentă nepolară. O legătură polară covalentă este realizată de o pereche comună de electroni deplasați (polarizați) către nucleul unuia dintre atomii parteneri. Legătura ionică este considerată extrem de polarizată legătură covalentă. Pentru a evalua capacitatea unui atom al unui element dat de a atrage o pereche de electroni comună la sine, se utilizează valoarea electronegativității relative (χ) (Tabelul 5). Cu cât diferența de electronegativitate (Δχ) este mai mare, cu atât polarizarea legăturii este mai mare (cu atât ionicitatea legăturii este mai mare). Se crede că dacă Δχ > 1,9, atunci legătura este ionică.
2.6. Calculați diferența de electronegativitate relativă a atomilor pentru legăturile H-O și E-O din compușii E(OH)2, unde E sunt elementele Ca, Sr, Ba și determinați:
o ce Legătura N-O sau E-O este caracterizat în fiecare moleculă printr-un grad mai mare de ionicitate; b) care este natura ionizării acestor molecule într-o soluție apoasă?
Decizie: a) Calculați Δχ pentru relația dintre E-O și H-O:
Δχ Ca-O = 3,5 - 1,04 = 2,46 ΔχSr-O = 3,5 - 0,99 = 2,51 Δχ Ba-O = 3,5 - 0,90 = 2,60 Δχ H-O = 3,5 - 2,1 = 1.
Din compararea lui Δχ vedem că Comunicarea E-O poate fi considerat ionic, legătura H-O este polară.
b) ionizarea în soluții apoase se va efectua de-a lungul celei mai ionice legături, adică. conform schemei: E (OH) 2 ↔ E2 + + 2OH- (după tip
temeiuri).
Forța unei legături chimice este caracterizată de energie (kJ/mol) și
lungimea (nm sau A) a legăturii. Cu cât energia de legătură este mai mare și cu cât lungimea sa este mai mică, cu atât legătura este mai puternică.
Legătura chimică, adică o pereche de electroni comună se poate forma în două moduri: prin mecanismul de schimb și donor-acceptor. O legătură chimică este caracterizată de trei proprietăți principale:
1) are o anumită direcție în spațiu. Din acest punct de vedere, σ și legături π. Unghiul format de direcțiile a două legături σ se numește unghi de valență. Dacă o legătură π combină mai mulți atomi, se numește nelocalizată;
2) tinde spre saturație, drept urmare particulele au o anumită compoziție și structură. Posibil: coordonare

stări nesaturate, saturate coordonator, saturate de valență și nesaturate de valență ale atomilor;
3) poate fi polarizat sub influența diverșilor factori (în funcție de electronegativitatea atomilor, precum și sub influența unui câmp electric sau magnetic extern, sub acțiunea altor molecule polare).
Pentru a explica structura geometrică a moleculelor, se utilizează conceptul de hibridizare a orbitalilor atomici ai atomului central. Conform acestui concept, formarea legăturilor σ este precedată de o schimbare a formei și energiei orbitalilor atomici. Se formează orbitali hibrizi, capabili de o suprapunere mai profundă și, prin urmare, de legături mai puternice. Pentru elementele de tip electronic s și p, orbitalii, inclusiv perechile de electroni neîmpărțiți, pot lua parte la hibridizare.
2.7. Arătați formarea unei legături într-o moleculă BF3 și a unui ion BF4 -. Explicați structura acestor particule.
Rezolvare: 1. Compuneți formulele electronice ale atomilor și io-
nou: B 1s2 2s2 2p1 ; F 1s2 2s2 2p5 ; F- 1s2 2s2 2p6 .
2. Să arătăm distribuția electronilor pe orbitalii de valență. În acest caz, luăm în considerare gradul de oxidare al atomului de bor din compus (putem presupune condiționat că numărul de electroni nepereche din atom corespunde gradului de oxidare).
3. Vom arăta formarea tuturor legăturilor posibile, vom indica mecanismul formării lor:
3 legături σ au fost formate prin mecanismul de schimb Pe baza posibilităților de valență ale atomului
bor și tendința lui la saturație, vom arăta formarea unei legături π de către mecanismul donor-acceptor. Dar, pentru că această legătură unește mai mult de doi atomi
mov, va fi nelocalizat.
În ionul BF4 - se formează 4 legături σ, trei dintre ele prin schimb și una prin mecanismul donor-acceptor.

4. Calculați multiplicitatea conexiunii ca raport numărul total conexiuni la legături σ. În molecula BF3, multiplicitatea legăturilor este 1⅓; în ionul BF4, multiplicitatea legăturilor este 1.
5. Să definim starea atomului central în termeni de saturație
poduri. În molecula BF3, valența maximă se manifestă datorită legăturilor σ și π, prin urmare, starea atomului de bor este saturată de valență.
În ionul BF 4 - valența maximă se manifestă datorită legăturilor σ, prin urmare, starea atomului de bor este saturată coordonator.
6. Să definim natura conexiunii B-F din punct de vedere al polarității. pentru că diferența în valoarea electronegativității (Δχ) este 4,0-2,0 = 2,0, adică. mai mult de 1,9, legătura poate fi considerată ionică.
7. Să determinăm tipul de hibridizare a orbitalilor atomici ai atomului central și forma geometrică a particulelor.
În molecula BF 3, orbitalii s și 2p sunt implicați în formarea legăturilor σ, de unde tipul de hibridizare sp2. Molecula este triunghiulara
structura. În ionul BF4 -, unul s și trei orbitali p sunt implicați în formarea legăturilor σ, de unde tipul de hibridizare sp3. Ionul are o formă tetraedrică.
8. Să descriem grafic structura particulelor
2.8. Arătați formarea legăturilor în molecula de SO3, explicați structura moleculei.
Soluție: Formule electronice ale elementelor
S 1s2 2s2 2p6 3s2 3p4 O 1s2 2s2 2p4 .
pentru că starea de oxidare a atomului de sulf este +6, vom arăta distribuția electronilor peste orbitalii de valență ai atomului de sulf excitat.
Atomul de sulf formează 3 legături σ (datorită unui orbital s și doi p-atomi) și 3 legături π (datorită unui orbital p- și doi d-atomi) prin mecanismul de schimb.
În consecință, atomul este saturat de valență, nesaturat coordonator; multiplicitatea legăturilor 6/3 = 2. Conexiune S-O polari, perechile de electroni comuni sunt mutate la oxigen (Δχ = 0,5). Tipul de hibridizare Sp2. Molecula are structura unui triunghi.

3. COMPUȘI COMPLEXI
Compușii complecși joacă un rol important în viața organismelor vii. Ionii de Na, K, Ca, Mg, care îndeplinesc funcții fiziologice importante în organism, se găsesc în sânge, limfă și fluide tisulare sub formă de compuși complecși. Ionii de Fe, Zn, Mn, Cu formează compuși complecși cu proteine și fac parte din enzime și vitamine. Fierul face parte din hemoglobina. Hemoglobina este legătura dintre proteina globină și complexul hem. În hem, ionul central este Fe2+.
Compușii complecși se numesc compuși moleculari, a căror combinație de componente duce la formarea de ioni complecși capabili să existe liber atât în cristal, cât și în soluție. În moleculele compușilor complecși, se disting sferele interne și externe. Sfera interioară este cuprinsă între paranteze pătrate și constă dintr-un atom sau ion central, numit agent de complexare, și atomi, ioni sau molecule coordonate în jurul acesteia, numite liganzi.
Numărul de liganzi coordonați în jurul agentului de complexare determină numărul de coordonare al acestuia (c.h.). Acesta din urmă arată numărul de legături σ care apar între f.p. și liganzi.
Legătura dintre k.ch. | k.o. și starea sa de oxidare |
||
Stare de oxidare | |||
Molecula c.s. neutru din punct de vedere electric. Sarcina sferei interioare egal cu taxa extern cu semnul opus. Sarcina unui ion complex este egală cu suma algebrică a sarcinilor k.o. și liganzi.
Clasificarea compușilor complecși
1. După natura încărcăturii ionului complex
- cationic: format datorită coordonării în jurul unui c.o încărcat pozitiv. molecule de ligand neutru
CI2; CI3;
- anionic: agent de complexare - ionii pozitivi, fie că-
bandele sunt anioni K2; Na2;
- neutru: format la coordonare în jurul unui f.r. neutru. liganzi neutri o sau cu coordonare simultană în jurul unui c.o încărcat pozitiv.
liganzi încărcați negativ și neutri
2. Prin natura liganzilor
Hidrati sau acvacomplexe Cl3 ;
amoniac SO4;
- complexe acide K 2 ;
- Na hidroxocomplexe.
3. După numărul de k.o.
CI2 mononuclear;
[(NH 3 )4 Co\ / OH OH / \ Co(NH3 )4 ]Cl4 polinuclear.
Reguli pentru denumirea compușilor complecși
1) numele lui c.s. începe cu un cation;
2) în numele unui ion complex sunt indicați mai întâi liganzii, apoi atomul central. Terminația „o” este adăugată la numele liganzilor anionici, liganzii moleculari sunt numiți ca
molecule libere corespunzătoare. Excepție: NH3 - amină; H2O - apă; CO - carbonil;
3) agent de complexare în cationic și neutru c.s. numit numele rusesc al elementului, în anionic - numele latin cu adăugarea terminației „la”;
4) stare de oxidare k.o. notat cu o cifră arabă și introdus în
paranteze după numele său. K3 – hexanitritocobaltat de potasiu (+3); Cl3 - clorură de hexaacvacrom (+3); o este pentacarbonil de fier (0).
Comportarea compușilor complecși în soluție
In solutii de c.s. se comportă ca un electrolit puternic și se disociază în întregime într-un ion complex și ioni din sfera exterioară:
Cl → + + Cl-
Ionii complecși ionizează reversibil și treptat: + ↔ + + NH3
+ ↔ Ag+ + NH3 sau în total: + ↔ Ag+ + 2NH3
Constanta de echilibru de ionizare a unui ion complex se numește constantă de instabilitate
A cuibăra. = | |
Depinde doar de natura compusului și de temperatură; este dat în cărțile de referință (vezi Tabelul 6).
4. ECHILIBRUL CHIMIC
Echilibrul chimic este o stare care corespunde egalității ratelor reacțiilor directe și inverse:
În acest caz, modificarea energiei Gibbs este zero
Du-te=O; ΔΗο = T Deci
Starea de echilibru chimic rămâne neschimbată la o constantă conditii externe. Când aceste condiții (temperatura, presiune, concentrații) se modifică, echilibrul este perturbat pentru a fi restabilit, dar în condiții noi.
Schimbarea echilibrului se supune principiului Le Chatelier: dacă una dintre condițiile care determină poziția de echilibru este schimbată într-un sistem de echilibru, atunci echilibrul se deplasează în direcția procesului care slăbește efectul impactului. Deci, odată cu creșterea concentrației de reactivi, echilibrul se deplasează către procesul care va determina consumul acestor reactivi. Motivul acestui comportament al sistemului de echilibru este o creștere a numărului de ciocniri de particule ale reactivilor indicați, ceea ce determină o accelerare a reacției înainte sau inversă.
În sistemele cu gaz, o creștere a concentrațiilor de reactivi are loc cu o creștere a presiunii sau o scădere a volumului sistemului. Prin urmare, cu o creștere a presiunii totale în sistem, una dintre cele două reacții reversibile care are loc cu participarea unui număr mai mare de moli de gaz, adică. echilibrul se deplasează spre formarea unui număr mai mic de alunițe.
Odată cu creșterea temperaturii, viteza reacțiilor directe și inversă crește, dar rata endotermei crește într-o măsură mai mare.
reacţii, pentru că are un coeficient de temperatură mai mare.
Sarcini și exerciții
4.1. Arătați direcția deplasării echilibrului cu scăderea concentrației de H2 în sistemul de echilibru:
CO + H2 O↔ CO2 + H2 Soluție: Cu o scădere a CH 2, conform principiului Le-
Chatelier, reacția directă trebuie să prevaleze, pentru că în acest caz, cantitatea de H2 va crește, iar echilibrul va fi restabilit.
4.2. În ce direcție se va deplasa echilibrul PC15 ↔ PC13 + C12 - 31 kJ mol-1 odată cu creșterea temperaturii și presiunii?
Soluție: Pe măsură ce temperatura crește, echilibrul se va deplasa spre dreapta, deoarece reacția directă are loc cu absorbția de căldură, adică. este
endotermic. Pe măsură ce presiunea crește, numărul de ciocniri al moleculelor PC13 și C12 va fi mai mare decât PC15, astfel încât echilibrul se va deplasa spre stânga.
4.3. În ce condiții într-un sistem de echilibru
N2 g + 3H2 g ↔ 2NH3 g + 22 kJ mol-1 este posibil să se maximizeze randamentul de NH3?
Soluție: Pentru a crește producția de NH3, de ex. pentru a deplasa echilibrul la dreapta, este necesar:
1) creste presiunea amestecului de gaze, deoarece în acest caz, viteza reacţiei directe creşte, deoarece Mai mult alunițe;
2) crește concentrația de azot 2 și H2 și reduceți concentrația de NH3, eliminându-l din sfera de reacție;
3) scade temperatura amestecului de reacţie, deoarece reacție despre-
Formarea NH3 este exotermă.
Caracteristica cantitativă a stării de echilibru chimic este constanta de echilibru, care reflectă legea acțiunii masei.
Constanta de echilibru este legată de energia Gibbs prin relația RTlnK
= -∆G aproximativ . Pentru proces aA + bB ↔ cC + dD constantă de concentrație
echilibrul are forma: Кс = [C] c [D] d , unde [A], [B], [C], [D] – echilibru [A]a [B]b
concentrații nye în mol/l; a, b, c, d coeficienți stoichiometrici.
Pentru sistemele cu gaz scrieți constanta K | |||||||
presiuni parțiale ale gazelor și amestecurilor.
Constantele Kc și Kp caracterizează procesele de echilibru în soluții diluate de electroliți și neelectroliți și în sistemele de gaze la presiuni apropiate de 101,3 kPa (gaze ideale).
Pentru soluții concentrate și gaze neideale, trebuie utilizate valorile activității:
K a = a C ca D da A a a B b
Constanta de echilibru depinde de natura reactivilor și de temperatură, dar nu depinde de concentrațiile componentelor sistemului de echilibru.
În sistemele eterogene, concentrația fazei solide este inclusă în valoarea constantei de echilibru, deoarece este o valoare constantă.
Dacă reacțiile au loc în soluții apoase cu participarea apei, atunci concentrația de apă este mare și constantă și practic nu va afecta starea de echilibru.
Scriem constantele de echilibru ale proceselor: 4HC1g + O2 g ↔ 2H2 Og + 2C12 g
PH 2 | P С2 1 |
||||||||||||||
4 2 2 | |||||||||||||||
CuSO4 p-p + Fekp ↔ Cukp + FeSO4 p-p |
|||||||||||||||
La rezolvarea problemelor, este necesar să se definească clar starea de agregare substanțele care reacţionează, precum și pentru a distinge concentrațiile inițiale ale substanțelor de echilibru.
C echilibru \u003d C inițial - C cheltuit
4.4. 1 mol de H2 și 1 mol de I2 au fost amestecați într-un vas cu o capacitate de 1 l la 410°C. Calculați la ce concentrații se stabilește echilibrul chimic dacă constanta de echilibru este 48?
Rezolvare: H 2 + I 2 ↔ 2HI
Să presupunem că X moli de H2 și I2 sunt consumați în reacție. Apoi s-au format 2X moli de HI, i.e. HI = 2 mol/l. În acest caz ==
1 - X. Să notăm: Кс = | (2x)2 | ||||
(1−x)2 |
|||||
Obținem ecuația: 44X2 - 96X + 48 = 0 Rezolvând-o, obținem X = 0,776. Calculați concentrațiile de echilibru: HI = 2X = 2 0,776 = 1,552 mol/l
1 - X \u003d 0,222 mol / l.
4.5. În reacția reversibilă CO + C12 ↔ COC12 s-au stabilit următoarele concentrații de echilibru (mol/l): = 0,1; = 0,4; = 4. Calculați Crav. și concentrațiile inițiale de C12 și CO.
Rezolvare: K = | |||||

Găsim concentrațiile inițiale: Cish. = Comp. + Dimensiunexp. . Pentru formarea a 4 mol COC12, conform ecuației reacției, 4
mol de CO și C12. Prin urmare, concentrațiile inițiale sunt: CCO = 0,1 + 4 = = 4,1 mol/l; CC1 2 \u003d 0,4 + 4 \u003d 4,4 mol / l.
4.6. Determinați compoziția volumetrică a amestecului în momentul echilibrului pentru reacția Cgrafit + O2 g ↔ CO2 g, dacă la 1300 ° C Equn. = 0,289.
Rezolvare: K p \u003d P R CO 2
Fie ca X să desemneze conținutul de CO2 în fracții de volum (procent). Atunci conținutul de O2 va fi (100-X). Înlocuiți în ecuație:
K \u003d 0,289 \u003d (100 X - X); X = 22,42 % vol. Conținutul de O2 va fi
5. CINETICA CHIMICA
Cinetica chimică studiază viteza și mecanismul reacțiilor chimice, precum și influența diferiților factori asupra vitezei. viteza medie reactie chimica măsurată prin modificarea concentrației de reactanți pe unitatea de timp:
V = ±C 2 − C 1 ,
τ2−τ1
unde C2 și C1 sunt concentrațiile de substanțe (mol/l) corespunzătoare timpului τ2 și τ1 (în s sau min). Pentru sistemele eterogene se măsoară viteza
modificarea concentrației pe unitatea de suprafață a fazei solide (1 cm2 sau 1 m2).
Viteza unei reacții chimice depinde de următorii factori principali:
- natura și starea substanțelor care reacţionează;
- natura mediului în care are loc reacția;
Catalizator;
- concentrația substanțelor de reacție, și pentru gaze și presiune;
Temperaturile.
Activitatea chimică a substanțelor depinde de structura atomilor sau moleculelor, de natura legăturilor intramoleculare și intermoleculare. Radicalii au cea mai mare activitate, este oarecum mai scăzută pentru ioni și molecule. Starea de agregare a reactivilor și gradul de dispersie sunt, de asemenea, de importanță nu mică.
Aproape întotdeauna, substanțele reacționează cu mediul (solvent), formând solvați (hidrați). În plus, solventul poate avea un efect catalitic.
În general, catalizatorii accelerează reacțiile chimice schimbându-le calea. În acest caz, o nouă cale de reacție corespunde unei energii de activare mai scăzute. Energia de activare (Ea) este energia minimă pe care trebuie să o aibă particulele substanţelor care reacţionează pentru a realiza interacţiunea. Valoarea Ea este determinată de natura chimică a substanțelor.
Efectul concentrației, presiunii și temperaturii asupra vitezei unei reacții chimice este cuantificabil.
Legea maselor care actioneaza exprimă dependența vitezei unei reacții chimice de concentrația reactanților: viteza de reacție este direct proporțională cu concentrațiile reactanților ridicate la puterea coeficienților lor stoichiometrici. Pentru reacție
аА + вВ → С V = KCA a CB b ,

unde CA și CB sunt concentrațiile molare ale reactivilor A și B;
A și b sunt coeficienți stoichiometrici pentru A și B;
La - constanta de viteză a acestei reacții, reflectând influența naturii substanțelor. Depinde de temperatură, dar nu depinde de concentrația de substanțe.
Pentru sistemele cu gaz, în loc de concentrații, puteți folosi valoarea
ne presiuni parțiale: V = KPA a PB b .
În sistemele eterogene, concentrațiile de substanțe cristaline sunt valori constante și sunt incluse în constanta de viteză. Motivul creșterii vitezei de reacție cu creșterea concentrațiilor de reactanți poate fi explicat printr-o creștere a numărului total de ciocniri de particule și, prin urmare, o creștere a numărului de ciocniri active. Să scriem expresii pentru vitezele următoarelor reacții:
a) 2H2 g + O2 g \u003d 2H2 Og
V=KC | V=KP | |||||
b) CaOcr + CO2 g \u003d CaCO3 cr | ||||||
V=KCCO2 | V = KPCO 2 | |||||
c) Soluție de FeCl3 + 3KSCN p-p = Fe(SCN)3 p-p | V = KC FeCl3C3KSCN |
|||||
d) 2AgCO3 cr | V=K |
|||||
→ 2Agcr + 2CO2 g + O2 g |
||||||
Legea acțiunii în masă este valabilă numai pentru reacții simple cu o ordine și o molecularitate reduse.
Ordinea de reacție este înțeleasă ca suma exponenților la concentrații în expresia legii acțiunii masei. Molecularitatea reacției este determinată de numărul minim de molecule implicate în actul de interacţiune. Pe baza molecularității, reacțiile sunt împărțite în monomoleculare (monomoleculare), bimoleculare (bimoleculare) și trimoleculare (trimoleculare). Reacțiile moleculare superioare sunt rare, deoarece astfel de reacții se desfășoară în mai multe etape.
Reacțiile unimoleculare includ reacții de descompunere și rearanjamente intramoleculare, pentru ele V = K·C. Reacțiile cu două molecule includ reacții în care interacțiunea are loc atunci când două molecule se ciocnesc, pentru ele V \u003d K C1 C2; pentru reacţiile trimoleculare V = K·C1 ·C2 ·C3 . Pe baza ordinii reacției, există ordinea întâi, a doua și a treia, precum și zero și fracțional.
de ordinul trei V = K·C3 , V = K·C1 2 ·C2 , V = K·C1 ·C2 2 .
Reacțiile sunt de ordin zero dacă concentrația substanței nu se modifică pe parcursul întregului proces și viteza este o valoare constantă. Acest lucru este posibil în sisteme eterogene unde substanță cristalină interacționează cu suprafața, iar concentrația rămâne valoare constantă. Pentru o reacție de ordin zero, V = K·Co . Reacția are o ordine fracțională dacă procesul are loc în mai multe etape, fiecare având o viteză neglijabilă.
Sarcini și exerciții
5.1. Determinați molecularitatea și ordinea reacției:
С12 g + 2NOg = 2NOClg
Soluție: 1 mol de C12 și 2 moli de NO intră în reacție, prin urmare, reacția indicată este trimoleculară. Procedura de determinare
folosim ecuația: V = KCCl 2 C2 NO . Răspunsul este de ordinul trei.
5.2. Calculați viteza de dizolvare a hidroxidului de fier (II) în 0,02 M H2SO4 la K = 40. Determinați molecularitatea și ordinea reacției.
Soluție: Reacția va merge conform ecuației:
Fe(OH)2cr + H2SO4 p-p = FeSO4 p-p + 2H2 Ozh
V \u003d KCH 2 SO 4, deoarece Fe(OH)2 este în fază cristalină. Molecularitatea reacției este 2, ordinea este 1. Calculați viteza de reacție:
V \u003d 40 0,02 \u003d 0,8 mol / min l.
5.3. Într-o soluție care conține 1 mol de SnCl 2 și 2 moli FeCl3, reacția se desfășoară conform ecuației:
SnCl2 p + 2FeCl3 p ↔ SnCl4 p + 2FeCl2 p
De câte ori va scădea viteza de reacție după reacție
ruet 0,65 mol SnCl2?
Soluție: Calculați viteza de reacție în inițială
După ce 0,65 mol SnCl2 au reacţionat, concentraţiile vor fi
au următoarele valori: СSnCl2 = 1 - 0,65 = 0,35 mol/l; СFeCl3 = = 2 - 1,3 = 0,7 mol/l. În acest caz, viteza de reacție va fi egală cu:
V1 = K 0,35 0,72 = 0,17 K.
Raportul de viteză | |||||
5.4. Cum se va schimba viteza de reacție CO2 + C12 g = COC12 g dacă volumul amestecului de gaz se reduce la jumătate?
Soluție: viteza de reacție inițială va fi:
Vo = K CCO CC1 2 . Cu o înjumătățire a volumului, concentrațiile tuturor
componentele se vor dubla și viteza poate fi calculată după cum urmează: V 1= K 2C CO2C Cl2 = 4KC COC Cl2
Este destul de evident că, cu o scădere a volumului de 2 ori, viteza de reacție crește de 4 ori.
Este de asemenea cuantificat efectul temperaturii asupra vitezei unei reacții chimice. Odată cu creșterea temperaturii, viteza oricăror reacții crește, ceea ce se explică prin creșterea numărului de particule active a căror energie atinge sau depășește energia de activare Ea. Dependența de temperatură a constantei vitezei de reacție este exprimată ca
Ecuația lui Arrhenius: 2,303 lg | |||||||||
Aici K1 și K2 | sunt constantele de viteză ale acestei reacții pentru absolut |
||||||||
temperaturile T1 și T2; | |||||||||
Ea | este energia de activare; | ||||||||
este constanta gazului. | |||||||||
În practică, pentru calcule, se folosește regula van't Hoff, conform căreia, cu o creștere a temperaturii cu 10 °, viteza sau constanta de viteză a reacției crește de 2-4 ori.
Vt 2 | Kt 2 | t2 − t1 | ||||||
= γ 10 , |
||||||||
unde Vt1 și Vt2 | sunt vitezele de reacție la temperaturile t1 și t2; |
|||||||
Kt1, Kt2 | sunt constantele ratei; | |||||||
γ este coeficientul de temperatură.
Regula lui Van't Hoff dă rezultate mai puțin precise decât ecuația lui Arrhenius, deoarece γ poate fi considerat constant doar într-un interval mic de temperatură. Pentru reacțiile anorganice γ = 2-4, pentru reacțiile enzimatice γ = 7-8.
5.5. Coeficientul de temperatură al vitezei de descompunere a lui HI în intervalul de temperatură 356-376o C este 2. Calculați constanta de viteză a acestei reacții la 376o C, dacă la 356o C este 8,09·10-5.
Soluţie: | Să scriem expresia matematică a regulii |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Van't Hoff: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
V 376 | K 376 | 376− 356 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
= γ 10 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
5.7. Pesticidul se descompune în apă la 25°C timp de 10 zile. La ce temperatură trebuie păstrată apa otrăvită astfel încât să devină inofensivă după 1 oră dacă coeficientul de temperatură al reacției de descompunere chimică este 3?
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ansamblul stărilor unui electron dintr-un atom cu aceeași valoare n numit nivel de energie. Numărul de niveluri la care electronii se află în starea fundamentală a atomului coincide cu numărul perioadei în care se află elementul. Numerele acestor niveluri sunt indicate prin cifre: 1, 2, 3, ... (mai rar - prin litere K, L, M, ...).
Subnivelul energetic- un set de stări energetice ale unui electron dintr-un atom, caracterizate prin aceleași valori ale numerelor cuantice nși l. Subnivelurile sunt notate cu litere: s, p, d, f... Primul nivel de energie are un subnivel, al doilea - două subniveluri, al treilea - trei subniveluri și așa mai departe.
Dacă orbitalii sunt desemnați în diagramă ca celule (cadre pătrate), iar electronii ca săgeți (sau ↓), atunci puteți vedea că numărul cuantic principal caracterizează nivelul de energie (EU), combinația cuantumului principal și orbital. numere - subnivelul energetic (EPL), un set de numere cuantice principale, orbitale și magnetice - orbital atomic, iar toate cele patru numere cuantice sunt un electron.
Fiecărui orbital îi corespunde o anumită energie. Denumirea orbitalului include numărul nivelului de energie și litera corespunzătoare subnivelului corespunzător: 1 s, 3p, 4d etc. Pentru fiecare nivel de energie, începând cu al doilea, existența a trei egale în energie p orbitali situati in trei directii reciproc perpendiculare. La fiecare nivel de energie, începând cu al treilea, sunt cinci d-orbitali cu o formă mai complexă de patru foi. Începând de la al patrulea nivel energetic, apar forme și mai complexe. f-orbitali; Sunt șapte la fiecare nivel. Un orbital atomic cu o sarcină de electroni distribuită peste el este adesea numit nor de electroni.
Întrebarea 12.
Periodicitate orizontală
Astfel de proprietăți fizice, ca energie de ionizare și afinitate electronică, se manifestă și o periodicitate orizontală, asociată cu o modificare periodică a numărului de electroni la ultimele subnivele energetice:
Întrebarea 13.
Întrebarea 14.
Caracteristicile magnetice ale unui atom
Electronul are propriul său moment magnetic, care este cuantificat în direcția paralelă sau opusă câmpului magnetic aplicat. Dacă doi electroni care ocupă același orbital au spini direcționați opus (conform principiului Pauli), atunci se anulează reciproc. În acest caz, se spune că electronii sunt perechi. Atomii cu doar electroni perechi sunt împinși în afara câmpului magnetic. Astfel de atomi sunt numiți diamagnetici. Atomii care au unul sau mai mulți electroni nepereche sunt atrași într-un câmp magnetic. Se numesc diamagnetice.
Momentul magnetic al unui atom, care caracterizează intensitatea interacțiunii unui atom cu camp magnetic, este practic proporțională cu numărul de electroni nepereche.
Particularități structura electronica atomi diverse elemente se reflectă în caracteristici energetice precum energia de ionizare și afinitatea electronică.
Energie de ionizare
Energia (potenţialul) de ionizare a unui atom Ei este energia minimă necesară pentru a îndepărta un electron dintr-un atom la infinit conform ecuației
X = X + + e− . Valorile sale sunt cunoscute pentru atomii tuturor elementelor sistemului periodic. De exemplu, energia de ionizare a unui atom de hidrogen corespunde tranziției unui electron de la 1 s- subnivelul energetic (−1312,1 kJ/mol) la subnivelul cu energie zero și egal cu +1312,1 kJ/mol.
La modificarea primelor potențiale de ionizare, corespunzătoare îndepărtării unui electron, a atomilor, periodicitatea se exprimă clar cu o creștere a numărului ordinal al atomului:
Când se deplasează de la stânga la dreapta de-a lungul perioadei, energia de ionizare, în general, crește treptat, în timp ce crește numărul de serie în cadrul grupului, aceasta scade. Potențialele minime de prima ionizare au Metale alcaline, maxim - gaze nobile.
Pentru același atom, a doua, a treia și următoarele energii de ionizare cresc întotdeauna, deoarece electronul trebuie să fie detașat de un ion încărcat pozitiv. De exemplu, pentru un atom de litiu, prima, a doua și a treia energie de ionizare sunt 520,3, 7298,1 și, respectiv, 11814,9 kJ/mol.
Secvența de detașare a electronilor este de obicei inversa secvenței populației de orbitali de electroni în conformitate cu principiul energiei minime. Cu toate acestea, elementele care sunt populate d-orbitalii sunt exceptii - in primul rand nu pierd d-, A s-electroni.
afinitatea electronică
Afinitatea unui atom pentru un electron A e - capacitatea atomilor de a atasa un electron suplimentar si de a se transforma intr-un ion negativ. Măsura afinității electronice este energia eliberată sau absorbită în proces. Afinitatea electronică este egală cu energia de ionizare a ionului negativ X − : X − = X + e −
Atomii de halogen au cea mai mare afinitate electronică. De exemplu, pentru un atom de fluor, adăugarea unui electron este însoțită de eliberarea a 327,9 kJ/mol de energie. Pentru un număr de elemente, afinitatea electronilor este aproape de zero sau negativă, ceea ce înseamnă că nu există un anion stabil pentru acest element.
De obicei, afinitatea electronilor pentru atomii diferitelor elemente scade în paralel cu creșterea energiei lor de ionizare. Cu toate acestea, există excepții pentru unele perechi de elemente:
O explicație pentru aceasta poate fi dată pe baza dimensiunilor mai mici ale primilor atomi și a respingerii electron-electron mai mari din ei.
Întrebarea 15.
Întrebarea 16.
Periodicitate orizontală
Periodicitatea orizontală constă în apariția valorilor maxime și minime ale proprietăților substanțe simpleși conexiuni în fiecare perioadă. Este vizibil în special pentru elementele grupului VIIIB și lantanide (de exemplu, lantanidele cu numere de serie pare sunt mai frecvente decât cele cu numere impare).
În proprietăți fizice precum energia de ionizare și afinitatea electronică, se manifestă și periodicitatea orizontală, asociată cu o modificare periodică a numărului de electroni la ultimele subnivele energetice.






