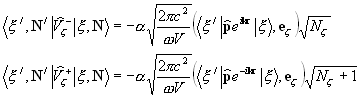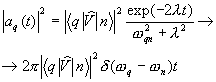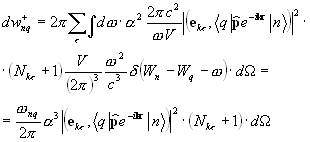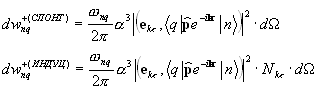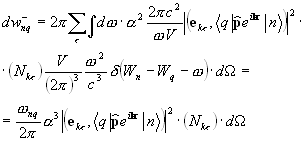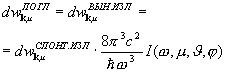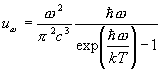Emisia spontană și stimulată
Un număr mare de fenomene diferite apar din cauza modificării energiei atomilor și moleculelor. În unele cazuri, pentru practică, nu este nevoie de o abordare atomo-moleculară a analizei fenomenelor. În altele, utilizarea eficientă a fenomenului este posibilă numai cu luarea în considerare indispensabilă a naturii sale moleculare (atomice).
Acest capitol evidențiază caracteristicile radiației și absorbției energiei de către atomi și molecule, precum și câteva fenomene practic importante, a căror cunoaștere a naturii atomice este esențială pentru utilizarea lor. O parte din acest subiect larg este discutat în capitolul următor.
29.1. CARACTERISTICI DE RADIAȚIE ȘI ABSORȚIE DE ENERGIE
ATOMI ȘI MOLECULE
Un atom și o moleculă pot fi în stări de energie staționară. În aceste stări, ele nu emit sau absorb energie. Stările de energie sunt descrise schematic ca niveluri (vezi, de exemplu, Fig. 28.13). Cel mai scăzut nivel de energie - nivelul solului - corespunde stării fundamentale.
În tranzițiile cuantice, atomii și moleculele sar de la o stare staționară la alta, de la un nivel de energie la altul.
O schimbare în starea atomilor este asociată cu tranziții energetice electroni. În molecule, energia se poate modifica nu numai ca urmare a tranzițiilor electronice, ci și ca urmare a modificărilor vibrației atomilor și a tranzițiilor între nivelurile de rotație.
La mutarea de la sus niveluri de energie eliberează energie atomului sau moleculei inferioare și o absoarbe în timpul tranzițiilor inverse. Un atom în starea sa fundamentală poate absorbi doar energie.
Există două tipuri de tranziții cuantice:
1) fără radiație sau absorbție de energie electromagnetică de către un atom sau moleculă. O astfel de tranziție neradiativă are loc atunci când un atom sau o moleculă interacționează cu alte particule.
mi, de exemplu, în procesul de coliziune. Se face distincția între ciocnirea inelastică, în care starea internă a atomului se modifică și are loc o tranziție neradiativă, și elastică - cu o modificare a energiei cinetice a atomului sau a moleculei, dar cu păstrarea stării interne; 2) cu emisie sau absorbție a unui foton.
Energia unui foton este egală cu diferența dintre energiile stărilor staționare inițiale și finale ale unui atom sau moleculă:
Formula (29.1) exprimă legea conservării energiei.
În funcție de cauza care provoacă o tranziție cuantică cu emisia unui foton, se disting două tipuri de radiații. Dacă această cauză este o particulă internă și excitată trece spontan la un nivel de energie mai scăzut, se numește astfel de radiație spontan(Fig. 29.1, a). Este aleatoriu și haotic în timp, frecvență (pot exista tranziții între diferite subniveluri), în direcția de propagare și polarizare. Sursele de lumină convenționale emit în mare parte radiații spontane. Alte radiații forţat, sau induse(Fig. 29.1, b). Apare în timpul interacțiunii unui foton cu o particulă excitată, dacă energia fotonului este egală cu diferența dintre nivelurile de energie. Ca rezultat al unei tranziții cuantice forțate, doi fotoni identici se vor propaga din particulă în aceeași direcție: unul este primar, forțator, iar celălalt este secundar, emis.
Energia emisă de atomi sau molecule formează spectrul de emisie, iar energia absorbită formează spectrul de absorbție.
Intensitate linii spectrale este determinată de numărul de tranziții identice care au loc pe secundă și, prin urmare, depinde de numărul de atomi emitenți (absorbitori) și de probabilitatea tranziției corespunzătoare.
Tranzițiile cuantice nu sunt efectuate între niciun nivel de energie. Reguli stabilite de selecție, sau de interdicție, care formulează condițiile în care tranzițiile sunt posibile și imposibile sau improbabile.
Nivelurile de energie ale majorității atomilor și moleculelor sunt destul de complexe. Structura nivelurilor și, în consecință, spectrele nu depind de

numai din clădire un singur atom sau molecule, dar și din cauze externe.
Interacțiunea electromagnetică a electronilor duce la o divizare fină a 1 niveluri de energie (structură fină). Influența momentelor magnetice ale nucleelor determină scindarea hiperfină (structură hiperfină). Extern unui atom sau moleculă, electric și campuri magnetice provoacă, de asemenea, divizarea nivelurilor de energie (fenomenele Stark și Zeeman; vezi 30.2).
Spectrele sunt o sursă de informații diverse.
În primul rând, atomii și moleculele pot fi identificați după forma spectrului, care face parte din sarcinile analizei spectrale calitative. Numărul de atomi emitenți (absorbanți) este determinat din intensitatea liniilor spectrale - analiză spectrală cantitativă. În același timp, impuritățile în concentrații de 10 -5 - 10 -6% sunt relativ ușor de găsit și se stabilește compoziția probelor de masă foarte mică - până la câteva zeci de micrograme.
Din spectre, se poate judeca structura unui atom sau a unei molecule, structura nivelurilor lor de energie, mobilitatea părților individuale ale moleculelor mari etc. Cunoscând dependența spectrelor de câmpurile care acționează asupra unui atom sau moleculă, se obține informații despre poziție relativă particule, deoarece influența atomilor (moleculelor) vecini se realizează prin câmp electromagnetic.
Studiul spectrelor corpurilor în mișcare face posibilă, pe baza efectului optic Doppler, determinarea vitezelor relative ale emițătorului și receptorului de radiație.
Dacă luăm în considerare faptul că din spectrul unei substanțe se pot trage concluzii despre starea, temperatura, presiunea, etc., atunci putem aprecia foarte mult utilizarea radiației și absorbția energiei de către atomi și molecule ca metodă de cercetare. .
În funcție de energia (frecvența) unui foton emis sau absorbit de un atom (sau moleculă), se clasifică următoarele tipuri de spectroscopie: radio, infraroșu, radiații vizibile, ultraviolete și raze X 2 .
În funcție de tipul de substanță (sursa spectrului), spectre atomice, moleculareși spectrecristale.
1 Termenul „divizare” aici nu înseamnă un proces, ci o stare deja formată.
2 Spectroscopia gamma datorată tranzițiilor cuantice nucleare nu este indicată aici.
29.2. ABSORȚIA LUMINII
Intensitatea luminii care se propagă într-un mediu poate scădea datorită absorbției și împrăștierii acesteia de către moleculele (atomii) substanței.
Prin absorbția luminiinumită slăbirea intensității luminii la trecerea prin orice substanță datorită conversiei energiei luminoase în alte forme de energie.
Să stabilim legea absorbției luminii de către materie. Dacă alegem un strat mic de substanță cu o grosime dX(Fig. 29.2), atunci atenuarea intensității dI a luminii de către acest strat în timpul absorbției va fi cu atât mai mare, cu atât grosimea stratului și intensitatea luminii incidente pe acest strat este mai mare:
Unde k- indicele natural de absorbtie (factor de proportionalitate care depinde de mediul absorbant si nu depinde in anumite limite de intensitatea luminii); semnul „-” înseamnă că intensitatea luminii scade la trecerea prin substanță, adică. dI<0. Интегрируя (29.2) и подставляя соответствующие пределы (рис. 29.2), получаем:
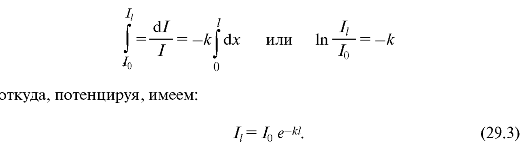
Această formulă exprimă Legea lui Bouguer a absorbției luminii. După cum puteți vedea, rata de absorbție naturală k este inversul distanței la care intensitatea luminii este atenuată ca urmare a absorbției în mediu în e o singura data.
Indicele de absorbție naturală depinde de lungimea de undă a luminii, de aceea este recomandabil să scrieți legea (29.3) pentru lumina monocromatică:
Unde kx- indicator natural monocromatic de absorbție.
Deoarece absorbția luminii se datorează interacțiunii cu moleculele, legea absorbției poate fi legată de anumite caracteristici ale moleculelor.
Lăsa P este concentrația de molecule care absorb cuante de lumină. Să notăm secțiunea transversală de absorbție efectivă a unei molecule ca σ (o zonă, când intră un foton în care este captat de moleculă).
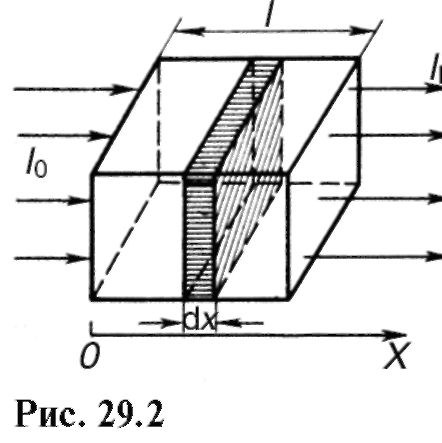
Aria totală a secțiunii transversale efective a moleculelor acestui strat este egală cu σnSdx. Un flux de fotoni cade pe acest strat Ф = ESTE. Fracțiunea suprafeței efective a secțiunii transversale a moleculelor din suprafața totală a secțiunii transversale:
Fracția de fotoni absorbită de strat poate fi exprimată în termeni de flux (F/F) sau intensitate (dI/I) luminii. Pe baza celor de mai sus, putem scrie:


29.3. DIFUZIA LUMINII
Difuzia luminiinumit fenomen în care un fascicul de lumină care se propagă într-un mediu este deviat în toate direcțiile posibile.
O condiție necesară pentru apariția împrăștierii luminii este prezența neomogenităților optice, adică. regiuni cu un indice de refracție altul decât mediul principal.
Difuzarea și împrăștierea luminii au unele caracteristici comune, ambele fenomene depind de raportul dintre bariera sau neomogenitatea și lungimea de undă. Diferența dintre aceste fenomene constă în faptul că difracția se datorează interferenței undelor secundare, iar împrăștierea se datorează adăugării (și nu interferenței!) radiațiilor rezultate din oscilațiile forțate ale electronilor în neomogenități sub influența luminii.
Există două tipuri principale de astfel de neomogenități:
1) particule străine mici într-o substanță transparentă omogenă. Astfel de medii sunt tulburi: fum (particule solide în gaz), ceață (picături de lichid în gaz), suspensii, emulsii etc. Imprăștirea în medii tulburi se numește fenomen Tyndall;
2) neomogenități optice care apar într-o substanță pură din cauza abaterii statistice a moleculelor de la o distribuție uniformă (fluctuații de densitate). Imprăștirea luminii prin neomogenități de acest tip se numește moleculară; de exemplu, împrăștierea luminii în atmosferă.
Scăderea intensității luminii din cauza împrăștierii, ca și în cazul absorbției, este descrisă folosind o funcție exponențială:
Unde m- indicele de dispersie (natural).
Sub acțiunea combinată de absorbție și împrăștiere a luminii, atenuarea intensității este, de asemenea, o funcție exponențială:
unde μ este indicele de atenuare (natural). Este ușor de observat că μ = m+k.
Rayleigh a descoperit că în timpul împrăștierii într-un mediu tulbure prin neomogenități aproximativ mai mici de 0,2λ, precum și în timpul împrăștierii moleculare, intensitatea luminii împrăștiate este invers proporțională cu puterea a patra a lungimii de undă. (Legea lui Rayleigh):
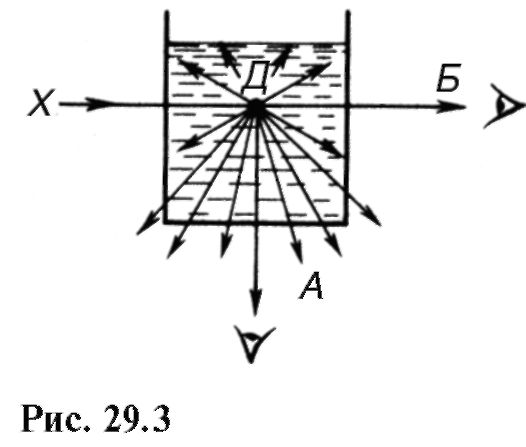
Aceasta înseamnă că din lumina albă o substanță, de exemplu, într-un punct d(Fig. 29.3), razele albastre și violete se vor împrăștia predominant (direcția A), iar razele roșii vor trece în direcția b lumină căzând. Un fenomen similar se observă în natură: culoarea albastră a cerului este lumină împrăștiată, culoarea roșie a Soarelui apus este o schimbare a spectrului luminii albe din cauza împrăștierii semnificative.
razele albastre și violete din atmosferă cu incidență oblică (vezi explicația pentru Fig. 27.3).
În semnalizare se utilizează mai puțină împrăștiere a razelor roșii: lumini de identificare la aerodromuri, cel mai important semafor este roșu etc. Razele infraroșii se împrăștie și mai puțin. Pe fig. 29.4 prezintă două fotografii ale peisajului: în stânga, realizată prin metoda obișnuită, ceața vizibilitate limitată sever: în dreapta, luată în radiații infraroșii pe o placă specială, ceața nu interferează, s-a dovedit a fi transparentă pentru valuri mai lungi.
Dacă particulele în suspensie sunt mari în comparație cu lungimea de undă, atunci împrăștierea nu corespunde legii Rayleigh (29.14) - numitorul fracției va fi λ 2 . Lumina difuză își pierde albastrul și devine mai albă. Astfel, cerul prăfuit al orașelor ni se pare albicios, în contrast cu cerul albastru închis al spațiilor maritime clare.
Direcția luminii împrăștiate, gradul de polarizare a acesteia, compoziția spectrală etc. aduce informații despre parametrii care caracterizează interacțiunea intermoleculară, dimensiunile macromoleculelor din soluții, particulelor din soluții coloidale, emulsii, aerosoli etc.

Se numesc metode de măsurare a luminii împrăștiate pentru a obține acest tip de informații nefelometrie, și dispozitivele corespunzătoare nefelometre.
29.4. SPECTRE ATOMICE OPTICE
Spectrele atomice sunt atât spectre de emisie, cât și spectre de absorbție care apar în timpul tranzițiilor cuantice între nivelurile atomilor liberi sau care interacționează slab.
Prin spectre atomice optice înțelegem cele care se datorează tranzițiilor între nivelurile electronilor externi cu energii fotonice de ordinul mai multor electronvolți. Aceasta include regiunile ultraviolete, vizibile și infraroșu apropiat (până la micrometri) ale spectrului.
De cel mai mare interes sunt spectrele optice de emisie atomică, care sunt obținute din atomi excitați. Excitația lor se realizează de obicei ca urmare a tranzițiilor cuantice neradiative în timpul unei descărcări electrice într-un gaz sau încălzirea unei substanțe cu o flacără a unui arzător cu gaz, un arc electric sau o scânteie.
În 29.1, au fost date considerații generale despre spectrele atomilor. Informații detaliate despre spectrele unor atomi specifici pot fi găsite în cărțile speciale de referință despre spectroscopie. Ca exemplu simplu, luați în considerare spectrul unui atom de hidrogen și al ionilor asemănători hidrogenului.
Din formulele (28.24) și (29.1) se poate obține o formulă pentru frecvența luminii emise (absorbite) de un atom de hidrogen (Z = 1):
Această formulă a fost găsită experimental de I.Ya. Balmer cu mult înainte de crearea mecanicii cuantice și obținut teoretic de Bohr (vezi 28.7); iși k sunt numerele ordinale ale nivelurilor între care are loc tranziția cuantică.
Spectrul poate fi împărțit în grupuri de linii numite serie spectrală.
Fiecare serie, așa cum este aplicată spectrelor de emisie, corespunde tranzițiilor de la diferite niveluri la același nivel final (Fig. 29.5).
Situat în regiunea ultravioletă seria lyman, care se formează în timpul trecerii de la cele mai înalte niveluri de energie la cele mai
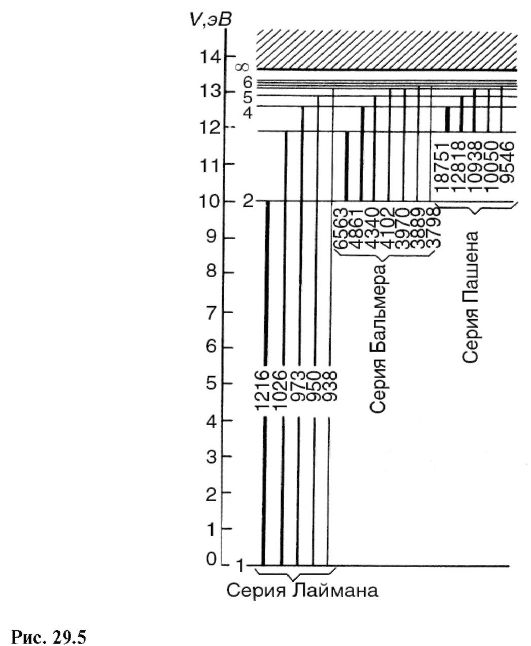
inferior, principal (k = 1). Din formula (29.15) pentru seria Lyman obținem:
acestea. găsiți frecvențele tuturor liniilor acestei serii. Linia cu cea mai lungă lungime de undă are cea mai mare intensitate. Intensitățile liniilor spectrale din Fig. 29.5 sunt arătate condiționat de grosimea tranzițiilor directe corespunzătoare.
În regiunile vizibile și aproape ultraviolete ale spectrului, există seria Balmer, care apare ca urmare a tranzițiilor de la nivelurile superioare de energie la a doua (k = 2). Din formula (29.15) pentru Seria Balmer primim:

29.5. SPECTRE MOLECULARE
Spectrele moleculare (emisii și absorbții) apar în timpul tranzițiilor cuantice ale moleculelor de la un nivel de energie la altul (vezi 28.9) și constau dintr-un set de benzi mai mult sau mai puțin largi, care sunt linii strâns distanțate. Complexitatea spectrelor moleculare în comparație cu cele atomice se datorează
o mare varietate de mișcări și, în consecință, tranziții energetice în moleculă.
Ținând cont de (29.1) și (28.37), găsim frecvența emisă sau absorbită de moleculă:


Spectrele moleculare fac posibilă studierea nu numai a structurii moleculelor, ci și a naturii interacțiunilor intermoleculare.
Spectrele de absorbție (absorbție) moleculară sunt o sursă importantă de informații despre moleculele funcționale biologic, ele fiind utilizate pe scară largă în lucrările biochimice și biofizice moderne.
În multe cazuri, aceste spectre sunt înregistrate ca continue, nerezolvând detaliile care au fost descrise mai sus.
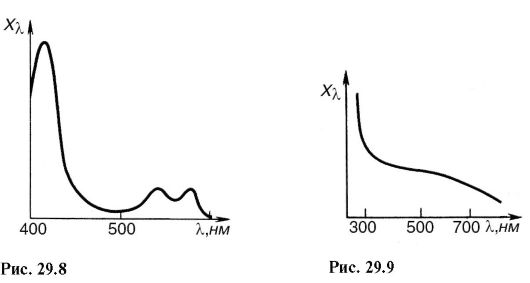
Deci, de exemplu, în fig. 29.8 prezintă spectrul de absorbție al unei suspensii de eritrocite. Spectrul de absorbție al pielii umane este prezentat în Fig. 29.9, în partea ultravioletă, rata de absorbție este mare, iar pielea absoarbe radiațiile în straturile superioare. În regiunea vizibilă, absorbanța scade și rămâne aproape constantă până în regiunea roșie.
29.6. DIVERSE TIPURI DE LUMINESCENCE
Luminescența se numește exces asupra radiației termice a unui corp la o anumită temperatură, care are o durată care depășește semnificativ perioada(10 -15 s) unde luminoase emise.
Semnul duratei în această definiție a fost propus de S.I. Vavilov pentru a distinge luminescența de alte fenomene de luminiscență secundară, cum ar fi reflectarea și împrăștierea luminii.
În funcție de tipul de excitație, se disting mai multe tipuri de luminiscență.
Luminescența cauzată de particulele încărcate: ioni - io-noluminiscență, electroni - catodoluminiscență, radiatie nucleara - radioluminescență. Luminescența sub influența razelor X și a radiațiilor γ se numește luminescență cu raze X, fotonii - fotoluminiscență (vezi 29.7). Când frecați, zdrobiți sau despicați unele cristale, triboluminiscenţă. Emotionat de un câmp electric electroluminiscență, un caz special al căruia este strălucirea unei descărcări de gaz. Luminiscența care însoțește o reacție chimică exotermă se numește chemiluminiscenţă (vezi 29.8).
Fotoluminescența, denumită uneori pur și simplu luminiscență, este subdivizată în fluorescență (scurtă strălucire) și fosforescență (relativ lungă durată).
Actul inițial al oricărei fotoluminiscențe este excitarea unui foton cu energie hv atom sau moleculă. În cel mai simplu caz, care se realizează de obicei în vapori și gaze monoatomice, atomul revine la starea fundamentală, emițând un foton de lumină de aceeași frecvență ν (Fig. 29.10). Acest fenomen se numește fluorescență rezonantă (împrăștiere rezonantă). Experimente speciale au arătat ce este lumina
29.7. FOTOLUMINESCENZA
![]()
Emisia are loc la aproximativ 10 -8 s după iluminarea substanței și, prin urmare, nu se împrăștie în sensul obișnuit al cuvântului.
Când la vaporii luminescenți se adaugă gaze străine (hidrogen, oxigen etc.), fluorescența rezonantă scade. Acest lucru se datorează faptului că în timpul în care atomul este

într-o stare excitată, poate întâlni un alt tip de moleculă și îi poate da energie. În acest caz, energia cinetică a moleculei crește, iar atomul trece neradiativ în starea fundamentală.
Este mai probabil ca din starea de excitat 3 (Fig. 29.11) molecula va trece neradiativ la nivel 2, iar apoi spontan cu emisia unui cuantic cu energie hv" la nivel 1.
În moleculele organice complexe, are loc o tranziție de la o stare excitată 3 în unele intermediare, metastabile 4, tranziția de la care la starea fundamentală este puțin probabilă (Fig. 29.12). Datorită energiei molecular-cinetice a particulelor din jur sau datorită unui nou cuantum de lumină, este posibilă tranziția moleculei la un nivel excitat. 2, iar de la ea la starea fundamentală 1. Acesta este unul dintre mecanismele fosforescenței. Încălzirea crește probabilitatea de a părăsi nivelul metastabil și îmbunătățește fosforescența.
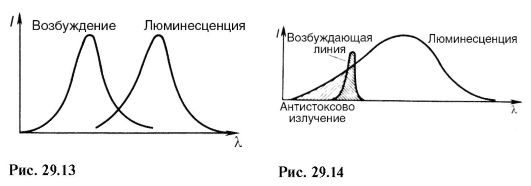
Pentru fotoluminiscență, este practic adevărat Legea lui Stokes: spectrul de luminescență este deplasat către lungimi de undă mari în raport cu spectrul care a cauzat această fotoluminiscență (Fig. 29.13).
De fapt, după cum se poate observa din fig. 29.10, energia hv "a fotonului emis nu este mai mare decât energia hv a fotonului absorbit:
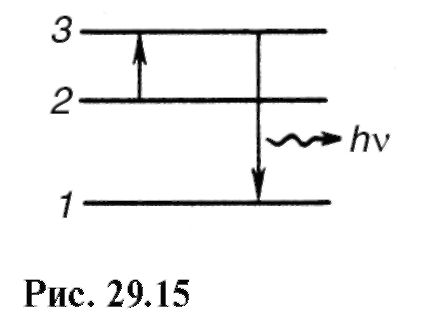
de unde λ "\u003e λ. Există abateri de la legea Stokes - luminiscența anti-Stokes. Acest lucru este evident mai ales atunci când fotoluminiscența este excitată de o linie spectrală separată, adică lumină monocromatică (Fig. 29.14). Radiația anti-Stokes apare atunci când o particula este excitată care era deja într-o stare excitată (Fig. 29.15, nivelul 3). 2 pe principal 1 este emisă energie hv". După cum se poate observa din figură:
Un număr de molecule funcționale biologic, cum ar fi moleculele de proteine, prezintă fluorescență. Parametrii de fluorescență sunt sensibili la structura mediului moleculei fluorescente; prin urmare, luminescența poate fi utilizată pentru a studia transformările chimice și interacțiunile intermoleculare.
În ultimele decenii, moleculele fluorescente speciale adăugate sistemelor membranare din exterior au devenit utilizate pe scară largă. Astfel de molecule se numesc sonde fluorescente (legatura non-covalenta cu membrana) sau etichete fluorescente (legatura chimica).
Modificarea fluorescenței sondelor și etichetelor face posibilă detectarea rearanjamentelor conformaționale în proteine și membrane.
Luați în considerare câteva aplicații ale fotoluminiscenței în scopuri medicale.
Analiza luminiscentă, bazată pe observarea luminiscenței obiectelor pentru a le studia, este utilizată pentru a detecta stadiul inițial al deteriorării alimentelor, pentru a sorta preparatele farmacologice și pentru a diagnostica anumite boli. Deci, părul și solzii afectați de ciupercă sub lumina ultravioletă dau o strălucire luminiscentă de culoare verde strălucitor. Permeabilitatea capilară a pielii poate fi determinată prin injectarea subcutanată a coloranților fluorescenți.
În condiții favorabile, analiza luminiscente face posibilă detectarea substanțelor luminiscente cu o greutate de până la 10 -10 g.
Analiza luminescentă a obiectelor microscopice se realizează folosind microscoape luminiscente speciale, care, spre deosebire de sursele de lumină convenționale, folosesc de obicei lămpi cu mercur de înaltă și ultraînaltă presiune și folosesc două filtre de lumină. Unul dintre ele, situat în fața condensatorului

așternut, evidențiază regiunea spectrului sursei de lumină, care provoacă luminescența obiectului; celălalt, situat între lentilă și ocular, emite lumină de luminiscență. Pe baza fotoluminiscenței, au fost create surse de lumină, al căror spectru este mai consistent cu lumina zilei decât cu cel al lămpilor cu incandescență. Acest lucru este important atât pentru scopuri industriale, cât și pentru igienă. În astfel de lămpi fluorescente, numite lămpi fluorescente, se produce o descărcare electrică în vapori de mercur la presiune joasă (electroluminiscență). Pe suprafața interioară a lămpii, din sticlă obișnuită (Fig. 29.16), se depune un strat subțire de fosfor, care fotoluminesce sub influența radiațiilor de la vaporii de mercur.
Prin modificarea compoziției fosforului, se poate alege cel mai potrivit spectru de fotoluminiscență. Pe fig. 29.17 arată unul dintre spectrele posibile, liniile intense corespund spectrului de vapori, a căror radiație trece parțial prin fosfor.
29.8. CHIMILUMINESCENZA
Luminescența care însoțește reacțiile chimice se numește chemiluminiscență.
Este emis fie direct de produșii de reacție, fie de alte componente care sunt excitate ca urmare a transferului de energie către aceștia din produsele de reacție.
Luminozitatea chimioluminiscenței, de ex. numărul de cuante emise pe unitatea de timp crește odată cu creșterea vitezei de reacție și a eficienței chemiluminiscenței - numărul mediu de cuante pe un act de reacție. Chemiluminiscența poate fi utilizată pentru a determina compoziția unei substanțe (analiza chemiluminiscentă).
O manifestare specială a chemiluminiscenței - o strălucire care însoțește reacțiile chimice ale obiectelor biologice - se numește biohe-
miluminescență.Radiații putrezite, licurici - exemple de biochimiluminiscență (bioluminiscență).
Printre biofizicieni, se numește bioluminiscență de intensitate scăzută lumină super slabă, a fost studiat activ de un număr de oameni de știință, în special de Yu.A. Vladimirov.
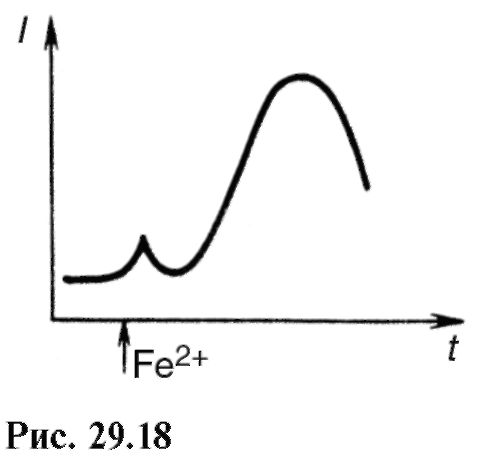
S-a demonstrat că în sistemele biologice chemiluminiscența are loc în timpul recombinării radicalilor liberi peroxid lipidic: RO 2 +RO 2 - produs excitat - produs + + cuantum de chemiluminiscență.
Intensitatea chemiluminiscenței crește semnificativ atunci când sistemelor biologice studiate sunt adăugate, de exemplu, săruri feroase. Pe fig. 29.18 arată o creștere a intensității luminiscenței în suspensia mitocondriilor în momentul introducerii fierului feros. Dacă se face un experiment similar cu plasmă de sânge în cazul apendicitei purulente sau colecistitei, atunci se poate observa că strălucirea în primul caz este mult mai slabă. Astfel, chemiluminiscența poate fi utilizată ca metodă de diagnostic.
29.9. PROCESE FOTOBIOLOGICE
Procesele fotobiologice sunt numite procese care încep cu absorbția cuantelor de lumină de către molecule funcționale biologic și se termină cu o reacție fiziologică corespunzătoare în organism sau țesuturi.
O caracteristică importantă a efectului luminii asupra cursului proceselor biologice este spectrul acțiunii fotobiologice - dependența efectului fotobiologic de lungimea de undă a luminii care acționează. Spectrele de acțiune fac posibilă determinarea regiunii spectrului care provoacă cel mai eficient un proces biologic, precum și a afla mecanismul unui astfel de efect.
Medicul are nevoie de o înțelegere a acestor procese pentru a explica mecanismul vederii (vezi 29.10) și pentru a evalua diferitele efecte ale radiațiilor UV (vezi 27.7).
După ce a absorbit o cantitate de lumină (vezi 29.2), molecula este excitată. Energia de excitație poate fi transferată către alte molecule. Pentru un proces fotobiologic, este esențial ca în urma unei astfel de excitații să aibă loc o transformare chimică (reacție fotochimică). După actul fotochimic primar, reacțiile se dezvoltă în așa fel încât prezența luminii să nu fie necesară (reacții întunecate), în final conduc la răspunsul sistemului biologic la lumină.
Să luăm în considerare cantitativ etapele inițiale ale acestui proces: absorbția luminii și reacția fotochimică primară.
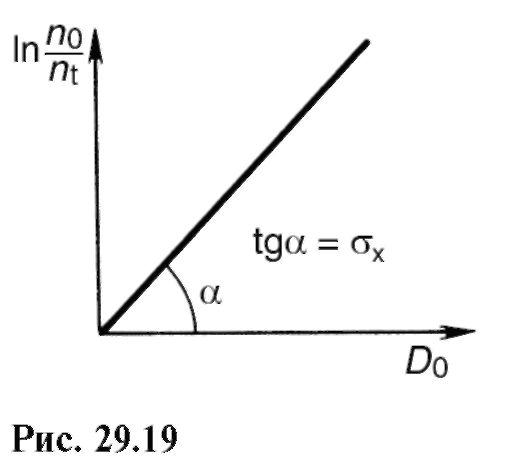
Similar cu 29.2, introducem conceptul de secțiune transversală de absorbție efectivă a unei molecule de foton σ. Diferența față de derivarea legii Bouguer-Lambert-Beer este cel puțin următoarea: în primul rând, vom ține cont de scăderea numărului de molecule activate, deoarece expunerea la lumină determină transformarea acestora; în al doilea rând, luați în considerare un strat suficient de subțire de soluție diluată, acest lucru ne va permite să citim intensitatea luminii eu 0 constantă și aceeași în toată soluția.
Scăderea elementară a concentrației dn a moleculelor sub acțiunea luminii este proporțională cu:
Concentratii n molecule;
Secțiune transversală de absorbție eficientă σ;
Timp de iradiere dt;
Numărul de fotoni care trec pe unitatea de timp prin 1 m 2 al feței celulei (I 0):

Aici I 0 t = D0- doza de radiație și σφ χ = σ χ - aria secțiunii transversale a moleculei pentru transformarea fotochimică, este proporțională cu probabilitatea unei astfel de interacțiuni a unui foton cu o moleculă, în urma căreia va avea loc o reacție fotochimică .
Pentru a găsi φ χ, reprezentați grafic dependența ln (" 0 / n t) = f(D0) iar de-a lungul pantei dreptei [vezi (29.24)] determinați această valoare (Fig. 29.19).
În fotochimie, dependența σ χ (λ) se numește spectru de acțiune. Această relație poate fi găsită folosind relația σ χ = σφχ . Ideea este că cuantica
Randamentul total al reacțiilor fotochimice în soluții nu depinde de lungimea de undă a luminii care acționează (φ χ = const). Din punct de vedere fizic, aceasta înseamnă că, indiferent de energia de excitație hv, molecula va fi excitată (vezi 28.9) și va putea începe o transformare fotochimică. Ținând cont de acest lucru, putem concluziona că spectrul de acțiune σ χ (λ) și spectrul de absorbție (vezi 29.2) - dependența σ (λ) - au aceeași formă, întrucât diferă doar printr-un factor constant φ χ . Astfel de
Această caracteristică face posibilă, prin compararea spectrului de acțiune fotobiologică cu spectrul de absorbție a diferiților compuși biochimici, să se determine mecanismul de acțiune al luminii și, în special, al radiației UV.
Deci, de exemplu, s-a constatat că curba morții bacteriene sub acțiunea radiațiilor UV (spectrul de acțiune fotobiologică) este similară cu spectrul de absorbție al acizilor nucleici. Acest lucru a dat motive pentru a concluziona că moartea bacteriilor se datorează deteriorării acizilor nucleici.
În 26.4, au fost luate în considerare caracteristicile părții conducătoare de lumină a ochiului. Percepția luminii de către ochi este un proces fotobiologic, prin urmare, aici este luat în considerare mecanismul de funcționare al aparatului de percepere a luminii.
29.10. FUNDAMENTELE BIOFIZICE ALE RECEPȚIEI VIZUALE
Celulele vizuale sensibile la lumină - tije și conuri - joacă roluri diferite în excitarea senzației de lumină. Tijele sunt mai sensibile la lumină, dar nu disting culorile. Conurile disting culorile; în plus, cu o luminozitate suficientă a obiectului, acestea sunt sensibile la percepția detaliilor imaginii, astfel încât rezoluția ochiului se datorează plasării conurilor pe retină (vezi 26.4).
Tijele aparțin aparatului de amurg și viziune acromatică, iar conurile - ziua și culoarea.
Luați în considerare mai întâi câteva întrebări generale despre sensibilitatea ochiului la lumină și culoare.
Sensibilitatea ochiului la lumină este reciproca luminozității pragului, adică. luminozitatea minimă care produce o senzație vizuală în condiții de vizualizare date.
Sensibilitatea ochiului la lumină variază într-o gamă largă din cauza vizualului adaptare- capacitatea ochiului de a se adapta la diferite luminozități. Adaptarea se realizează în următoarele moduri:
1) prin modificarea diametrului pupilei în intervalul de la 2 la 8 mm, care modifică fluxul luminos de 16 ori;
2) o scădere a concentrației de substanță fotosensibilă necompusă;
3) ecranarea conurilor și tijelor cu un pigment închis plasat în coroidă și capabil să se deplaseze spre corpul vitros în procesul de adaptare;
4) o modificare a gradului de participare a tijelor și conurilor la excitarea senzației de lumină, în funcție de luminozitatea obiectului.
Adaptarea permite ochiului să funcționeze normal în intervalul de luminozitate de la 10 -7 la 10 5 cd/m 2 . Limita inferioară, sau pragul absolut al sensibilității la lumină a ochiului cu adaptare completă la întuneric, este de aproximativ o sută de fotoni pe secundă. Dintre acestea, doar aproximativ 10% sunt absorbite de moleculele de pigment vizual din tijele retiniene, iar restul sunt reflectate de cornee, absorbite de mediile optice ale ochiului sau trec prin retină și sunt absorbite în celulele epiteliul pigmentar. Prezența epiteliului pigmentar de la baza retinei reduce semnificativ reflectarea și împrăștierea luminii din peretele din spate al ochiului. Ochiul uman răspunde la undele electromagnetice cu o lungime de undă de aproximativ 400 până la 760 nm. Sensibilitatea spectrală a ochiului se caracterizează prin vizibilitatea radiațiilor:

Maximul curbei de vizibilitate a vederii diurne corespunde maximului de radiație solară care a trecut prin atmosferă și a lovit suprafața Pământului (vezi 27.4), aceasta arată oportunitatea organizării ochiului uman.
Tija este formată (Fig. 29.21) dintr-un segment exterior sensibil la lumină 1 și segmentul autohton 2, conţinând nucleul şi mitocondriile, care asigură funcţionarea celulei. În interiorul segmentului exterior sunt discuri subțiri 3 aproximativ 6 µm în diametru. Fiecare disc constă dintr-o membrană cu două straturi și are forma unui lipozom aplatizat (vezi 13.1). Un pigment vizual este încorporat în discurile vizuale.

![]()
ment - rodopsina. Numărul de discuri dintr-o celulă este măsurat în câteva sute. Din segmentul interior există o legătură cu fibra nervoasă.
Rodopsina este o proteină complexă cu o greutate moleculară de aproximativ 40 000. Diametrul moleculei sale este de 4 nm, dacă forma sa este luată ca sferică.
Rodopsina este formată din opsina proteică și grupul cromofor - retinian.
Retinal, vorbind în general, poate avea mai mulți izomeri spațiali, dar numai P-cisretinal se leagă de opsină (Fig. 29.22). Sub acțiunea luminii, retina este scindată din rodopsina și trece în cea mai stabilă conformație a izomerului trans continuu.
Ca urmare a modificărilor în structura retinei, apar modificări în membrana discului asociate cu o schimbare a poziției rodopsinei. Rodopsina trece de la suprafața hidrofilă interdiscală în faza girofobă interioară a membranei.
Dacă în întuneric membrana discului este impermeabilă la Na+, K+, Ca 2+ etc., atunci ca urmare a iluminării, modificarea conformațională a rodopsinei duce la o schimbare a stării membranei: permeabilitatea pentru unii ioni crește . În aceste procese, funcția rodopsinei este aceea că, sub acțiunea luminii, favorizează formarea de pori în discuri pentru unii ioni și închide canalele de pe membrana exterioară pentru ionii de sodiu. Acest lucru duce la apariția potențialelor care provoacă un impuls nervos. O caracteristică a segmentelor exterioare ale tijelor retinei este că în întuneric potențialul are natură de sodiu, în contrast cu potențialul altor celule (vezi 13.7). Ca urmare a modificării structurii rodopsinei sub acțiunea luminii, permeabilitatea membranelor pentru sodiu scade brusc, iar pentru alți ioni nu.
se schimba. În acest caz, permeabilitatea pentru potasiu este pe primul loc, potențialul devine de natură a potasiului și polaritatea acestuia se modifică. Acest lucru duce la faptul că, spre deosebire de toate celelalte celule cunoscute, pe membrana citoplasmatică a segmentelor exterioare ale tijelor, potențialul are un semn plus în interior și un semn minus în exterior.
Pigmentul conului conține, de asemenea, P-cisretinal, ca rodopsina, dar partea proteică a pigmentului este diferită, așa că pigmenții conului se numesc iodopsine.
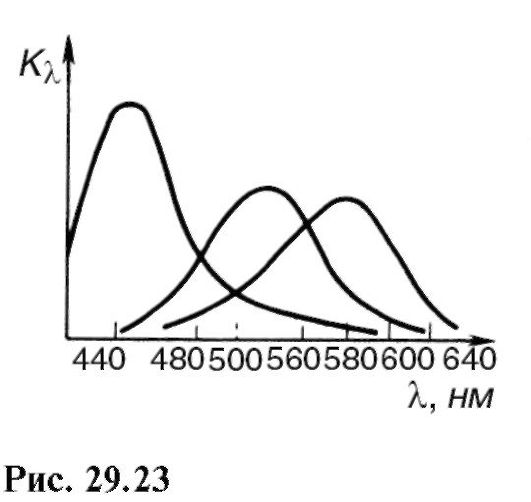
Măsurarea spectrelor de absorbție ale varietăților individuale de conuri a arătat că fiecare con conține un anumit tip de iod-psină. Iodopsinele cu conuri umane au maxime de absorbție la 445, 535 și 570 nm (Fig. 29.23). Aceste informații se bazează pe teoria cu trei componente a vederii culorilor. În unele boli genetice, sinteza proteinelor iodopsine este perturbată, iar ochiul nu este capabil să facă distincția între culorile roșii și cele verzi (daltonism).
§ 6 Absorbție.
Spontană şi emisie stimulata
În condiții normale (în absența influențelor externe), majoritatea electronilor din atomi se află la cel mai scăzut nivel neexcitat. E 1, adică un atom are o cantitate minimă de energie internă, nivelurile rămase E 2 , E 3 ....E
n corespunzătoare stărilor excitate, au o populație minimă de electroni sau sunt libere deloc. Dacă atomul este în starea fundamentală cu E 1 , apoi sub acțiunea radiației externe, o tranziție forțată la o stare excitată cu E 2. Probabilitatea unor astfel de tranziții este proporțională cu densitatea radiației care provoacă aceste tranziții.
Un atom, aflat în stare excitată 2, poate, după un timp, să treacă spontan spontan (fără influențe externe) într-o stare cu o energie mai mică, eliberând excesul de energie sub formă radiatie electromagnetica, adică emitând un foton.
Se numește procesul de emisie a unui foton de către un atom excitat fără influențe externe emisie spontană (spontană). Cu cât probabilitatea de tranziții spontane este mai mare, cu atât durata medie de viață a unui atom în stare excitată este mai scurtă. pentru că atunci, tranzițiile spontane nu sunt legate reciproc emisia spontană nu este coerentă.
Dacă un atom în starea excitată 2 este expus la radiații externe cu o frecvență satisfăcătoarehn = E 2 - E 1, atunci are loc o tranziție forțată (indusă) la starea fundamentală 1 cu emisia unui foton cu aceeași energiehn = E 2 - E unu . Într-o astfel de tranziție, are loc radiația de către un atom în plus la fotonul sub care s-a produs tranziția. Radiația rezultată din expunerea externă se numește forţat. Astfel, în proces emisie stimulata sunt implicați doi fotoni: un foton primar care provoacă emisia de radiație de către atomul excitat și un foton secundar emis de atom. Fotoni secundari de nedistins din primar.
Einstein și Dirac au demonstrat că emisia stimulată este identică cu emisia stimulatoare: au aceeași fază, frecvență, polarizare și direcție de propagare.Þ Emisie stimulata strict coerent cu emisie forţată.
Fotonii emiși, care se deplasează într-o direcție și se întâlnesc cu alți atomi excitați, stimulează tranzițiile induse în continuare, iar numărul de fotoni crește ca o avalanșă. Cu toate acestea, împreună cu emisia stimulată, va avea loc și absorbția. Prin urmare, pentru a amplifica radiația incidentă, este necesar ca numărul de fotoni din emisiile stimulate (care este proporțional cu populația stărilor excitate) să depășească numărul de fotoni absorbiți. În sistem, atomii sunt în echilibru termodinamic, absorbția va prevala asupra emisiei stimulate, adică. Radiația incidentă va fi atenuată pe măsură ce trece prin materie.
Pentru ca mediul să amplifice radiația incidentă pe el, este necesar să se creeze starea de neechilibru a sistemului, la care numărul de atomi în starea excitată este mai mare decât în starea fundamentală. Se numesc astfel de stări state cu inversarea populaţiei. Procesul de creare a unei stări de neechilibru a materiei se numește pompat. Pomparea se poate face prin metode optice, electrice și alte metode.
În mediile cu populație inversată, emisia stimulată poate depăși absorbția, adică. radiatia incidenta va fi amplificata la trecerea prin mediu (aceste medii se numesc active). Pentru aceste mass-media din legea lui Bouguereu = eu 0e- AX , coeficient de absorbție a - negativ.
§ 7. Lasere - generatoare cuantice optice
La începutul anilor '60, a fost creat un generator cuantic al gamei optice - un laser " Amplificarea luminii prin emisie stimulată de radiații ” - amplificarea luminii prin emisie indusa de radiatii. Proprietăți ale radiației laser: monocromaticitate ridicată (frecvență luminoasă extrem de ridicată), orientare spațială clară, luminozitate spectrală uriașă.
Conform legilor mecanicii cuantice, energia unui electron într-un atom nu este arbitrară: poate avea doar un anumit interval (discret) de valori E 1, E 2, E 3 ... E n numit niveluri de energie. Aceste valori sunt diferite pentru diferiți atomi. Se numește setul de valori ale energiei permise spectrul energetic atom. În condiții normale (în absența influențelor externe), majoritatea electronilor din atomi se află la cel mai scăzut nivel excitat E 1, adică. un atom are o cantitate minimă de energie internă; alte niveluri E 2 , E 3 ..... E n corespund energiei superioare a atomului și sunt numite excitat.
În timpul tranziției unui electron de la un nivel de energie la altul, un atom poate emite sau absorbi unde electromagnetice, a căror frecvență n m n \u003d (E m - E n) h,
unde h - constanta lui Planck ( h = 6,62 10-34 Js);
E n - final, E m - Primul nivel.
Un atom excitat poate renunța la o parte din excesul său de energie, primit de la o sursă externă sau dobândit de acesta ca urmare a mișcării termice a electronilor, în două moduri diferite.
Orice stare excitată a unui atom este instabilă și există întotdeauna posibilitatea tranziției sale spontane la o stare de energie inferioară cu emisia unui cuantum de radiație electromagnetică. O astfel de tranziție se numește spontan(spontan). Este neregulat și haotic. Toate sursele obișnuite produc lumină prin emisie spontană.
Acesta este primul mecanism de emisie (radiația electromagnetică). În revizuit schema pe doua niveluri emisia de lumină, nu se poate realiza nicio amplificare a radiației. Energie absorbită h n eliberată ca cuantică cu aceeași energie h n și poți vorbi despre echilibru termodinamic: procesele de excitare a atomilor dintr-un gaz sunt întotdeauna echilibrate de procesele inverse de emisie.

§2 Schema pe trei niveluri
În atomii unei substanțe aflate în echilibru termodinamic, fiecare nivel excitat ulterior conține mai puțini electroni decât cel anterior. Dacă acționăm asupra sistemului cu radiații excitante cu o frecvență care intră în rezonanță odată cu trecerea între nivelurile 1 și 3 (schematic 1→ 3), atunci atomii vor absorbi această radiație și vor trece de la nivelul 1 la nivelul 3. Dacă intensitatea radiației este suficient de mare, atunci numărul de atomi care au trecut la nivelul 3 poate fi destul de semnificativ, iar noi, încălcând echilibrul distribuția populațiilor de nivel, va crește populația de nivelul 3 și, prin urmare, va reduce populația de nivelul 1.
De la nivelul al treilea superior, sunt posibile tranziții 3→ 1 și 3 → 2. Sa dovedit că tranziția 3→ 1 duce la emisia de energie E 3 -E 1 = h n 3-1 , iar tranziția 3 → 2 nu este radiativ: duce la populația ''de sus'' a nivelului intermediar 2 (o parte din energia electronilor în timpul acestei tranziții este dată substanței, încălzind-o). Acest al doilea nivel se numește metastabil, și ca rezultat vor fi mai mulți atomi pe el decât pe primul. Deoarece atomii ajung la nivelul 2 de la nivelul solului 1 prin starea superioară 3 și revin înapoi la nivelul solului cu o „întârziere mare”, atunci nivelul 1 este „epuizat”.
Ca urmare, există inversare, acestea. distribuţia inversă inversă a populaţiilor de nivel. Inversarea populației a nivelurilor de energie este creată de o intensă radiație auxiliară numită radiatia pompatași în cele din urmă duce la induse multiplicarea (forțată) a fotonilor într-un mediu invers.
Ca în orice generator, într-un laser, pentru a obține modul de generare, este necesar Părere. Într-un laser, feedback-ul este implementat folosind oglinzi. Mediul de amplificare (activ) este plasat între două oglinzi - plate sau mai des concave. O oglindă este solidă, cealaltă este parțial transparentă.
„Sămânța” procesului de generare este emisia spontană a unui foton. Ca urmare a mișcării acestui foton în mediu, acesta generează o avalanșă de fotoni care zboară în aceeași direcție. După ce a ajuns la o oglindă translucidă, avalanșa va fi parțial reflectată și parțial va trece prin oglindă spre exterior. După reflectarea din oglinda dreaptă, valul se întoarce, continuând să devină mai puternic. Mersul pe josl, ajunge in oglinda din stanga, se reflecta si din nou se repezi spre oglinda dreapta.
Astfel de condiții sunt create numai pentru undele axiale. Quanta din alte direcții nu sunt capabile să preia o parte notabilă din energia stocată în mediul activ.
Unda care iese din laser are un front aproape plat și un grad ridicat de coerență spațială și temporală pe întreaga secțiune transversală a fasciculului.
În lasere, diferite gaze și amestecuri de gaze sunt utilizate ca mediu activ ( lasere cu gaz), cristale și pahare cu impurități ale anumitor ioni ( lasere cu stare solidă), semiconductori ( lasere cu semiconductor).
Metodele de excitare (în sistemul de pompare) depind de tipul mediului activ. Aceasta este fie o metodă de transfer a energiei de excitație ca urmare a unei coliziuni de particule într-o plasmă cu descărcare în gaz (lasere cu gaz), fie de transfer de energie prin iradierea centrilor activi cu lumină incoerentă din surse speciale (pompare optică în lasere cu stare solidă), sau injectarea de purtători de neechilibru prin p- n - tranziție, fie excitare printr-un fascicul de electroni, fie pompare optică (lasere cu semiconductor).
În prezent, a fost creat un număr extrem de mare de lasere diferite care produc radiații într-o gamă largă de lungimi de undă (200¸ 2 10 4 nm). Laserele funcționează cu impulsuri de lumină foarte scurte. t » 1·10 -12 s pot da, de asemenea, radiații continue. Densitatea fluxului de energie al radiației laser este de aproximativ 10 10 W/cm 2 (intensitatea Soarelui este de numai 7.10 3 W/cm 2).
Până acum, neutrinul a fost foarte asemănător cu fotonul. La fel ca un foton, un neutrin este neîncărcat, nu are masă și călătorește întotdeauna cu viteza luminii. Ambele particule au spin. Spinul fotonului este +1 sau -1, în timp ce spinul neutrinului este +1/2 sau -1/2 (diferența nu este foarte semnificativă). Cu toate acestea, există o diferență interesantă și chiar surprinzătoare între ele, pe care următorul raționament ne va ajuta să o înțelegem.
Să urmărim două evenimente inversate în timp. Lasă persoana care ține mingea să o arunce, să zicem, spre sud. Dacă mingea se apropie de persoană, mișcându-se în direcția opusă, persoana ridică mâna și o prinde. În primul caz, succesiunea evenimentelor a fost: 1) persoana ține mingea, 2) persoana aruncă mingea, 3) mingea zboară spre sud. Mișcarea inversă în timp a avut o succesiune diferită de evenimente: 1) mingea zboară spre nord, 2) persoana prinde mingea, 3) persoana ține mingea. Toate acestea amintesc foarte mult de un film, care este mai întâi derulat într-o direcție, apoi în direcția opusă.
Să încercăm să transferăm acest principiu în lumea subatomică Dacă un electron dintr-un atom trece dintr-o stare excitată într-o stare mai puțin excitată, emite un foton de lumină vizibilă, a cărui lungime de undă depinde de diferența de energie dintre cele două stări excitate. a atomului. Același atom poate absorbi sau „prinde” un foton cu exact aceeași lungime de undă, caz în care electronul va trece de la o stare mai puțin excitată la o stare mai excitată. Fiecare tip de atom emite fotoni de anumite lungimi de undă (în funcție de energia stărilor sale excitate) și, în condițiile potrivite, absoarbe fotoni cu exact aceleași lungimi de undă.
Totuși, diferența dintre un eveniment direct și unul inversat în timp nu este doar o schimbare a direcției și a secvenței. Prinderea mingii este mai greu decât aruncarea ei. Aruncând mingea, pui în mișcare un obiect imobil și totul depinde doar de tine. Cu timpul tău, poți mai bine să iei mingea, să ținești cu grijă etc. Când prindeți mingea, trebuie să vă ocupați de un obiect în mișcare și nu aveți timp să căscăți. Pe măsură ce mingea se apropie, aceasta trebuie apucată rapid, deoarece mingea va rămâne la îndemână pentru o fracțiune de secundă. În acea fracțiune de secundă, ar trebui să aveți timp să vă extindeți brațul exact în direcția mingii și să o opriți. Dacă ratați, mingea va zbura pe lângă.
Același lucru se întâmplă cu un atom care emite un foton. Un astfel de atom emite un foton într-un timp care, în medie, este de aproximativ 10 -8 sec.În consecință, atomul, ca să spunem așa, își gestionează propriul timp și emite un foton atunci când îi este convenabil.
Pentru a absorbi același foton, un atom are nevoie de 10 -8 sec, care este o consecinţă firească a reversibilităţii evenimentelor. Dar un atom nu poate absorbi un foton fără mari probleme. Fotonul se mișcă cu viteza luminii și nu rămâne lângă atom pe tot intervalul de timp 10 -8 sec. Pentru o astfel de perioadă de timp, un foton de lumină zboară în medie 300 cm. Unii fotoni pot parcurge o distanță mai mare, alții mai puțin. Este clar de ce, de obicei, este foarte greu pentru atomi să prindă fotoni: până la urmă, dimensiunea unui atom este mult mai mică decât această distanță! (În mod similar, jucătorilor de baschet le este greu să prindă mingi care merg prea repede.) Cu toate acestea, întâmplător, un atom poate prinde și absorbi un foton.
Toate cele de mai sus presupun că fotonul nu are dimensiuni intrinseci; deși este de fapt destul de mare. Un foton tipic de lumină vizibilă are o lungime de undă de aproximativ 1/20.000 cm. La această lungime, aproximativ o mie de atomi încap pe rând. Un foton de lumină vizibilă poate fi gândit ca un fel de sferă, al cărei diametru este de o mie de ori mai mare decât diametrul unui atom, iar volumul este de 1.000.000.000 de ori volumul unui atom. În orice moment, un foton de lumină intră în contact cu aproximativ un miliard de atomi, dintre care unul reușește să-l prindă și să-l absoarbă.
Prin urmare, adâncimea la care un foton pătrunde în materie înainte de absorbție nu este de 300 cm,și de un miliard de ori mai puțin, adică 3 10 -7 cm.
La această distanță, nu se potrivesc mai mult de 10-15 atomi la rând. Aceasta înseamnă că un foton de lumină înainte de momentul absorbției pătrunde în substanță nu mai adânc de 10-15 straturi atomice. O grosime de 10-15 atomi este un simplu fleac la solzi obișnuiți, astfel încât majoritatea solidelor, chiar și sub formă de pelicule subțiri, sunt opace la lumină (deși folia de aur poate fi făcută atât de subțire încât devine transparentă).
Cu cât lungimea de undă a luminii este mai mică, cu atât fotonul este mai mic, cu atât mai puțini atomi sunt în contact cu acesta la un moment dat și, prin urmare, cu atât călătorește mai mult prin materie înainte de a fi absorbit. Din acest motiv, lumina ultravioletă pătrunde în pielea umană mai adânc decât lumina vizibilă; razele X trec liber prin țesuturile moi ale corpului și sunt oprite doar de substanța osoasă mai densă; razele a? pătrund în materia densă de mulți centimetri. (Desigur, lumina vizibilă parcurge o distanță considerabilă în substanțe precum sticla sau cuarțul, ca să nu mai vorbim de majoritatea lichidelor, dar toate acestea sunt considerații separate.)
Absorbția neutrinilor
Să încercăm acum să folosim toate cele de mai sus în legătură cu neutrini și antineutrini. Să scriem încă o dată reacția de dezintegrare a neutronilor, care are ca rezultat formarea unui proton, a unui electron și a unui antineutrino:
P> p++ e -+ "?.
Să presupunem că, în condiții adecvate, este posibil procesul invers, în care un proton, captând un electron și un antineutrin, devine neutron. Atunci feedback-ul ar arăta astfel:
p++ e -+ "? > P.
Desigur, protonul trebuie să prindă electronul și antineutrinul în același timp, ceea ce reduce foarte mult probabilitatea finalizarea cu succes proces. (Acest lucru este echivalent cu a cere unui jucător de baschet să prindă două mingi în același timp cu o mână, zburând spre el din direcții diferite.)
Pentru a simplifica sarcina, schimbăm ordinea invocării. Orice proces care absoarbe un electron poate fi înlocuit cu un proces care produce un pozitron. (O regulă similară există în algebră: scăderea -1 este aceeași cu adăugarea +1.) Cu alte cuvinte, în loc să absoarbă simultan un electron și un antineutrin, un proton poate absorbi un antineutrin și emite un pozitron:
p++ "? > n + „e+.
Cu această variantă a reacției sunt îndeplinite legile de conservare. Deoarece protonul este înlocuit cu un neutron (ambele cu număr de barion +1) și antineutrinul este înlocuit cu un pozitron (ambele cu număr de lepton -1), legile conservării barionului și a numărului de leptoni sunt valabile.
Rămâne de luat în considerare probabilitatea de absorbție a unui antineutrin de către un proton. Timpul de înjumătățire al neutronilor este de 12,8 min, deși neutronii individuali necesită mai mult sau mai puțin de 12,8 pentru a se descompune min.În consecință, pentru formarea unui neutron atunci când un antineutrin este captat de un proton și este emis un pozitron, o medie de 12,8 min. Cu alte cuvinte, un antineutrin este absorbit de un proton în medie de 12,8 min.
Dar neutrinii călătoresc cu viteza luminii și în 12.8 min parcurge o distanta de 2,3 10 8 km(adică o cale aproximativ egală cu distanța de la Soare la Marte). Este greu de crezut că un antineutrin poate parcurge o distanță atât de mare în materie solidă înainte de a fi absorbit, chiar dacă presupunem că volumul său este egal cu cel al unui foton. Dar, de fapt, antineutrinii sunt mult mai mici decât un atom.
În realitate, situația este mult mai complicată.În cazul fotonilor, absorbția are loc datorită electronilor, care ocupă o mare parte din volumul atomului, iar într-o materie solidă, atomii sunt strâns adiacenți între ei. Antineutrinii sunt absorbiți de protonii aflați în nucleele atomice, care ocupă o parte nesemnificativă a atomului. Antineutrini care zboară prin solid, se ciocnește foarte rar cu un nucleu minuscul. Pentru doar o sută de milioane din timpul când antineutrinul se află în interiorul atomului, este atât de aproape de proton încât acesta din urmă îl poate capta. Prin urmare, pentru ca un antineutrin să aibă o anumită șansă de a fi prins de un proton, trebuie să parcurgă o cale în materie solidă de o sută de milioane de ori mai lungă decât 230.000.000. km. S-a descoperit că, în medie, un antineutrino trebuie să călătorească aproximativ 3.500 de ani lumină în plumb înainte de a fi absorbit.
Desigur, nicăieri în univers nu există un strat de plumb gros de 3.500 de ani lumină. Universul este format din stele individuale, extrem de slab distribuite în spațiu, iar diametrul oricărei stele este mult mai mic de o milioneme. an lumină. Majoritatea stelelor sunt făcute din materie mult mai puțin densă decât plumbul. Excepția este materia superdensă a unui nucleu stelar relativ mic. (Există și stele superdense în Univers, dar sunt foarte mici - nu mai multe planete.) Dar chiar și părțile superdense ale stelelor nu pot opri antineutrinii. Zburând prin Univers în orice direcție, antineutrinii trec foarte rar printr-o stea și chiar mai rar prin miezul ei superdens. Grosimea totală a materiei stelare prin care trece antineutrino, zburând de la un capăt la altul al universului vizibil, este mult mai mică de un an lumină.
Tot ceea ce s-a spus aici despre antineutrini se aplică, desigur, neutrinilor și, prin urmare, se poate argumenta că neutrinii și antineutrinii practic nu sunt absorbiți. Odată ce au apărut într-un proces subatomic, ele se mișcă pentru totdeauna și nu sunt supuse niciunei modificări și influențe din tot ceea ce le înconjoară. Din când în când, aceștia sunt absorbiți, dar numărul de neutrini absorbiți este neglijabil în comparație cu numărul imens al celor deja existenți și al celor care au apărut recent. Cunoștințele moderne ne permit să spunem cu încredere că practic toți neutrinii și antineutrinii care au apărut în timpul vieții Universului există până astăzi.
Cum au prins antineutrino?
Concluzia de mai sus nu a fost o veste foarte bună. Indiferent cât de mult ar deduce un fizician necesitatea existenței neutrinilor și a antineutrinilor din legile de conservare, el ar fi cu adevărat fericit doar atunci când ar descoperi cu adevărat particule minuscule prin observație directă. Dar pentru a demonstra existența lor, el trebuie mai întâi să capteze cel puțin o particulă, adică să o facă să interacționeze cu o altă particulă, astfel încât rezultatul acestei interacțiuni să poată fi detectat. Și din moment ce era de fapt imposibil să prindeți neutrini sau antineutrini, a existat o îndoială serioasă cu privire la realitatea existenței lor!
Drept urmare, fizicianul și-a salvat înțelegerea structurii universului, care se dezvoltase de-a lungul a trei secole, insistând asupra existenței a ceva ce trebuia să fie considerat de la sine înțeles. El a dovedit existența neutrinilor pe baza teoriilor sale și și-a salvat teoriile afirmând existența neutrinilor. S-a dovedit " cerc vicios". Au rămas motive de îndoială și incertitudine. A fost extrem de important să se dezvolte o metodă de detectare a neutrinilor sau a antineutrinilor, dacă este posibil.
O breșă în armura aproape impenetrabilă a neutrinului evaziv fusese străpunsă cu cuvântul „mediu”. Am spus că înainte de a fi absorbit, un antineutrino trece, în medie, printr-un strat de plumb solid de 3.500 de ani lumină grosime. Dar doar asta in medie. Unii antineutrini pot lua o cale mai scurtă, alții una mai lungă și doar câțiva vor merge la absorbție fie foarte mică, fie foarte distanta lunga. Prin urmare, este necesar să ne concentrăm asupra fracției infinitezimale de antineutrini care sunt absorbite într-o astfel de grosime a materiei (să zicem, câțiva metri) încât să fie ușor de creat în laborator. Pentru ca acest procent infinitezimal să conțină cât mai mulți antineutrini, este necesar să existe o sursă foarte puternică a acestor particule. O sursă atât de puternică de antineutrini este reactor nuclear. Excesul de neutroni produși în reactor se descompun mai devreme sau mai târziu în protoni, electroni și antineutrini. Când reactorul funcționează la capacitate maximă, se produc în mod continuu un număr mare de antineutrini. În 1953 grupul fizicienilor americani, condus de Clyde Cowan și Frederick Reines, a început experimente privind înregistrarea antineutrinolor. Au folosit un reactor nuclear din Savannah River, Carolina de Sud, ca sursă de particule. Acest reactor a emis aproximativ 10 18 antineutrini în fiecare secundă.
Orez. 7. Detectarea antineutrino.
Pentru o astfel de multitudine de antineutrini, a fost necesar să se creeze o țintă bogată în protoni. Cea mai simplă țintă naturală este apa. Fiecare moleculă de apă este formată din doi atomi de hidrogen, ale căror nuclee sunt protoni, și un atom de oxigen. Cowan și Reines au folosit cinci rezervoare de apă 1.9 m iar latimea 1,4 m. Grosimea rezervoarelor a fost diferită (Fig. 7). Două rezervoare subțiri de 7,6 înălțime cm au fost folosite ca țintă. Alte trei rezervoare înălțime 60 cm a servit drept detector. Tancurile au fost amplasate în următoarea ordine: detector - țintă - detector - țintă - detector. Apa din rezervoarele țintă conținea o cantitate mică de clorură de cadmiu dizolvată. Rezervoarele detectorului conțineau o soluție de scintilator, o substanță care emite o parte din energia primită atunci când absoarbe o particulă subatomică sub forma unei explozii scurte de lumină. Un astfel de „sandviș dublu” de rezervoare a fost amplasat pe calea fluxului antineutrino din reactor. Tot ce a rămas a fost să aștepte. Dacă antineutrini există cu adevărat, la fiecare douăzeci de minute (în medie) unul dintre ei ar trebui să fie absorbit de un proton. Dar tancurile au fost supuse la radiații cosmice continue din spațiul interplanetar, bombardate de particule emise de cantități mici de substanțe radioactive în aer, materiale de construcții, sol. Toată dificultatea a fost să evidențiem absorbția antineutrinilor pe tot acest fundal de evenimente care au avut loc în interiorul rezervoarelor de apă.
La început, „zgomotul” subatomic nedorit a împiedicat detectarea absorbției antineutrino. Treptat, a fost creată o ecranare din ce în ce mai eficientă pentru a scăpa de radiațiile și particulele nedorite. Desigur, nicio ecranare, nicio grosime de metal sau beton nu putea opri antineutrinii, iar în cele din urmă „zgomotul” a scăzut la un nivel care nu mai era ascuns de „șoapta” slabă a antineutrinilor foarte rari capturați accidental de protoni. Dar această șoaptă nu a fost încă identificată.
Când un antineutrin este absorbit de un proton, se formează un neutron și un pozitron - o combinație de particule care este ușor de distins. De îndată ce se formează un pozitron într-unul dintre rezervoarele țintă, acesta interacționează cu un electron în mai puțin de o milioneme dintr-o secundă și sunt produși doi fotoni, fiecare având o energie de 0,51. MeV. Conform legii conservării impulsului, doi fotoni trebuie să se împrăștie în direcții exact opuse: dacă unul dintre ei din rezervorul țintă intră în rezervorul superior al detectorului, atunci celălalt trebuie să cadă în rezervorul detector inferior. În fiecare rezervor de detectare apare un fulger de lumină. Aceste blițuri sunt imediat înregistrate automat de o sută sau mai multe fotomultiplicatoare situate în jurul rezervoarelor de apă.
Dar ce se întâmplă cu neutronul? De obicei, rătăcește printre moleculele de apă (care absorb foarte rar un neutron), ciocnindu-se cu ele până când se descompune spontan după o medie de 12,8 min după apariţia ei. Cu toate acestea, nu are rost să așteptați atât de mult, deoarece dezintegrarea poate apărea cu câteva minute mai devreme sau mai târziu. Aici vine în ajutor clorura de cadmiu din rezervorul țintă. Neutronul rătăcește până când se ciocnește cu un atom de cadmiu, moment în care este absorbit aproape instantaneu. Acest lucru se întâmplă în câteva milioane de secundă după anihilarea pozitronului - perioada este destul de scurtă și totuși suficientă pentru a separa în timp două evenimente: anihilarea pozitronului și absorbția neutronului. Când un neutron este absorbit de un atom de cadmiu, se eliberează energie, care este imediat emisă sub formă de trei sau patru fotoni cu o energie totală de 9. Mev.
Deci, Cowen și Reines au observat următoarea imagine: mai întâi, doi fotoni cu o energie de 0,5 mev fiecare, care au fost înregistrate de doi fotomultiplicatori pe laturile opuse ale rezervoarelor de apă, apoi după câteva milionimi de secundă, producerea simultană a trei fotoni cu o energie de 3 mev fiecare (uneori patru fotoni cu o energie de 2,25 mev fiecare). Nicio altă interacțiune subatomică nu a condus la o astfel de succesiune de evenimente. Și dacă tocmai un astfel de curs de evenimente a fost înregistrat, era rezonabil să concluzionăm că protonul absoarbe antineutrino, prin urmare, antineutrinul există cu adevărat.
Dar apoi un alt gând a apărut în mințile precaute ale experimentatorilor. Dar dacă o astfel de secvență de evenimente este cauzată nu de o interacțiune subatomică, ci de două?
Să presupunem că s-a creat cumva un pozitron și, după câteva milionatimi de secundă, un atom de cadmiu a absorbit un neutron care exista independent de pozitron. În acest caz, apariția a doi și apoi a trei fotoni ar fi rezultatul nu al unei interacțiuni (antineutrino cu un proton), ci a două interacțiuni complet nelegate. Ce fel de interacțiune au observat Cowan și Reines?
Experimentatorii au rezolvat problema făcând măsurătorile mai întâi cu reactorul în funcțiune și apoi cu acesta oprit. Dacă reactorul este oprit, zgomotul va acționa asupra rezervoarelor, iar bombardarea acestora cu un flux de antineutrini se va opri. (De fapt, există întotdeauna antineutrini în spațiul înconjurător, dar numărul lor este mult mai mic decât numărul de antineutrini din apropierea reactorului în funcțiune.) Prin urmare, atunci când reactorul a fost oprit, vor continua să fie înregistrate coincidențe duble, iar absorbția de antineutrinii s-ar opri.
S-a dovedit că, cu reactorul oprit, au fost înregistrate 70 de evenimente pe zi mai puțin decât cu reactorul pornit. Aceasta înseamnă că 70 de antineutrini au fost absorbiți și înregistrati pe zi (unul la douăzeci de minute). Rezultatele experimentului ar putea fi considerate dovezi incontestabile, iar în 1956 s-a raportat că, la douăzeci și cinci de ani după ce Pauli a prezis pentru prima dată existența antineutrinilor, o astfel de particulă a fost în sfârșit înregistrată. Acest eveniment este de obicei denumit „detecție neutrino”, deși a fost detectat un antineutrin. Cu toate acestea, după ce au „prins” antineutrinul, fizicienii cred că existența neutrinilor este dincolo de orice îndoială.
Spectrele atomilor multielectroni
A . Legea conservării energiei. Exprimată prin regula frecvenței Bora. (7.1)
Energia fotonului emis (absorbit) este egală cu diferența dintre energiile atomului emitent (absorbant).
b . Legea conservării impulsului . Se manifestă în că un atom liber în radiație(absorbţie)revine. Dacă luăm impulsul unui atom cu masă m aînainte de emisia unui foton dincolo de zero, apoi în proiecția pe direcția de emisie a unui foton obținem egalitatea:
![]() . (7.2)
. (7.2)
Semnul minus indică faptul că atomul „saltă” în direcție direcție inversă mișcarea fotonului. Când un foton este absorbit, direcția vitezei de recul coincide cu direcția de mișcare a fotonului ![]() . (7.3)
. (7.3)
Rata de recul a atomilor în timpul emisiei de lumină în domeniile IR, vizibil și UV este scăzută. De exemplu, un atom de hidrogen care emite un foton în serie violet Balmer Cu l= 410 nm, primește viteza de recul v x = hçm a l = 6,6 10 -34 ç (0,001 ç 6 10 23) 410 10 -9 = 1m ç Cu. Aceasta este de 1000 de ori mai mică decât viteza mișcării termice a atomilor.
Datorită reculului, o parte din energia radiației este transportată de atom. Prin urmare, ținând cont de recul, legea conservării energiei ia forma: ![]() . (7.4)
. (7.4)
Energia de recul a atomilor este foarte mică. Pentru atomul de hidrogen din exemplul de mai sus, acesta nu depășește 10 -8 din energia fotonului. Datorită reculului atomilor, energia și frecvența fotonilor emiși scad. În domeniile IR, vizibil și UV, efectele legate de recul sunt de obicei neglijate din cauza micii lor. Și numai în intervalele de raze X și gamma, aceste efecte devin semnificative.
în . Legea conservării momentului unghiular . După cum arată experiența, fotonii, ca și electronii, au un moment mecanic de spin L S, care este de două ori impulsul mecanic de spin al electronului. În proiecție pe direcția mișcării, momentul unghiular de rotație al unui foton poate lua două valori, ħ. (7.5)
Prin emiterea sau absorbția unui foton, un atom nu numai că dă sau primește energie, dar își schimbă și momentul unghiular cu o valoare egală cu impulsul fotonului. Această schimbare poate apărea atât din cauza unei modificări a configurației norului de electroni (modificări ale impulsului orbital al electronului), cât și din cauza unei modificări a orientării spinului electronului.
In primul caz vorbim despre modificarea momentului mecanic orbital electron prin valoare ħ , care corespunde unei modificări a azimutului număr cuantic l pe unitate. Din aceasta obținem regula de selecție (5.12), care astfel exprimă legea conservării momentului unghiular.
A doua cale - reorientarea spinului electronului de asemenea ca dimensiune ħ . Această cale este foarte puțin probabilă. Prin urmare, tranzițiile care încalcă regula de selecție D l = ± 1 în sursele de lumină terestre practic nu sunt implementate. De exemplu, tranzițiile unui atom de hidrogen excitat de la 2 s- în 1 s- starea poate apărea numai în coroana solară foarte rarefiată sau în atmosferele stelelor. Atomii excitați de aici nu se confruntă cu coliziuni pentru o lungă perioadă de timp. Prin urmare, chiar și astfel de tranziții improbabile sunt realizate în ele.
2. Spectrele metalelor alcaline mai mult decât alte elemente sunt similare cu spectrul hidrogenului. Atomii de metale alcaline sunt un miez simetric central cu o înveliș de gaz inert și o sarcină totală de + eîn jurul căruia se mișcă un electron.
Metalele alcaline formează subgrupul principal al primului grup al tabelului Mendeleev. Toate perioadele încep cu ele. Dintre elementele stabile, acesta este litiu Li, Z= 3 (nucleul este un nucleu cu o înveliș de heliu, electronul superior dintr-un atom neexcitat este 2 s- stare), Na de sodiu, Z= 11 (miezul este un miez cu o înveliș de neon, un electron în 3 s- stare), potasiu K , Z= 19 (nucleul este un nucleu cu o înveliș de argon, un electron în 4 s- stare), rubidiu Rb, Z= 37 (miezul este un miez cu o înveliș de cripton, un electron în 5 s- stare), cesiu Cs, Z= 55 (miezul este un miez cu o înveliș de xenon, un electron în 6 s- condiție).
Există mai multe serii în spectrele metalelor alcaline. Cele mai importante dintre ele sunt 4: principal, ascuțit, difuz și principal.În 1900 Johannes Rydberg găsite forma generala Formula de serie pentru metale alcaline. 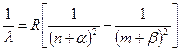 . (7.6)
. (7.6)
Aici n £ m- numărul de niveluri de energie, Ași b- corecții care au semnificații diferite pentru diferite metale și pentru diferite serii.
Luați în considerare, ca exemplu, spectrul sodiului. Figura 44 prezintă nivelurile de energie din atomul de sodiu și schemele tranzițiilor electronice care formează seria spectrală.
 A . Seria principală
. Numit așa pentru că există nu numai în spectrele de emisie, ci și în spectrele de absorbție. Corespunde seriei Lymanîn spectrul hidrogenului. Pentru sodiu, este descris prin formula ( m= 3,4,5,…¥):
A . Seria principală
. Numit așa pentru că există nu numai în spectrele de emisie, ci și în spectrele de absorbție. Corespunde seriei Lymanîn spectrul hidrogenului. Pentru sodiu, este descris prin formula ( m= 3,4,5,…¥):
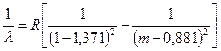 . (7.7)
. (7.7)
În spectrul de emisie, seria principală apare atunci când un electron trece din p– afirmă la principalul 3 s- condiție. Linia de cap a acestei serii (adică linia cu lungimea de undă maximă l, corespunzătoare valorii minime a numărului m= 3) - galben strălucitor caracteristic D- linia de sodiu cu l=589 nm. Aceasta este singura linie a acestei serii din gama vizibilă. Se formează când un electron trece de la 3 p la 3 s- stare într-un singur strat energetic.
Următoarea linie din această serie este emisă la tranziția 4 p 3s. Lungimea ei de undă l=330nm este în domeniul UV. Lungimea de undă de tăiere a seriei principale (linia la m = ¥) = 241 nm.
Datorită interacțiunii spin-orbita p– subnivelul este împărțit energetic în două. Prin urmare, liniile spectrale ale seriei principale sunt dublete. De exemplu, linia principală a seriei principale de dublet galben de sodiu constă din două linii cu l 1 = 589,6 nm și l 2 = 589,0 nm.
Nu numai p- subnivel, dar si altele superioare d, f– subnivelurile sunt împărțite energetic în două. Prin urmare, diviziunea multiplet în spectrele metalelor alcaline este prezentă și în alte serii.
Studiul spectrelor atomilor multielectroni a arătat că constanta Rydberg R crește oarecum odată cu creșterea numărului de elemente. Deci, pentru hidrogen RH\u003d 1,09678 10 7 m -1, pentru sodiu R Na\u003d 1,09735 10 7 m -1 și pentru cei mai grei atomi R Z > 20 \u003d 1,09737 10 7 m -1. Creştere R apare în principal la începutul tabelului periodic și deja cu clor Cl ( Z= 17) creștere R practic invizibil.
b . ascuțit
(ascuțit) serie
apare numai în spectrul radiațiilor sodiu în timpul tranziției unui electron de la s- state in p- stare (Fig. 44). Formula de serie ascuțită pentru sodiu este: 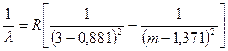 , m=4, 5, 6,… (7.8)
, m=4, 5, 6,… (7.8)
Datorită împărțirii în două componente p– liniile de subnivel ale unei serii ascuțite reprezintă și dublete. Cap dublu de serie ( m= 4) se află în regiunea IR, l 1 = 1140 nm și l 2 = 1138 nm (tranziția 4 s 3p). Dubletul de tranziție 5 s 3p 616 și 615 nm se încadrează în raza vizibila. Tranziția 6 s 3p corespunde liniei de 515 nm (diviziunea D l mai mică de 1 nm). Limitarea lungimii de undă a unei serii ascuțite = 408 nm. Prin urmare, cu excepția liniei de conducere, întreaga serie ascuțită se află în domeniul vizibil.
După cum sugerează și numele, liniile seriei ascuțite sunt în contrast. Acest lucru se explică prin faptul că în timpul emisiei acestei serii, electronii trec din s- state care nu au divizare de energie. Deoarece electronii lovesc două componente p– subnivel, atunci energia fotonilor emiși în dublete dintr-o serie ascuțită are aceeași diferență h D n pentru întreaga serie. Diferența de frecvență D nîntre componentele dubletului este constantă. Exprimată în lungimi de undă, diferența D l scade rapid la deplasarea spre capătul violet al seriei.
în . difuz (difuz) serie există numai în spectrul de emisie și apare în timpul tranzițiilor unui electron la un dublu 3 p- subnivel tot de la suprapus dublu d- subniveluri (Fig. 44). Regulile de selecție permit implementarea doar a trei dintre cele patru opțiuni de tranziție. Prin urmare, fiecare linie din serie este triplet. Distanțele energetice dintre componente d– sunt mult mai puține subniveluri comparativ cu distanța 3 p– subnivel. Din această cauză, în dispozitivele spectrale cu putere de rezoluție insuficientă, componentele tripletului nu sunt rezolvate, iar întregul triplet este perceput ca o linie neclară (difuză). Formula de serie difuză pentru sodiu este:
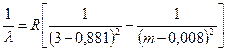 , m= 3, 4, 5,… (7.9)
, m= 3, 4, 5,… (7.9)
Linia principală a acestei serii ( m= 3) are lungime l= 818 nm și se află în domeniul IR apropiat. Este emis în timpul tranzițiilor electronice 3 d 3pîn cadrul aceluiaşi strat energetic. Pe măsură ce numărul crește m liniile sunt emise în domeniul vizibil, l(m= 4) = 586 nm, l(m= 5) = 498 nm. Lungimea de undă limită, ca în seria ascuțită, l(m= ¥) = 408 nm. Cu excepția liniilor principale, ambele serii - ascuțite și difuze - sunt în intervalul vizibil.
G . Principal (Fundamental), fundamental seria este numită astfel deoarece formula sa are diferențe minime față de formulă Balmer. Pentru sodiu
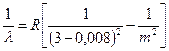 ,m= 4,5,6,… (7.10)
,m= 4,5,6,… (7.10)
Apare atunci când un electron se mișcă de la f– afirmă în 3 d- condiție. Toate liniile acestei serii sunt în gama IR. Linia capului (4 f 3d) are o lungime l= 1846 nm, următorul (5 f 3d) l= 1268 nm, linie de delimitare ( m= ¥) l= 813 nm. Seria principală din spectrul de sodiu este foarte asemănătoare cu seria Pashenîn spectrul hidrogenului (1875 - 820 nm).
Factori de corecție Ași bîn formulele seriei (7.6) scad pe măsură ce energia nivelurilor crește. Da, nivelul 3 s are amendamentul 1.371, nivelul 3 p– amendamentul 0.881, nivelul 3 d- corectie 0,008. Din aceasta putem concluziona că cu cât nivelul de energie din atom este mai scăzut metal alcalin, cu cât este mai aproape de învelișul unui gaz inert, cu atât câmpul electric al nucleului este mai deformat, cu atât acesta diferă mai mult de câmpul Coulomb al atomului de hidrogen. Seria fundamentală este așadar atât de asemănătoare cu seria Pashenîn spectrul atomului de hidrogen care nivelurile dși f situat departe de miezul atomului de metal alcalin.
3. Lățimea naturală a liniilor spectrale. Emisia unui foton în condiții normale are loc atunci când spontan tranziția (spontană) a unui atom de la o stare excitată, adică superioară energetic, la o stare energetic inferioară. Timp t, peste care numărul de atomi într-o stare excitată dată scade în e ori, se numește durata de viață stare de excitat. În cele mai multe cazuri t»10 -8 10 -9 s. Și numai în metastabil stări (anormal de longevive) timpul t poate 10 -1 s.
Posibilitatea tranzițiilor spontane indică faptul că stările excitate nu pot fi considerate strict staționare. Energia stării excitate nu este definită cu precizie. Din relația de incertitudine Heisenberg pentru energie și timp (3.3) rezultă că incertitudinea energetică D E atomul în stare excitată este invers proporțional cu timpul t : ħ, . (7.11)
Incertitudinea în energia unui atom excitat duce la o răspândire a energiilor fotonilor emiși de acesta. . (7,12)
Să trecem de la intervalul de frecvență D n la intervalul de lungime de undă D l. pentru că
![]() , apoi . (7,13)
, apoi . (7,13)
Pentru seriale de titlu Balmer (l= 656,3 nm, t= 10 -8 s) această lățime este D l= 2,3 10-5 nm. Dispozitivele spectrale moderne fac posibilă măsurarea acestui lucru latimea naturala linii spectrale.
Dacă trasați dependența intensității luminii de un grafic eu de la lungimea de undă l, apoi se obține o curbă simetrică în formă de clopot. În Fig. 45, o astfel de curbă este prezentată pentru linia roșie a cadmiului Cd cu o lungime de undă l= 643,8 nm. Există foarte puține astfel de linii cu adevărat simple într-o mare varietate de spectre. Chiar și pentru acele linii care sunt considerate simple în schema structurii fine (interacțiunea spin-orbital), multiplicitatea se găsește cu rezoluția crescândă.
4. Structura hiperfină a spectrului. Un astfel de suplimentar structură hiperfină poate apărea din două motive.
In primul rand, datorită compoziţiei izotopice mixte a atomilor emiţători. De exemplu, hidrogenul natural constă dintr-un amestec de doi izotopi - protiași deuteriu- într-un raport de 5000: 1. Liniile spectrale ale deuteriului sunt ușor deplasate către regiunea cu lungimi de undă mai scurte. Într-un amestec obișnuit, liniile de deuteriu sunt invizibile. Dar dacă concentrația de deuteriu în gaz crește, atunci fiecare linie, de exemplu, într-o serie Balmer, se împarte în două. Aceasta este multiplicitatea izotopică.
În al doilea rând, datorită prezenţei de nucleul atomic momente mecanice și magnetice. Momentul magnetic al nucleelor este de aproximativ 1000 de ori mai mic decât momentul magnetic orbital al electronilor. Dar, cu toate acestea, interacțiunea momentelor spin-orbitale ale electronilor cu momentul magnetic al nucleului duce la multiplicitate, care este înregistrată de dispozitive spectrale de înaltă rezoluție. De exemplu, linia verde a mercurului Hg cu o lungime de undă l= 546,0724 nm, pe lângă linia principală, are o structură hiperfină de șase linii, -0,0236, -0,0102, -0,0069, l= 546,0724 nm, +0,0085, +0,0128, +0,0214 nm.
5. Lărgirea Doppler a liniilor spectrale. Mișcarea de translație a atomilor radianți, datorită mișcării lor termice, duce la o lărgire suplimentară a liniilor spectrale.
Frecvența luminii emise de un atom care se apropie de receptor datorită efectului Doppler ceva mai mare și egală n 0+D n. Frecvența luminii de la un atom în retragere este puțin mai mică și egală cu n 0-D n. Aici n 0 este frecvența luminii emise de un atom imobil. Ca urmare, aceeași linie spectrală datorită mișcare înainte atomii este lărgit la banda de frecvență ( n 0+D n) – (n 0-D n) = 2D n.
Din formula optică pentru efectul longitudinal Doppler(Optică, f. 28.10) rezultă că
![]() , Unde . (7,14)
, Unde . (7,14)
Prin urmare, . (7,15)
Lărgirea Doppler relativă. (7,16)
La temperatura camerei, viteza de mișcare termică a atomilor de hidrogen v= 2 10 3 m ç Cu. De aici.
Lărgirea Doppler apare deja în semnul 5-6 al frecvenței n sau lungimea de undă l. Dispozitivele spectrale moderne fac posibilă măsurarea n sau l până la 7-8 caractere. Prin urmare, lărgirea termică a liniilor spectrale este un efect bine marcat și adesea nedorit. Pentru a o elimina, este necesar să se aplice astfel de metode de excitare a atomilor care pot fi realizate la temperaturi scăzute. De exemplu, luminescență(vezi §10).
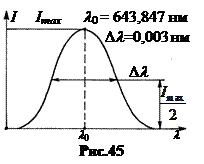
 6. Spectre moleculare. Combinația de atomi într-o moleculă duce la faptul că, împreună cu energia mișcării electronice în atomi, molecula, ca un sistem complex, are energie mișcări oscilatorii și de rotație(Fig. 46). În ordinea mărimii, treptele de energie cuantică sunt cel mai adesea aranjate după cum urmează: D E e-mail >D E numără >D E temp. Aici D E– trepte ale nivelurilor de energie electronică dintr-un atom.
6. Spectre moleculare. Combinația de atomi într-o moleculă duce la faptul că, împreună cu energia mișcării electronice în atomi, molecula, ca un sistem complex, are energie mișcări oscilatorii și de rotație(Fig. 46). În ordinea mărimii, treptele de energie cuantică sunt cel mai adesea aranjate după cum urmează: D E e-mail >D E numără >D E temp. Aici D E– trepte ale nivelurilor de energie electronică dintr-un atom.
Cel mai semnificativ efect asupra spectrului emis de moleculă este exercitat de mișcare oscilatorie. Deoarece energia mișcării vibraționale intramoleculare este cuantificată, în orice volum de gaz există grupuri de molecule cu aceleași valori ale energiei vibraționale D E col 1, D E col 2, D E col 3 etc. Ca rezultat al aceleiași tranziții electronice în atom grupuri diferite moleculele corespund fotonilor cu frecvenţe diferite n 1 , n 2 , n 3 ,… deoarece în timpul emisiei unui foton, la energia de tranziție electronică se poate adăuga energia de vibrație a moleculei.
Dacă o substanță în stare atomică, de exemplu, hidrogenul H, emite o linie cu o frecvență n, atunci această linie emisă de o substanță în stare moleculară (H 2) este împărțită într-un sistem de linii în funcție de numărul de trepte energetice ale vibrației moleculare.
Despicarea liniilor, pe lângă cea vibrațională, se datorează și mișcare de rotație molecule. Ca urmare, spectrele de emisie ale moleculelor conțin grupuri cu un numar mare linii - dungişi de aceea se numesc dungi (Fig. 47).
9.1. Operator de interacțiune cu sistem sarcini electrice cu câmp electromagnetic
În electrodinamica clasică, energia de interacțiune a sarcinilor cu un câmp electromagnetic poate fi exprimată ca produs scalar al a patru vectori de densitate de curent și potențial (9.1) și, ținând cont de gabaritul Lorentz ales, în termeni de produs scalar al vectori tridimensionali de densitate de curent si potential vectorial. Prin analogie cu expresia clasică, introducem operator de interacţiune cu un câmp extern, care se exprimă evident în termenii operatorilor de creare și anihilare (9.2). Operatorul de interacțiune este împărțit într-o sumă infinită de operatori independenți unul de celălalt, corespunzătoare interacțiunii cu fiecare mod de radiație. Pentru fiecare mod, există o sumă a doi operatori corespunzători creării și anihilării unui foton. Produsele stărilor subsistemelor care nu interacționează (9.3) sunt alese ca stări ale aproximării zero. Pe aceste stări, elementele matriceale ale creării și anihilării unui foton în fiecare dintre moduri au forma (9.4). Pentru a obține formule pentru probabilitatea unei tranziții cu emisie sau absorbție, ar trebui să folosiți metoda standard a teoriei perturbațiilor.
|
Expresie clasică pentru energia unui sistem de sarcini într-un câmp electromagnetic extern (gabaritul Lorentz) |
||
|
Operator de perturbare care descrie interacțiunea unui câmp electromagnetic extern cu un sistem de sarcini |
||
|
|
Funcția de undă a sistemului fără interacțiune |
|
|
|
Elemente de matrice diferite de zero ale operatorilor de creare și anihilare în fiecare mod. |
9.2. Teoria perturbației (de ordinul întâi)
Starea sistemului în prezența interacțiunii între sarcini de către câmp poate fi extinsă în termeni de stări staționare (9.3) ale aproximării zero (9.5). sistemul era în starea |n> și nu a existat nicio interacțiune între subsistemele sale (9.6). Înlocuirea expansiunii (9.5) în ecuația Schrödinger nestaționară duce cu ușurință la sistemul ecuatii diferentiale pentru coeficienții de expansiune dependenți de timp (9.7), a căror soluție cu condițiile inițiale (9.6) nu este dificilă în cazul unei perturbații slabe, ceea ce determină micimea tuturor coeficienților dependenți de timp, cu excepția amplitudinii lui fiind în starea iniţială (9.8). Conform reguli generale mecanica cuantică, probabilitatea de tranzițieîntr-o stare q dat de pătratul modulului amplitudineși se dovedește a fi proporțional cu timpul (9.9), ceea ce ne permite să introducem probabilitatea de tranziție pe unitatea de timp (9.10). În cazul unei stări finale cu spectru continuu, se introduce probabilitatea trecerii la un interval infinit mic. dm (9.11).
|
Extinderea stărilor unui sistem cu interacțiune în termeni de stări staționare ale aproximării 0. |
||
|
Starea inițială a sistemului. |
||
|
Sistem de ecuații pentru amplitudini dependente de timp ale tranzițiilor cu emisie și absorbție. |
||
|
|
Soluția aproximativă a sistemului (9.7) |
|
|
|
q până când t. |
|
|
Probabilitatea de tranziție a stării q pe unitatea de timp. |
||
|
Probabilitatea tranziției pe unitatea de timp la o stare cu spectru continuu. |
9.3. Probabilități de tranziții cu emisie și absorbție de lumină
În cazul tranzițiilor între stările atomilor cu emisie de lumină, starea finală aparține spectrului continuu, care corespunde unui număr infinit de direcții și frecvențe ale fotonului emis (9.12). Luând în considerare expresia obținută, probabilitatea unei tranziții cu emisia unui foton la un mod ales se dovedește a fi proporțională cu numărul de fotoni prezenți deja în acest mod (9.13) crescut cu 1. Cei doi termeni care au apărut în acest fel (proporțional cu numărul de fotoni disponibili și independent de numărul de fotoni) sunt de obicei interpretați ca probabilități forţatși emisie spontană(9.14) Probabilitatea unei tranziții cu absorbție are o formă similară cu (9.13), dar nu conține un termen care să descrie procesul spontan (9.15).
Expresiile care relaționează probabilitățile de emisie și absorbție a fotonilor sunt atât de importante pentru numeroase aplicații încât pare oportun să le scriem ca dependențe de cantități mai tradiționale pentru fizica experimentală. În loc de numărul de umplere (numărul de fotoni), este mai convenabil să folosiți conceptul densitatea spectrală a intensității radiațieiîntr-un mod dat, care este un flux de energie de radiație electromagnetică de o polarizare dată, care se încadrează pe un interval de frecvență infinitezimal dat și se propagă într-un unghi solid infinit de mic (9.16). Este evident că valoarea de intrare ar trebui să fie proporțională cu produsul dintre energia unui foton și numărul și viteza lor de mișcare în spațiu. La numărarea numărului de fotoni, concentrația lor în modul corespunzător direcției spațiale alese trebuie înmulțită cu densitatea corespunzătoare a numărului de stări. Spre deosebire de expresia expresiei date anterior (7.12), ea nu ia în considerare toate stările unei energii date, ci doar cele care corespund propagării luminii unei polarizări date într-o direcție dată.
Înlocuirea numărului de fotoni cu densitatea spectrală a intensității radiației face posibilă obținerea unei expresii convenabile pentru aplicații pentru relația dintre probabilitățile de emisie și absorbția luminii (9.17).
|
|
Numărul de stări corespunzător emisiei unui foton în b.m. intervalul de frecvență și b.m. unghi solid. |
|
|
|
Probabilitatea tranziției între stările |n> și |q> cu emisie de lumină într-un mod dat. |
|
|
|
Probabilități de emisie spontană și indusă |
|
|
|
Probabilitatea de a absorbi lumina dintr-un mod dat. |
|
|
|
Relația dintre densitatea spectrală a intensității radiației într-un unghi solid elementar și numărul de fotoni în modul corespunzător. |
|
|
|
Relația dintre probabilitățile de emisie și absorbție a luminii stimulate și spontane. |
9.3. Coeficienții Einstein
În cazul radiațiilor izotrope, o caracteristică mai rezonabilă este densitatea spectrală densitatea energiei volumetrice a radiației(9.18), care se obține din densitatea spectrală a intensității ca rezultat al integrării peste unghiuri și al însumării peste polarizări și, bineînțeles, al divizării prin viteza de propagare a energiei în spațiu. Integrarea peste unghiuri a expresiilor pentru probabilitățile de radiație (9.17) conduce la binecunoscuta relație dintre probabilitățile totale (sumate pe direcții și polarizări) ale tranzițiilor radiative (9.19). Expresia de mai sus ține cont și de posibilitatea degenerării nivelurilor atomice (adică prezența unor stări diferite cu aceeași energie) prin introducerea ponderilor statistice ale acestora g i .
Datorită faptului că probabilitățile tranzițiilor radiative induse sunt proporționale cu intensitatea radiației, se dovedește a fi convenabil să le scriem ca produs al intensităților prin coeficienți (9.20) independent de numărul de fotoni. Cantitatile introduse in acest mod se numesc Coeficienții Einstein. Relația (9.19) implică o legătură evidentă între acești coeficienți (9.21). Este interesant de observat că clasicul (nerelativista) mecanica cuantică s-a dovedit incapabil să explice într-un mod consistent natura radiațiilor spontane. În cadrul acestei teorii, expresia coeficientului Einstein pentru tranzițiile spontane a fost introdusă fenomenologic, pe baza cerinței ca echilibrul termodinamic dintre radiație și materie să fie posibil.
|
|
Densitatea spectrală a densității volumetrice de energie în cazul radiațiilor izotrope spațial. |
|
|
Probabilitățile totale (însumate pe unghiuri și polarizări) de tranziții între cele superioare |u>și mai jos |d> stările unui atom cu emisia sau absorbția unui foton. |
||
|
Coeficienții Einstein |
||
|
|
Relația dintre coeficienții Einstein |
9.4. Radiația de echilibru
Relația stabilită între probabilitățile de emisie spontană și cea stimulată face ușoară obținerea unei expresii binecunoscute pentru distribuția de frecvență a densității energiei spectrale a radiației într-o stare de echilibru termodinamic cu materia sau spectrul. radiația corpului negru. În condiția echilibrului, numărul de acte de absorbție și emisie de fotoni de către atomi pe unitatea de timp ar trebui să fie egal unul cu celălalt (9.22). Această considerație, împreună cu ipoteza distribuției de energie Boltzmann a atomilor, face posibilă găsirea numărului de fotoni în modul corespunzător decalajului de energie dintre nivelurile atomice(9.23) și calculați dependența densității volumetrice de energie a radiației de frecvența acesteia (9.24). raportul rezultat, numit Distribuția Planck, este în excelent acord cu datele experimentale. Inclus în caracteristica expresiei pentru statisticile Bose-Einstein factorul poate fi interpretat ca probabilitatea de a găsi un foton într-o stare cu o energie dată. Deoarece statistica Bose-Einstein este implementată pentru obiecte mecanice cuantice cu spin întreg, rezultatul obținut este în deplin acord cu concluzia făcută în Lectura 7 că fotonul are un spin egal cu 1.
|
Condiția de echilibru dintre radiații și materie: numărul de radiații și evenimentele de absorbție sunt egale între ele. n i- concentrarea atomilor în starea energetică superioară sau inferioară. |
||
|
|
Numărul de electroni într-un mod de radiație de echilibru. |
|
|
|
Distribuția Planck pentru radiația de echilibru. |