Liniile spectrale ale atomului de hidrogen. Procedura de efectuare a lucrărilor de laborator. Secvența izoelectronică a hidrogenului
Până la apariția teoriei lui Bohr, atomul de hidrogen fusese studiat destul de bine. Este cel mai simplu dintre atomi. Un singur electron se rotește în jurul nucleului său. Spectrul de linii de hidrogen este, de asemenea, simplu. Prin urmare, a fost obținută descrierea acestuia înainte de descrieri spectrele altor atomi.
Spectrele moleculare sunt observate atunci când o moleculă este supusă absorbției sau emisiei radiatie electromagnetica cu rezultatul creşterii sau scăderii energiei. Există restricții impuse de legi asupra cărora vaporii pot participa la schimbările de energie și în măsura în care radiațiile sunt absorbite sau emise. Aceste două fenomene sunt denumite absorbție indusă și, respectiv. De asemenea, o moleculă aflată într-o stare de energie excitată poate emite în mod spontan radiații electromagnetice, revenind la un nivel de energie mai scăzut fără prezența radiațiilor inductoare.
Conform primului postulat al lui Bohr, într-un atom, electronii din jurul nucleului se pot roti nu în oricare, ci doar în anumite orbite staționare, care sunt numite „permise”. În acest caz, energia nu este nici emisă, nici absorbită de atom. Fiecare astfel de orbită corespunde unei anumite nivel de energie atom. Energia unui atom se schimbă numai atunci când electronul se deplasează pe o altă orbită sau la un alt nivel de energie. Când se întâmplă acest lucru, absorbția sau eliberarea unui cuantum de energie.
Ați învățat deja despre structura atomului. Electronii din jur nucleul atomic, sunt dispuse într-o serie de niveluri energetice crescătoare. Fiecare element are un număr unic de electroni într-o configurație unică, astfel încât fiecare element are propriul său set de niveluri de energie. Această aranjare a nivelurilor de energie servește ca o amprentă unică a atomului.
Cu toate acestea, un gaz încălzit la temperaturi similare ar emite lumină doar la anumite lungimi de undă specifice. Motivul acestei observații nu a fost înțeles la momentul respectiv. Oamenii de știință au studiat acest efect folosind un tub de descărcare. Tubul de curgere este un tub de sticlă umplut cu gaz cu o placă metalică la ambele capete. Dacă există o diferență de tensiune suficient de mare între două plăci metalice, atomii de gaz din interiorul tubului vor absorbi suficientă energie pentru a face ca unii dintre electroni să se desprindă, adică atomii de gaz se vor ioniza.
Atomul de hidrogen din teoria lui Bohr
Atom de hidrogen conform lui Bohr
În teoria sa, Bohr a presupus că nucleul unui atom este nemișcat, iar electronul se învârte în jurul lui pe o orbită circulară. Dar stiinta moderna se știe că orbita permisă de-a lungul căreia se mișcă electronul nu este deloc o linie de cerc fixă. De fapt, aceasta este o anumită regiune a spațiului, un strat concentric subțire sub formă de minge, al cărui centru este nucleul unui atom și în care este cel mai probabil apariția unui electron. Această regiune se numește învelișul de electroni a atomului sau orbital.
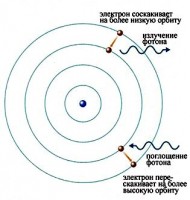
Acești electroni încep să se miște prin gaz și creează un curent care ridică unii dintre electronii din alți atomi la niveluri mai mari de energie. Apoi, când electronii din atomi cad înapoi, ei emit radiații electromagnetice. Cantitatea de lumină emisă la diferite lungimi de undă, numită spectru de emisie, este prezentată pentru un tub descărcat umplut cu hidrogen gazos dedesubt. Sunt observate doar anumite lungimi de undă de lumină, așa cum arată liniile din figură.
În cele din urmă, oamenii de știință și-au dat seama că aceste linii provin de la fotoni cu o anumită energie emisă de electroni care fac tranziții între nivelurile de energie specifice ale atomului. Figura prezintă un exemplu în acest sens. Când un electron dintr-un atom scade de la un nivel de energie mai înalt la un nivel de energie mai scăzut, emite un foton pentru a transporta energia suplimentară.
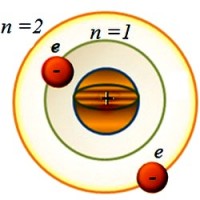
Un atom poate avea mai multe învelișuri de electroni. Fiecare dintre ele este caracterizat număr cuantic principal n . Ia valori întregi 1, 2, 3, ..., 7, ..., denotă numărul nivelului de energie și determină energia electronilor aflați pe orbita dată. Cu cât valoarea este mai mare n , cu cât electronul este mai departe de nucleu și cu atât are mai multă energie. În fizică învelișuri de electroni mai des notate cu litere K, L, M, N, O, P, Q . Cel mai apropiat de nucleu este La -coajă. Pentru ea n = 1. Electronul situat pe el are cea mai mică valoare energetică. De exemplu, pentru o coajă L n = 2 etc.
După cum am discutat mai devreme, frecvența unui foton este legată de energia sa printr-o ecuație. Deoarece o anumită frecvență fotonică ne oferă o anumită culoare, putem vedea cum fiecare linie de culoare este asociată cu o anumită tranziție. Lumina vizibilă nu este singurul fel radiații electromagnetice emise. Tranzițiile mai energice sau mai puțin energetice pot produce radiații ultraviolete sau infraroșii. Cu toate acestea, deoarece fiecare atom are propriul său set de niveluri de energie, fiecare atom are propriul spectru de emisie.
Atomii nu emit doar fotoni; ei absorb și fotonii. Dacă un foton lovește un atom, iar energia fotonului se potrivește cu decalajul dintre cele două niveluri de energie ale electronilor din atom, atunci electronul de la nivelul de energie inferior poate absorbi fotonul și să sară la nivelul de energie superior. Dacă energia fotonului nu corespunde diferenței dintre cele două niveluri de energie, atunci fotonul nu va fi absorbit.
Dar, ca și Bohr, să simplificăm problema și să presupunem că electronul se învârte în jurul nucleului pe o orbită circulară. Dacă electronul se află pe prima orbită ( n =1), atunci această stare a atomului se numește principal. Aceasta este o stare stabilă. Și energia sa în acest caz are o valoare minimă.
Și de ce are nevoie un electron pentru a se muta pe o orbită mai îndepărtată? Pentru a face acest lucru, el trebuie să depășească atracția unui nucleu încărcat pozitiv. Și acest lucru este posibil atunci când primește energie suplimentară din exterior. Și apoi va fi pe orbită cu numărul n ˃ 1 (n =2, 3, 4, …). În acest caz, energia atomului crește. Și intră într-o stare numită excitat.
Folosind acest efect, dacă avem o sursă de fotoni de diferite energii, putem obține spectre de absorbție pentru diferite materiale. Pentru a obține un spectru de absorbție, pur și simplu străluciți lumină albă pe o probă din materialul care vă interesează. Lumina albă este formată din toate lungimile de undă diferite lumina vizibila adunate împreună. Vor exista lacune în spectrul de absorbție. Golurile corespund energiilor pentru care există o diferență corespunzătoare în nivelurile de energie pentru un anumit element.
Fotonii absorbiți apar ca linii negre deoarece fotonii acestor lungimi de undă sunt absorbiți și nu apar. Din acest motiv, spectrul de absorbție este inversul exact al spectrului de emisie. Priviți cele două figuri de mai jos. În figură puteți vedea spectrul de emisie al liniei de hidrogen. Figura arată spectrul de absorbție. Acesta este exact opusul spectrului de radiații! Atât metodele de emisie, cât și cele de absorbție pot fi utilizate pentru a obține aceleași informații despre nivelurile de energie ale unui atom.
Chiar și Max Planck și-a dat seama că atomii absorb sau emit energie în porțiuni strict definite, pe care le-a numit cuante. Iar mărimea acestei energii este proporțională cu frecvența vibrațiilor luminii.
Ε = ħ· ѵ ,
Liniile întunecate corespund frecvențelor luminii care au fost absorbite de gaz. Când fotonii luminii sunt absorbiți de electroni, electronii se deplasează la niveluri de energie mai înalte. Acesta este procesul opus al radiației. Liniile întunecate, liniile de absorbție, corespund frecvențelor spectrului de emisie al aceluiași element. Cantitatea de energie absorbită de un electron pentru a se deplasa la mai mult nivel inalt, coincide cu cantitatea de energie eliberată la revenirea la nivelul energetic inițial.
Am un gaz necunoscut într-un recipient de sticlă. Am bănuiala că gazul ar putea fi hidrogen. Ce se dă și ce trebuie făcut? Avem o linie de absorbție la 642 nm. Aceasta înseamnă că substanța din recipientul de sticlă absoarbe fotoni cu o lungime de undă de 642 nm. Trebuie să calculăm care 2 niveluri de energie de hidrogen corespund acestei tranziții. Deci trebuie să știm câtă energie au absorbit fotonii.
Unde ѵ - frecvență radiații cuantice,
ħ este constanta lui Planck.
Și când un electron se mișcă de pe o orbită îndepărtată pe una mai aproape de nucleu, este emisă o cuantă de energie.
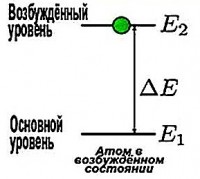
Deoarece atomul de hidrogen are un singur electron, cel mai adesea se află în starea fundamentală stabilă ( n =1), în care poate sta destul de mult timp, fără a emite nimic în același timp. Dar acest lucru continuă până când primește o cantitate suplimentară de energie. Și după ce l-a primit, electronul sare pe o altă orbită permisă cu o rază mai mare, iar atomul intră într-o stare excitată. Cu toate acestea, el nu poate rămâne în această stare mult timp. Revenind la starea fundamentală, atomul emite un foton (cuantum de lumină). Energia acestui cuantum este egală cu diferența dintre energiile stării excitate și ale stării fundamentale.
Calculați energia fotonilor absorbiți. Fotonii absorbiți aveau o energie de 3,1 × 10 -19 J. Aflați energia tranzițiilor care conduc la radiații la lungimi de undă vizibile. Figura prezintă diferite tranziții ale nivelului de energie. Tranzițiile asociate cu lungimile de undă vizibile sunt etichetate ca tranziții care încep sau se termină la nivelul energiei. Să găsim energia acestor tranziții și să o comparăm cu energia fotonilor absorbiți, pe care tocmai am calculat-o.
Energia de tranziție de la nivelul energetic 2 la nivelul energetic 3. 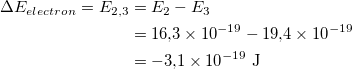
Prin urmare, energia unui foton pe care un electron trebuie să o absoarbă pentru a trece de la nivelul de energie 2 la nivelul de energie 3 este de 3,1 × 10 -19 J. Aceasta este aceeași energie ca și fotonii absorbiți de gazul din recipient! Prin urmare, deoarece tranzițiile tuturor elementelor sunt unice, se poate spune că gazul din recipient este hidrogen. Tranziția este absorbția unui foton între nivelul energetic 2 și nivelul energetic.
De ce este căptușit spectrul atomului de hidrogen
Spectrul de emisie al unui atom de hidrogen
Încă de la începutul secolului al XIX-lea, s-a stabilit că spectrul atomului de hidrogen din partea vizibilă este format din 4 linii separate: roșu, verde, albastru și violet. Cum poate fi explicat acest lucru? La urma urmei, are doar un electron.
Chestia este că atunci când radiază, un electron poate sări, de exemplu, de pe a patra orbită nu numai pe a treia, ci și pe a doua și pe prima, precum și de la a treia la a doua etc.
Aplicarea spectrelor de emisie și absorbție
Energia unui foton nu corespunde energiei unui nivel de energie, ea corespunde diferenței de energie dintre două niveluri de energie. Studiul spectrelor stelelor și galaxiilor în astronomie se numește spectroscop. Spectroscopia este un instrument utilizat pe scară largă în astronomie pentru a afla diferite lucruri despre obiectele astronomice.
Identificarea elementelor din obiectele astronomice folosind spectrele acestora
Măsurarea spectrului luminii de la o stea le poate spune astronomilor din ce este făcută o stea. Deoarece fiecare element emite sau absoarbe lumină doar la anumite lungimi de undă, astronomii pot identifica elementele care se află în stele din liniile din spectrele lor. Din studierea spectrelor multor stele, știm că există multe tipuri diferite stele care conțin elemente diferite și în cantități diferite.
Să presupunem că electronul se află pe a doua orbită. După ce a absorbit un foton, acesta se deplasează pe a treia orbită. Iar valoarea energiei fotonului absorbit este egală cu diferența dintre energiile acestor niveluri.
Ε = E 3 – E 2
Determinarea vitezelor galaxiilor folosind spectroscopie
Ați învățat deja în capitolul 9 despre efectul Doppler și despre cum se schimbă frecvența. unde sonoreîn funcție de faptul că obiectul care emite sunetul se deplasează spre tine sau se îndepărtează de tine. Același lucru se întâmplă și cu radiațiile electromagnetice. Dacă un obiect care emite lumină se mișcă spre noi, atunci lungimea de undă a luminii este mai scurtă. Dacă un obiect se îndepărtează de noi, atunci lungimea de undă a luminii sale devine alungită.
Efectul Doppler afectează spectrele obiectelor din spațiu în funcție de mișcarea lor față de noi pe Pământ. De exemplu, lumina dintr-o galaxie îndepărtată care se îndepărtează de noi cu o anumită viteză va fi roșie. Aceasta înseamnă că liniile de emisie și absorbție din spectrul galaxiei vor fi mutate la o lungime de undă mai mare. Știind unde ar fi fiecare linie din spectru în mod obișnuit dacă galaxia nu s-ar fi mișcat și compararea acesteia cu poziția sa deplasată spre roșu le permite astronomilor să măsoare cu precizie viteza galaxiei în raport cu Pământul.
Dar diferența de energie dintre nivelurile de energie vecine nu este valoare constantă. Cu cât un electron este mai departe de nucleu, cu atât este mai mic. În consecință, energia fotonilor emiși și frecvența radiației oscilațiilor electromagnetice vor fi diferite. Valoarea sa poate fi determinată folosind regula frecvenței sau postulat al doilea al lui Bohr.
Încălzirea globală și gazele cu efect de seră
Soarele emite radiații într-o gamă de lungimi de undă, care se află în principal în partea vizibilă a spectrului. Radiația la aceste lungimi de undă călătorește prin gazele atmosferei pentru a încălzi pământul și oceanele de dedesubt. Aerul cald radiază apoi acea căldură la lungimi de undă lungi în infraroșu. Dioxidul de carbon din atmosferă are niveluri de energie corespunzătoare lungimilor de undă infraroșii care îi permit să absoarbă radiația infraroșie. Apoi radiază și la lungimi de undă infraroșii în toate direcțiile.
Când un electron se mișcă de pe o orbită m pe orbită n se emite un cuantum de energie, a cărui valoare este calculată prin relația:
Ε = ħ· ѵ = E m – E n , m ˃ n ;
Unde ѵ - frecvența radiației cuantice,
ħ este constanta lui Planck.
De aici ѵ = (E m – E n)/ ħ
După cum putem vedea, frecvența radiației depinde de diferența de energie pe orbitele între care a avut loc tranziția. Și fiecare frecvență corespunde unei linii din spectrul de emisie al unui atom. Aceasta explică prezența liniilor individuale în spectrul atomului de hidrogen.
Acest efect oprește o cantitate mare de radiații infraroșii să iasă din atmosferă, ceea ce face ca atmosfera și pământul să se încălzească. Mai multe radiații intră decât revin. ecuația Rydberg, stări cuantice, structura electronica. Lumina este definită de culoarea, lungimea de undă sau frecvența sa - oricare dintre aceste trei calități determină structura de bază a undei luminoase. Undele luminoase sară în jurul nostru, sărind de milioane de suprafețe, rezultând un număr infinit de culori. lumina trece printr-un grătar de refracție, prismă sau nor nor, lumina este împărțită în toate culorile curcubeului.
Spectrul complet al atomului de hidrogen
Seria spectrală a atomului de hidrogen
Trebuie spus că liniile spectrale individuale sau grupurile de linii apropiate sunt observate în spectrul de emisie al oricărui gaz. Și aceste linii nu sunt aranjate aleatoriu, ci într-o anumită ordine.
Dar lumina care vine din interiorul unui atom este foarte diferită de lumina reflectată. Constatăm că lumina conține doar foarte puține lungimi de undă. Lumina emisă de atomi și proprietățile sale unice ne oferă o idee despre structura atomului din care scapă.
În acest experiment, veți folosi un spectrometru pentru a examina lumina emisă de heliul excitat și apoi de atomii de hidrogen. Veți vedea cum lumina emisă de un element este diferită de lumina naturală din jurul nostru și diferită de lumina emisă de alt element. Veți calibra spectrometrul cu heliu gazos și apoi utilizați spectrometrul pentru a măsura emisiile de hidrogen. Veți calcula nivelurile de energie disponibile în atomul de hidrogen și apoi determinați ce tranziții între aceste niveluri de energie cuantificate corespund fiecărei linii, fiecărei lungimi de undă din spectrele de hidrogen pe care le măsurați.
Descrierea matematică a locației linii spectrale atomul de hidrogen a fost făcut de un om de știință elvețian Johann Jacob Balmerîn 1855

Johann Jacob Balmer
Balmer era un matematician și credea că diverse combinații de numere întregi ar putea explica legătura dintre multe fenomene fizice. Ei spun că un prieten al lui Balmer, un fizician elvețian, a fost implicat în apariția unei formule care vă permite să calculați lungimea de undă a fiecăreia dintre cele patru linii vizibile ale spectrului hidrogenului. Eduard Hagenbach-Bischoff, care l-a provocat să descrie liniile roșii, verzi, albastre și violete ale spectrului hidrogenului. Și Balmer a derivat empiric următoarea formulă:
![]()
Unde λ - lungimea de unda;
n = 3, 4, 5, 6 (principal număr cuantic nivelul inițial de energie);
b = 3645,6 Å (angstrom).
Sensul fizic al formulei lui Balmer la acea vreme nu putea fi explicat de nimeni. Și abia în 1913, Niels Bohr și-a dat seama că numerele întregi din formulă sunt orbitele permise, iar liniile spectrale sunt rezultatul tranzițiilor electronilor de la o orbită la alta.
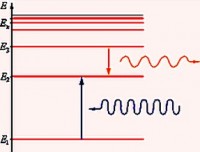
Dar s-a dovedit că serii spectrale din spectrul de radiații al atomului de hidrogen există nu numai în partea vizibilă. Mai târziu au fost găsite în zonele ultraviolete și infraroșii.
Lungimea de undă emisă de un atom de hidrogen în diferite intervale poate fi calculată prin formula, care a fost derivată în 1889 de către fizicianul suedez Johannes Rydberg:
![]() ,
,
Unde R ≈ 109737,3157 cm–1 (constanta Rydberg pentru atomul de hidrogen);
λ - lungimea de unda;
n - număr întreg;
n" este numărul seriei spectrale și n" < n .

Johannes Rydberg
În spectrul de emisie Seria Balmer observat în timpul tranziției electronilor de la nivelurile de energie excitată la n ˃ 2 (n = 3, 4, 5,…) la al doilea nivel de energie ( n" = 2). În spectrul de absorbție, se formează în timpul tranziției electronilor de la al doilea nivel la niveluri superioare de energie.
Formula Rydberg în acest caz ia forma:
![]()
Seria găsită în partea ultravioletă a spectrului se numește Seria Lyman. A fost descoperit în 1906 de un fizician american Theodore Lyman. În spectrul de emisie, această serie se formează în timpul tranziției electronilor de la nivelurile de energie excitată la primul, iar în spectrul de absorbție, în timpul trecerii de la primul nivel la cel mai înalt.
Formula lui Rydberg pentru seria Lyman:
![]()
n" = 1;
n = 2, 3, 4…
Și în domeniul infraroșu, au fost detectate 4 serii: Seria Paschen, seria Bracket, seria Pfundși Seria Humphrey.
Seria Paschen a fost descoperit în 1908 de un fizician austriac Friedrich Paschen.
Formula Rydberg pentru seria Paschen:
![]()
Unde n" = 3;
n = 4, 5, 6, …
Următoarea serie a fost deschisă de un fizician american Frederick Sumner Brackettîn 1922. corespunde formulei Rydberg pentru n' = 4 și n = 5, 6, 7…
Seria Pfund a fost descoperită de un fizician american August Hermann Pfundîn 1924. Pentru această serie n' = 5 și n = 6, 7, 8, …
Pentru seria Humphrey, deschisă în 1953. fizician american Curtis Humphrey, n' = 6 și n = 7, 8, 9, …:
Înlocuirea valorilor corespunzătoare în formula Rydberg n" și n , obținem formule pentru toate seriile din spectrul atomului de hidrogen.
Teoria lui Bohr explică modelul de linii ale spectrului atomului de hidrogen și spectrele atomilor asemănătoare hidrogenului, care includ izotopii grei ai deuteriu și tritiu, precum și orice ion care mai are doar un electron rămas, de exemplu, un heliu ionizat. atom. Dar, din păcate, nu poate fi aplicat la atomi mai complecși.
Obiectiv:
1. Explorează partea vizibilă a spectrului atomului de hidrogen.
2. Determinați constanta Rydberg și energia de ionizare a atomului de hidrogen.
Principalele prevederi teoretice ale lucrării.
Legile fizicii clasice descriu procese continue. Un atom format dintr-un nucleu încărcat pozitiv și electroni care îl înconjoară, conform acestor legi, va fi în echilibru numai dacă electronii se mișcă continuu în jurul nucleului pe anumite orbite. Dar din punctul de vedere al electrodinamicii clasice, electronii care se mișcă cu accelerație radiază unde electromagnetice, drept urmare pierd energie și cad treptat pe nucleu. În aceste condiții, frecvența de revoluție a electronilor se modifică continuu, iar spectrul de emisie al atomului trebuie să fie continuu. Când un electron lovește nucleul, atomul încetează să mai existe.
Prin calcule simple, se poate asigura că intervalul de timp după care electronul cade pe nucleu este de 10 -11 s. Experimentul arată că spectrele atomice constau din linii individuale sau grupuri de linii. Toate acestea indică faptul că procesele în care sunt implicate micro-obiectele sunt caracterizate de discontinuitate (discret), iar metodele fizicii clasice, în general, nu sunt aplicabile descrierii mișcărilor intra-atomice.
În 1913, N. Bohr a reușit să construiască o teorie consistentă care a explicat cu succes structura atomului de hidrogen. Bohr a extins postulatul lui M. Planck (1900) privind existența stărilor staționare stabile ale oscilatorilor (care este o condiție prealabilă necesară pentru derivare). formula corecta radiația corpului negru) către orice sistem atomic. Teoria lui Bohr se bazează pe două postulate:
1. Un atom și sistemele atomice pot rămâne mult timp doar în anumite stări (staționare), în care, în ciuda mișcărilor particulelor încărcate care apar în ele, ele nu emit sau absorb energie. În aceste stări, sistemele atomice au energii care formează o serie discretă: E 1 , E 2 , …, E n . Aceste stări se caracterizează prin stabilitatea lor: orice modificare a energiei ca urmare a absorbției sau emisiei de radiații electromagnetice sau ca urmare a unei coliziuni poate avea loc numai cu o tranziție completă (salt) de la o stare la alta.
2. În timpul trecerii de la o stare la alta, atomii emit (sau absorb) radiații doar cu o frecvență strict definită. Radiația emisă (sau absorbită) în timpul trecerii de la o stare cu energie E m la o stare E n este monocromatică, iar frecvența acesteia este determinată din condiția
Ambele postulate contrazic cerințele electrodinamicii clasice. Primul postulat afirmă că atomii nu radiază, deși electronii care îi formează fac mișcare accelerată (circulație pe orbite închise). Conform celui de-al doilea postulat, frecvențele emise nu au nimic de-a face cu frecvențele mișcărilor periodice ale electronilor.
Spectrul de emisie al unei substanțe este caracteristica sa importantă, care vă permite să stabiliți compoziția acesteia, unele caracteristici ale structurii sale, proprietățile atomilor și moleculelor.
Atomii de gaz emit spectre de linii formate din grupuri de linii spectrale individuale numite serie spectrală. Cel mai simplu spectru este cel al atomului de hidrogen. Deja în 1885, Balmer a arătat că lungimile de undă ale celor patru linii aflate în partea vizibilă a spectrului pot fi reprezentate foarte precis prin formula empirică.
unde n = 3, 4, 5, 6,…, V este o constantă empirică.
Regularitatea exprimată prin această formulă devine deosebit de evidentă dacă este prezentată în forma în care este utilizată de obicei în prezent:
![]() (3)
(3)
Cantitatea este uneori desemnată și numită numărul de undă spectroscopică. Se numește constanta constanta Rydberg. Astfel, ajungem în sfârșit
![]() . (4)
. (4)
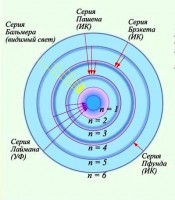
Pe măsură ce numărul liniei n crește, intensitatea liniei scade. Diferența dintre numerele de undă ale liniilor adiacente scade și ea. Pentru n = ∞ se obține o valoare constantă =. Dacă reprezentăm schematic locația liniilor spectrale definite de (4) și reprezentăm condiționat intensitatea acestora cu lungimea liniei, obținem imaginea prezentată în Fig. 1.
Setul de linii spectrale care dezvăluie în secvența și distribuția de intensitate regularitatea prezentată în Fig. 1 se numește serie spectrală. Se numește lungimea de undă limită în jurul căreia liniile se îngroașă ca n → ∞ limita seriei. Seria descrisă de formula (4) se numește seria Balmer.
Alături de seria Balmer, în spectrul atomului de hidrogen au fost găsite o serie de alte serii, reprezentate prin formule complet analoge.
În regiunea ultravioletă a fost găsită seria Lyman:
![]() (5)
(5)
În regiunea infraroșu a spectrului au fost găsite
Seria Paschen
![]() (6)
(6)
Seria bracket
![]() (7)
(7)
Seria Pfund
![]() (8)
(8)
Seria Humphrey
![]() (9)
(9)
Astfel, toate serii cunoscute de hidrogen atomic pot fi reprezentate prin așa-numitul prin formula generalizată Balmer:
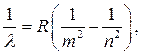 (10)
(10)
unde m din fiecare serie are o valoare constantă, iar n este o serie de valori întregi începând de la m+1.
Căutare simțul fizic formulele (10) au condus la creare teoria cuantica un atom de hidrogen. Ecuația lui Schrödinger este scrisă astfel:
![]() (11)
(11)
unde Ψ(r) este funcția de undă care descrie starea electronului în atom, E este energia totală a electronului.
Soluția acestei ecuații este spectrul de valori posibile energie deplină atom de hidrogen:
![]() (12)
(12)
Conform (1), frecvența tranziției între stări este determinată de
Pe de altă parte, după binecunoscuta formulă
Combinând (12), (13) și (14), obținem:
![]() (15)
(15)
coincide cu formula generalizată Balmer.
Valoarea teoretică a constantei Rydberg (16) diferă în continuare semnificativ de valoarea experimentală obținută din măsurători spectroscopice. Acest lucru se datorează faptului că la derivarea formulei (16) se fac două ipoteze: a) masa nucleului unui atom este infinit de mare în comparație cu masa unui electron (de unde simbolul „∞” în denumirea de a constantă) și b) nucleul este nemișcat. În realitate, de exemplu, pentru un atom de hidrogen, masa nucleului este de numai 1836,1 ori masa electronului. Luarea în considerare a acestei circumstanțe conduce la următoarea formulă:
unde M este masa nucleului atomic. În această aproximare, constanta Rydberg depinde de masa nucleului și, prin urmare, valorile sale pentru diferiți atomi asemănătoare hidrogenului diferă unele de altele (Fig. 2).
Fig.2 Fig.3
Pentru a obține întregul set de informații despre atom, este convenabil să folosiți diagrama nivelului de energie (Fig. 3). Liniile drepte orizontale corespund diferitelor stări de energie ale atomului de hidrogen. Pe măsură ce numărul stărilor crește, distanța dintre nivelurile învecinate scade și dispare în limită. Deasupra punctului de confluență se află o regiune continuă de energii pozitive necuantificate. Nivelul de energie zero este considerat a fi energia nivelului cu n = ∞. Sub această valoare, nivelurile de energie sunt discrete. Ele corespund valorilor negative ale energiei totale a atomului. Această împrejurare indică faptul că energia unui electron în astfel de stări este mai mică decât energia sa în cazul în care este separat de atom și se odihnește la infinit. distanta lunga, adică că electronul este într-o stare legată.
Prezența electronilor nelegați face posibile tranziții cuantice între stările spectrului energetic continuu, precum și între astfel de stări și stări ale spectrului energetic discret. Aceasta se manifestă sub formă spectru continuu emisie sau absorbție suprapusă spectrul de linii atom. Prin urmare, spectrul nu se oprește la limita seriei, ci continuă dincolo de aceasta către lungimi de undă mai scurte, unde devine continuu. Tranzițiile de la stările spectrului continuu (acele stări în care atomul este ionizat) la stările spectrului discret sunt însoțite de recombinarea unui electron și ion pozitiv. Radiația rezultată se numește recombinare.
Tranziția unui atom de la starea normală la un nivel de energie mai înalt al spectrului discret este excitarea atomului. Tranziția unui atom de la unul dintre nivelurile spectrului discret la regiunea spectrului continuu transformă atomul într-un sistem nelegat. Este un proces ionizarea atomului. Energia corespunzătoare numărului de undă de la începutul spectrului continuu din partea undelor lungi (numărul de undă al limitei seriei) ar trebui să fie egală cu energie de ionizare, adică energia necesară pentru a separa un electron de un atom și pentru a-l îndepărta la o distanță infinită. Astfel, numărul de undă al limitei seriei Lyman dă energia de ionizare a atomului de hidrogen din sol, starea cea mai stabilă.
În această lucrare, studiem primele patru linii ale seriei Balmer, care au următoarele denumiri:
Linie roșie (n = 3),
Linie albastră - albastră (n = 4),
linie albastră (n=5),
Linie violet (n = 6).






