Numărul maxim de orbitali din niveluri. Sarcini pentru secțiunea despre elementele de bază ale structurii atomilor
În această secțiune puteți găsi principalele tipuri de sarcini pe tema structurii atomului: reprezentarea configuratie electronica, definiția numerelor cuantice și altele.
Problema 1. Masa unui neutron este de 1,67*10 -27 kg, iar viteza lui este de 4*10 2 m/s. Determinați lungimea de undă de Broglie.
Sarcina 2. Alcătuiți formule electronice și reprezentați grafic distribuția electronilor de-a lungul celule cuantice pentru elementele specificate. Analizați posibilitățile de separare a electronilor perechi în timpul excitației atomilor cu formarea de electroni de valențăîn conformitate cu teoria spin-valenţei. Carbon, clor.
Sarcina 3. Alcătuiți formule electronice și reprezentați grafic distribuția electronilor în celulele cuantice pentru elementele indicate. Analizați posibilitățile de separare a electronilor perechi în timpul excitației atomilor cu formarea electronilor de valență în conformitate cu teoria spin-valenței.
clor, beriliu argon
Sarcina 4. Ce număr cuantic determină numărul de orbitali dintr-un anumit subnivel al unui atom? Care este numărul de orbitali pe s-, p-, d- șif- subniveluri?
11 și 25.
Soluţie:
Soluţie: Numărul cuantic principal n caracterizează energia și dimensiunea orbitalului și ia doar valori ale numerelor întregi de la 1 la ∞.
Număr cuantic lateral (orbital) l caracterizează forma geometrică a orbitalului și pentru fiecare nivel de energie ia valorile numerelor întregi de la 0 la (n-1).
În atomii multielectroni, energia electronilor depinde și de valoare l. Prin urmare, starea electronului, caracterizată prin valori diferite l se numesc subniveluri energetice:
l=0, orbitalii s sunt sferici
l=1, orbitalii p au formă de gantere
l=2, orbitalii d au o formă mai complexă
l=3, orbitalii f au o formă mai complexă
Numărul cuantic magnetic m l caracterizează direcția orbitalului în spațiu și ia o valoare din - l … 0 … +l .
s-subnivelul este caracterizat prin valoarea l=0, m l = 0
p-subnivelul este caracterizat prin valoarea l=1, m l = -1; 0; +1 (3 orbitali)
d-subnivelul se caracterizează prin valoarea l=2, m l = -2; -unu; 0; +1; +2 (5 orbitali)
f-subnivelul se caracterizează prin valoarea l=3, m l = -3; -2; -unu; 0; +1; +2; +3 (7 orbitali)
m l determină numărul de orbitali pe un subnivel de energie dat al unui atom.
Numărul cuantic de spin m s caracterizează rotația unui electron în jurul axei sale și ia valorile + ½ și - ½.
La nivelul 4, sunt posibile stări de energie 4s, 4p, 4d pentru stratul exterior al atomului.
Să scriem un set de numere cuantice pentru ele:
4s: n =4, l = 0, m l = (2l+1)=1 (1 orbital), m s = ±½
4p: n =4, l = 1, m l = (2l+1)=3 (3 orbitali -1,0,+1), m s = ±3½
4d: n =4, l = 2, m l = (2l+1)=5 (5 orbitali -2,-1,0,+1,+2), m s = ±5½
Domnișoară indicat pentru numărul maxim de electroni.
Numărul maxim de electroni pe subnivel p este 6 conform .
Ψ2 în această zonă este maxim.
Orez. 2.3. Distribuția probabilității ca un electron să se afle într-un atom de hidrogen.
Se poate spune că fluctuează nu electronul în sine, ci probabilitatea de a-l găsi oriunde în atom.
Astfel, un atom datorită naturii ondulatorii a unui electron
nu are dimensiuni geometrice exacte și o formă neschimbată.
Un electron dintr-un atom este un obiect ondulat. Cu toate acestea, pierderea unui electron de către un atom (ionizarea unui atom) are loc întotdeauna sub forma unui singur
electronul fisionabil ca particulă.
2.7. Structura învelișurilor electronice ale atomilor. numere cuantice
Integrând ecuația Schrödinger, se găsește funcția de undă Ψ=f(x,y,z) . După ce s-a determinat Ψ, este posibil să se estimeze valoarea lui Ψ 2 dV – probabilitatea
probabilitatea de a găsi un electron în volumul spațiului dV care înconjoară nucleul atomic.
Consecința rezolvării ecuației Schrödinger sunt trei numere cuantice care caracterizează comportamentul unui electron într-un atom.
2.7.1. Numărul cuantic principal (n)
Numărul cuantic principal caracterizează (în prima aproximare) energia totală a unui electron sau nivelul său de energie.
Ea definește dimensiuni orbital atomic . Cu cât mai mult „n”, cu atât marime mai mare orbital atomic, ceea ce înseamnă că electronul este mai departe de nucleu, prin urmare, energia lui este mai mare.
Pentru n=1, o soluție a ecuației Schrödinger este posibilă.
Pentru n=2, există patru soluții posibile, pentru n=3, nouă soluții ale ecuației Schrödinger și așa mai departe. În general, pentru fiecare valoare a lui „n” există soluții „n2”.
Aceste soluții sunt funcțiile de undă orbitale sau orbitalii electronului.
Conceptul de „orbital” nu trebuie identificat cu conceptul de „orbita”, care este folosit în teoria lui Bohr. În teoria lui Bohr, orbita este înțeleasă ca traiectoria (calea) electronului în jurul nucleului.
Orbitalii pot fi considerați ca niște zone din jurul nucleului la care au acces electronii. (dar nu completându-le întotdeauna)
yut). Acesta este locul punctelor în care probabilitatea de a găsi electroni într-o stare excitată este maximă (~95%).
Din moment ce electronul are sarcina negativa, orbitalul său poate fi considerat ca unele distribuirea taxelor. Această distribuție se mai numește nor electronic.
Un set de electroni cu aceeași valoare a „n” se numește nivel de energie (sau înveliș, sau strat de electroni).
mânca ). La atomii neexcitați, valoarea maximă a lui „n” corespunde numărului perioadei acestui element din tabelul D.I. Mendeleev.
Nivelurile de energie sunt uneori indicate cu majuscule.
(Numerele sunt cel mai frecvent utilizate.)
2.7.2. Numărul cuantic orbital (l)
Numărul cuantic orbital determină forma norului de electroni (totuși, acest lucru este clar doar pentru un atom de hidrogen cu un electron).
În atomii cu mulți electroni, l caracterizează și energia. În acești atomi, electronii unui nivel de energie dat sunt grupați în subniveluri cu energii diferite.
Fiecare valoare a lui l corespunde unei anumite energii
subnivelul cerului. Un set de electroni cu aceleași „n” și „l” se numește subnivel (sau subshell).
Numărul cuantic orbital ia valori de la 0 la (n-1): 0.1,2.3,…….(n-1).
Mai des, valoarea „l” În loc de numere, acestea sunt exprimate în numere mici ale alfabetului latin.
l = 0 1 2 3 ... | ||
denumire s p d f …. |
||
(Mai mult de patru subniveluri ale atomilor neexcitați nu sunt umplute, deoarece valorile l \u003d 0,1,2,3 descriu electronii tuturor elementelor cunoscute în prezent).
Tabelul 2.1 |
|||
Relația dintre numerele cuantice principale și orbitale |
|||
Număr cuantic (n) | Valoarea orbitală |
||
număr cuantic | |||
la(l) | |||
0,1,2(s-, p-, d-) | |||
0,1,2,3 (s-, p-, d-, f-) | |||
Orbitali pentru care l = 0, | |||||||
forma unei bile (sfere) | numit | ||||||
orbitalii (reprezentați în mod condiționat în | |||||||
cercuri). | |||||||
Electronii cu l = 0 se numesc electroni s. |
|||||||
După cum se poate observa din tabelul 2.1, orbitalul s este |
|||||||
la toate nivelurile energetice. La primul |
|||||||
nivel de energie sunt doar s- |
|||||||
orbitali. | |||||||
Orbitalii pentru care l =1 au |
|||||||
forma unei gantere (volumul opt) și pe- |
|||||||
se numesc orbitali p (electroni –p- |
|||||||
electroni). orbitalii p sunt pe toate |
|||||||
alte niveluri decât primul. | |||||||
Orbitalii cu l =2 au | mai complex |
||||||
formă („frunză de trifoi”) voluminoasă și pe- |
|||||||
se numesc d-orbitali. | |||||||
orbitalii d sunt la toate nivelurile, cu excepția primului |
|||||||
primul (n=1) și al doilea (n=2). | |||||||
Orbitali cu l =3 (orbitali f) |
|||||||
mai complicat decât orbitalii d. Sunt, |
|||||||
începând cu al patrulea nivel. | |||||||
Energia orbitală | (subniveluri), | ||||||
care sunt la același nivel energetic, nu sunt la fel și cresc în serie:
Es Distribuția subnivelurilor în funcție de energie este prezentată în grafic Subnivelul energetic este desemnat astfel: cuantumul principal numărul este scris cu cifre arabe, orbital – corespunzător supă de varză cu litere latine. Subniveluri Orez. 2.4. Schema de împărțire a nivelurilor de energie în subniveluri. De exemplu: 4d este subnivelul d al celui de-al patrulea nivel de energie (n=4,l=2). Numărul de valori l pentru fiecare nivel este egal cu numărul de valori ale numărului cuantic principal (a se vedea tabelul 2.1), astfel încât numărul de subniveluri la nivel este, de asemenea, egal cu numărul cuantic principal „n”. 2.7.3. Număr cuantic magnetic (ml) Numărul cuantic magnetic caracterizează orientarea norului de electroni în spațiu în raport cu câmpul magnetic. Ea determină alungirea norului de electroni de-a lungul axelor, adică. deplasarea sa în spațiu de-a lungul axei, coincizând cu direcția câmpului magnetic. „ml” poate lua orice valori întregi pozitive și negative de la -l la +l, inclusiv zero. Numărul de valori „ml” determină numărul de orbitali dintr-un anumit subnivel. De exemplu: s-subnivel: l =0 → ml = 0 → 1 orbital p-subnivel: l =1 → ml = –1, 0, +1 → 3 orbitali d-subnivel: l =2 → ml = –2, – 1, 0, +1, +2 → 5 orbitali f-subnivel: l =3 → ml = –3, –2, –1, 0, +1, +2, +3 → 7 orbitali. În general, numărul de orbitali dintr-un subnivel este egal cu ml =2l +1 (2.10). Grafic, orice orbital este reprezentat ca o celulă (cuantică celulă) □ , iar electronul din ea este sub forma unei săgeți. substrat s: substrat p: substrat d: substrat f: Numărul total de orbitali la nivel de energie este: Deci, fiecare orbital și electronul care se află în acest orbital este caracterizat de trei numere cuantice - principalul (n), orbital (l) și magnetic (m l). Tabelul 2.2 Numărul de orbitali în niveluri de energie desemna valoarea ml a sufla- orbitali 2, -1, 0, +1, +2 2, -1, 0, +1, +2 3,-2,-1,0,+1,+2,+3 Electronul este caracterizat de încă unul - număr cuantic de spin. 2.7.4. Numărul cuantic de rotație (ms) „m s” caracterizează mișcarea internă a electronului - spin. Este asociat cu propriul moment magnetic al electronului, datorită mișcării acestuia în jurul axei sale. Pur și simplu, „ms” Exprimă direcția de rotație a unui electron în jurul axei sale. Acest număr cuantic ia doar două valori: 1 2 și −1 2 Dacă direcțiile de rotație ale unui electron în jurul nucleului și în jurul axei sale sunt aceleași (de exemplu, în sensul acelor de ceasornic), atunci „ms” ia valoarea +1/2, iar dacă nu se potrivesc, atunci -1/2. Doi electroni cu aceleași valori de n, l și ml, dar cu spini direcționați opus (antiparalel) se numesc pereche de electroni pereche sau neîmpărțită. Electronii cu spinuri nesaturate se numesc nepereche (sau „lente”). Un orbital fără electroni se numește orbital vacant. 2.8. Structura atomilor multielectroni Înregistrarea distribuției electronilor într-un atom (sau configurația electronică a unui element) pe niveluri, subnivele și orbitali este dată pentru starea fundamentală (neexcitată) a atomului. Dacă unul sau mai mulți atomi sunt într-o stare excitată, atunci configurația electronică va caracteriza și starea excitată a atomului. La scrierea configurației electronice, numărul cuantic principal (n) este indicat în cifre, subnivelurile (s, p, d, f) sunt indicate cu litere, iar gradul la litere este numărul de electroni dintr-un subnivel dat. De exemplu, 4d3 - există 3 electroni la subnivelul d al celui de-al patrulea nivel de energie. Hidrogen - 1s1 Litiu - 1s2 2s1 Magneziu - 1s2 2s2 2p6 3s2 etc. Distribuția electronilor în orbitali în atomi este determinată de trei prevederi principale: principiul Pauli; -
principiul energiei minime; regula lui Gund. 2.8.1. Principiul Pauli (1925) Pe baza analizelor spectrelor elementelor și a pozițiilor lor în Tabelul Periodic, Pauli a derivat cel mai important principiu: Un atom nu poate avea doi electroni cu aceleași valori ale tuturor celor patru numere cuantice, adică. oricare doi electroni dintr-un atom trebuie să difere cu cel puțin un număr cuantic. Sau: un orbital nu poate conține mai mult de doi electroni, care trebuie să aibă spini opuși. Consecințele principiului Pauli: 1. Sa observat deja că numărul de orbitali la un nivel este egal cu pătratul numărului cuantic principal, adică: Norb \u003d n2 și, deoarece nu pot fi mai mult de doi electroni într-un orbital, atunci: Numărul maxim de electroni dintr-un nivel este de două ori pătratul numărului cuantic principal. n=1: (Nel =2 12 =2 electroni) n=2: (Nel =2 22 = 8 electroni) n=3: (Nel =2 32 = 18 electroni) n=4: (Nel =2 42 \u003d 32 de electroni) 2. De asemenea, sa remarcat mai sus că numărul de orbitali la un anumit subnivel este egal cu numărul de valori ale numărului cuantic magnetic pentru acest subnivel (ml = 2l + 1), și deoarece nu pot exista mai mult de două electroni pe orbital, atunci: Numărul maxim de electroni dintr-un subnivel este egal cu dublul numărului de valori ale numărului cuantic magnetic pentru acest subnivel: La subnivelul s: Nel = 2 (2 0 + 1) = 2 electroni (s-electroni); la subnivelul p: Nel =2·(2·1+1) =6 electroni (p-electroni); la subnivelul d: Nel = 2 (2 2 + 1) = 10 electroni (d-electroni); la subnivelul f: Nel = 2 (2 3 + 1) = 14 electroni (electroni f). 2.8.2. Principiul energiei minime După cum sa menționat mai sus, starea cea mai stabilă a unui electron dintr-un atom corespunde valorii minime a energiei sale, iar electronul care se află pe orbita cea mai apropiată de nucleu are energia minimă. Orice altă stare este excitată, instabilă - din ea electronul trece spontan într-o stare cu o energie mai mică. Secvența de plasare a electronilor într-un atom ar trebui să corespundă celei mai mari conexiuni a acestora cu nucleul, adică. electronul trebuie să aibă cea mai mică energie. Prin urmare, un electron nu ocupă un subnivel de energie mai înalt atâta timp cât există locuri libere pe cel de bază, situate pe care electronul va avea cea mai mică energie. necorespunzător dreapta Regulile lui Klechkovsky: 1. Deoarece energia unui electron este determinată în principal de valorile numerelor cuantice principale și orbitale, mai întâi se umple subnivelul pentru care suma n + l este mai mică. De exemplu, dintre cele două subniveluri 3d și 4s, subnivelul 4s va fi mai întâi umplut cu electroni: 3d: (n+l =3+2=5)4s→3d 4s: (n+l =4+0=4) 2. Dacă sumele n + l sunt aceleași pentru diferite subniveluri, atunci subnivelul cu „n” mai mic este completat mai întâi , deoarece contribuția la energia electronului la „n” este mai mare decât cea a lui „ l ". De exemplu, la subnivelurile 5s, 4p și 3d sumele n+ l sunt aceleași: 5s: (5+0=5), 4p: (4+1=5), 3d: (3+2=5). Următorul- În consecință, umplerea merge după schema: 3d→4p→5s. 2.8.3. regula lui Gund Orbitalii dintr-un anumit subnivel sunt umpluți mai întâi de un electron , adică fiecare electron este situat într-o celulă separată sub forma unui electron nepereche. Acest model se datorează faptului că electronii se resping reciproc mai puternic, când ocupă același orbital. Prin urmare, ei tind să ocupe orbitali diferiți, atunci repulsia va fi mai mică (adică și mai puțină energie). Aceeași direcție a spinurilor contribuie și la o scădere a energiei; acest lucru se datorează faptului că electronii cu același spin se evită reciproc atunci când se mișcă și, prin urmare, se resping mai puțin. Această consistență se numește corelația electronică. Cu alte cuvinte, pentru o valoare dată l» electronii din atom sunt aranjați astfel încât numărul lor total de spin (Σm s ) a fost maximul. Luați în considerare, de exemplu, care aranjament a trei electroni pe subnivelul p corespunde stării stabile a atomului: Σms = − 1
Σms = Σms = − 1
Σms = − 1
− 1
Exemplu. Caracterizați stările electronilor dintr-un atom cu patru numere cuantice: electron Stabilit pe baza spectroscopice, chimice și razelor X Date noscopice, ordinea în care orbitalii sunt umpluți cu electroni este următoarea: 1s2 | 2s2 2p6 | 3s2 3p6 | 4s2 3d10 4p6 | 5s2 4d10 5p6 | 6s2 5d1 4f14 5d2÷10 6p6 | 7s2 6d1 5f14 6d2÷10 …7p6 | De exemplu, conform formulei de mai sus, vom întocmi o schemă de umplere orbitali electronici: zirconiu 40 Zr: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d2 100 Fm:1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 5d1 4f14 5d9 6p6 7s2 6d1 5f11 . În funcție de subnivelul umplut cu electroni, aceștia diferă: elementele s - în atomii lor, subnivelul s al nivelului exterior este ultimul umplut cu electroni (în tabele sunt cel mai adesea colorate în roșu); elementele p - în atomii lor, subnivelul p al nivelului exterior (culoare portocalie) este ultimul umplut cu electroni (de la 1 la 6); elementele d - în atomii lor, subnivelul d al nivelului pre-extern este ultima umplut cu electroni (de la 1 la 10), iar la nivelul extern, majoritatea au doi electroni (s2). Ulterior, pe baza unor studii spectrale subtile, s-a constatat că nu toate cele 32 de elemente d au doi electroni la nivelul exterior (ns). Pentru 9 elemente: Cr, Cu, Nb, Mo, Ru, Rh, Ag, Pt, Au - câte unul (ns1), în timp ce paladiului (Pd) îi lipsesc ambii electroni (5s0). Acest lucru se datorează „descoperirii” (sau „eșecului”) electronilor de la subnivelul s exterior la subnivelul d pre-exterior (un electron „cade” în nouă elemente și doi în paladiu). „Breakthrough” sau „eșec” se caracterizează printr-un efect exotermic și duce la o configurație mai stabilă (d-elements - albastru). elemente f - în atomii lor, subnivelul f al celui de-al treilea nivel este ultimul care este umplut cu electroni, numărând din exterior (de obicei negru). CAPITOLUL 3. SISTEMUL PERIODIC LUI D.I.MENDELEEV formă orbitală Număr cuantic magneticm l caracterizează momentul magnetic al electronului. Determină orientarea subnivelului cuantic în spațiu. Numărul de proiecții ale unui subnivel pe direcția liniilor câmpului magnetic este cuantificat și este egal cu numărul de orbitali la un anumit subnivel. Se poate spune că numărul cuantic magnetic determină numărul de orbitali dintr-un subnivel. m l ia valori de la –l la zero la +l. m l = –l,…,+1, 0, –1,…, +l. Luați în considerare subnivelul s. Pentru el: l=0, m l =0 La Subnivelul Р are l=1, iar m l = –1, 0, +1 În acest caz, conform regulilor de cuantizare, există deja trei proiecții. Prin urmare, există trei orbitali p pe subnivelul p. fig2.2. Pentru subnivelul d: l=2, m l = –2, –1, 0, +1, +2. Aceasta înseamnă că, conform teoriei cuantice, subnivelul d este format din cinci orbitali d. Subnivelul f are l=3, m l = –3, –2, –1, 0, +1, +2, +3. Prin urmare, subnivelul f este format din șapte orbitali f. Numărul de orbitali la subnivel poate fi determinat din expresia m l =2l+1: Valoarea l: 0, 1, 2, 3, ……. subnivel: s, p, d, f, ……. numărul de orbitali: 1, 3, 5, 7, ……. Spin număr cuanticm s caracterizează momentul propriu al impulsului, ia naștere ca datorită „rotației” electronului în jurul propriei axe. Este nevoie de două valori: +1/2 și –1/2, care corespund a două direcții posibile de rotație a electronilor. m s = +1/2; -1/2. A fost obținut din experimentele lui Stern și Gerlach. Numerele cuantice luate în considerare determină energia electronului, volumul și forma spațiului în care este probabil să rămână în volumul circumnuclear, adică. dimensiunea, forma și orientarea orbitalului în spațiu. Deoarece funcția de undă este o soluție a ecuației Schrödinger pentru toate valorile posibile ale numerelor cuantice, putem spune că funcția de undă este, la rândul său, o funcție a parametrilor cuantici considerați n, l și m l , unde: n= 1, 2, 3, 4,…, l= 0, 1, 2, 3,…,n–1 m l =–l,…, –1, 0, +1,…, +l orbitali atomici. Deoarece probabilitatea de a găsi un electron într-un spațiu departe de nucleu este foarte mică, atunci când se vorbește despre orbitali, se referă la o astfel de zonă din jurul nucleului atomic în interiorul căreia este concentrată 90–95% din sarcina electronică. Din punctul de vedere al mecanicii cuantice, orbitalii atomici sunt o reprezentare geometrică a funcției de undă (n, l, m l). Z Y a determinat poziția electronului în spațiul tridimensional și Au pus capăt în acel loc, apoi printr-un set de astfel de definiții X ar obține o imagine sub forma unui nor spațial Puncte Nogo cu margini neclare /Fig.2.3.) T Z s-orbital. Există pentru l=0. Valoarea lui m l este de asemenea Y zero. Avem o singură valoare m l =0. Prin urmare, Orbitalul s are simetrie maximă. Ea are Forma X sferică (Fig.2.4.). În acest caz, probabilitatea de mișcarea unui electron în spațiul circumnuclear este determinată de: fig.2.4. este doar un vector rază și nu depinde de unghiul de coordonate. electronul corespunde unei curbe cu un maxim (Fig. 2.5.). Probabilitatea maximă de propagare este la 0 r 1 r,A 0 distanta de la miezul r 1 care corespunde razei fig.2.5. prima orbită Bohr. p-orbital. Există pentru l=1. ml = -1, 0, +1. Z p-orbital apare pe al doilea și pe toate ulterioare Y nu fiecare nivel poate avea trei p-orbitali. p-orbital X se află în spațiu în direcția coordonatei Px axele. Se numesc, respectiv, p x, p y, p z -orbitali Py (fig.2.6.). R dz 2 dx 2 y 2 dxy dxz dyz d-orbital. Apare la l=2 la al treilea nivel cuantic. La subnivelul d, pot exista deja cinci stări diferite ale electronilor, prin urmare, la subnivelul d al fiecărui nivel cuantic, există cinci orbitali d. În acest caz, m l ia cinci valori: m l = -2, -1, 0, +1, +2, orbitalii d au o formă mai complexă decât orbitalii p, fie sub formă de patru petale, fie sub formă de formă de gantere cu margine ( Fig.2.7.). f-orbital. Apare când l=3. Orbitalii f pot fi doar la al patrulea și mai îndepărtat nivel. Deoarece la l=3 m l are 7 valori /–3, –2, –1, 0, +1, +2, +3/, atunci pot exista șapte orbitali pe subnivelul f. Forma orbitalilor f este chiar mai complexă decât cea a orbitalilor d. Orbitalii f sunt reprezentați ca figuri complexe cu șase lobi. Forma orbitalilor și orientarea acestuia joacă un rol semnificativ în formarea legăturilor chimice, deoarece acești doi factori determină natura și gradul de suprapunere a norilor de electroni ai atomilor de legătură. 2.1.5. Structura învelișurilor electronice ale atomilor. Structura completă de energie electronică a atomilor este predeterminată de setul de numere cuantice considerate. Numărul cuantic principal n determină nu numai numărul nivelului cuantic, ci indică și numărul de subniveluri conținute în acest nivel. De exemplu, când n=3, avem al treilea nivel cuantic, care constă din trei subniveluri: s-, p-, d-subnivel. Cu cât nivelul cuantic este mai departe de nucleu, cu atât este mai încăpător, cu atât este compus din mai multe subniveluri. Numărul de orbitali la un nivel poate fi determinat prin formula k n =n 2 , iar numărul de orbitali la un subnivel, după cum sa menționat deja, prin formula k l =2l+1. Să luăm în considerare schema teoretică a dispunerii reciproce a nivelurilor și subnivelurilor cuantice. /Fragment pentru primele patru niveluri/. Pe patru linii verticale trasăm valorile numerelor cuantice n, l, m l și m s. Fig.2.8.). Știm deja că cu cât valoarea numerică a lui n este mai mare, cu atât nivelul cuantic este mai încăpător. Prin urmare, în figură se face mai lung în înălțime. A doua linie verticală, legată de numărul cuantic l, arată împărțirea nivelurilor cuantice în subniveluri. Primul nivel cuantic constă dintr-un singur subnivel /desemnat ca subnivel s/. Al doilea nivel cuantic este deja împărțit în două subniveluri: subnivelul s și subnivelul p. Al treilea nivel este împărțit în trei subniveluri /s, p și d/, iar al patrulea este împărțit în patru subniveluri /s, p, d și f/. subnivelurile cuantice ale electronilor orbitali nivel superior în orbitali vena Fig.2.8. A treia linie verticală corespunde numărului cuantic m l . Aceasta arată împărțirea subnivelului cuantic în orbitali. Numărul de orbitali pe subnivel este numărul de valori pe care le ia numărul cuantic magnetic. Subnivelul s este format dintr-un singur orbital, deci există un singur orbital în primul nivel cuantic. Subnivelul p este format din trei orbitali. ml = -2, -1, 0, +1, +2 subnivelul f și-a crescut capacitatea la șapte orbitali f-subnivel m l = -3, -2, -1, 0, +1, +2 +3 A patra linie verticală este atribuită numărului cuantic de spin m s . Privind în viitor, observăm că acest număr cuantic predetermina numărul posibil de electroni în orbital. Conform postulatului corespunzător, într-un orbital pot exista doi electroni, dar ei trebuie să aibă spini diferiți, adică. diferite valori ale m s: +1/2 și –1/2. În acest sens, a patra linie verticală arată ocuparea maximă a subnivelului cuantic și a nivelului de către electroni. La subnivelul s - 2 electroni La subnivelul p - 6 electroni La subnivelul d - 10 electroni La subnivelul f - 14 electroni Numărul maxim de electroni pe subnivel poate fi determinat prin formula: Secvența teoretică de aranjare a nivelurilor cuantice și a subnivelurilor arată astfel: 1s2s2p3s3p3d4s4p4d4f5s5p5d5f6s6p6d6f7p7p… Cu toate acestea, atunci când nivelurile cuantice sunt împărțite în subniveluri, secvența teoretică de mai sus este încălcată. Se determină dispunerea reală a subnivelurilor regula lui Klechkovsky, conform căruia succesiunea subnivelurilor este determinată de valoarea totală a două numere cuantice n și l. În cazul în care pentru două sau mai multe subniveluri n + l are aceeași valoare, atunci subnivelul cu valoarea mai mică a lui n merge primul. 1s - 2s - 2p - 3s - 3p - 3d - 4s - 4p - 4d - 4f - 5s -5p - 5d - 5f (n+l) 1 2 3 3 4 5 4 5 6 7 5 6 7 8 Conform regulii Klechkovsky, succesiunea reală a subnivelurilor este următoarea: 1s2s2p3s3p4s3d4p5s4d5p6s5d4f5d 2–5 6p7s6d 1 5f 6d 2–5 7p. Structura învelișurilor de electroni ale atomilor este prezentată în următoarea diagramă (Fig. 2.9.): 2.1.6. Principiile de bază ale distribuției electronilor într-un atom. Învelișul de electroni considerat al unui atom este umplut cu electroni în conformitate cu trei principii: principiul energiei minime, principiul Pauli / regula / Hund. principiul minimului afirmă că un electron dintr-un atom ocupă acel subnivel liber la care va avea o valoare energetică minimă. În alt mod, electronul rămâne la subnivelul la care este asigurată cea mai puternică legătură cu nucleul. Secvența în care sunt umplute subnivelurile corespunde locației reale a subnivelurilor în structura învelișului de electroni a atomului dată mai sus: 1s2s2p3s3p4s3d –… etc. /cm. de mai sus/. principiul Pauli/Interdicția Pauli/ spune că un atom nu poate avea nici măcar doi electroni cu aceleași valori a patru numere cuantice. Consecinţă. Un orbital poate conține doi electroni cu spini diferiți (adică cu valori diferite ale numărului cuantic de spin: m s = +1/2 și m s = –1/2). Al treilea principiu este Principiul sau regula lui Hund/Hunda/. Ea explică ordinea în care electronii umplu subnivelul cuantic. În cadrul subnivelului, electronii sunt distribuiți în așa fel încât numărul lor cuantic total să aibă o valoare maximă /primul electron pe orbital și apoi împerecherea/. Distribuția corectă va fi, de exemplu, trei electroni p în acest fel: În funcție de ce subnivel este umplut cu ultimii electroni, se disting elementele s-, p-, d-, f-. Elementele s sunt acele elemente în atomi cărora ultimii electroni ocupă subnivelul s al nivelului cuantic exterior. /De exemplu, sodiu, magneziu, potasiu, calciu etc./. Elementele p sunt acele elemente în a căror atomi ultimii electroni ocupă subnivelul p al nivelului cuantic exterior. /De exemplu, carbon, oxigen, clor etc./. Subnivelul d, umplut cu ultimii electroni, clasifică elementele drept elemente d. /De exemplu, elementele d sunt titan, crom, fier, cupru, deoarece în aceste elemente, ultimii electroni ocupă subnivelul d al penultimului nivel/. Elementele f sunt acele elemente în ai căror atomi ultimii electroni ocupă subnivelul f al celui de-al doilea din afara nivelului cuantic. /De exemplu, praseodim, europiu, erbiu etc./. 2.1.7. Imagine a structurii electronice a atomilor folosind formule electronice și celule cuantice. Structura electronică a oricărui atom este reprezentată prin formule electronice. În formulele electronice, nivelul electronic cuantic este notat cu valoarea numerică a numărului cuantic principal n, subnivelul este scris prin desemnarea literei subnivelului corespunzător, iar numărul de electroni din subnivel este indicat de gradul subnivelului. desemnare. De exemplu, 3d 5 înseamnă că există cinci electroni în subnivelul d al celui de-al treilea nivel cuantic. Formula electronică a oricărui element constă dintr-un set complet de astfel de fragmente, așa cum este indicat în exemplu. Astfel, formula electronică a atomului de titan /№22/ este: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 . Suma tuturor puterilor este 22, ceea ce înseamnă că atomul de titan, având o sarcină nucleară de +22, conține 22 de electroni pe învelișul de electroni, care, cu sarcina lor negativă totală (–22), compensează sarcina pozitivă a nucleul atomic, făcând atomul un sistem complex neutru din punct de vedere electric. Este mai convenabil să compuneți formule electronice după luarea în considerare a structurii sistemului periodic de elemente al lui D.I. Mendeleev. Privind în perspectivă și pe baza cunoștințelor acumulate în liceu, vă prezentăm sistemul periodic de elemente sub formă de formule electronice. (Fig. 2.10.) Vom reveni mai târziu la scrierea formulelor electronice ale unui anumit element din sistemul periodic și vom lua în considerare un algoritm prin care este ușor de învățat cum să scrieți formula electronică a oricărui element. În al doilea rând, structura învelișului de electroni a unui atom este descrisă folosind celule cuantice. IV 4s 2 3d 10 4p 6 V 5s 2 4d 10 5p 6 VI 6s 2 5d 1 4f 14 5d 9 6p 6 VII 7s 2 6d 1 5f 14 6d 9 7p 6 Am folosit deja celule cuantice, deși nu am introdus conceptul de „celulă cuantică”. O celulă cuantică nu este altceva decât o reprezentare grafică a unui orbital. Este indicat de o celulă, iar electronii din orbital sunt reprezentați de o săgeată care stă într-o celulă. O celulă este atribuită pentru subnivelul s, deoarece subnivelul s are un singur orbital. Trei celule sunt alocate pentru subnivelul p deoarece subnivelul p conține trei orbitali p. Subnivelul d este reprezentat de cinci celule, iar subnivelul f de șapte celule. Structura electronică a atomului de titan, pentru care am scris deja formula electronică, descrisă folosind celule cuantice, arată astfel: 2.1.8. Despre individualitatea fiecărui element chimic. „Cartea de identitate” a unui element chimic poate fi numită formula sa electronică. Privind la ea, chimistul va spune multe despre individualitatea acestui „caracter chimic”. Știm deja că caracteristica universală a unui element este sarcina pozitivă a nucleului atomic și, dacă te uiți și mai adânc, atunci numărul de particule elementare încărcate pozitiv - protoni. O creștere a numărului lor duce la o schimbare bruscă a proprietăților. Începe să opereze legea universală a naturii - legea trecerii cantității în calitate. Cu toate acestea, modificarea indicatorilor calitativi ai unui element este afectată nu numai de numărul de protoni, ci și de numărul de neutroni din nucleu. După cum sa menționat deja, elementele care au același număr de protoni în nucleu, dar un număr diferit de neutroni sunt numite izotopi. Fiecare element are propriul său număr de izotopi: unul are mai mulți, celălalt are mai puțini. Când în tabelul D.I. Mendeleev indică masa atomică a unui element ca număr fracționar, aceasta nu înseamnă că există un număr fracționar de particule elementare în nucleu, în acest caz se ia masa atomică medie a tuturor izotopilor unui element dat, ținând cont conţinutul lor cantitativ în natură. Dar dacă în experimentele exacte folosim o astfel de masă atomică „medie”, atunci acest lucru nu va fi în întregime corect, deoarece după „medie” acest izotop își pierde individualitatea, mai ales dacă izotopul este radioactiv. În practică, ele se abat și mai mult de la valoarea adevărată atunci când folosesc nu masa atomică, ci numărul de masă „A”, adică. întregul cel mai apropiat de masa atomică. Poate că, luând în considerare caracteristicile individuale ale unui element, este mai bine să luăm masa atomică a izotopului care este mai mare procentual în natură, sau cea care este cea mai stabilă/sau instabilă/, dacă vorbim de radioactiv. elemente. După cum puteți vedea, legea tranziției cantității în calitate pentru elementele chimice este implementată în două direcții: proton și neutron. După proton: apariția următorului proton în nucleu duce brusc la un nou element, iar după neutron: extinde calitatea acestui element până la apariția radioactivității. Acest lucru poate fi văzut în exemplul hidrogenului. Dacă se adaugă un proton la nucleul de hidrogen, atunci acesta neagă deja toate calitățile hidrogenului ca element /dat individ/ și îl transformă într-un nou element - heliu /i.e. într-un individ nou. Adăugarea unui neutron nu neagă elementul hidrogen în sine, ci extinde limitele calității acestuia, formând izotopul hidrogenului 2 1 H / numit deuteriu 2 1 D / și apoi izotopul 3 1 H / numit tritiu 3 1 T / . Odată cu creșterea numărului de neutroni, elementul capătă caracteristici suplimentare, în acest caz, radioactivitate. Manifestarea proprietăților radioactive de către izotopi individuali conferă acestor elemente o individualitate aparte, s-ar putea spune o individualitate periculoasă, dacă luăm în considerare elementele din punct de vedere ecologic. LA Rezumate similare: regula lui Van't Hoff. Ecuația lui Arrhenius și aplicarea acesteia. Teoria ciocnirilor active ale moleculelor care reacţionează. Fundamentele teoriei stării de tranziție. Cinetica reacțiilor eterogene. Caracteristicile proceselor eterogene. Cataliza omogenă și eterogenă. Aplicarea legii acțiunii masei pentru reacții pe suprafețe. Algoritmi pentru derivarea ecuatiilor cinetice pentru mecanisme liniare bazate pe metodele teoriei grafurilor. Aplicarea teoriei grafurilor în cinetica chimică. O succesiune de arce orientate. Efectul termic al unei reacții chimice sau modificarea entalpiei unui sistem datorită unei reacții chimice. Influența condițiilor externe asupra echilibrului chimic. Influența presiunii, concentrației și temperaturii asupra poziției de echilibru. Tipuri de legături chimice. Conceptul și tipurile de reacții complexe. Reacții reversibile de diferite ordine. Cel mai simplu caz de două reacții paralele ireversibile de ordinul întâi. Mecanismul și etapele reacțiilor succesive. Caracteristicile și viteza reacțiilor în lanț și cuplate. Probleme de cinetică chimică, etape ale unui proces chimic. Sisteme deschise și închise, legea conservării masei și energiei. Legea lui Hess și consecința ei, viteza reacțiilor. Fenomenul de cataliză, reacții omogene, eterogene, redox. În cataliza eterogenă, catalizatorul și reactanții sunt în faze diferite, cel mai adesea catalizatorul este un solid, iar reactanții sunt în stare lichidă sau gazoasă, iar reacția are loc la interfața dintre două faze, adică la suprafață. a catalizatorului. Poeto... Conceptul și subiectul de studiu al cineticii chimice. Viteza unei reacții chimice și factorii care o influențează, metode de măsurare și semnificație pentru diverse industrii. Catalizatori și inhibitori, diferența de efect asupra reacțiilor chimice, aplicare. Clasificarea catalizatorilor se bazează pe un anumit set de proprietăți sau caracteristici. Clasificare după tipul de substanțe, gradul de discretitate și colectivitatea acțiunii, după specificul structurii electronice. Utilizare în reacții chimice. Partea teoretică. Secțiunea de chimie care studiază viteza și mecanismul proceselor fizice și chimice se numește cinetică chimică. Cinetica vă permite să aflați mecanismele reale ale proceselor. În cinetica chimică se disting procese omogene și eterogene. Interpretarea reacțiilor trimoleculare după Trautz. Ecuația finală pentru viteza de reacție a luminii. Conceptul de energie de activare eficientă. Formule pentru concentrații cvasi-staționare de valențe libere. Particularitățile proceselor în lanț neramificat. Dependența unei reacții chimice de concentrația reactanților la o temperatură constantă. Viteza reacțiilor chimice în sisteme eterogene. Influența concentrației substanțelor inițiale și a produselor de reacție asupra echilibrului chimic într-un sistem omogen. Conceptele de cataliză, catalizator și proces catalitic, diferitele lor definiții. Mecanisme de accelerare a reacțiilor prin catalizatori. Cataliza chimică (nebiologică). Sinteza dietil eterului din alcool cu participarea acidului sulfuric. Teorii ale catalizei. Cinetica chimică și importanța acesteia în controlul proceselor chimice. Clasificarea reacțiilor în funcție de mediile de curgere, caracteristicile lor distinctive. Viteza reacțiilor chimice, dependența acesteia de temperatura mediului și prezența luminii. Principiul de funcționare al catalizatorilor. Procesul de ramificare a lanțului. Inițierea fotochimică. Energie de activare eficientă. Centri activi, modurile lor de formare și stingere. presiune parțială. Interpretarea limitelor de aprindere a lanțului. Practica și teoria exploziei nucleare. Viteza de transformare chimică la suprafață în regim staționar. Difuzie și modul cinetic. adsorbția la suprafață. Proces catalitic heterogen de suprafață. Regimuri limitative ale unei reacții în lanț ramificat. Ramificare și rupere. Definiția catalizei și rolul acesteia în industrie. Selectivitate și idei generale despre conceptul de „mecanism al unei reacții chimice”. Clasificarea sistemelor catalitice pe faze și tipuri de reacții. Adsorbția și cerințele de bază pentru catalizatorii industriali.



sunt caracterizate stările 2 și 5. Prin urmare, acestea corespund stării stabile a atomului.
Fundamentele Chimiei
 Nu poate exista decât o singură proiecție a unui subnivel sferic. (Fig. 2.1.), care are valoarea „zero”. Prin urmare, există un singur orbital s la subnivelul s.
Nu poate exista decât o singură proiecție a unui subnivel sferic. (Fig. 2.1.), care are valoarea „zero”. Prin urmare, există un singur orbital s la subnivelul s. nor electronic. Dacă în fiecare moment
nor electronic. Dacă în fiecare moment care nor de sarcină se numește nor de electroni. Densitatea sa, proporțională cu 2 , este o măsură directă a probabilității de a găsi un electron. Suprafața de frontieră a norului, care conține 90–95% din sarcina electronului, dă forma orbitalului.
care nor de sarcină se numește nor de electroni. Densitatea sa, proporțională cu 2 , este o măsură directă a probabilității de a găsi un electron. Suprafața de frontieră a norului, care conține 90–95% din sarcina electronului, dă forma orbitalului. Distribuția radială a densității electronilor pentru 1s
Distribuția radială a densității electronilor pentru 1s Nivelurile Pz. Deoarece m l are trei valori, atunci pe subnivelurile p
Nivelurile Pz. Deoarece m l are trei valori, atunci pe subnivelurile p are forma de calice. Toți cei trei orbitali p sunt localizați
are forma de calice. Toți cei trei orbitali p sunt localizați Figura 2.6. Z Y Y Z Z
Figura 2.6. Z Y Y Z Z

f
4f
d
4d
p
4p
s
4s
d
3d
p
3p
s
3s
n=2
––
p
2p
s
2s
n=1
–
s
1s
6p
6s
4d
5s
3d
4s
3s
2s
1s
Fig.2.9.
eu
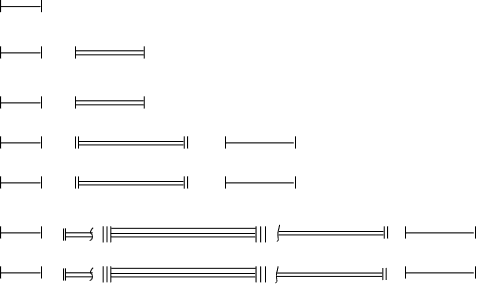
 1s2
1s2II 2s 2 2p 6
4p
3d
3p
2p






