Ce este masa atomică relativă în fizică. Formula masei atomice
Masele atomilor și moleculelor sunt foarte mici, așa că este convenabil să alegeți masa unuia dintre atomi ca unitate de măsură și să exprimați masele atomilor rămași în raport cu acesta. Este exact ceea ce a făcut fondatorul teoriei atomice Dalton, care a întocmit un tabel cu masele atomice, luând masa unui atom de hidrogen ca unitate.
Până în 1961, în fizică, 1/16 din masa unui atom de oxigen 16 O a fost luată ca unitate de masă atomică (amu prescurtat), iar în chimie - 1/16 din media masă atomică oxigen natural, care este un amestec de trei izotopi. Unitatea de masă chimică a fost cu 0,03% mai mare decât cea fizică.
În prezent, în fizică și chimie a fost adoptat un sistem unificat de măsurare. 1/12 din masa atomului de carbon 12 C este aleasă ca unitate standard de masă atomică.
1 amu \u003d 1/12 m (12 C) \u003d 1,66057 × 10 -27 kg \u003d 1,66057 × 10 -24 g.
DEFINIȚIE
Masa atomică relativă a unui element (A r)- aceasta este o cantitate adimensională egală cu raportul dintre masa medie a unui atom element și 1/12 din masa unui atom 12 C.
La calcularea masei atomice relative, se ia în considerare abundența izotopilor elementelor din scoarța terestră. De exemplu, clorul are doi izotopi 35 Cl (75,5%) și 37 Cl (24,5%).Masa atomică relativă a clorului este:
A r (Cl) \u003d (0,755 × m (35 Cl) + 0,245 × m (37 Cl)) / (1/12 × m (12 C) = 35,5.
Din definiția masei atomice relative rezultă că masa absolută medie a unui atom este egală cu masa atomică relativă multiplicată cu uma:
m(Cl) = 35,5 × 1,66057 × 10 -24 = 5,89 × 10 -23 g.
Exemple de rezolvare a problemelor
EXEMPLUL 1
| Exercițiu | În care dintre următoarele substanțe este mai mare fracția de masă a elementului oxigen: a) în oxid de zinc (ZnO); b) în oxid de magneziu (MgO)? |
| Soluţie |
Aflați greutatea moleculară a oxidului de zinc: Mr(ZnO) = Ar(Zn) + Ar(O); Mr(ZnO)=65+16=81. Se știe că M = Mr, ceea ce înseamnă M(ZnO) = 81 g/mol. Atunci fracția de masă a oxigenului din oxidul de zinc va fi egală cu: ω (O) = Ar (O) / M (ZnO) × 100%; ω(O) = 16 / 81 × 100% = 19,75%. Aflați greutatea moleculară a oxidului de magneziu: Mr(MgO) = Ar(Mg) + Ar(O); Mr (MgO) = 24+ 16 = 40. Se știe că M = Mr, ceea ce înseamnă M(MgO) = 60 g/mol. Atunci fracția de masă a oxigenului din oxidul de magneziu va fi egală cu: ω (O) = Ar (O) / M (MgO) × 100%; ω (O) = 16 / 40 × 100% = 40%. Astfel, fracția de masă a oxigenului este mai mare în oxidul de magneziu, deoarece 40 > 19,75. |
| Răspuns | Fracția de masă a oxigenului este mai mare în oxidul de magneziu. |
EXEMPLUL 2
| Exercițiu | În care dintre următorii compuși, fracția de masă a metalului este mai mare: a) în oxid de aluminiu (Al 2 O 3); b) în oxid de fier (Fe 2 O 3)? |
| Soluţie | Fracția de masă a elementului X din molecula compoziției HX se calculează prin următoarea formulă: ω (X) = n × Ar (X) / M (HX) × 100%. Să calculăm fracția de masă a fiecărui element de oxigen din fiecare dintre compușii propuși (valorile maselor atomice relative luate din Tabelul periodic al lui D.I. Mendeleev vor fi rotunjite la numere întregi). Aflați greutatea moleculară a oxidului de aluminiu: Mr (Al2O3) = 2×Ar(Al) + 3×Ar(O); Domnul (Al 2 O 3) \u003d 2 × 27 + 3 × 16 \u003d 54 + 48 \u003d 102. Se știe că M \u003d Mr, ceea ce înseamnă M (Al 2 O 3) \u003d 102 g / mol. Atunci fracția de masă a aluminiului din oxid va fi egală cu: ω (Al) \u003d 2 × Ar (Al) / M (Al 2 O 3) × 100%; ω (Al) \u003d 2 × 27 / 102 × 100% \u003d 54 / 102 × 100% \u003d 52,94%. Aflați greutatea moleculară a oxidului de fier (III): Mr (Fe 2 O 3) = 2×Ar(Fe) + 3×Ar(O); Domnul (Fe 2 O 3) \u003d 2 × 56 + 3 × 16 \u003d 112 + 48 \u003d 160. Se știe că M \u003d Mr, ceea ce înseamnă M (Fe 2 O 3) \u003d 160 g / mol. Atunci fracția de masă a fierului din oxid va fi egală cu: ω (O) \u003d 3 × Ar (O) / M (Fe 2 O 3) × 100%; ω (O) = 3×16 / 160 × 100% = 48 / 160× 100% = 30%. Astfel, fracția de masă a metalului este mai mare în oxidul de aluminiu, deoarece 52,94 > 30. |
| Răspuns | Fracția de masă a metalului este mai mare în oxidul de aluminiu. |
Orice corp are masa. Să luăm un corp ca un sac de mere. Acest corp are masă. Masa sa va fi suma masei fiecărui măr din pungă. O pungă de orez are și masa sa, care se determină prin adăugarea masei tuturor boabelor de orez, deși acestea sunt foarte mici și ușoare.
Toate corpurile sunt formate din materie. Masa unui corp este formată din masa substanțelor sale constitutive. Substanțele, la rândul lor, constau din particule, molecule sau atomi, prin urmare, particulele unei substanțe au și masă.
§ 2. Unitatea de masă atomică
Masa unui atom de oxigen este de aproximativ șaisprezece ori mai mare și este de 2,66∙ 10 -23 g, masa unui atom de carbon 1,99∙ 10 -23 g. Masa unui atom se notează -m a.
În acest caz, masa unui atom de hidrogen va fi de 1 amu, masa unui atom de oxigen va fi de 16 amu, iar masa unui atom de carbon va fi de 12 amu.
Chimiștii de multă vreme nu au avut idee cât cântărește un atom din orice element în unitățile obișnuite și convenabile pentru a măsura masa (grame, kilograme etc.).
S-au încercat să se determine de câte ori atomii unor elemente sunt mai grei decât altele. Astfel, oamenii de știință au căutat să compare masa unui atom al unui element cu masa unui atom al altui element.
Rezolvarea acestei probleme a fost, de asemenea, plină de mari dificultăți și, mai ales, de alegerea unui standard, i.e. element chimic, față de care ar trebui efectuată compararea maselor atomice ale elementelor rămase.
§3 . Masa atomică relativă
Oamenii de știință din secolul al XIX-lea au rezolvat această problemă pe baza datelor experimentale pentru a determina compoziția substanțelor. Cel mai ușor atom, atomul de hidrogen, a fost luat ca standard. Experimental, s-a descoperit că atomul de oxigen este de 16 ori mai greu decât atomul de hidrogen, adică masa relativă(față de masa atomului de hidrogen) este 16.
 Această valoare a fost indicată cu litere A r (indicele „r „- din litera inițială cuvânt englezesc„rudă” - rudă). Astfel, înregistrarea valorii maselor atomice relative ale elementelor chimice ar trebui să arate astfel: masa atomică relativă a hidrogenului este 1, masa atomică relativă a oxigenului este 16, masa atomică relativă a carbonului este 12.
Această valoare a fost indicată cu litere A r (indicele „r „- din litera inițială cuvânt englezesc„rudă” - rudă). Astfel, înregistrarea valorii maselor atomice relative ale elementelor chimice ar trebui să arate astfel: masa atomică relativă a hidrogenului este 1, masa atomică relativă a oxigenului este 16, masa atomică relativă a carbonului este 12.
Masa atomică relativă arată de câte ori masa unui atom al unui element chimic este mai mare decât masa unui atom, care este standardul, prin urmare această valoare nu are dimensiune.
După cum sa menționat deja, inițial valorile maselor atomice au fost determinate în raport cu masa atomului de hidrogen. Mai târziu, standardul pentru determinarea maselor atomice a fost 1/12 din masa unui atom de carbon (un atom de carbon este de 12 ori mai greu decât un atom de hidrogen).
Masa atomică relativă a unui element ( A r ) este raportul dintre masa unui atom al unui element chimic și 1/12 din masa unui atom de carbon.
Valorile maselor atomice ale elementelor chimice sunt date în Sistemul periodic al elementelor chimice de către D.I. Mendeleev. Aruncați o privire la tabelul periodic și luați în considerare oricare dintre celulele sale, de exemplu, la numărul 8.
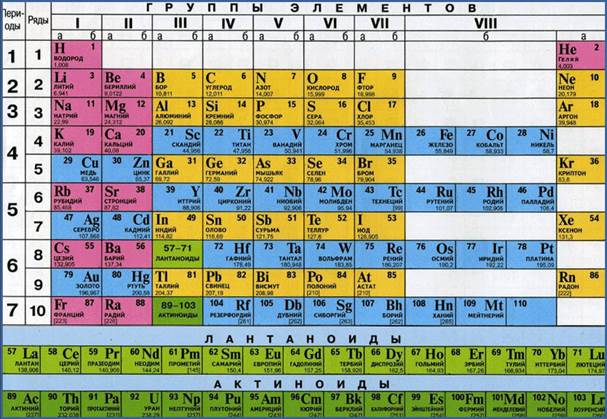
Sub semn chimic iar numele din linia de jos indică valoarea masei atomice a unui element chimic:masa atomică relativă a oxigenului este 15,9994. Vă rugăm să rețineți: masele atomice relative ale aproape tuturor elementelor chimice au o valoare fracțională. Motivul pentru aceasta este existența izotopilor. Permiteți-mi să vă reamintesc că izotopii sunt numiți atomi ai aceluiași element chimic, ușor diferiți ca masă.
La școală, calculele folosesc de obicei valorile maselor atomice relative, rotunjite la numere întregi. Dar în câteva cazuri se folosesc valori fracționate, de exemplu: masa atomică relativă a clorului este 35,5.
§ 4. Greutatea moleculară relativă
Masele atomilor se adună la masa unei molecule.
Greutatea moleculară relativă a unei substanțe este un număr care arată de câte ori masa unei molecule a acestei substanțe este mai mare decât 1/12 din masa unui atom de carbon.
Greutatea moleculară relativă se notează cu −Domnul
Greutatea moleculară relativă a substanțelor se calculează din formule chimice care exprimă compoziția substanțelor. Pentru a afla greutatea moleculară relativă, este necesar să se însumeze valorile maselor atomice relative ale elementelor care alcătuiesc molecula unei substanțe, ținând cont de compoziția cantitativă, adică de numărul de atomi ai fiecărui element. (în formule chimice se exprimă folosind indici). De exemplu, greutatea moleculară relativă a apei, care are formula H2O , este egal cu suma a două valori ale relativei
masa atomică a hidrogenului și o valoare a masei atomice relative a oxigenului:![]()
Greutatea moleculară relativă a acidului sulfuric având formula H 2 SO 4 este egal cu suma
două valori ale masei atomice relative a hidrogenului, o valoare a masei atomice relative a sulfului și patru valori ale masei atomice relative a oxigenului:![]() .
.
Greutatea moleculară relativă este o mărime adimensională. Nu trebuie confundat cu adevărata masă a moleculelor, exprimată în unități de masă atomică.
Literatură:
NU. Kuznetsova. Chimie. clasa a 8-a. Tutorial pentru institutii de invatamant. – M. Ventana-Graf, 2012.
Surse utilizate pentru designul vizual:
http://www.google.ru/imgres?imgurl=http%3A%2F%2Fwww.pskgu.ru%2Febooks%2Fkimages%2Fst000_26.jpg&imgrefurl=http%3A%2F%2Fwww.pskgu.ru%2Febooks%2Fkps018. htm&h=333&w=400&tbnid=aUsXyHOtCzUHGM%3A&zoom=1&docid=G82TADT3Vv3rxM&ei=VwB3VP7OC-a6ygP61oKQDw&tbm=isch&ved=0CEsXyHOtCzUHGM%3A&zoom=1&docid=G82TADT3Vv3rxM&ei=VwB3VP7OC-a6ygP61oKQDw&tbm=isch&ved=0CEsXyHOtCzUHGM%3A&zoom=1&docid=G82TADT3Vv3rxM&ei=VwB3VP7OC-a6ygP61oKQDw&tbm=isch&ved=0CEsQygP61oKQDw&tbm=isch&ved=0CEsQ&Vd=0CEsQ&Myct=0CEsQ&My
masă atomică este suma maselor tuturor protonilor, neutronilor și electronilor care formează un atom sau o moleculă. În comparație cu protoni și neutroni, masa electronilor este foarte mică, deci nu este luată în considerare în calcule. Deși este incorect din punct de vedere formal, acest termen este adesea folosit pentru a se referi la masa atomică medie a tuturor izotopilor unui element. De fapt, aceasta este masa atomică relativă, numită și greutate atomica element. Greutatea atomică este media maselor atomice ale tuturor izotopilor naturali ai unui element. Chimiștii trebuie să facă distincția între aceste două tipuri de masă atomică atunci când își fac treaba - o valoare incorectă a masei atomice poate duce, de exemplu, la un rezultat incorect pentru randamentul unui produs de reacție.
Pași
Aflarea masei atomice conform tabelului periodic al elementelor
- Unitatea de masă atomică caracterizează masa un mol din elementul dat în grame. Această valoare este foarte utilă în calculele practice, deoarece poate fi folosită pentru a converti cu ușurință masa unui anumit număr de atomi sau molecule ale unei anumite substanțe în moli și invers.
-
Găsiți masa atomică în tabelul periodic al lui Mendeleev. Cel mai mese standard Mendeleev conține masele atomice (greutăți atomice) ale fiecărui element. De regulă, ele sunt date ca un număr în partea de jos a celulei cu elementul, sub literele care denotă elementul chimic. Acesta nu este de obicei un număr întreg, ci o zecimală.
Amintiți-vă că tabelul periodic arată masele atomice medii ale elementelor. După cum sa menționat mai devreme, masele atomice relative date pentru fiecare element din tabelul periodic sunt mediile maselor tuturor izotopilor unui atom. Această valoare medie este valoroasă pentru multe scopuri practice: de exemplu, este utilizată la calcularea masei molare a moleculelor formate din mai mulți atomi. Cu toate acestea, atunci când aveți de-a face cu atomi individuali, această valoare de obicei nu este suficientă.
- Deoarece masa atomică medie este o medie a mai multor izotopi, valoarea dată în tabelul periodic nu este exacte valoarea masei atomice a unui singur atom.
- Masele atomice ale atomilor individuali trebuie calculate luând în considerare numărul exact de protoni și neutroni dintr-un singur atom.
Aflați cum se scrie masa atomică. Masa atomică, adică masa unui atom sau a unei molecule date, poate fi exprimată în unități SI standard - grame, kilograme și așa mai departe. Cu toate acestea, datorită faptului că masele atomice exprimate în aceste unități sunt extrem de mici, ele sunt adesea scrise în unități de masă atomică unificate, sau pe scurt a.u.m. sunt unități de masă atomică. O unitate de masă atomică este egală cu 1/12 din masa izotopului standard de carbon-12.
Calculul masei atomice a unui atom individual
-
Aflați numărul atomic al unui element dat sau izotopul acestuia. Numărul atomic este numărul de protoni din atomii unui element și nu se modifică niciodată. De exemplu, toți atomii de hidrogen și numai au un proton. Sodiul are un număr atomic de 11 pentru că are unsprezece protoni, în timp ce oxigenul are un număr atomic de opt pentru că are opt protoni. Puteți găsi numărul atomic al oricărui element în tabelul periodic al lui Mendeleev - în aproape toate versiunile sale standard, acest număr este indicat deasupra denumirii literei elementului chimic. Numărul atomic este întotdeauna un număr întreg pozitiv.
- Să presupunem că suntem interesați de un atom de carbon. Există întotdeauna șase protoni în atomii de carbon, așa că știm că numărul său atomic este 6. În plus, vedem că în tabelul periodic, în partea de sus a celulei cu carbon (C) se află numărul „6”, indicând faptul că numărul de atomi de carbon este șase.
- Rețineți că numărul atomic al unui element nu este legat în mod unic de masa sa atomică relativă din tabelul periodic. Deși, în special pentru elementele din partea de sus a tabelului, masa atomică a unui element poate părea a fi de două ori numărul său atomic, nu se calculează niciodată prin înmulțirea numărului atomic cu doi.
-
Aflați numărul de neutroni din nucleu. Numărul de neutroni poate fi diferit pentru diferiți atomi ai aceluiași element. Când doi atomi ai aceluiași element cu același număr de protoni au un număr diferit de neutroni, ei sunt izotopi diferiți ai acelui element. Spre deosebire de numărul de protoni, care nu se modifică niciodată, numărul de neutroni din atomii unui anumit element se poate schimba adesea, astfel încât masa atomică medie a unui element este scrisă ca o fracție zecimală între două numere întregi adiacente.
Adunați numărul de protoni și neutroni. Aceasta va fi masa atomică a acestui atom. Ignorați numărul de electroni care înconjoară nucleul - masa lor totală este extrem de mică, așa că au puțin sau deloc efect asupra calculelor dvs.
Calcularea masei atomice relative (greutatea atomică) a unui element
-
Determinați ce izotopi sunt în probă. Chimiștii determină adesea raportul izotopilor dintr-o anumită probă folosind un instrument special numit spectrometru de masă. Cu toate acestea, în timpul instruirii, aceste date vă vor fi furnizate în condițiile sarcinilor, controlului și așa mai departe sub formă de valori preluate din literatura științifică.
- În cazul nostru, să presupunem că avem de-a face cu doi izotopi: carbon-12 și carbon-13.
-
Determinați abundența relativă a fiecărui izotop din probă. Pentru fiecare element, diferiți izotopi apar în rapoarte diferite. Aceste rapoarte sunt aproape întotdeauna exprimate ca procent. Unii izotopi sunt foarte comuni, în timp ce alții sunt foarte rari – uneori atât de rari încât sunt greu de detectat. Aceste valori pot fi determinate folosind spectrometria de masă sau găsite într-o carte de referință.
- Să presupunem că concentrația de carbon-12 este de 99% și de carbon-13 este de 1%. Alți izotopi ai carbonului într-adevăr există, dar în cantităţi atât de mici încât în acest caz pot fi neglijate.
-
Înmulțiți masa atomică a fiecărui izotop cu concentrația sa din probă.Înmulțiți masa atomică a fiecărui izotop cu procentul său (exprimat ca zecimală). Pentru a converti procentele în zecimal, împărțiți-le la 100. Concentrațiile rezultate ar trebui să însumeze întotdeauna 1.
- Eșantionul nostru conține carbon-12 și carbon-13. Dacă carbonul-12 reprezintă 99% din probă și carbonul-13 este 1%, atunci înmulțiți 12 (masa atomică a carbonului-12) cu 0,99 și 13 (masa atomică a carbonului-13) cu 0,01.
- Cărțile de referință oferă procente bazate pe cantitățile cunoscute ale tuturor izotopilor unui element. Majoritatea manualelor de chimie includ aceste informații într-un tabel de la sfârșitul cărții. Pentru proba studiată, concentrațiile relative ale izotopilor pot fi determinate și folosind un spectrometru de masă.
-
Adunați rezultatele.Însumați rezultatele înmulțirii pe care le-ați obținut la pasul anterior. Ca rezultat al acestei operațiuni, veți găsi masa atomică relativă a elementului dvs. - valoarea medie a maselor atomice ale izotopilor elementului în cauză. Când un element este considerat ca un întreg, și nu un izotop specific al unui element dat, această valoare este cea care este utilizată.
- În exemplul nostru, 12 x 0,99 = 11,88 pentru carbon-12 și 13 x 0,01 = 0,13 pentru carbon-13. Masa atomică relativă în cazul nostru este 11,88 + 0,13 = 12,01 .
- Unii izotopi sunt mai puțin stabili decât alții: se descompun în atomi de elemente cu mai puțini protoni și neutroni în nucleu, eliberând particule care alcătuiesc nucleul atomic. Astfel de izotopi sunt numiți radioactivi.






