Care este formula substanței. Formule chimice ale substanțelor
2.1. Limbajul chimic și părțile sale
Omenirea folosește multe limbi diferite. Cu exceptia limbi naturale(Japoneză, engleză, rusă - peste 2,5 mii în total), există și limbaje artificiale de exemplu, Esperanto. Printre limbile artificiale se numără limbi variat Științe. Deci, în chimie, se folosește propriul său, limbaj chimic.
limbaj chimic- un sistem de simboluri și concepte concepute pentru înregistrarea și transmiterea concisă, concisă și vizuală a informațiilor chimice.
Un mesaj scris în majoritatea limbilor naturale este împărțit în propoziții, propoziții în cuvinte și cuvinte în litere. Dacă numim propoziții, cuvinte și litere părți ale limbii, atunci putem distinge părți similare în limbajul chimic (Tabelul 2).
Masa 2.Părți limbaj chimic
Este imposibil să stăpânești orice limbă deodată, acest lucru se aplică și limbajului chimic. Prin urmare, deocamdată, vă veți familiariza doar cu elementele de bază ale acestei limbi: învățați câteva „litere”, învățați să înțelegeți sensul „cuvintelor” și „propozițiilor”. La sfârșitul acestui capitol, veți fi prezentat titluri chimicalele sunt o parte integrantă a limbajului chimic. Pe măsură ce studiezi chimia, cunoștințele tale despre limbajul chimic se vor extinde și se vor aprofunda.
LIMBAJUL CHIMIC.
1. Ce limbi artificiale cunoașteți (cu excepția celor menționate în textul manualului)?
2. Cum diferă limbajele naturale de cele artificiale?
3. Crezi că este posibil să faci fără folosirea limbajului chimic atunci când descrii fenomene chimice? Dacă nu, de ce nu? Dacă da, care ar fi avantajele și dezavantajele unei astfel de descrieri?
2.2. Simboluri ale elementelor chimice
Simbolul unui element chimic denotă elementul în sine sau un atom al acelui element.
Fiecare astfel de simbol este un nume latin prescurtat al unui element chimic, constând din una sau două litere ale alfabetului latin (vezi Anexa 1 pentru alfabetul latin). Simbolul este scris cu majuscule. Simbolurile, precum și denumirile rusești și latine ale unor elemente, sunt date în Tabelul 3. Informații despre originea numelor latine sunt, de asemenea, date acolo. regula generala pronunția simbolurilor nu există, prin urmare, tabelul 3 arată și „citirea” unui simbol, adică modul în care acest simbol este citit într-o formulă chimică.
Este imposibil să înlocuiți numele unui element cu un simbol în vorbirea orală, dar în textele scrise de mână sau tipărite acest lucru este permis, dar nu este recomandat. elemente chimice, 109 dintre ele au nume și simboluri aprobate de Uniunea Internațională de Chimie Pură și Aplicată (IUPAC).
Tabelul 3 oferă informații despre doar 33 de elemente. Acestea sunt elementele pe care le vei întâlni mai întâi când studiezi chimia. Numele rusești (în ordine alfabetică) și simbolurile tuturor elementelor sunt prezentate în Anexa 2.
Tabelul 3Numele și simbolurile unor elemente chimice
Nume |
||||
latin |
Scris |
|||
| - | Scris |
Origine |
- | - |
| Azot | N itrogeniu | Din greaca. „născând salitrul” | "ro" | |
| Aluminiu | Al uminiu | Din lat. "alaun" | "aluminiu" | |
| Argon | Ar gon | Din greaca. "inactiv" | "argon" | |
| Bariu | Ba rium | Din greaca. " greu" | "bariu" | |
| Bor | B orum | Din arabă. "mineral alb" | "bor" | |
| Brom | Br omum | Din greaca. „urât mirositoare” | "brom" | |
| Hidrogen | H hidrogeniu | Din greaca. „nașterea apei” | "frasin" | |
| Heliu | El lium | Din greaca. "Soare" | "heliu" | |
| Fier | Fe rrum | Din lat. "sabie" | "ferrum" | |
| Aur | Au rom | Din lat. "ardere" | "aurum" | |
| Iod | eu odum | Din greaca. " violet" | "iod" | |
| Potasiu | K alium | Din arabă. "leşie" | "potasiu" | |
| Calciu | Ca lciu | Din lat. "calcar" | "calciu" | |
| Oxigen | O xigeniu | Din greaca. „producător de acizi” | " despre" | |
| Siliciu | Si liciu | Din lat. "cremene" | "siliciu" | |
| Krypton | kr ypton | Din greaca. "ascuns" | "cripton" | |
| Magneziu | M A g nesiu | Din nume peninsulele Magneziei | "magneziu" | |
| Mangan | M A n ganum | Din greaca. "purificare" | "mangan" | |
| Cupru | Cu prum | Din greaca. Nume despre. Cipru | "cuprum" | |
| Sodiu | N / A trium | Din arabă, „detergent” | "sodiu" | |
| Neon | Ne pe | Din greaca. " nou" | "neon" | |
| Nichel | Ni coloană | De la el. „cuprul Sfântului Nicolae” | "nichel" | |
| Mercur | H ydrar g yrum | Lat. "argint lichid" | "hidrgyrum" | |
| Conduce | P lum b um | Din lat. denumirea aliajului de plumb și staniu. | "plumb" | |
| Sulf | S sulf | Din sanscrită „pulbere inflamabilă” | "es" | |
| Argint | A r g entum | Din greaca. " Deschis la culoare" | "argentum" | |
| Carbon | C arboneum | Din lat. „cărbune” | "ce" | |
| Fosfor | P osfor | Din greaca. "aducator de lumina" | "pe" | |
| Fluor | F luorum | Din lat. verbul „a curge” | "fluor" | |
| Clor | Cl orum | Din greaca. "verzui" | "clor" | |
| Crom | C h r omium | Din greaca. "vopsea" | "crom" | |
| cesiu | C ae s ium | Din lat. "cer albastru" | "cesiu" | |
| Zinc | Z i n cum | De la el. "staniu" | "zinc" | |
2.3. Formule chimice
Folosit pentru a se referi la substanțe chimice formule chimice.
Pentru substanțele moleculare, formula chimică poate desemna și o moleculă a acestei substanțe.
Informațiile despre o substanță pot fi diferite, deci sunt diferite tipuri de formule chimice.
În funcție de caracterul complet al informațiilor, formulele chimice sunt împărțite în patru tipuri principale: protozoare,
molecular, structuralși spațială.
Indicele din cea mai simplă formulă nu au un divizor comun.
Indexul „1” nu este pus în formule.
Exemple dintre cele mai simple formule: apă - H 2 O, oxigen - O, sulf - S, oxid de fosfor - P 2 O 5, butan - C 2 H 5, acid fosforic - H 3 PO 4, clorură de sodiu (sare de masă) - NaCl.
Cea mai simplă formulă a apei (H 2 O) arată că apa conține elementul hidrogen(H) și element oxigen(O), și în orice porțiune (o porțiune este o parte din ceva care poate fi divizat fără a-și pierde proprietățile.) de apă, numărul de atomi de hidrogen este de două ori mai mult număr atomi de oxigen.
Numărul de particule, inclusiv număr de atomi, notat cu litera latină N. Indicând numărul de atomi de hidrogen - N H , iar numărul de atomi de oxigen este N O, putem scrie asta
Sau N H: N O=2:1.
Cea mai simplă formulă a acidului fosforic (H 3 PO 4) arată că acidul fosforic conține atomi hidrogen, atomi fosforși atomi oxigen, iar raportul dintre numărul de atomi ai acestor elemente din orice porțiune de acid fosforic este 3:1:4, adică
NH: N P: N O=3:1:4.

Cea mai simplă formulă poate fi întocmită pentru orice individ chimic, iar pentru o substanță moleculară, în plus, poate fi compusă formulă moleculară.
Exemple de formule moleculare: apă - H 2 O, oxigen - O 2, sulf - S 8, oxid de fosfor - P 4 O 10, butan - C 4 H 10, acid fosforic - H 3 PO 4.
Substanțele nemoleculare nu au formule moleculare.
Secvența de scriere a simbolurilor elementelor în cele mai simple și moleculare formule este determinată de regulile limbajului chimic, pe care le vei învăța pe măsură ce studiezi chimia. Secvența caracterelor nu afectează informațiile transmise de aceste formule.
Dintre semnele care reflectă structura substanțelor, le vom folosi până acum doar lovitură de valență(„liniuță”). Acest semn arată prezența între atomii așa-numitului legătură covalentă(ce fel de conexiune este aceasta și care sunt caracteristicile ei, veți afla în curând).
În molecula de apă, atomul de oxigen este conectat prin legături simple (single) cu doi atomi de hidrogen, iar atomii de hidrogen nu sunt legați între ei. Aceasta este ceea ce arată clar formula structurala apă. ![]()
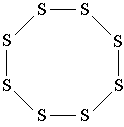
Un alt exemplu: molecula de sulf S 8 . În această moleculă, 8 atomi de sulf formează un ciclu cu opt membri în care fiecare atom de sulf este conectat la alți doi atomi prin legături simple. Comparați formula structurală a sulfului cu modelul tridimensional al moleculei acestuia prezentat în fig. 3. Vă rugăm să rețineți că formula structurală a sulfului nu transmite forma moleculei sale, ci arată doar succesiunea atomilor de legătură prin legături covalente.
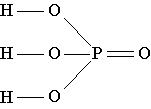
Formula structurală a acidului fosforic arată că în molecula acestei substanțe unul dintre cei patru atomi de oxigen este conectat doar cu atomul de fosfor printr-o legătură dublă, iar atomul de fosfor, la rândul său, este conectat cu încă trei atomi de oxigen prin legături simple. . Fiecare dintre acești trei atomi de oxigen, în plus, este conectat printr-o legătură simplă cu unul dintre cei trei atomi de hidrogen prezenți în moleculă./p>
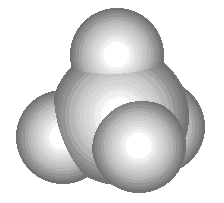
Comparați următorul model tridimensional al moleculei de metan cu formula sa spațială, structurală și moleculară:
|
|
|
În formula spațială a metanului, loviturile de valență în formă de pană, parcă în perspectivă, arată care dintre atomii de hidrogen este „mai aproape de noi” și care este „mai departe de noi”.
Uneori, formula spațială indică lungimile legăturilor și valorile unghiurilor dintre legăturile din moleculă, așa cum se arată în exemplul moleculei de apă.

Substanțele nemoleculare nu conțin molecule. Pentru comoditatea calcule chimiceîntr-o substanță nemoleculară, așa-numita unitate de formulă.
Exemple de compoziție a unităților de formulă ale unor substanțe: 1) dioxid de siliciu (nisip de cuarț, cuarț) SiO 2 - unitate de formulă constă dintr-un atom de siliciu și doi atomi de oxigen; 2) clorură de sodiu (sare comună) NaCl - unitatea de formulă constă dintr-un atom de sodiu și un atom de clor; 3) fier Fe - o unitate de formulă constă dintr-un atom de fier.Asemenea unei molecule, o unitate de formulă este cea mai mică porțiune a unei substanțe care își păstrează proprietățile chimice.
Tabelul 4
Informații transmise de diferite tipuri de formule
Tipul formulei |
Informația trecută prin formulă. |
|
| Protozoare Molecular Structural Spațial |
|
|
Să luăm acum în considerare, cu exemple, ce ne oferă formulele de informații de diferite tipuri.
1. Substanță: acid acetic. Cea mai simplă formulă este CH 2 O, formula moleculară este C 2 H 4 O 2, formula structurală
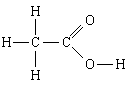
Cea mai simplă formulă ne spune că
1) acidul acetic conține carbon, hidrogen și oxigen;
2) în această substanță, numărul de atomi de carbon este legat de numărul de atomi de hidrogen și de numărul de atomi de oxigen, ca 1:2:1, adică N H: N C: N O = 1:2:1.
Formulă moleculară adaugă că
3) într-o moleculă de acid acetic - 2 atomi de carbon, 4 atomi de hidrogen și 2 atomi de oxigen.
Formula structurala adaugă că
4, 5) în moleculă, doi atomi de carbon sunt legați printr-o singură legătură; unul dintre ei, în plus, este asociat cu trei atomi de hidrogen, cu fiecare legătură simplă, iar celălalt cu doi atomi de oxigen, cu o legătură dublă, iar cu celălalt o legătură simplă; ultimul atom de oxigen este, de asemenea, legat printr-o legătură simplă de al patrulea atom de hidrogen.
2. Substanță: clorura de sodiu.
Cea mai simplă formulă este NaCl.
1) Clorura de sodiu conține sodiu și clor.
2) În această substanță, numărul de atomi de sodiu este egal cu numărul de atomi de clor.
3. Substanță: fier.
Cea mai simplă formulă este Fe.
1) Compoziția acestei substanțe include numai fier, adică este o substanță simplă.
4. Substanță: acid trimetafosforic . Cea mai simplă formulă este HPO 3, formula moleculară este H 3 P 3 O 9, formula structurală
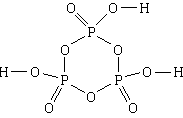
1) Compoziția acidului trimetafosforic include hidrogen, fosfor și oxigen.
2) N H: N P: N O = 1:1:3.
3) O moleculă este formată din trei atomi de hidrogen, trei atomi de fosfor și nouă atomi de oxigen.
4, 5) Trei atomi de fosfor și trei atomi de oxigen, alternând, formează un ciclu cu șase membri. Toate linkurile din ciclu sunt simple. Fiecare atom de fosfor, în plus, este asociat cu încă doi atomi de oxigen, cu unul - o legătură dublă, iar celălalt - una simplă. Fiecare dintre cei trei atomi de oxigen legați prin legături simple la atomii de fosfor este, de asemenea, legați printr-o legătură simplă la un atom de hidrogen.
| Acid fosforic - H3PO4(un alt nume este acid fosforic) - transparent incolor substanță cristalină structura moleculara, topindu-se la 42 o C. Aceasta substanta este foarte solubila in apa si chiar absoarbe vaporii de apa din aer (higroscopic). Acidul fosforic este produs în cantități mari și este utilizat în primul rând în producția de îngrășăminte fosfatice, precum și în industria chimică, în producția de chibrituri și chiar în construcții. În plus, acidul fosforic este folosit la fabricarea cimentului în tehnologia dentară, face parte din multe medicamente. Acest acid este suficient de ieftin încât în unele țări, cum ar fi Statele Unite, acid fosforic foarte pur, foarte diluat cu apă, este adăugat la băuturi răcoritoare pentru a înlocui acidul citric scump. |
| Metan - CH 4. Dacă ai acasă o sobă pe gaz, atunci dai peste această substanță în fiecare zi: gazul natural care arde în arzătoarele aragazului tău este 95% metan. Metanul este un gaz incolor și inodor, cu punctul de fierbere de -161 o C. Atunci când este amestecat cu aerul, este exploziv, ceea ce explică exploziile și incendiile care apar uneori în minele de cărbune (o altă denumire a metanului este clapeta). A treia denumire a metanului - gazul de mlaștină - se datorează faptului că bulele acestui gaz particular se ridică din fundul mlaștinilor, unde se formează ca urmare a activității anumitor bacterii. În industrie, metanul este folosit ca combustibil și materie primă pentru producerea altor substanțe.Metanul este cel mai simplu hidrocarbură. Această clasă de substanțe include și etanul (C 2 H 6), propanul (C 3 H 8), etilena (C 2 H 4), acetilena (C 2 H 2) și multe alte substanțe. |
Tabelul 5.Exemple de formule de diferite tipuri pentru unele substanțe-