Suyun füzyon ısısı. Sürahi filtreler, kartuşlar. Uzay roketi nozulu
Su arıtma
sürahi filtreleri, kartuşlar
Değişiklikleri için buz özellikleri
İleti:
Merhaba Oleg, Kuzbass Eyaleti ikinci sınıf öğrencisiyim teknik enstitü, yapmak bilimsel çalışma. Ve bir problemle karşılaştım: Buzun özelliklerini tüm modifikasyonları (özgül füzyon ısısı, özgül direnç, enine ve boyuna yayılma hızı) için hiçbir yerde bulamıyorum. ses dalgaları, katsayı bu dalgaların emilimi, çatlama eğilimi ve mekanik özellikler). Size içtenlikle minnettar olacağım bu konularda bildiğiniz bilgileri bana "atabilir misiniz"?
Aynı madde daha düşük atmosferik basınç daha düşük özgül ısıya sahiptir. Duyarlı ısı, bir organizmanın moleküler yapısını etkilemeden alabileceği ısı miktarıdır. Değişmezse, moleküler yapı durum değiştirmez. Moleküler yapı değişmediği için sıcaklıkta bir değişiklik olur, bu nedenle buna ısı kapasitesi denir.
Gizli ısı, bir maddenin fazını değiştirmek için gereken enerjidir. Katıdan sıvıya değişim ise termonükleer ısı olarak adlandırılır. Sıvıdan gaza geçiş ise buharlaşma ısısı olarak adlandırılır. Durumunu değiştirdiği sıcaklığa ulaşmış bir maddeye ısı uygulandığında, sıcaklığı yükseltmek mümkün değildir, sadece durumunu değiştirmek mümkündür. Maddeye bağlı olarak, gizli ısı genellikle gram başına kalori veya kilogram başına kilojul olarak ölçülebilir.
Merhaba Dmitry.
maalesef böyle tüm bilgiler fiziksel ve mekanik özelliklere sahip değilim, çünkü özellikle buzu ve özelliklerini incelemedim. İşte bu konu hakkında bildiklerim:
Doğada, 14 buz modifikasyonu bilinmektedir. Doğru, altıgen eş zamanlılıkta kristalleşen ve buz I olarak adlandırılan, bize tanıdık gelen buz dışındaki her şey, egzotik koşullar altında oluşur - çok düşük sıcaklıklarda (yaklaşık -110150 0 C) ve yüksek basınçlarda, su molekülündeki hidrojen bağlarının açıları değişir ve altıgen dışında sistemler oluşur. Bu tür koşullar kozmik koşulları anımsatır ve Dünya'da bulunmaz. Örneğin, -110 ° C'nin altındaki sıcaklıklarda, su buharı, birkaç nanometre boyutunda oktahedronlar ve küpler şeklinde metal bir plaka üzerinde çökelir - bu sözde kübik buzdur. Sıcaklık -110 °C'nin biraz üzerindeyse ve buhar konsantrasyonu çok düşükse, plaka üzerinde son derece yoğun amorf bir buz tabakası oluşur.

Su: gizli ısı erime noktası: gram başına 80 kalori, gizli buharlaşma ısısı: gram başına 540 kalori. Çelik: Gizli füzyon ısısı: 50 kalori. Magnezyum: Gizli füzyon ısısı: 72 kalori. Nikel: Gizli füzyon ısısı: 58 kalori. Oksijen: Gizli füzyon ısısı: 3 kalori.
Çinko: Gizli füzyon ısısı: 28 kalori. Buz Kalorimetresi: Üniversite Kimya Öğretimine Tarihsel ve Deneysel Bir Yaklaşım. Bir buz kalorimetresinin ısıdaki yavaş değişimleri ölçebilmesinin olağan avantajına ek olarak, burada açıklanan aletin yapımı ve çalıştırılması son derece basittir. Alüminyum, bakır, kurşun ve kalay metallerinin özgül ısıları, hazır malzemelerden yapılmış bir buz kalorimetresi kullanılarak belirlendi.
Buz, sıcaklık, basınç, yoğunluk ve geçirgenliğin yapısal modifikasyonlarına ilişkin bazı veriler Tablo 1 ve Tablo 2'de gösterilmektedir.
Sekme. bir . - Buz modifikasyonlarının yapıları hakkında bazı veriler
Not. 1A=10 -10 m.
Sekme. 2 . - Sıcaklık, basınç, yoğunluk ve dielektrik sabitiçeşitli buz
Anahtar Kelimeler: Lavoisier; kalorimetre; özısı. Kalori iletişiminde kalori ve anti-sosyal eylemler için madalya. Bunun nasıl yapılacağına bakacağız. İlaç hastalıklarının tedavisi için ilaç kalorimetrisinin öngörücüleri olarak, tedavi için kullanılan uygulamalar, sağlık durumu üzerinde yeterli kontrol yoktur ve çevre.
Genel sıcaklığa, hakim aquedido'ya göre uluslararası alıcı yok. Оооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооеееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееее. "Mekanik teoriler"e göre de, Yunan kökenli, ısı, maddenin kurucu parçacıklarının hareketinden kaynaklanır. Lavoisier ve Laplace, ısının, yoğunluğu kütle çarpı hızın karesi ile orantılı olan, moleküllerin duyarsız hareketlerinden kaynaklanan canlı bir güç olduğu mekanik hipotezinden bahsettiler.
Tüm buz modifikasyonlarının kristalleri, hidrojen bağlarıyla üç boyutlu bir çerçeveye bağlanan H2O su moleküllerinden yapılmıştır ( pilav. bir ). Su molekülü basitçe bir tetrahedron (üçgen tabanlı piramit) olarak hayal edilebilir. Merkezinde iki köşede bir oksijen atomu bulunur - elektronları oluşumda yer alan bir hidrojen atomu tarafından kovalent bağ oksijen ile. Kalan iki köşe çiftler tarafından işgal edilir değerlik elektronları molekül içi bağların oluşumuna katılmayan oksijen, bu nedenle yalnız denir.
Bundan, bir cisimler karışımında ısının korunumu ilkesini ve bir dizi kombinasyon veya durum değişikliğinden sonra orijinal durumuna geri döndüğünde salınan ve emilen ısı toplamının değişmezliği ilkesini çıkardılar. Herhangi bir hipotez öne sürmediler, ancak doğru olabileceklerini eklediler. 2, 3. Lavoisier, kalorilerin büyük bir savunucusuydu. Bu teori, iç kısımlarındaki tüm cisimlerin görünmez olduğuna inanıyordu. sıvı madde aşağılık kütle, kalori içeriği, daha yüksek sıcaklıktaki bir cismin, daha düşük sıcaklıktaki diğerinden daha yüksek bir kalorifik değere sahip olmasıdır. 9, 10.
Şekil 1 . Buz yapısıben.
Buz en çok araştırılan bendoğal modifikasyon. Buzun yapısında, her su molekülü, tetrahedronun köşelerine yönelik 4 bağa katılır. Bir molekülün bir protonu, başka bir molekülün bir çift paylaşılmamış oksijen elektronu ile etkileşime girdiğinde, molekül içi bir bağdan daha az güçlü, ancak bitişik su moleküllerini yakınlarda tutacak kadar güçlü bir hidrojen bağı ortaya çıkar. Her molekül, donma sırasında yoğun bir yapının oluşturulmasına izin vermeyen tetrahedronun köşelerine yönelik 109 ° 28 "'e eşit kesin olarak tanımlanmış açılarda diğer moleküllerle aynı anda dört hidrojen bağı oluşturabilir. Aynı zamanda buz yapılarında ben, ic, VII ve VIII bu tetrahedron doğrudur. buzun yapısında II, III, V ve VI tetrahedra belirgin şekilde bozulmuştur. buzun yapısında VI, VII ve VIII Karşılıklı olarak kesişen 2 hidrojen bağı sistemi ayırt edilebilir. Hidrojen bağlarının bu görünmez iskelesi, yapı olarak içi boş kanallara sahip bir bal peteğine benzer şekilde, molekülleri bir ağ ağı içinde düzenler. Buz ısıtılırsa ağ yapısı çöker: su molekülleri ağın boşluklarına düşmeye başlar ve daha yoğun bir sıvı yapıya yol açar - bu nedenle su buzdan daha ağırdır.
Madde olarak kalorik düşünme teorisi, enerji olarak ısı teorisi lehine terk edildi, çünkü esas olarak nesnelerin ısınması bir ısı kaynağı dışında açıklanamaz. Isı, enerji akışı gibi, temas halindeyken daima en yüksek sıcaklıktaki bir sistemden daha düşük sıcaklıktaki bir sisteme geçer. on bir.
Sürahi filtreler, kartuşlar
Yıllar geçtikçe, ısı araştırması, bilimsel öncüdeki baskın konumundan düştü ve bu da Kimya'nın genel yapısında kesin bir konum olduğunu düşündürdü. Şu anda, kalorimetri kimyagerler için değerli veriler ve bununla ilgili teorilerin geliştirilmesini sağlar. kimyasal etkileşimler. 1.
Buzun yapısında ve özelliklerinde pek çok şey olağandışı görünüyor. Buz kristali kafesinin yerlerinde oksijen atomları düzenli bir şekilde düzenlenir, düzenli altıgenler oluşturur ve hidrojen atomları bağlar boyunca çeşitli konumlarda bulunur. Bu nedenle, komşularına göre su moleküllerinin 6 eşdeğer yönelimi mümkündür. Aynı hidrojen bağı üzerinde aynı anda 2 proton bulunması olası olmadığı için bazıları hariç tutulur, ancak su moleküllerinin yöneliminde yeterli bir belirsizlik kalır. Atomların bu davranışı atipiktir, çünkü katı bir maddede herkes aynı yasaya uyar: ya tüm atomlar sıralanır ve sonra bir kristal ya da rastgele ve sonra amorf bir maddedir. Böyle sıra dışı bir yapı, çoğu buz modifikasyonunda gerçekleştirilebilir - I, III, V, VI ve VII(ve görünüşe göre ic) ve buzun yapısında II, VIII ve IX su molekülleri oryantasyonel olarak sıralanmıştır. J. Bernal'e göre buz, oksijen atomlarına göre kristal ve hidrojen atomlarına göre camsı yapıdadır.
Eriyen buzun ısısının ve suyun doğada kristalleşmesinin rolü
Bu çalışmanın amacı, son derece basit bir izotermal kalorimetrik sistemde kurulacak ve işlenecek, hazır malzemelerle yapılmış, elde edilen değerleri bilinen teorik değerlerle karşılaştırarak, kullanım olasılığını gösteren metalik cisimlerin özgül ısı kapasitesini belirlemekti. Bu tür kalorimetre. Bu staj, lisans laboratuvarları için mükemmel bir iş teklifidir.
Kalorimetrik bir sistemin oluşturulması. Bu çalışmada önerilen Lavoisier kalorimetre ve kalorimetrenin karşılaştırmalı bir görüntüsü var. Strafor kutuda, biri hortumun geçmesine izin vermek için kutunun altında, diğeri kutunun yan tarafında olmak üzere, erimiş buzun straforun içinden toplanmasını sağlayan iki delik açılmıştır. Tencere, bir tripod tarafından desteklenen strafor içine yerleştirildi.
Yine de atmosferik basınçta oluşan ve 0 °C'de eriyen sıradan buz, en bilinen ancak hala tam olarak anlaşılamayan maddedir. Bağlantılı olarak yaygın Yeryüzünde su ve buz, buzun özellikleri ile diğer maddelerin özellikleri arasındaki fark, doğal süreçlerde önemli bir rol oynar. Suyun yoğunluğundan daha düşük yoğunluğu nedeniyle buz, suyun yüzeyinde nehirleri ve rezervuarları dip donmasından koruyan yüzen bir örtü oluşturur. Çok kristalli buzda akış hızı ve stres arasındaki ilişki hiperboliktir; bir güç denklemi ile yaklaşık bir açıklamasıyla, voltaj arttıkça üs de artar.
Kalorimetre için iki beher destek görevi gördü. Metal gövdeler, ısıtma sırasında kalorimetrenin yanında bulunan bir manyetik karıştırıcı üzerinde ısıtıldı. Alüminyum bir kahve makinesinde tel ile kaplanmış metal bir kabuk kullanılarak inşa edilmiş ucuz bir buz kalorimetre devresi görülebilir. Kahve makinesi bir strafor kutuya yerleştirildi. Deney için kahve makinesi ve strafor kutusu buzla doldurulmuştur. Buzu eritmek için iki musluk yerleştirildi: biri kahve makinesinin dibine, diğeri strafor üzerine.
Ek olarak, buz akış hızı, aktivasyon enerjisiyle doğru orantılı ve mutlak sıcaklıkla ters orantılıdır, böylece azalan sıcaklıkla buz, özelliklerinde mutlak değere yaklaşır. sağlam vücut. Ortalama olarak, erimeye yakın bir sıcaklıkta buzun akışkanlığı, kayalardan 106 kat daha fazladır. Akışkanlığı nedeniyle buz tek bir yerde birikmez, sürekli buzullar şeklinde hareket eder.
Erimiş buz kütlesini belirlemek için musluktan boşaltılan su bir kapta toplandı. Metallerin özgül ısı kapasitesinin belirlenmesi. Deney için, strafor kutu, iç kabın kenarına kadar tamamen kırılmış buzla dolduruldu. Önceden tartılmış bir metal numunesi, 96°C'de 10 dakika boyunca 600 ml su içeren bir beher içindeki bir metal drenaja yerleştirildi. Metal numunenin kalorimetreye eklenmesinden birkaç dakika önce, iç kap kısmen buzla doldurulmuştur. Isıtılmış metal kasa hızla kalorimetreye eklendi ve kalorimetre içindeki metalin yüzeyine bir miktar buz atıldı.
Kulağa ne kadar garip gelse de buzun erimesi zordur. Su moleküllerini birbirine bağlayan hidrojen bağları olmasaydı, su -90°C'de erirdi. Aynı zamanda, donarken, çoğu durumda olduğu gibi, suyun hacminde azalma olmaz. bilinen maddeler, ve artar - bir buz ağ yapısının oluşumu nedeniyle.
Buzun (0,45) ve karın (0,95'e kadar) çok yüksek yansıtıcılığı nedeniyle, kapladıkları alan yılda ortalama 72 milyon hektardır. km 2 her iki yarım kürenin yüksek ve orta enlemlerinde - normalden %65 daha az güneş ısısı alır ve güçlü bir soğutma kaynağıdır yeryüzü modern enlem iklimsel bölgeliliğini büyük ölçüde belirleyen . Yaz aylarında, kutup bölgelerinde güneş radyasyonu ekvator kuşağından daha fazladır, ancak sıcaklık düşük kalır, çünkü emilen ısının önemli bir kısmı çok yüksek bir erime ısısına sahip olan eriyen buza harcanır.
On beş dakika, metalin buzla temas ettiği toplam süre olan bir zamanlayıcı ile işaretlendi. 15 dakika sonra musluktan belli bir miktar su alındı. Bu erimiş buz kütlesi, metalin özgül ısısını belirlemek için tartıldı. Analiz sadece deneylerin referans numunesi olarak kullanılması gereken bir sepet ile gerçekleştirilmiştir. Tüm analizler 5 tekrarlı olarak yapılmıştır.
Ne zaman iki sistem farklı sıcaklıklarısıl olarak yalıtılmış bir kap içine yerleştirildiğinde, aralarındaki ısıl dengeye ulaşılana kadar sistemden en yüksek sıcaklığa, en düşük sıcaklıktaki sisteme ısı şeklinde bir enerji transferi olur. Bu ilke, termodinamiğin sıfırıncı yasasıdır.
Buzun diğer olağandışı özellikleri arasında üreme vardır. Elektromanyetik radyasyon büyüyen kristalleri. Suda çözünen yabancı maddelerin çoğunun buz büyümeye başladığında buza aktarılmadığı bilinmektedir; donuyorlar. Bu nedenle, en kirli su birikintisinde bile buz tabakası temiz ve şeffaftır. Bu durumda, katı ve sıvı ortamın sınırında iki katman şeklinde safsızlıklar birikir. elektrik ücretleriönemli bir potansiyel farklılığa neden olan farklı işaret. Yüklü kirlilik tabakası alt sınır ile birlikte hareket eder. genç buz ve elektromanyetik dalgalar yayar. Bu sayede kristalleşme süreci detaylı olarak gözlemlenebilir. Bu nedenle, bir iğne şeklinde uzunlamasına büyüyen bir kristal, yanal süreçlerle kaplanmış olandan farklı bir şekilde yayılır ve büyüyen tanelerin radyasyonu, kristaller çatladığında meydana gelenden farklıdır. Radyasyon darbelerinin şekli, sırası, frekansı ve genliğinden buzun donma hızı ve ne tür bir buz yapısının elde edildiği belirlenebilir.
Böylece öz ısısı yüksek olan bir malzeme, öz ısısı düşük olan bir malzemeden çok daha yavaş ısıtılır ve soğutulur. Özgül ısı değerinin sıcaklığa bağlı olarak küçük sapmalara sahip olduğuna dikkat etmek önemlidir. 10. İzotermal kalorimetre geliştirilecek ilk kişiydi ve içinde kalorimetrik deney yapıldı. Sabit sıcaklık. 1 Bir buz kalorimetresinde, ısı metalden diğerine aktarılır. Yüksek sıcaklık buza, erimesine neden olur.
Bu sistem çevreden termal olarak izole edildiğinden, metal tarafından alınan ısı miktarı buz tarafından emilen ısı miktarına eşittir, bu da Denklem 1 ve 2'ye eşittir. Böylece, tüm cisimlerin özgül ısı kapasiteleri, suyun referans organ olarak hareket ettiği Denklem 3 ile belirlenebilir.
Sekme. 3 . - Buzun bazı özellikleri I
| Mülk | Anlam | Not |
| Isı kapasitesi, kal/(G°C) erime ısısı, cal/g Buharlaşma ısısı, cal/g | Azalan sıcaklıkla güçlü bir şekilde azalır |
|
| Termal genleşme katsayısı, 1/°C Deney üç kopya halinde gerçekleştirildi. Sadece 1 dakika sonra metal kalorimetreye yerleştirildi ve ilk damlalar görünmeye başladı. Elde edilen sonuçlar literatürde bulunanlara çok yakındır ve Tablo 1'de sunulmuştur. Sonuçlar, bu basit sistemin metallerin özgül ısı kapasitelerini belirlemek için öğretim uygulamalarında kullanılabileceğini göstermiştir. Deneysel veriler arasındaki fark, ortam sıcaklığındaki farklılıklardan ve su akışını engelleyen buz bloklarının oluşumundan kaynaklanmalıdır. Lavoisier'in zamanının birçok bilim adamı, bir buz kalorimetresi kullanarak tutarlı sonuçlar elde etmeyi zor buldu, çünkü o zamanlar strafor gibi yalıtkan malzemelere sahip değildiler ve o sırada kullanılan kuzu derilerinden daha uygun bir yalıtım sağlıyorlardı. Ancak, kışın harika sonuçlar aldılar. | 9.1 10 -5 (0°C) | |
| Termal iletkenlik, kal/(cm saniye°C) | ||
| Kırılma indisi: sıradan bir ışın için olağanüstü ışın için | ||
| Spesifik elektrik iletkenliği, ohm -1 ·santimetre -1 | Görünür aktivasyon enerjisi 11 kcal/mol Böyle bir deney, lisans öğrencilerinin son derece önemli kimyager Antoine Laurent Lavoisier'in tarihi ve çalışmaları ile bağlantı kurmasını sağlayacaktır. Isı, özgül ısı ve termodinamiğin sıfırıncı yasası gibi önemli kavramları dahil etmenin yanı sıra hafif bir izotermal kalorimetre oluşturulmasına izin verir. Ayrıca, bilimin koruyucularının dehasını gösterir ve öğrencilerin kimyanın gelişiminin temel taşları olan bu bilim adamlarının deneylerini yeniden üretmelerine olanak tanır. Sonuçlar, literatürdekilere yakın belirli ısı kapasitelerinin tutarlı değerlerini bulmanın mümkün olduğunu göstermiştir. Gizli ısının buz gibi erimesi. Buzun füzyonunun gizli ısısı, su fiziksel durumunu değiştirdiğinde olan şeydir. Bu özel durumda, katı hal bir sıvıya. |
|
| yüzey elektrik iletkenliği, ohm -1 | Görünür aktivasyon enerjisi 32 kcal/mol |
|
| Gencin modülü din/cm | 9 10 10 (-5°C) | polikristal buz |
| Direnç, Mn/dk 2 : ezici | polikristal buz polikristal buz Isının bir enerji şekli olduğuna ve kalorimetre ile kalorimetre arasındaki ısı alışverişinin olduğuna inanılmaktadır. dış ortam ihmal edilebilir, buz, su ve bir alüminyum kaptan oluşan bir sistem için varsayabiliriz. Alınan ısı miktarı = verilen ısı miktarı. Ve yukarıdaki denklemdeki modül, alınan ısı miktarı negatif olduğu için ayarlanmıştır. Yukarıdaki bu denklemden, eğer ikinci denklem. Bu sapmalar denklem kullanılarak yayılır. Denklemde kısmi türevler uygulayarak. Alüminyum kabın ağırlığını ölçün ve not edin; Bir test tüpü kullanarak, kap ve alüminyumun içine 300 ml musluk suyu döküyoruz ve setin kütlesini ölçüyoruz; Ayarlanan sıcaklığı ölçtük; Kap ile cam arasındaki havanın ilk sıcaklığını ölçüyoruz; Buzun içindeki cam kütlesini ölçün; Tüm buzu, içinde su bulunan bir alüminyum küvete döküyoruz; Üründe kullanılan camı ölçüyoruz; Denge sıcaklığını kaydedin; Cam ve kap arasındaki hava sıcaklığını ölçüyoruz. polikristal buz |
|
| Ortalama etkin viskozite, pz | polikristal buz |
|
| Akışın güç yasasının üssü | ||
| Deformasyon ve mekanik gevşeme sırasında aktivasyon enerjisi, kcal/mol | 0,0361 ile doğrusal artan kalori/(köstebek°C) 0 ila 273.16 K |
Not. 1 kal / (g ° C) \u003d 4.186 kjl(kilogram(İLE) ; 1 ohm -1 santimetre -1 =100 sim/m; 1 din/cm=10 -3 n/m; 1 kal/(santimetre(saniye°С)=418.68 sal/(m(İLE) ; 1 pz= 10 -1 n(saniye/dk 2 .
Doğal buzben genellikle sudan çok daha temizdir, çünkü maddelerin (NH 4 F hariç) buzdaki çözünürlüğü son derece düşüktür. Ice II ise sadece eser gazların varlığında stabilize olur; saf haliyle, istikrarsızlığı nedeniyle kimse onu almadı. Örneğin, helyum yardımıyla basınç oluşturulursa, kesinlikle dondurucu suda çözülür. Bu kurulumda kullanıma uygun başka bir soy gaz olan argonun da buzla katı çözeltiler oluşturabildiğine dair kanıtlar vardır. Bununla birlikte, hiç kimse, asal gazlarla bu tür klatrat buz bileşiklerini özel olarak incelememiştir.
Buz II, III ve V modifikasyonları Sıcaklık -170°C'yi geçmezse, atmosfer basıncında uzun süre saklanır. Yaklaşık -150 °C'ye ısıtıldığında buz küp buzic.
bulunan buz II arasındaki durum diyagramında Buz III ve buz IX. Protonların sıralamasında birbirlerinden farklıdırlar, oksijen çerçeveleri ise aynıdır: bazı su moleküllerinin spiralleri, sanki diğer su moleküllerinin eksenlerine bağlıymış gibi. Bir protonun şu veya bu yeri işgal etme olasılıkları eşit olduğunda, buz düzensiz olacaktır.
Pirinç. 2. durum diyagramı kristal buz
Bununla birlikte, kural olarak, egzotik buzlarla yapılan tüm deneyler, kuru buz, sıvı nitrojen ve hatta helyum sıcaklıklarına soğumaları ve ayrıca binlerce atmosfer basıncına sıkıştırma ile ilişkilidir. Genel görünüm bakarak sonuçlara ulaşılabilir. resim, kristal buzun durum diyagramının gösterildiği yer.
Birçok yüksek basınçlı buz normal basınçta saklanabilir. Bunu yapmak için sıvı nitrojen içinde soğutulurlar ve ardından basınç serbest bırakılır. Ana çalışmaların yapıldığı sertleşmiş buz üzerindeydi. Yapılarının çok çeşitli olduğunu gösterdiler.
İlk yüksek basınçlı buzun yapısı, Buz II, bu alandaki araştırmaların başlangıcında, X-ışını kırınımı için ilk güçlü araçların 1964'te ortaya çıktığı zaman tespit edildi. Görünüşe göre, bu buz altı bağlantılı oluklu döngülerden oluşan içi boş sütunlardan oluşuyor. Her sütun, birbirine göre periyodun üçte biri kadar kaydırılmış, aynı sütunlardan altı tanesiyle çevrilidir. Bu buzun yapısı, I h'nin peteklerinin bir kısmı kırılır ve geri kalan petekleri birbirine bağlayan delikli çerçevelere dönüştürülürse elde edilebilir. Bu durumda, ortaya çıkan altıgen kanalların boyutu büyük ölçüde artar - en geniş kanallara sahip olan buz II'dir, çapları 3 Å'dir. Bu tür kanallar helyum, neon ve hatta hidrojen molekülleri içerebilir.
Pirinç. 3 . Buz yapısıII
Helyum gibi soy gaz hidratlar, buz II'den iki şekilde elde edilebilir. İlk olarak, (bir helyum atmosferinde) suya 0,28–0,5 GPa'lık bir basınç uygulayın ve suyu 250–270K'ya soğutun. Buz III ve V diyagramın bu bölgesinde kararlı olmasına rağmen, buz II'ye dayalı bir hidrat elde edilecektir. İlginçtir ki, içindeki protonlar zaten sıralanmıştır. (Genellikle, yalnızca önceden oluşturulmuş buz güçlü bir şekilde soğutulduğunda sipariş edilirler.)
İkincisi, helyumu çözmek mümkündür. buz ben h 0,3 GPa'lık düşük sıcaklık ve basınçta. Helyumun görünümü kristal kafesin genişlemesine yol açar ve daha sonra 180K'ya ısıtılması yapısal bir dönüşüme uğramaya yardımcı olur.
Buz II'de katı çözeltiler elde etmenin nispi kolaylığı ve gaz halinde hidrojen (altı su molekülü başına bir gaz molekülü) depolaması olarak yüksek potansiyeli, pratik bilim adamlarının dikkatini buna çekiyor: hidrojende uygulama olasılığı Enerji aktif olarak tartışılıyor.
Su buharı daha soğuk bir alt tabaka üzerinde yoğunlaştığında, amorf buz. Bu buz II ve amorf buz formlarının her ikisi de kendiliğinden altıgen buz ayrıca, sıcaklık o kadar yüksek olur.
Buz IV modifikasyonu buzun yarı kararlı fazıdır. Çok daha kolay oluşur ve özellikle ağır su basınca maruz kaldığında stabildir.
Buz erime eğrisi V ve VII 20 basınca kadar test edildi h/dk 2 (200 bin kgf/cm 2 ). Bu basınç altında buz VII, 400°C'de erir.
buz VIII düşük sıcaklıkta sıralı bir formdur Buz VII.
Buz IX- aşırı soğutma sırasında meydana gelen yarı kararlı faz Buz III ve esasen düşük sıcaklık formunu temsil eder.
Buz polimorfizmi ilk olarak 1900 yılında G. Tamman tarafından keşfedilmiş ve 1912 yılında P. Bridgeman tarafından detaylı olarak incelenmiştir. Tablo. 3 ve 4, buz modifikasyonlarının yapıları ve bazı özellikleri hakkında bazı veriler sunar.
Buzun son iki modifikasyonu - XIII ve XIV- Oxford'dan bilim adamları, 2006'da oldukça yakın zamanda keşfettiler. Monoklinik ve eşkenar dörtgen kafesli buz kristallerinin var olması gerektiği varsayımını doğrulamak zordu: -160 ° C sıcaklıkta suyun viskozitesi çok yüksektir ve saf aşırı soğutulmuş su moleküllerinin bu miktarda bir araya gelmesi zordur. bir kristal çekirdeğin oluştuğunu söyledi. Bu, su moleküllerinin düşük sıcaklıklarda hareketliliğini artıran bir katalizör - hidroklorik asit yardımıyla sağlandı. Karasal doğada, bu tür buz modifikasyonları oluşamaz, ancak diğer gezegenlerin donmuş uydularında meydana gelebilir.
BUZUN BAZI FİZİKSEL VE MEKANİK ÖZELLİKLERİ.
Buz stabilitesi hesaplamalarda dikkate alınması gereken birçok faktöre bağlı olan çok faktörlü bir olgudur:
BUZUN SERTLİK. Buzun kalıcı deformasyonlar almayan başka bir cismin nüfuzuna direnme yeteneği. Etki eden P yükünün, oluşturulan dişin S yüzeyine oranı olarak tanımlanır. Sertlik H = P/S, dişteki basıncın ortalama değeridir. Buzun sıcaklığına ve yükün uygulanma süresine bağlı olarak (kısa süre dinamik sertliğe, uzun süre statik sertliğe karşılık gelir), H değerleri bir büyüklük sırasından daha fazla farklılık gösterebilir.
BUZ DOKUSU. Hava, mineral ve organik kapanımların mekansal düzenlenmesi nedeniyle buz yapısının bir özelliği.
Hava kapanımları dikkate alındığında, buz alt bölümlere ayrılır. monolitik(görünür kapanımlardan yoksun) ve gözenekli(düzgün, katmanlı ve dikey olarak lifli bir dağılıma sahip olabilen kapanımların varlığı ile).
Kapanımların boyutuna göre buz ayrılır: ince veziküler(0,2 mm'den küçük inklüzyonlar), orta kabarcık(0,2 ila 0,5 mm arasındaki inklüzyonlar), kaba kabarcıklı(0,5 ila 1,0 mm arasındaki inklüzyonlar), büyük boşluk(1.0 mm'den büyük kapanımlar).
Kapanımların şekli oval, boru şeklinde, dallanmış ve dönüşüyor. Kökenlerine göre, kapanımlar ayrılır birincil (otojen), ikincil (ksenojenik) ve dokulu (kataklastik).
BUZ ERİME SICAKLIĞI. Buzun sabit dış basınçta eridiği sıcaklık. Erime deniz buzu olduğu gibi belirli bir sıcaklıkta oluşmaz. taze buz, ancak sürekli olarak, sıcaklığın 0°C'nin altında olduğu andan belirli bir tuzluluktaki deniz suyunun donma noktasına kadar.
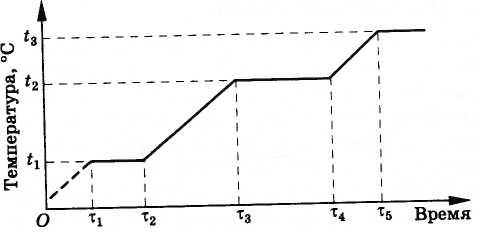
Buza ısı verildiğinde zaman içinde buzdaki sıcaklık değişimi
1 - 2 - buz ısıtma;2 - 3 - eriyen buz:3 - 4- su ısıtma;t lütfen - buzun erime sıcaklığı.
Atmosfer basıncında buzun erimesi 0,01°C'lik bir sıcaklıkta gerçekleşir (pratik hesaplamalarda 0°C varsayılır). 1 kg buzun erime noktasında suya dönüşmesi için verilmesi gereken ısı miktarına denir. özgül füzyon ısısı L metrekare Özısı tatlı su buzunun normal koşullar altında erimesi, suyun 33.3·10 4 J/kg özgül kristalleşme ısısına eşittir.
BUZUN ISI İLETKENLİĞİ (Termal İletkenlik Katsayısı). Durağan olmayan termal işlemlerde buz sıcaklığı değişim oranını karakterize eden bir parametre. Buzun termal yayılımı
a= λ/Cpρ),
nerede Cp - buzun özgül ısı kapasitesi sabit basınç, ρ - buz yoğunluğu, λ - ısıl iletkenlik katsayısı, ısıl iletkenlik katsayısı Cp'ye karşılık gelen bir ısı akışının bir sonucu olarak birim buz hacminin sıcaklığındaki artışa sayısal olarak eşit .
Buz II eşkenar dörtgendir. Buz I ile şaşırtıcı olmayan bir şekilde benzerlikleri vardır, çünkü altındaki başka bir halkaya birleştirilmiş altı üyeli dalgalı halkalardan oluşur. Bununla birlikte, komşu halkalar tam bir altıgen ağ oluşturmaz, bunun yerine üç katlı vida eksenlerini çevreler. Aşağıdaki şema Ice I(sol) ve Ice II (sağ)'daki halkaları göstermektedir. Vida eksenleri etrafındaki halkaların yükseklikleri sağdaki şemada gösterilmiştir. Halkalar boşlukları çevrelediğinden, Ice II yapısı aslında daha az boş alana sahiptir ve daha yoğundur. Yoğunluk 1.17 gm/cc'dir.
Yukarıdaki yapı tanıdık geliyorsa, olmalıdır. Oksijen atomları, elmastaki karbon atomlarıyla aynı düzenlemeye sahiptir. Bu buz formuna Ice Ic denir.
Solda, sadece oksijenlerin gösterildiği, Ice Ic'nin kübik birim hücresi var. O-H-O bağlantıları turuncu renktedir.
Aşağıdaki şema, kübik birim hücrenin yakın paketleme katmanlarıyla ilişkisini göstermektedir.
Buz Ic, yaklaşık -80 C'nin altındaki buhardan oluşur ve Ice Ih ile hemen hemen aynı yoğunluğa sahip olmasına rağmen, yarı kararlı bir buz formu gibi görünür. Buz Ih, çok düşük sıcaklıklarda Ice Ic'ye dönüşmez, ancak Ice Ic, -80 C'nin üzerine ısıtıldığında kolaylıkla Ice Ih'ye döner. .
Ice II'nin yapısı gösterilmektedir. Biraz farklı dalgalanma derecelerine sahip, yeşil ve açık mavi olarak gösterilen iki halka seti vardır. C ekseni boyutları açısından, bir küme 0, 1/3, 2/3 ve diğeri 1/6, 1/2 ve 5/6 yüksekliklerinde ortalanır. İki set dönüşümlü olarak dikey olarak ve üç katlı vida eksenleri etrafında kümelenmiştir. İki halka grubunu P ve Q olarak belirtirsek, halkalar her üç katlı eksen etrafında P-Q-P-Q-P-Q- şeklinde bağlanır. İki tür halkada halkalar kırmızı ve mor, çapraz bağlantılar laciverttir.
Buz II tetragonaldir. Birim hücrenin boyutları kübiktir (bir kenarda 6.83 Angstromunit), ancak simetride dörtgendir. Yoğunluk 1.14 gm/cc'dir. Dört yüzlü O-H-O bağlantıları biraz bozuk. Aşağıdaki şemada, oksijen atomları, izleyiciye daha yakın olan daha büyük atomlarla mavi renkte gösterilmiştir. O-H-O bağlantıları kırmızı renktedir ve daha kalın çizgiler izleyiciye daha yakındır. Bir okla biten bağlantılar daha derin bir seviyeye işaret ediyor, sivri uçlu olanlar daha yüksek bir seviyeye işaret ediyor. Yapının birkaç seviyesi gösterilmektedir. Aynı boyutta gösterilen atomlar aslında biraz farklı yüksekliklerde olabilir. Örneğin, dik açıdaki üç atomdan oluşan L-şekilli kümeler aslında diyagramın düzlemine göre biraz eğimlidir. Eğik oksijen kareleri dört katlı vida eksenlerini çevreler.
Solda Ice Ih yapısının üstten görünüşü. Bazı atomlardaki kırmızı noktalar, bir sonraki B katmanını gösteren O-H-O bağlantıları ile bir B katmanını işaretler. Diğer atomlar bir A katmanındadır ve bir sonraki A katmanına doğru O-H-O bağlantılarına sahiptir.
Yüksek Basınçlı Buz Polimorfları
Buz, solda gösterildiği gibi çok sayıda polimorf sergiler. Çayınızdaki buz Buz I'dir.
Buz I, yaklaşık 2 kb'de Buz II veya Buz III'e dönüşür. Antarktika Buz Başlığı'nın (5 km kalınlığında) tabanında basınç sadece 0,5 kb civarındadır. Yani dünyadaki buz asla daha yoğun bir faza dönüşecek kadar kalınlaşmaz. Kabukta daha yüksek basınçlara ulaşırız, ancak herhangi bir buz türünün erime noktasının çok ötesindeki sıcaklıklarda.
Bununla birlikte, dış Güneş Sistemi'ndeki büyük uyduların içlerinde yoğun buz evreleri neredeyse kesin olarak bulunur ve muhtemelen meteoroid çarpmaları sırasında şok metamorfizması tarafından kolayca üretilir.
Buz V monokliniktir. Aşağıdaki şemada, oksijen atomları, izleyiciye daha yakın olan daha büyük atomlarla mavi renkte gösterilmiştir. O-H-O bağlantıları kırmızı renktedir ve daha kalın çizgiler izleyiciye daha yakındır. Bir okla biten bağlantılar daha derin bir seviyeye işaret ediyor, sivri uçlu olanlar daha yüksek bir seviyeye işaret ediyor. Yapının birkaç seviyesi gösterilmektedir. Aynı boyutta gösterilen atomlar aslında biraz farklı yüksekliklerde olabilir. Birim hücre gri renkte gösterilir (bir kenar kümesi yatay olarak uzanır ve büyük ölçüde atomlar ve bağlar tarafından gizlenmiştir, ancak oradadır. Yakından bakın).
Buz VI, a = 6.27 Angström birimi ve c = 5.79 - neredeyse kübik olan dörtgendir. Yoğunluk 1.31 gm/cc'dir. Bir "kendinden klatrat" olarak tanımlanabilir. Bir klatrat, bir su molekülleri kafesi ile çevrili bir moleküldür. Buz VI'da, diğer dördünden oluşan bir tetrahedral kafeste merkezi bir molekül olan beş su molekülünden oluşan kümeler vardır. Kümelerin merkezleri, vücut merkezli tetragonal kafesin köşelerinde ve merkezlerinde bulunur ve çevreleyen moleküller, merkezi molekülün 3/8c üstünde ve altındadır.
Sıkıca paketlenmiş yapılar, tetrahedral bağlantılara çok iyi izin vermez. Buz VI ve Buz VII, yoğunluklarını birbirine geçen fakat bağlantısız iki kafese sahip olarak elde ederler. Bu şemada O-H-O iki ayrı ağdaki bağlantılar kırmızı ve mor olarak gösterilir.
oksijen atomları, izleyiciye daha yakın olan daha büyük atomlarla mavi renkte gösterilir. O-H-O bağlantılarının iki ağı kırmızı ve mor renkte olup, daha kalın çizgiler izleyiciye daha yakındır. Okla biten bağlantılar daha derin bir düzeyi, sivri uçlu olanlar daha yüksek bir düzeyi gösterir. Yapının birkaç seviyesi gösterilmektedir.
Bazı yönlerden Ice VII'yi anlamak en kolayıdır, çünkü iki iç içe geçmiş Ice Ic kafesinden oluşur.
İç içe geçmiş iki kafes kümesi turuncu ve kırmızı olarak gösterilmiştir. Birim hücre, sekiz vücut merkezli küpten oluşur.
Ice VII, 1.66 gm/cc'lik bir yoğunluğa sahiptir.
Ice VII birim hücresi, oldukça sıkı bir şekilde paketlenmiş vücut merkezli küplerden oluşur. Sıkıca paketlenmiş su moleküllerine dayalı bir buz yapısı, oldukça bozulmuş bağlar gerektirecektir ve teorik hesaplamalar, IceVII'nin en az 200 kilobar'a kadar kararlı form olduğunu göstermektedir. Dünya yerçekiminde, 200 kilobar, faz değişiklikleri dikkate alındığında yaklaşık 1500 kilometrelik bir buz derinliğine karşılık gelir.
Aşırı yüksek basınçlarda, su moleküllerinin tamamen parçalanmasını ve iyonik bağ ile sıkı paketlenmiş bir yapının oluşmasını bekleyebiliriz.
Erime sırasında uzamsal kafes yok edilir kristal gövde. Bu işlem, bazı dış kaynaklardan belirli miktarda enerji tüketir. Sonuç olarak, erime işlemi sırasında vücudun iç enerjisi artar.
Bir cismi erime noktasında katı halden sıvı hale getirmek için gereken ısı miktarına füzyon ısısı denir.
Vücudun katılaşması sürecinde, aksine, vücudun iç enerjisi azalır. Vücut çevresindeki cisimlere ısı verir. Enerjinin korunumu yasasına göre, bir cismin erime sırasında (erime sıcaklığında) emdiği ısı miktarı, bu cismin katılaşma sırasında (katılaşma sıcaklığında) verdiği ısı miktarına eşittir.
Özgül füzyon ısısı
Füzyon ısısı, eriyen maddenin kütlesine ve özelliklerine bağlıdır. Füzyon ısısının maddenin türüne bağımlılığı, bu maddenin özgül füzyon ısısı ile karakterize edilir.
Bir maddenin özgül füzyon ısısı, bir cismin bu maddeden füzyon ısısının cismin kütlesine oranıdır.
Füzyon ısısını şu şekilde gösterelim: Q lütfen , vücut ağırlığı t ve λ harfi ile özgül füzyon ısısı . O zamanlar
Böylece, kütleli kristal bir cismi eritmek için m, erime sıcaklığında alındığında, gereken ısı miktarı eşittir
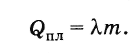 (8.8.2)
(8.8.2)
kristalleşme ısısı
Enerjinin korunumu yasasına göre, bir cismin kristalleşmesi sırasında (kristalleşme sıcaklığında) açığa çıkan ısı miktarı şuna eşittir:
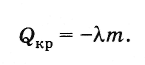 (8.8.3)
(8.8.3)
Formül (8.8.1)'den, SI'deki özgül füzyon ısısının kilogram başına joule cinsinden ifade edildiğini takip eder.
Buzun erimesinin özgül ısısı oldukça yüksektir, 333,7 kJ/kg. Kurşunun özgül füzyon ısısı sadece 23 kJ/kg, altınınki ise 65.7 kJ/kg'dır.
(8.8.2) ve (8.8.3) formülleri, kristal cisimlerin erimesi ve katılaşması ile uğraştığımız durumlarda ısı dengesi denklemlerini derlemek için problemlerin çözümünde kullanılır.
Eriyen buzun ısısının ve suyun doğada kristalleşmesinin rolü
Buzun erimesi sırasında ısının emilmesi ve suyun donması sırasında serbest bırakılması, özellikle su kütlelerinin yakınında hava sıcaklığındaki değişiklik üzerinde önemli bir etkiye sahiptir. Muhtemelen hepiniz, yoğun kar yağışları sırasında ısınmanın başladığını fark etmişsinizdir.
Çok önemli büyük önem buzun erimesinin özgül ısısı. XVIII yüzyılın sonunda bile. Füzyon ve kristalleşme ısısının varlığını keşfeden İskoç bilim adamı D. Black (1728-1799), şöyle yazdı: “Buzun önemli bir füzyon ısısı olmasaydı, ilkbaharda tüm buz kütlesinin erimesi gerekirdi. havadaki ısı sürekli olarak buza aktarıldığından, birkaç dakika veya saniye içinde. Ancak o zaman bunun sonuçları korkunç olurdu: sonuçta, mevcut durumda bile, büyük buz kütleleri ve karlar eridiğinde büyük seller ve güçlü su akışları ortaya çıkar.
Uzay roketi nozulu
Füzyon ve buharlaşma ısısının pratik kullanımına ilişkin ilginç bir teknik örnek verelim. Nozul imalatında uzay Roketi Roket memesinden çıkan gaz jetinin yaklaşık 4000 °C sıcaklığa sahip olduğu dikkate alınmalıdır. Doğada, saf haliyle böyle bir sıcaklığa dayanabilecek neredeyse hiçbir malzeme yoktur. Bu nedenle yakıtın yanması sırasında meme malzemesini soğutmak için her türlü hileye başvurmak gerekir.
Meme, toz metalurjisi ile yapılır. Kalıp boşluğuna refrakter metal tozu (tungsten) yerleştirilir. Daha sonra sıkıştırma işlemine tabi tutulur. Toz sinterlenerek gözenekli pomza benzeri bir yapı elde edilir. Daha sonra bu "pomza" bakır ile emprenye edilir (erime noktası sadece 1083 ° C'dir).
Ortaya çıkan malzemeye sahte alaşım denir. Şekil 8.31, sözde alaşım mikro yapısının bir fotoğrafını göstermektedir. Tungsten çerçevenin beyaz arka planında, düzensiz şekilli bakır kapanımlar görülebilir. İnanılmaz gibi görünse de bu alaşım, yakıtın yanması sırasında oluşan gazların sıcaklığında, yani 4000 ° C'nin üzerinde bile kısa süre çalışabilir.

Aşağıdaki şekilde gerçekleşir. Başlangıçta alaşımın sıcaklığı bakırın erime noktasına ulaşana kadar yükselir. t 1 (Şek. 8.32). Bundan sonra, tüm bakır eriyene kadar nozülün sıcaklığı değişmeyecektir (τ'dan zaman aralığı 1 τ'ya kadar 2 ). Gelecekte, bakır kaynayana kadar sıcaklık tekrar yükselir. Bu bir sıcaklıkta olur t 2 = 2595 °С, tungstenin erime noktasından (3380 °С) daha düşük. Tüm bakır kaynayana kadar, buharlaşan bakır tungstenden ısı aldığı için memenin sıcaklığı tekrar değişmeyecektir (τ'dan zaman aralığı 3 τ'ya kadar 4 ). Tabii ki, nozul istediğiniz kadar çalışmayacaktır. Bakır buharlaştıktan sonra tungsten tekrar ısınmaya başlayacaktır. Bununla birlikte, roket motoru yalnızca birkaç dakika çalışır ve bu süre zarfında memenin aşırı ısınması ve erimesi için zamanı yoktur.