Standart değerlerin Gibbs enerji tablosu. Standart maddelerin oluşum entalpileri, standart entropiler ve standart Gibbs maddelerin oluşum enerjileri
Bir maddenin standart molar oluşum entalpisi ΔH o6p, m (298 K), belirli bir maddenin bir molünün kurucu elementlerinden 298 K sıcaklıkta ve basınçta standart durumlarında oluşumu sırasında entalpideki değişikliktir. bir atmosfer.
Bu tanımı yukarıda verilen örneklerle karşılaştıralım. emin olduk
hidrojenin oksidasyonunun en az üç farklı ile temsil edilebileceğini stokiyometrik denklemler. Böylece, en az üç farklı standart molar entalpi biliyoruz:
a) ΔH°t (298 K, 2H20(l.)) = - 571.6 kJ/mol
b) ΔH°t (298 K, H20(l.)) = - 285.8 kJ/mol
c) ΔH°t (298 K, H2O(T.)) = - 241.8 kJ/mol
Bu değerlerden hangisi suyun standart molar oluşum entalpisine karşılık gelir? (c) değeri buna karşılık gelemez, çünkü suyun 298 K'deki standart durumu, H20(g) gösterimine karşılık gelen buharlı (gazlı) bir durum değildir. Suyun standart molar oluşum entalpisi, kalan iki değerden birine sahip olabilir; aralarındaki fark, reaksiyon denkleminin nasıl yazıldığına göre belirlenir. Bununla birlikte, standart molar oluşum entalpisinin yukarıdaki tanımı, bunun, oluşan maddenin molü başına entalpi değişimine karşılık geldiğini gösterdiğinden, (b) seçeneği seçilmelidir. Böylece, standart molar su oluşum entalpisi\u003d - 285.8 kJ / mol.
Masada. Tablo 5.1, bazı yaygın maddelerin standart durumlarında standart molar oluşum entalpilerini listeler. Tablonun sadece maddeleri değil aynı zamanda bazı iyonları da içerdiğine dikkat edin. İyonlar ve birçok bileşik, onları oluşturan elementlerden doğrudan sentez ile elde edilemez. Bununla birlikte, standart oluşum entalpileri Hess yasası kullanılarak hesaplanabilir (Kısım 5.3'te öğreneceğiz).
Çoğu bileşik, negatif oluşum entalpileri ile karakterize edilir. Bu nedenle ekzotermik bileşikler olarak adlandırılırlar. Sadece birkaç bileşik pozitif bir oluşum entalpisine sahiptir. Bunlara endotermik bileşikler denir. Endotermik bir bileşiğe bir örnek benzendir.
Katı bileşiklerin oluşum entalpilerinin, kural olarak, gaz oluşum entalpilerinden daha büyük (mutlak değerde) negatif değerlere sahip olduğuna dikkat edilmelidir. Bir maddenin veya iyonun standart molar oluşum entalpisi, belirli bir bileşiği oluşturan elementlere kıyasla kararlılığının bir ölçüsüdür. Bir bileşiğin oluşum entalpisinin negatif değeri (mutlak değerde) ne kadar fazlaysa, bu bileşik o kadar kararlıdır.
Tanım olarak, herhangi bir elementin standart durumunda 298 K'de standart molar oluşum entalpisi sıfırdır. Örneğin, ΔH (298 K, 02(g)) = 0.
Tablo 5.1. Standart molar oluşum entalpileri
Madde |
ΔH(298 K), kJ/mol |
Madde |
D298K), kJ/mol |
Benson'a göre ideal gaz özelliklerini hesaplamak için grup bileşenleri
sikloalkanlar
asetilen hidrokarbonlar
aromatik hidrokarbonlar
oluşum entalpisi
Oluşum entalpisini tahmin etme
Organik bileşiklerin ilk çevreleriyle birlikte atomlar için Benson yöntemiyle tahmini
İdeal gaz durumu için Benson yönteminin bazı çok değerlikli grupları
GİRİİŞ
Kimyasal teknoloji süreçlerinin ve bunların uygulanması için ekipmanın geliştirilmesine yönelik en iyi çözüm, yalnızca kimyasal bileşiklerin fizikokimyasal ve termodinamik özellikleri hakkında güvenilir bilgi ile mümkündür. Bu tür bilgiler genellikle tasarım girdisinin %50 ila %90'ını oluşturur.
Uygulama için deneysel veriler tercih edilir. Yıllar boyunca, bu tür büyük miktarda veri toplandı ve işlendi. Bu bilgiler çok sayıda derleme ve referans kitabında mevcuttur. Bazılarında termodinamik ve fizikokimyasal özelliklerin şu anda bilinen tüm değerleri verilmiş ve kritik analizleri verilmiştir. Diğerleri, yalnızca yazarlar tarafından önerilen, genellikle ortalama değerler veya tüm birikmiş bilgi dizisinin istatistiksel olarak işlenmesinin sonucu olan değerleri içerir. Bununla birlikte, teknolojinin hızlı ilerlemesi ve sahaya daha fazla yeni madde ve malzemenin girmesi, veri ihtiyacı ile bulunabilirliği arasında önemli bir boşluğa neden olmaktadır. Devlet ve kompozisyonların geniş parametrelerinde deneysel değerleri belirlemek genellikle zordur ve bazen basitçe imkansızdır.
Bu nedenle, mühendis genellikle maddelerin özelliklerini hesaplamak ve tahmin etmek için çeşitli yöntemlere güvenmek zorunda kalır. "Hesaplama" ve "tahmin" terimlerinin genellikle birbirinin yerine kullanıldığı akılda tutulmalıdır, ancak bunlardan ikincisi, sonucun yalnızca kısmen doğru olabileceği gerçeğinin dürüst bir şekilde tanınmasını sağlar. Hesaplamalar teoriye, deneysel değerlerin korelasyonuna veya her ikisinin birleşimine dayalı olabilir.
oluşum entalpisi
Oluşum entalpisi, birçok teorik ve pratik problemin çözümünde kullanılan temel özelliktir. Reaktiflerin oluşum entalpilerini bilmek, reaksiyon bölgesindeki adyabatik sıcaklık farkını tahmin ederken gerekli olan ilgili reaksiyonların termal etkilerini hesaplamaya izin verir, reaktör tasarımı için gereksinimleri ve kimyasal işlemin teknolojik özelliklerini oluşturur. Proseslerin kantitatif termodinamik analizini yaparken, reaktiflerin teorik dönüşüm derecesini belirlerken, iletkenlik koşullarını seçerken, maddelerin oluşum entalpileri gereklidir. kimyasal dönüşüm vb. Gerçekleştirilen termodinamik analizin kalitesi, büyük ölçüde maddelerin oluşum entalpileri hakkındaki bilgilerin güvenilirliğine bağlıdır.
Entalpi birimleri kJ/mol ve J/mol'dür. Önceki yılların referans literatüründe, oluşum entalpileri genellikle kcal/mol (1 cal = 4.184 J, 1 kcal = 4.184 kJ) olarak sunulur.
Dar anlamda bağlantının oluşum entalpisi () standart elementlerden belirli bir maddenin oluşum reaksiyonundaki entalpi değişimi veya basit maddeler. Basit maddeler, doğal fazlarında ve kimyasal hallerinde dikkate alınan sıcaklıkta bulunan kimyasal elementlerdir.
Bir maddenin standart durumu olarak, bu maddenin 1 atm (101325 Pa) standart basınçta kararlı olduğu bir durum seçilir. Bir maddenin yoğuşma durumu, basıncının düştüğü sıcaklıklara kadar standarttır. doymuş buhar 1 atm'ye ulaşır. Bu sıcaklıkların üzerinde ideal gaz hali standart olarak seçilir.
Çoğu organik bileşiğin moleküllerinin oluşumunda yer alan basit maddeler için 298.15 K'daki standart durum şöyledir:
karbon - grafit için;
hidrojen, oksijen, azot, flor ve klor için - ideal bir iki atomlu gaz;
brom için iki atomlu bir sıvı;
iyot ve kükürt için - sırasıyla iki atomlu ve tek atomlu bir kristal durum.
Mutlak entalpi değerleri mutlak değerler içerdiğinden belirlenemez içsel enerji. Bileşiklerin oluşum entalpilerini belirleme ihtiyacı, standart durumdaki elementlerin ve basit maddelerin değerlerinin sıfıra eşit alındığı uluslararası bir anlaşmanın yapılmasını gerektiriyordu.
Karmaşık bir moleküler yapıya sahip maddelerin büyüklüğü ve işareti farklı olabilir. Bu şu şekilde açıklanmaktadır. Serbest atomlardan maddenin oluşumuna her zaman enerji salınımı eşlik eder, ortaya çıkan maddeler negatiftir. Ancak, iki atomlu moleküllerden (H 2, O 2, N 2, Cl 2 vb.) oluşan basit maddelerden veya yoğun halde (karbon, brom vb.) bir madde oluştuğunda, belirli bir miktarda enerji oluşur. Bu basit maddelerin moleküllerindeki bağları kırmak veya gaz haline dönüştürmek için gereklidir. Sonuç olarak, oluşum entalpisi hem pozitif hem de negatif olabilir ve sıfıra eşit olabilir.
Genel durumda, değer ve işaret, bir maddenin termodinamik kararlılığı ile ilgili herhangi bir ifade için temel oluşturmaz, çünkü sadece entalpiye değil, aynı zamanda bu oluşumu sırasında serbest enerjideki değişimin entropi bileşenine de bağlıdır. madde. Bununla birlikte, aynı homolog grubun temsilcilerinin veya benzer moleküler yapıya sahip bileşiklerin termodinamik stabilitesini karşılaştırmak için, ilk yaklaşımda bunların oluşum entalpilerini analiz etmek oldukça bilgilendirici olabilir. Bu durumda, daha düşük bir oluşum entalpisine sahip bir madde, daha büyük bir termodinamik stabiliteye sahiptir.
Çoğu bileşik için, basit maddelerden oluşum reaksiyonları pratikte gerçekleştirilemez. Organik bileşiklerin oluşum entalpileri hakkında gerçek bilgilerin ana kaynağı, kalorimetrik yöntemle elde edilen yanma entalpileri () hakkında deneysel verilerdir. Bugüne kadar birikmiş ve önerilen değerler ve derlemelerde yer almaktadır. Şimdiye kadar, ilgili referans bilgileri yalnızca kalorimetrik verilerle sağlanmıştır. Modern ampirik tahmin yöntemleri de yalnızca kalorimetrik verilere dayanmaktadır. Aynı zamanda, ilgili maddelerin aralığı, yapılan çalışmaların hacmi ve elde edilen termodinamik özelliklerin doğruluğu açısından benzersiz olan bilgilerin kimyasal denge çalışmasının sonuçlarında yer aldığına dikkat edilmelidir. Kanaatimizce, bu bilgilerin etkin kullanımı, organik maddelerin kütle hesaplama yöntemlerinin prognostik yeteneklerini önemli ölçüde genişletecektir.
OLUŞUM ENTALPILERİNİN TAHMİNİ
Organik bileşiklerin oluşum entalpilerini tahmin etmek için ana yöntemler, yani, bir maddenin 1 atm basınçta ideal bir gaz halindeki özelliğini karakterize ederler. ve genellikle standart olarak adlandırılan 298.15 K'lik bir sıcaklık. Kütle hesaplama yöntemleri arasında moleküler mekanik ve katkı yöntemleri (lat. ek- ilave). Çoğu yarı deneysel yöntem, gerekli tahmin kalitesini sağlamaz. Ampirik olmayan yöntemler, maddelerin oluşum entalpilerine doğrudan erişim sağlamaz ve dahası, karmaşık bir moleküler yapıya sahip organik maddelerin özelliklerini hesaplamak için hala erişilemez.
Moleküler mekanik yöntemleri grubunda, MMX yöntemini kullanma konusunda önemli bir deneyim biriktirdik ( kuvvet alanı Ellinger). Yöntem, alkanlara uygulamada kendini kanıtlamıştır. Bununla birlikte, aromatik bileşikler için bile, oluşum entalpilerini hesaplamak için değil, moleküldeki sübstitüentlerin etkileşiminin etkilerini değerlendirmek için kullanılması tavsiye edilir, yani. izomerlerin oluşum entalpilerindeki farklılıklar için. Organohalojen, oksijen, nitrojen ve kükürt içeren bileşiklerin çoğu için yöntem, yanlı tahminler verir. Ancak, bu yöntem bir mülkün açık bir şekilde değerlendirilmesi için her durumda kullanılmalıdır. Diğer herhangi bir yöntem gibi, sonuçların başka bir tahmin yöntemiyle elde edilen bilgilerle desteklenmesini gerektirir. Moleküler mekanik yöntemi mükemmel bir arayüze sahiptir ve moleküllerin yapısı ve geometrik parametreleri hakkında bir bilgi kaynağı olarak son derece etkilidir.
Tahmin için referans verilerin yokluğunda, şu anda çeşitli katkı yöntemleri yaygın olarak kullanılmaktadır. Organik maddelerin ideal gaz halindeki özelliklerini tahmin etmek için ana katkı yöntemlerinin yaratılmasından bu yana, önemli bir zaman geçti, ancak giderek daha erişilebilir moleküler modelleme yöntemlerine rağmen önemlerini koruyorlar. Bu yöntemler, özelliğin moleküldeki aynı tipteki fragmanların sayısındaki bir değişiklikle doğrusal olarak değiştiği durumlarda etkilidir. Katkı maddesi, örneğin bir maddenin moleküler ağırlığıdır. Organik bileşiklerin oluşum entalpileri için, eklemeli yaklaşım çoğu durumda hesaplamada sadece bir miktar yaklaşıklıktır. Gerçek şu ki, homolog bir grupta bile, moleküldeki karbon atomu sayısındaki bir değişiklikle doğrusal olmayan bir şekilde değişir (Şekil 1.1).
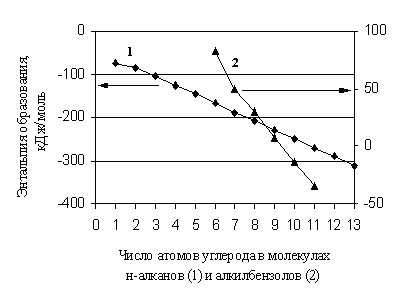
Pirinç. 1.1. n-alkanların ve alkil benzenlerin oluşum entalpisinin moleküllerindeki karbon atomlarının sayısına bağımlılığı
Dolayısıyla homolog fark, özellikle homolog grupların ilk üyeleri için sabit bir değer değildir. Aynı şekilde, organik maddelerin moleküllerinde aynı tipteki ikame edicilerin sayısındaki artışla birlikte, çoğu zaman toplamdan bir sapmadan bahsetmek gerekir. Bununla birlikte, toplamsızlık için düzeltmeler yapıldığında, detaylandırma derecesi ve derinliği yeterliyse ve modern deneyin doğruluğuna karşılık geliyorsa, bu grubun yöntemleri oldukça tatmin edici bir şekilde çalışır.
Kabul edilen ideolojiye bağlı olarak, eklemeli yöntemlerde yapısal ve nicel bilgi taşıyıcıları, bir molekülü oluşturan atomlar, atom grupları veya bağlar olabilir. Çoğu tahmin yöntemi, oluşum entalpileri hakkındaki veri tabanı genişledikçe, kısmi katkıların değerleri nispeten kolayca rafine edilebilecek veya yeni düzeltmeler yapılabilecek şekilde tasarlanmıştır.
Maddelerin oluşum entalpilerini tahmin etmeye yönelik genel yaklaşım, gerekirse, diğer sıcaklıklarda veya k'de ideal gaz oluşum entalpilerine geçişle sonraki hesaplamayı içerir, yani. gerçek bir durumda maddenin bir özelliğine.
Toplamsal hesaplama yöntemlerinin çeşitliliğinden ikisini ele alıyoruz; Benson'un ilk ortamları olan atomlar için grup yöntemi ve bağlar için Tatevskii'nin yöntemi.
Organik bileşiklerin ilk çevreleriyle birlikte atomlar için Benson yöntemiyle tahmini
Organik maddelerin oluşum entalpilerini tahmin etmek için çeşitli katkı şemaları arasında, Benson yönteminin en yaygın olarak uzun bir süre boyunca kullanıldığı kabul edilmelidir. Bu muhtemelen, bu yöntemin en geniş bileşik yelpazesini kapsaması gerçeğiyle açıklanmaktadır. Bileşiklerin büyük çoğunluğunun herhangi bir teknik aracın katılımı olmadan hızlı bir şekilde değerlendirilmesi için, yöntemin belki de eşiti yoktur. Evrenselliğinin fiyatının tahminin doğruluğu olduğu oldukça açıktır. Bu nedenle, yöntemi kullanırken, kaçınılmaz sınırlamalarının farkında olmak gerekir. Potansiyel kullanıcıların dikkatini, yöntemin kapsamlı testlerinin sonucu olan ana olanlara çekmeye çalışacağız.
Benson yöntemine genellikle grup yöntemi denir. atom ilk çevresi ile. Yöntem, yazar tarafından maddelerin aşağıdaki ideal gaz özelliklerini hesaplamak için geliştirilmiştir: ısı kapasitesi 100 derecenin katları olan sıcaklıklarda, oluşum entalpisi ve entropi.
Sistemin entalpisi. standart koşullar. Bir maddenin oluşum entalpisi. Tepkime entalpisi. Endotermik ve ekzotermik reaksiyonlar.
Sistemin entalpisi (Yunanca entalpo I ısısından), ϶ᴛᴏ bağımsız entropi parametreleri S ve iç enerji U ile H ilişkisi ile ilişkili olan P basıncına sahip bir termodinamik sistemin durumunun tek değerli bir H fonksiyonudur. =U+PV, burada V, sistemin hacmidir.Kimyada, çoğu zaman izobarik süreçler (P = const) olarak kabul edilir ve bu durumda termal etki, sistemin entalpisindeki değişiklik olarak adlandırılır veya sürecin entalpisi: Qp = ∆H; ∆H=∆U+P∆V. Entalpi, enerji (kJ) boyutuna sahiptir. Değeri, madde miktarıyla orantılıdır; bir maddenin birim miktarının (mol) entalpisi kJ∙mol–1 cinsinden ölçülür.Termodinamik bir sistemde, bir kimyasal işlemin açığa çıkan ısısı negatif olarak kabul edilir (ekzotermik işlem, ΔH< 0), а поглощение системой теплоты соответствует эндотермическому процессу, ΔH >0. Sürecin entalpisini gösteren kimyasal reaksiyon denklemlerine termokimyasal denir. Entalpi ΔH'nin sayısal değerleri, kJ cinsinden bir virgül ile belirtilir ve tüm reaktanların stokiyometrik katsayıları dikkate alınarak tüm reaksiyona atıfta bulunur. Reaktantlar farklı olabileceğinden kümelenme durumları, o zaman parantez içinde sağ alt indeks ile gösterilir: (t) - katı, (k) - kristal, (g) - sıvı, (d) - gaz halinde, (p) - çözünmüş. Örneğin, gaz halindeki H2 ve Cl2'nin etkileşimi, iki mol gaz halinde HCl üretir. Termokimyasal denklem şu şekilde yazılır: Gaz halindeki H2 ve O2 etkileşime girdiğinde, oluşan H2O, entalpi değişimini etkileyecek olan üç kümelenme durumunda olabilir: 298K. standart durum termodinamik fonksiyon, örneğin entalpi, alt simgeler ve üst simgelerle gösterilir: alt simge genellikle atlanır: Δ.
Oluşum entalpisi (oluşma ısısı), verilen başlangıç maddelerinden belirli bir maddenin (veya çözeltinin) oluşum reaksiyonunun ısısı. Kimyasal bir bileşiğin oluşum entalpisine, belirli bir bileşiğin basit maddelerden oluşum reaksiyonunun entalpisi denir. Basit maddeler seçtikçe kimyasal elementler belirli bir sıcaklıkta doğal fazlarında ve kimyasal hallerinde. Bu nedenle, 298 K'da, klor için, C12 moleküllerinden oluşan gaz halindeki klor basit bir maddedir ve potasyum için metalik potasyumdur. 298 K'de katı KCl'nin oluşum ısısı, tepkimenin entalpisidir: K(katı) + 1/2Cl2= KCl(katı) 500 K'da KCl(katı) oluşum ısısı, tepkimeye karşılık gelir: K( sıvı) + 1/2Cl2 = KCl (katı), çünkü potasyum için doğal faz durumu (basit madde) artık bir kristal değil, bir sıvıdır (erime sıcaklığı K 336.66 K).
Oluşum entalpisi herhangi bir sıcaklıkta belirlenmelidir. Standart oluşum entalpileri, hem basit maddelerin hem de elde edilen bileşiğin 1 atm (1.01 x 105 Pa) basınç altında olduğu oluşum reaksiyonlarına karşılık gelir. Tanım olarak, herhangi bir sıcaklıktaki tüm basit maddeler için = 0. Çoğu kimyasal için. bağlantı oluşum entalpisi - negatif. miktarları.
Oluşum entalpisinin ölçüm birimleri J / g, J / mol'dür Çözeltilerin termodinamiğinde (erir), oluşum entalpisi, 1 mol (1 g) izotermal-izobarik oluşumu sırasında entalpideki değişiklik olarak anlaşılır. ) saf bileşenlerden belirli bir bileşimin bir çözeltisinin (erimesi). Böylece, iki bileşenli sistem KF-A1F3'te, %50 molar bileşimli bir eriyiğin oluşum entalpisi şu sürece karşılık gelir: 1/2KF (sıvı) + 1/2A1F3 (sıvı) = KF-A1F3 (eriyik, 50 mol.%).
Endotermik reaksiyonlar (diğer Yunanca ἔνδον - içeriden ve θέρμη - ısıdan) - ısı emiliminin eşlik ettiği kimyasal reaksiyonlar. Endotermik reaksiyonlar için, entalpi ve iç enerjideki değişim pozitiftir (ΔH > 0, ΔU > 0), bu nedenle reaksiyon ürünleri orijinal bileşenlerden daha fazla enerji içerir.Endotermik reaksiyonlar şunları içerir: metallerin oksitlerden indirgenmesi reaksiyonları, elektroliz ( elektrik enerjisi emilir ), elektrolitik ayrışma (örneğin, tuzların suda çözünmesi), iyonlaşma, fotosentez Endotermik reaksiyonlar ekzotermik reaksiyonların tersidir.
Ekzotermik bir reaksiyon, ısı salınımının eşlik ettiği kimyasal bir reaksiyondur. Endotermik reaksiyonun tersi: Bir kimyasal sistemdeki toplam enerji miktarını ölçmek veya hesaplamak son derece zordur. Öte yandan, entalpi ΔH'deki değişim Kimyasal reaksiyonölçmek veya saymak çok daha kolay. Bu amaçlar için kalorimetreler kullanılır. ΔH'nin ölçülen değeri aşağıdaki gibi moleküllerin bağlanma enerjisi ile ilgilidir: ΔH = bağları kırmak için harcanan enerji - reaksiyon ürünlerinin bağları oluştuğunda açığa çıkan enerji Ekzotermik reaksiyonlar için bu formül için negatif bir değer verir. ΔH, çünkü büyük değer küçük değerden çıkarılır. Hidrojenin yanması sırasında, örneğin: 2H2 + O2 → 2 H2O, entalpi değişimi bir mol O2 başına ΔH = -483,6 kJ'dir.
Yakıtın atmosferik oksijende yanması.
Barut yanıyor.
Suya konsantre sülfürik asit eklenmesi.
Canlı organizmalarda yağların ve karbonhidratların oksidasyonu.
adyabatik yanma
Sistemin entalpisi. standart koşullar. Bir maddenin oluşum entalpisi. Tepkime entalpisi. Endotermik ve ekzotermik reaksiyonlar. - kavram ve türleri. "Sistemin entalpisi. Standart koşullar. Bir maddenin oluşum entalpisi. Reaksiyon entalpisi. Endotermik ve ekzotermik reaksiyonlar" kategorisinin sınıflandırılması ve özellikleri. 2014, 2015.
Kimyasal termodinamiğin ve kimyasal dengenin temel denklemleri
1.Q=DE+W-termodinamiğin birinci yasasının denklemi
2.W=PDV
3. Q v = DE v -izokorik sürecin ısısı
4. Q p = DH p -izobarik sürecin ısısı
5. DH p = DE + PDV -izobarik süreçler için termodinamiğin birinci yasasının denklemi
6. DH = å n DH 0 298 arr. ürün. tepki. - å n DH 0 298 arr. referans maddeler - P Hess yasasının ilk sonucu
7. DH = å n DH 0 298 yanma. Çıkış. içinde. - å n DH 0 298 yandı ürün. reaksiyonlar - içindeHess yasasının ikinci sonucu
8.Q=W-biyosistemler için termodinamiğin birinci yasasının denklemi
9.DS = ¾¾ -sistemin durumunun bir fonksiyonu olarak entropi
10.DS ³ 0 -termodinamiğin ikinci yasasının denklemi
11 S = å n S 0 298 devam R. - å n S 0 298 ref. içinde. -reaksiyon entropisi hesaplaması
12. DG 0 = DH 0 - TDS 0 -Gibbs enerjisini hesaplamak için denklemler
13. DG 0 = å n DG 0 298 prod. R. - å n DG 0 298 ref. içinde.(x)
14. DG 0 \u003d - 2.3RT lg Ks - standart koşullar altında kimyasal reaksiyon izoterm denklemi
15. - kimyasal reaksiyon izoterm denklemi
16. - bir maddenin denge konsantrasyonları cinsinden ifade edilen kimyasal denge sabiti
17. - denge cinsinden ifade edilen kimyasal denge sabiti kısmi basınçlar maddeler
18. - izobar denklemi
19. - sabitlerin değerlerinden termal etkinin hesaplanması
tablo 1
| Madde | Standart oluşum entalpisi kJ/mol | Standart entropi J/mol×K | Standart Gibbs oluşum enerjisi kJ/mol |
| inorganik maddeler | |||
| C (grafit) | +6 | ||
| Çark dişi) | -110 | +198 | -137 |
| CO2 (g) | -393,5 | +214 | -394 |
| Cl2 (g) | +223 | ||
| Cl 2 O (g) | +76 | +266 | +94 |
| FeСО 3 (tv) | -753 | +96 | -680 |
| H2 (g) | +131 | ||
| HC1 (g) | -92 | +187 | -95 |
| Merhaba (g) | +24 | +206 | -1 |
| HNO2 (çözelti) | -119 | +153 | -56 |
| HNO3 (l) | -174 | +156 | -81 |
| H 2 O (l) | -286 | +70 | -237 |
| H 2 O 2 (l) | -187 | +110 | -120 |
| H 2 S (g) | -21 | +206 | -34 |
| H2SO4 (l) | -814 | +157 | -690 |
| KNO3 (TV) | -495 | +133 | -395 |
| KOH(çözelti) | -477 | +92 | -441 |
| N2 (g) | +192 | ||
| NH3 (g) | -46 | +192 | -16 |
| H2O (g) | +82 | +220 | +104 |
| HAYIR (g) | +91 | +211 | +87 |
| NO2 (g) | +33 | +240 | +51 |
| N2O3 (g) | +11 | +356 | +115 |
| Na 2 O 2 (TV) | -510 | +95 | -447 |
| Na 2 S 2 O 3 (TV) | -1117 | +225 | -1043 |
| O2 (g) | +205 | ||
| SO2 (g) | -297 | +248 | -300 |
| SO3 (g) | -396 | +257 | -371 |
| organik madde | |||
| metan (g) | -75 | +186 | -51 |
| etan (g) | -85 | +229 | -33 |
| etilen (g) | +52 | +219 | +68 |
| asetilen (g) | +227 | +201 | +209 |
| Benzen (w) | +49 | +173 | +125 |
| Sikloheksan (l) | -156 | +204 | +27 |
| Klorometan (g) | -86 | +234 | -63 |
| Diklorometan (g) | -95 | +270 | -69 |
| Triklorometan (g) | -101 | +296 | -69 |
| Karbon tetraklorür (g) | -100 | +310 | -58 |
| metanol (w) | -239 | +127 | -166 |
| etanol (w) | -277 | +161 | -174 |
| Dietil eter (l) | -279 | +253 | -123 |
| Asetaldehit (g) | -166 | +264 | -133 |
| aseton (w) | -247 | +199 | -154 |
| Piruvat iyonu (çözelti) | + | -559 | |
| L-laktik asit (çözelti) | -686 | +222 | -539 |
| Sükroz (TV) | -2222 | +360 | -1545 |
| D-glikoz (çözelti) | -1264 | +269 | -917 |
| nitrobenzen (w) | +16 | +224 | +146 |
| anilin (w) | +31 | +191 | +149 |
| L-lösin (çözelti) | -643 | +208 | -362 |
| Glisin (çözelti) | -523 | +159 | -380 |
| D,L-lösilglisin (çözelti) | + | -464 | |
| Glisilglisin (çözelti) | -734 | +231 | -492 |
Organik maddelerin standart yanma entalpileri, kJ/mol
Özısı vücuttaki maddelerin tam oksidasyonu, kJ/g.
Öğrenme görevleri:
Görev 1İnsan vücudunda etil alkolün oksidasyon reaksiyonu iki aşamada gerçekleşir. Birincisi, alkol dehidrojenaz enziminin katılımıyla etil alkolün asetaldehite oksidasyonu, aşağıdaki denkleme göre ilerler: C 2 H 5OH + ½ O 2 \u003d CH3 COH + H 2 O.
Hess yasasının ilk sonucunu kullanarak reaksiyonun DH 0'ını hesaplayın.
DN 0 arr. (C2H5OH) \u003d - 278 kJ / mol;
DN 0 arr. (CH3COH) \u003d - 166 kJ / mol;
DN 0 arr. (H20) \u003d - 286 kJ / mol.
Çözüm: DH 0 = å n DH 0 - å n DН 0 ters ref.in.in; DH = (-166+ (-286)-(-278)) = - 174 kJ/mol
Cevap: reaksiyonun termal etkisi DH = -174 kJ/mol, yani. ekzotermik süreç.
Görev 2. Glikozun yanma ısısı -2810 kJ/mol, etil alkolün yanma ısısı -1366 kJ/mol'dür. Bu verilere dayanarak, glikoz fermantasyonunun biyokimyasal sürecinin termal etkisini hesaplayın:
C6H12O6 \u003d 2C 2H5OH + 2C02
Çözüm: Bu reaksiyonun termal etkisi, Hess yasasının ikinci sonucu uygulanarak hesaplanabilir:
DH = ån DH 0 yanması. Çıkış. maddeler - å n DH 0 yanma. ürün. reaksiyonlar
DH \u003d -2810 - 2 ∙ (-1366) \u003d - 78 kJ / mol
Cevap: fermantasyon işleminin termal etkisi - 78 kJ / mol'dür.
Görev 3. Reaksiyonun standart entropisini hesaplayın:
NH 2 - CH 2 - COOH + NH 2 - CH 2 - COOH → NH 2 - CH 2 - CO - NH - CH 2 - COOH + H 2 O
glisin glisin glisilglisin
S 0 (glisilglisin) = 231 J / mol × K ise;
S 0 (glisin) \u003d 159 J / mol × K;
S 0 (H20) \u003d 70 J / mol × K;
Çözüm:
DS \u003d S 0 298 (hl-hl) + S 0 298 (H 2 O) - 2 S 0 298 (glisin) \u003d (231 + 70) - (159 + 159) \u003d -17 J / mol × K
Cevap: DS 0 298 \u003d - 17 J / mol × K, yani. entropi azalır.
Görev 4. Karbonhidratların, proteinlerin ve yağların yanma ısısı 17, 17 ve 39 kJ'dir.
sırasıyla. Erkek öğrencilerin günlük ortalama protein, yağ ve karbonhidrat ihtiyacı 113, 106 ve 451 gramdır. Erkek öğrencilerin günlük enerji ihtiyacı nedir?
Çözüm: Karbonhidratların, proteinlerin ve yağların oksidasyonu sırasında ne kadar enerji açığa çıktığını hesaplayın
DH = (451×17) + (113×17) + (106×39) = 13722 kJ.
Cevap: Günlük enerji ihtiyacı 13722 kJ'dir.
Görev 5. Reaksiyon endotermik ise ve termal etki 2830 J/mol ise, 40 0 °C'de protein denatürasyon işlemi neden kendiliğinden gerçekleşir? Bu reaksiyon için DS değeri 288 J/mol∙K'dır.
Çözüm: Sürecin yönünü belirlemek için, denkleme göre hesaplanan Gibbs enerjisindeki değişimin büyüklüğünü bilmek gerekir: DG 0 = DH 0 - TDS 0 . Hesaplama gösteriyor ki DG< 0 (DG 0 = 2830 Дж/моль - (313К × 288 Дж/моль∙К) = - 87314 Дж/моль или - 87,3 кДж/моль).
Cevap: Çünkü DG< 0, то процесс денатурации белка при 40 0 С протекает самопроизвольно, повышение температуры тела может представлять опасность для жизнедеятельности организма.
Görev 6. Standart koşullar altında glikoliz reaksiyonu için süreçlerin kendiliğindenliği için bir kriter olan Gibbs enerjisini hesaplayın: C 6 H 12 O 6 (çözelti) ® 2C 3 H 6 O 3 (çözelti) (laktik asit).
Çözüm:
Termodinamik değerler tablosundan kimyasal süreçteki katılımcılar için standart Gibbs enerjisini yazıyoruz: ∆G 0 (C 6 H 12 O 6) = -917 kJ / mol; ∆G0 (C3H603) = -539 kJ/mol. Hess yasasından 1 sonuç kullanarak Gibbs enerjisini hesaplıyoruz:
ΔG 0 = 2×ΔG 0 (C 3 H 6 O 3) - ΔG 0 (C 6 H 12 O 6)
ΔG 0 \u003d 2 (-539) - (-917) \u003d -161 kJ / mol
Cevap:çünkü ∆G0< 0, то реакция протекает самопроизвольно в ileri yönde.
Görev 7. Bu reaksiyon için oluşum entalpilerinin standart değerlerini ve mutlak entropileri kullanarak Gibbs enerjisindeki 25 0 C'deki değişimi hesaplayın: CO + 2H 2 = CH 3OH
DН 0 arr CH3OH \u003d -293 kJ / mol S 0 (CH30H) \u003d 127 J / mol × K
DH 0 arr CO \u003d - 110 kJ / mol. S 0 (CO) \u003d 198 J / mol × K
S 0 (H 2) \u003d 131 J / mol × K
Çözüm: DG 0 = DH 0 - TDS 0
DH 0 = ånDH 0 arr. pr. reak. - ånDH 0 arr. referans maddeler
DH 0 \u003d - 293 - (-110) \u003d - 183 kJ / mol
DS 0 = å n S 0 devam. p - å n S 0 sonucu. maddeler
DS 0 \u003d 127 - (198 + 2 (131) \u003d - 333 J / mol × K
DG 0 \u003d - 183,5 kJ / mol - (298K × 0.333 kJ / mol × K) \u003d - 83,8 kJ / mol
Cevap: DG 0 \u003d - 83,8 kJ / mol
Görev 8. ATP + AMP ↔ 2ADP reaksiyonu için 310 K'de denge sabitini hesaplayın. bedava enerji Gibbs reaksiyonu ΔG°=-2.10kJ/mol.
Çözüm: dengede DG 0 = - 2.3RT log Ks
Kc \u003d 10 0.354 \u003d 2.26
Cevap: Kc = 2.26
Görev 9. Reaksiyonun denge sabiti: PCl 5 (g) “PCl3 (g) + Cl2 (g) 250 0 C'de 2'dir. Reaksiyon aşağıdaki konsantrasyonlarda hangi yönde ilerler: C (PCl 5) \u003d C (PCl 3) \u003d 2 mol/l; C (Cl 2) \u003d 4 mol / l?
Çözüm: Reaksiyonun yönünü belirlemek için izoterm denklemini kullanırız.
Ps'yi hesapla
Çünkü Ps > Ks, ardından DG > 0
Çözüm: reaksiyon ileri yönde kendiliğinden ilerleyemez, çünkü DG>0.
Görev 10. 627 0 C sıcaklıkta 2SO 2 (g) + O 2 (g) Û 2SO 3 (g) reaksiyonunun denge sabiti 2.3 ∙ 10 -7, DH 0 = 376.5 kJ / mol'dür. 727 0 С'de denge sabitini hesaplayın.
Çözüm: kimyasal reaksiyonun izobar denklemini kullanırız:
T 1 \u003d 273 + 627 \u003d 900 K
T2 = 273 + 727 = 1000K
Cevap: 727 0 C'deki denge sabiti 3.56 × 10 -5'tir.
Görev 11. H 2 O (g) + CO (g) ® CO 2 (g) + H 2 (g) reaksiyonu için, kimyasal denge sabitleri eşittir: 800 0 C'de Kp = 2.87, 1000 0 C'de Kp = 1.39. Bu reaksiyonun termal etkisini hesaplayın.
Çözüm: Kimyasal bir reaksiyonun izobar denklemini uygulayarak DH'yi hesaplıyoruz
T 1 = 800 + 273 = 1073 K alalım
T 2 \u003d 1000 + 273 \u003d 1273 K
Cevap: DH = -39.16 kJ/mol.
Bağımsız çözüm için görevler:
Görev 1. 1 mol suyu buharlaştırmak 40 kJ alır. Deri yoluyla 720 g su salındığında günde ne kadar ısı kaybedilir?
Cevap: 1600 kJ
Görev 2. Kütle oranı % 3 olan bir çözelti şeklinde hidrojen peroksit (H 2 O 2). tıpta yaraların tedavisinde kullanılır. Katalaz enziminin varlığında hidrojen peroksitin ayrışma sürecinin kendiliğinden olduğunu, başlangıç maddelerinin standart oluşum entropisinin değerlerini ve aşağıdakileri hesaplamak için reaksiyon ürünlerini kullanarak kanıtlayın:
S 0 298 (H20 2) = 110 J/mol×K; S 0 298 (H20) \u003d 70 J / mol × K; S 0 298 (O 2) = 205 J / mol × K.
Cevap: Δ S = 62,5 J/mol × K
Görev 3. 2 m3 hacimli metan yakıldığında, 79600 kJ ısı açığa çıkar. Metanın standart yanma ısısını hesaplayın.
Cevap: 891,52 kJ/mol
Görev 4. Aşağıdaki verilere göre glikoz oksidasyonu işlemi için standart Gibbs enerjisini hesaplayın: DH 0 arr (C 6 H 12 O 6) \u003d - 1264.4 kJ / mol; DH 0 arr (CO 2) \u003d - 393 kJ / mol;
DH 0 arr (H20) \u003d - 286 kJ / mol. Tüm reaksiyona giren sistemin entropisindeki değişim 0.259 kJ/mol×K'dir.
Cevap: DG \u003d - 2886.8 kJ / mol.
Görev5. Gerekli standart yanma entalpilerini kullanarak standart etanol oluşum entalpisini hesaplayın.
Cevap: DN 0 arr. = -273 kJ/mol
Görev 6. 25°C'de N 2 0 4 (g) ↔ 2N0 2 (g) reaksiyonunun denge sabiti 0.1'dir. Aşağıdaki madde konsantrasyonlarında reaksiyon hangi yönde ilerleyecektir:
a) C (N0 2) \u003d C (N 2 0 4) \u003d 0.1 mol / l;
b) C (N0 2) \u003d 0.01 mol / l; C (N 2 0 4) \u003d 0.02 mol / l?
Görev 7. 444 0 C'de H2 + I 2 ® 2HI reaksiyonu için denge sabiti 50'dir. İlk karışım aşağıdaki bileşime sahipse işlemin yönünü belirleyin: C (H 2) \u003d 2 mol / l, C ( YÜKSEK) \u003d 10 mol / l.
Cevap: Denge durumu, çünkü ∆G=0.
Görev 8. Bu reaksiyon için DG 0 298 4.478 kJ/mol ise denge sabitini hesaplayın.
Cevap: 6,1
Görev 9. Bir tıbbi maddenin 413K'da bir otoklavda bozunmasının denge sabiti 0.396∙105 Pa'dır ve 443K'da 1.286∙105 Pa'dır. Reaksiyonun termal etkisini hesaplayın.
Cevap: 59.6 kJ/mol.
Görev 10.ΔG° değerini kullanarak, ilaç olarak kullanıldığında hasta zehirlenmesi tehdidi olup olmadığını belirleyin. uyuşturucu nitrik oksit (I), Toksik nitrik oksit (II) reaksiyonu ile oluşturulabilir: 2N 2 O + O 2 = 4NO. Tüm maddeler içinde gaz hali. Referans verileri için tabloya bakın.






