Entalpia specifike e avullit. Enciklopedia e madhe e naftës dhe gazit
Faqe 1
Dendësia avujt e ngopur në të njëjtën temperaturë janë shumë të ndryshme për substanca të ndryshme. Në temperaturën e dhomës, dendësia e avullit të ngopur të ujit është 13 mm, dhe dendësia e avullit të ngopur të merkurit është vetëm 0,005 mm.
Dendësia e avullit të ngopur në ekuilibër me të ngurta, rritet me rritjen e temperaturës.
Dendësia e avujve të ngopur të produktit, në varësi të temperaturës, përcaktohet nga tabelat.
Vlera e densitetit të avullit të ngopur varet vetëm nga temperatura (tabela) dhe nuk varet nga vëllimi i zënë.
Vlera e densitetit të avullit të ngopur në një presion të tepërt në ndarësin 0 7 kgf / szh2 është marrë nga tabelat, stresi i lejuar i hapësirës së avullit të ndarësit është mesatar brenda vlerave të rekomanduara. U miratua një ndarës me një vëllim prej 0 7 m3, një diametër prej 600 mm të impiantit të bojlerit Biysk - 1 copë.
Presioni dhe dendësia e avullit të ngopur në drejtim të boshtit x në sipërfaqen e lëngut nuk ndryshon, ndërkohë, në një rrokje pafundësisht të hollë të avullit ngjitur drejtpërdrejt me lëngun, numri i molekulave zvogëlohet gjatë gjithë kohës për shkak të kondensimit. . Për të kompensuar këtë humbje, duhet të ketë një lëvizje molare ose molekulare të grimcave të avullit në lëng, megjithatë, të dyja janë të mundshme vetëm nëse ka ndonjë ndryshim në densitet ose presion në drejtim të boshtit x, por asnjëra prej tyre nuk është të mundshme.
A varet dendësia e avullit të ngopur nga temperatura.
Procesi i formimit të avullit nga një fazë e lëngshme ose e ngurtë quhet avullim. Nëse avulli formohet në mënyrë të kundërt, atëherë procesi quhet kondensim.
Çifti mund të shihet si gaz ideal nëse është në kushtet presion i ulët dhe temperaturë të lartë. Në pothuajse 99 raste nga 100, kur përdorin fjalën "avull" kuptojnë ose nënkuptojnë avujt e ujit, në të gjitha rastet e tjera zakonisht ka një sqarim.
Ekzistojnë dy lloje të gjendjeve të avullit komponimet kimike, që nuk përmban përbërës papastërti:
- avulli i pangopur, d.m.th. avulli që nuk është ende në ekuilibër dinamik me lëngun. Nëse sipërfaqja e lëngut është avulli i pangopur, atëherë procesi i avullimit mbizotëron mbi procesin e kondensimit. Kjo është arsyeja pse në këtë rast vëllimi i lëngut në enë do të ulet gradualisht.
- avulli i ngopur, d.m.th. avulli që është në ekuilibër dinamik me një lëng, që do të thotë thjesht si vijon: asnjë nga proceset - avullimi ose kondensimi - nuk mbizotëron njëri mbi tjetrin. Nëse vëllimi është i fiksuar dhe temperatura është e njëjtë në të dy rastet, nuk do të ketë vëllim në enën e dhënë. më shumë avull se sa fillimisht. Ky ekuilibër mund të prishet nëse avulli sipër lëngut kompresohet me ndihmën e një pistoni: kondensimi do të mbizotërojë mbi avullimin. Vlen të kujtohet se ky proces është një fenomen i përkohshëm dhe do të vazhdojë derisa të vendoset sërish ekuilibri dinamik.
Koha për vendosjen e ekuilibrit dinamik midis avullit dhe lëngut varet ndjeshëm nga dendësia e avullit, e cila shoqërohet me ndryshimin në forcat e ndërveprimit ndërmolekular.
Varësia e ndryshimit të densitetit, si dhe karakteristikat e tjera fizike të avullit të ujit (të ngopur) nga temperatura, jepet në tabelë:
Shembuj të zgjidhjes së problemeve
SHEMBULL 1
| Ushtrimi | Njehsoni dendësinë a) për oksigjenin; b) azoti; c) nga ajri i gazrave të mëposhtëm: fluori i borit BF 3 dhe oksidi i azotit (V). |
| Zgjidhje |
M r (BF 3) = A r (B) + 3 × A r (F) = 11 + 3 × 19 = 11 + 57 = 68. D ajër (BF 3) = M r (BF 3) / M r (ajër) = 68/29 = 2,345; D O2 (BF 3) \u003d M r (BF 3) / M r (O 2) \u003d 68 / 32 \u003d 0,875; D N2 (BF 3) = M r (BF 3) / M r (N 2) = 68 / 28 = 1. M r (N 2 O 5) = 2 × A r (N) + 5 × A r (O) = 2 × 14 + 5 × 16 = 28 + 80 = 108. D ajër (N 2 O 5) \u003d M r (N 2 O 5) / M r (ajër) \u003d 108/29 \u003d 3,724; D O2 (N 2 O 5) \u003d M r (N 2 O 5) / M r (O 2) \u003d 108 / 32 \u003d 3,375; D N2 (N 2 O 5) \u003d M r (N 2 O 5) / M r (N 2) \u003d 108 / 28 \u003d 3,857. |
| Përgjigju | Dendësia e fluorit të borit në ajër, oksigjen dhe azot janë përkatësisht 2.345, 0.875 dhe 1; dendësia e oksidit nitrik (V) në ajër, oksigjen dhe azot janë përkatësisht 3.724, 3.375 dhe 3.857. |
SHEMBULL 2
| Ushtrimi | Njehsoni dendësinë a) për oksigjenin; b) azoti; c) nga ajri gazrat e mëposhtëm: monoksidi i karbonit (IV) dhe bromi i hidrogjenit HBr. |
| Zgjidhje | Për të llogaritur dendësinë relative të një gazi nga një tjetër, është e nevojshme të pjesëtohet pesha molekulare relative e gazit të parë me peshën molekulare relative të gazit të dytë. Pesha molekulare relative e ajrit merret e barabartë me 29 (duke marrë parasysh përmbajtjen e azotit, oksigjenit dhe gazrave të tjerë në ajër). Duhet të theksohet se koncepti i "peshës molekulare relative të ajrit" përdoret me kusht, pasi ajri është një përzierje gazesh. M r (HBr) = A r (H) + A r (Br) = 1 + 80 = 81. D ajër (HBr) \u003d M r (HBr) / M r (ajër) \u003d 81 / 29 \u003d 2,7931; D O2 (HBr) \u003d M r (HBr) / M r (O 2) \u003d 81 / 32 \u003d 2,5313; D N2 (HBr) \u003d M r (HBr) / M r (N 2) \u003d 81 / 28 \u003d 2,8929. M r (O 2) = 2 × A r (O) = 2 × 16 = 32. M r (N 2) = 2 × A r (N) = 2 × 14 = 28. M r (CO 2) \u003d A r (C) + 2 × A r (O) \u003d 12 + 2 × 16 \u003d 12 + 32 \u003d 44. D ajër (CO 2) \u003d M r (CO 2) / M r (ajër) \u003d 44 / 29 \u003d 1,5172; D O2 (CO 2) \u003d M r (CO 2) / M r (O 2) \u003d 44 / 32 \u003d 1,375; D H2 (CO 2) \u003d M r (CO 2) / M r (N 2) \u003d 44 / 28 \u003d 1,5714. |
| Përgjigju | Dendësia e bromurit të hidrogjenit në ajër, oksigjen dhe azot janë përkatësisht 2,7931, 2,5313 dhe 2,8929; dendësia e monoksidit të karbonit (IV) në ajër, oksigjen dhe azot janë përkatësisht 1.5172, 1.375 dhe 1.5714. |
Ne kemi vërejtur tashmë se me rritjen e temperaturës, densiteti i avullit të ngopur rritet (shih §6.3). Dendësia e një lëngu në ekuilibër me avullin e tij, përkundrazi, zvogëlohet për shkak të zgjerimit të tij kur nxehet.
Tabela 2 tregon vlerat e densitetit të ujit dhe avullit të tij të ngopur për temperatura të ndryshme.
tabela 2
Nëse në një figurë vizatojmë kthesa për varësinë e densitetit të një lëngu dhe avullit të tij të ngopur nga temperatura, atëherë për lëngun kurba do të ulet, dhe për avullin do të rritet (Fig. 6.6). Në temperaturën kritike, të dy kthesat bashkohen, d.m.th., dendësia e lëngut bëhet e barabartë me densitetin e avullit. Dallimi midis lëngut dhe avullit zhduket.
Gaz dhe avull
Fjalët “gaz” dhe “avull” i kemi përdorur shumë herë. Këto terma filluan në një kohë kur besohej se avulli mund të shndërrohej në një lëng, por një gaz jo. Pasi të gjithë gazrat janë kondensuar (shih § 6.7), nuk ka asnjë bazë për një terminologji të tillë të dyfishtë. Avulli dhe gazi janë një dhe e njëjta gjë, nuk ka asnjë ndryshim thelbësor midis tyre. Kur njerëzit flasin për avullin e një lëngu, zakonisht nënkuptojnë se temperatura e tij është më e ulët se ajo kritike dhe se mund të shndërrohet në lëng me anë të ngjeshjes. Është vetëm nga zakoni që flasim për avujt e ujit dhe jo për gazin e ujit, për avullin e ngopur dhe jo për gazin e ngopur etj.
Studim eksperimental i gjendjes kritike
Eksperimentet për studimin e gjendjes kritike u kryen në 1863 nga shkencëtari rus MP Avenarius. Pajisja me të cilën mund të vëzhgoni gjendjen kritike (pajisja Avenarius) përbëhet nga një banjë ajri (Fig. 6.7) dhe një tub qelqi i mbyllur (ampula) me eter të lëngshëm brenda banjës. Vëllimi i ampulës (kapaciteti i saj) është i barabartë me vëllimin kritik të eterit të derdhur në tub. Hapësira mbi eterin në ampulë është e mbushur me avull të ngopur të eterit.
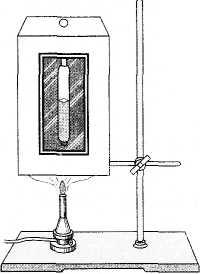
Duke përdorur një djegës me gaz ose ngrohës tjetër, banja e ajrit nxehet. Gjendja e eterit vërehet përmes një dritareje xhami në instrument.
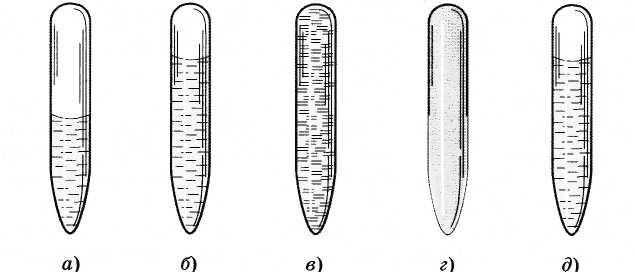
Në temperaturën e dhomës, ju mund të shihni qartë kufirin midis lëngut dhe avullit (Fig. 6.8, a). Me afrimin e temperaturës kritike, vëllimi i eterit të lëngshëm rritet dhe ndërfaqja lëng-avull bëhet e shprehur dobët, e paqëndrueshme (Fig. 6.8, b).
Kur afrohet gjendje kritike kufiri midis tyre zhduket plotësisht (Fig. 6.8, në).
Kur ftohet, shfaqet një mjegull e dendur, duke mbushur të gjithë tubin (Fig. 6.8, G). Këto janë pika të lëngshme. Pastaj ato bashkohen së bashku dhe përsëri ekziston një ndërfaqe midis lëngut dhe avullit (Fig. 6.8, e).
Eteri u zgjodh për eksperimentin, pasi ka një presion kritik relativisht të ulët (rreth 36 atm). Temperatura e tij kritike është gjithashtu e ulët: 194 °C.
Nëse e ngjeshni gazin, duke e mbajtur temperaturën e tij mbi atë kritike (shih Fig. 6.4, izotermi T3), dhe, si më parë, filloni me vëllime shumë të mëdha, atëherë një rënie në vëllim do të çojë në një rritje të presionit në përputhje me ekuacionin e gjendjes së një gazi ideal. Sidoqoftë, nëse kondensimi i avullit ka ndodhur në një temperaturë nën atë kritike në një presion të caktuar, atëherë tani nuk do të vërehet formimi i lëngut në enë. Mbi temperaturën kritike, një gaz nuk mund të shndërrohet në lëng në asnjë presion.
Ky është kuptimi kryesor i konceptit të temperaturës kritike.






