Tabelul energetic Gibbs al valorilor standard. Entalpii standard de formare a substanțelor, entropii standard și energii Gibbs standard de formare a substanțelor
Entalpia molară standard de formare a unei substanțe ΔH o6p, m (298 K) este modificarea entalpiei în timpul formării unui mol dintr-o substanță dată din elementele sale constitutive în stările lor standard la o temperatură de 298 K și o presiune de o singură atmosferă.
Să comparăm această definiție cu exemplele date mai sus. Ne-am asigurat
că oxidarea hidrogenului poate fi reprezentată de cel puţin trei diferite ecuații stoichiometrice. Astfel, cunoaștem cel puțin trei entalpii molare standard diferite:
a) ΔH°t (298 K, 2H20(l.)) = - 571,6 kJ/mol
b) ΔH°t (298 K, H20(l.)) = - 285,8 kJ/mol
c) ΔH°t (298 K, H2O(T.)) = - 241,8 kJ/mol
Care dintre aceste valori corespunde entalpiei molare standard de formare a apei? Valoarea (c) nu îi poate corespunde, deoarece starea standard a apei la 298 K nu este o stare vaporoasă (gazoasă), corespunzătoare denumirii H20(g). Entalpia molară standard de formare a apei poate avea una dintre cele două valori rămase, diferența dintre care este determinată de modul în care este scrisă ecuația reacției. Cu toate acestea, deoarece definiția de mai sus a entalpiei molare standard de formare indică faptul că aceasta corespunde modificării entalpiei pe mol a substanței formate, ar trebui aleasă opțiunea (b). În acest fel, entalpia molară standard de formare a apei\u003d - 285,8 kJ / mol.
În tabel. Tabelul 5.1 enumeră entalpiile molare standard de formare a unor substanțe comune în stările lor standard. Rețineți că tabelul include nu numai substanțe, ci și unii ioni. Ionii și mulți compuși nu pot fi obținuți prin sinteză directă din elementele care îi formează. Cu toate acestea, entalpiile lor standard de formare pot fi calculate folosind legea lui Hess (despre care vom afla în secțiunea 5.3).
Majoritatea compușilor sunt caracterizați prin entalpii negative de formare. Prin urmare, se numesc compuși exotermici. Doar câțiva compuși au o entalpie de formare pozitivă. Se numesc compuși endotermici. Un exemplu de compus endotermic este benzenul.
Trebuie acordată atenție faptului că entalpiile de formare a compușilor solizi, de regulă, au valori negative mai mari (în valoare absolută) decât entalpiile de formare a gazelor. Entalpia molară standard de formare a unei substanțe sau ion este o măsură a stabilității acestuia în comparație cu elementele care formează un anumit compus. Cu cât valoarea negativă a entalpiei de formare a unui compus este mai mare (în valoare absolută), cu atât acest compus este mai stabil.
Prin definiție, entalpia molară standard de formare a oricărui element în starea sa standard la 298 K este zero. De exemplu, ΔH (298 K, 02(g)) = 0.
Tabelul 5.1. Entalpii molare standard de formare
Substanţă |
ΔН(298 K), kJ/mol |
Substanţă |
D298 K), kJ/mol |
Grupați componente pentru calcularea proprietăților gazelor ideale conform Benson
Cicloalcani
Hidrocarburi de acetilenă
hidrocarburi aromatice
Entalpia de formare
Prognoza entalpiei de formare
Predicția compușilor organici prin metoda Benson pentru atomii cu primul lor mediu
Câteva grupuri multivalente ale metodei Benson pentru starea ideală de gaz
INTRODUCERE
Cea mai bună soluție pentru dezvoltarea proceselor de tehnologie chimică și a echipamentelor pentru implementarea lor este posibilă numai cu informații fiabile despre proprietățile fizico-chimice și termodinamice ale compușilor chimici. Astfel de informații reprezintă adesea 50 până la 90% din inputul de proiectare.
Pentru practică, datele experimentale sunt de preferat. De-a lungul anilor, o cantitate imensă de astfel de date a fost colectată și procesată. Aceste informații sunt disponibile în numeroase compilații și cărți de referință. În unele dintre ele sunt date toate valorile cunoscute în prezent ale caracteristicilor termodinamice și fizico-chimice și se face analiza lor critică. Altele conțin doar valori recomandate de autori, fiind adesea fie valori medii, fie rezultatul prelucrării statistice a întregii game de informații acumulate. Cu toate acestea, progresul rapid al tehnologiei și introducerea în domeniu a tot mai multe substanțe și materiale noi provoacă un decalaj semnificativ între nevoia de date și disponibilitatea acestora. Determinarea valorilor experimentale în parametrii largi ai stării și compozițiilor este adesea dificilă și uneori pur și simplu imposibilă.
Din acest motiv, inginerul este adesea forțat să se bazeze pe o varietate de metode pentru calcularea și prezicerea proprietăților substanțelor. Trebuie avut în vedere faptul că termenii „calcul” și „prognoză” sunt adesea folosiți în mod interschimbabil, deși al doilea dintre ei implică o recunoaștere sinceră a faptului că rezultatul poate fi doar parțial corect. Calculele pot fi bazate pe teorie, pe corelarea valorilor experimentale sau pe o combinație a ambelor.
Entalpia de formare
Entalpia de formare este principala proprietate utilizată în rezolvarea multor probleme teoretice și practice. Cunoașterea entalpiilor de formare a reactanților face posibilă calcularea efectelor termice ale reacțiilor de interes, ceea ce este necesar la estimarea diferenței de temperatură adiabatică în zona de reacție, formând cerințe pentru proiectarea reactorului și caracteristicile tehnologice ale procesului chimic. Entalpiile de formare a substanțelor sunt necesare atunci când se efectuează o analiză termodinamică cantitativă a proceselor, se determină gradul teoretic de conversie a reactivilor, se aleg condițiile de desfășurare. transformare chimică etc. Calitatea analizei termodinamice efectuate depinde în mare măsură de fiabilitatea informațiilor despre entalpiile de formare a substanțelor.
Unitățile de entalpie sunt kJ/mol și J/mol. În literatura de referință din anii precedenți, entalpiile de formare sunt adesea prezentate în kcal/mol (1 cal = 4,184 J, 1 kcal = 4,184 kJ).
Entalpia de formare () a legăturii în sens restrâns este standard modificarea entalpiei în reacția de formare a unei substanțe date din elemente sau substanțe simple. Substanțele simple sunt elemente chimice care se află la temperatura considerată în faza și stările lor chimice naturale.
Ca stare standard a unei substanțe, se alege o astfel de stare în care această substanță este stabilă la o presiune standard de 1 atm (101325 Pa). Starea de condensare a unei substanțe este standard până la acele temperaturi la care presiunea acesteia abur saturat ajunge la 1 atm. Peste aceste temperaturi, starea de gaz ideală este aleasă ca standard.
Pentru substanțele simple implicate în formarea moleculelor majorității compușilor organici, starea standard la 298,15 K este:
pentru carbon - grafit;
pentru hidrogen, oxigen, azot, fluor și clor - un gaz diatomic ideal;
pentru brom, un lichid diatomic;
pentru iod și sulf - o stare cristalină, diatomic și, respectiv, monoatomic.
Valorile entalpiei absolute nu pot fi determinate, deoarece includ valori absolute energie interna. Necesitatea de a determina entalpiile de formare a compușilor a necesitat realizarea unui acord internațional, conform căruia valorile elementelor și substanțelor simple în stare standard au fost luate egale cu zero.
Mărimea și semnul substanțelor cu o structură moleculară complexă pot fi diferite. Acest lucru este explicat după cum urmează. Formarea materiei din atomi liberi este întotdeauna însoțită de eliberarea de energie, substanțele rezultate sunt negative. Cu toate acestea, atunci când o substanță este formată din substanțe simple formate din molecule diatomice (H 2, O 2, N 2, Cl 2 etc.) sau în stare condensată (carbon, brom etc.), o anumită cantitate de energie este necesare pentru a rupe legăturile din moleculele acestor substanțe simple sau pentru a le transfera în stare gazoasă. Ca rezultat, entalpia de formare poate fi atât pozitivă, cât și negativă și egală cu zero.
În cazul general, valoarea și semnul nu oferă motive pentru nicio afirmație cu privire la stabilitatea termodinamică a unei substanțe, deoarece aceasta depinde nu numai de entalpie, ci și de componenta entropică a modificării energiei libere în timpul formării acestei substanțe. substanţă. Cu toate acestea, pentru a compara stabilitatea termodinamică a reprezentanților aceluiași grup omolog sau compuși cu o structură moleculară similară, poate fi destul de informativ, în prima aproximare, să analizăm entalpiile lor de formare. În acest caz, o substanță cu o entalpie de formare mai mică are o stabilitate termodinamică mai mare.
Pentru majoritatea compușilor, reacțiile de formare a acestora din substanțe simple nu pot fi efectuate în practică. Principala sursă de informații faptice despre entalpiile de formare a compușilor organici sunt datele experimentale privind entalpiile arderii acestora (), obținute prin metoda calorimetrică. Acumulate până în prezent și valorile recomandate și sunt cuprinse în compilații. Până acum, informațiile de referință despre au fost furnizate exclusiv prin date calorimetrice. Metodele empirice moderne de prognoză se bazează, de asemenea, numai pe date calorimetrice. Totodată, trebuie menționat că informațiile unice în ceea ce privește gama de substanțe implicate, volumul de studii efectuate și acuratețea caracteristicilor termodinamice obținute sunt conținute în rezultatele studiului echilibrului chimic. În opinia noastră, utilizarea eficientă a acestor informații va extinde semnificativ capacitățile de prognostic ale metodelor de calcul în masă a substanțelor organice.
PREVIZIA ENTALPIILOR DE FORMARE
Principalele metode de predicție a entalpiilor de formare a compușilor organici se referă la, adică ele caracterizează proprietatea unei substanțe în starea unui gaz ideal la o presiune de 1 atm. și o temperatură de 298,15 K, care este adesea numită standard. Dintre metodele de calcul al masei, o atenție deosebită trebuie acordată metodelor mecanicii moleculare și metodelor aditive (lat. aditio- adaos). Majoritatea metodelor semi-empirice nu oferă calitatea de prognoză necesară. Metodele neempirice nu oferă acces direct la entalpiile de formare a substanțelor și, în plus, sunt încă inaccesibile pentru calcularea proprietăților substanțelor organice cu o structură moleculară complexă.
În grupul de metode de mecanică moleculară, am acumulat o experiență considerabilă în utilizarea metodei MMX (bazată pe Câmp de forță Ellenger). Metoda sa dovedit bine în aplicare la alcani. Cu toate acestea, chiar și pentru compușii aromatici, este recomandabil să se folosească nu pentru calcularea entalpiilor de formare, ci pentru evaluarea efectelor interacțiunii substituenților în moleculă, adică. pentru diferenţele de entalpii de formare a izomerilor. Pentru majoritatea compușilor organohalogenați, care conțin oxigen, azot și sulf, metoda oferă estimări părtinitoare. Cu toate acestea, această metodă ar trebui utilizată în toate cazurile pentru evaluarea expresă a unei proprietăți. Ca orice altă metodă, necesită ca rezultatele să fie susținute de informații obținute printr-o altă metodă de prognoză. Metoda mecanicii moleculare are o interfata excelenta si este extrem de eficienta ca sursa de informatii despre structura moleculelor si parametrii lor geometrici.
În absența datelor de referință pentru prognoză, în prezent sunt utilizate pe scară largă diferite metode aditive. De la crearea principalelor metode aditive pentru prezicerea proprietăților substanțelor organice în starea unui gaz ideal, a trecut o perioadă semnificativă de timp, dar își păstrează importanța, în ciuda metodelor din ce în ce mai accesibile de modelare moleculară. Aceste metode sunt eficiente în acele cazuri când proprietatea se modifică liniar cu o modificare a numărului de fragmente de același tip din moleculă. Strict aditiv este, de exemplu, greutatea moleculară a unei substanțe. Pentru entalpiile de formare a compușilor organici, abordarea aditivă este în multe cazuri doar o aproximare în calcul. Faptul este că chiar și într-un grup omoloage se modifică neliniar cu o modificare a numărului de atomi de carbon din moleculă (Fig. 1.1).
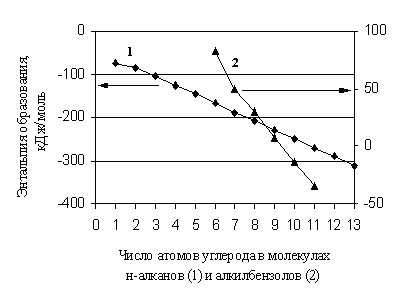
Orez. 1.1. Dependența entalpiei de formare a n-alcanilor și alchilbenzenilor de numărul de atomi de carbon din moleculele lor
Astfel, diferența omoloagă nu este o valoare constantă, în special pentru primii membri ai grupurilor omoloage. În același mod, cu creșterea numărului de substituenți de același tip în moleculele de substanțe organice, este de foarte multe ori necesar să se vorbească despre o abatere de la aditivitate în . Cu toate acestea, atunci când sunt introduse corecții pentru nonaditivitate, metodele acestui grup funcționează destul de satisfăcător dacă gradul și profunzimea detalierii lor sunt suficiente și corespund acurateței experimentului modern.
În funcție de ideologia adoptată, purtătorii de informații structurali și cantitativi în metodele aditive pot fi atomii, grupurile de atomi sau legăturile care alcătuiesc o moleculă. Majoritatea metodelor de prognoză sunt construite în așa fel încât, pe măsură ce baza de date privind entalpiile de formare se extinde, este relativ ușor să rafinați valorile contribuțiilor parțiale sau să introduceți noi corecții.
Abordarea generală a predicției entalpiilor de formare a substanțelor implică calculul cu tranziția ulterioară, dacă este necesar, la entalpiile de formare a gazelor ideale la alte temperaturi sau k , i.e. la o proprietate a materiei în stare reală.
Din varietatea metodelor de calcul aditiv, luăm în considerare două; Metoda grupului lui Benson pentru atomi cu primul lor mediu și metoda lui Tatevskii pentru legături.
Predicția compușilor organici prin metoda Benson pentru atomii cu primul lor mediu
Ar trebui să recunoaștem faptul că dintre toate variantele de scheme de aditivi pentru prezicerea entalpiilor de formare a substanțelor organice, metoda Benson este cea mai utilizată pe o perioadă lungă de timp. Acest lucru se explică probabil prin faptul că această metodă acoperă cea mai largă gamă de compuși. Pentru evaluarea rapidă a marii majorități a compușilor fără implicarea vreunui mijloc tehnic, metoda, probabil, nu are egal. Este destul de evident că prețul universalității sale este exactitatea prognozei. Prin urmare, atunci când utilizați metoda, este necesar să fiți conștienți de limitările ei inevitabile. Vom încerca să atragem atenția potențialilor utilizatori asupra celor principale, care sunt rezultatul testării noastre ample a metodei.
Metoda Benson este de obicei numită metoda grupului, deși atom cu primul său anturaj. Metoda a fost dezvoltată de autor pentru a calcula următoarele proprietăți ale gazelor ideale ale substanțelor: capacitatea termică la temperaturi care sunt multipli de 100 de grade, entalpia de formare și entropia.
Entalpia sistemului. conditii standard. Entalpia de formare a unei substanțe. Entalpia de reacție. Reacții endoterme și exoterme.
Entalpia sistemului (din grecescul enthalpo I căldură) este ϶ᴛᴏ o funcție cu o singură valoare H a stării unui sistem termodinamic cu parametrii de entropie independenți S și presiunea P, care este legată de energia internă U prin relația H =U+PV, unde V este volumul sistemului.În chimie, de cele mai multe ori se consideră procese izobare (P = const), iar efectul termic în acest caz se numește modificarea entalpiei sistemului sau entalpia procesului: Qp = ∆H; ∆H=∆U+P∆V. Entalpia are dimensiunea energiei (kJ). Valoarea sa este proporțională cu cantitatea de substanță; entalpia unei cantități unitare dintr-o substanță (mol) se măsoară în kJ∙mol–1. Într-un sistem termodinamic, căldura eliberată dintr-un proces chimic este considerată negativă (proces exotermic, ΔH< 0), а поглощение системой теплоты соответствует эндотермическому процессу, ΔH >0. Ecuațiile reacțiilor chimice care indică entalpia procesului se numesc termochimice. Valorile numerice ale entalpiei ΔH sunt indicate cu virgulă în kJ și se referă la întreaga reacție, ținând cont de coeficienții stoichiometrici ai tuturor reactanților. Deoarece reactanții pot fi în diferite stări de agregare, atunci este indicat prin indexul din dreapta jos între paranteze: (t) - solid, (k) - cristalin, (g) - lichid, (d) - gazos, (p) - dizolvat. De exemplu, interacțiunea dintre H2 și Cl2 gazos produce doi moli de HCl gazos. Ecuația termochimică se scrie astfel: Când H2 și O2 gazos interacționează, H2O format poate fi în trei stări de agregare, ceea ce va afecta modificarea entalpiei: 298K. stare standard funcția termodinamică, de exemplu, entalpia, este indicată prin indice și indice: indicele este de obicei omis: Δ.
Entalpia de formare (căldura de formare), entalpia reacției de formare a unei anumite substanțe (sau soluție) din substanțe inițiale date. Entalpia de formare a unui compus chimic se numește entalpia reacției de formare a unui compus dat din substanțe simple. După cum aleg substanțele simple elemente chimiceîn faza lor naturală şi starea lor chimică la o temperatură dată. Deci, la 298 K, pentru clor, clorul gazos, format din molecule C12, este o substanță simplă, iar pentru potasiu, potasiul metalic. Entalpia de formare a solidului KCl la 298 K este entalpia reacției: K(solid) + 1/2Cl2= KCl(solid).Entalpia de formare a KCl(solid) la 500 K corespunde reacției: K( lichid) + 1/2Cl2 = KCl (solid), deoarece starea naturală de fază (substanță simplă) pentru potasiu nu mai este un cristal, ci un lichid (temperatura de topire K 336,66 K).
Entalpia de formare trebuie determinată la orice temperatură. Entalpiile standard de formare corespund reacțiilor de formare în care atât substanțele simple, cât și compusul rezultat sunt sub presiune de 1 atm (1,01 x 105 Pa). Prin definiție, pentru toate substanțele simple la orice temperatură = 0. Pentru majoritatea substanțelor chimice. conn. entalpia de formare - negativă. cantități.
Unitățile de măsură ale entalpiei de formare sunt J / g, J / mol. În termodinamica soluțiilor (topituri), entalpia de formare este înțeleasă ca modificarea entalpiei în timpul formării izotermo-izobare a 1 mol (1 g). ) a unei soluții (topite) a unei compoziții date din componente pure. Deci, în sistemul cu două componente KF-A1F3, entalpia de formare a unei topituri cu 50% compoziție molară corespunde procesului: 1/2KF (lichid) + 1/2A1F3 (lichid) = KF-A1F3 (topitură, 50). mol.%).
Reacții endoterme (din altă greacă ἔνδον - interior și θέρμη - căldură) - reacții chimice însoțite de absorbția căldurii. Pentru reacțiile endoterme, modificarea entalpiei și a energiei interne sunt pozitive (ΔH > 0, ΔU > 0), astfel, produșii de reacție conțin mai multă energie decât componentele originale.Reacțiile endoterme includ: reacții de reducere a metalelor din oxizi, electroliză ( energia electrică este absorbită), disociere electrolitică (de exemplu, dizolvarea sărurilor în apă), ionizare, fotosinteză.Reacțiile endoterme sunt opusul reacțiilor exoterme.
O reacție exotermă este o reacție chimică însoțită de eliberarea de căldură. Opusul unei reacții endoterme.Cantitatea totală de energie dintr-un sistem chimic este extrem de greu de măsurat sau calculat. Pe de altă parte, modificarea entalpiei ΔH în reactie chimica mult mai ușor de măsurat sau numărat. În aceste scopuri se folosesc calorimetre. Valoarea măsurată a ∆H este legată de energia de legare a moleculelor astfel: ∆H = energia cheltuită în ruperea legăturilor - energia eliberată la formarea legăturilor produselor de reacție.Pentru reacțiile exoterme, această formulă dă un negativ valoare pentru ∆H, deoarece valoarea mai mare este scăzută din valoarea mai mică. În timpul arderii hidrogenului, de exemplu: 2H2 + O2 → 2 H2O, modificarea entalpiei este ΔH = −483,6 kJ pe un mol de O2.
Arderea combustibilului în oxigenul atmosferic.
Arderea prafului de pușcă.
Adăugarea acidului sulfuric concentrat în apă.
Oxidarea grăsimilor și carbohidraților din organismele vii.
Arderea adiabatică
Entalpia sistemului. conditii standard. Entalpia de formare a unei substanțe. Entalpia de reacție. Reacții endoterme și exoterme. - concept și tipuri. Clasificarea si caracteristicile categoriei "Entalpia sistemului. Conditii standard. Entalpia de formare a materiei. Entalpia de reactie. Reactii endoterme si exoterme." 2014, 2015.
Ecuații de bază ale termodinamicii chimice și echilibrului chimic
1.Q=DE+W-ecuația primei legi a termodinamicii
2.W=PDV
3. Q v = DE v -căldura procesului izocor
4. Q p = DH p -căldura procesului izobar
5. DH p = DE + PDV -ecuația primei legi a termodinamicii pentru procesele izobare
6. DH = å n DH 0 298 arr. prod. reacţiona. - å n DH 0 298 arr. ref. substante - P Primul corolar al legii lui Hess
7. DH = å n DH 0 298 ardere. Exod. în. - å n DH 0 298 ars prod. reactii - inal doilea corolar al legii lui Hess
8.Q=W-ecuația primei legi a termodinamicii pentru biosisteme
9.DS = ¾¾ -entropia în funcție de starea sistemului
10.DS ³ 0 -ecuația celei de-a doua legi a termodinamicii
11 S = å n S 0 298 cont. R. - å n S 0 298 ref. în. -calculul entropiei de reacție
12. DG 0 = DH 0 - TDS 0 -ecuații pentru calcularea energiei Gibbs
13. DG 0 = å n DG 0 298 prod. R. - å n DG 0 298 ref. în.(X)
14. DG 0 \u003d - 2.3RT lg Ks - ecuația izotermei reacției chimice în condiții standard
15. - ecuația izotermei reacției chimice
16. - constantă de echilibru chimic exprimată în termeni de concentrații de echilibru ale unei substanțe
17. - constantă de echilibru chimic exprimată în termeni de echilibru presiuni parțiale substante
18. - ecuația izobară
19. - calculul efectului termic din valorile constantelor
tabelul 1
| Substanţă | Entalpia standard de formare kJ/mol | Entropia standard J/mol×K | Energia Gibbs standard de formare kJ/mol |
| substante anorganice | |||
| C (grafit) | +6 | ||
| CO (g) | -110 | +198 | -137 |
| CO 2 (g) | -393,5 | +214 | -394 |
| CI2 (g) | +223 | ||
| CI20 (g) | +76 | +266 | +94 |
| FeСО 3 (tv) | -753 | +96 | -680 |
| H2 (g) | +131 | ||
| HCI (g) | -92 | +187 | -95 |
| Bună g) | +24 | +206 | -1 |
| HNO2 (soluție) | -119 | +153 | -56 |
| HNO 3 (l) | -174 | +156 | -81 |
| H2O (l) | -286 | +70 | -237 |
| H2O2 (l) | -187 | +110 | -120 |
| H2S (g) | -21 | +206 | -34 |
| H2SO4 (l) | -814 | +157 | -690 |
| KNO 3 (TV) | -495 | +133 | -395 |
| KOH (soluție) | -477 | +92 | -441 |
| N2 (g) | +192 | ||
| NH3 (g) | -46 | +192 | -16 |
| H2O (g) | +82 | +220 | +104 |
| NU (g) | +91 | +211 | +87 |
| NR 2 (g) | +33 | +240 | +51 |
| N2O3 (g) | +11 | +356 | +115 |
| Na 2 O 2 (TV) | -510 | +95 | -447 |
| Na 2 S 2 O 3 (TV) | -1117 | +225 | -1043 |
| O 2 (g) | +205 | ||
| SO 2 (g) | -297 | +248 | -300 |
| SO 3 (g) | -396 | +257 | -371 |
| materie organică | |||
| metan (g) | -75 | +186 | -51 |
| Etan (g) | -85 | +229 | -33 |
| Etilenă (g) | +52 | +219 | +68 |
| Acetilena (g) | +227 | +201 | +209 |
| benzen (w) | +49 | +173 | +125 |
| Ciclohexan (l) | -156 | +204 | +27 |
| clormetan (g) | -86 | +234 | -63 |
| Diclormetan (g) | -95 | +270 | -69 |
| Triclormetan (g) | -101 | +296 | -69 |
| tetraclorură de carbon (g) | -100 | +310 | -58 |
| Metanol (w) | -239 | +127 | -166 |
| Etanol (w) | -277 | +161 | -174 |
| Eter dietil (l) | -279 | +253 | -123 |
| acetaldehidă (g) | -166 | +264 | -133 |
| Acetonă (w) | -247 | +199 | -154 |
| Ioni de piruvat (soluție) | + | -559 | |
| Acid L-lactic (soluție) | -686 | +222 | -539 |
| Zaharoza (TV) | -2222 | +360 | -1545 |
| D-glucoză (soluție) | -1264 | +269 | -917 |
| Nitrobenzen (w) | +16 | +224 | +146 |
| anilina (w) | +31 | +191 | +149 |
| L-leucină (soluție) | -643 | +208 | -362 |
| Glicina (soluție) | -523 | +159 | -380 |
| D,L-leucilglicină (soluție) | + | -464 | |
| Glicilglicină (soluție) | -734 | +231 | -492 |
Entalpii standard de ardere a substanțelor organice, kJ/mol
Căldura specifică oxidarea completă a substanțelor din organism, kJ/g.
Sarcini de invatare:
Sarcina 1În corpul uman, reacția de oxidare a alcoolului etilic are loc în două etape. Prima este oxidarea alcoolului etilic la acetaldehidă cu participarea enzimei alcool dehidrogenază, care se desfășoară conform ecuației: C 2 H 5 OH + ½ O 2 \u003d CH 3 COH + H 2 O.
Calculați DH 0 al reacției folosind primul corolar al legii lui Hess dacă
DН 0 arr. (C2H5OH) \u003d - 278 kJ/mol;
DН 0 arr. (CH3COH) \u003d - 166 kJ / mol;
DН 0 arr. (H2O) \u003d - 286 kJ / mol.
Soluţie: DH 0 = å n DH 0 - å n DН 0 invers ref.in.in; DH = (-166+ (-286)-(-278)) = - 174 kJ/mol
Răspuns: efectul termic al reacției DH = -174 kJ/mol, i.e. proces exotermic.
Sarcina 2. Căldura de ardere a glucozei este de -2810 kJ/mol, căldura de ardere a alcoolului etilic este de -1366 kJ/mol. Pe baza acestor date, calculați efectul termic al procesului biochimic de fermentare a glucozei:
C 6 H 12 O 6 \u003d 2C 2 H 5 OH + 2CO 2
Soluţie: Efectul termic al acestei reacții poate fi calculat prin aplicarea celui de-al doilea corolar al legii lui Hess:
DH = ån DH 0 arde. Exod. substanţe - å n DH 0 arde. prod. reactii
DH \u003d -2810 - 2 ∙ (-1366) \u003d - 78 kJ / mol
Răspuns: efectul termic al procesului de fermentare este de - 78 kJ/mol.
Sarcina 3. Calculați entropia standard a reacției:
NH 2 - CH 2 - COOH + NH 2 - CH 2 - COOH → NH 2 - CH 2 - CO - NH - CH 2 - COOH + H 2 O
glicină glicină glicilglicină
Dacă S 0 (glicilglicină) = 231 J / mol × K;
S 0 (glicină) \u003d 159 J / mol × K;
S 0 (H 2 O) \u003d 70 J / mol × K;
Soluţie:
DS \u003d S 0 298 (hl-hl) + S 0 298 (H 2 O) - 2 S 0 298 (glicină) \u003d (231 + 70) - (159 + 159) \u003d -17 J / mol × K
Răspuns: DS 0 298 \u003d - 17 J / mol × K, adică. entropia va scădea.
Sarcina 4. Căldura de ardere a carbohidraților, proteinelor și grăsimilor este de 17, 17 și 39 kJ
respectiv. Necesarul mediu zilnic de proteine, grăsimi și carbohidrați pentru studenții de sex masculin este de 113, 106 și 451 g. Care este necesarul zilnic de energie al studenților de sex masculin?
Soluţie: Calculați câtă energie este eliberată în timpul oxidării carbohidraților, proteinelor și grăsimilor
DH = (451×17) + (113×17) + (106×39) = 13722 kJ.
Răspuns: Necesarul zilnic de energie este de 13722 kJ.
Sarcina 5. De ce procesul de denaturare a proteinei la 40 0 C este spontan dacă reacția este endotermă și efectul termic este de 2830 J/mol? Valoarea DS pentru această reacție este 288 J/mol∙K
Soluţie: Pentru a determina direcția procesului, este necesar să se cunoască mărimea modificării energiei Gibbs, calculată prin ecuația: DG 0 = DH 0 - TDS 0 . Calculul arată că DG< 0 (DG 0 = 2830 Дж/моль - (313К × 288 Дж/моль∙К) = - 87314 Дж/моль или - 87,3 кДж/моль).
Răspuns: Pentru că DG< 0, то процесс денатурации белка при 40 0 С протекает самопроизвольно, повышение температуры тела может представлять опасность для жизнедеятельности организма.
Sarcina 6. Calculați energia Gibbs, care este un criteriu pentru spontaneitatea proceselor, pentru reacția de glicoliză în condiții standard: C 6 H 12 O 6 (soluție) ® 2C 3 H 6 O 3 (soluție) (acid lactic).
Soluţie:
Din tabelul de valori termodinamice scriem energia Gibbs standard pentru participanții la procesul chimic: ∆G 0 (C 6 H 12 O 6) = -917 kJ / mol; ∆G0 (C3H6O3) = -539 kJ/mol. Folosind 1 corolar din legea Hess, calculăm energia Gibbs:
ΔG 0 = 2×ΔG 0 (C 3 H 6 O 3) - ΔG 0 (C 6 H 12 O 6)
ΔG 0 \u003d 2 (-539) - (-917) \u003d -161 kJ / mol
Răspuns: deoarece ∆G0< 0, то реакция протекает самопроизвольно в directie înainte.
Sarcina 7. Calculați modificarea energiei Gibbs la 25 0 C folosind valorile standard ale entalpiilor de formare și entropiilor absolute pentru această reacție: CO + 2H 2 = CH 3 OH
DН 0 arr CH 3 OH \u003d -293 kJ / mol S 0 (CH 3 OH) \u003d 127 J / mol × K
DH 0 arr CO \u003d - 110 kJ / mol. S 0 (CO) \u003d 198 J / mol × K
S 0 (H 2) \u003d 131 J / mol × K
Soluţie: DG 0 = DH 0 - TDS 0
DH 0 = ånDH 0 arr. pr. reak. - ånDH 0 arr. ref. substante
DH 0 \u003d - 293 - (-110) \u003d - 183 kJ / mol
DS 0 = å n S 0 cont. p - å n S 0 rezultat. substante
DS 0 \u003d 127 - (198 + 2 (131) \u003d - 333 J / mol × K
DG 0 \u003d - 183,5 kJ / mol - (298K × 0,333 kJ / mol × K) \u003d - 83,8 kJ / mol
Răspuns: DG 0 \u003d - 83,8 kJ / mol
Sarcina 8. Calculați constanta de echilibru la 310 K pentru reacția ATP + AMP ↔ 2ADP dacă energie gratis Reacția Gibbs ΔG°=-2,10 kJ/mol.
Soluţie:în echilibru DG 0 = - 2,3RT log Ks
K c \u003d 10 0,354 \u003d 2,26
Răspuns: Kc = 2,26
Sarcina 9. Constanta de echilibru a reacției: PCl 5 (g) „PCl 3 (g) + Cl 2 (g) la 250 0 C este 2. În ce direcție are loc reacția la următoarele concentrații: C (PCl 5) \u003d C (PCl 3) \u003d 2 mol/l; C (Cl 2) \u003d 4 mol / l?
Soluţie: Pentru a determina direcția reacției, folosim ecuația izotermă
Calculați Ps
pentru că P s > K s, apoi DG > 0
Concluzie: reacţia nu poate decurge spontan în direcţia înainte, deoarece DG>0.
Sarcina 10. Constanta de echilibru a reacţiei 2SO 2 (g) + O 2 (g) Û 2SO 3 (g) la o temperatură de 627 0 C este 2,3 ∙ 10 -7, DH 0 = 376,5 kJ/mol. Calculați constanta de echilibru la 727 0 С.
Soluţie: folosim ecuația izobarei unei reacții chimice:
T 1 \u003d 273 + 627 \u003d 900 K
T2 = 273 + 727 = 1000K
Răspuns: Constanta de echilibru la 727 0 C este 3,56 × 10 -5.
Sarcina 11. Pentru reacția H 2 O (g) + CO (g) ® CO 2 (g) + H 2 (g), constantele de echilibru chimic sunt: la 800 0 C Kp = 2,87, la 1000 0 C Kp = 1,39. Calculați efectul termic al acestei reacții.
Soluţie: Aplicând ecuația izobarei unei reacții chimice, calculăm DH
Să luăm T 1 = 800 + 273 = 1073 K
T 2 \u003d 1000 + 273 \u003d 1273 K
Răspuns: DH = -39,16 kJ/mol.
Sarcini pentru soluție independentă:
Sarcina 1. Este nevoie de 40 kJ pentru a se evapora 1 mol de apă. Câtă căldură se va pierde pe zi când 720 g de apă sunt eliberate prin piele?
Răspuns: 1600 kJ
Sarcina 2. Peroxid de hidrogen (H 2 O 2) sub formă de soluție cu o fracție de masă de 3%. utilizat în medicină pentru tratarea rănilor. Demonstrați că procesul de descompunere a peroxidului de hidrogen în prezența enzimei catalaze este spontan, folosind valorile entropiei standard de formare a substanțelor inițiale și a produselor de reacție pentru a calcula:
S0298 (H202) = 110 J/mol x K; S 0 298 (H 2 O) \u003d 70 J / mol × K; S 0 298 (O 2) = 205 J/mol × K.
Răspuns: Δ S = 62,5 J/mol × K
Sarcina 3. La arderea metanului cu un volum de 2 m 3, se eliberează 79600 kJ de căldură. Calculați căldura standard de ardere a metanului.
Răspuns: 891,52 kJ/mol
Sarcina 4. Calculați energia Gibbs standard pentru procesul de oxidare a glucozei conform următoarelor date: DH 0 arr (C 6 H 12 O 6) \u003d - 1264,4 kJ / mol; DH 0 arr (CO 2) \u003d - 393 kJ / mol;
DH 0 arr (H2O) \u003d - 286 kJ / mol. Modificarea entropiei întregului sistem de reacție este de 0,259 kJ/mol × K
Răspuns: DG \u003d - 2886,8 kJ / mol.
Sarcina 5. Calculați entalpia standard de formare a etanolului folosind entalpiile standard de ardere necesare.
Răspuns: DН 0 arr. = -273 kJ/mol
Sarcina 6. Constanta de echilibru a reacției N 2 0 4 (g) ↔ 2N0 2 (g) la 25°C este 0,1. În ce direcție se va desfășura reacția la următoarele concentrații de substanțe:
a) C (N0 2) \u003d C (N 2 0 4) \u003d 0,1 mol / l;
b) C (N0 2) \u003d 0,01 mol / l; C (N 2 0 4) \u003d 0,02 mol / l?
Sarcina 7. Pentru reacția H 2 + I 2 ® 2HI la 444 0 C, constanta de echilibru este 50. Determinați direcția procesului dacă amestecul inițial are următoarea compoziție: C (H 2) \u003d 2 mol / l, C ( HI) \u003d 10 mol / l.
Răspuns: Starea de echilibru, deoarece ∆G=0.
Sarcina 8. Calculați constanta de echilibru dacă DG 0 298 pentru această reacție este de 4,478 kJ/mol.
Răspuns: 6,1
Sarcina 9. Constanta de echilibru a descompunerii unei substanțe medicinale într-o autoclavă la 413K este 0,396∙10 5 Pa, iar la 443K este 1,286∙10 5 Pa. Calculați efectul termic al reacției.
Răspuns: 59,6 kJ/mol.
Sarcina 10. Folosind valoarea ΔG°, determinați dacă există o amenințare de otrăvire a pacientului atunci când este utilizat ca a medicament oxid nitric (I), oxid nitric toxic (II) se poate forma prin reacția: 2N 2 O + O 2 = 4NO. Toate substanțele sunt în stare gazoasă. Consultați tabelul pentru date de referință.






