Gazdan katıya. Katı, sıvı ve gaz halindeki cisimlerin yapısı - Bilgi Hipermarketi
Atomların dizilişinde ideal bir düzenin kurulması, yani katı bir cismin oluşumu, termal hareketlerle engellenir, ana özellik bu, bildiğimiz gibi, rastgelelik, düzensizliktir. Bu nedenle, bir maddenin katı halde olması için sıcaklığı yeterince düşük olmalıdır - o kadar düşük ki, termal hareketlerin enerjisi daha az olmalıdır. potansiyel enerji atomların etkileşimi.
Tüm atomların dengede olduğu ve minimum enerjiye sahip olduğu tamamen ideal bir kristal, vücut ancak tamamen sıfır. Aslında, tüm maddeler çok daha fazla katı hale gelir. yüksek sıcaklıklar. Tek istisna, mutlak sıfırda bile sıvı kalan helyumdur, ancak bu, aşağıda kısaca tartışacağımız bazı kuantum etkilerinden kaynaklanmaktadır.
Bir madde sıvı halden katı hale geçebildiği gibi gaz halden de geçebilir. Her iki durumda da, böyle bir geçiş, simetriden yoksun bir durumdan simetrinin var olduğu bir duruma geçiştir (bu, her durumda, kristallerde var olan, ancak sıvı veya sıvıda mevcut olmayan uzun menzilli düzeni ifade eder). gaz halindeki maddeler). Bu nedenle, katı hale geçiş, bildiğimiz gibi sürekli olarak da meydana gelebilen gaz-sıvı geçişinin aksine, aniden, yani belirli bir sıcaklıkta gerçekleşmelidir.
Önce sıvının dönüşümünü düşünün- sağlam. Bir sıvının soğutulması sırasında katı bir cismin oluşum süreci, kristal oluşum (kristalleşme) sürecidir (ve belirli bir sıcaklıkta, kristalleşme veya katılaşma sıcaklığında gerçekleşir. Böyle bir dönüşüm sırasında enerji azaldığı için, gizli kristalleşme ısısı şeklinde enerji salınımı ile birlikte Ters dönüşüm erir - aynı sıcaklıkta aniden meydana gelir ve formdaki enerjinin emilmesi eşlik eder
füzyon ısısının büyüklüğü kristalleşme ısısına eşittir.
Bu, Şekil 2'de gösterilen zamana karşı soğutma suyu sıcaklığı grafiğinden açıkça görülmektedir. 179 (a eğrisi). A eğrisinin 1. Bölümü, sıvıdan ısının çıkarılması nedeniyle sıvının sıcaklığındaki monoton bir düşüşün seyrini verir. Yatay bölüm 2, belirli bir sıcaklıkta, ısı çıkışının devam etmesine rağmen azalmasının durduğunu göstermektedir. Bir süre sonra sıcaklık tekrar düşmeye başlar (bölüm 3). Bölüm 2'ye karşılık gelen sıcaklık, kristalleşme sıcaklığıdır. Kristalleşme sırasında açığa çıkan ısı, maddeden ısının uzaklaştırılmasını telafi eder ve bu nedenle sıcaklıktaki düşüş geçici olarak durur. Kristalizasyon işleminin sona ermesinden sonra, artık katı bir cismin sıcaklığı tekrar düşmeye başlar.
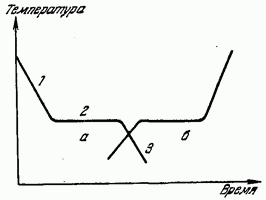
Sıcaklık düşüş grafiğinin böyle bir seyri aşağıdakiler için tipiktir: kristal cisimler. Kristalleşmeyen sıvıları (amorf maddeler) soğuturken, gizli ısı göze çarpmaz ve soğuma eğrisi, soğutmayı durdurmadan monoton bir eğridir.
Bir maddenin geçişinin tersi sürecinde katı halısıtma eğrisinde sıvıya (erime) girerken, gizli erime ısısının emilmesi nedeniyle sıcaklıktaki artışta bir durma vardır - kristal kafesin tahrip olması nedeniyle ısı (Şekil 179'daki eğri) ).
Kristalizasyonu başlatmak için bir kristalizasyon merkezinin veya merkezlerinin varlığı gereklidir. Bu tür merkezler, sıvının tamamı katı bir cisme dönüşene kadar giderek daha fazla parçacığın birleşebileceği, birbirine yapışmış sıvı parçacıklarının rastgele birikimleri olabilir. Bununla birlikte, sıvının kendisinde bu tür birikimlerin oluşumu termal hareketler tarafından engellenir ve bu da onları gözle görülür bir boyut kazanmaya zamanları olmadan önce yok eder. Toz parçacıkları ve cisimler şeklinde yeterince büyük katı parçacıklar, en başından itibaren sıvıda kristalleşme merkezleri haline gelen sıvı içinde mevcutsa, kristalleşme büyük ölçüde kolaylaşır.
Sıvının kendisinde kristalleşme merkezlerinin oluşumu, elbette, azalan sıcaklıkla kolaylaştırılır. Bu nedenle, yabancı oluşumlardan yoksun saf bir sıvının kristalleşmesi,
genellikle gerçek kristalleşme sıcaklığından biraz daha düşük bir sıcaklıkta başlar. Normal koşullar altında, kristalleşen bir sıvıda birçok kristalleşme merkezi vardır, bu nedenle sıvı içinde birçok kristal birlikte büyür ve katılaşan madde polikristal olur.
Yalnızca, genellikle sağlanması zor olan özel koşullar altında, tek bir kristal elde edilebilir - tek bir kristalizasyon merkezinden büyüyen tek bir kristal. Bu durumda, tüm yönler için parçacıkların birikmesi için aynı koşullar sağlanırsa, kristal simetri özelliklerine göre doğru yönlü olarak elde edilir.
Sıvı-katı geçişi ve ters dönüşüm, bir faz geçişidir, çünkü sıvı ve katı haller bir maddenin iki fazı olarak kabul edilebilir. Kristalleşme (erime) sıcaklığındaki her iki faz da denge halindeyken (örneğin buz suda erimeden yüzebilir), tıpkı bir sıvı ile doymuş buharının dengede olabilmesi gibi birbiriyle temas edebilir.
Kaynama noktası basınca bağlı olduğu gibi, kristalleşme sıcaklığı (ve eşdeğer erime noktası) da basınca bağlıdır ve genellikle artan basınçla artar. Büyür çünkü dış basınç atomları bir araya getirir ve erime sırasında kristal kafesi yok etmek için atomların birbirinden uzaklaşması gerekir: daha fazla baskı bu, daha büyük bir termal hareket enerjisi, yani daha yüksek bir sıcaklık gerektirir.
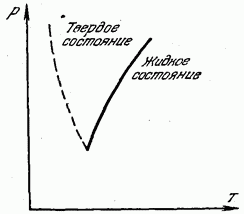
Şek. 180, basınca karşı erime (kristalleşme) sıcaklığının bir eğrisini gösterir. Katı eğri, tüm bölgeyi iki parçaya böler. Eğrinin solundaki alan katı duruma, eğrinin sağındaki alan ise sıvı duruma karşılık gelir. Erime eğrisi üzerinde bulunan herhangi bir nokta katı ve sıvı fazların dengesine tekabül eder: bu basınç ve sıcaklıklarda sıvı ve katı haldeki madde dengededir, birbiriyle temas halindedir ve sıvı sertleşmez, ve katı erimez.
Şek. 180, katılaşma sırasında hacmin azalmadığı, ancak arttığı birkaç madde (bizmut, antimon, buz, germanyum) için erime eğrisini gösterir. Çok
maddeler, elbette, artan basınçla erime noktası düşer.
Erime noktasındaki değişiklik, Clausius-Clapeyron ilişkisi ile basınçtaki değişiklik ile ilgilidir:
![]()
Burada, erime (kristalleşme) sıcaklığı ve sırasıyla sıvı ve katı fazların molar hacimleri ve molar füzyon ısısıdır.
Bu formül diğer faz geçişleri için de geçerlidir. Özellikle, buharlaşma ve yoğuşma durumu için Clausius-Clapeyron formülü Bölüm'de türetilmiştir. VII [bkz. (105.6)].
Clapeyron-Clausius formülünden, basınçtaki bir değişiklikle erime sıcaklığındaki değişikliğin işaretinin iki değerden hangisi veya daha fazlası tarafından belirlendiği görülebilir. Eğrinin dikliği ayrıca gizli geçiş ısısının değerine de bağlıdır; sıcaklık ne kadar düşükse, erime sıcaklığı basınçla o kadar az değişir. Masada. 20, bazı maddeler için spesifik (yani birim kütle başına) füzyon ısısının değerlerini gösterir.
Tablo 20 (taramaya bakın) Özısı bazı maddeler için erime
Clausius-Clapeyron denklemi şu şekilde de yazılabilir:
![]()
Bu denklem, her iki denge fazının bulunduğu basıncın sıcaklıkla nasıl değiştiğini gösterir.
Bir katı, yalnızca bir sıvının kristalleştirilmesiyle değil, aynı zamanda bir gazın (buharın) sıvı fazı atlayarak bir kristal halinde yoğunlaşmasıyla da oluşturulabilir. Bu durumda, gizli geçiş ısısı da salınır, ancak bu her zaman gizli füzyon ısısından daha büyüktür. Sonuçta, belirli bir sıcaklık ve basınçta katı oluşumu, hem doğrudan gaz halinden hem de ön sıvılaştırma yoluyla meydana gelebilir.
durumlarda, ilk ve son durumlar aynıdır. Bu durumların enerji farkının aynı olduğu anlamına gelir. Bu arada, ikinci durumda, ilk olarak, gaz halinden sıvı hale geçiş sırasında yoğuşmanın gizli ısısı ve ikinci olarak, sıvıdan katı hale geçiş sırasında kristalleşme gizli ısısı açığa çıkar. Gaz fazından bir katının doğrudan oluşumundaki gizli ısının, sıvıdan gelen yoğuşma ve kristalleşme ısılarının toplamına eşit olması gerektiği sonucu çıkar. Bu sadece erime noktasında ölçülen ısılar için geçerlidir. Daha düşük sıcaklıklarda, gazdan gelen yoğuşma ısısı artar.
Bir katının buharlaşmasının tersi işlemine genellikle süblimasyon veya süblimasyon denir. Bir katının buharlaşan parçacıkları, bir sıvının buharlaşmasıyla tam olarak aynı şekilde onun üzerinde buhar oluşturur. Belirli basınç ve sıcaklıklarda buhar ve katı dengede olabilir. Bir katı ile dengede olan buhara da denir. doymuş buhar. Bir sıvı durumunda olduğu gibi, esneklik doymuş buhar Bir katının üzerindeki sıcaklık, sıcaklığa bağlıdır, azalan sıcaklıkla hızla azalır, böylece normal sıcaklıklardaki birçok katı için doymuş buhar basıncı ihmal edilebilir.
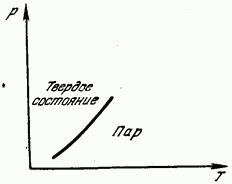
Şek. 181, sıcaklığa karşı doymuş buhar basıncının eğrisini gösterir. Bu eğri, katı ve gaz fazları arasındaki denge çizgisidir. Eğrinin solundaki bölge katı duruma, sağındaki gaz durumuna karşılık gelir. Süblimleşme, erime gibi, kafesin yok edilmesiyle ilişkilidir ve bunun için gerekli enerjinin harcanmasını gerektirir. Bu enerji, elbette, gizli yoğuşma ısısına eşit olan gizli süblimleşme (süblimleşme) ısısı olarak kendini gösterir.Bu nedenle süblimleşme ısısı, erime ve buharlaşma ısılarının toplamına eşittir.
Üçte kalabilen maddelerin çoğu 
haller: sıvı, katı ve gaz. Bu durumlara toplu durumlar denir.
 Bir madde ısıtıldığında veya soğutulduğunda ve ayrıca basınç değiştiğinde bir durumdan diğerine geçer.
Bir madde ısıtıldığında veya soğutulduğunda ve ayrıca basınç değiştiğinde bir durumdan diğerine geçer.
Suyu kaynama noktasına kadar ısıtırsanız, suya dönüşeceğini zaten biliyorsunuz. buhar. Yani, gidecek gaz hali. Her üç devletin özelliklerini açıklayan bir teori var.
Kinetik olarak adlandırılır ve parçacıkların maddenin bileşiminde hareket ettiği ifadesine dayanır.
Kinetik teori.
 Bilimdeki çoğu hipotez, kanıtlanıncaya kadar kabul edilmez, ancak yalnızca belirli fenomenleri açıkladıkları için doğru kabul edilir. Katı, sıvı ve katıların özelliklerini açıklar. gazlı cisimler, bileşimlerinde bulunan parçacıkların enerjisine bağlı olarak, Kinetik teori. Katı bir cismin parçacıkları birbirine çok yakın bulunur, çekim kuvveti ile bağlanır ve serbest bırakılamaz. Sadece merkez etrafında salınım yaparlar. Ancak bedeni ısıtmaya başlar başlamaz, parçacıklarının enerjisi artmaya başlayacaktır. İşte o zaman birbirlerinden kopabilirler. Katı erimeye ve akmaya başlar. Gaz parçacıkları daha da fazla enerjiye sahiptir ve birbirlerinden daha da uzak bir mesafede bulunurlar. Isıtma, parçacıkların enerjisini artırmanıza izin verir, daha hızlı hareket ederler ve vücut bir başkasına geçer. toplama durumu.
Bilimdeki çoğu hipotez, kanıtlanıncaya kadar kabul edilmez, ancak yalnızca belirli fenomenleri açıkladıkları için doğru kabul edilir. Katı, sıvı ve katıların özelliklerini açıklar. gazlı cisimler, bileşimlerinde bulunan parçacıkların enerjisine bağlı olarak, Kinetik teori. Katı bir cismin parçacıkları birbirine çok yakın bulunur, çekim kuvveti ile bağlanır ve serbest bırakılamaz. Sadece merkez etrafında salınım yaparlar. Ancak bedeni ısıtmaya başlar başlamaz, parçacıklarının enerjisi artmaya başlayacaktır. İşte o zaman birbirlerinden kopabilirler. Katı erimeye ve akmaya başlar. Gaz parçacıkları daha da fazla enerjiye sahiptir ve birbirlerinden daha da uzak bir mesafede bulunurlar. Isıtma, parçacıkların enerjisini artırmanıza izin verir, daha hızlı hareket ederler ve vücut bir başkasına geçer. toplama durumu.
Brown hareketi.
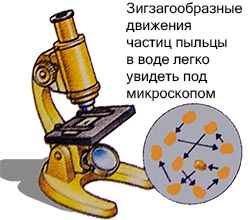 İngiliz biyolog Robert Brown 1927'de bir sıvıya yerleştirilen polen parçacıklarını mikroskop altında inceledi.
İngiliz biyolog Robert Brown 1927'de bir sıvıya yerleştirilen polen parçacıklarını mikroskop altında inceledi.
Zigzag şeklinde hareket ettiklerini fark etti ama açıklayamıyordu.
Moleküllerin bu rastgele hareketine denir. kahverengi hareket. Açıklama daha sonra Albert Einstein tarafından yapıldı.
Bir sıvının içine yerleştirilen parçacıkların, aynı zamanda hareketli fakat görünmez moleküllerin çarpışması nedeniyle hareket ettiğini belirtti.
 Devlet değişikliği.
Devlet değişikliği.
Sıcaklık yükseldikçe cismin taneciklerinin enerjisi artar ve erime noktasına ulaşır.Daha sonra parçacıklar arasındaki bağlarda bir kopukluk olur ve vücut erir.
Örneğin, bir mumdan parafin. Isıtıldığında aşağı akar, soğurken tekrar katı halde katılaşır.
Daha fazla ısıtma ile kaynama noktasına ulaşılır ve parçacıklar karşılıklı bağdan tamamen kurtulur ve sıvı buhara dönüşür.
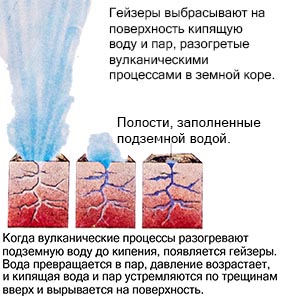 Bir örnek, volkanik süreçlerle ısıtılan, kaynar su ve buharı yüzeye çıkaran bir gayzerdir. Ancak soğuyunca ters işlem gerçekleşir. Gaz yoğunlaşır ve sıvı hale gelir ve sıvı daha fazla soğuyarak donar ve katı hale gelir.
Bir örnek, volkanik süreçlerle ısıtılan, kaynar su ve buharı yüzeye çıkaran bir gayzerdir. Ancak soğuyunca ters işlem gerçekleşir. Gaz yoğunlaşır ve sıvı hale gelir ve sıvı daha fazla soğuyarak donar ve katı hale gelir.
Karbondioksit, sıvı halini atlayarak katı halden gaz haline geçebilir.
Mars'taki su eksikliği, ihmal edilebilir atmosferik basınçla açıklanıyor.
Oradaki su hemen kaynar ve buharlaşır. Farklı maddeler için başka bir duruma geçiş farklı sıcaklıklarda gerçekleşir.
Maddeye biraz safsızlık ekleyerek veya basıncı değiştirerek erime ve kaynama noktasını da değiştirebilirsiniz.
Dünya atmosferinin basıncına atmosfer basıncı diyoruz.
 |
 |
 Yüzey gerilimi.
Yüzey gerilimi.
Su yürüyüşçülerinin rezervuarın yüzeyinde nasıl sakince yürüdüklerini gördünüz.
Batmazlar ve su yüzeyinde istedikleri kadar hareket edebilirler.
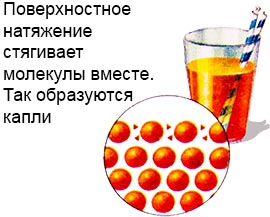 Bu, sıvının bir yüzey gerilimi tabakasına sahip olması nedeniyle mümkündür.
Bu, sıvının bir yüzey gerilimi tabakasına sahip olması nedeniyle mümkündür.
Bu katmanın molekülleri, sıvının derinliğinden çok daha güçlü bir şekilde bağlanır.
Bu, sıvının yüzeyinde bir tür film oluşturur ve ayrıca damlalar oluşturur.
Ve su yürüyüşçüsünün ağırlığı onu kırmak için yeterli değil.
Buharlaşma.
 Sıvı, ısıtılmasa bile sürekli buharlaşır. Bunun nedeni yüzey tabakasındaki moleküllerin enerjisinin çok daha fazla olması ve bu da moleküllerin yüzeyden kopmasına yani buharlaşmasına olanak sağlamasıdır.
Sıvı, ısıtılmasa bile sürekli buharlaşır. Bunun nedeni yüzey tabakasındaki moleküllerin enerjisinin çok daha fazla olması ve bu da moleküllerin yüzeyden kopmasına yani buharlaşmasına olanak sağlamasıdır.
Buharlaştıkça sıvının sıcaklığı düşer. Bu, özellikle bir kişi terlediğinde geçerlidir.
Cilt üzerindeki su damlacıkları buharlaşır ve cilt soğur.
Gazlar.
 Gaz, sabit bir hacmi veya şekli olmayan bir maddedir. Kinematik teoriye göre, gaz moleküllerinin enerjisi bağları kırmak ve ayrı uçarak etraflarındaki tüm hacmi doldurmak için yeterlidir.
Gaz, sabit bir hacmi veya şekli olmayan bir maddedir. Kinematik teoriye göre, gaz moleküllerinin enerjisi bağları kırmak ve ayrı uçarak etraflarındaki tüm hacmi doldurmak için yeterlidir.
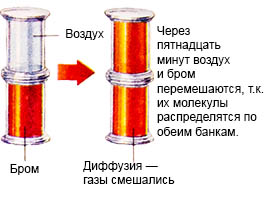
Bu işleme difüzyon denir.
Gaz basıncının miktarı, gaz moleküllerinin kabın duvarlarına ne kadar kuvvetli çarptığına bağlıdır. Sıcaklığı değiştirmeden, kabın hacmini azaltarak gazın hacmi azalırsa, gaz molekülleri daha sık kabın duvarlarına çarpacağından basıncı artacaktır.Veya yeni bir gaz kısmı pompalarsanız.
Isıtıldığında, gaz molekülleri daha hızlı hareket eder, gaz genişler ve daha az yoğun hale gelir. Bir gazı ısıtarak hacmini sınırlamak için, basınç artmaya başlayacaktır.
 |
 |
Hacim, kütle ve yoğunluk.
Hacim, sıvı veya katı bir cismin kapladığı alan miktarıdır. Hacim metreküp cinsinden ölçülür. Sıvının hacmini bulmak için, onu bir ölçüm kabına dökmeniz gerekir. Katı bir cismin hacmi doğru biçim kaptan onun tarafından yer değiştiren sıvının hacmi ile tanınır. Doğru biçimdeki katı bir gövdenin hacmi - formüle göre.
Terazinin bir tarafına tartılacak cismi, diğer tarafına - kütlesi bilinen bir cismi yerleştiririz. Katı, sıvı veya gaz halindeki bir cismin kütlesi bize ne kadar madde içerdiğini söyler. Kütle kilogram ve gram olarak ölçülür. Kütle ve ağırlık arasındaki farkı anlamak gerekir - vücuda etki eden yerçekimi kuvvetinin büyüklüğü.
 |
 |
 Yoğunluğa göre, vücudu oluşturan parçacıkların ne kadar sıkı "uyumlu" olduğuna karar verebiliriz. Örneğin metal moleküller birbirine kağıt moleküllerden daha yakındır.
Yoğunluğa göre, vücudu oluşturan parçacıkların ne kadar sıkı "uyumlu" olduğuna karar verebiliriz. Örneğin metal moleküller birbirine kağıt moleküllerden daha yakındır.
Bu, metalin yoğunluğunun daha yüksek olduğu anlamına gelir. Yoğunluk, bir cismin kütlesinin hacmine bölünmesiyle hesaplanır ve metreküp başına kilogram (kg/m3) olarak ölçülür.
Bir sıvının yoğunluğunu ölçmek için bir cihaz var - bir hidrometre. Yoğun bir sıvıda, ağırlığı yalnızca küçük bir sıvı hacminin yerini alabildiğinden yüzeye yakın yüzer.
FAYDALI KEYİFLE BİRLEŞTİRİN!
 Bu deney, yüzey gerilimi kuvvetinin etkisini gösterir. Saf öküzü bir tabağa dökün ve talk gibi biraz toz ekleyin.
Bu deney, yüzey gerilimi kuvvetinin etkisini gösterir. Saf öküzü bir tabağa dökün ve talk gibi biraz toz ekleyin.
Ortasına sıvı sabun damlatın. Ne oluyor?
sabun yok eder yüzey gerilimi, yani Moleküller arasındaki çekici kuvvet. Duvarların yakınında bulunan moleküller birbirine daha sıkı bağlanır, bu nedenle fincan tabağındaki tüm toz yanlarda toplanır.
Yerkabuğundaki mineral yakıtlar, karbon (çeşitli kömürler ve şeyller) ve hidrokarbonlar (petrol ve gaz birikintileri) şeklinde yoğunlaşmıştır. Bilimde ve uygulamada, moleküler ağırlığı 60'tan fazla olan hidrokarbon birikimlerinin yerkabuğunda bulunduğu fikri kesin olarak yerleşmiştir. sıvı hal, ve daha hafif olanlar - gaz halinde.
Bununla birlikte, Sovyet bilim adamları Akademisyen A. A. Trofimuk, SSCB Bilimler Akademisi Sorumlu Üyesi N. V. Chersky, Doktor teknik bilimler F.A. Trebin, Ph.D. Yu.F. Makogon ve Ph.D. termodinamik koşullar yerkabuğunda katı bir duruma geçer ve gaz hidrat birikintileri oluşturur ve gözenekli ortamın birim hacmi başına sıradan gaz birikintilerinden kıyaslanamayacak kadar yüksek bir gaz konsantrasyonuna sahiptir.
Gaz, hidrostatik basınçlarda ve +25°'ye kadar nispeten düşük sıcaklıklarda formasyon suyuyla bağlantı kurarak yerkabuğunda katı hale geçer. Deneysel çalışmalar Aynı basınçlarda, bir gaz hidrat tortusunun, geleneksel eşit hacimli bir gaz tortusundan birkaç kat daha fazla gaz içerdiğini gösterdi, çünkü bir hacim su, bir hidrat durumuna geçtiğinde 220 hacime kadar gaz bağlarken, olağan gazın sudaki çözünürlüğü iki ila dört hacmi geçmez ve buz için daha da düşüktür.
Bir gaz hidrat rezervuarının fiziksel özellikleri, geleneksel bir gaz rezervuarının fiziksel özelliklerinden çok farklıdır. Böyle bir tortunun elektrik iletkenliği, geleneksel bir tortununkinden çok daha düşüktür, bu da yerkabuğundaki gaz hidrat tortularını tanımlamak için jeofizik özellikleri yorumlamak için yeni yöntemler geliştirmeyi ve bu özellikleri yeni oluşturmak için kullanmayı mümkün kılar. prosesler (gaz ayırma, büyük miktarda gazın düşük basınçlar vb.).
Bir gaz hidrat birikintisi oluşturma sürecine, rezervuar basıncında (hidrostatikin altında) önemli bir azalma, tortunun boyutunda bir azalma ve gaz ve su girişinin varlığında, gaz rezervlerinde önemli bir artış eşlik edebilir. depozito.
Gaz hidrat birikintilerinin bölgeleri esas olarak permafrost alanlarında yoğunlaşmıştır ve ortak alan, bu tür mevduatların bulunabileceği yer, bölgenin %50'sinden fazlasıdır. Sovyetler Birliği, gezegenimizin topraklarının yaklaşık dörtte biri ve okyanusların %90'ından fazlası.
Araştırmacılardan SSCB Gaz Endüstrisi Bakanlığı Jeoloji Dairesi Başkanı V. G. Vasiliev, “Bu, ülkemizin enerji ve kimyasal kaynaklarını çoğaltacak önemli bir doğal gaz rezervidir. Dünya Okyanusu'nun dibinin altında da devlette gaz birikintileri olduğu varsayılmaktadır.Bilim adamlarının mantık yürütmeleri şu şekildedir: okyanus tabanı 300-500 atm basınçla su basıncı altındadır ve böyle bir basınçtadır. basınç, Yakut içlerinin düşük sıcaklıklarına artık hidratların oluşumu için ihtiyaç duyulmaz.Okyanus gezegenin çoğunu kapladığından ve permafrost toprağın önemli bir bölümünü kapladığından, gazın katı halinin olduğu varsayılabilir. bir istisna değil, kuraldır.
Maden inşa etmeden yeraltından hidratlar nasıl çıkarılabilir? Araştırmacılar, metanın doğrudan rezervuarda katı halden gaz haline dönüştürülmesini ve ardından geleneksel kuyular kullanılarak "seçilmesini" önerdiler. Bunu yapmanın birkaç yolu vardır. Kuyudaki basıncı yapay olarak düşürürseniz veya rezervuardaki sıcaklığı yükseltirseniz, bu hidratın ayrışmasına neden olur ve serbest gaz borularda yükselir. Ancak bilim adamlarına göre en umut verici olanı, su moleküllerinin güçlü tutuşundan gaz moleküllerinin salınmasını hızlandıran bir katalizör ile su üzerinde hareket etmek. Rezervuardaki gaz konsantrasyonu çok yüksektir ve bu devasa kuvvet dikkatli bir şekilde serbest bırakılmalıdır.
Bugün gaz hidrat yataklarının endüstriyel kullanımı hakkında konuşmak mümkün mü? SSCB Bilimler Akademisi Sorumlu Üyesi N. V. Chersky bu soruyu yanıtlıyor: “Kuzey Kutbu'ndaki Messoyakhskoye sahasının gaz hidrat oluşumlarından çıkarılan yüz binlerce metreküp gaz” diyor, “Norilsk Madenciliğine çoktan ulaştı” ve Metalurjik Kombine Gazın maliyeti yaklaşık olarak aynı Her zamanki gibi, 30'dan fazla katı gaz yatağı keşfedildi. Moskova, Novosibirsk ve Yakutsk'taki bilim adamları, rasyonel gelişim ve kullanım sorunları üzerinde çalışıyorlar."
>>Katı, sıvı ve gaz halindeki cisimlerin yapısı
İnternet sitelerinden okuyucular tarafından gönderildi
fizik kütüphanesi, fizik dersleri, fizik programı, fizik derslerinin özetleri, fizik ders kitapları, hazır ödev
ders içeriği ders özeti destek çerçeve ders sunum hızlandırıcı yöntemler etkileşimli teknolojiler Uygulama görevler ve alıştırmalar kendi kendine muayene çalıştayları, eğitimler, vakalar, görevler ödev tartışma soruları öğrencilerden retorik sorular İllüstrasyonlar ses, video klipler ve multimedya fotoğraflar, resimler grafikler, tablolar, mizah şemaları, fıkralar, şakalar, çizgi roman benzetmeleri, sözler, bulmacalar, alıntılar Eklentiler özetler makaleler meraklı hile sayfaları için çipler ders kitapları temel ve ek terimler sözlüğü diğer Ders kitaplarının ve derslerin iyileştirilmesiders kitabındaki hataları düzeltme ders kitabındaki bir parçanın güncellenmesi derste yenilik unsurlarının eskimiş bilgiyi yenileriyle değiştirmesi Sadece öğretmenler için mükemmel dersler yıl için takvim planı yönergeler tartışma programları Entegre DerslerBir maddenin kümelenme durumuna genellikle şeklini ve hacmini koruma yeteneği denir. Ek bir özellik, bir maddenin bir kümelenme durumundan diğerine geçme yollarıdır. Buna dayanarak, üç kümelenme durumu ayırt edilir: katı, sıvı ve gaz. Görünür özellikleri aşağıdaki gibidir:
Katı bir gövde hem şekli hem de hacmi korur. Hem ergiyerek sıvıya geçebilir, hem de süblimleşerek doğrudan gaza geçebilir.
- Sıvı - hacmi korur, ancak şekli değil, yani akışkanlığı vardır. Dökülen sıvı, üzerine döküldüğü yüzey üzerinde süresiz olarak yayılma eğilimindedir. Bir sıvı kristalleşerek katıya, buharlaşarak gaza geçebilir.
- Gaz - şeklini veya hacmini korumaz. Herhangi bir kabın dışındaki gaz, her yöne süresiz olarak genişleme eğilimindedir. Dünya atmosferinin uzaya dağılmaması sayesinde sadece yerçekimi bunu yapmasını engelleyebilir. Bir gaz, yoğuşma yoluyla bir sıvıya geçer ve doğrudan bir katıya çökelme yoluyla geçebilir.
Faz geçişleri
Bir maddenin bir kümelenme durumundan diğerine geçişine faz geçişi denir, çünkü kümelenme halinin bilimsel eş anlamlısı maddenin fazıdır. Örneğin, su katı fazda (buz), sıvı halde (sıradan su) ve gaz halinde (buhar) bulunabilir.
Su örneği de süblimleşmeyi iyi gösterir. Ayaz rüzgarsız bir günde kuruması için bahçeye asılan çamaşırlar hemen donar, ancak bir süre sonra kuru olduğu ortaya çıkar: buz süblimleşir, doğrudan su buharına dönüşür.
Kural olarak, katıdan sıvıya ve gaza faz geçişi ısıtma gerektirir, ancak ortamın sıcaklığı artmaz: Termal enerji maddedeki iç bağları kırmaya gider. Bu, faz geçişinin gizli ısısıdır. Ters olduğunda faz geçişleri(yoğuşma, kristalleşme) bu ısı açığa çıkar.
Bu nedenle buhar yanıkları çok tehlikelidir. Cilt ile temas ettiğinde yoğunlaşır. Suyun buharlaşma/yoğuşma gizli ısısı çok yüksektir: bu açıdan su anormal bir maddedir; Bu yüzden Dünya'da yaşam mümkündür. Bir buhar yanığı sırasında, su yoğunlaşmasının gizli ısısı, yanmış yeri çok derinden "haşlandırır" ve bir buhar yanığının sonuçları, vücudun aynı bölgesindeki bir alevden çok daha şiddetlidir.
psödofazlar
Bir maddenin sıvı fazının akışkanlığı, viskozitesi ile belirlenir ve viskozite, bir sonraki bölümün ayrıldığı iç bağların doğası ile belirlenir. Bir sıvının viskozitesi çok yüksek olabilir ve böyle bir sıvı göze fark edilmeden akabilir.
Klasik örnek camdır. Katı değil, çok viskoz bir sıvıdır. Depolardaki cam levhaların asla duvara eğik bir şekilde yaslanarak depolanmadığını lütfen unutmayın. Birkaç gün içinde kendi ağırlıkları altında sarkarlar ve kullanılamaz hale gelirler.
Sahte katı cisimlerin diğer örnekleri, ayakkabı zift ve inşaat bitümüdür. Çatıdaki köşeli bitüm parçasını unutursanız, yaz boyunca keke yayılacak ve tabana yapışacaktır. Sözde katı cisimler, erimenin doğasıyla gerçek cisimlerden ayırt edilebilir: gerçek cisimler ya hemen yayılana kadar (lehim yaparken lehim) şekillerini korurlar ya da su birikintileri ve akıntılar (buz) bırakarak yüzerler. Ve çok viskoz sıvılar, aynı zift veya bitüm gibi yavaş yavaş yumuşar.
Akışkanlığı uzun yıllar ve on yıllar boyunca fark edilmeyen son derece viskoz sıvılar plastiktir. Şekillerini koruma konusundaki yüksek yetenekleri, binlerce ve milyonlarca hidrojen atomu olan polimerlerin devasa moleküler ağırlığı ile sağlanır.
Maddenin evrelerinin yapısı
Gaz fazında, bir maddenin molekülleri veya atomları birbirinden çok uzaktadır, aralarındaki mesafeden birçok kat daha fazladır. Sadece çarpışmalar sırasında, ara sıra ve düzensiz olarak birbirleriyle etkileşime girerler. Etkileşimin kendisi esnektir: sert toplar gibi çarpıştılar ve hemen dağıldılar.
Bir sıvıda, moleküller/atomlar kimyasal yapıdaki çok zayıf bağlar nedeniyle sürekli olarak birbirlerini "hissederler". Bu bağlar her zaman kopar ve hemen yeniden kurulur, sıvının molekülleri sürekli birbirine göre hareket eder ve bu nedenle sıvı akar. Ancak onu gaz haline getirmek için tüm bağları bir kerede kırmak gerekir ve bu çok fazla enerji gerektirir, bu yüzden sıvı hacmini korur.
Bu bağlamda, su diğer maddelerden farklıdır, çünkü bir sıvıdaki molekülleri oldukça güçlü olan hidrojen bağları ile bağlanır. Bu nedenle, su yaşam için normal sıcaklıkta bir sıvı olabilir. Normal koşullar altında, sudan onlarca ve yüzlerce kat daha büyük moleküler ağırlığa sahip birçok madde, en azından sıradan ev gazı gibi gazlardır.
Bir katıda, güçlü olması nedeniyle tüm molekülleri sıkıca yerindedir. Kimyasal bağlar aralarında bir kristal kafes oluşturur. Doğru formdaki kristaller, büyümeleri için özel koşullar gerektirir ve bu nedenle doğada nadiren bulunur. Katıların çoğu, mekanik ve elektriksel nitelikteki kuvvetlerle sıkı sıkıya bağlı kristalitler olan küçük ve minik kristallerin konglomeralarıdır.
Okuyucu, örneğin, kırık bir araba yarı aksı veya bir dökme demir ızgara görmüşse, hurda üzerindeki kristalit tanecikleri basit bir gözle görülebilir. Ve kırık porselen veya fayans tabaklarının parçalarında bir büyüteç altında görülebilirler.
Plazma
Fizikçiler ayrıca maddenin dördüncü toplam durumunu - plazmayı da ayırt eder. Plazmada elektronlar koparılır. atom çekirdeği ve elektrik yüklü parçacıkların bir karışımıdır. Plazma çok yoğun olabilir. Örneğin, beyaz cüce yıldızların iç kısmından gelen bir santimetre küp plazma onlarca ve yüzlerce ton ağırlığındadır.
Plazma, aktif olarak etkileşime girdiği için ayrı bir kümelenme durumuna izole edilir. Elektromanyetik alanlarÇünkü parçacıkları yüklüdür. AT boş alan Plazma genleşme, soğuma ve gaza dönüşme eğilimindedir. Ancak elektromanyetik alanların etkisi altında, katı bir cisim gibi damarın dışında şeklini ve hacmini koruyabilir. Plazmanın bu özelliği termonükleer güç reaktörlerinde kullanılır - geleceğin enerji santrallerinin prototipleri.






