Gaz, sıvı ve katı cisimlerin özellikleri ve yapısı
Tüm cansız maddeler, davranışları farklı olabilen parçacıklardan oluşur. Gaz, sıvı ve sıvının yapısı katılar kendine has özellikleri vardır. Katılardaki parçacıklar birbirine çok yakın oldukları için bir arada tutulurlar ve bu da onları çok güçlü kılar. Ek olarak, en küçük parçacıkları pratik olarak hareket etmediğinden, sadece titreştiğinden, belirli bir şekli koruyabilirler. Sıvılardaki moleküller birbirine oldukça yakındır, ancak serbestçe hareket edebilirler, bu nedenle kendi şekilleri yoktur. Gazlardaki parçacıklar çok hızlı hareket eder ve genellikle etraflarında çok fazla boşluk vardır, bu da kolayca sıkıştırıldıklarını gösterir.
Katıların özellikleri ve yapısı
Katıların yapısı ve özellikleri nelerdir? Birbirine çok yakın parçacıklardan oluşurlar. Hareket edemezler ve bu nedenle şekilleri sabit kalır. Katı bir cismin özellikleri nelerdir? Büzülmez, ancak ısıtılırsa artan sıcaklıkla hacmi artar. Bunun nedeni, parçacıkların titreşmeye ve hareket etmeye başlaması ve bu da yoğunluğun azalmasına yol açmasıdır.

Katıların özelliklerinden biri de sabit bir şekle sahip olmalarıdır. Bir katı ısıtıldığında taneciklerin hareketi artar. Daha hızlı hareket eden parçacıklar daha şiddetli çarpışır ve her parçacığın komşularını itmesine neden olur. Bu nedenle, sıcaklıktaki bir artış genellikle vücudun gücünde bir artışa yol açar.
Katıların kristal yapısı
Bir katının bitişik molekülleri arasındaki moleküller arası etkileşim kuvvetleri, onları sabit bir konumda tutacak kadar güçlüdür. Bu en küçük parçacıklar oldukça düzenli bir konfigürasyondaysa, bu tür yapılara genellikle kristal denir. Bir elementin veya bileşiğin parçacıklarının (atomlar, iyonlar, moleküller) iç düzeni, özel bir bilim - kristalografi ile ele alınır.

Bir katının kimyasal yapısı da özellikle ilgi çekicidir. Kimyacılar, parçacıkların davranışlarını, nasıl oluştuklarını inceleyerek, belirli türdeki malzemelerin belirli koşullar altında nasıl davranacağını açıklayabilir ve tahmin edebilirler. Katı bir cismin en küçük parçacıkları bir kafes şeklinde düzenlenmiştir. Bu, çeşitli parçacıkların sözde düzenli düzenlenmesidir. Kimyasal bağlar onların arasında.

Katı bir cismin yapısının bant teorisi, onu her biri sırayla bir çekirdek ve elektronlardan oluşan bir dizi atom olarak kabul eder. AT Kristal yapı atom çekirdekleri, belirli bir uzaysal periyodiklik ile karakterize edilen kristal kafesin düğümlerinde bulunur.

Bir sıvının yapısı nedir?
Katıların ve sıvıların yapısı, oluşturdukları parçacıkların üzerinde yer alması bakımından benzerdir. yakin MESAFE. Aradaki fark, moleküllerin serbestçe hareket etmesi gerçeğinde yatmaktadır, çünkü aralarında bir katıdan çok daha zayıftır.
Bir sıvının özellikleri nelerdir? Birincisi akışkanlıktır, ikincisi sıvı, konulduğu kabın şeklini alacaktır. Isıtılırsa hacim artar. Parçacıkların birbirine yakınlığı nedeniyle sıvı sıkıştırılamaz.

Gaz halindeki cisimlerin yapısı ve yapısı nedir?
Gaz tanecikleri rastgele sıralanmıştır, birbirlerinden o kadar uzaktırlar ki aralarında hiçbir çekici kuvvet olamaz. Bir gazın hangi özellikleri vardır ve gaz halindeki cisimlerin yapısı nedir? Kural olarak, gaz, yerleştirildiği tüm alanı eşit olarak doldurur. Kolayca sıkıştırır. parçacık hızı gazlı cisim artan sıcaklıkla artar. Aynı zamanda, basınçta bir artış var.

Gaz, sıvı ve katı cisimlerin yapısı, bu maddelerin en küçük parçacıkları arasındaki farklı mesafelerle karakterize edilir. Bir gazın tanecikleri, katı veya sıvı hal. Örneğin havada, parçacıklar arasındaki ortalama mesafe, her parçacığın çapının yaklaşık on katıdır. Böylece, moleküllerin hacmi toplam hacmin sadece yaklaşık %0,1'ini kaplar. Kalan %99,9 boş alan. Buna karşılık, sıvı parçacıklar toplam sıvı hacminin yaklaşık %70'ini doldurur.
Her gaz parçacığı, başka bir parçacıkla (gaz, sıvı veya katı) çarpışana kadar düz bir yol boyunca serbestçe hareket eder. Parçacıklar genellikle yeterince hızlı hareket eder, ikisi çarpıştıktan sonra birbirlerinden sekerler ve yollarına yalnız devam ederler. Bu çarpışmalar yön ve hız değiştirir. Gaz parçacıklarının bu özellikleri, gazların herhangi bir şekli veya hacmi dolduracak şekilde genişlemesine izin verir.

durum değişikliği
Gaz, sıvı ve katı cisimlerin yapısı, üzerlerine belirli bir dış etki uygulanırsa değişebilir. Hatta ısıtma veya soğutma gibi belirli koşullar altında birbirlerinin durumlarına bile dönüşebilirler.

- Buharlaşma. Sıvı cisimlerin yapısı ve özellikleri, belirli koşullar altında tamamen farklı bir fiziksel duruma geçmelerine izin verir. Örneğin, bir arabaya yakıt doldururken yanlışlıkla benzin dökerseniz, keskin kokusunu çabucak koklayabilirsiniz. Bu nasıl olur? Parçacıklar sıvı boyunca hareket eder, bunun sonucunda belirli bir kısmı yüzeye ulaşır. Yönlü hareketleri bu molekülleri yüzeyden sıvının üzerindeki boşluğa taşıyabilir, ancak çekim onları geri çekecektir. Öte yandan, eğer bir parçacık çok hızlı hareket ediyorsa, diğerlerinden makul bir mesafe ile ayrılabilir. Böylece, genellikle ısıtıldığında meydana gelen parçacıkların hızındaki bir artışla, buharlaşma süreci, yani sıvının gaza dönüşümü gerçekleşir.
Farklı fiziksel durumlarda vücutların davranışı
Gazların, sıvıların, katıların yapısı esas olarak tüm bu maddelerin atomlardan, moleküllerden veya iyonlardan oluşması gerçeğinden kaynaklanmaktadır, ancak bu parçacıkların davranışı tamamen farklı olabilir. Gaz parçacıkları birbirinden kaotik bir şekilde uzaktır, sıvı moleküller birbirine yakındır, ancak bir katıdaki kadar katı bir yapıya sahip değildirler. Gaz parçacıkları titreşir ve yüksek hızlarda hareket eder. Bir sıvının atomları ve molekülleri titreşir, hareket eder ve birbirlerinin yanından kayarlar. Katı bir cismin parçacıkları da titreşebilir, ancak bu hareket onların özelliği değildir.

İç yapının özellikleri
Maddenin davranışını anlamak için önce iç yapısının özelliklerini incelemek gerekir. Granit, zeytinyağı ve helyum arasındaki içsel farklar nelerdir? balon? Maddenin yapısının basit bir modeli bu soruyu cevaplamaya yardımcı olacaktır.
 Model, gerçek bir nesnenin veya maddenin basitleştirilmiş bir versiyonudur. Örneğin, gerçek inşaat başlamadan önce, mimarlar önce bir model bina projesi inşa ederler. Böyle basitleştirilmiş bir model mutlaka kesin bir açıklama anlamına gelmez, ancak aynı zamanda şu veya bu yapının nasıl olacağına dair kaba bir fikir verebilir.
Model, gerçek bir nesnenin veya maddenin basitleştirilmiş bir versiyonudur. Örneğin, gerçek inşaat başlamadan önce, mimarlar önce bir model bina projesi inşa ederler. Böyle basitleştirilmiş bir model mutlaka kesin bir açıklama anlamına gelmez, ancak aynı zamanda şu veya bu yapının nasıl olacağına dair kaba bir fikir verebilir.
Basitleştirilmiş Modeller
Ancak bilimde modeller her zaman fiziksel bedenler. Geçen yüzyıl, insanın fiziksel dünya hakkındaki anlayışında önemli bir artış gördü. Bununla birlikte, birikmiş bilgi ve deneyimin çoğu, örneğin matematiksel, kimyasal ve fiziksel formüller biçiminde son derece karmaşık temsillere dayanmaktadır.  Bütün bunları anlamak için, bu kesin ve karmaşık bilimlerde oldukça bilgili olmanız gerekir. Bilim adamları, fiziksel olayları görselleştirmek, açıklamak ve tahmin etmek için basitleştirilmiş modeller geliştirdiler. Bütün bunlar, neden bazı cisimlerin belirli bir sıcaklıkta sabit bir şekle ve hacme sahip olduğunu, diğerlerinin ise onları değiştirebildiğini vb. anlamayı büyük ölçüde basitleştirir.
Bütün bunları anlamak için, bu kesin ve karmaşık bilimlerde oldukça bilgili olmanız gerekir. Bilim adamları, fiziksel olayları görselleştirmek, açıklamak ve tahmin etmek için basitleştirilmiş modeller geliştirdiler. Bütün bunlar, neden bazı cisimlerin belirli bir sıcaklıkta sabit bir şekle ve hacme sahip olduğunu, diğerlerinin ise onları değiştirebildiğini vb. anlamayı büyük ölçüde basitleştirir.
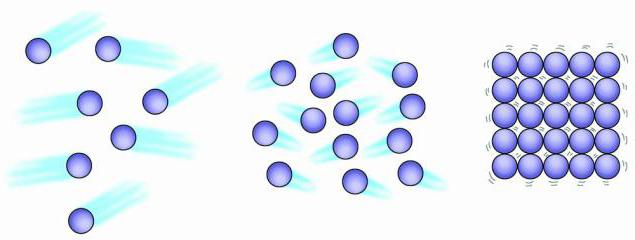
Tüm maddeler küçük parçacıklardan oluşur. Bu parçacıklar sürekli hareket halindedir. Hareketin hacmi sıcaklıkla ilgilidir. Artan sıcaklık, hareket hızında bir artış olduğunu gösterir. Gaz, sıvı ve katı cisimlerin yapısı, parçacıklarının hareket serbestliği ve parçacıkların birbirlerine ne kadar güçlü bir şekilde çekildikleri ile ayırt edilir. Fiziksel, fiziksel durumuna bağlıdır. sıvı su ve buz aynı Kimyasal özellikler, ama onlar fiziksel özelliklerÖnemli ölçüde farklı.
>>Fizik: Gaz, sıvı ve katı cisimlerin yapısı
Moleküler kinetik teori, bir maddenin neden gaz, sıvı ve katı halde olabileceğini anlamayı mümkün kılar.
Gazlar. Gazlarda, atomlar veya moleküller arasındaki mesafe ortalama olarak birçok kez daha fazla boyut moleküllerin kendileri ( şek.8.5). Örneğin, atmosferik basınçta, bir kabın hacmi, içindeki moleküllerin hacminden on binlerce kat daha fazladır.
Gazlar kolayca sıkıştırılırken moleküller arasındaki ortalama mesafe azalır, ancak molekülün şekli değişmez ( şek.8.6).
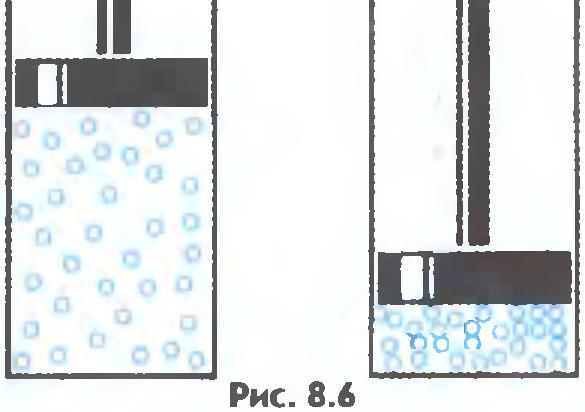
Büyük hızlara sahip moleküller - saniyede yüzlerce metre - uzayda hareket eder. Çarpışarak, bilardo topları gibi birbirlerinden farklı yönlere sıçrarlar. Gaz moleküllerinin zayıf çekim kuvvetleri onları birbirine yakın tutamaz. Bu yüzden gazlar süresiz olarak genişleyebilir. Ne şekli ne de hacmi korurlar.
Moleküllerin kap duvarları üzerindeki çok sayıda etkisi gaz basıncı oluşturur.
sıvılar. Bir sıvının molekülleri neredeyse birbirine yakındır ( şek.8.7), bu nedenle sıvı bir molekül, bir gaz molekülünden farklı davranır. Sıvılarda, sözde kısa menzilli düzen vardır, yani moleküllerin sıralı düzeni birkaç moleküler çapa eşit mesafelerde korunur. Bir molekül, komşu moleküllerle çarpışarak denge konumu etrafında salınır. Sadece zaman zaman başka bir "sıçrama" yapar, yeni bir denge konumuna düşer. Bu denge konumunda itme kuvveti çekici kuvvete eşittir, yani molekülün toplam etkileşim kuvveti sıfırdır. Zaman yerleşik hayat su molekülleri, yani oda sıcaklığında belirli bir denge pozisyonu etrafındaki salınımlarının süresi ortalama 10-11 s'dir. Bir salınımın süresi çok daha azdır (10 -12 -10 -13 s). Sıcaklık arttıkça moleküllerin yerleşik yaşam süresi azalır.

İlk olarak Sovyet fizikçi Ya.I. Frenkel tarafından kurulan sıvılardaki moleküler hareketin doğası, sıvıların temel özelliklerini anlamayı mümkün kılar.
Sıvı moleküller doğrudan yan yana bulunur. Hacimdeki azalma ile itici kuvvetler çok büyük hale gelir. Bu açıklıyor sıvıların düşük sıkıştırılabilirliği.
Bilindiği gibi, sıvılar akışkandır, yani şekillerini korumazlar. Bu şekilde açıklanabilir. Dış kuvvet, saniyedeki moleküler sıçramaların sayısını fark edilir şekilde değiştirmez. Ancak moleküllerin sabit bir konumdan diğerine sıçramaları, ağırlıklı olarak etki yönünde meydana gelir. dış güç (şek.8.8). Bu nedenle sıvı akar ve bir kap şeklini alır.
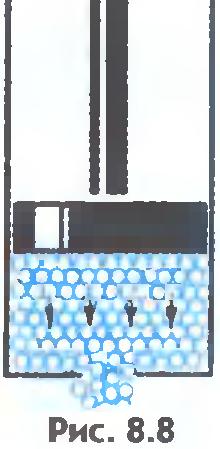
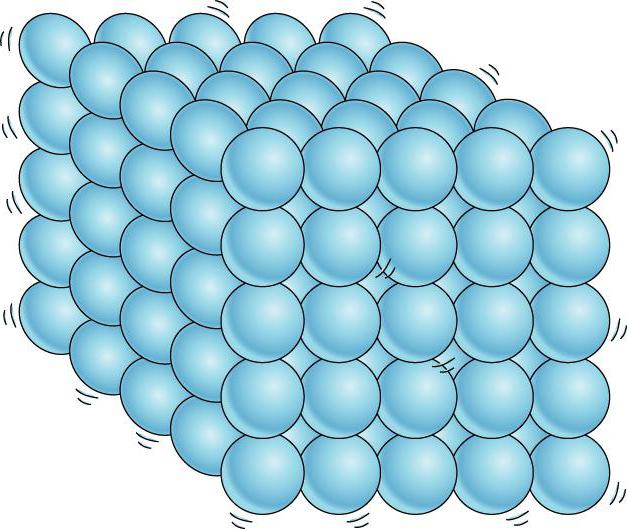
Sıvılar ve katılar arasında önemli bir fark daha vardır. Bir sıvı, bireysel bireylerin yerinde durmaksızın itişip kakıştığı bir insan kalabalığına benzetilebilir ve katı bir vücut, dikkat çekmeseler de kendi aralarında ortalama olarak belirli mesafeleri koruyan aynı bireylerin ince bir topluluğu gibidir. . Katı bir cismin atomlarının veya iyonlarının denge konumlarının merkezlerini bağlarsak, o zaman doğru uzaysal kafes elde ederiz. kristal.
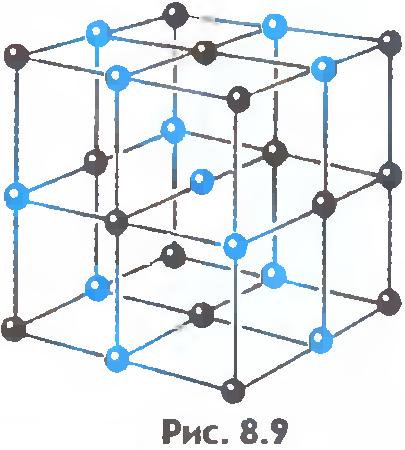
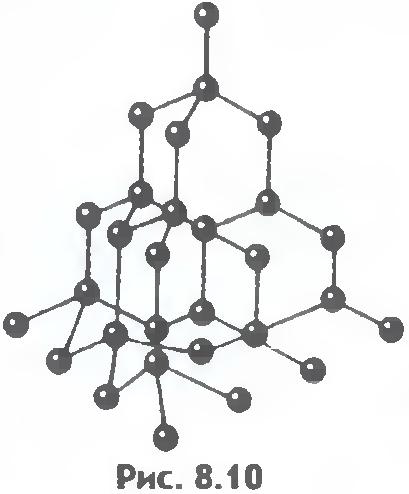
Şekil 8.9 ve 8.10 sofra tuzu ve elmasın kristal kafeslerini göstermektedir. Kristal atomların dizilişindeki iç düzen, düzenli dış geometrik şekillere yol açar.
Şekil 8.11 Yakut elmaslarını göstermektedir.
gaz mesafesi ben Moleküller arası moleküllerin boyutundan çok daha büyüktür. r0:" l>>r 0
.
Sıvılar ve katılar için l≈r0. Bir sıvının molekülleri düzensiz bir şekilde düzenlenir ve zaman zaman sabit bir konumdan diğerine atlar.
Kristal katılarda moleküller (veya atomlar) kesinlikle düzenli bir şekilde düzenlenir.
???
1. Gaz sınırsız genişleme yeteneğine sahiptir. Dünya'nın neden bir atmosferi var?
2. Gaz, sıvı ve katı moleküllerin hareket yörüngeleri arasındaki fark nedir? Bu durumdaki maddelerin moleküllerinin yaklaşık yörüngelerini çizin.
G.Ya.Myakishev, B.B.Bukhovtsev, N.N.Sotsky, Fizik 10. Sınıf
ders içeriği ders özeti destek çerçeve ders sunum hızlandırıcı yöntemler etkileşimli teknolojiler Uygulama görevler ve alıştırmalar kendi kendine muayene çalıştayları, eğitimler, vakalar, görevler ev ödevi tartışma soruları retorik sorularöğrencilerden İllüstrasyonlar ses, video klipler ve multimedya fotoğraflar, resimler grafikler, tablolar, mizah şemaları, fıkralar, şakalar, çizgi roman benzetmeleri, sözler, bulmacalar, alıntılar Eklentiler özetler makaleler meraklı hile sayfaları için çipler ders kitapları temel ve ek terimler sözlüğü diğer Ders kitaplarının ve derslerin iyileştirilmesiders kitabındaki hataları düzeltme ders kitabındaki bir parçanın güncellenmesi derste yenilik unsurlarının eskimiş bilgiyi yenileriyle değiştirmesi Sadece öğretmenler için mükemmel dersler yıl için takvim planı yönergeler tartışma programları Entegre DerslerBu ders için düzeltmeleriniz veya önerileriniz varsa,
Moleküler kinetik teori, bir maddenin neden gaz, sıvı ve katı halde olabileceğini anlamayı mümkün kılar.
Gaz. Gazlarda, bir ortamdaki atomlar veya moleküller arasındaki mesafe, moleküllerin kendi boyutlarından birçok kez daha fazladır (Şekil 10). Örneğin, ne zaman atmosferik basınç Onlarca gemi hacmi
kaptaki gaz moleküllerinin hacminden bin kat daha fazladır.
Gazlar kolayca sıkıştırılır, çünkü bir gaz sıkıştırıldığında sadece moleküller arasındaki ortalama mesafe azalır, ancak moleküller birbirini “sıkmaz” (Şekil 11).
Büyük hızlara sahip moleküller - saniyede yüzlerce metre - uzayda hareket eder. Çarpışarak, bilardo topları gibi birbirlerinden farklı yönlere sıçrarlar.
Gaz moleküllerinin zayıf çekim kuvvetleri onları birbirine yakın tutamaz. Bu nedenle, gazlar süresiz olarak genişleyebilir. Ne şekli ne de hacmi korurlar.
Moleküllerin kap duvarları üzerindeki çok sayıda etkisi gaz basıncı oluşturur.
Sıvılar. Sıvılarda moleküller neredeyse birbirine yakındır (Şekil 12). Bu nedenle sıvıdaki bir molekül gazdakinden farklı davranır. Bir hücrede olduğu gibi, diğer moleküller tarafından kenetlendiğinde, bir “yerinde çalışma” gerçekleştirir (denge konumu etrafında salınır, komşu moleküllerle çarpışır). Sadece zaman zaman bir "atlama" yapar, "kafesin parmaklıklarını" kırar, ancak daha sonra yeni komşuların oluşturduğu yeni bir "kafese" düşer. Bir su molekülünün "yerleşik yaşam" süresi, yani oda sıcaklığında belirli bir denge konumu etrafındaki salınımların süresi ortalama s'dir. Bir salınımın süresi çok daha azdır (s). Sıcaklık yükseldikçe, moleküllerin “hareketsiz yaşamı” azalır. İlk olarak Sovyet fizikçi Ya. I. Frenkel tarafından kurulan sıvılardaki moleküler hareketin doğası, sıvıların temel özelliklerini anlamayı mümkün kılar.
Bir sıvının molekülleri doğrudan yan yana yer alır, bu nedenle sıvının hacmini az miktarda da olsa değiştirmeye çalıştığınızda moleküllerin kendi deformasyonu başlar (Şekil 13). Ve bu çok fazla güç gerektirir. Bu, sıvıların düşük sıkıştırılabilirliğini açıklar.
Sıvılar bildiğiniz gibi akışkandır, yani şekillerini korumazlar. Bu şu şekilde açıklanmaktadır. Sıvı akmazsa, moleküllerin bir "hareketsiz" konumdan diğerine atlamaları her yönde aynı frekansta gerçekleşir (Şekil 12). Dış kuvvet, saniyedeki moleküler sıçramaların sayısını belirgin şekilde değiştirmez, ancak moleküllerin bir "hareketsiz" konumdan diğerine sıçramaları, ağırlıklı olarak dış kuvvet yönünde meydana gelir (Şekil 14). Bu nedenle sıvı akar ve bir kap şeklini alır.
Katılar. Katıların atomları veya molekülleri, sıvılardan farklı olarak belirli denge konumları etrafında salınır. Doğru, bazen moleküller denge konumlarını değiştirir, ancak bu çok nadiren olur. Bu nedenle katılar sadece hacmini değil aynı zamanda şeklini de korur.
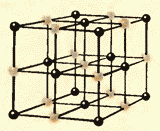
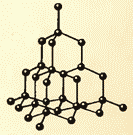
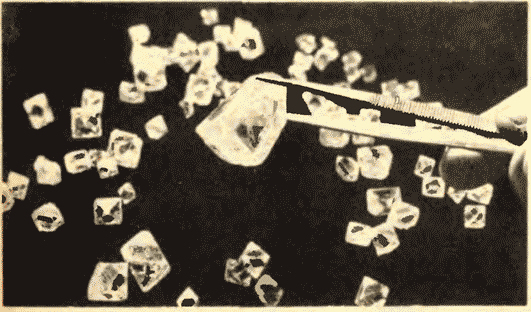
Sıvılar ve katılar arasında önemli bir fark daha vardır. Bir sıvı, bireysel üyeleri huzursuzca yerlerini iten bir kalabalığa benzetilebilir ve katı bir gövde, üyeleri dikkat çekmeseler de (termal hareket nedeniyle) ince bir kohort gibidir. kendi aralarında ortalama olarak belirli aralıklarla. Katı bir cismin atomlarının veya iyonlarının denge konumlarının merkezlerini birleştirirsek, kristal adı verilen düzenli bir uzaysal kafes elde ederiz. Şekil 15 ve 16, sofra tuzu ve elmasın kristal kafeslerini göstermektedir. Kristal atomlarının dizilişindeki iç düzen, geometrik olarak doğru dış biçimlere yol açar. Şekil 17, Yakut elmaslarını göstermektedir.
Görüldüğü gibi, maddenin temel özelliklerinin moleküler kinetik teori temelinde nitel bir açıklaması, özellikle zor değildir. Bununla birlikte, deneysel olarak ölçülen nicelikler (basınç, sıcaklık vb.) ile moleküllerin kendi özellikleri, sayıları ve hareket hızları arasında nicel ilişkiler kuran teori çok karmaşıktır. Kendimizi gazlar teorisini düşünmekle sınırlıyoruz.
1. Moleküllerin termal hareketinin varlığına dair kanıt sağlayın.
2. Neden Brown hareketi sadece küçük kütleli parçacıklar için fark edilebilir mi?
3. Moleküler kuvvetlerin doğası nedir? 4. Moleküller arasındaki etkileşim kuvvetleri, aralarındaki mesafeye nasıl bağlıdır? 5. Düzgün, temiz kesimli iki kurşun çubuk birbirine bastırıldığında neden birbirine yapışır? 6. Gaz, sıvı ve katı moleküllerinin termal hareketi arasındaki fark nedir?







