Katı kristallerin yapısı ve enerji özellikleri
Yürütme yeteneğine göre elektrik Tüm katı malzemeler genellikle iletkenlere, yarı iletkenlere ve dielektriklere ayrılır. İletken malzemeler iletken olarak sınıflandırılır mı? > 10 6 Ohm -1 cm -1; bunlar, yüksek iletkenlik elektronlarının yüksek konsantrasyonuyla sağlanan metalleri içerir. Oda sıcaklığındaki dielektriklerde çok az elektron var ve iletkenlikleri düşük mü?< 10 -10 Ом -1 см -1 . В промежуточную группу попадают полупроводники, которые могут иметь концентрацию электронов, близкую к нулю (тогда они являются диэлектриками) и близкую к концентрации электронов в металле (тогда они являются проводниками).
Metaller ve yarı iletkenler, farklı elektriksel iletkenliğe sahip olmalarına ek olarak, elektrik iletkenliğinin sıcaklığa bağımlılığında da farklılık gösterir. Metallerde, elektriksel iletkenlik, kural olarak, artan sıcaklıkla neredeyse doğrusal olarak azalır. Hiçbir kusur ve safsızlığın olmadığı (genellikle içsel olarak adlandırılır) yarı iletkenlerde, artan sıcaklıkla iletkenlik, üstel bir yasaya göre yaklaşık olarak artar:
yapısını göz önünde bulundurmak ve enerji özellikleri kristal katılar silisyum ve germanyum (yarı iletken cihazların üretiminde en yaygın olarak kullanılan yarı iletkenler) içeren , önce tek bir atomun enerji özelliklerine dönmelisiniz.
Bir atom, etrafında elektronların hareket ettiği ve bir elektron kabuğu oluşturan bir çekirdekten oluşur. Toplam negatif yük elektron dengeleri pozitif yükçekirdek, böylece normal durumda atom elektriksel olarak nötrdür. Göre kuantum teorisi, bir atomun elektronları yalnızca izin verilenler olarak adlandırılan kesin olarak tanımlanmış enerji değerlerine sahip olabilir. Bu enerji değerlerine enerji seviyeleri denir. Elektronların enerji seviyeleri birbirinden yasak aralıklarla ayrılmıştır. Çekirdeğin etrafında belirli yörüngelerde hareket eden elektronlar, çekirdekten farklı mesafelerde çıkarılır ve buna göre farklı enerji değerlerine sahiptir: çekirdekten ne kadar uzak olursa, elektronun enerjisi o kadar büyük ve çekirdekle ilişkili o kadar zayıftır.
dış katman elektronları elektron kabuğu değerlik denir. En yüksek enerjiye sahipler ve çekirdeğe en az bağlılar. Grafiksel olarak, tek bir atomdaki elektronların enerji spektrumu bir enerji diyagramı olarak gösterilebilir. Böyle bir diyagramın bir örneği Şekil 2'de gösterilmektedir. 1.1, bir. Enerji değerleri dikey boyunca çizilir ve karşılık gelen enerji seviyeleri yatay çizgiler olarak gösterilir. Pauli ilkesine göre, eksenleri etrafında farklı dönüş yönlerine sahip olan (ters dönüşler) ikiden fazla elektron aynı anda aynı enerji seviyesinde olamaz.
Atom normal durumdaysa ve dışarıdan enerji almıyorsa, izin verilen tüm düşük enerji seviyeleri elektronlar tarafından işgal edilir; bir elektronun bir seviyeden diğerine geçişi imkansızdır. İzin verilen daha yüksek seviyeler elektronlar tarafından işgal edilmeden kalır ve serbest olarak adlandırılır. Bir elektronun daha yüksek bir serbest enerji düzeyine geçişi, yani. çekirdekten daha uzak bir yörüngeye, ancak dışarıdan kesin olarak tanımlanmış bir enerji bölümünü (kuantum) (termal, ışık, elektrik, manyetik) emdiğinde, serbest enerji değerlerindeki farka eşit olduğunda mümkündür. ve bu elektron tarafından işgal edilen seviyeler. Bu durumda atom uyarılmış duruma geçer.
Bir atomun uyarılmış hali çok kararsızdır. Saniyenin sadece yüz milyonda biri kadar sürer ve atom, elektronun önceki enerji seviyesine geri geçişinin eşlik ettiği normal durumuna döner. Bir atomun uyarılmış bir durumdan normal bir duruma geçişine, bir kuantum elektromanyetik radyasyon şeklinde aşırı enerjinin salınması eşlik eder.
Elektron yeterli miktarda enerji alırsa atomdan ayrılır, atom iyonlaşır: serbest elektron ve pozitif iyona ayrılır. Ters işlem, serbest bir elektronun birleşimidir ve pozitif iyon nötr bir atoma - rekombinasyon denir ve radyasyon kuantumu şeklinde fazla enerjinin salınması eşlik eder. Serbest bırakılan enerji, daha önce atomun iyonlaşması için harcanan enerjiye eşittir.
Bir katının kristallerinin oluşumu sırasında, atomlar arasında bir etkileşim meydana gelir, bunun sonucunda bireysel atomların izin verilen enerji seviyeleri N alt seviyelerine bölünerek enerji bölgeleri oluşturur (Şekil 1.1, b). Bu durumda, tek bir atomda olduğu gibi, bir enerji seviyesinde zıt spinli ikiden fazla elektron olamaz (Pauli ilkesi korunur). Alt seviyelerin (N) sayısı büyük olduğundan (bir katının 1 cm3'ünde yaklaşık 10 22 - 10 23 atom vardır), alt seviyeler arasındaki enerji mesafesi çok küçüktür ve elektron alt seviyeden alt seviyeye hareket edebilir. küçük harici enerji etkileriyle bile bölgenin altından tavana kadar, yani. özgür bir adam gibi davranır. Ancak bu, yalnızca bölgedeki üst enerji seviyeleri işgal edilmemişse doğrudur, yani. alan tam olarak doldurulmamıştır.
Mutlak sıfır sıcaklığında (T = 0 K) elektronlar tarafından işgal edilen tek bir atomun enerji seviyeleri, kristalde, üst kısmı dolu olan, dolu bölgeler oluşturur. değerlik elektronları, değerlik bandı olarak adlandırılır.
Elektronlar tarafından işgal edilmeyen bir atomun izin verilen daha yüksek enerji seviyeleri
T = 0 K, kristalde serbest bölgeler oluşturur. Değerlik bandına en yakın serbest banda iletkenlik bandı denir, çünkü orada bulunan elektronlar atomlar arasında hareket edebilir ve bir elektrik akımı oluşturabilir. Dolu bölgedeki elektronlar, alanın etkisi altında hareket edemez (ve buna bağlı olarak, enerji kazanabilir), çünkü tüm enerji seviyeleri işgal edilmiştir ve Pauli ilkesine göre, bir elektron işgal edilmiş bir durumdan işgal edilmiş bir duruma geçemez. Bu nedenle, tamamen dolu bir değerlik bandının elektronları, elektriksel iletkenliğin oluşumuna katılmaz.
İletim bandı ile değerlik bandı arasında, kuantum mekaniğinin yasalarına göre elektronların olamayacağı (tıpkı bir atomdaki elektronların sahip olamayacağı gibi) bir bant aralığı E g (elektron volt (eV) olarak ölçülür) vardır. elektron kabuklarının enerjilerine karşılık gelmeyen enerjiler). Bant aralığı belirleyen ana parametredir. elektriksel özellikler sağlam vücut.
Bölgeleri elektronlarla doldurmanın doğasına göre, tüm cisimler iki büyük gruba ayrılabilir:
- ile İlk grup sadece kısmen doldurulmuş bir bölgenin tamamen doldurulmuş bölgelerin üzerinde bulunduğu gövdeleri içerir (Şekil 1.2, a). Bu bölge şu durumlarda oluşur: atom seviyesi oluştuğu, atomda tam olarak doldurulmamıştır. Sadece kısmen doldurulmuş bir bölgenin varlığı metallerin doğasında vardır. Metallerin bant aralığı yoktur;
- ile ikinci grup serbest bölgelerin tamamen doldurulmuş bölgelerin üzerinde bulunduğu gövdeleri içerir (Şekil 1.2, b, c). Bu tür organların tipik örnekleri şunlardır: kimyasal elementler Periyodik tablonun IV. Grubu: elmas yapısına sahip elmas, silikon, germanyum ve gri kalay modifikasyonunda karbon. Bu vücut grubu birçok kimyasal bileşik içerir - metal oksitler, nitrürler, karbürler, halojenürler alkali metaller vb.
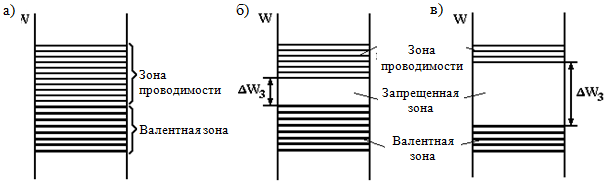
Yasak bölgenin genişliğine göre, ikinci grubun gövdeleri şartlı olarak dielektriklere ve yarı iletkenlere ayrılır. İle dielektrikler nispeten geniş bir bant aralığına sahip gövdeleri içerir. Tipik dielektrikler için, E g > 3 eV. Böylece elmas için E g = 5.2 eV; bor nitrür için Eg = 4.6 eV; A1 2 O 3 E g \u003d 7 eV vb. için
İle yarı iletkenler nispeten dar bir bant aralığına sahip gövdeleri içerir (Şekil 1.2, b). Tipik yarı iletkenler için, E g ? 1 eV, örneğin:
- germanyum için Eg = 0.72 eV;
- silikon, Eg = 1.12 eV'ye sahiptir;
- indiyum antimonit için Eg = 0.17 eV;
- galyum arsenit için E g = 1.43 eV, vb.
Metallerin, yarı iletkenlerin ve dielektriklerin enerji diyagramları
T = 0 K, Şek. 1.2. Bu diyagramlarda elektronlarla dolu değerlik bandı daha kalın düz çizgilerle, bu koşullar altında elektronların olmadığı iletim bandı ise ince çizgilerle gösterilmiştir.
Fizikte kolokyum №2'ye cevaplar.
Atomların ve moleküllerin enerji seviyeleri. Atomlarda ve moleküllerde kuantum geçişleri. Atomlar ve moleküller tarafından enerji absorpsiyonu ve emisyonu, absorpsiyon ve emisyon spektrumları.
Bir atomdaki elektronik enerji seviyeleri Uyarılmamış durumdaki elektronlar düşük enerjiyi doldurur. seviyeler ve üst seviyeler ücretsizdir. Bir atom, diğer atomlarla çarpışması sonucu veya bir kuantum ışığı emerek enerji alırsa, uyarılmış duruma geçer ve atomun herhangi bir elektronu alt seviyeden üst seviyeden birine gider. Kısa bir süre sonra, belirli bir frekansta kuantum ışık yayarak alt seviyeye döner.
Moleküller, etkileşen atomlardan oluşur, molekül içi hareket, atom içi hareketten daha karmaşıktır. Bir molekülde, elektronların çekirdeğe göre hareketine ek olarak, salınım hareketi atomlar kendi denge konumları ve bir bütün olarak molekülün dönme hareketi etrafında. Bir molekülün elektronik, titreşim ve dönme hareketi üç tür enerji düzeyine karşılık gelir: Yılan Balığı, Ekol, Heb. Molekülün toplam enerjisi: E=Eel+Eur+Ecol. Kuantum mekaniğine göre, moleküllerin titreşim ve dönme enerjisinin yanı sıra elektronik enerji de kuantum bir karaktere sahiptir, yani. ayrı ayrı değiştirin. Titreşim seviyeleri arasındaki mesafe elektronik olanlardan çok daha küçüktür. Bu nedenle, bir molekülün her elektronik seviyesi, bir dizi titreşim seviyesine (alt seviyelere) ayrılır. Buna karşılık, molekülün her bir titreşim seviyesi, aralarındaki mesafe titreşim seviyeleri arasındakinden bile daha küçük olan bir dizi dönme alt seviyesine karşılık gelir.
Sabit enerji. durum: hiçbir enerji yayılmaz veya emilmez. Kuantum geçişlerinde, atomlar ve moleküller bir durağan durumdan diğerine atlar, bir enerji seviyesi bir diğer. Bunun nedeni elektronların enerji geçişleridir.
Bir atom veya molekül, yüksek enerji seviyelerinden daha düşük seviyelere geçerken enerji verir, aksi takdirde emer. Temel durumundaki bir atom sadece enerjiyi emebilir.
Atomlar veya moleküller tarafından yayılan enerji, emisyon spektrumunu oluşturur ve emilen enerji, absorpsiyon spektrumunu oluşturur.
saat atomda elektron geçişi enerji bir kuantum EM radyasyonu şeklinde salınır veya emilir. Atomik emisyon ve absorpsiyon spektrumları çizgiye benzer.
Moleküllerde geçiş:
Bir moleküldeki elektronik seviyelerin titreşimsel ve rotasyonel alt seviyelere ayrılmasının bir sonucu olarak, olası sayıların sayısı enerji geçişleri atomlarla karşılaştırıldığında önemli ölçüde artar. Bu nedenle, moleküler spektrumlar daha karmaşık hale gelir, sürekli bir karaktere sahiptirler.
∆E >>∆Epol.> ∆Eur.
∆Ee ~ 1-3 EV λ~ 0,5 μV
∆Epol. ~ 10 -2 -10 -1 EP λ~1-100mkV
∆İb. ~ 10 3 -10 -5 V λ~100-1000mkV
bir molekülün enerji emilimi
2- Bir atomun enerjisinin bir molekül üzerindeki radyasyonu
Lüminesans, emisyon ve absorpsiyon spektrumları, Stokes kuralı. Biyofizik ve tıpta lüminesans kullanımı.
lüminesans- belirli bir sıcaklıkta termal radyasyondan fazla olan ve ışık dalgasının periyodundan t (10 -15) daha büyük bir periyoda sahip radyasyon. Lüminesans herhangi bir sıcaklıkta meydana gelir. Lüminesan maddeler ısınmadan parlar. Asla dengeli değildir.
Uyarma türüne göre, lüminesans:
1) Fotolüminesans - ışıkla uyarma;
2) Elektrolüminesans - uyarma Elektrik alanı;
3) Kemilüminesans (kimyasal reaksiyon yoluyla uyarma).
Bu kaynakların etkisi, ışıldayan maddenin atomlarının, moleküllerinin veya iyonlarının uyarılmasına yol açar. Radyasyon, madde parçacıklarının uyarılmış durumlardan zemine (veya daha az uyarılmış) kuantum geçişlerinin bir sonucu olarak meydana gelir.
Işımanın süresine göre, fotolüminesans ayrılır:
Floresan - kısa süreli parlama
Fosforesans - nispeten uzun bir afterglow

Lüminesans spektrumu süreklidir.
Lüminesansın temel özellikleri.
1) kuantum verimi:
ζ= %100 N(emisyon)/N(absorpsiyon),
N(radyasyon) ışık veren kuanta sayısıdır,
N(absorb) – absorbe edilen kuantum sayısı.
2) D, örneğin optik yoğunluğudur.
D=lgI 0 /I λ =Esl, burada E moleküler absorpsiyon indeksidir
3) D= f(λ ) absorpsiyon spektrumudur
ben λ = f(λ ) radyasyon spektrumu
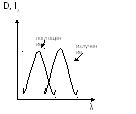
Stokes' kuralı:
Belirli bir maddenin absorpsiyon spektrumu, emisyon spektrumuna göre daha kısa dalga boylarına doğru kaydırılır.
Biyofizik ve tıpta lüminesansın kullanımı:
Fotolüminesans:
Gıda bozulmalarının ilk aşamasının tespiti
Farmakolojik preparatların sınıflandırılması
Bazı hastalıkların teşhisi (bir mantar veya liken tarafından hasarlarını teşhis ederken saçın parlaması, pullar, tırnaklar)
Fotolüminesansa dayalı olarak, spektrumu akkor lambalardan (floresan lambalar) daha çok gün ışığına benzeyen ışık kaynakları oluşturulmuştur.
Kemilüminesans - teşhiste uygulama
Membran sistemlerine dışarıdan eklenen özel floresan moleküllerin kullanılması. Bu tür moleküllere floresan problar veya etiketler denir. Bunları değiştirmek, zarlardaki proteinlerdeki konformasyonel yeniden düzenlemeleri tespit etmeyi mümkün kılar.
indüklenmiş emisyon. Düzeylerin ters popülasyonu. Optik kuantum jeneratörleri (lazerler). Özellikleri Lazer radyasyonu ve tıpta kullanımı.
uyarılmış emisyon uyarılmış parçacığın alt seviyeye zorla geçişidir. Bu durumda, saniyedeki geçiş sayısı aynı zamanda maddeye giren fotonların sayısına bağlıdır, yani. ışığın yoğunluğundan. Ayrıca, zorunlu geçişler, ilgili enerji durumlarının popülasyonu tarafından belirlenecektir. nüfus inversiyonu- üst seviyelerden birindeki partikül sayısının alt seviyedeki chm'den daha büyük olduğu ortamın böyle bir durumu. Seviyelerin ters popülasyonu, elektronların uyarılmış seviyeden 10 -5 kat daha uzun süre yarı kararlı seviyede kalabilmeleri ile sağlanır.
Vv 1960 ilk görünür radyasyon aralığının kuantum üreteci - lazerçalışan bir madde olarak yakut ile. 694.3 nm dalga boyunda darbeli radyasyon oluşturur.
Lazerin çalışma prensibi lüminesansa benzer.
![]()
![]()
Al 2 O 3 + Cr 2 O 3 - yakut
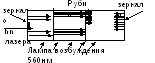
Lazer radyasyonunun özellikleri
Lazer radyasyonu her zaman tek renklidir
polarizasyon
Işınlar birbirinden ayrılmıyor, kesinlikle paralel
Çok yüksek yoğunluklar elde edebilirsiniz.
Lazer uygulaması:
DNA ve proteinlerin tanımlanması.
Oftalmoloji
Trofik ülserlerin tedavisi, malign tümörler
Sürekli modda çalışan lazerler, bol miktarda tedarik edilen organlarda operasyonlar için kullanılır.
X-ışını radyasyonu: karakteristik ve bremsstrahlung; radyasyon mekanizması, karakteristik spektrumlar ve bremsstrahlung X-ışınları.
röntgen radyasyonu 80 ila 10 -4 nm aralığında bir elektromanyetik dalgadır. Uzun dalga X-ışını radyasyonu, kısa dalga UV radyasyonu ile, kısa dalga uzun dalga y-radyasyonu ile örtüşmektedir. Uyarma yöntemine göre, X-ışını radyasyonu bremsstrahlung ve karakteristik olarak ayrılır.
frenTekrar-radyasyon.
Anot malzemesinde bir elektron yavaşladığında meydana gelen radyasyona bremsstrahlung X-ışınları denir. Elektronlar yavaşladığında, enerjinin yalnızca bir kısmı bir foton oluşturmaya gider, diğer kısmı ise anodu ısıtmaya harcanır. Bu parçalar arasındaki oran rastgele olduğundan, çok sayıda elektron yavaşladığında, sürekli bir x-ışını radyasyonu spektrumu oluşur.
Bremsstrahlung spektrumu: (1) - çeşitli voltajlarda röntgen tüpü)
X-ışını akısı aşağıdaki formülle ölçülür:
Ф=КUа-кIZ 2), burada U, I - X-ışını tüpündeki voltaj ve akım, Z - anotun atom maddesinin seri numarası, k=10 -9 V -1 - - orantı katsayısı.
Ф=- λ min ˜ ∫Ф λ d λ
Katot filaman sıcaklığı arttırılırsa, elektron emisyonu ve tüpteki akım artacaktır. Bu, her saniye yayılan X-ışını fotonlarının sayısını artıracaktır. Ancak spektral bileşimi değişmez.
2) Karakteristik x-ışını radyasyonu.
X-ışını tüpündeki voltajın arttırılması, sürekli bir spektrumun arka planına karşı, karakteristik X-ışını radyasyonuna karşılık gelen bir çizginin görünmesine neden olur. Yüksek voltajla hızlandırılan elektronlar, atomun derinliklerine nüfuz eder ve elektronları iç katmanlarından dışarı atar. Üst seviyelerden elektronlar, serbest yerlere geçer ve bunun sonucunda karakteristik radyasyon fotonları yayılır.
Karakteristik x-ışını spektrumu atom, bu atomun dahil olduğu kimyasal bileşiğe bağlı değildir. spektrum:
X-ışınlarının madde ile etkileşimi (uyumlu saçılma, fotoelektrik etki, Compton etkisi). X-ışını yoğunluğunun zayıflama yasası. Röntgen koruması.
X-ışını radyasyonunun madde ile etkileşimi
1)
tutarlı saçılma– uzun dalga boylu X-ışınlarının saçılması Durum: hn hn 1 = hn 2, burada n frekanstır. 2)
fotoelektrik etki. hn≥A ve. Bu durumda, X-ışını kuantumu emilir ve elektron atomdan ayrılır. Ayrılmış elektron alır kinetik enerji. Eğer büyükse, elektron çarpışma yoluyla komşu atomları iyonize edebilir. bir elektronun çıkarılması - iyonlaşma süreci hn \u003d Eion + m 0 v 2 / 2 3) Compton etkisi hn>>Ai. Bu durumda elektron atomdan ayrılır ve bir miktar kinetik enerji kazanır. Fotonun kendisinin enerjisi azalır. O. tutarsız saçılma (Compton etkisi) sonucunda ikincil saçılan radyasyon oluşur ve maddenin atomlarının iyonlaşması meydana gelir. hn \u003d Eion + mv 2 / 2 + hn X-ışını yoğunluğunun zayıflama yasası: Ix \u003d I 0 e -µx µ=µp +µp her işlem teriminin katkısı foton enerjisi tarafından belirlenir. fotoelektrik etki Compton etkisi 6. X-ışını tüpünün cihazı ve X-ışını aparatı. Radyasyonun sertliği ve yoğunluğu, ayarlanması. Röntgen elde etme yöntemi. Tıpta röntgen kullanımı. X-ışını tüpü cihazı: Tüp, iki elektrotlu (muhtemelen yüksek vakumlu) bir cam şişedir: yüksek voltajın uygulandığı bir anot ve bir katot. Katot elektronların kaynağıdır. Anot metal bir çubuktur eğimli yüzey ortaya çıkan x-ışınlarını tüpün eksenine bir açıyla yönlendirmek için. Yüksek voltajın etkisi altında, sıcak katot filamanından yayılan elektronlar yüksek enerjiye hızlandırılır. Bir elektronun kazandığı kinetik enerji, elektrik kuvvetlerinin işine eşittir ve katot ile anot arasındaki voltajla orantılıdır. X-ışını radyasyonu, anot malzemesindeki hızlı elektronların atomlarıyla çarpışması üzerine yoğun yavaşlamasının bir sonucu olarak ortaya çıkar (bir elektrik alanı ile etkileşim) atom çekirdeği ve elektronlar). Uа-к≈100∙10 3 V λmin= hc/ eUa-k 1) Kısa dalga boylu X-ışınları genellikle uzun dalga boylu olanlardan daha büyük bir nüfuz gücüne sahiptir ve denir. sert ve uzun dalgalı yumuşak. Yumuşak radyasyon madde tarafından daha güçlü bir şekilde emilir. X-ışını tüpündeki voltajı arttırmak, radyasyonun spektral bileşimini değiştirmek ve sertliği arttırmak. Röntgen almak. X-ışınlarının yoluna homojen olmayan bir cisim konur ve önüne bir floresan ekran yerleştirilirse, bu cisim radyasyonu emerek veya azaltarak ekranda bir gölge oluşturur. Bu gölgenin doğası gereği, vücutların şekli, yoğunluğu, yapısı ve birçok durumda doğası hakkında yargıya varılabilir. şunlar. x-ışını radyasyonunun farklı dokular tarafından emilmesinde önemli bir fark, gölge projeksiyonunda iç organların görüntüsünü görmenizi sağlar. µ1<µ2
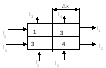
I 2 < tıpta x-ışını radyasyonunun uygulanması: Röntgen teşhisi: 1) Floroskopi (Röntgen tüpü hastanın arkasında bulunur. Önünde floresan ekran bulunur. Ekranda gölge (pozitif) görüntü görülür). 2) radyografi (nesne, içine özel bir fotoğraf emülsiyonu olan bir filmin yerleştirildiği bir kasete yerleştirilir. X-ışını tüpü nesnenin üzerine yerleştirilir. Ortaya çıkan radyografi, negatif bir görüntü verir, yani. resmin aksine. Bu yöntemde, görüntü daha nettir. Bu yöntemin umut verici bir çeşidi, X-ışını tomografisi ve bilgisayarlı tomografidir). 3) Florografi 4) X-ışını tedavisi - malign tümörleri yok etmek için x-ışınlarının kullanılması. 7. X-ışını tomografisinin prensibi. Röntgen tomografisi. Onun cihazı. Bir röntgen tomogramı ile bir röntgen arasındaki temel farklar nelerdir? 1) Yeniden emilim µ - absorpsiyon katsayısı, doku özelliği 2) Yeniden çalışma Ia \u003d I 0 e -µ x 1 Iv \u003d I 0 e -µ2 x 2 Iv \u003d I 0 e -µ1x1 e -µ2x2 \u003d I 0 e - (µ1x1 + µ2x2) Teşhisin amacı. µ3 ve ∆µ3'ü belirleyin lnI1/I 0 = -(µ1+µ2)∆х lnI2/I 0 = -(µ3+µ4)∆х lnI3/I 0 = -(µ3+µ1)∆х lnI4/I 0 = -(µ4+µ2)∆х ben 0 - ayarla I1,I2,I3,I4 - ölçülen (bilinen) ∆x - set (bilinen) 4 denklemlik bir sistem çözerek µ1µ2µ3µ4'ü bulun 2048∙2048= 4194304 Radon teoremlerinin sistemi Bir nesnenin sonsuz sayıda görüntüsünü alırsam, onu herhangi bir doğrulukla geri yüklemek mümkündür. Teknik çözüm. aşama: ölçümler I1,I2,I3,I4… aşama: bir görüntü oluşturma Her µ değerine bilgisayar kendi parlaklığını (renk) atar. 1 dilim - 1 saniye Kontrast ∆µ/µ=0,1%(%10 ile) Katman kalınlığı - 1-2mm Çözünürlük sınırı 0,2 mm Tomografi ile 2 mm'den daha az detaylara sahip vücudun katmanlı röntgen görüntüsünü elde etmek mümkündür. Bu, beynin gri ve beyaz maddesini ayırt etmenizi ve çok küçük tümör hücrelerini görmenizi sağlar. Eğitim 8. İyonlaştırıcı radyasyon türleri. İyonlaştırıcı radyasyonun madde üzerindeki etkisi. Absorbe, maruz kalma ve biyolojik (eşdeğer) dozlar, aralarındaki ilişki. SI sistemindeki doz birimleri ve tıpta kullanılan sistemik olmayan birimler. Radyoaktivite olgusunun radyasyon sürecinde, radyoaktif çekirdekler tarafından yayılan 3 tip ışın keşfedildi. Alfa bozunması a-parçacıklarının (helyum çekirdeği) emisyonu ile çekirdeğin kendiliğinden dönüşümünden oluşur. A Z X → A-4 Z -2 Y+ 4 2 α-bozunması sırasında, kızı çekirdek uyarılmış bir durumda oluşturulabilir. Bu durumda, uyarılmış çekirdeğin enerjisi çoğunlukla bir -kuantum şeklinde salınır. Bu nedenle alfa bozunmasına radyasyonu eşlik eder. beta bozunumu elektronların (veya pozitronların) emisyonu ile çekirdeğin kendiliğinden dönüşümünden oluşur. A Z X→ A Z +1 Y + 0 -1 β +ν Burada ν, antinötrino parçacığının tanımıdır. Bir nötronun bir protona intranükleer dönüşümü sonucu bir elektron oluşur. Gama radyasyonu elektromanyetik bir yapıya sahiptir ve dalga boyu λ≤10 -10 m olan bir fotondur. Bu tip radyasyon sadece -bozunmasına değil, aynı zamanda daha karmaşık nükleer reaksiyonlara da eşlik eder. madde ile etkileşim: Maddeden geçen yüklü bir parçacık, iyonlaşma sürüklemesi nedeniyle enerjisini kaybeder. Aynı zamanda, kinetik enerjisi ortamın atomlarının uyarılması ve iyonlaşması için harcanır.Yüklü bir parçacığın bir madde ile etkileşimini nicel olarak karakterize etmek için aşağıdaki miktarlar kullanılır: lineer iyonlaşma yoğunluğu, i, parçacığın birim yolu başına oluşan iyon çiftlerinin sayısı: i=dn/dl bir maddenin lineer durma gücü (S), birim yol başına yüklü bir parçacık tarafından kaybedilen enerjidir: S=dE/dl yüklü bir iyonlaştırıcı parçacığın (R) ortalama doğrusal aralığı, belirli bir maddede parçacık aralığının başlangıcı ve sonu arasındaki mesafedir. Çeşitli radyasyon türlerinin madde ile etkileşiminin karakteristik özellikleri: Alfa radyasyonu: Alfa parçacığı ortamda ilerledikçe önce I artar (hız azaldıkça ortamın molekülüne yakın geçirdiği süre artar dolayısıyla iyonlaşma olasılığı artar) ve çalışma sonunda (x = R) ) hareket hızındaki bir azalma ile ilişkili olarak keskin bir şekilde azalır. Parçacığın enerjisi iyonlaşma için gereken enerjiden daha az olduğunda iyon oluşumu durur. Ortamdaki alfa parçacığının geçtiği yola doğrusal iyonlaşma yoğunluğunun bağımlılığının grafiği: İyonizasyon ve uyarma birincil süreçlerdir. İkincil: moleküler termal hareketin hızında artış, karakteristik X-ışını radyasyonu, radyolüminesans, kimyasal süreçler. Beta radyasyonu. Bir ortamdaki elektronun hızı bu ortamdaki ışığın hızını aştığında iyonlaşma, uyarma, X-ışını radyasyonu (elektronlar yavaşladığında), karakteristik Cherenkov radyasyonuna neden olur. Gama radyasyonu, hafif bir birincil iyonizasyona, tutarlı ve tutarsız saçılmaya, iyonlaştırıcı bir fotoelektrik etkiye, elektron-pozitron çiftlerinin oluşumuna, bir kuantumun bir çekirdekle etkileşimi nedeniyle fotonükleer reaksiyonlara neden olur. Absorbe edilen doz (D)
-
ışınlanmış maddenin elementine aktarılan ∆E enerjisinin bu elementin m kütlesine oranına eşit bir değer: D=∆E /m. C'de, absorbe edilen dozun birimi gridir (Gy). 1 Gy, 1 J'lik iyonlaştırıcı radyasyon enerjisinin 1 kg ağırlığındaki ışınlanmış maddeye aktarıldığı radyasyon dozuna karşılık gelir.Sistemik olmayan birim 1rad=10 -2 Gy maruz kalma dozu radyasyon (X), ışınlanmış gövdeyi çevreleyen havadaki X-ışını ve γ-radyasyonunun iyonlaştırıcı etkisini karakterize eder. Maruz kalma dozunun SI birimi C/kg'dır. Maruz kalma dozunun SI birimi C/kg'dır. 1C/kg, 1 kg kuru havanın (n.c.) iyonlaşmasının bir sonucu olarak her işaretin 1C yüküne sahip iyonların oluştuğu foton radyasyonunun maruz kalma dozuna karşılık gelir. Maruz kalma doz hızı birimi 1A/kg'dır ve sistem dışı birim 1R/s'dir. Radyasyon dozu, gelen iyonlaştırıcı radyasyonla orantılı olduğundan, yayılan ve maruz kalma dozları arasında orantılı bir ilişki olmalıdır: D=fХ, burada f, ışınlanan madde ve foton enerjisine bağlı olarak belirli bir geçiş katsayısıdır. Eşdeğer doz - (N) iyonlaştırıcı radyasyonun biyolojik nesneler üzerindeki etkisini değerlendirmek için kullanılır; absorbe edilen radyasyon dozu ile aynı boyuta sahiptir, ancak adı farklıdır. SI'da: Sievert [Sv], 1Sv=1J/kg Sistem dışı birim: 1ber=10 -2 Sv. Maruz kalma ve emilen dozlar arasında bir ilişki vardır: H=KD, burada K kalite faktörüdür (bu tür radyasyonun biyolojik etkisinin etkinliğinin dokularda aynı doz radyasyonla foton radyasyonundan kaç kat daha büyük olduğunu gösterir). 9. doz oranı. Maruz kalma doz hızı ile radyoaktif bir preparatın aktivitesi arasındaki ilişki. Doz oranı nesnenin birim zamanda aldığı dozu belirleyen değerdir. Radyasyonun üniform bir etkisi ile, doz oranı N sayısal olarak D dozunun iyonlaştırıcı radyasyonun etki ettiği t zamanına oranına eşittir: N=D/t. Radyasyon doz hızı birimi gridir (Gy), bu 1J'lik iyonlaştırıcı radyasyon enerjisinin 1 kg ağırlığındaki ışınlanmış bir maddeye aktarıldığı radyasyon dozuna karşılık gelir; radyasyon doz hızı Gy/sn cinsinden ifade edilir. Radyasyon dozunun sistemik olmayan birimi rad (1 rad=10 -2 Gy=100erg/g), gücü rad/saniyedir. Radyasyonun maruz kalma dozu (X), ışınlanmış vücudu çevreleyen havada X-ışını ve y-radyasyonunun iyonlaştırıcı etkisini karakterize eder. Maruz kalma dozunun SI birimi C/kg'dır. 1C/kg, 1 kg kuru havanın (n.c.) iyonlaşmasının bir sonucu olarak her işaretin 1C yüküne sahip iyonların oluştuğu foton radyasyonunun maruz kalma dozuna karşılık gelir. Maruz kalma doz hızı birimi 1A/kg'dır ve sistem dışı birim 1R/s'dir. Radyasyon dozu, gelen iyonlaştırıcı radyasyonla orantılı olduğundan, yayılan ve maruz kalma dozları arasında orantılı bir ilişki olmalıdır: D=fХ, burada f, ışınlanan madde ve foton enerjisine bağlı olarak belirli bir geçiş katsayısıdır. Su ve insan yumuşak dokuları için f=1, bu nedenle, rad cinsinden radyasyon dozu, röntgenlerdeki karşılık gelen maruz kalma dozuna sayısal olarak eşittir. Maruz kalma doz hızı ile radyoaktif preparatın aktivitesi arasındaki ilişki: Kaynaktan, γ-fotonlar her yöne uçar. 1s'de belirli bir kürenin yüzeyinin 1 m 2'sine nüfuz eden bu fotonların sayısı, A aktivitesi ile orantılı ve kürenin yüzey alanı ile ters orantılıdır (4πr 2) / Maruz kalma doz hızı (X / t) V hacmi, iyonlaşmaya neden olan fotonların sayısına bağlıdır: X /t=k γ A/r 2 Burada k γ - verilen radyonüklid için tipik olan. 10. Radyoaktif bozunma yasası (sonuç). Hukuk çizelgesi. yapay radyoaktivite. Etiketli atom yöntemi, tıpta uygulama. radyoaktif bozunma istatistiksel bir olgudur. dN çekirdeğinin kısa bir zaman aralığında dt bozunmasına izin verin. Bu sayı, dt zaman aralığının yanı sıra toplam N radyoaktif çekirdek sayısıyla orantılıdır: dN=-λNdt, burada λ, farklı radyoaktif çekirdekler için farklı olan bir radyoaktif çekirdeğin bozunma olasılığı ile orantılı olan bozunma sabitidir t, zamanla azalır. Elde edilen ifadeyi entegre ediyoruz ve lnN/N 0 =-λt elde ediyoruz. N= N 0 e - λt . Bu, radyoaktif bozunmanın temel yasasıdır: eşit bir süre boyunca, başlangıçtaki çekirdek sayısının aynı kesri bozunur. İki madde için radyoaktif bozunma süreçleri λ1>λ2. Görev numarası 1.
Bir ışık okul mikroskobu altında bir bitki hücresinin hangi kısımları görülebilir?
1. Ribozomlar 2. Mitokondri 3. Hücre duvarı 4. Plazma zarı Açıklama: Hücrelerin büyük bölümleri ışık mikroskobu altında görülebilir. Sunulanlardan, böyle büyük bir organel hücre duvarıdır (oldukça kalındır) ve plazma zarının hücre duvarından görsel olarak (küçük bir artışla) izole edilmesi zordur. Doğru cevap 3'tür. Görev numarası 2.
12 nükleotitten oluşan bir DNA molekülünün bir parçası hakkında bilgi depolar.
1. Bir protein molekülünde 4 amino asit 2. Bir tRNA molekülünün 16 nükleotidi 3. 12 amino asit mRNA molekülü 4. 24 nükleotid rRNA molekülü Açıklama: Bir DNA molekülünün üç nükleotidi bir amino asidi kodlar (bu yapıya üçlü denir), yani bir protein molekülündeki 4 amino asit için DNA'nın 12 nükleotidi kodlanır. Doğru cevap 1'dir. Görev numarası 3.
Elektronların daha yüksek bir enerji seviyesine geçişi, moleküllerde ışık fazında gerçekleşir.
1. Klorofil 2. Su 3. Glikoz 4. Karbondioksit Açıklama: fotosentez sırasında, fotosentez sırasında biyokimyasal reaksiyonlar zincirinin başladığı pigmentten olduğu için, uyarılmış bir duruma giren klorofil molekülüdür. Doğru cevap 1'dir. Görev numarası 4.
Bir hayvanın bireysel gelişimi sırasında, bir zigottan çok hücreli bir organizma gelişir.
1. mayoz bölünme 2. Mitoz 3. Filogeni 4. Gametogenez Açıklama: bir zigot oluşumundan sonra, zigot tam olarak mitozla bölünmeye başlar (bu, somatik hücrelerin bölünmesi sürecidir), yani bir diploid hücreden iki diploid hücre oluşur: bir hücreden iki, ikiden 4, dörtten 8, vb. Doğru cevap 2'dir. Görev numarası 5.
Eşeysiz üremenin özelliği, yeni bir organizmanın gelişmesidir.
1. Erkek gamet 2. Döllenmemiş yumurta 3. Çift kromozomlu zigotlar 4. Çift kromozomlu somatik hücre Açıklama: aseksüel üreme, germ hücreleri ile ilişkili değildir, bu nedenle, sunulan cevap seçeneklerinden, aseksüel üreme ancak organizma çift kromozomlu somatik bir hücreden geliştiğinde mümkündür. Vejetatif üreme ile ebeveyn ile aynı olan bir yavru organizma elde edilir. Doğru cevap 4'tür. Görev numarası 6.
Genotipi bilinmeyen yuvarlak meyveli bir domates ile armut biçimli bir domates (çekinik özellik) çaprazlandığında, yavruların %50'sinin armut biçimli meyvelere sahip olduğu biliniyorsa üreme modelini belirleyin. 1. AA x aa 2. aa x aa 3. Aa x Aa 4. AA x AA Açıklama: Yavruların %50'si, yalnızca çekinik bir özellik - Aa x aa için bir heterozigot ile bir homozigot çaprazlanırsa armut biçimli meyvelere sahip olacaktır. Doğru cevap 2'dir. Görev numarası 7.
Mayoz bölünmede homolog kromozomların bağımsız olarak ayrılması, değişkenliğin nedenidir.
1. Genomik 2. Birleştirici 3. Kromozomal 4. Sitoplazmik Açıklama: birleştirici değişkenlik - ebeveyn genleri yeniden birleştirildiğinde ortaya çıkan değişkenlik. Sebepler aşağıdaki ihlaller olabilir: mayozun metafazında geçiş, mayozda kromozomların ayrılması, germ hücrelerinin füzyonu. Doğru cevap 2'dir. Görev numarası 8.
N.I. Vavilov, ekili bitkilerin özelliklerinin kalıtsal özelliklerini incelerken yasayı doğruladı 1. Kalıtsal değişkenlikte homolog seriler 2. Alelik olmayan genlerin bağımsız kalıtımı 3. Birinci nesil melezlerin hakimiyeti 4. Cinsiyete bağlı kalıtım Açıklama: N.I. Vavilov, homolojik seriler yasasını şu şekilde formüle etti: genotiplerinin (neredeyse aynı gen kümeleri) büyük benzerliği nedeniyle, yakından ilişkili türler benzer potansiyel kalıtsal değişkenliğe sahiptir (özdeş genlerin benzer mutasyonları); ortaya çıkan genotipik farklılıklar nedeniyle incelenen grupların (taksaların) evrimsel-filogenetik uzaklaştırılması olarak, kalıtsal değişkenliğin paralelliği daha az eksiksiz hale gelir. Sonuç olarak, kalıtsal değişkenlikteki paralelliklerin temeli, farklı taksonların temsilcilerindeki homolog genlerin ve genotip bölgelerinin mutasyonlarıdır, yani gerçekten homolog kalıtsal değişkenliktir. Bununla birlikte, aynı tür içinde bile, farklı genlerdeki mutasyonlar, görünüşte benzer karakterlere neden olabilir; çeşitli genlerin bu tür fenotipik paralel mutasyonları, elbette, farklı, ancak oldukça yakından ilişkili türlerde de meydana gelebilir. Doğru cevap 1'dir. Görev numarası 9.
Bakteri krallığı şunları içerir:
1. Klamidomonalar 2. E. koli 3. Infusoria-ayakkabı 4. Sıtma Plasmodium Açıklama: chlamydomonas, siliat terlik ve sıtma plasmodium protozoa ve Escherichia coli'dir ( Escherichia koli - bakteri. Doğru cevap 2'dir. Görev numarası 10.
Yumru, ampul
1. Toprak solunum organları 2. Değiştirilmiş sürgünler 3. Üretken organlar 4. İlkel sürgünler Açıklama: yumru ve ampul (örneğin, köksapın yanı sıra) değiştirilmiş sürgünlerdir. Doğru cevap 2'dir. Görev numarası 11.
Eğrelti otları, çiçekli bitkilerin aksine,
1. Anlaşmazlık 2. Kökler 3. Köksap 4. Tomurcuklanma Açıklama:çiçekli bitkiler tohumlarla, eğrelti otları ise sporlarla çoğalır. Doğru cevap 1'dir. Görev numarası 12.
Basit gözleri ve dört çift yürüyen bacağı olan eklembacaklıların sınıfı nedir?
1. Böcekler 2. Kafadanbacaklılar 3. Kabuklu deniz ürünleri 4. Araknidler Açıklama: resme bakın ve doğru cevabın 4 olduğu sonucuna varın. Görev numarası 13.
Yüksek metabolizma hızı kuşların
1. Yavrulara iyi bakın 2. Yuvalara yumurta bırakın 3. Bitkisel gıdalar tüketin 4. Uçuş sırasında çok fazla enerji harcayın Açıklama: yüksek metabolizma hızı uçmak için yapılan uyarlamalardan biridir, bu yüzden uçuş sırasında çok fazla enerji harcamayı seçiyoruz. Doğru cevap 4'tür. Görev numarası 14.
Bir kişi anemiden muzdaripse, kanında norm ile karşılaştırıldığında, içeriği
1. Lökositler 2. Kırmızı kan hücreleri 3. Trombositler 4. Fibrinojen Açıklama: anemi (başka bir isim - anemi), kırmızı kan hücrelerinin - eritrositler ve / veya hemoglobinin azaltılmış içeriğinde ifade edilir. Hastalığın belirtileri: baş dönmesi, artan yorgunluk, vb. hücrelere yetersiz oksijen verilmesinden kaynaklanır. Doğru cevap 2'dir. Görev numarası 15.
İnsan vücudundaki kompleks karbonhidratların birincil yıkımı,
1. Tükürük enziminin etkisi altında ağız boşluğu 2. Pepsin enziminin etkisi altındaki mide boşlukları 3. Glikojen depolayan karaciğer hücreleri 4. Hormon üreten pankreas hücreleri Açıklama: mide ve ağız boşluğunda üretilen bir enzim - amilaz, ağız boşluğundaki karmaşık karbonhidratların - polimerlerin parçalanmasına başlar. Doğru cevap 1'dir. Görev numarası 16.
İnsan kanındaki yabancı mikroorganizmaları yok etme işlevi şu şekilde gerçekleştirilir:
1. Nöronlar 2. Kırmızı kan hücreleri 3. Epitel hücreleri 4. Lenfositler Açıklama: lenfositler bağışıklık hücreleridir, yani insan kanındaki yabancı mikroorganizmalarla savaşırlar. Doğru cevap 4'tür. Görev numarası 17.
Alacakaranlık ışığının etkisi, insan görsel analizörü tarafından sinir uyarılarına dönüştürülür.
1. Göz merceği 2. İrisin öğrencisi 3. Retina çubukları 4. Göz küresinin sklera Açıklama: alacakaranlıkta ve karanlıkta ışık sinyallerini algılayan reseptörler retina çubuklarıdır. Onlardan sinyal merkezi sinir sistemine iletilir. Doğru cevap 3'tür. Görev numarası 18.
Kırık bir uzvun splintlenmesi
1. Kanamayı azaltır 2. Uzuv ödemini azaltır 3. Mikroorganizmaların kırık bölgesine girmesini önler 4. Kırık kemiklerin yer değiştirmesini önler Açıklama: kırık uzuv üzerine kemiklerin yer değiştirmesini önlemek için bir atel yerleştirilir. Doğru cevap 4'tür. Görev numarası 19.
Doğal seçilimin yaratıcı rolü şu şekilde kendini gösterir:
1. Tür içi mücadeleyi güçlendirmek 2. Yeni habitatların organizmalar tarafından geliştirilmesi 3. Yeni mutasyonların ortaya çıkması 4. Yeni türlerin ortaya çıkışı Açıklama: doğal seleksiyon evrimin itici güçlerinden biridir. Evrimin amacı, belirli koşullarda en uyumlu türleri yaratmaktır, bu nedenle doğal seçilimin yaratıcı rolü, yeni türlerin yaratılmasında da kendini gösterir. Doğru cevap 4'tür. Görev numarası 20.
Modern biyolojik bilimde, bir popülasyon olarak kabul edilir.
1. Bir krallığın organizmalarının toplamı 2. Besin zinciri oluşturan bireyler 3. Biyosenoz oluşturan farklı türlerin bireyleri 4. Aynı bölgede yaşayan aynı türün bireyleri Açıklama: popülasyon - aynı bölgede yaşayan ve özgürce iç içe geçen aynı türden bir grup birey. Doğru cevap 4'tür. Görev numarası 21.
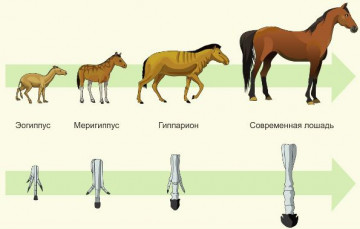
Atın filogenetik dizisi (yaklaşık)
1. Evrim sürecinin tersine çevrilebilirliği 2. Atasal formlara düzenli dönüş 3. Organizmaların postembriyonik gelişiminin benzerliği 4. Modern görünümün tarihsel gelişimi Açıklama: Atın filogenetik serisini düşünün. Resimden de anlaşılacağı gibi, bir türün filogenetik dizisi, onun tarihsel gelişim aşamalarının bir takibidir. Doğru cevap 4'tür. Görev numarası 22.
Aşağıdaki örneklerden hangisi organizmalar arasındaki rekabetçi ilişkiyi gösterir?
1. Sincap - ağaçkakan 2. Meşe - beyaz mantar 3. İnek - boğa tenyası 4. Zaten - bir kurbağa Görev numarası 23.
Uzun süreli biyotik ilişkilerin bir sonucu olarak, doğal biyosenozda yırtıcı-avcı gözlemlenir.
1. Avcı sayısında düzensiz artış 2. Her iki organizma grubunun bolluğundaki düzenli dalgalanma 3. Kurbanların gen havuzunda mutant alellerin birikmesi 4. Bir avcı popülasyonunda baskın özelliklerin tezahürü Açıklama: uzun süreli bir avcı-av ilişkisi ile bu iki türün sabit bir sayısı korunur, ancak çevre koşullarındaki değişiklikler nedeniyle popülasyon dalgaları oluşur ve bu sistemin sabitliği ile kademeli olarak sönerler (yani böyle bir sistem oldukça kararlı). Doğru cevap 2'dir. Görev numarası 24.
Biyosferdeki canlı madde sayesinde maddelerin dolaşımı
1. Aç 2. Çok sayıda kimyasal element içerir 3. Dünyadaki agrocenozların çeşitliliğini arttırır 4. Atmosferde asal gazların birikmesini sağlar Açıklama: canlı organizmalar (ve özellikle mikroorganizmalar) sayesinde, doğada karbon, hidrojen, oksijen, kükürt ve diğerleri gibi birçok elementin (ve karmaşık maddelerin - karbondioksit, su) döngüleri vardır. diğerleri ve hatta demir. Doğru cevap 2'dir. Görev numarası 25.
Doğal seçilimin biçimleriyle ilgili aşağıdaki ifadeler doğru mu?
A. Stabilize edici seçim, popülasyonun cinsiyet bileşiminde ani bir değişiklik koşullarında kendini gösterir.
B. Sürüş seçimi, özelliğin ortalama değerine sahip bireylerin sayısındaki artışa katkıda bulunur.
1. Sadece A doğrudur 2. Sadece B doğrudur 3. Her iki yargı da doğru 4. Her iki yargı da yanlış Açıklama: stabilize edici seçim, yalnızca sabit çevresel koşullar altında çalışır ve A - yanlış özelliğinin ortalama değerine sahip bireyleri korur. Sürüş seçimi, özelliğin ortalama değerinden sapan bireyleri korur, B - yanlış. Doğru cevap 4'tür. Görev numarası 26.
spermatogenez sırasında
1. Erkek cinsiyet hücreleri oluşur 2. Somatik hücreler oluşur 3. Kromozom sayısını yarıya indirmek 4. Dört gamet oluşur 5. Bir yumurta oluşur 6. Diploid kromozom setine sahip hücreler oluşur Açıklama: spermatogenez - erkek germ hücrelerinin oluşum süreci, öncü (diploid) hücreden dört haploid germ hücresi oluşur (yani kromozom seti yarıya iner). Doğru cevap 1, 3, 4'tür. Görev numarası 27.
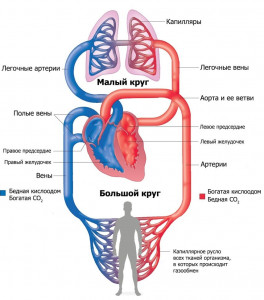
İnsan vücudundaki sistemik dolaşım
1. Sol ventrikülde başlar 2. Sağ karıncıktan kaynaklanır 3. Akciğerlerin alveollerinde oksijenle doymuş 4. Organları ve dokuları oksijen ve besinlerle besler 5. Sağ atriyumda biter 6. Kalbin sol tarafına kan getirir Açıklama: Sistemik dolaşımı düşünün. Şekilden de anlaşılacağı gibi, sol karıncıktan büyük bir daire çıkar ve kanı (oksijen, hormonlar vb.) vücudun tüm hücrelerine, karbondioksit ise onu hücrelerden alıp kalbe geri taşır, yani, sağ atriyuma. Doğru cevap 1, 4, 5'tir. Görev numarası 28.
Doğada yeni türlerin oluşumuna yol açan süreçler şunları içerir:
1. Mitotik hücre bölünmesi 2. Sıçrama benzeri mutasyon süreci 3. Değişiklik değişkenliği 4. Coğrafi izolasyon 5. Bireylerin eşeysiz üremesi 6. Doğal seçilim Açıklama:çeşitli mutasyonlar yeni türlerin oluşumuna yol açar (bundan önce popülasyon boyunca birikimleri ve dağılımları gelir), coğrafi izolasyon (yeni bir türün ortaya çıkabileceği diğer popülasyonların bireyleri ile üreme yokluğunda) ve doğal seleksiyon bir En adapte olanın bir organizmada hayatta kaldığı ve ardından belirli çevresel koşullara maksimum derecede adapte olan bir türün oluştuğu yönlendirilmiş süreç. Doğru cevap 2, 4, 6'dır. Görev numarası 29.
Ototrofik beslenmenin özellikleri ile türü arasında bir yazışma kurun.
Ototrof beslenmenin karakteristik türü A. Oksidasyon enerjisi kullanılır 1. Fotosentez inorganik maddeler 2. Kemosentez B. Enerji kaynağı - güneş ışığı B. Bitki hücrelerinde gerçekleştirilir D. Amonyağın oksidasyonu meydana gelir D. Oksijen atmosfere salınır Açıklama: fotosentez, güneş enerjisini fototroflar tarafından gerçekleştirilen kimyasal bağların enerjisine dönüştürme işlemidir. Kemosentez, kimyasal bileşiklerin oksidasyon enerjisini kullanarak inorganik maddeleri organik maddelere dönüştürme işlemidir. Bu nedenle fotosentez şu anlama gelir: enerji kaynağı güneş ışığıdır, süreç bitki hücrelerinde gerçekleşir ve oksijenin atmosfere salınması. Kalan iki hüküm kemosenteze atıfta bulunur. Doğru cevap 21121'dir. Görev numarası 30.
Karakteristik ve organizma krallığı arasında bir yazışma kurun.
Organizmaların karakteristik krallığı A. Hücre duvarı kitin içerir 1. Mantarlar B. Beslenme türü ototrofik 2. Bitkiler B. İnorganik maddelerden organik maddeler oluşturun D. Yedek besin nişastadır. D. Doğal sistemlerde ayrıştırıcıdırlar E. Vücut miselyumdan oluşur Açıklama: mantarların hücre duvarının bileşimi kitin içerir, bunlar heterotroflardır (yani hazır organik maddeler tüketirler) ve ayrıştırıcılardır (organik maddeleri inorganik olanlara ayrıştırır), vücutları miselyumdan oluşur. Bitkiler ototroftur (inorganik maddelerden organik maddeler oluştururlar, nişasta rezerv maddedir. Doğru cevap 122211'dir. Görev numarası 31.
İnsan vücudundaki fonksiyonların düzenlenmesinin işareti ile mekanizması arasında bir yazışma kurun.
İşaret Mekanizması düzenleme A. Endokrin sistem tarafından gerçekleştirilir 1. Sinir B. Hormonlar yayılır 2. Humoral B. Kan yoluyla organlara taşınır D. Maruz kalma hızı çok yüksek D. Biyoelektrik olaylara dayalı Açıklama: sinir düzenlemesi - sinir sisteminin yardımıyla düzenleme, yani sinir hücrelerinin süreçleri boyunca (elektriksel uyarıların yardımıyla) gerçekleştirilir, bu düzenlemenin hızı çok yüksektir. Hümoral (hormonal) düzenleme - biyolojik olarak aktif maddeler yardımıyla düzenleme - kan yoluyla organlara verilen ve endokrin sistemin bezleri tarafından üretilen hormonlar. Doğru cevap 22211'dir. Görev numarası 32.
Organizmaların türü ile onun özelliği olan evrimin yönü arasında bir yazışma kurun.
Tür Evrimin yönü A. Gri sıçan 1. Biyolojik ilerleme B. Kar leoparı 2. Biyolojik gerileme B. Amur kaplanı G. Sürünen buğday çimi D. Przewalski'nin atı E. ortak karahindiba Açıklama: biyolojik ilerleme - sayıların artması, aralığın genişlemesi ve tür içi değişkenliğin eşlik ettiği bireylerin uygunluğunda bir artış. Biyolojik gerileme - sayılarda bir azalma, menzilde bir azalma ve türlerin daha fazla neslinin tükenmesi ile birlikte bireylerin uygunluğunda bir azalma. Sayılardaki azalma, kar leoparı, Amur kaplanı ve Przewalski atı için tipiktir. Doğru cevap 122121'dir. Görev numarası 33.
Coğrafi türleşme süreçlerinin sırasını belirtin.
1. Bir özelliğin popülasyondaki dağılımı 2. Yeni yaşam koşullarında mutasyonların ortaya çıkışı 3. Popülasyonların mekansal izolasyonu 4. Yararlı modifikasyonlara sahip bireylerin seçimi 5. Yeni bir türün oluşumu Açıklama: türleşme izolasyonla başlar, bu koşullar altında, aralarında sadece yararlı olanların seçildiği mutasyonlar ortaya çıkmaya başlar, daha sonra bu faydalı mutasyonlar popülasyondaki tüm bireyler arasında yayılır. Mantıklı olan coğrafi türleşme, yeni bir türün oluşumuyla sona erer. Doğru cevap 32415'tir. Görev numarası 34.
Maya mantarlarının ekmek ve unlu mamüllerin yapımında kullanılmasının amacı nedir? Hangi süreç gerçekleşir? Açıklama: ekmek pişirirken maya kullanılır, çünkü maya fermantasyonu (oksijensiz solunum) gerçekleştirerek, hamurun kabarmasına yardımcı olan (hamurda kabarcıklar oluşur) karbondioksit açığa çıkarır, bu da daha sonra hamura ihtişam verir. Görev numarası 35.
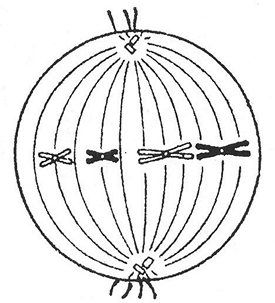
Şekilde hangi bölüm ve hangi aşama gösterilmektedir? Bu periyotta kromozom setini (n), DNA molekül(ler)inin sayısını belirtiniz. Cevabı gerekçelendirin. Açıklama:şekilde, homolog kromozom çiftleri hücrenin ekvatorunda sıralanmıştır ve ayrılmaya hazırdır (yani, bu, anafaz 1'den önceki dönemdir ve anafaz 1'den önce, metafaz 1'dir. Bu, diploidin ayarlandığı anlamına gelir. hücre 2n'dir (kromozom çiftlerini gördüğümüz için) ve DNA moleküllerinin sayısı - 4c, çünkü her kromozom iki kromatitten (yani iki DNA molekülünden) oluşur. Görev numarası 36.
Verilen metindeki hataları bulun. Hata yapılan cümle sayısını belirtin, düzeltin.
1. Mitokondri ve plastidler iki zarlı organellerdir. 2. Işığa duyarlı pigmentler, mitokondri ve plastidlerin iç zarında bulunur. 3. Plastidlerin aksine, mitokondri kendi dairesel nükleik asit moleküllerini içerir. 4. Fotosentez süreci kloroplastlarda gerçekleşir. 5. Mitokondrinin ana işlevi, hücre lipidlerinin sentezidir. Açıklama: 2 - Mitokondri zarında pigment yoktur (fotosentez işlemini gerçekleştirmedikleri için). 3-plastidler ayrıca kendi nükleik asitlerini de içerirler. 5 - mitokondrinin ana işlevi, lipidlerin değil ATP'nin (evrensel enerji molekülü) sentezidir. Görev numarası 37.
İnsan vücudunda mide suyunun ayrılmasının nörohumoral regülasyonu nasıldır? Cevabı açıklayın. Açıklama: sinir regülasyonu iki şekilde gerçekleştirilir: 1. Koşullu reflekslerin yardımıyla: bir limon (veya genel olarak yiyecek) veya ağızda tencere sesi görüldüğünde tükürük, yani vücut salınmaya başlar. enzimler salgılayarak yemek yemeye hazırlanır. 2. Ağız boşluğu ve mide reseptörlerinin tahrişi ile, yani koşulsuz reflekslerin yardımıyla. Humoral düzenleme, yalnızca besinler emilim sırasında kana girdiğinde gerçekleştirilir. Hormonlar salgılanmaya ve vücuttaki hücrelere taşınmaya başlar. Görev numarası 38.
Metinde hangi tür kriterlerinin belirtildiğini belirtin.
Çevik kertenkele türlerinin tüm bireyleri aynı karyotipe sahiptir. Hızlı kertenkelenin erkeklerde vücut rengi yeşil, dişilerde ise kahverengidir. Bu hayvanlar, dünyanın tropikal ve subtropikal bölgelerinde en çoktur. Açıklama: karyotipin tanımı - genetik kriter. Vücut renginin tanımı (ve dişiler ile erkekler arasındaki farklılıklar) morfolojik bir kriterdir. Türlerin aralığının tanımı coğrafi bir kriterdir. Görev numarası 39.
Antikodonlar CCA, GUU ve GAA'ya sahip tRNA'lar, protein sentezinde art arda yer aldı. DNA ve mRNA moleküllerinin bileşimini belirleyin. Açıklama: Moleküllerin bileşimini ters sırada yazmaya başlayalım, yani önce tRNA, sonra mRNA ve son olarak DNA. tRNA: CCA GUU GAA mRNA: GGU CAA CUU DNA: CCA GTT GAA Görev numarası 40.
Tepeli (A) yeşil (B) dişi için bir analiz çaprazı yapıldı, yavrularda dört fenotipik sınıf elde edildi. Ortaya çıkan tepeli yavrular kendi aralarında geçti. Bu geçişte arması olmayan yavru almak mümkün müdür? Eğer öyleyse, hangi cinsiyet olacak, hangi fenotip? Kanaryalarda, bir tepenin varlığı otozomal bir gene bağlıdır, tüylerin rengi (yeşil veya kahverengi), X kromozomuna bağlı bir gene bağlıdır. Kuşlarda heterogametik cinsiyet dişidir. Açıklama:
İlk çapraz: R: AaHVU x aaHvHv G: AHV, AHV, AU, AU X AHV F1: АаХВХв - tepeli yeşil erkek ааХВХв - tepesiz yeşil erkek AaHvU - tepeli kahverengi dişi Bir erkek ve bir dişiyi tepeli olarak geçiyoruz: R: AaHVHv x AaHvU G: AHV, AHV, AHV, AHV x AHV, AU, AHV, AU F2: Aralarında sadece 4 fenotipin ayırt edilebildiği 16 genotip elde ederiz. Tepesi olmayan bireylerin fenotipleri: Dişiler: ааХВУ - tepesiz yeşil dişi ааХвУ - tepesiz kahverengi dişi Erkekler: ааХВХв - tepesiz yeşil erkek ааХвХв - tepesiz kahverengi erkek. Bir maddenin molekülü uyarılmamış durumdaysa, elektronlar en düşük enerji seviyesinde bulunur. Bu durumda, molekülün elektron kabuğu singlet durumundadır, yani tüm elektronların eşleştiği ve toplam spin momentinin sıfıra eşit olduğu bir durumda. Bu duruma zemin singlet durumu, elektronların bu sırada bulunduğu seviyeye ise zemin enerji seviyesi denir. S 0 olarak gösterelim (Şekil 1). Bir tirozin molekülündeki elektronik geçişler örneğini kullanarak moleküllerdeki elektronik geçişleri ele alalım. Moleküller ışık kuantumunu emerse, moleküllerin dış kabuklarının elektronları daha yüksek bir enerji seviyesine S 2 * geçer (Şekil 1'deki geçiş 1). Bu durumda, molekül uyarılmasına rağmen elektron kabukları tekli halde kalır. Soğurulan kuantumun enerjisinin değeri, elektron geçişinin gerçekleştiği iki enerji seviyesi arasındaki farka eşittir: hv emilimi \u003d E 2 - E 0 (8) Böylece, bir elektronun ana singlet seviyesinden uyarılmış singlet seviyesine geçişi, kısaca yazılan ışığın absorpsiyonuna karşılık gelecektir: S 0 -> S * Bir molekül farklı bir dalga boyundaki ışığı soğurabiliyorsa, elektron artık S2* düzeyine değil, soğurulan kuantumun enerjisine karşılık gelen başka bir düzeye gidecektir. Bu kuantumun enerjisi daha az ise, enerji seviyesi S 2 *'nin altında yer alacaktır (Şekil 1'de, bu S 1 * seviyesi ve geçiş 2'dir). Bir molekül, bu tür birkaç uyarılmış singlet seviyesine sahip olabilir. Absorpsiyon spektrumundaki her biri, maksimum optik yoğunluğuna karşılık gelecektir. Şek. 1, molekülün sadece elektronik seviyelerini gösterir ve titreşimsel ve rotasyonel alt seviyeleri göstermez. Moleküller sadece elektronik seviyelere sahip olsaydı, o zaman enerji geçişlerinin sayısı sınırlı olurdu ve moleküler spektrumlar bir çizgi karakterine sahip olurdu ve maddeler yüksek bir absorpsiyon seçiciliğine sahip olurdu. Aslında, elektronik seviyelerin titreşimsel ve rotasyonel alt seviyelere ayrılmasından dolayı, moleküllerin enerji geçişlerinin sayısı önemli ölçüde artar ve moleküler spektrumlar süreklidir. Bu durumda, absorpsiyon spektrumundaki en olası elektronik geçişler maksimuma karşılık gelir. Ayrıca, moleküllerin farklı moleküller için doğası farklı olan bir çözücü ile etkileşimi, moleküllerin sürekli spektrumlarının ortaya çıkmasında büyük önem taşır. Moleküller uzun süre heyecanlı durumda kalamazlar; genellikle molekülün uyarılmış durumda olduğu sürenin süresi 10 -8 saniyeyi geçmez. Uyarılmış bir molekülün elektronik enerjisi birkaç işlemin sonucu olarak harcanabilir: başka bir moleküle aktarılabilir - enerji göçü; molekülün titreşimsel (termal) enerjisini arttırmak için kullanılabilir. Bütün bu durumlarda, elektron ya zemin enerji seviyesine S 0 döner ya da verilen uyarılmış seviyenin altında kalan bir seviyeye gider. Şek. Şekil 1, enerjinin ısıya dönüşmesinin eşlik ettiği elektronik ışınımsız geçişleri tasvir etmektedir. Yukarıda belirtilen işlemlere ek olarak, uyarılmamış bir duruma geçişlerine eşlik eden moleküllerin lüminesansı meydana gelebilir. Elektronlar daha sonra zemin enerji seviyesine geri döner. Elektronların uyarılmış seviyelerden zemin seviyesine geçişine eşlik eden moleküllerin lüminesans sürecine lüminesans denir. Lüminesans iki türe ayrılır: floresan ve fosforesans (son parıltı). Elektronların uyarılmış seviyelerden zemin seviyesine geçişi her zaman elektronların üst uyarılmış seviyelerden en düşük uyarılmış seviyeye geçişi ile başlar. bunlar geçişler Bu durumda kuantum yayılmaz ve molekülün elektronik enerjisi ısıya dönüştürülür. Bu enerji israfı süreci çok hızlı gerçekleşir - 10 -13 - 10 -12 s. Elektron geçişinin bir sonraki aşaması, daha düşük uyarılmış seviyeden S 0 * zemin seviyesine S 0 geçiştir. Bu durumda, bir lüminesans kuantumu yayılacaktır. Işığın absorpsiyonu sırasında depolanan enerjinin bir kısmı ısıya harcandığından, lüminesans kuantumunun enerjisi her zaman absorbe edilen kuantumun enerjisinden daha az olacaktır. Isıda harcanan enerji E ısı miktarına göre daha az olacaktır: hv lum = hv absorbe - E ısı (9) Bu nedenle, yayılan ışık, emilen ışıktan daha düşük bir frekansa ve daha uzun dalga boyuna sahip olacaktır. Bu ilişkiye Stokes yasası denir: lüminesans sırasında yayılan ışığın dalga boyu her zaman buna neden olan ışığın dalga boyundan daha büyüktür: λ lum > λ pre. Bu model, termodinamiğin ikinci yasasının bir yansımasıdır; buna göre, enerjinin bir biçimden diğerine geçişine, enerjinin ısıya dağılması eşlik eder. Lüminesans yoğunluğu, özel bir kavram olan kuantum verimi kullanılarak tahmin edilir. Lüminesans kuantum verimi φ, ışıldama kuantum sayısının soğurulan nicelik N sayısına oranı olarak anlaşılır: Lüminesans, elektronların alt uyarılmış seviyeden zemin seviyesine geçişi sırasında her zaman gözlendiğinden, lüminesans yoğunluğu, kuantumun absorpsiyonu sırasında elektronun daha önce atıldığı seviyeye bağlı olmayacaktır. Bu hüküm Vavilov yasası olarak adlandırılır: lüminesansın kuantum verimi (olasılığı), lüminesansa neden olan ışığın dalga boyuna bağlı değildir.. Bir elektronun alt uyarılmış singlet seviyesinden zemine S 0 * -> S 0 geçişi sırasında gözlenen lüminesansa floresans denir. Moleküllerin uyarılmış haldeki ömrü 10 -9 - 10 -8 s olduğundan, floresan sadece doğrudan nesnenin aydınlatılması sırasında gözlenir. Bununla birlikte, birçok maddenin (özellikle düşük sıcaklıklarda) ışık kapatıldıktan sonra bile yoğun bir şekilde parlamaya devam ettiği uzun zamandır keşfedilmiştir. Bu ışıma, elektronların sözde üçlü seviyeden geçişinden kaynaklanmaktadır. İki eşleşmemiş elektronun bulunduğu elektron kabuklarının üçlü durumundan daha önce bahsetmiştik. Üçlü seviyesi (Şekil 1'deki T), alt uyarılmış tekli seviyesinin S 0 * biraz altında bulunur. Üçlü seviye yasaktır - bir elektron zemin seviyesinden buraya gelemez (S 0 -> T geçişleri olası değildir). Bir elektron, uyarılmış bir singlet seviyesinden triplet seviyesine girebilir; o zaman tüm yolu S 0 -> S * -> T olacaktır. Elektron, enerjinin bir kısmını ısıya harcar ve alt uyarılmış singlet seviyesinden triplet seviyesine geçer. Bu geçiş sırasında, elektronun dönüşü tersine çevrilir, bunun sonucunda iki elektron eşleşmez ve molekül çift yönlü hale gelir. Üçlü durumdaki bir molekülün ömrü 10 -3 s ile birkaç saniye arasında değişir. Üçlü halde molekülün iki eşleşmemiş elektronu olduğundan, kimyasal aktivitesi yüksektir ve molekülün içine girebilir. kimyasal etkileşim. Ek olarak, bir elektron triplet seviyesinden zemin seviyesine hareket edebilir ve bu durumda açığa çıkan enerji ya ısıya dağılır ya da bir lüminesans kuantumu şeklinde yayılır. Elektronların triplet seviyesinden zemin seviyesine T -> S 0 (Şekil 1'deki geçiş 4) geçişine eşlik eden lüminesansa fosforesans denir. Triplet seviyesi uyarılmış singlet seviyesinin altında olduğundan, fosforesans sırasında yayılan ışığın dalga boyu, floresan sırasında yayılandan daha uzundur. Lüminesans sırasında yayılan ışığın dalga boyu bir eksen boyunca çizilirse ve ışıldama yoğunluğu diğer eksen boyunca çizilirse, o zaman ışıldama spektrumunun eğrisini elde ederiz. Lüminesans spektrumları, floresan spektrumları ve fosforesans spektrumlarına ayrılır. Şek. 1a, tirozinin absorpsiyon ve lüminesans spektrumlarını gösterir. S 0 Seviyesi - tirozin molekülünün ana singlet seviyesi - şartlı olarak sıfıra eşit bir enerjiye sahiptir. Daha sonra, ışığın emilmesi üzerine bir elektron S 0 -> S 2 * geçişi, 5,7 eV (elektron volt) bir enerji gerektirir. Bu geçiş, 217 nm dalga boyunda absorpsiyon spektrumunda bir maksimuma karşılık gelecektir. Bir kuantum S 0 -> S 1 * 'nin absorpsiyonu sırasında başka bir elektronik geçiş 4,5 eV'lik bir enerji depolamasına karşılık gelir ve absorpsiyon spektrumunda λ = 275 nm'de bir maksimuma karşılık gelir. Floresans, bir elektron alt uyarılmış singlet seviyesinden zemin seviyesine döndüğünde meydana gelir. Bu durumda, yayılan kuantum 4.1 eV'lik bir enerjiye sahiptir. Bu enerji, emilen fotonların enerjisinden (5,7 ve 4,5 eV) daha azdır. Bu geçiş, λ = 304 nm'de floresan spektrumunda bir maksimuma karşılık gelir. Floresans sırasında yayılan ışığın dalga boyu, soğurulan ışığın dalga boyundan daha uzun olduğu için, floresan tayfı, soğurma tayfına göre dalga boyu ölçeğinde sağa kaydırılır. Fosforesans, T -> S 0 geçişine karşılık gelir. Bu durumda, 3,2 eV enerjili bir kuantum yayılır. Fosforesans spektrumundaki bu geçiş, λ = 387 nm'de bir maksimuma karşılık gelir. Fosforesans spektrumu, dalga boyu ölçeğinde flüoresans spektrumundan daha fazla sağa kaydırılır. Lüminesans spektrumları, absorpsiyon spektrumları gibi, spektrofotometreler kullanılarak elde edilir. Bu spektrofotometreler, yukarıda tartışılanlardan biraz farklı bir tasarıma sahiptir. Özellikle, bir dizi ışık filtresi içerirler. Lüminesans verilerine dayanarak, bir molekülde depolanan enerji kuantumunun büyüklüğü yargılanabilir. Soğurulan enerji niceliğine ilişkin verilerle birlikte bu, molekülün enerji seviyelerinin konumunun hesaplanmasını mümkün kılar. Lüminesans yöntemine dayanarak, uyarılmış bir durumdaki moleküllerin ömrü, ışıldamanın ortaya çıkma ve kaybolma hızına göre yargılanabilir. Lüminesansın yoğunluğuna dayanarak, bir molekül tarafından enerji israfı süreçleri hakkında sonuçlar çıkarılabilir. Son olarak, lüminesan yöntemi yardımıyla maddenin durumunu araştırmak çok uygundur; hafif değişimi bile (toplanma, kompleks oluşumu, pH değişimi vb.) ışıldama özelliklerini etkiler. Spektrum tarafından verilen bilgilerin yorumlanması, atom teorisi kullanılarak gerçekleştirilir. Bu nedenle, atomların bazı özelliklerini ve radyasyonlarını kısaca hatırlıyoruz. Bir atom, elektrostatik çekim ile bir arada tutulan bir çekirdek ve elektron sistemidir. Bir atomun enerjisi (daha doğrusu elektron kabuğu) yalnızca belirli değerlere sahip olabilir. şartlar, veya seviyeler. En düşük enerji durumu denir ana, geri kalan - heyecanlı. Hidrojen atomunun enerji seviyelerinin şeması, Şek. 4, her çizgi bir seviyeyi temsil eder (alttaki ana çizgiyi temsil eder). Seviyelerin temel duruma olan uzaklıkları, temel durumun enerjisinden ölçülen atomun enerjisiyle orantılıdır. Bir atom bir halden diğerine geçerek enerjisini değiştirebilir. Bu genellikle en dıştaki elektronun hareketindeki bir değişiklikten kaynaklanır. baştan geçişler yüksek seviyeler daha düşük olanlara, dış etki olmadan kendiliğinden meydana gelebilir ve enerjideki fark, ışık radyasyonunun bir "kısmı" ile yayılır. kuantum. Yayılan ışığın frekansı kuantum enerjisiyle orantılıdır. Kesin olarak tanımlanmış enerji değişiklikleri farklı geçişlere karşılık geldiğinden, atom spektrumda bireysel çizgilere yol açan yalnızca belirli frekansların kuantalarını yayar. "Yukarı", yani alt seviyelerden üst seviyelere geçişler kendiliğinden gerçekleşemez; bunların uygulanması harici bir enerji kaynağı gerektirir (örneğin, uygun frekansın kuantası). Böyle bir sürece denir Devralmak. Bir atomun enerji seviyelerinin sayısı sonsuzdur; elektronun atomdan tamamen ayrıldığı enerjiye karşılık gelen bir sınıra kadar yoğunlaşırlar. Tüm üst düzeylerden belirli bir düzeye geçişler sırasında oluşan çizgiler kümesine denir. spektral seri. Yani hidrojen, birinci seviyeye geçişlere karşılık gelen bir Lyman serisine, ikinci seviyeye geçişler sırasında oluşan bir Balmer serisine vb. sahiptir. Birinci seviye diğerlerinden çok uzak olduğu için, ona geçişlere büyük bir enerji değişimi eşlik eder. , ve Lyman serisinin kuantası uzak ultraviyole bölgesinde yer alır. Örneğin, ikinci seviyeden birinciye geçiş sırasında oluşan L a çizgisi 1216Â 1 dalga boyuna sahipken, spektrumun mor kısmı yaklaşık 4000 A dalga boyuna karşılık gelir. Balmer serisinin çizgileri - H α (6563 Å), H β (4861 Å) ve diğerleri, spektrumun görünür kısmında yer alır. Hidrojen serisinin geri kalanı kızılötesi bölgede bulunur. Diğer elementlerin enerji seviyeleri daha karmaşıktır. Bunları temsil etmek için, Şekil 1'deki gibi birden fazla sütun çizmeniz gerekir. 4, ancak ortak bir üst sınır ile birkaç. 1 (Å (angstrom) - spektroskopide 10 -8 cm'ye eşit dalga boylarının ölçüm birimi.) Çoğu atomda, enerji seviyeleri birbirine yakın birkaç parçaya bölünür. alt düzeyler. Bu nedenle, çizgiler genellikle iki veya üç veya daha fazla bileşenden oluşur, bunun sonucunda bunlara çiftler, üçlüler vb. denir veya genel olarak - çoklu. Tek satırlar denir atletler. Karmaşık atomlarda seviye bölünmesi çok güçlü olabilir. Hidrojen atomunun seviyeleri de iki alt seviyeden oluşur, ancak enerjileri pratik olarak aynıdır. Herhangi bir elementin atomunun tayfı ve seviye şeması karşılaştırıldığında, gözlemlenen çizgilerin tüm geçişlere karşılık gelmediği görülebilir; bazı geçişler hiç olmuyor. Bu tür geçişlere denir yasak. İzin verilmiş geçişler, enerji seviyeleri arasında kesin olarak tanımlanmış ilişkilere karşılık gelir. seçim kuralları. Seçim kurallarını ihlal eden geçişlerin kesinlikle yasaklanmadığına dikkat edilmelidir: belirli koşullar altında ilgili satırlar yine de gözlemlenebilir. Yasaklığın "derecesi" en iyi, bir atomun kendiliğinden belirli bir geçiş yapabilene kadar geçmesi gereken ortalama süre ile karakterize edilir.İzin verilen bir geçiş için bu süre genellikle 10 -7 - 10 -8 saniyedir. yasak bir geçiş yapmak için, atomun çok daha uzun süre üst durumda olması gerekir - inhibisyon derecesine bağlı olarak 10 -3 saniyeden birkaç gün veya daha fazlasına kadar.Belirli bir seviyeden izin verilen "aşağı" geçişler yoksa, o zaman atom belirli koşullar altında nispeten uzun bir süre orada kalabilir.Bu tür seviyelere denir. yarı kararlı. Çoğu element ve iyonları için zemin seviyesine yakın düşük seviyeler yarı kararlıdır. Yasak çizgiler genellikle köşeli parantez içindeki eleman sembolü ile gösterilir ve iyonlaşma derecesini gösteren bir Romen rakamı ile gösterilir. Örneğin, [OH] yasaklanmış iyonize oksijen çizgisi, a - çift iyonize oksijenin yasak çizgisi anlamına gelir. İzin verilen satırlarda köşeli parantez yoktur. Bir atomun kuantum yayması için uyarılmış seviyelerden birinde olması gerekir, yani söz konusu seviyenin enerjileri ile ilk seviye arasındaki farka karşılık gelen bir enerji verilmelidir. Bu enerji, bir atoma bir kuantum emdiğinde veya başka bir parçacıkla, özellikle bir elektronla çarpıştığında verilebilir. Bu durumda elektronun enerjisi, karşılık gelen geçişin enerjisinden daha büyük olmalıdır. Ortalama parçacık enerjisi ile orantılıdır mutlak sıcaklık gaz. Ancak ortalama enerji uyarılma için yetersiz olsa bile, gazda her zaman gerekli enerjiye sahip elektronlar bulunur, ancak sayıları artan enerji ile hızla azalır. Bu nedenle, enerjisi ortalama enerjiden belirgin şekilde yüksek olan bir seviyenin uyarılma sayısı nispeten küçük olacaktır 1 . 1 (Uyarma frekansı, yalnızca enerjisi uyarma eşiğinden daha büyük olan elektronların sayısına değil, aynı zamanda atomun özelliklerine, daha kesin olarak, atomun belirli bir seviyesinin hızlı bir elektron tarafından uyarılma olasılığına da bağlıdır.) Bir iyonun veya nötr bir atomun etkisi de atomu uyarılmış bir duruma aktarabilir, ancak bunun için iyonun enerjisi, seviyenin enerjisinden yüzlerce veya binlerce kez daha büyük olmalıdır, çünkü ağır bir parçacık her zaman yalnızca bir enerjisinin çok küçük bir kısmını bir atomun hafif elektronuna dönüştürür. Bu nedenle, seviye enerjisinin istisnai olarak küçük olduğu durumlar dışında, astrofizik koşullar altında ağır parçacıklar tarafından uyarım genellikle önemli değildir. Bir elektron uyarılmış bir atomla çarpışırsa, ikincisi enerjisini ona aktarabilir. Daha sonra atom bir kuantum yaymadan daha düşük bir duruma geçecek ve çarpışan elektron artan enerjiyle sıçrayacaktır. Böyle bir sürece denir ikinci tür darbe, bir çarpışma sırasında bir atomun uyarılma sürecinin aksine ( birinci tür hitler). İkinci türden etkiler, atomların çarpışmaları arasındaki zaman aralığının, uyarılmış bir durumdaki bir atomun ömründen daha kısa olduğu yoğun gazlarda esastır. Bu durumda, atomlar ışımaya vakit bulamadan çarpışırlar, böylece ikinci türden darbeler ışımayı önemli ölçüde azaltır. "Aşağı" geçişlere izin verilmeyen ve dolayısıyla atomun çok daha uzun süre kaldığı yarı kararlı seviyeler için, ikinci türden etkiler düşük yoğunlukta da önemli olabilir. Bu nedenle laboratuvarda yasak geçişlere karşılık gelen çizgileri gözlemlemiyoruz: Uyarım genellikle radyasyonla değil, ikinci dereceden bir darbe ile sona eriyor. Çok nadir bir gazda, çarpışmalar arasındaki aralık, yaşam süresi ile karşılaştırılabilir hale gelebilir. yarı kararlı durum, ve yasak satırlar görünecektir. Aşağıda görüleceği gibi, bulutsularda gerçekleşen bu koşullardır. Bir elektron, terimlerin sınırından daha fazla enerji alırsa, atomdan kopacaktır. Böyle bir sürece denir iyonlaşma. Bir atomun iyonlaşması, hem bir kuantum emildiğinde hem de hızlı bir elektronla çarpıştığında meydana gelebilir. Bir atoma bağlı olmayan bir serbest elektron herhangi bir enerjiye sahip olabilir. Bu nedenle, yalnızca belirli bir frekanstaki kuantaların emilebildiği bir atom içindeki geçişlerin aksine, enerjisi başlangıç seviyesinden iyonlaşma enerjisine geçiş için gerekenden daha büyük olan herhangi bir kuantum tarafından iyonizasyon üretilebilir. Örneğin, birinci seviyede bulunan bir hidrojen atomu, dalga boyu 912 A'dan az olan herhangi bir kuantumu ve ikinci seviyeden - dalga boyu 3646 A'dan az olan bir kuantumu emebilir. elektron, daha sonra fazla enerji, çıkarılan elektronun kinetik enerjisine geçer. Çarpma iyonizasyonu, ancak çarpan elektronun enerjisi, ayrılma için gerekenden daha büyükse mümkündür. Gaz sıcaklığı ne kadar yüksek olursa, daha fazla elektronlar gerekli enerjiye sahiptir, iyonlaşmalar ne kadar sık meydana gelir ve diğer şeyler eşit olursa, iyonize atomların oranı o kadar büyük olur. Ağır bir parçacık, bir atomu yalnızca iyonlaşma enerjisinden çok daha yüksek enerjilerde iyonize edebilir. Gaz çok yüksek bir sıcaklığa sahipse veya güçlü bir radyasyon alanındaysa, elektronu geri yakalama zamanı gelmeden önce ikinci, üçüncü elektron vb. ondan koparılabilir. defalarca iyonize atomlar. Bununla birlikte, sonraki her elektronun ayrılması, iyonun yükü arttıkça daha fazla enerji gerektirir. Bu nedenle, çoklu iyonizasyon, gazın veya iyonlaştırıcı radyasyon kaynağının çok yüksek bir sıcaklığını gerektirir. Ters iyonizasyon işlemine denir rekombinasyon. Bir iyon tarafından bir elektronun yakalanmasını temsil eder. Bir elektron, bir atom tarafından herhangi bir seviyede yakalanabilir. Bu nedenle, rekombinasyon sonucu oluşan bir atom uyarılmış veya uyarılmamış olabilir. Rekombinasyon sırasında, serbest ve bağlı bir elektronun enerjileri arasındaki farka eşit bir enerji, genellikle bir kuantum biçiminde serbest bırakılmalıdır. Düşük enerjili bir elektron yeniden birleşirse, kuantumun frekansı, karşılık gelen seviye serisinin sınırına yakındır. Yeniden birleşen elektronun enerjisi ne kadar büyükse, yayılan kuantumun frekansı da o kadar büyük olur. Serbest elektronlar herhangi bir enerjiye sahip olabileceğinden, rekombinasyonlar sırasında yayılan spektrum, seri sınırından hemen sonra başlayan ve giderek daha yüksek frekanslara doğru gerilerek, kademeli olarak zayıflayan sürekli bir bant şeklindedir. Böyle bir spektrum denir süreklilik. Parlaklığın zayıflaması, hızlı elektronların kesrinin artan enerji ile her zaman azalması gerçeğinden kaynaklanır. Gaz sıcaklığı ne kadar yüksek olursa, elektronların yeniden birleştirilmesinin ortalama enerjisi o kadar yüksek olur ve yoğunluk, seri sınırın ötesine o kadar yavaş düşer. Bir atomun sadece rekombinasyon sırasında değil, aynı zamanda bir enerji seviyesinden diğerine geçişler sırasında da ışık yayabildiğini yukarıda söylemiştik. Bir iyonun elektrik alanında hareket eden serbest bir elektronun da radyasyon yayabildiği ortaya çıktı. Bir serbest elektron hiperbolik bir yörünge boyunca bir iyon alanında hareket eder ve farklı yörüngeler farklı enerjilere karşılık gelir. Tıpkı bir atoma bağlı bir elektronun bir eliptik yörüngeden diğerine geçişi sırasında bir kuantumun yayılması veya soğurulması gibi, bir elektron bir hiperbolik yörüngeden diğerine geçerken bir kuantum yayılabilir veya soğurulabilir. Böyle bir süreç serbestten özgüre geçiş denir. Her iki yörüngenin enerjisi herhangi bir değere sahip olabileceğinden, serbest-serbest geçişler sırasında emisyon ve absorpsiyon sürekli bir spektrumda meydana gelir. Serbest-serbest geçişler sırasında enerjideki değişim genellikle küçük bir kesirdir. tam Enerji böylece yayılan fotonların enerjisi elektronların ortalama enerjisinden daha azdır. çok değilken Yüksek sıcaklık serbest gaz radyasyonu, kızılötesi ışınlardan radyo dalgalarına kadar uzun dalgalar bölgesinde yoğunlaşır. Şimdiye kadar tek tek atomlar tarafından ışığın emisyonu ve absorpsiyonu hakkında konuştuk. Gerçekte, tüm bir gaz katmanından gelen radyasyon her zaman gözlenir. Gaz tabakası tüm frekanslarda şeffafsa, tek tek atomların radyasyonu basitçe özetlenecektir. Rekombinasyonlar sırasında oluşan daha az parlak sürekli bir spektrumun arka planına karşı parlak çizgilerden oluşacaktır. çeşitli seviyeler ve serbestten özgüre geçişler. Ancak gaz tabakasının kalınlığını arttırırsanız, radyasyonun bir kısmı gaz tarafından emilecektir. Her şeyden önce, çizgileri oluşturan kuanta emilecek ve bu nedenle çizgiler sürekli spektrumun arka planına karşı daha az kontrastlı olacaktır. Homojen katman tüm frekanslarda pratik olarak opaksa, çizgiler kaybolacaktır. Radyasyon, yalnızca sıcaklığa bağlı olarak sürekli bir spektruma sahip olacak ve bu spektrumdaki maksimum yoğunluk, gaz tabakasının sıcaklığının artmasıyla kısa dalgalara doğru kayacaktır. Aynı zamanda, birim yüzey tarafından yayılan toplam enerji miktarı artacaktır. Yıldızların radyasyonu, katmanın homojen olmaması gerçeğiyle karmaşıklaşır - sıcaklığı ve yoğunluğu derinlikle artar. Bu nedenle, yıldızların tayfında koyu çizgiler vardır ve yoğunluğun genel seyri, opak bir gaz tabakasının tayfı ile örtüşmez.

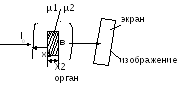

toplam sayfalar: 6
nerede v abs. - emilen ışığın frekansı, E 2 ve E 0 - geçişin gerçekleştirildiği seviyelerin enerjisi.
burada v lum lüminesans sırasında yayılan ışığın frekansıdır. Sayfa
3
toplam sayfalar: 6






