Entropi entalpi iç enerjisi fark nedir. İç enerji ve entalpi
KİMYASAL TERMODİNAMİĞİN TEMELLERİ
Kimyasal termodinamiğin temel kavramları. Sistem, denge durumu ve termodinamik süreç. Kapsamlı ve yoğun özellikler. Durum fonksiyonları ve süreç fonksiyonları. Genel durumda bir süreç fonksiyonu olan termodinamik bir nicelik, bir durum fonksiyonunun özelliklerini alabilir mi? Evet ise, lütfen örnekler verin.
Termodinamiğin birinci yasası. İçsel enerji. Enerji transfer biçimleri olarak ısı ve iş. Bu değerlerin izokorik ve izotermal süreçlerdeki ilişkisi.
Termodinamiğin birinci yasası, termodinamiğin 1. yasasının formülasyonları. Sistemin iç enerjisi. Enerji transfer biçimleri olarak ısı ve iş. İzotermal ve izokorik süreçlere uygulanan termodinamiğin 1. yasası.
Durum parametrelerinin koordinatlarında bir grafik üzerinde şematik olarak çizin Р=f(V) ideal bir iki atomlu gazın aynı başlangıç durumundan hacimde iki kat artışa kadar tersinir izotermal ve tersinir izobarik genleşmesi süreçleri. Yukarıdaki süreçlerden hangisi için genişleme işinin daha büyük olduğunu açıklayın?
Gaz diyagramındaki adyabatik çizim (kalın çizgi). - gaz basıncı; - Ses.
Özel bir durumda, hacimdeki bir değişiklikle iş yapıldığında, aşağıdaki şekilde tanımlanabilir: gazın, kolayca kayan bir piston tarafından sıkıca kapatılmış silindirik bir kap içine alınmasına izin verin, gaz genişlerse, gazın hareket etmesine izin verin. piston ve bir segmente geçerken iş yapın
burada F, gazın pistona etki ettiği kuvvettir. Denklemi yeniden yazalım:
nerede s pistonun alanıdır. O zaman iş olacak
gaz basıncı nerede, küçük bir hacim artışıdır. Benzer şekilde, denklemin keyfi bir kesit şekline sahip gemiler için de geçerli olduğu görülebilir.
İzokorik ve izobarik molar ısı kapasiteleri. İdeal bir gaz için aralarındaki ilişki. Kristal, sıvı ve gaz halindeki maddeler için izobarik ısı kapasitesinin sıcaklığa bağımlılığı.
Sıvıyı ısıtırken ve katılar hacimleri pratikte değişmez ve genişleme işi sıfıra eşit olur. Bu nedenle, vücut tarafından alınan tüm ısı miktarı, iç enerjisini değiştirmeye gider. Sıvılardan ve katılardan farklı olarak, ısı transferi sürecindeki bir gaz hacmini büyük ölçüde değiştirebilir ve iş yapabilir. Bu nedenle, gaz halindeki bir maddenin ısı kapasitesi, termodinamik sürecin doğasına bağlıdır. Genellikle, gazların ısı kapasitesinin iki değeri dikkate alınır: C V – izokorik bir süreçte molar ısı kapasitesi (V= const) ve C p – izobarik bir süreçte molar ısı kapasitesi (p= sabit).
süreçte sabit hacim gaz işe yaramaz A= 0. 1 mol gaz için termodinamiğin birinci yasasından şu şekildedir:
nerede ∆ V- sıcaklığı Δ ile değiştiğinde 1 mol ideal gazın hacmindeki değişiklik T. Bu şu anlama gelir:
nerede R evrensel gaz sabitidir. saat p= sabit
Böylece molar ısı kapasiteleri arasındaki ilişkiyi ifade eden bağıntı C p ve C V, formuna sahiptir ( Mayer'in formülü ):
|
C p = C V + R. |
|
Faz geçişleri sırasında(bir kristal modifikasyondan diğerine, katı hal sıvıya, vb.) ısı kapasitesi aniden değişirken çoğu madde için C V erime noktasında biraz daha sıvı C V kristal (Şekil 1.7). |
|||
|
| |||
|
| |||
|
Pirinç. 1.7. Isı kapasitesi bağımlılığı HCl sıcaklık T T FP - sıcaklık faz geçişi; T PL. - erime sıcaklığı; T KIP. - kaynama sıcaklığı | |||
|
3. Gaz ve sıvı maddelerin ısı kapasitesi genellikle artan sıcaklıkla artar (Şekil 1.8). | |||
|
| |||
|
Maddelerin ısı kapasitesinin 298 ila T aralığında sıcaklığa bağımlılığı genellikle tanımlanır. | |||
|
ampirik denkleme göre organik maddeler için: C P = a + içinde T + c T 2 (1.22) |
| ||
6. İç enerji ve entalpi si, ilişkileri. İç enerjinin ve maddenin entalpisinin sıcaklığa bağımlılığı. Karşılık gelen denklemlerin entegrasyonu.
içsel enerji sistem, vücudun tüm parçacıklarının birbirleriyle etkileşiminin potansiyel enerjisinin toplamı olarak adlandırılır ve kinetik enerji hareketleri, yani içsel enerji sistem translasyon enerjisinden oluşur ve döner hareket moleküller, molekülleri oluşturan atomların ve atom gruplarının molekül içi titreşim hareketinin enerjisi, atomlardaki elektronların dönme enerjisi, atomların çekirdeğinde bulunan enerji, moleküller arası etkileşim enerjisi ve diğer enerji türleri.
Bir cismin iç enerjisinin mutlak değeri bilinmemektedir, ancak kimyasal olayları incelemek için sistemin bir durumdan diğerine geçişi sırasında sadece iç enerjideki değişimi bilmek önemlidir.Birçok süreçte enerji kısmen aktarılabilir. ısı şeklinde ve kısmen iş şeklinde.
Böylece, ısı ve iş, bir vücuttan diğerine enerji transferinin niteliksel ve niceliksel olarak iki farklı biçimini karakterize eder; enerji ile aynı birimlerde ölçülürler.
Her türlü iş veya enerji iki faktörün ürünü olarak temsil edilebilir: yoğunluk faktörü çarpı kapasitans faktöründeki değişim, aynı zamanda yayılma faktörü olarak da adlandırılır (yoğunluk faktörü işlem sırasında sabit kalırsa).Örneğin, normal iş (mekanik) eşittir uygulanan kuvvetin ürününe ve yol artışına:
Sisteme (madde veya maddeler kümesi) ısı verilirse, o zaman, enerjinin korunumu yasasına göre, genellikle sistemin iç enerjisini arttırmak için harcanır U ve A işi, yani.
(1) burada U, U BAŞLANGIÇ durumundan son duruma U CON geçişi sırasında sistemin iç enerjisindeki değişimdir.
![]() Kimyasal reaksiyonlarda iş, esas olarak dış basınca karşı çalışma ile karakterize edilir. İlk yaklaşımda, sistemin basınç ve hacim değişimi V çarpımına eşittir:
Kimyasal reaksiyonlarda iş, esas olarak dış basınca karşı çalışma ile karakterize edilir. İlk yaklaşımda, sistemin basınç ve hacim değişimi V çarpımına eşittir:
(2) burada V, süreçteki hacim değişikliğidir.
Bir izokorik süreçle, A = 0, çünkü sistemin hacminde bir değişiklik yoktur ( V=0) Bu nedenle, sistemin durum 1'den durum 2'ye geçişi şu eşitliğe karşılık gelir:
(3) Bu nedenle, reaksiyon V=const'ta devam ederse, o zaman ısının salınması ve emilmesi Q V iç enerjideki U bir değişiklikle ilişkilidir.
Bir izobarik işlem için, V, reaksiyon ürünlerinin hacimlerinin toplamı ile başlangıç maddelerinin hacimlerinin toplamı arasındaki farktır (P=const).
![]() (4) Bir izobarik süreç için, Q P termal etkisi şuna eşit olacaktır:
(4) Bir izobarik süreç için, Q P termal etkisi şuna eşit olacaktır:
![]() (5)(6)
(5)(6)
(8) - Entalpi
entalpi iç enerjinin toplamına ve hacim ile basıncın çarpımına eşittir.
entalpi iç enerji gibi, maddenin doğasına, basınca ve sıcaklığa bağlı olarak devletin kapsamlı bir işlevidir. Sistemin faz durumunun değişmediği sıcaklık aralığında entalpi, ana parametrelerin monoton bir fonksiyonudur.
şunlar. H, Q p reaksiyonunun p=const'taki termal etkisidir.
Entalpi bir durum fonksiyonudur, yani. değişimi, sistemin verilen ilk ve son durumları tarafından belirlenir ve geçiş yoluna bağlı değildir.
loş [H]=[kJ] veya [kJ/mol]
Böylece, izokorik reaksiyonun proses termal etkisi:
termal etki(sıcaklık Kimyasal reaksiyon) sabit hacim veya basınç koşulları altında reaksiyon sırasında sistem tarafından salınan veya emilen ısı (enerji) miktarıdır ve sonuçta ortaya çıkan ürünler orijinal madde ile aynı sıcaklığa sahiptir.
ideal bir gazın iç enerjisi hacme ve basınca bağlı değildir, ancak yalnızca sıcaklığın bir fonksiyonudur, o zaman denklem (2.7) temelinde, onu entegre ettikten sonra, iç enerji için herhangi bir sıcaklıkta elde ederiz. T:
sen T = sen o + İle birlikte V (T – TÖ). (5.2) İdeal bir gazın entalpisi de iç enerji gibi sadece sıcaklığa bağlıdır. Tanım gereği, H = sen + pV ve 1 mol gaz için pV = RT ve ( İle birlikte R – İle birlikte V)
=R, sonra H = sen o + İle birlikte R (T – TÖ). (5.3) İdeal bir gazın izokorik ve izobarik potansiyelleri Sabit sıcaklık(4.28) ve (4.34) denklemlerinin integrali alınarak belirlenir. Bir mol ideal gaz için T= sabit dF =
– pdV =
–  dV, (5. 4) entegrasyondan sonra nereden elde ederiz F = F(T)
– RT içinde v.(5.5)
dV, (5. 4) entegrasyondan sonra nereden elde ederiz F = F(T)
– RT içinde v.(5.5)
Termokimya. Hess yasası ve termodinamik doğrulaması. Sabit basınç ve sabit hacimde bir kimyasal reaksiyonun termal etkileri arasındaki ilişki.
Hess yasası- aşağıdaki gibi formüle edilen temel termokimya yasası:
İzobarik-izotermal veya izokorik-izotermal koşullar altında gerçekleştirilen bir kimyasal reaksiyonun termal etkisi, yalnızca başlangıç malzemelerinin ve reaksiyon ürünlerinin tipine ve durumuna bağlıdır ve oluşum yoluna bağlı değildir..
Başka bir deyişle, herhangi bir işlemde salınan veya emilen ısı miktarı, verilen kimyasal dönüşümün bir veya birkaç aşamada ilerlemesine bakılmaksızın (maddelerin sıcaklık, basınç ve toplam durumlarının aynı olması şartıyla) her zaman aynıdır.

Şekil, A 1, A 2 ... başlangıç maddelerinin bir, iki veya çeşitli şekillerde gerçekleştirilebilen B 1, B 2 ... reaksiyon ürünlerine dönüştürülmesine ilişkin bazı genelleştirilmiş kimyasal işlemlerin şematik bir temsilini göstermektedir. her birine bir termal etki eşlik eden üç aşama ΔH i. Hess yasasına göre, tüm bu reaksiyonların termal etkileri aşağıdaki bağıntı ile ilişkilidir.
TERMOKİMYASAL DENKLEMLER
Hess yasası
Tüm kalitatif hesaplamalar Hess yasasına göre yapılır:
Reaksiyonun entalpisindeki değişiklik, yalnızca başlangıç malzemelerinin ve reaksiyon ürünlerinin fiziksel durumuna ve kimyasal doğasına bağlıdır ve reaksiyonun ara aşamalarına bağlı değildir. (1840)
Hess yasasından çıkan sonuçlar:
1) İleri reaksiyonun termal etkisi, büyüklük olarak eşittir ve ters reaksiyonun termal etkisine işaret olarak zıttır.
2) Reaksiyonun ısı etkisi, ürünlerin ve başlangıç malzemelerinin reaksiyon oluşum entalpilerinin toplamının stokiyometrik katsayılarla çarpımı arasındaki farka eşittir.
3) Reaksiyonun ısı etkisi, başlangıç maddelerinin ve ürünlerin reaksiyonunun yanma entalpilerinin toplamının stokiyometrik katsayılarla çarpımı arasındaki farka eşittir.
termodinamik parametreler
Termodinamik parametreler, fiziksel özellikler termodinamik sistemlerde durumu ve süreçleri karakterize eden .
Bunlara termodinamik özellikler de denir. Yoğun olarak ayrılırlar (madde miktarına bağlı değildir) - bu sıcaklık, basınç, konsantrasyon ve kapsamlıdır (madde miktarına bağlıdır) - bu kütle, hacim, enerjidir. Termodinamik özelliklerin değer kümesi karakterize eder termodinamik durum sistemler.
Termodinamik özellikler, termodinamik sistemleri tanımlamak için kullanılır ve genellikle nicel olarak bir dizi nicelik olarak sunulur.
İç enerji ve entalpi
Entalpi, ısı salınımı ve iş performansı nedeniyle enerji sistemindeki değişiklikleri hesaba katan genelleştirilmiş bir parametredir. Entalpi aynı zamanda sistemin ısı içeriği olarak da adlandırılır, çünkü entalpideki değişim sabit basınç emilen ısıya eşittir. Bu, sistemin kapsamlı bir özelliğidir.
Sadece sıvılar ve katılar, o zaman reaksiyonun entalpisindeki değişim, iç enerjideki değişime yaklaşık olarak eşittir. Bunun nedeni, hacimdeki değişimin pratik olarak sıfır olması ve genişleme işinin yapılmadığı ortaya çıkıyor.
Ancak, bir kimyasal reaksiyon sonucunda gaz halindeki maddeler salınır veya emilirse, denklem tam olarak kullanılır. İdeal bir gazın izotermal genleşmesinde iç enerji sıfırdır. Genel durumda, sistemdeki enerji değişimi, sistem ve sistem arasındaki alışverişle bağlantılı olarak gerçekleşir. çevreısı veya iş.
İzole ve kapalı sistemlerde meydana gelen süreçlerin tanımlanmasında entropi ve rolü
Entropi, bir sistemdeki rastgeleliği veya düzensizliği açıklayan nicel bir termodinamik özelliktir; başka bir deyişle, organizasyon eksikliği. Düzensizlik ne kadar büyükse, entropinin değeri o kadar büyüktür ve bunun tersi de geçerlidir. Entropi, k'nin Voltzmann sabiti olduğu S=klnW sisteminin olasılığı ile orantılıdır. Evrenin entropisi sürekli artıyor. Termodinamiğin ikinci yasasına göre izole sistemler sadece entropide bir artış olan bu tür süreçler mümkündür. Entropi mümkün olan maksimum seviyeye ulaştığında sistemde denge oluşur. 0 K'da saf, mükemmel bir kristalin entropisi sıfırdır (termodinamiğin üçüncü yasası).
Sistem izole değilse, geri dönüşü olmayan süreçler sırasında sistem ve çevrenin entropilerindeki değişikliklerin toplamı her zaman pozitiftir. Bu toplam, yalnızca termodinamik olarak tersinir işlemlerde sıfıra eşittir.
Kapalı sistemlerde, sadece entropi yardımıyla yönü ve dengeyi belirlemek imkansızdır; genelleştirilmiş parametreler kullanırlar: Helmholtz enerjisi ve Gibbs enerjisi.
Helmholtz enerjisi, V ve T'nin sabit olduğu süreçlerde kullanılır. dA=dU-TdS
Gibbs enerjisi, P ve T'nin sabit olduğu süreçlerde kullanılır. dG=dH-TdS 298K
Entalpi ve entropideki değişimin nitel olarak belirlenmesi
Değiştirmek bedava enerji sistemde meydana gelen süreçleri tanımlamadaki rolü, kapalı sistem
G değeri, sistemin faydalı işler yapma yeteneğini karakterize eder.
Sürecin yönünü belirlemek için Gibbs enerjisi kullanılabilir.
eğer G<0, то процесс протекает самопроизвольно.
G=0 ise denge oluşur.
KİMYASAL DENGE
Kimyasal Dengeyi Etkileyen Faktörler
Sistemin kimyasal dengesi, konsantrasyon, basınç (gaz halindeki maddeler için), sıcaklık ve ayrıca katalizörlerden etkilenir.
Denge sabiti
Denge sabiti, payı reaksiyon ürünlerinin denge konsantrasyonlarının ürününü içeren orana eşittir ve payda, tüm konsantrasyon değerleri eşit güçlerde alınırken, başlangıç maddelerinin konsantrasyonlarının ürünüdür. reaksiyon denklemindeki stokiyometrik katsayılara. Ayrıca denge sabiti, ileri ve geri reaksiyonların hız sabitlerinin oranına eşittir.
Kimyasal dengede kayma
Kimyasal dengenin konumu şu reaksiyon parametrelerine bağlıdır: sıcaklık, basınç ve konsantrasyon. Bu faktörlerin bir kimyasal reaksiyon üzerindeki etkisi, Fransız bilim adamı Le Chatelier tarafından 1885'te genel terimlerle ifade edilen bir modele tabidir.
Kimyasal dengeyi etkileyen faktörler:
1) sıcaklık
Sıcaklık arttıkça kimyasal denge endotermik (absorpsiyon) reaksiyona, azaldıkça ekzotermik (izolasyon) reaksiyona doğru kayar.
CaCO3=CaO+CO2 -Q t →, t↓ ←
N2+3H2↔2NH3 +Q t ←, t↓ →
2) basınç
Basınç arttığında, kimyasal denge daha küçük bir madde hacmine ve azaldığında daha büyük bir hacme doğru kayar. Bu ilke yalnızca gazlar için geçerlidir, yani. reaksiyona katı maddeler dahil ise, bunlar dikkate alınmaz.
CaCO3=CaO+CO2 P ←, P↓ →
1mol=1mol+1mol
3) başlangıç maddelerinin ve reaksiyon ürünlerinin konsantrasyonu
Başlangıç maddelerinden birinin konsantrasyonundaki artışla, kimyasal denge reaksiyon ürünlerine ve reaksiyon ürünlerinin konsantrasyonundaki artışla başlangıç maddelerine doğru kayar.
S2+2O2=2SO2 [S],[O] →, ←
Katalizörler kimyasal dengenin kaymasını etkilemez!
10. Prensip LE - CHATELIER (bir örnek düşünün)
Sistem dengedeyse, koşullardan biri (sıcaklık, kons., basınç) değiştiğinde, denge, değişimi engelleyen reaksiyon yönünde kayar. N2(g)+3H2(g)<->2NH3(g) +Q
Katalizörler
Katalizör, kimyasal reaksiyonun hızını değiştiren ancak nihai ürünlerin bir parçası olmayan bir maddedir. Katalizörler, denge reaksiyon karışımının bileşimini etkilemez, ancak reaksiyonu hızlandırır, bu da kimyasal dengeye ulaşmak için gereken süreyi azaltır. Katalizörler (pozitif katalizörler) ve inhibitörler (negatif katalizörler) vardır.
Homojen ve heterojen kataliz
Homojen katalizde, reaktanlar ve katalizör tek fazlı bir sistem oluşturur - gaz veya sıvı, katalizör ile reaktanlar arasında bir arayüz yoktur. Homojen kataliz için, kimyasal reaksiyon hızının katalizör konsantrasyonu ile orantılı olduğu bulunmuştur.
Heterojen katalizde, reaktanlar ve katalizör, farklı fazlardan oluşan bir sistem oluşturur. Bu durumda, katalizör ve reaktanlar arasında bir arayüz vardır. Katalizör genellikle katıdır ve reaktanlar gaz veya sıvıdır. Katı bir katalizörün aktivitesi, yüzeyinin özelliklerine (boyut, kimyasal bileşim, yapı ve durum) bağlıdır. Pozitif katalizörlerin etkisi, reaksiyonun aktivasyon enerjisinde bir azalmaya, başka bir deyişle enerji bariyerinin yüksekliğinde bir azalmaya indirgenir. Bu, daha düşük bir enerji seviyesine sahip aktifleştirilmiş bir kompleks oluşturur ve reaksiyon hızı büyük ölçüde artar.
ATOMUN YAPISI VE PERİYODİK HUKUK
İzotoplar, izobarlar, çekirdek türleri?
İzotoplar ilk olarak 1912'de JJ Thomson'ın bir elektrik ve manyetik alanda yüklü parçacıkların sapmasını gözlemlediği deneylerinde keşfedildi. İzotoplar, aynı kimyasal elementin, aynı nükleer yüklere, ancak farklı kütle numaralarına sahip atom çeşitleri olarak adlandırıldı. Doğadaki elementler, örneğin doğal karbon 12 6 C ve 13 6 C gibi izotop karışımlarından oluşur. Ancak atomların kütlesi çok küçüktür, bu nedenle atomik kütle birimleri olarak adlandırılan göreceli birimler, karbon 12 kütlesinin 1/12'sidir. .
İzobarlar, aynı kütle numarasına, ancak farklı atom numaralarına sahip farklı kimyasal elementlerin atom çeşitleridir.
Çekirdek türleri:
Schrödinger denklemi
V potansiyel enerjisine sahip bir kuvvet alanında tek boyutlu uzayda hareket eden bir elektron için aşağıdaki forma sahiptir:
-(h^2/8pi^2m)d^2horns/dx^2+Vhorns=Ehorns
Bu denklemde, m elektron kütlesidir, x, x ekseni boyunca elektronun koordinatıdır, E toplam enerjidir ve boynuzlar dalga fonksiyonudur. Dalga fonksiyonunun x koordinatına göre ikinci türevi.
dalga numaraları
λ dalga boyu ile ilgili nicelik, bağıntı ile: k= 2π/λ (2π uzunluğundaki dalga sayısı). V. spektroskopisinde, dalga boyuna (1/λ) karşılık gelen niceliğe genellikle denir.
Pauli prensibi
Her yörünge sadece iki elektron içerebilir ve spinleri zıttır. Bir atomun aynı dört kuantum sayısına sahip iki elektronu olamaz.
Gund'un kuralı
Aynı enerjiye sahip birkaç olası orbital arasında en kararlı konfigürasyon, en eşleşmemiş elektronlara sahip olanıdır.
Kuantum sayıları
Temel kuantum sayısı n, elektronun toplam enerjisini belirler. Her sayı bir enerji seviyesine karşılık gelir. n=1,2,3,4…veya K,L,M,N…
Yörünge kuantum sayısı l, enerji seviyesindeki alt seviyeleri belirler. Kuantum sayısı l yörüngelerin şeklini belirler (n-1) 0,1,2…
Manyetik kuantum sayısı ml, bir alt seviyedeki orbitallerin sayısını belirler. …-2,-1,0,+1,+2… Alt seviyedeki toplam yörünge sayısı 2l+1'dir.
Spin kuantum sayısı ms, iki farklı yönelimi ifade eder +1/2 -1/2 Her yörüngede zıt dönüşlere sahip yalnızca iki elektron olabilir.
Elementlerin oksidasyon durumları
Oksidasyon durumu (oksidasyon numarası, formal yük), oksidasyon, indirgeme ve redoks reaksiyonlarının süreçlerini kaydetmek için yardımcı koşullu bir değerdir, elektron çiftlerinin taşıdığı varsayımıyla bir moleküldeki bir atoma atfedilen elektrik yükünün sayısal değeridir. bağlantı tamamen daha elektronegatif atomlara doğru kaydırılır.
Oksidasyon derecesi hakkındaki fikirler, inorganik bileşiklerin sınıflandırılması ve isimlendirilmesinin temelini oluşturur.
Oksidasyon durumu, bir moleküldeki veya bir kimyasal formal birimdeki bir iyonun yüküne veya bir atomun formal yüküne karşılık gelir, örneğin:
Oksidasyon durumu, element sembolünün üzerinde gösterilir. Bir atomun yükünü belirtmekten farklı olarak, oksidasyon derecesini belirtirken, önce işaret, ardından sayısal değer konur, tersi değil:
Oksidasyon derecesi,
Ücretler.
Basit bir maddede bir atomun oksidasyon durumu sıfırdır, örneğin:
Bir moleküldeki atomların oksidasyon durumlarının cebirsel toplamı her zaman sıfırdır:
Oksidasyon derecesi kavramı, stokiyometrik olmayan bileşiklere (KS 8 , Mo 5 Si 3 , Nb 3 B 4 , vb.) oldukça uygulanabilir. Örneğin, iyi bilinen pirit kavurma reaksiyonunda:
4FeS 2 + 11O 2 \u003d 2Fe 2 O 3 + 8SO 2
orijinal bileşikte demir +3'ün oksidasyon durumunu almak en uygunudur (gerçekte demir atomu kendisinden 2 elektronu yer değiştirse de, yani demirin oksidasyon durumu +2'dir) ve kükürt için -3'tür. /2 (!), oksidasyon durumunun tanımıyla hiç çelişmeyen , geleneksel bir birim olarak ve reaksiyonu diğer redoks işlemlerinde olduğu gibi basit bir şekilde eşitlemenize izin verir.
Bir moleküldeki atomların toplam oksidasyon durumu her zaman sıfırdır.
KİMYASAL BAĞ
iletişim sırası
Moleküler orbitaller teorisindeki bağ sırası, ifade ile belirlenir.
![]()
burada ve sırasıyla bağlanma ve gevşeme orbitallerindeki toplam elektron sayılarıdır.
Kimyasal bağ türleri
Atomların birbirleriyle birleşerek hem basit hem de karmaşık maddeler oluşturduğu bilinmektedir. Bu durumda, çeşitli kimyasal bağlar oluşur: iyonik, kovalent (polar olmayan ve polar), metalik ve hidrojen. Aralarında ne tür bir bağ - iyonik veya kovalent - oluştuğunu belirleyen element atomlarının en temel özelliklerinden biri elektronegatifliktir, yani. bir bileşikteki atomların elektronları kendine çekme yeteneği.
Kimyasal bağın türü, elementlerin bağlanan atomlarının elektronegatiflik değerlerindeki farkın ne kadar büyük olduğuna bağlıdır. Bağı oluşturan elementlerin atomları elektronegatiflik açısından ne kadar farklıysa, kimyasal bağ o kadar polardır. Kimyasal bağ türleri arasında keskin bir sınır çizmek imkansızdır. Çoğu bileşikte, kimyasal bağ türü ara bağdır; örneğin, oldukça polar bir kovalent kimyasal bağ, iyonik bir bağa yakındır. Sınırlayıcı durumlardan hangisinin doğada kimyasal bağa daha yakın olduğuna bağlı olarak, buna iyonik veya kovalent bir polar bağ denir.
elektron hibridizasyonu
Yörünge hibridizasyonu, çok atomlu bir molekülün merkez atomunun farklı (s, p, d) orbitallerini, özelliklerinde eşdeğer olan aynı sayıda orbitalin görünümü ile karıştırmanın varsayımsal bir işlemidir. Hibridizasyon türleri
[değiştir] sp hibridizasyonu
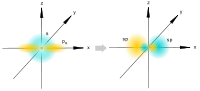
sp hibridizasyonu
Bir s- ve bir p-orbitalleri karıştırıldığında oluşur. 180 derecelik bir açıyla doğrusal olarak yerleştirilmiş ve karbon atomunun çekirdeğinden farklı yönlere yönlendirilmiş iki eşdeğer sp-atomik orbital oluşur. Kalan iki hibrit olmayan p-orbital, karşılıklı olarak dik düzlemlerde bulunur ve π-bağlarının oluşumuna katılır veya yalnız elektron çiftleri tarafından işgal edilir.
[değiştir] sp 2 hibridizasyonu

sp 2 hibridizasyonu
Bir s ve iki p orbitali karıştırıldığında oluşur. Aynı düzlemde bulunan ve üçgenin köşelerine 120 derecelik bir açıyla yönlendirilen eksenlerle üç hibrit yörünge oluşturulur. Hibrit olmayan p-atomik yörünge düzleme diktir ve kural olarak π-bağlarının oluşumuna katılır.
[değiştir] sp 3 hibridizasyonu
![]()
sp3 hibridizasyonu
Eşit şekil ve enerjiye sahip dört sp3-hibrit orbital oluşturarak bir s- ve üç p-orbitalini karıştırırken oluşur. Diğer atomlarla dört σ bağı oluşturabilirler veya yalnız elektron çiftleriyle doldurulabilirler.
sp3-hibrit orbitallerin eksenleri, düzenli bir tetrahedronun köşelerine yönlendirilir. Aralarındaki tetrahedral açı 109°28" olup, bu en düşük elektron itme enerjisine karşılık gelir. Sp3 orbitalleri ayrıca diğer atomlarla dört σ-bağ oluşturabilir veya paylaşılmamış elektron çiftleriyle doldurulabilir.
Hibridizasyon ve moleküler geometri
Atomik orbitallerin hibridizasyonu hakkındaki fikirler, Gillespie-Nyholm elektron çiftlerinin itme teorisinin temelini oluşturur. Her hibridizasyon türü, merkezi atomun hibrit orbitallerinin kesin olarak tanımlanmış bir uzaysal yönelimine karşılık gelir ve bu da inorganik kimyadaki stereokimyasal kavramların temeli olarak kullanılmasına izin verir.
Tablo, tüm hibrit orbitallerin kimyasal bağların oluşumuna katıldığını varsayarak (paylaşılmamış elektron çifti yoktur) en yaygın hibritleşme türleri ile moleküllerin geometrik yapısı arasındaki yazışmaların örneklerini göstermektedir.
| hibridizasyon türü | Hibrit orbital sayısı | Geometri | Yapı | Örnekler |
| sp | Doğrusal | | BeF 2 , CO 2 , NO 2 + | |
| sp 2 | üçgensel |  | BF 3 , NO 3 – , CO 3 2– | |
| sp 3 | dört yüzlü | 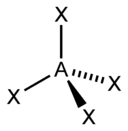 | CH 4, ClO 4 –, SO 4 2–, NH 4 + | |
| dsp2 | düz kare |  | Ni(CO) 4 , XeF 4 | |
| 3 gün | altı yüzlü | 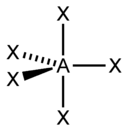 | PCl 5 , AsF 5 | |
| özel 3 gün 2 | oktahedral | 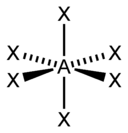 | SF 6 , Fe(CN) 6 3– , CoF 6 3– |
Sigma ve pi bağlantısı
Sigma- ve pi-bağları (s- ve p-bağları), elektron yoğunluğunun dağılımının belirli, ancak farklı bir uzaysal simetrisi ile karakterize edilen kovalent kimyasal bağlar. Bilindiği gibi, etkileşen atomların elektronlarının sosyalleşmesi sonucunda kovalent bir bağ oluşur. Ortaya çıkan s-bağ elektron bulutu, iletişim hattına, yani etkileşen atomların çekirdeklerini birleştiren hatta göre simetriktir. Kimyasal bileşiklerdeki basit bağlar genellikle (t-bağları (bkz. Basit bağ) şeklindedir.P-bağ elektron bulutu bağ hattından geçen düzleme göre simetriktir (Şekil 1,b) ve bu düzlemde (nodal denir) ) elektron yoğunluğu eşittir Yunan harfleri s ve p'nin kullanımı, atomun elektronlarının belirlenmesinde Latin harfleri s ve p ile yazışmalarıyla ilişkilidir, katılımı ilk kez mümkün hale gelir. sırasıyla s- ve p-bağları oluşturmak için p z) Kartezyen koordinatların (x, y, z) karşılık gelen eksenleri etrafında simetriktir, o zaman bir p-orbital, örneğin p z, bir s- oluşumunda yer alırsa bağ (z ekseni bir iletişim hattıdır), kalan iki p-orbital (p x, p y) iki p-bağının oluşumunda yer alabilir (nodal düzlemleri sırasıyla yz ve xz olacaktır; bkz. Şekil 2) d- (bkz. Şekil 1) ve f ayrıca bir atomun s ve p-bağlarının -elektronlarının oluşumunda yer alabilir.Bir moleküldeki atomlar arasında ise hem s- hem de p-bağları aynı anda hıçkırır, o zaman ortaya çıkan bağ bir çokludur (bkz. çoklu bağlar, çift bağlar, üçlü bağlar ve değerlik).  Pirinç. 1. s - s-, s - p s - , p s - p s -etkileşimleri (a) ve p p sonucu olarak p-bağları sonucunda bir s-bağının oluşumu sırasında yörüngelerin uzaysal yöneliminin şematik gösterimi - , p p - , d p - d p - etkileşimler ( b). Pirinç. 1. s - s-, s - p s - , p s - p s -etkileşimleri (a) ve p p sonucu olarak p-bağları sonucunda bir s-bağının oluşumu sırasında yörüngelerin uzaysal yöneliminin şematik gösterimi - , p p - , d p - d p - etkileşimler ( b). 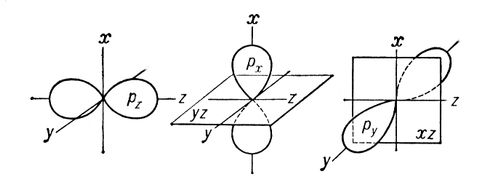 Pirinç. 2. Bulutların şematik gösterimi p x -, p y -, p z - elektronlar. Kartezyen koordinatların eksenleri ve p x - ve p y - orbitallerinin düğüm düzlemleri gösterilmektedir. Pirinç. 2. Bulutların şematik gösterimi p x -, p y -, p z - elektronlar. Kartezyen koordinatların eksenleri ve p x - ve p y - orbitallerinin düğüm düzlemleri gösterilmektedir. |
dipol momenti
Tek ve çoklu bağlantı
İlişkiler σ ve π. Tekli ve çoklu bağlar
İki atom da birbirleriyle çoklu bağlar, yani ikili ve üçlü bağlar oluşturabilir. Bu durumda, ilk oluşan bileşen her zaman bir σ-bağ olacaktır (en yüksek mukavemete sahiptir ve molekülün geometrik şeklini belirler).
İkinci ve üçüncü bileşenlere π-bağları denir, herhangi bir orbitalin yanal örtüşmesiyle oluşurlar. s-orbitaller: 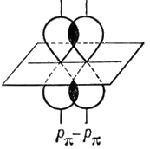

Örneğin, 2 p-iki karbon atomunun orbitalleri kendi aralarında oluşabilir tek, çift ve üçlü bağlantılar. İlk durumda, molekülün iskeleti oluşur. etan C2H6.
saat çift bağlayıcı karbon atomları ilk 2 p-orbitaller bir σ-bağ oluşturur ve ikincisi - bir π-bağ oluşturur; bu durumda molekülün iskeleti oluşur etilen C2H4.
saat üçlü bağ (bir σ-bağ, iki π-bağ) molekülün omurgasını oluşturur asetilen C2H2.
Bu tür çoklu bağlar her zaman tekli bağlardan daha kısa ve güçlüdür ve kırılması daha zordur. Çoğu zaman bu açıklar kimyasal eylemsizlik maddeler - örneğin nitrojen N2 (:N≡N:) ve karbon dioksit CO2 (O=C=O).
ile parçacık örnekleri katlar bağlar aynı zamanda SO 3, SO 2, NO 2 molekülleri ve CO 3 2−, SO 4 2−, SO 3 2− anyonlarıdır
İyonik bağ ve özellikleri
Atomlar arasında bir veya daha fazla elektronun tam transferi ile oluşur. Elektron(lar) veren atom katyon, alan atom ise anyon olur. İyonik, zıt yüklü iyonlar arasındaki elektrostatik çekim kuvvetlerinin bir sonucu olarak ortaya çıkar. İyonik bir bağ, atomları elektronegatiflik değerlerinde büyük bir fark olan bileşiklerin ve elementlerin karakteristiğidir, alkali metallerin (elektropozitif elementler) ve halojenlerin (elektronegatif elementler) atomları arasında oluşur. ÖZELLİKLERİ
İyonik bileşiklerin yapısı
Farklı iyonlar arasındaki maksimum çekim ve benzer iyonların minimum itmesi nedeniyle ideal bir iyonik bileşiğin yapısı, büyük ölçüde katyonların ve anyonların iyonik radyasyon oranı ile belirlenir. Bu basit geometrik yapılarla gösterilebilir.
51. Donör-alıcı bağı. Özellikleri, örnek veriniz
Verici-alıcı mekanizması (aksi halde koordinasyon mekanizması), iki atom veya bir atom grubu arasında tek bir elektron çifti, bir donör atom ve bir serbest yörünge pahasına gerçekleştirilen bir kovalent kimyasal bağın oluşumu için bir yöntemdir. bir alıcı atomun
"Verici-alıcı bağ" veya "koordinasyon bağı" terimleri yanlıştır, çünkü bu bir tür kimyasal bağ değil, yalnızca oluşumunun özelliğini tanımlayan teorik bir modeldir. Verici-alıcı mekanizma tarafından oluşturulan bir kovalent kimyasal bağın özellikleri, değişim mekanizması tarafından oluşturulan bağların özelliklerinden farklı değildir (örneğin, amonyum iyonunda NH bağları NH 4 + veya hidroksonyum iyonunda OH bağları H 3 O +).

Amonyak ve bor triflorür eklentisinin oluşumu
Vericiler genellikle küçük değerlik orbitallerinde paylaşılmamış elektron çiftlerine sahip olan nitrojen, oksijen, fosfor, kükürt vb. atomlarıdır. Bir alıcının rolü, iyonize bir hidrojen atomu H +, bazı p-metaller (örneğin, AlH 4 - iyonunun oluşumunda alüminyum) ve özellikle, içinde doldurulmamış enerji hücrelerine sahip d-elemanları tarafından gerçekleştirilebilir. değerlik elektron tabakası.
Moleküllerde ve kompleks (koordinasyon) bileşiklerin moleküler iyonlarında lokalize kovalent bağların oluşumu, donör-alıcı mekanizması açısından tarif edilir: bağ, ligandın yalnız elektron çifti ve serbest yörünge nedeniyle oluşur. kompleks yapan atomun Verici-alıcı mekanizması ayrıca yük transfer kompleksleri gibi reaksiyon ara ürünlerinin oluşumunu da açıklar.
Verici-alıcı mekanizması modeli, yalnızca kovalent bağların oluşumu sırasında elektron yoğunluğunun lokalizasyonu olarak değerlik kavramı içinde bulunur (değerlik şemaları yöntemi). Moleküler orbital yöntemi çerçevesinde bu tür temsillere gerek yoktur.
Hidrojen bağı
Bu bir tür moleküller arası etkileşimdir. Bu bağlar, çok elektronegatif bir A atomuna kovalent olarak bağlı bir H atomu ile bağı oluşturmak için serbest bir elektron çifti sağlayabilen bir elektronegatif B atomu arasındaki zayıf kalıcı kuvvetlerdir. Bir hidrojen bağı üç nokta ile temsil edilir. -A-N ... B-
Hidrojen bağları yalnızca en elektronegatif elementlerin atomlarıyla oluşur. Bunlardan en önemlileri F, O, N, Cl'dir. EK OLARAK
53. Moleküller arası etkileşim kuvvetleri, özellikleri (van der Waals kuvvetleri)
Van der Waals kuvvetleri birkaç tür etkileşim içerir: oryantasyonel dipol-dipol, indüksiyon ve dağılım.
1) Aynı maddenin veya farklı maddelerin iki molekülü kalıcı dipol ise, zıt yüklü kenarlar tarafından birbirlerine çekilirler ve buna göre uzayda yönlendirilirler. FORMÜL (s. 172).
2) Endüktif etkileşim, bir polar molekülün, komşu polar olmayan bir molekülün polarizasyonuna (bir dipolü indüklemesi) neden olmasıdır. Ayrıca, uzayda birbirlerine göre yönlendirilirler. Nihai sonuç etkileşimdir: dipol - indüklenmiş dipol. FORMÜL (s. 172).
3) Dispersiyon etkileşimleri, asil gaz atomları gibi nötr atomlar veya polar olmayan moleküller dahil moleküller arasındaki zayıf çekici kuvvetlerdir. FORMÜL (s. 173).
ÇÖZÜMLER
çözüm nedir
Çözeltiler, iki veya daha fazla bileşen içeren değişken bileşimli termodinamik olarak kararlı homojen sistemlerdir. Konsantrasyonu diğer tüm maddelerden daha fazla olan maddelere çözücü, diğer maddelere çözünmüş maddeler denir. Çözelti içindeki çözücünün faz durumu değişmez, örneğin su çözelti içinde sıvı halde kalır. Çözeltiler sıvı, katı ve gaz halindedir.
su
Su, dünyadaki en yaygın çözücülerden biridir. Su molekülü açısal bir yapıya sahiptir: (105 derece). O-H kimyasal bağı kovalenttir, ancak ortak elektron çifti O atomuna çekilir.Her H atomunda pozitif bir yük ve O üzerinde negatif bir yük görünür. Bu kısmi yükler, çözücü olarak suya özel özelliklerini veren molekülün polaritesini yaratır. Saf su, düşük bir O ve OH konsantrasyonuna sahiptir ve zayıf bir elektrik iletkenidir. Moleküller arası hidrojen bağları suyun özellikleri üzerinde önemli bir etkiye sahiptir. Hidrojen bağlarıyla bağlanan su molekülleri, açık bir uzaysal ızgara oluşturur. Su üç kümelenme halinde olabilir: sıvı, katı (buz) veya gaz (buhar). Suyun buharlaşması ve buzun süblimleşmesi herhangi bir sıcaklıkta meydana gelir.
Su moleküllerinin birliği
Kalıcı dipoller olan su molekülleri, karşılıklı
Zıt yüklü kutupların çekimi ikili, üçlü vb. şeklinde birleştirilebilir.
Bununla birlikte, bu durumda etki eden çekici kuvvetler küçüktür ve su durumunda, benzer bir
dipol birliği sadece küçük bir rol oynar.
Su moleküllerinin birleşmesi için birincil öneme sahip olan şey, su moleküllerinin oluşumudur.
hidrojen bağları denir. İkincisi, hidrojenin çekiciliği nedeniyle ortaya çıkar.
aşağıdaki şemaya göre bir su molekülünü oksijene dönüştürür:
H
?
O-N O-N
.
.
H
Böyle bir çekiciliğin olasılığı, önemli bir çekiciliğin olduğu varsayımıyla tutarlıdır.
molekülde hem hidrojen (?H = ?0.33) hem de oksijen (?O = ?0.66) için etkin yükler
su.
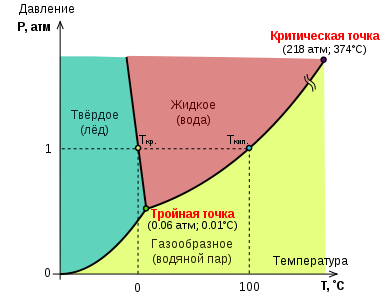
Su Durum Şeması
Elektrolit olmayan çözeltiler
Elektrolit olmayanlar, sulu çözeltileri ve eriyikleri, molekülleri iyonlara ayrışmadığından elektrik akımı iletmeyen maddelerdir.
65. Raoult'un birinci ve ikinci yasaları!
Raoult'un birinci yasası, bir çözelti üzerindeki doygunluk buhar basıncını, bileşimiyle ilişkilendirir; aşağıdaki gibi formüle edilir:
Bir çözelti bileşeninin doymuş buharının kısmi basıncı, çözeltideki mol kesri ile doğru orantılıdır ve orantı katsayısı, saf bileşen üzerindeki doymuş buhar basıncına eşittir.
2. Kitap bölüm 1.6
elektrolit çözeltileri
Güçlü elektrolitler sulu çözeltilerde neredeyse tamamen iyonlara ayrıştığından, iyonların konsantrasyonu yüksek olabilir. Güçlü elektrolitlerin konsantre çözeltilerinde iyonlar o kadar yaklaşır ki aralarındaki etkileşim çok önemli hale gelir. İnteriyonik etkileşim nedeniyle iyonların hareketliliği azalır ve iyonların kimyasal reaksiyonlara katılımıyla konsantrasyonu düşürme etkisi oluşur. Bu nedenle iyonlar, kimyasal reaksiyonlara gerçek konsantrasyonlarına göre değil, görünür konsantrasyonlarına göre - aktivitelerine göre girerler. Bir çözeltideki bir iyonun aktivitesi ile konsantrasyonu arasında bir ilişki vardır: ai=yi*ci .
izotonik oran
İdeal olmayan çözümlerin fiziksel özellikleri üzerindeki etkisini dikkate almanızı sağlar. Elektrolit çözeltileri için tipik olan çözünmüş maddelerin molekülleri ayrışabilir, ancak ayrışma ile birlikte moleküllerin birleşmesi de meydana gelebilir. Ayrışma ve birleşme süreçlerinden dolayı çözeltideki parçacıkların sayısındaki değişikliği hesaba katmak için izotonik katsayı i kullanılır.
İzotonik katsayı, bir çözünen maddenin parçacık sayısının, başlangıç durumundaki parçacık sayısına oranını ifade eder. Elektrolit olmayan çözeltiler için izotonik katsayı 1'dir, ayrışma süreci i.k. 1'den büyük, birleşme 1'den az. İzotonik katsayının deneysel olarak belirlenmesi, bir çözünen maddenin ayrışma veya birleşme derecesinin hesaplanmasını sağlar.
amfoterik hidroksitler
Amfoterik hidroksitler, asidik bir ortamda bazlar gibi ve alkali bir ortamda asitler gibi davranan kimyasallardır.
Her periyotta metal özelliği taşıyan elementlerin yerini hem metal hem de ametal özelliği gösteren elementler alır. Bu elementlerin bileşiklerine amfoterik denir. Alüminyum elementi, bileşiklerde bir metalin ve bir metal olmayanın özelliklerini gösterir. Benzer özellikler A gruplarının unsurlarına sahiptir - Be, Ga, Ge, Sn, Pb, Sb, Bi ve diğerleri, ayrıca B gruplarının çoğu unsuru - Cr, Mn, Fe, Zn, Cd ve diğerleri. Hemen hepsi suda çözünmez ve zayıf elektrolitlerdir.
Isıtıldığında, bileşikler ayrışır. Çoğu durumda, bir metal hidroksitin etkileşimi, karşılık gelen asidin bir hidroksosaltını üretir: örneğin, Al(3+), Cr(3+), Zn(2+) ve diğer birçok metal için etkileşim bu şekilde ilerler. Bu reaksiyon tersine çevrilebilir, denge pozisyonu ortamın metal pH'ının doğasına ve kısmen sıcaklığa bağlıdır. Metalin koordinasyon sayısı daha düşük olan iyonlar da çözeltide bulunabilir.
iyon aktivitesi
Aktivite (iyonların) - çözeltideki iyonlar arasındaki elektrostatik etkileşimi hesaba katan etkili konsantrasyon. Aktivite konsantrasyondan bir miktar farklılık gösterir. Aktivitenin (a) çözeltideki bir maddenin konsantrasyonuna (c, g-iyon / l'de) oranına aktivite katsayısı denir: γ \u003d a / c.
Aktivite faktörü
Aktivite katsayısı - bir çözümün belirli bir bileşeninin aktivitesinin, gerçek çözümlerin özelliklerinin ideal çözümlerin özelliklerinden sapmasını karakterize eden konsantrasyonuna oranı. İdeal çözümlerde ve sonsuz seyreltme K. ve. bire eşittir. K. a'nın yaklaşık değerleri. Debye-Hückel denklemi ile hesaplanır.
Su ayrışması
Suyun ayrışması, bazen başlangıçta ayrışan çözeltide yer almayan veya ayrışmanın başlamasından önce, ayrışmanın tamamlanmasından sonra olduğundan daha küçük bir miktarda bulunan yeni elementlerin yaratılmasıyla meydana gelen, suyun kurucu kimyasal elementlere ayrışmasıdır. işlem.
Suyun ayrışması endotermik bir reaksiyondur (bkz. endotermik reaksiyon), yani. ortamdan ısının emilmesi ile gidiyor.
Suyu ayrıştırmanın bilinen yolları:
1. Sulu elektrolit çözeltilerinin elektrolizi. - günümüzde bilinen en az etkili su ayrıştırma yöntemi, çünkü bu durumda enerji esas olarak iletkeni - elektroliti ısıtmak için harcanır, öyle ki, dağılan çözelti sadece soğumaz, aksine, önemli ölçüde maruz kalır. ısıtma. 20. yüzyıl endüstrisinde, petrol gibi elektrik elde edilen yenilenemeyen enerji kaynakları gibi mallar için talep sağlaması ve yüksek fiyatların korunmasına izin vermesi nedeniyle en yaygın hale gelen bu yöntemdir. gaz, kömür vb.
2. Santrifüj alanında suyun ayrışma sürecinin modeli Örneğin, dönen bir tambura ısıtılmış bir elektrolit dökülür, burada dönme sırasında, yeni başlayan bir elektrokimyasal işlemin bir sonucu olarak, su hidrojen ve oksijene ayrışır. Bu işlem, harici bir kaynağın kinetik enerjisini ve ısıtılmış elektrolitin termal enerjisini kullanarak suyu ayrıştırır. Bu sürece dayanarak, biri (RU 98/00190 (06/22/1998)) yazar olan bir dizi patent vardır - Kudymov G.I. ve Studennikov V.V. diğer şeylerin yanı sıra, ortamın ısısını emen bir ısı pompasının yanı sıra konumlandırılırlar, bu nedenle, büyük ölçüde ortamın enerjisinden veya nedeniyle bir hidrojen-oksijen karışımının üretimi burada gerçekleştirilir. örneğin içten yanmalı motorların egzoz gazları gibi genellikle geri dönüşü olmayan bir şekilde kaybedilen ısıya.
Suyun iyonik ürünü
Su iyonlarının konsantrasyonunun ürününün denge değerine suyun iyon ürünü denir. Kv olarak adlandırılır ve 10 -14 Kv \u003d (H +) (OH -)'ye eşittir
Hidrojen indeksi (pH)
pH, hidrojen iyonlarının denge konsantrasyonunun negatif ondalık logaritmasıdır. pH değeri, çözeltinin ortamını belirlemek için kullanılabilir. pH değeri, özel bir cihaz - bir pH metre ve ayrıca göstergeler kullanılarak belirlenir. Ayrıca pH, hidroksit iyonlarının denge konsantrasyonu pH=14-pOH yoluyla belirlenebilir.
çözünürlük ürünü
Az çözünür bir iyonik bileşiğin doymuş bir çözeltisinde, belirli bir sıcaklıkta iyonlarının konsantrasyonunun ürünü sabit bir değerdir ve çözünürlük ürünü olarak adlandırılır. PR sadece az çözünür güçlü elektrolitler için geçerlidir, bu da çözeltide tamamen iyonlara ayrışmaları ve ikincil reaksiyonlara katılmamaları gerektiği anlamına gelir.
Bileşiğin kimyasal formülü birlik dışında stokiyometrik katsayılar içeriyorsa, iyon konsantrasyonları stokiyometrik katsayılarına eşit güçlerde alınır.
Üç hidroliz vakası
Hidroliz için üç seçenek vardır:
1) Katyon hidrolizi, zayıf bir baz katyonu ve güçlü bir asit anyonu içeren bir tuzun hidrolizidir.
2) Anyon hidrolizi, güçlü bir baz katyonu ve zayıf bir asit anyonu içeren bir tuzun hidrolizidir.
3) Katyon ve anyon ile hidroliz, zayıf bir bazdan oluşan bir katyon ve zayıf bir asitten oluşan bir anyon içeren bir tuzun hidrolizidir.
tampon çözeltiler
Bir maddenin (veya sistemin) iç enerjisi, bu maddeyi oluşturan parçacıkların toplam enerjisidir (ayrıca bkz. § 54). Parçacıkların kinetik ve potansiyel enerjilerinden oluşur. Kinetik enerji, parçacıkların öteleme, titreşim ve dönme hareketinin enerjisidir; Potansiyel enerji, parçacıklar arasında etki eden çekim ve itme kuvvetlerinden kaynaklanır.
İç enerji maddenin durumuna bağlıdır. Belirli bir süreçte sistemin AU iç enerjisindeki değişim belirlenebilir. A işini yaparken ve dış ortamdan ısıyı emerken, bazı işlemlerin sonucunda sistem ilk durum 1'den son durum 2'ye geçsin.
Sistemin iç enerjisinin A kadar azalacağı, Q kadar artacağı ve son durumda şuna eşit olacağı açıktır.
nerede ve sistemin ilk (1) ve son (2) durumlarındaki iç enerjisidir. Farkı ile gösterirsek, denklem şu şekilde temsil edilebilir:
![]()
Bu denklem, enerjinin korunumu yasasını ifade eder; buna göre, iç enerjideki değişim, sürecin gerçekleştirilme şekline bağlı değildir, ancak yalnızca sistemin ilk ve son durumları tarafından belirlenir. Bununla birlikte, enerjinin hangi kısmının işe gideceği ve hangi kısmının ısıya dönüşeceği, işlemin gerçekleştirilme yöntemine bağlıdır: iş ile ısı arasındaki oran farklı olabilir. Özellikle, işlem sırasında dış basınca karşı genleşme işi de dahil olmak üzere herhangi bir iş yapılmazsa, yani sistemin hacmi değişmiyorsa,
sabit hacim koşulları altında sistem tarafından emilen ısı nerede.
Son denklem, çeşitli süreçlerde iç enerjideki değişimi belirlemeyi mümkün kılar. Örneğin, bir maddenin sabit bir hacimde ısıtılması durumunda, iç enerjideki değişim bu maddenin ısı kapasitesi ile belirlenir:
Sabit hacimde bir maddenin molar ısı kapasitesi; n madde miktarıdır; son ve ilk sıcaklıklar arasındaki farktır.
Sistemin hacminde bir değişiklik olmadan ilerleyen bir kimyasal reaksiyon durumunda, iç enerjideki değişiklik, bu reaksiyonun zıt işaretli ısı etkisine eşittir.
burada n madde miktarıdır; Cp, bir maddenin sabit basınçtaki molar ısı kapasitesidir.
Bir maddenin kümelenme durumundaki değişikliklerle ve allotropik geçişlerle, entalpideki değişiklik, karşılık gelen dönüşümün ısısına (erime, kaynama, bir değişiklikten diğerine dönüşüm) büyüklük olarak eşittir, ancak ters işaretlidir. Son olarak, bir kimyasal reaksiyon durumunda, entalpideki değişim, zıt işaretle alınan sabit sıcaklık ve sabit basınçta gerçekleştirilen reaksiyonun ısı etkisine eşittir.
Entalpi, iç enerji gibi, bir maddenin enerji durumunu karakterize eder, ancak dış basıncın üstesinden gelmek için harcanan enerjiyi, yani genişleme işini içerir. İç enerji gibi, entalpi de sistemin durumu tarafından belirlenir ve bu duruma nasıl ulaşıldığına bağlı değildir. Gazlar söz konusu olduğunda, belirli bir işlem sırasında ve arasındaki fark önemli olabilir. Gaz içermeyen sistemlerde sürece eşlik eden iç enerji ve entalpi değişimleri birbirine yakındır. Bunun nedeni, maddelerin yoğunlaşmış (yani katı veya sıvı) hallerinde geçirdikleri işlemler sırasında hacim değişikliklerinin genellikle çok küçük olması ve değerin ile karşılaştırıldığında küçük olmasıdır.

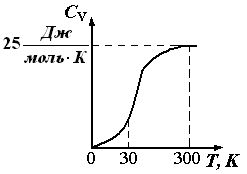 Pirinç. 1.6. Kristalli maddelerin ısı kapasitesinin sıcaklığa bağımlılığı
Pirinç. 1.6. Kristalli maddelerin ısı kapasitesinin sıcaklığa bağımlılığı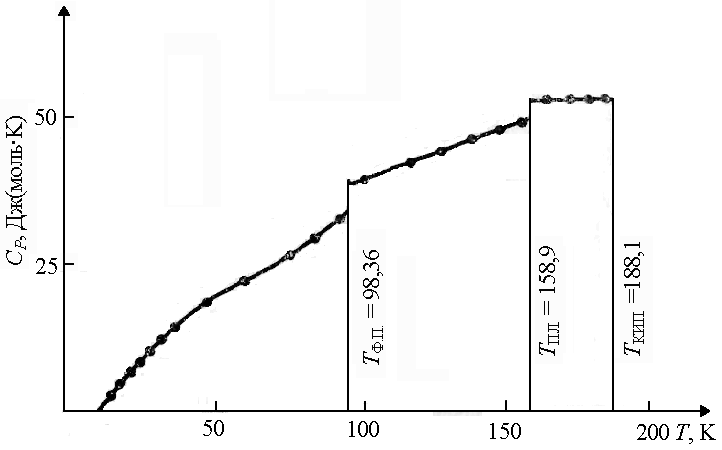
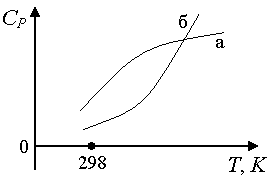 Pirinç. 1.8. Gazların ısı kapasitesinin sıcaklığa bağımlılığı: a) eğri düşük ise ^
T yüksek olanlardan daha büyük bir eğriliğe sahiptir, onu formun ampirik bir güç serisiyle tanımlamak tercih edilir: C P
= a + içindeT + c'/T 2; b) eğri b formun güç serisi: C P = a + içindeT + cT 2
Pirinç. 1.8. Gazların ısı kapasitesinin sıcaklığa bağımlılığı: a) eğri düşük ise ^
T yüksek olanlardan daha büyük bir eğriliğe sahiptir, onu formun ampirik bir güç serisiyle tanımlamak tercih edilir: C P
= a + içindeT + c'/T 2; b) eğri b formun güç serisi: C P = a + içindeT + cT 2




