Struktura e molekulës Struktura e molekulës
STRUKTURA E MOLEKULËS
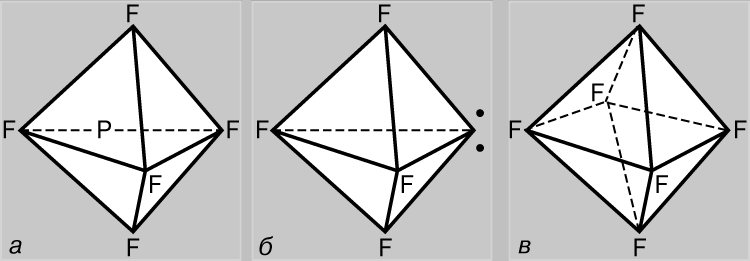
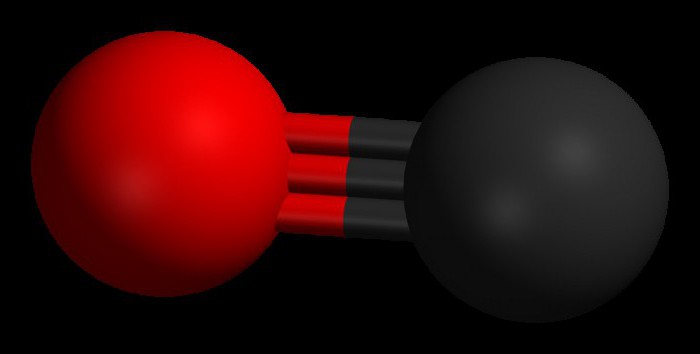
STRUKTURA E MOLEKULËS- (struktura molekulare), renditja e ndërsjellë e atomeve në molekula. Gjatë reaksionet kimike ka një rirregullim të atomeve në molekulat e reagentëve dhe formohen përbërje të reja. Prandaj, një nga problemet themelore kimike është të sqarohet renditja e atomeve në përbërjet fillestare dhe natyra e ndryshimeve në formimin e përbërjeve të tjera prej tyre. Idetë e para për strukturën e molekulave u bazuan në analizën e sjelljes kimike të materies. Këto ide u bënë më të komplikuara pasi u grumbulluan njohuri për vetitë kimike të substancave. Zbatimi i ligjeve bazë të kimisë bëri të mundur përcaktimin e numrit dhe llojit të atomeve që përbëjnë molekulën e një përbërjeje të caktuar; ky informacion gjendet në formulën kimike. Me kalimin e kohës, kimistët kuptuan se një formulë kimike nuk mjafton për të karakterizuar me saktësi një molekulë, pasi ka molekula izomere që kanë të njëjtat formula kimike, por veti të ndryshme. Ky fakt i çoi shkencëtarët në idenë se atomet në një molekulë duhet të kenë një topologji të caktuar, të stabilizuar nga lidhjet midis tyre. Kjo ide u shpreh për herë të parë në vitin 1858 nga kimisti gjerman F. Kekule. Sipas ideve të tij, një molekulë mund të përshkruhet duke përdorur një formulë strukturore, e cila tregon jo vetëm vetë atomet, por edhe lidhjet midis tyre. Lidhjet ndëratomike duhet gjithashtu të korrespondojnë me rregullimin hapësinor të atomeve. Fazat e zhvillimit të ideve për strukturën e molekulës së metanit janë paraqitur në Fig. 1. Struktura r korrespondon me të dhënat moderne: molekula ka formën e një tetraedri të rregullt, në qendër të të cilit ka një atom karboni, dhe në kulmet - atomet e hidrogjenit.
Oriz. 1. KATËR METODAT PËR IMAZHIMIN E MOLEKULËS SË METANIT. a - formula kimike. Tregohet vetëm numri dhe lloji i atomeve; b - formula strukturore; c - skema reale e molekulës; d - rregullimi hapësinor i atomeve në një molekulë.
Studime të tilla, megjithatë, nuk thanë asgjë për madhësinë e molekulave. Ky informacion u bë i disponueshëm vetëm me zhvillimin e metodave të përshtatshme fizike. Më e rëndësishmja prej tyre ishte difraksioni me rreze X. Nga shpërndarja e fotove rrezet x në kristalet, u bë e mundur të përcaktohet pozicioni i saktë i atomeve në një kristal, dhe për kristalet molekulare, ishte e mundur të lokalizoheshin atomet në një molekulë të vetme. Metoda të tjera përfshijnë difraksionin e elektroneve ndërsa kalojnë nëpër gazra ose avuj dhe analizën e spektrave rrotullues të molekulave. I gjithë ky informacion është vetëm ide e pergjithshme për strukturën e molekulës. natyrës lidhjet kimike ju lejon të eksploroni modernen teoria kuantike. Dhe megjithëse struktura molekulare nuk mund të llogaritet ende me një saktësi mjaft të lartë, të gjitha të dhënat e njohura mbi lidhjet kimike mund të shpjegohen. Madje është parashikuar ekzistenca e llojeve të reja të lidhjeve kimike.
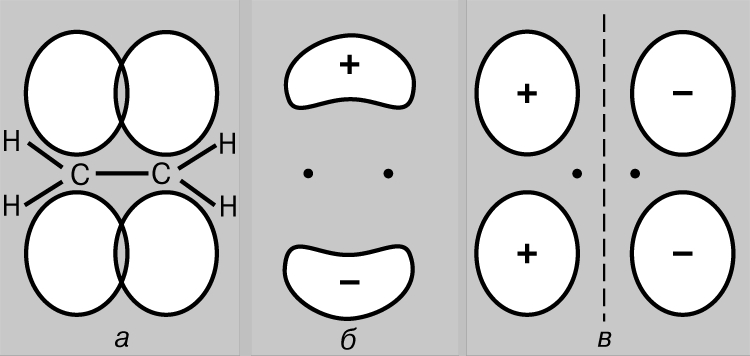
Lidhje e thjeshtë kovalente. Molekula e hidrogjenit H 2 përbëhet nga dy atome identike. Sipas matjet fizike gjatësia e lidhjes - distanca midis bërthamave të atomeve të hidrogjenit (protoneve) - është 0,70 (1 = 10-8 cm), që i përgjigjet rrezes së atomit të hidrogjenit në gjendjen bazë, d.m.th. në gjendjen më të ulët të energjisë. Lidhja midis atomeve mund të shpjegohet vetëm duke supozuar se elektronet e tyre janë të lokalizuara kryesisht midis bërthamave, duke formuar një re të grimcave lidhëse të ngarkuara negativisht dhe duke mbajtur së bashku protonet e ngarkuar pozitivisht. Konsideroni dy atome hidrogjeni në gjendjen bazë, d.m.th. gjendja në të cilën elektronet e tyre janë në orbitalën 1s. Secili prej këtyre elektroneve mund të konsiderohet si një valë, dhe orbitalja si një valë në këmbë. Kur atomet afrohen me njëri-tjetrin, orbitalet fillojnë të mbivendosen (Fig. 2), dhe, si në rastin e valëve të zakonshme, ndodh interferenca - mbivendosja e valëve (funksionet valore) në rajonin e mbivendosjes. Nëse shenjat e funksioneve valore janë të kundërta, atëherë valët shkatërrojnë njëra-tjetrën gjatë interferencës (ndërhyrje shkatërruese), dhe nëse janë të njëjta, atëherë ato shtohen (ndërhyrje konstruktive). Kur atomet e hidrogjenit afrohen me njëri-tjetrin, dy rezultate janë të mundshme në varësi të faktit nëse funksionet valore janë në fazë (Fig. 2a) ose në antifazë (Fig. 2b). Në rastin e parë, do të ndodhë ndërhyrje konstruktive, në të dytën - shkatërruese dhe do të shfaqen dy orbitale molekulare; njëri prej tyre karakterizohet nga një densitet i lartë në rajonin midis bërthamave (Fig. 2c), ndërsa tjetri karakterizohet nga një densitet i ulët (Fig. 2d) - në fakt, një nyje me amplitudë zero që ndan bërthamat.
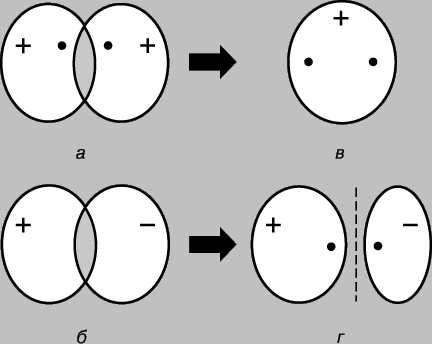
Oriz. 2. REZULTATET E MBYVENDOSJES SË ORBITALEVE 1S TË ATOMEVE TË HIDROGJENIT. a - fazat e funksioneve valore përkojnë; vërehet interferenca konstruktive dhe si rezultat formohet një orbitale molekulare me densitet të lartë në rajonin ndërmjet bërthamave (c); b - fazat e funksioneve valore nuk përkojnë; ndodh interferenca shkatërruese, duke rezultuar në formimin e një orbitale molekulare me një densitet të ulët midis atomeve (r).
Kështu, kur atomet e hidrogjenit afrohen dhe ndërveprojnë, orbitalet 1s formojnë dy orbitale molekulare dhe dy elektrone duhet të mbushin njërën prej tyre. Elektronet në atome gjithmonë përpiqen të zënë pozicionin më të qëndrueshëm - atë në të cilin energjia e tyre është minimale. Për orbitalin e treguar në Fig. 2c, një densitet i lartë është karakteristik në rajonin midis bërthamave dhe çdo elektron që zë këtë orbital do të jetë në shumicën e rasteve pranë bërthamave të ngarkuara pozitivisht, d.m.th. e tij energji potenciale do të jetë i vogël. Përkundrazi, orbitalja e treguar në Fig. 2d, dendësia maksimale ndodh në rajonet e vendosura në të majtë dhe në të djathtë të bërthamave, dhe energjia e elektroneve në këtë orbital do të jetë e lartë. Pra, elektronet kanë më pak energji kur zënë orbitalin në, dhe kjo energji është edhe më pak se ajo që do të kishin nëse atomet do të ishin pafundësisht të ndarë nga njëri-tjetri. Meqenëse ka vetëm dy elektrone në këtë rast, të dy mund të zënë një orbitë energjikisht më të favorshme nëse rrotullimet e tyre janë antiparalele (parimi Pauli). Prandaj, energjia e një sistemi të përbërë nga dy atome hidrogjeni zvogëlohet kur atomet i afrohen njëri-tjetrit, dhe për të hequr atomet nga njëri-tjetri, kërkohet energji, e barabartë me energjinë formimi i një molekule të qëndrueshme hidrogjeni H2. Vini re se një kusht i domosdoshëm për ekzistencën e një molekule hidrogjeni është lokalizimi preferencial i elektroneve midis bërthamave në përputhje me atë që kemi thënë tashmë më lart. Orbitalja molekulare c quhet orbitale lidhëse dhe orbitalja r quhet orbitale liruese. Konsideroni tani afrimin e dy atomeve të heliumit (numri atomik 2). Edhe këtu, mbivendosja e orbitaleve 1s rezulton në formimin e dy orbitaleve molekulare, njëra prej të cilave korrespondon me një energji më të ulët dhe tjetra me një energji më të lartë. Këtë herë, megjithatë, 4 elektrone duhet të vendosen në orbitale, 2 elektrone nga çdo atom helium. Vetëm dy prej tyre mund të mbushin orbitalën e lidhjes me energji të ulët, dy të tjerat duhet të zënë orbitalën me energji të lartë r. Ulja e energjisë për shkak të lokalizimit të favorshëm të çiftit të parë është afërsisht e barabartë me rritjen e energjisë për shkak të të pafavorshmes. pozicioni i çiftit të dytë. Tani afrimi i atomeve nuk jep një fitim në energji, dhe heliumi molekular He2 nuk formohet. Kjo mund të ilustrohet lehtësisht me një diagram (Fig. 3); orbitale të ndryshme mbi të janë të paraqitura në formë nivelet e energjisë ku mund të gjenden elektronet. Këto të fundit tregohen me shigjeta që tregojnë lart e poshtë për të dalluar drejtimet e rrotullimeve. Dy elektrone mund të zënë të njëjtën orbitale vetëm nëse rrotullimet e tyre janë antiparalele.
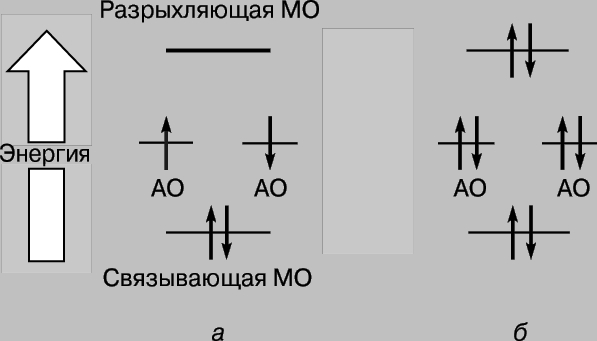
Oriz. 3. NDRYSHIMET NË ENERGJINË E ELEKTRONIT gjatë formimit të (a) hidrogjenit dhe (b) molekulave të heliumit. Elektronet tregohen me shigjeta që tregojnë lart e poshtë për të dalluar rrotullimet e tyre. Orbitalet molekulare me energji të ulët janë të lidhura, ndërsa orbitalet molekulare me energji të lartë janë antilidhëse.
Këto parime të përgjithshme përmbushen në formimin e molekulave nga atomet. Sapo dy atome afrohen aq afër sa orbitalet e tyre atomike (AO) fillojnë të mbivendosen, shfaqen dy orbitale molekulare (MO): njëra lidhet, tjetra po lirohet. Nëse secili prej AO-ve ka vetëm një elektron, të dy mund të zënë një lidhje MO me energji më të ulët se ajo e AO dhe të formojnë një lidhje kimike. Lidhjet e këtij lloji, të quajtura tani kovalente, kanë qenë prej kohësh të njohura për kimistët (ideja e një lidhjeje kovalente formoi bazën e teorisë oktet të lidhjes të formuluar nga kimisti fizik amerikan G. Lewis në 1916). Formimi i tyre u shpjegua me shoqërizimin e një çifti elektronesh nga atomet që ndërveprojnë. Sipas koncepteve moderne, forca e lidhjes varet nga shkalla e mbivendosjes së orbitaleve përkatëse. Të gjitha sa më sipër sugjerojnë se lidhjet midis atomeve mund të formohen gjatë shoqërizimit të jo vetëm dy, por edhe një ose tre elektroneve. Megjithatë, ato do të jenë më të dobëta se normalja lidhjet e valencës arsyet e mëposhtme. Kur krijohet një lidhje me një elektron, energjia e vetëm një elektroni zvogëlohet dhe në rastin e formimit të lidhjes si rezultat i shoqërizimit të tre elektroneve, energjia e dy prej tyre zvogëlohet, ndërsa e treta, përkundrazi. rritet, duke kompensuar uljen e energjisë së njërit prej dy elektroneve të parë. Si rezultat, lidhja me tre elektrone që rezulton është dy herë më e dobët se lidhja e zakonshme kovalente. Socializimi i një dhe tre elektroneve ndodh gjatë formimit jon molekular molekulat e hidrogjenit H 2+ dhe HHe, përkatësisht. Në përgjithësi, lidhjet e këtij lloji janë të rralla, dhe molekulat përkatëse janë shumë reaktive.
Valence. Obligacionet donator-pranues. Të gjitha sa më sipër supozojnë se atomet mund të formojnë aq lidhje kovalente sa ka orbitale të zëna nga një elektron, por kjo nuk është gjithmonë kështu. (Në skemën e pranuar të mbushjes AO, fillimisht tregoni numrin e guaskës, pastaj llojin e orbitalit dhe më pas, nëse ka më shumë se një elektron në orbital, numrin e tyre (mbishkrimin). Pra, shënimi (2s) 2 do të thotë se orbitalja s e shtresës së dytë përmban dy elektrone.) Atomi i karbonit në gjendjen bazë (3P) ka konfigurimin elektronik (1s) 2 (2s) 2 (2px) (2py), ndërsa dy orbitale nuk janë të mbushura. , d.m.th. përmbajnë një elektron. Megjithatë, komponimet dyvalente të karbonit janë shumë të rralla dhe kanë aktivitet të lartë kimik. Zakonisht, karboni është katërvalent, dhe kjo për faktin se kërkon shumë pak energji për të shkuar në gjendjen e ngacmuar 5S (1s) 2 (2s) (2px)(2py)(2pz) me katër orbitale boshe. Kostot e energjisë që lidhen me kalimin e një elektroni 2s në një orbitale të lirë 2p kompensohen më shumë nga energjia e çliruar gjatë formimit të dy lidhjeve shtesë. Për formimin e AO të paplotësuar është e nevojshme që ky proces të jetë energjikisht i favorshëm. Atomi i azotit me konfigurimin elektronik (1s) 2 (2s)2(2px)(2py)(2pz) nuk formon komponime pesëvalente, pasi energjia e nevojshme për të transferuar elektronin 2s në orbitalin 3d për të formuar konfigurimin pesëvalent (1s ) 2 (2s )(2px)(2py)(2pz)(3d) është shumë i madh. Në mënyrë të ngjashme, atomet e borit me konfigurimin e zakonshëm (1s) 2 (2s) 2 (2p) mund të formojnë komponime trevalente në gjendjen e ngacmuar (1s) 2 (2s) (2px) (2py), e cila ndodh kur një elektron 2s kalon në 2p -AO, por nuk formon komponime pesëvalente, pasi kalimi në gjendjen e ngacmuar (1s)(2s)(2px)(2py)(2pz), për shkak të transferimit të njërit prej 1s-elektroneve në më shumë nivel të lartë, kërkon shumë energji. Ndërveprimi i atomeve me formimin e një lidhjeje ndërmjet tyre ndodh vetëm në prani të orbitaleve me energji të afërta, d.m.th. orbitale me të njëjtin numër kuantik kryesor. Të dhënat përkatëse për 10 elementët e parë të tabelës periodike janë përmbledhur më poshtë. Gjendja valore e një atomi është gjendja në të cilën ai formon lidhje kimike, siç është gjendja 5S për karbonin katërvalent.
Këto modele tregohen në shembujt e mëposhtëm:
Të gjitha sa më sipër vlejnë vetëm për atomet neutrale. Jonet dhe atomet përkatëse kanë numër të ndryshëm elektronesh; jonet mund të kenë të njëjtën valencë si atomet e tjera me të njëjtin numër elektronesh. Pra, jonet N + dhe B kanë të njëjtin numër elektronesh (gjashtë) si atomi neutral i karbonit, dhe, në përputhje me rrethanat, ato janë tetravalente. Jonet e amonit NH 4 + dhe hidridi i borit BH 4 - formojnë kripëra komplekse dhe në të konfigurim elektronik të ngjashme me metanin CH 4 . Le të supozojmë tani se molekulat e amoniakut NH 3 dhe trifluoridit të borit BF 3 i afrohen njëra-tjetrës. Kur një elektron kalon nga një atom azoti në një atom bori, marrim dy jone, NH 3 + dhe BF 3 - , secili me një orbital bosh, i cili mund të çojë në formimin e një lidhje kovalente. Molekula H 3 N-BF 3 është një analog elektronik i 1,1,1-trifluoroetan H 3 C-CF 3 . Lidhjet e formuara si rezultat i transferimit ndëratomik të elektroneve të ndjekura nga formimi i një lidhje kovalente quhen lidhje dhuruese-pranuese.
Gjeometria e molekulave. Hibridizimi. Të gjitha orbitalet atomike, përveç s, janë sferikisht asimetrike dhe shkalla e mbivendosjes së tyre me AO të atomeve të tjera varet nga orientimi i ndërsjellë i orbitaleve. Kështu, p-AO do të mbivendoset me AO të një atomi tjetër në shumica, nëse kjo e fundit ndodhet përgjatë boshtit të saj (Fig. 4a). Kjo do të thotë që lidhjet e formuara si rezultat i mbivendosjes së AO duhet të kenë një gjeometri specifike. Konsideroni një atom karboni në gjendjen 5S. Ai ka nga një elektron secili në tre orbitale p dhe në një orbitale s të katërt, sferikisht simetrike. Duket se tre lidhjet që ajo formon do të ndryshojnë nga e katërta, ndërsa lidhjet p do të vendosen në drejtime pingule reciproke përgjatë boshteve p-AO. Në fakt, ekziston një pamje tjetër, krejtësisht simetrike. Mënyra më e lehtë për ta shpjeguar është si më poshtë. Bashkësia e orbitaleve (2s)+(2px)+(2py)+(2pz) është një sasi e caktuar "hapësire orbitale" e aftë të mbajë katër palë elektrone. Ne mund të marrim një përshkrim ekuivalent të kësaj situate duke përzier të gjitha orbitalet dhe duke e ndarë shumën e tyre në katër pjesë të barabarta, në mënyrë që secila prej orbitaleve të përziera ose hibride që rezultojnë të ketë një palë elektrone. Prandaj, gjendja 5S e karbonit mund të përfaqësohet si (1s)2(t 1)(t 2)(t 3)(t 4), ku t i janë orbitale hibride, gjë që shpjegon me sukses formimin e një molekule simetrike tetravalente karboni. Le të shqyrtojmë tani se çfarë ndodh kur p-AO përzihet me s-AO. Forcimi i gjysmës së shtangës p gjatë ndërhyrjes do të shoqërohet pa ndryshim nga një dobësim i gjysmës tjetër të tij (Fig. 4b), duke rezultuar në formimin e një orbitale hibride asimetrike (Fig. 4c). Ajo do të mbivendoset në mënyrë efektive nga orbitale të tjera të orientuara në të njëjtin drejtim, me formimin e lidhjeve mjaftueshëm të forta. Kjo është një nga arsyet pse atomi i karbonit preferon të krijojë lidhje nëpërmjet hibridizimit të AO. Por ka edhe një arsye tjetër. Konsideroni një përbërje tipike karboni tetravalent, siç është metani CH 4 . Në të, çdo atom hidrogjeni mbahet afër atomit të karbonit nga një palë elektronesh të përbashkëta. Këto çifte sprapsin njëra-tjetrën dhe konfigurimi optimal i molekulës është i tillë që ato të jenë në distancën maksimale të mundshme nga njëra-tjetra. Në këtë rast, atomet e hidrogjenit do të vendosen në kulmet e një tetraedri të rregullt, dhe atomi i karbonit do të jetë në qendër të tij. Një gjeometri e tillë mund të realizohet duke përdorur të ashtuquajturat. sp 3 orbitalet hibride, secila prej të cilave formohet nga 1/4 e 2s-AO dhe një nga 2p-AO. Të gjitha këto orbitale janë identike në formë, formojnë lehtësisht lidhje dhe drejtohen nga atomi i karbonit në qendër të një tetraedri të rregullt në katër kulmet e tij (Fig. 1d).
Oriz. 4. MBYVENDOSJA E ORBITALEVE P ME ORBITALEN E NJË ATOMI TJETËR është më efikase kur ky i fundit është i orientuar përgjatë të njëjtit bosht (a). Mbivendosja e orbitales atomike p me orbitalin s (b) çon në formimin e një "trapi" asimetrike (c).
Atomi i azotit mund të krijojë lidhje vetëm me ndihmën e 2p-AO, këndet ndërmjet të cilave do të ishin 90°, por zmbrapsja e ndërsjellë e çifteve të elektroneve lidhëse dhe çifteve të elektroneve jolidhëse të guaskës së dytë minimizohet nëse "tetraedralja" orbitalet sp3 marrin pjesë në formimin e lidhjeve. Këtu, megjithatë, shfaqet një veçori tjetër. Për jonin N+, konfigurimet (1s)2(2s)(2p)3 dhe (1s)2(t) 4, ku t janë AO hibride sp 3, janë me të vërtetë ekuivalente. Një gjë tjetër është atomi neutral i azotit, elektroni i 7-të i të cilit mund të zërë ose 2s-AO, dhe më pas do të merret konfigurimi (1s)2(2s)(2p) 4, ose t-AO në konfigurimin (1s )2(t) 5 . Meqenëse 2s-AO ndodhet nën 2p-AO dhe për rrjedhojë nën çdo orbitale të hibridizuar sp, konfigurimi i parë është energjikisht më i favorshëm dhe do të pritej që, duke qenë të barabarta nga gjërat e tjera, azoti trivalent do të preferonte konfigurimin "të pahibridizuar". Megjithatë, zmbrapsja e ndërsjellë e çifteve të elektroneve është me sa duket e mjaftueshme që të ndodhë hibridizimi, në të cilin këndet e lidhjes në një përbërje të tillë azoti si amoniaku NH3 janë afër këndeve përkatëse në një tetraedron të rregullt, d.m.th. deri në 109°. E njëjta gjë vlen edhe për oksigjenin dyvalent në përbërjen e molekulës së ujit H 2 O. Në të gjitha këto raste, atomet e lidhur zënë tre (ose dy) kulme të tetraedrit, dhe çiftet e elektroneve të vetme të shtresës së dytë zënë kulmet e mbetura. . Një arsyetim i ngjashëm vlen edhe për elementët e tjerë tipikë të grupeve IV, V dhe VI të tabelës periodike. Elementet katërvalente të grupit IV (Si, Ge, Sn dhe Pb) gjithmonë formojnë struktura tetraedrale, megjithatë, elementët e tjerë të grupeve V dhe VI (P, S, As, Se, Sb, Te) ndryshojnë nga azoti dhe oksigjeni dhe formojnë komponime. me kënde lidhjeje, afër 90°. Me sa duket për shkak të madhësi më të madhe këto atome të zmbrapsjes së ndërsjellë elektronet e valencës nuk mjafton për të bërë të mundur hibridizimin e vërejtur për N dhe O.
Lidhjet që përfshijnë d-orbitalet. Ndryshe nga azoti, atomi i fosforit mund të formojë pesë lidhje kovalente. Në gjendjen bazë, fosfori ka konfigurimin (1s) 2 (2s) 2 (2p) 6 (3s) 2 (3p x) (3p y) (3p z) dhe është trevalent, duke formuar, si azoti, komponime të PF. 3 lloj. Sidoqoftë, në këtë rast, pjesëmarrja e elektroneve 3s në formimin e lidhjeve është e mundur, pasi d-AO (3d) ka të njëjtin parim numër kuantik. Në të vërtetë, janë të njohura edhe përbërjet e fosforit pesëvalent të tipit PF 5, ku fosfori është në gjendje valence +5, në përputhje me konfigurimin elektronik (1s) 2 (2s) 2 (2p) 6 (3s) (3p x)( 3p y)(3p z)(3d); lidhjet në këtë rast formohen si rezultat i hibridizimit sp 3 d (dmth. si rezultat i përzierjes së një s-, tre p- dhe një d-AO). Bipiramida trekëndore është struktura optimale nga pikëpamja e reduktimit të zmbrapsjes së ndërsjellë të çifteve të elektroneve valente (Fig. 5a). Squfuri mund të jetë jo vetëm dyvalent, por edhe tetra- (SF4) dhe gjashtëvalent (SF 6), duke qenë në gjendjet (1s) 2 (2s) 2 (2p) 6 (3s) 2 (3p x) (3p y)( 3p z)(3d) dhe (1s) 2 (2s) 2 (2p) 6 (3s)(3p x)(3p y)(3p z)(3d 1)(3d 2), respektivisht. Në përbërjet e squfurit tetravalent, zmbrapsja e ndërsjellë e elektroneve të shtresës së tretë optimizohet nga hibridizimi i orbitaleve të të gjitha elektroneve të tij. Struktura e përbërjeve të këtij lloji është e ngjashme me atë të PF 5, por një nga kulmet e bipiramidës trekëndore është e zënë nga një palë elektrone të vetme të shtresës së tretë (Fig. 5b). Në përbërjet gjashtëvalente të squfurit, zmbrapsja reciproke e elektroneve minimizohet gjatë hibridizimit sp 3 d 2, kur të gjitha orbitalet janë ekuivalente dhe të drejtuara drejt majave të një tetëedri të rregullt (Fig. 5c).
Oriz. 5. PENTAFLUORID I FOSFORIT (a) formohet me pjesëmarrjen e elektronit 3s. Molekula e tetrafluoridit të squfurit (b) ka një formë të ngjashme, por një nga kulmet e bipiramidës trekëndore është e zënë nga një palë elektrone të pandarë të shtresës së tretë (pikat). Te heksafluoridi i squfurit (c), të gjitha orbitalet janë ekuivalente dhe të drejtuara në kulmet e një tetëedri të rregullt.
Deri më tani, ne kemi konsideruar vetëm ato elemente të tabelës periodike në të cilat predha me orbitale d janë ose të mbushura plotësisht ose plotësisht të lira. Le të ndalemi tani në elementet kalimtare, në të cilat këto guaska nuk janë mbushur plotësisht. Energjia e elektroneve në orbitale të ndryshme të shtresës së tretë rritet në rendin e mëposhtëm: 3s
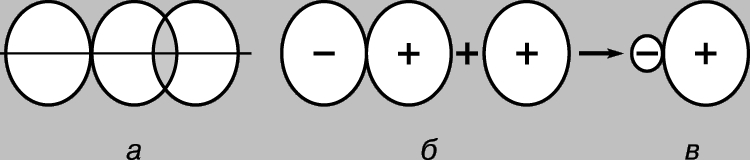
Lidhje të shumta. Një nga përbërjet e njohura të karbonit është etilen C2H4, në të cilin çdo atom karboni është i lidhur vetëm me tre atome të tjerë. Për analogji me borin, mund të supozohet se një gjeometri e tillë do të jetë optimale, në të cilën orbitalet hibride sp 2 shtrihen në të njëjtin plan. Në këtë rast, çdo atom karboni do të ketë një orbitale p të papërdorur (në hibridizimin sp 2), e cila përmban një nga katër elektronet valente. Nëse të gjashtë atomet e etilenit shtrihen në të njëjtin rrafsh, atëherë dy p-AO të papërdorura mbivendosen me njëri-tjetrin siç tregohet në Fig. 6, a. Kjo mbivendosje çon në formimin e një çifti MO: një MO lidhëse (Fig. 6b) dhe një MO liruese (Fig. 6c). Meqenëse secila prej tyre përmban vetëm një elektron, ato mund të formojnë një lidhje MO me energji të ulët. Kështu, një lidhje shtesë lind midis atomeve të karbonit dhe formula strukturore e etilenit ka formën
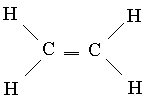
Ky lloj i ri lidhjesh ndryshon nga ato të formuara nga mbivendosja e orbitaleve përgjatë vijës së lidhjes së atomeve në dy aspekte. Lidhje të tipit të fundit, single Lidhjet C-C, janë simetrike në aksi, prandaj nuk ndikohen nga rrotullimi i grupeve që lidhin. Në të kundërt, mbivendosja e orbitaleve p varet nëse të gjashtë atomet në molekulën e etilenit shtrihen në të njëjtin plan, pasi p-AOs duhet të jenë paralelë për mbivendosje optimale. Kështu, nëse rrotullimi rreth një lidhjeje të vetme C-C mund të ndodhë relativisht lirshëm, atëherë rreth një lidhje dyfishe C=C është shumë e vështirë. Në të vërtetë, molekula e etilenit është një strukturë e ngurtë e sheshtë. Dallimi i dytë ka të bëjë me shkallën e mbivendosjes orbitale. Mbivendosja e kryqëzuar e p-AO është relativisht joefikase, dhe për këtë arsye ky lloj lidhjeje është i dobët. Prandaj, etileni është më reaktiv se komponimet e ngopura që kanë vetëm lidhje të vetme.
Oriz. 6. NËSE TË GJASHTË ATOMET E ETILENIT shtrihen në të njëjtin rrafsh, atëherë dy p-orbitalet atomike të papërdorura marrin pjesë në mbivendosjen tërthore (a). Kjo çon në formimin e një çifti orbitalesh molekulare - lidhja (b) dhe lirimi (c).
Lidhjet e formuara kur orbitalet mbivendosen përgjatë vijës së lidhjes së atomeve (mbivendosje gjatësore) quhen lidhje s, dhe kur mbivendosen tërthor - lidhje p. Molekulat e disa përbërjeve, të tilla si acetilen C 2 H 2, përmbajnë lidhje të trefishta. Në to, çdo atom karboni është i lidhur me fqinjin e tij me lidhje s të formuara nga orbitalet hibride sp. Ato janë kolineare, kështu që katër atome në një molekulë acetilen shtrihen në të njëjtën vijë të drejtë. P-AO-të e mbetura të atomeve të karbonit, kur mbivendosen, formojnë dy lidhje p.
komponimet aromatike. Molekula e benzenit C6H6 përfaqësohet si një unazë me gjashtë anëtarë të atomeve të karbonit, secila prej të cilave gjithashtu ka një atom hidrogjeni të bashkangjitur (Fig. 7a). Meqenëse çdo atom karboni ka tre fqinjë, mund të supozohet se lidhjet përkatëse janë formuar si rezultat i hibridizimit sp 2 dhe shtrihen në të njëjtin rrafsh në një kënd prej 120 ° me njëra-tjetrën. Në të vërtetë, molekula e benzenit është një strukturë e sheshtë. P-AO të papërdorura të atomeve të karbonit mund të formojnë lidhje p (Fig. 7b), por për benzenin situata është më e ndërlikuar se në rastet e shqyrtuara më sipër, kur lidhjet u krijuan si rezultat i mbivendosjes së çifteve AO. Në benzen, 2p-AO e çdo atomi karboni duhet të mbivendoset në mënyrë të barabartë në mënyrë efektive me 2p-AO të të gjithë atomeve fqinjë. (Këtu mund të nxjerrim një analogji me interferencën valore të shumëfishtë duke krahasuar mbivendosjen e orbitaleve në një molekulë benzeni me mbivendosjen e valëve të difraktuara në dy çarje ose në një grilë difraksioni.) Si rezultat, për benzenin marrim një grup molekularesh unazore orbitalet që mbulojnë të gjashtë atomet e karbonit (Fig. 7, në). Energjia totale e sistemit me një konfigurim të tillë elektronik është më e vogël se nëse p-AO-të formojnë lidhje të zakonshme p në çifte. Në të vërtetë, benzeni është më i qëndrueshëm dhe më pak aktiv sesa mund të pritet bazuar në strukturën e tij "klasike" (Fig. 7d). Të gjitha lidhjet në molekulën e saj janë simetrike, dhe gjatësitë e tyre janë të njëjta, dhe për sa i përket forcës ato zënë një pozicion të ndërmjetëm midis lidhjeve të vetme dhe të dyfishta. Njihen edhe komponime të tjera në të cilat p-elektronet marrin pjesë në formimin e MO "shumëqendrore" dhe për të cilat karakteristika të ngjashme gjatësia e lidhjes dhe aktiviteti kimik.
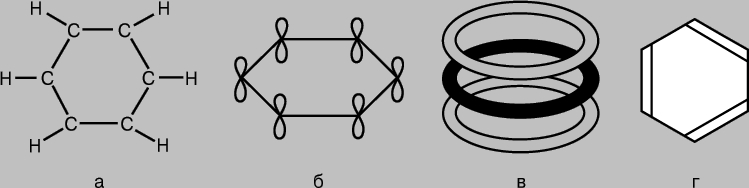
Oriz. 7. MOLEKULA E BENZENIT C 6 H 6 është një unazë gjashtë-anëtarësh e atomeve të karbonit, secila prej të cilave është gjithashtu e lidhur me një atom hidrogjeni (a). P-orbitalet "shtesë" të atomeve të karbonit mbivendosen me formimin e lidhjeve p (b), duke rezultuar në një grup orbitalesh molekulare unazore që mbulojnë të gjashtë atomet (c). Si rezultat, benzeni është një përbërës më i qëndrueshëm dhe më pak aktiv sesa mund të pritet nga struktura e tij "klasike" (d).
Komponimet që përmbajnë lidhje shumëqendrore. Edhe në molekula të tilla të thjeshta si CH4, orbitalet individuale molekulare domosdoshmërisht ndërveprojnë me njëra-tjetrën. Prandaj, ideja e lidhjeve kovalente të lokalizuara me dy qendra mund të konsiderohet vetëm si një përafrim. Sidoqoftë, si rregull, këto ndërveprime janë të dobëta, pasi shkalla e mbivendosjes orbitale është e vogël (me përjashtim të p-MO në përbërjet aromatike dhe të ngjashme). Sidoqoftë, ekzistenca e molekulave me AO të shumëfishta të mbivendosura përgjegjëse për formimin e lidhjeve përmes ndarjes së elektroneve nga tre ose më shumë atome nuk mund të përjashtohet. Një shembull është diborani B 2 H 6 , i cili ka gjashtë palë elektrone valente; kjo nuk mjafton për të formuar shtatë lidhjet e nevojshme për të krijuar strukturën klasike H3B-BH3. H. Longe-Higgins propozoi strukturën e diboranit, të paraqitur në fig. 8, a. Në këtë strukturë, atomet qendrore të hidrogjenit lidhen me lidhje treqendrore të formuara si rezultat i mbivendosjes së orbitaleve hibride sp3 të dy atomeve të borit me 1s-AO të atomit të hidrogjenit (Fig. 8b). Katër nga gjashtë çiftet e elektroneve të valencës janë të përfshirë në formimin e lidhjeve s të zakonshme me atome hidrogjeni "terminale", dhe dy çifte - lidhje treqendrore. Një shembull më kompleks i një lidhjeje shumëqendrore është dhënë nga molekula dibenzenekrom (Fig. 8c). Unazat e benzenit në këtë molekulë janë të lidhura me atomin e metalit me anë të orbitaleve komplekse shumëqendrore, të cilat formohen si rezultat i mbivendosjes së p-MO të benzenit me 3d-, 4s- dhe 4p-AO të atomit qendror. Komponime të tjera të ngjashme njihen gjithashtu që kanë një strukturë sanduiç.
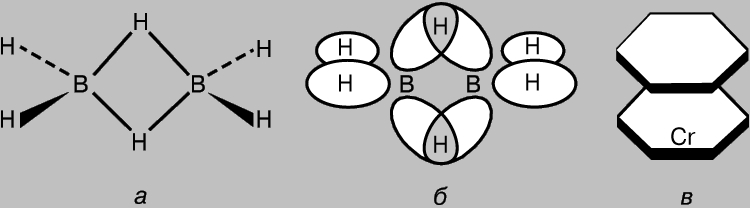
Oriz. 8. Në DIBORANE (a), atomet e hidrogjenit lidhen me lidhje treqendrore të formuara si rezultat i mbivendosjes së orbitaleve hibride sp3 të dy atomeve të borit me orbitalën atomike 1s të hidrogjenit (b). Një shembull më kompleks i formimit të lidhjeve të këtij lloji është molekula e dibenzenekromit (c).
perspektivat. Deri më sot, parimet e përgjithshme të strukturës së molekulave mund të konsiderohen të vendosura. Janë zhvilluar metoda fiziko-kimike për përcaktimin e strukturës së molekulave komplekse, përfshirë ato biologjike. Në të ardhmen e afërt, përparimi është i mundur në dy drejtime të ndërlidhura. Duhet pritur, së pari, një rritje në saktësinë e llogaritjeve mekanike kuantike dhe, së dyti, një përmirësim metodat eksperimentale matjet e parametrave molekularë përkatës.
LITERATURA
Kondratiev V.N. Struktura e atomeve dhe molekulave. M., 1959 Coulson C. Valence. M., 1965 Slater J. Struktura elektronike molekulat. M., 1965 Cartmell E., Fouls G. Valenca dhe struktura e molekulave. M., 1979
Monoksidi i karbonit, i njohur gjithashtu si monoksidi i karbonit, ka një përbërje molekulare shumë të fortë, është inert në vetitë kimike dhe është pak i tretshëm në ujë. Ky përbërës është gjithashtu tepër toksik; kur hyn në sistemin e frymëmarrjes, kombinohet me hemoglobinën e gjakut dhe ndalon transportimin e oksigjenit në inde dhe organe.
Emrat kimikë dhe formula
Monoksidi i karbonit njihet edhe me emra të tjerë, duke përfshirë monoksidin e karbonit II. Në jetën e përditshme, zakonisht quhet monoksid karboni. Ky monoksid karboni është një gaz helmues, pa ngjyrë, pa shije dhe erë. Formula e tij kimike është CO dhe masa e një molekule është 28,01 g/mol.

Ndikimi në trup
Monoksidi i karbonit kombinohet me hemoglobinën për të formuar karboksihemoglobinë, e cila nuk ka kapacitet transportues të oksigjenit. Thithja e avujve të tij shkakton dëmtim të sistemit nervor qendror (qendror sistemi nervor) dhe mbytje. Mungesa e oksigjenit që rezulton shkakton dhimbje koke, marramendje, ulje të ritmit të zemrës dhe ritmit të frymëmarrjes, duke çuar në të fikët dhe vdekjen e trupit.

Gaz toksik
Monoksidi i karbonit prodhohet nga djegia e pjesshme e substancave që përmbajnë karbon, për shembull në motorë djegia e brendshme. Përbërja përmban 1 atom karboni të lidhur në mënyrë kovalente me 1 atom oksigjen. Monoksidi i karbonit është shumë toksik dhe është një nga shkaqet më të zakonshme të helmimeve fatale në mbarë botën. Ekspozimi mund të shkaktojë dëmtim të zemrës dhe organeve të tjera.
Cilat janë përfitimet e monoksidit të karbonit?
Megjithë toksicitetin e tij serioz, monoksidi i karbonit është jashtëzakonisht i dobishëm - falë teknologjive moderne, një numër produktesh jetike krijohen prej tij. Monoksidi i karbonit, edhe pse sot konsiderohet si një ndotës, ka qenë gjithmonë i pranishëm në natyrë, por jo në sasi të tilla si, për shembull, dioksidi i karbonit.
Ata që besojnë se përbërja e monoksidit të karbonit nuk ekziston në natyrë gabohen. CO tretet në shkëmbin vullkanik të shkrirë në presione të larta në mantelin e tokës. Përmbajtja e oksideve të karbonit në gazrat vullkanikë varion nga më pak se 0,01% në 2%, në varësi të vullkanit. Meqenëse natyralja e këtij përbërësi nuk është një vlerë konstante, nuk është e mundur të maten me saktësi emetimet e gazit natyror.

Vetitë kimike
Monoksidi i karbonit (formula CO) i referohet oksideve që nuk formojnë kripë ose oksideve indiferente. Megjithatë, në një temperaturë prej +200 o Me të reagon me hidroksid natriumi. Gjatë kësaj ndodh formimi i formatit të natriumit:
NaOH + CO = HCOONa (kripë e acidit formik).
Vetitë e monoksidit të karbonit bazohen në aftësinë e tij reduktuese. Oksid karboni:
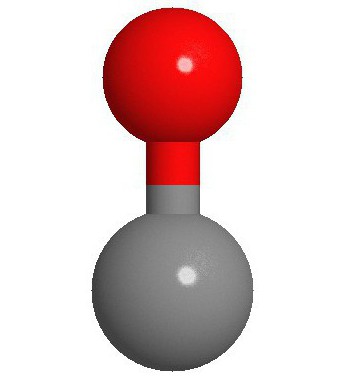
Struktura e molekulës
Dy atomet që përbëjnë molekulën e monoksidit të karbonit (CO) janë të lidhur me një lidhje të trefishtë. Dy prej tyre formohen nga shkrirja e p-elektroneve të atomeve të karbonit me oksigjenin dhe e treta është për shkak të një mekanizmi të veçantë për shkak të orbitalit të lirë 2p të karbonit dhe çiftit elektronik 2p të oksigjenit. Kjo strukturë i siguron molekulës forcë të lartë.
Pak histori
Më shumë Aristoteli nga Greqia e lashte përshkroi tymrat toksikë të prodhuar nga djegia e qymyrit. Vetë mekanizmi i vdekjes nuk dihej. Megjithatë, një nga metodat e lashta të ekzekutimit ishte mbyllja e shkelësit në një dhomë me avull, ku kishte thëngjij që digjeshin. Mjeku grek Galen sugjeroi se disa ndryshime ndodhin në përbërjen e ajrit që shkaktojnë dëm kur thithet.
Gjatë Luftës së Dytë Botërore, gazi i lidhur me monoksid karboni u përdor si lëndë djegëse për automjetet motorike në pjesë të botës ku benzina dhe nafta ishin të pakta. U instaluan gjeneratorë të jashtëm (me disa përjashtime) me qymyr ose gaz druri dhe një përzierje e azotit atmosferik, monoksidit të karbonit dhe një sasi të vogël gazesh të tjera u fut në një mikser gazi. Ishte i ashtuquajturi gaz druri.
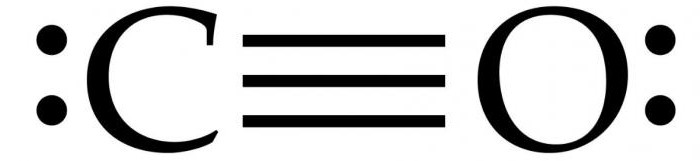
Oksidimi i monoksidit të karbonit
Monoksidi i karbonit formohet gjatë oksidimit të pjesshëm të përbërjeve që përmbajnë karbon. CO formohet kur nuk ka oksigjen të mjaftueshëm për të prodhuar dioksid karboni (CO 2 ), si për shembull kur një furrë ose motor me djegie të brendshme funksionon në një hapësirë të mbyllur. Nëse oksigjeni është i pranishëm, si dhe disa përqendrime të tjera atmosferike, monoksidi i karbonit digjet, duke lëshuar dritë blu, duke prodhuar dioksid karboni, i njohur si dioksid karboni.
Gazi i qymyrit, i përdorur gjerësisht deri në vitet 1960 për ndriçimin e brendshëm, gatimin dhe ngrohjen, kishte CO si përbërësin kryesor të karburantit. Disa procese në teknologjive moderne, të tilla si shkrirja e hekurit, ende prodhojnë monoksid karboni si nënprodukt. Vetë përbërja e CO oksidohet në CO 2 në temperaturën e dhomës.
A ekziston CO në natyrë?
A ekziston monoksidi i karbonit në natyrë? Një nga burimet e tij natyrale janë reaksionet fotokimike që ndodhin në troposferë. Këto procese pritet të jenë në gjendje të gjenerojnë rreth 5×10 12 kg substancë në vit. Ndër burimet e tjera, siç u përmend më lart, janë vullkanet, zjarret në pyje dhe llojet e tjera të djegies.
Vetitë molekulare
Monoksidi i karbonit ka masë molare 28.0, gjë që e bën atë pak më pak të dendur se ajri. Gjatësia e lidhjes midis dy atomeve është 112.8 mikrometra. Kjo është mjaft afër për të siguruar një nga lidhjet kimike më të forta. Të dy elementët në një përbërje CO së bashku kanë rreth 10 elektrone në një shtresë valence.
Si rregull, një lidhje e dyfishtë ndodh në përbërjet organike karbonil. tipar karakteristik Molekula e CO është që një lidhje e fortë trefishe lind midis atomeve me 6 elektrone të zakonshme në 3 orbitale molekulare të lidhura. Meqenëse 4 nga elektronet e përbashkëta vijnë nga atomi i oksigjenit dhe vetëm 2 nga karboni, një orbitale e lidhur është e zënë nga dy elektrone nga O2, duke formuar një lidhje dative ose dipole. Kjo shkakton një polarizim C ← O të molekulës me një ngarkesë të vogël "-" në karbon dhe një ngarkesë të vogël "+" në oksigjen.
Dy orbitalet e mbetura të lidhura zënë një grimcë të ngarkuar nga karboni dhe një nga oksigjeni. Molekula është asimetrike: oksigjeni ka një densitet elektronik më të lartë se karboni dhe gjithashtu është pak i ngarkuar pozitivisht në krahasim me karbonin negativ.
Faturë
Në industri, monoksidi i karbonit CO përftohet duke ngrohur dioksidin e karbonit ose avujt e ujit me qymyr pa qasje në ajër:
CO 2 + C \u003d 2CO;
H 2 O + C \u003d CO + H 2.
Përzierja e fundit që rezulton quhet gjithashtu ujë ose gaz sintetik. Në kushte laboratorike, monoksidi i karbonit II duke ekspozuar acidet organike ndaj acidit sulfurik të përqendruar, i cili vepron si një agjent dehidratues:
HCOOH \u003d CO + H 2 O;
H 2 C 2 O 4 \u003d CO 2 + H 2 O.
Simptomat kryesore dhe ndihma për helmimin nga CO
A shkakton helmim monoksidi i karbonit? Po, dhe shumë i fortë. Helmimi nga monoksidi i karbonit është dukuri më e zakonshme në mbarë botën. Simptomat më të zakonshme:
- ndjenja e dobësisë;
- nauze;
- marramendje;
- lodhje;
- nervozizëm;
- oreks i dobët;
- dhimbje koke;
- çorientim;
- dëmtimi i shikimit;
- të vjella;
- të fikët;
- konvulsione.
Ekspozimi ndaj këtij gazi toksik mund të shkaktojë dëme të konsiderueshme, të cilat shpesh mund të çojnë në kushte kronike afatgjata. Monoksidi i karbonit mund të shkaktojë dëme serioze në fetusin e një gruaje shtatzënë. Viktimave, për shembull, pas një zjarri, duhet t'u jepet ndihmë e menjëhershme. është urgjente të telefononi një ambulancë, të jepni akses në ajër të pastër, të hiqni rrobat që kufizojnë frymëmarrjen, të qetë, të ngrohtë. Helmimi i rëndë, si rregull, trajtohet vetëm nën mbikëqyrjen e mjekëve, në një spital.
Aplikacion
Monoksidi i karbonit, siç është përmendur tashmë, është helmues dhe i rrezikshëm, por është një nga përbërësit bazë që përdoret në industrinë moderne për sintezën organike. CO përdoret për të prodhuar metale të pastra, karbonile, fosgjen, sulfur karboni, alkool metil, formamide, acide aromatike. Kjo substancë përdoret gjithashtu si lëndë djegëse. Pavarësisht toksicitetit dhe helmimit të tij, shpesh përdoret si lëndë e parë për prodhimin e substanca të ndryshme në industrinë kimike.
Monoksidi i karbonit kundër dioksidit të karbonit: Cili është ndryshimi?
Monoksidi i karbonit dhe dioksidi i karbonit (CO dhe CO 2) shpesh ngatërrohen me njëri-tjetrin. Të dy gazrat janë pa erë dhe pa ngjyrë, dhe të dy ndikojnë negativisht në sistemin kardiovaskular. Të dy gazrat mund të hyjnë në trup përmes thithjes, lëkurës dhe syve. Këto komponime, kur ekspozohen ndaj një organizmi të gjallë, kanë një sërë simptomash të zakonshme - dhimbje koke, marramendje, konvulsione dhe halucinacione. Shumica e njerëzve e kanë të vështirë të bëjnë dallimin dhe nuk e kuptojnë se shkarkimi i makinës lëshon CO dhe CO 2. Në ambiente të mbyllura, një rritje në përqendrimin e këtyre gazrave mund të jetë e rrezikshme për shëndetin dhe sigurinë e personit të ekspozuar ndaj tyre. Qfare eshte dallimi?
Në përqendrime të larta, të dyja mund të jenë fatale. Dallimi është se CO 2 është një gaz natyror i zakonshëm i nevojshëm për të gjithë jetën bimore dhe shtazore. CO nuk është e zakonshme. Është një nënprodukt i djegies së karburantit pa oksigjen. Dallimi kritik kimik është se CO 2 përmban një atom karboni dhe dy atome oksigjen, ndërsa CO ka vetëm një. Dioksidi i karbonit është jo i ndezshëm, ndërsa monoksidi ka më shumë gjasa të ndizet.
Dioksidi i karbonit ndodh natyrshëm në atmosferë: njerëzit dhe kafshët thithin oksigjen dhe nxjerrin dioksid karboni, që do të thotë se qeniet e gjalla mund të përballojnë sasi të vogla të tij. Ky gaz është gjithashtu i nevojshëm për zbatimin e fotosintezës nga bimët. Megjithatë, monoksidi i karbonit nuk ndodh natyrshëm në atmosferë dhe mund të shkaktojë probleme shëndetësore edhe në përqendrime të ulëta. Dendësia e të dy gazeve është gjithashtu e ndryshme. Dioksidi i karbonit është më i rëndë dhe më i dendur se ajri, ndërsa monoksidi i karbonit është pak më i lehtë. Kjo veçori e tyre duhet të merret parasysh gjatë instalimit të sensorëve të duhur në shtëpi.
Me lidhje kimike nënkuptohet lloje te ndryshme ndërveprimet që shkaktojnë ekzistencën e qëndrueshme të komponimeve dy dhe poliatomike: molekulat, jonet, substanca kristalore. Nga natyra e saj, një lidhje kimike është një ndërveprim midis bërthamave të ngarkuara pozitivisht dhe elektroneve të ngarkuar negativisht, si dhe elektroneve me njëri-tjetrin. Llojet kryesore të lidhjeve kimike: kovalente, jonike, metalike. Dy metoda përdoren për të përshkruar një lidhje kovalente - metoda e lidhjes valente (MVS) dhe metoda orbitale molekulare (MMO).
Metoda VS bazohet në dispozitat e mëposhtme:
1. Vetëm elektronet e paçiftuara të dy atomeve me rrotullime të drejtuara kundërt marrin pjesë në formimin e një lidhjeje kovalente (një mekanizëm shkëmbimi për formimin e një lidhjeje) ose një çift elektronik të një atomi
Dhurues dhe orbital i lirë i një atomi tjetër - pranues (mekanizmi dhurues-pranues).
2. Një lidhje kimike kovalente midis dy atomeve ndodh si rezultat i mbivendosjes orbitalet atomike me formimin e çifteve elektronike (socializimi i dy elektroneve).
Sipas teorisë së lidhjeve valente, një lidhje kovalente drejtohet drejt mbivendosjes maksimale të orbitaleve atomike të atomeve që ndërveprojnë.
Struktura gjeometrike (hapësinore) e një molekule që përbëhet nga më shumë se dy atome është për shkak të marrëveshje reciproke orbitalet atomike të përfshira në formimin e lidhjeve kimike. Molekula AB 2 mund të ketë një lineare ![]() , ose një strukturë këndore (a). Molekula AB 3 mund të ketë formën e një trekëndëshi të rregullt (b), një piramide trigonale (c). Molekula AB 4 ka formën e një tetraedri (d).
, ose një strukturë këndore (a). Molekula AB 3 mund të ketë formën e një trekëndëshi të rregullt (b), një piramide trigonale (c). Molekula AB 4 ka formën e një tetraedri (d).
a) 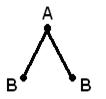 b)
b) 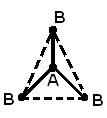 në)
në) 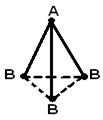 G)
G) 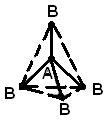
Struktura hapësinore e një molekule përcaktohet nga lloji i hibridizimit të orbitaleve të valencës së atomit qendror dhe numri i çifteve të elektroneve të pandarë që përmbahen në shtresën e elektroneve të valencës.
Shembulli 1 Përshkruani strukturën e molekulave nga pikëpamja e metodës së lidhjeve valente: a) РН 3 , b) BBr 3 . Cilat orbitale atomike përfshihen në formimin e lidhjeve kimike? Specifikoni llojin e hibridizimit (nëse ndodh hibridizimi). Cila është struktura hapësinore e këtyre molekulave?
Zgjidhje. a) Formimi i molekulës PH 3.
Le të shkruajmë formulat elektronike të atomeve që formojnë molekulën PH 3 në gjendjen tokësore (normale): 15 Р 1s 2 2s 2 2p 6 3s 2 3p 3 ; 1 H 1s 1
Formulat elektro-grafike të nivelit të jashtëm të këtyre atomeve:
Në këtë molekulë, atomi qendror është një atom fosfori, në të cilin vetëm orbitalet p marrin pjesë në formimin e tre lidhjeve kimike, të vendosura në të njëjtin nënnivel dhe që kanë të njëjtën formë dhe të njëjtën energji. Rrjedhimisht, nuk ka hibridizim në molekulën PH 3.
Për një paraqitje vizuale të skemave të valencës, mund të përdoret metoda e mëposhtme. Elektronet e vendosura në shtresën e jashtme elektronike shënohen me pika të vendosura rreth simbolit kimik të atomit. Elektronet e përbashkëta për dy atome tregohen me pika të vendosura midis simboleve të tyre kimike; një lidhje e dyfishtë ose e trefishtë shënohet përkatësisht me dy ose tre palë pika të përbashkëta. Duke përdorur këto shënime, formimi i molekulës PH 3 mund të përfaqësohet si më poshtë:
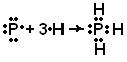 H
H
ê
Kjo skemë mund të shkruhet ndryshe: H - P - H, ku çdo çift elektronesh që lidh dy atome korrespondon me një vizë që përshkruan një lidhje kovalente në formulat strukturore.
p – retë elektronike të atomit të fosforit janë të orientuara në drejtime reciproke pingule (përgjatë boshteve të koordinatave) –p x, p y, p z dhe kanë një formë trap. Në atomin e hidrogjenit në formimin e një kimike Komunikimet R-N përfshihet një s-elektron, i cili ka një formë reje sferike. Kur formohet një molekulë PH 3, retë p-elektronike të atomit të fosforit mbivendosen me retë e elektroneve s të tre atomeve të hidrogjenit:
Në përputhje me kërkesat e metodës së lidhjeve të valencës, tre lidhje
P - H duhet të vendoset në kënde afër 90 ° C. Prandaj, rregullimi hapësinor i lidhjeve të vetme përcakton strukturën gjeometrike të molekulës. Molekula PH 3 duhet të ketë formën e një piramide trigonale:
Në krye të piramidës është një atom fosfori, dhe në krye të bazës janë atomet e hidrogjenit.
b) Formimi i molekulës BBr 3. Në molekulën ВВr 3, atomi qendror është një atom bor.
Formulat elektronike të atomeve:
5 V 1s 2 2s 2 2p 1 35 Br 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 5
Formulat grafike elektronike të nivelit të jashtëm kanë formën:
Meqenëse bori në përbërje është trevalent, ne shkruajmë formulën elektronografike të atomit të borit në gjendjen e ngacmuar:
Në formimin e tre lidhjeve kimike në molekulën BBr 3, përfshihen një s- dhe dy p-orbitale, të vendosura në nënnivele të ndryshme dhe që kanë formë të ndryshme dhe energji të ndryshme
Në këtë rast, në vend të orbitaleve origjinale s- dhe dy p të atomit të borit të ngacmuar, formohen tre orbitale hibride ekuivalente (sp 2 - hibridizimi). Me hibridizimin sp 2, retë elektronike hibride janë rregulluar në drejtime që shtrihen në të njëjtin plan dhe janë të orientuara në kënde 120 ° me njëra-tjetrën:
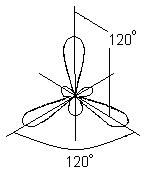
Ky lloj hibridizimi korrespondon me formimin e një molekule trekëndore të sheshtë. Kur formohet molekula BBr 3, tre orbitale hibride të atomit të borit mbivendosen me orbitalet p-elektronike të tre atomeve të bromit:
Molekula BBr 3 ka formën e një trekëndëshi të rregullt të sheshtë me një atom bori në qendër dhe atome bromi në kulme. Të tre lidhjet B-Br në molekulën BBr 3 janë ekuivalente.
Shembulli 2 Vizatoni skemat energjetike për formimin e molekulës F 2 dhe jonit molekular F 2 + duke përdorur metodën orbitale molekulare. Sa elektrone ka në orbitalet lidhëse dhe antilidhëse? Cili është rendi i lidhjes në këto grimca? Specifikoni karakteristikën e tyre magnetike (paramagnetizëm ose diamagnetizëm).
Zgjidhje. Sipas teorisë së orbitaleve molekulare (MMO), një molekulë konsiderohet si një koleksion i bërthamave të ngarkuara pozitivisht dhe elektroneve të ngarkuar negativisht, ku secili elektron lëviz në fushën e elektroneve të tjera dhe të gjitha bërthamave.
Të përshkruash një molekulë sipas teorisë MMO do të thotë të përcaktosh llojin e orbitaleve të saj, energjitë e tyre dhe të përcaktosh natyrën e shpërndarjes së elektroneve mbi orbitalet.
Kur formohet një molekulë, lindin dy lloje të orbitaleve molekulare - lidhja dhe lirimi. Nëse, gjatë formimit të një molekule nga atomet, kalimi i një elektroni në një orbital molekular shoqërohet me një rënie të energjisë, atëherë një orbital i tillë molekular është duke lidhur. Nëse kalimi i një elektroni në një orbital molekular shoqërohet me një rritje të energjisë, atëherë një orbital i tillë molekular do të jetë lirim.
Elektronet në molekula janë të vendosura në orbitalet molekulare s dhe p. s-orbitalet mund të formohen nga mbivendosja e orbitaleve atomike s dhe mbivendosja e orbitaleve atomike 2p x. Në këtë rast, formohen orbitalet molekulare: s-lidhja (s st) dhe s-lidhja (s raz). Kur orbitalet atomike 2p y dhe 2p z mbivendosen, formohen orbitalet molekulare: p sv2Py, p sv2P z dhe p times2Py, p herë2P z. Rendi i vendosjes së elektroneve në orbitalet molekulare është i njëjtë si në rastin e orbitaleve atomike, domethënë i përgjigjet parimit të energjisë më të vogël, parimit të Paulit, rregullit të Hundit.








